Новости о лечении онкологических заболеваний
Сколько живут при раке горла? Это один из важнейших животрепещущих вопросов, который интересует пациентов и их близких. Заболевание представляет собой группу новообразований злокачественного характера, которые развиваются на слизистых прослойках глотки и гортани. Чаще всего распространяется на другие органы.
Продолжительность жизни людей с раком горла на разных стадиях
Продолжительность жизни человека напрямую связана со стадией онкологической болезни. Нулевая стадия рака горла – одна из форм, при ней на слизистой появляются новообразования. Сколько живут при раке горла такого типа? При своевременном вмешательстве 95% пациентов может прожить более 5 лет.
Рак горла 1 стадии
Если у пациента 1 стадия рака горла, то в 80% случаев он может прожить 5 лет. 1 стадия рака горла – это этап, когда патологически измененные ткани затрагивают и слизистые прослойки, и соседние ткани. Но при этом, если у человека 1 стадия рака горла, то метастазы не переходят на лимфоузлы. На этой стадии рака горла еще можно прооперировать пациента и убрать опухоль.
Рак горла 2 стадии
Если у пациента рак горла 2 стадии, то в дальнейшие 5 лет процент выживания – до 70%. Опухоль может достичь максимальных размеров при раке горла 2 стадии. Из-за нее сложно дышать, глотать еду.
Рак горла 3 стадии
Если у человека 3 стадия рака горла, то постепенно опухоль будет выделять метастазы. На этой стадии рака горла они попадают в кровь, распространяются на слизистые прослойки горла. На 3 стадии рака горла у человека может пропасть голос. Также возможно, что начнет ослабевать глотательный рефлекс. Только 50% всех больных на 3 стадии рака горла живет 5 лет, но только при правильной терапии и реабилитации.
Рак горла 4 стадии
На 4 стадии рака горла заболевание поражает прилегающие к опухоли ткани и органы. Метастазы можно обнаружить в лимфатической системе. На этой стадии рака горла процесс развития опухоли и в целом болезни только ускоряется.
Каким должен быть уход за больным с диагнозом рак горла
Сколько живут при раке горла, зависит не только от правильного лечения и стадии болезни, но и от обеспечения надлежащего ухода. Уже на первой стадии рака горла рекомендовано сразу переходить на диету. Запрещены продукты, которые содержат канцерогены, сахар, холестерин. Полезно употреблять свежие овощи и фрукты, а также постные блюда, которые были приготовлены на пару. Минимизировать употребления мяса, принимать очищенную воду в больших количествах.
Обязательно нужно соблюдать все гигиенические меры, а также употреблять препараты, которые назначил доктор. Также важна психологическая поддержка. Необходимо уделять больше внимания больным, особенно их эмоциональному состоянию. Полезны прогулки гулять на свежем воздухе.
Заключение
Сложно найти ответ на вопрос о том, сколько живут при раке горла. Рекомендуется как можно раньше обратиться в онкологический центр, чтобы своевременно получить помощь врачей. Лучше всего записаться на прием к онкологу, как только возникнут первые подозрения или характерные симптомы. После диагностики врач подберет соответствующую терапию, которая повысит шансы на выживание. И лучше это сделать на ранней стадии рака горла, тогда вероятность успеха очень большая. Главное – соблюдать все предписания врача, вовремя проходить лечебные радикальные и реабилитационные мероприятия, получать специальный уход.
Рак полости рта и ротоглотки
Полость рта и ротоглотка состоит из различных тканей, которые могут стать источниками возникновения как доброкачественных, так и злокачественных опухолей.
Из доброкачественных опухолей следует выделить: эозинофильную гранулему, фиброму, кератоакантому, лейомиому, остеохондрому, липому, шванному, нейрофиброму, папиллому, рабдомиому, одонтогенные опухоли и др.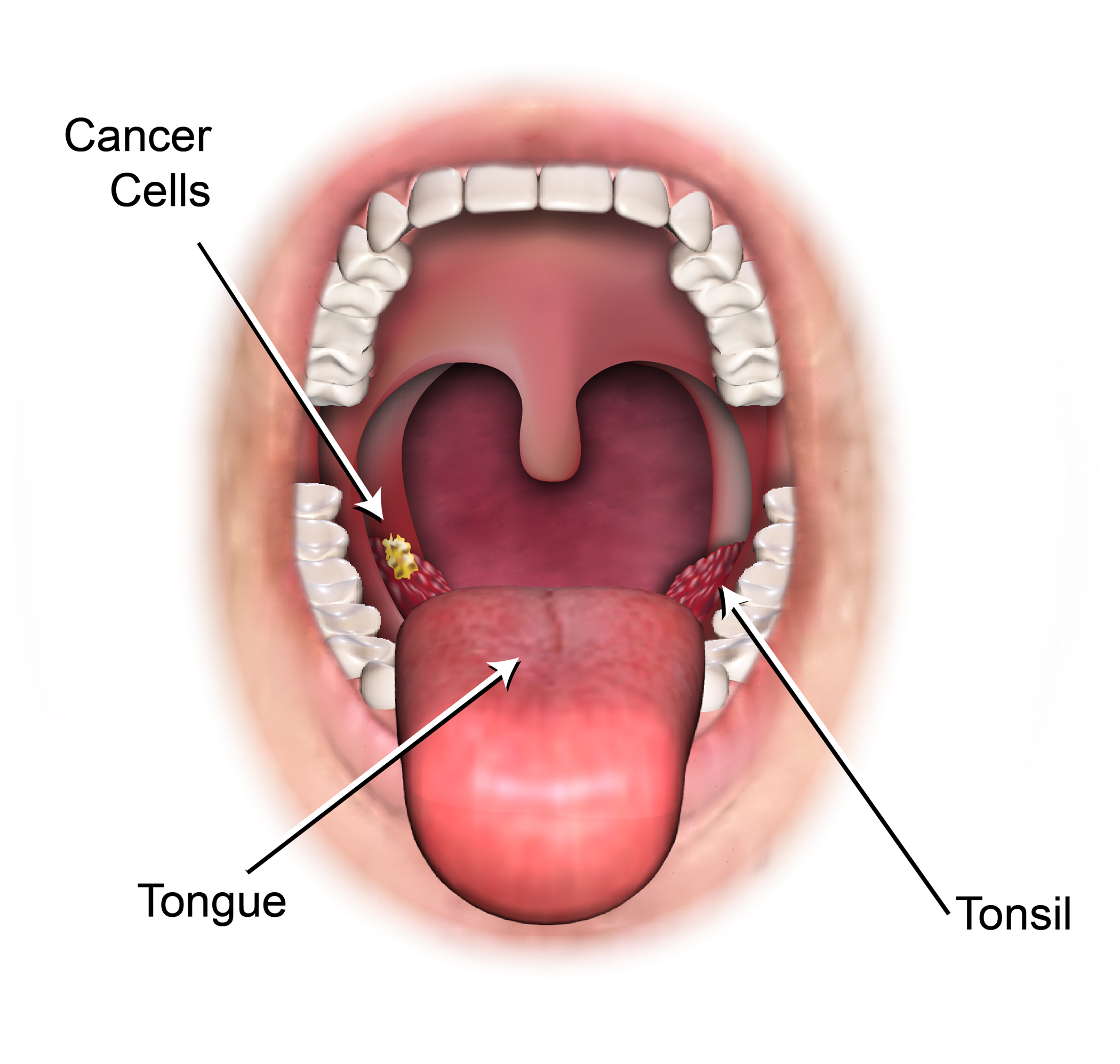
Как правило, единственным методом лечения таких опухолей является операция, рецидивы после которой встречаются очень редко.
Лейкоплакия, эритроплакия и дисплазия
Лейкоплакия и эритроплакия — термины, обозначающие различные изменения слизистой оболочки полости рта и глотки при курении, жевании табака, травме слизистой оболочки полости рта зубным протезом
Появление измененной слизистой оболочки белого цвета может указывать на наличие у больного лейкоплакии. При эритроплакии измененная слизистая оболочка имеет красный цвет, может несколько выступать над поверхностью и легко кровоточить.
Серьезность появившихся изменений слизистой оболочки полости рта и глотки можно уточнить только с помощью биопсии (взятия кусочка ткани для микроскопического исследования) или соскабливания отдельных клеток.
Указанные изменения могут оказаться безобидными и проходить после прекращения воздействия причинного фактора, но могут предшествовать возникновению рака.
Такое предопухолевое состояние носит название дисплазии.
Различают незначительную, умеренную и тяжелую степени дисплазии. Зная степени дисплазии, можно прогнозировать (предсказывать) вероятность самоизлечения, исчезновения после лечения или превращения в злокачественную опухоль.
Без правильного лечения 5% лейкоплакий в течение 10-летнего периода перерождается в рак.
Эритроплакия является более серьезным состоянием, при котором почти в 50% случаев после биопсии устанавливается диагноз рака.
Более 90% опухолей полости рта и ротоглотки представляют плоскоклеточный рак, развивающийся из покровных (эпителиальных) клеток.
Веррукозная (бородавчатая) карцинома является разновидностью плоскоклеточного рака и составляет 5% от всех опухолей полости рта. Этот вид рака относится к опухолям низкой степени злокачественности, редко дает метастазы, но может глубоко распространяться в окружающие ткани. В связи с этим рекомендуется широкое удаление опухоли в пределах здоровых тканей.
Малые слюнные железы, расположенные в слизистой оболочке полости рта и глотки, могут стать источниками возникновения различных видов рака, таких как аденоидная кистозная карцинома, мукоэпидермоидный рак и полиморфная аденокарцинома низкой степени злокачественности.
В миндалинах и основании языка находится лимфоидная ткань, из которой могут развиваться лимфомы (неходжкинская лимфома/лимфосаркома и болезнь Ходжкина/лимфогранулематоз).
Как часто возникают злокачественные опухоли полости рта и ротоглотки?
В 2002 г. в России было выявлено 10215 случаев злокачественных опухолей полости рта и глотки, причем мужчины заболевали почти в 4 раза чаще женщин.
По предварительным данным, в США в 2004 г. может быть выявлено 28260 случаев рака полости рта и ротоглотки.
За последние 20 лет наблюдается снижение, как заболеваемости, так и смертности от этого вида рака.
Факторы риска развития рака полости рта и ротоглотки
В настоящее время известны некоторые факторы, которые повышают вероятность развития рака полости рта и ротоглотки.
Возраст. Вероятность развития рака полости рта и ротоглотки повышается с возрастом, особенно после достижения 35-летнего возраста.
Пол. Рак полости рта более чем в 2 раза чаще возникает у мужчин по сравнению с женщинами.
Табак. 90% больных злокачественными опухолями полости рта и ротоглотки указывают на употребление ими табака в виде курения или жевания. Риск возникновения рака повышается с количеством выкуренных сигарет или табака, употребленного при жевании.
Среди курильщиков рак полости рта и ротоглотки возникает в 6 раз чаще по сравнению с некурящими людьми.
У 35% больных, продолжающих курить после излечения рака, впоследствии развиваются другие злокачественные опухоли полости рта, ротоглотки или гортани по сравнению с 6% у лиц, прекративших курение.
У курильщиков трубки имеется значительный риск возникновения рака губы.
Жевательный табак чаще всего вызывает рак щеки, десен и губы и повышает риск развития рака этих локализаций в 50 раз.
Работа или проживание среди курильщиков (пассивное курение) также является фактором риска возникновения рака полости рта и ротоглотки.
Алкоголь. Употребление спиртных напитков существенно повышает риск рака полости рта и ротоглотки среди курильщиков.
75-80% больных раком полости рта указывают на употребление алкоголя в значительных количествах. У пьющих людей рак этой локализации встречается в 6 раз чаще по сравнению с непьющими людьми.
Ультрафиолетовое излучение. 30% больных раком губы имели работу, связанную с длительным пребыванием на открытом воздухе.
Раздражение. Предполагается, что плохо подогнанный зубной протез, вызывающий раздражение слизистой оболочки полости рта, может повышать риск развития рака полости рта.
Питание. Неполноценное питание с низким содержанием овощей и фруктов повышает риск рака полости рта и ротоглотки.
Угнетение иммунной системы при приеме специальных препаратов, например, с целью предотвращение отторжения пересаженных органов, может повышать риск возникновения рака полости рта и ротоглотки.
Профилактика рака полости рта и ротоглотки
Большинство случаев рака полости рта и ротоглотки можно предотвратить, если избегать воздействия известных факторов риска.
Табак и курение являются наиболее важными факторами риска в развитии рака полости рта и ротоглотки. Лучшее решение для всех людей — не начинать курить, не употреблять спиртные напитки или же резко ограничить их употребление.
Если же Вы курите и употребляете алкоголь даже в течение длительного времени, то отказ от этих привычек в значительной степени снизит риск возникновения рака этих локализаций.
Избегайте пребывания на солнце в середине дня, когда воздействие ультрафиолетового излучения наибольшее, тем самым Вы снизите риск развития рака губы и кожи.
Полноценное питание с употреблением большого количества овощей и фруктов несколько раз в день и продуктов из зерна грубого помола будет способствовать снижению возникновения рака полости рта и ротоглотки.
Диагностика рака полости рта и ротоглотки
Многие злокачественные опухоли полости и ротоглотки могут быть выявлены на ранних стадиях самими больными или во время осмотра врачом.
Признаки и симптомы рака полости рта и ротоглотки
При наличии одного или нескольких ниже перечисленных признаков или симптомов в течение 2 и более недель необходимо, не откладывая, проконсультироваться у врача.
- Наличие длительно незаживающей язвы во рту.
- Непроходящая боль в полости рта.
- Припухлость или утолщение щеки.
- Белые или красные пятна на деснах, языке, миндалинах или слизистой оболочке полости рта.
- Ощущение инородного тела в глотке.
- Затруднение жевания или глотания.
- Затруднение движение челюстью или языком.
- Онемение языка.
- Изменение голоса.
- Появление припухлости на шее.
- Потеря веса.
- Длительно существующее затрудненное дыхание
Следует указать на то, что указанные изменения не обязательно имеют отношение к раку и могут быть при ряде других неопухолевых заболеваниях. Тем не менее, только врач может выяснить причину подобных изменений.
Методы диагностики рака полости рта и ротоглотки
При беседе врач расспросит Вас о появившихся симптомах, факторах риска и перенесенных заболеваниях. После этого он осмотрит голову, шею, полость рта, прощупает лимфатические узлы.
При необходимости будет вызван отоларинголог- специалист по заболеваниям уха, горла и носа, который может назначить дополнительное обследование.
Назофарингоскопия, фарингоскопия, ларингоскопия (осмотр, соответственно, полости носа, глотки и гортани) с помощью зеркала или специального инструмента позволяет осмотреть указанные области и сделать при необходимости биопсию (взятие кусочка ткани для исследования).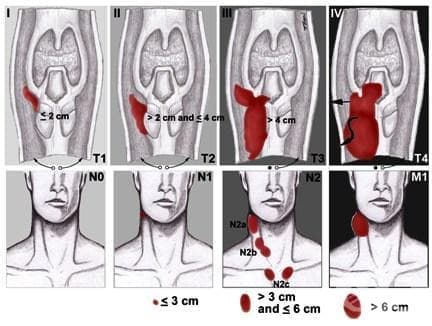
С целью подтверждения диагноза опухоли материал может быть получен в результате соскоба в области подозрительного участка, пункции тонкой иглой или хирургического удаления части опухоли.
Анализ периферической крови позволяет оценить общее состояние больного и обнаружить анемию (малокровие), а при биохимическом анализе крови можно заподозрить поражение печени и костей.
Рентгенография грудной клетки дает возможность выявить поражение легочной ткани, что встречается редко, но возможно при распространенном опухолевом процессе.
Компьютерная томография (КТ), иногда с дополнительным введением контрастного вещества, помогает определить размер, форму и расположение опухоли, а также наличие увеличенных лимфатических узлов.
Магнитно-резонансная томография (МРТ) дает возможность получить дополнительную к КТ информацию, особенно в отношении спинного и головного мозга.
При позитронно-эмиссионной томографии (ПЭТ) используется радиоактивная глюкоза, которая накапливается в опухолевых клетках. Этот метод особенно оправдан для выявления пораженных лимфатических узлов.
Определение стадии рака полости рта и ротоглотки
Проведение всестороннего обследования дает возможность выявить распространенность опухолевого процесса и определить стадию опухоли — от 0 до IV.
Стадия 0 означает самую раннюю фазу развития рака, когда опухоль еще не вышла за пределы слизистой оболочки полости рта или ротоглотки.
Возрастание стадии указывает на большую распространенность процесса. Под стадией IV подразумевается поражение отдаленных от первичной опухоли органов.
Рецидив рака означает возврат болезни в области первичного расположения опухоли или в отдалении от основного очага.
Лечение рака полости рта и ротоглотки
При лечении больных раком полости рта и ротоглотки используют хирургический, лучевой и лекарственный методы. При этом в зависимости от стадии опухоли применяют один или несколько методов терапии.
При этом в зависимости от стадии опухоли применяют один или несколько методов терапии.
Для хирургического лечения опухолей полости рта и ротоглотки могут быть использованы различные операции с учетом уточнения местоположения опухоли и стадии процесса, а также необходимости выполнения реконструктивных (восстановительных) вмешательств с целью восстановления утраченных функций.
У больных с подвижной опухолью в полости рта выполняется удаление опухоли без иссечения костной ткани. В случае ограниченной подвижности опухоли и отсутствии изменений в кости (на рентгеновских снимках) производится удаление опухоли вместе с частью челюсти. Явное поражение челюсти, видимое на рентгенограммах, требует более широкого иссечения костной ткани.
При поражении губы в отдельных случаях может быть использован специальный хирургический микрографический метод, при котором опухоль удаляется слоями и исследуется под микроскопом. Это позволяет полностью удалить опухоль и максимально сохранить нормальные ткани губы.
Злокачественные опухоли полости рта и ротоглотки часто распространяются в лимфатические узлы шеи. В этих случаях показана операция удаления их и подозрительных лимфатических узлов. Объем операции зависит от степени распространения опухоли и может быть значительным, вплоть до удаления мышц, нервов и сосудов.
Побочные эффекты и осложнения при оперативном удалении лимфатических узлов связаны с повреждением нервов: онемение уха, затруднение поднятия руки над головой, опущение нижней губы. Эти явления могут постепенно пройти, но могут и остаться навсегда, если нерв был полностью удален.
В некоторых случаях при больших опухолях ротоглотки, приводящих к затруднению дыхания, выполняется трахеотомия (рассечение трахеи) и введение трубки в трахею для восстановления дыхания. После удаления опухоли трубка извлекается и обычное дыхание восстанавливается.
Лучевая терапия может быть основным методом лечения у больных с небольшими опухолями полости рта и ротоглотки. У пациентов с опухолями значительных размеров лучевой метод используют наряду с операцией для уничтожения оставшихся опухолевых клеток. Лучевую терапию также применяют для облегчения боли, прекращения кровотечения, устранения затрудненного глотания.
У пациентов с опухолями значительных размеров лучевой метод используют наряду с операцией для уничтожения оставшихся опухолевых клеток. Лучевую терапию также применяют для облегчения боли, прекращения кровотечения, устранения затрудненного глотания.
При опухолях полости рта и ротоглотки наиболее часто используют наружное облучение. Лечение проводится 5 раз в неделю в течение 5-7 недель.
У некоторых больных может быть применена брахитерапия (внутреннее облучение). При этом в опухоль или вблизи нее на определенное время вводятся металлические стержни, содержащие радиоактивный материал. Перед выпиской домой эти стержни удаляются.
В ряде случаев используют как наружное, так и внутреннее облучение.
Побочные эффекты лучевой терапии: покраснение кожи, сухость во рту, боль в горле, осиплость голоса, частичная потеря вкуса, слабость. Из осложнений лечения могут возникнуть: повреждение щитовидной железы и сосудов, питающих головной мозг.
Под химиотерапией подразумевается применение противоопухолевых препаратов. Ее можно использовать перед операцией или лучевой терапией для сокращения размеров опухоли. В ряде случаев химиотерапию применяют в сочетании с облучением или операцией.
Для химиотерапии рака полости рта и ротоглотки наиболее часто используются цисплатин и 5-фторурацил. Кроме того, могут быть применены и другие препараты: метотрексат, блеомицин, карбоплатин. Препараты используют как в отдельности, так и в комбинации для усиления противоопухолевого эффекта.
Побочные эффекты химиотерапии могут проявляться в виде тошноты, рвоты, потери аппетита, облысения, появления язв во рту, утомляемости, повышенной восприимчивости к инфекции, кровоточивости. Большинство побочных эффектов со временем проходит, некоторые из них, например, нарушение слуха при применении цисплатина, могут быть стойкими.
Результаты лечения рака полости рта и ротоглотки
У больных с 0 стадией рака полости рта и ротоглотки длительная выживаемость составляет 95-100%, однако в случае рецидива (возврата) болезни может потребоваться более серьезное оперативное вмешательство или лучевая терапия. Этим больным нужно знать о том, что курение может способствовать развитию другой злокачественной опухоли.
Этим больным нужно знать о том, что курение может способствовать развитию другой злокачественной опухоли.
Применение операции или лучевой терапии у пациентов с I стадией рака позволяет добиться длительной выживаемости в 80-85% случаев, а при II стадии — в 60-80%.
У пациентов с III-IV стадиями рака полости рта и ротоглотки применяют 2 или все 3 метода лечения. При этом длительная выживаемость колеблется от 20 до 50%.
Что происходит после окончания лечения рака полости рта и ротоглотки?
После проведенного лечения по поводу рака полости рта и ротоглотки у больного могут возникнуть проблемы с речью и глотанием. Специалисты (логопед, диетолог) дадут консультацию и назначат соответствующие процедуры для устранения имеющихся проблем.
У больных, перенесших лечение по поводу злокачественных опухолей полости рта и ротоглотки, имеется повышенный риск развития рецидива или новой опухоли. Рецидивы обычно возникают в течение первых 2 лет после окончания лечения, поэтому пациенты должны находиться под тщательным врачебным наблюдением и проходить обследование.
У 30-40% больных, получавших лучевую терапию, могут быть низкие уровни гормонов щитовидной железы. Таким пациентам показана консультация эндокринолога и назначение соответствующей терапии.
Доказано, что у больных, перенесших лечение по поводу рака полости рта и ротоглотки, имеется повышенный риск развития рецидива или новой опухоли, особенно если они курят или злоупотребляют алкогольными напитками.
Поэтому настоятельно рекомендуется избавиться от этих привычек.
Лечение рецидива рака ротоглотки после химиолучевой терапии Текст научной статьи по специальности «Клиническая медицина»
© Л.П. Яковлева, М.А. Кропотов, А.М. Мудунов, Е.Л. Дронова, Л.Е. Ротобельская, 2016
УДК 616.321-006.6-039.35-08
ЛЕЧЕНИЕ рЕцИдИВА рака ротоглотки ПОСЛЕ
химиолучевой терапии
л.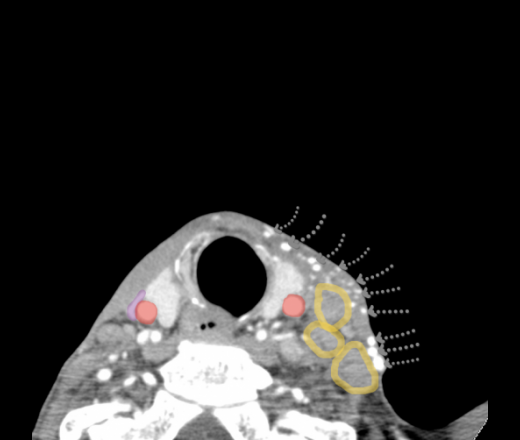 п. Яковлева, М.А. кропотов, А.М. Мудунов, Е.л. Дронова, л.Е. ротобельская
п. Яковлева, М.А. кропотов, А.М. Мудунов, Е.л. Дронова, л.Е. ротобельская
ФГБУ «Российский онкологический научный центр имени Н.Н. Блохина» Минздрава России, г. Москва
TREATMENT OF RECURENCEs OF THE OROPHARYNX TUMORs AFTER CHEMORADIATION
L.p. Yakovleva, M.A. Kropotov, A.M. Mudunov, E.L. Dronova, L.E. Rotobelskaya
Russian Cancer Research Center, Moscow
яковлева Лилия Павловна — кандидат медицинских наук, научный сотрудник хирургического отделения №11 (опухолей верхних дыхательных и пищеварительных путей) ФГБУ «Российский онкологический научный центр имени Н.Н. Блохина» Минздрава России
115478, г. Москва, Каширское шоссе, д. 23, тел. +7-903-199-49-28, e-mail: [email protected]
Yakovleva L.P. — Cand. Med. Sc., researcher of the surgical Department №11 (tumors of the upper respiratory and digestive tracts) of the Russian Cancer Research Center
23 Kashirskoye highway, Moscow, Russian Federation, 115478, tel. +7-903-199-49-28, e-mail: [email protected]
реферат. В статье отражены основные направления в лечении рака ротоглотки. Приведен анализ результатов лечения 65 пациентов с остаточной опухолью ротоглотки после перенесенного химиолучевого лечения и с рецидивами рака ротоглотки. Обсуждены вопросы возможности выполнения и выбора объема хирургического вмешательства при таких ситуациях. Описаны варианты реконструкции дефектов после удаления опухоли, трансоральной лазерной хирургии, доступа через срединную мандибулотомию и показания к сегментарной резекции нижней челюсти. У 40 % пациентов была выявлена остаточная опухоль после проведенного химиолучевого лечения, а у 60% были диагностированы рецидивы заболевания.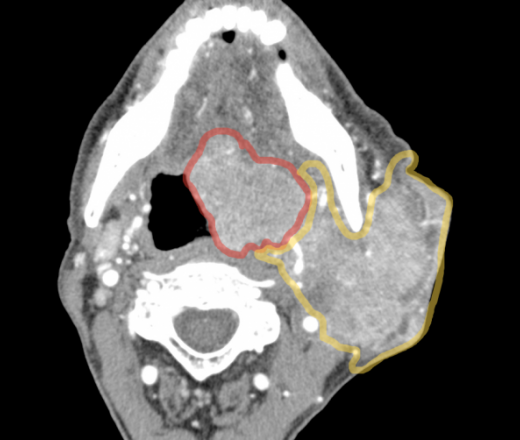 При анализе общей выживаемости отмечено, что при остаточных опухолях она составляет до 68,4% к 50% при лечении рецидивных опухолей. При этом локализация опухоли в области мягкого неба является менее прогностически благоприятной локализацией — общая выживаемость составляет 30% по сравнению с опухолями в области миндалины (64,6%) и корня языка (57,2%).
При анализе общей выживаемости отмечено, что при остаточных опухолях она составляет до 68,4% к 50% при лечении рецидивных опухолей. При этом локализация опухоли в области мягкого неба является менее прогностически благоприятной локализацией — общая выживаемость составляет 30% по сравнению с опухолями в области миндалины (64,6%) и корня языка (57,2%).
Ключевые слова: рак ротоглотки, рецидивы, хирургическое лечение, локализация опухоли, реконструкция дефектов после удаления опухоли, общая выживаемость.
Abstract. The paper is dedicated to guideline directions in the treatment of the oropharynx cancer and contain information about results of treatment of the 65 patients with recurrences (60%) and rudimentary tumors (40%). We try to describe the problem questions of scope of surgery, reconstruction, and access in surgery. In results: the overall survival in group with rudimentary tumors consist 68,4% in relation to patients with recurrences after chemoradiation — 50,2%. And tumors with location on the soft palate have worse prognosis (o.s. — 30%) in relation to side wall oropharynx tumors (o.s. — 64,6%) and base of tongue tumors (57,2%).
Key words: oropharynx cancer, treatment, recurrence, rudimentary tumors, overall survival, tumors location.
Ротоглотка является одной из наиболее частых локализаций плоскоклеточного рака органов головы и шеи. Причем на фоне снижения общей частоты плоскоклеточного рака головы и шеи в мире, частота развития рака ротоглотки растет, в основном за счет опухоли, ассоциированной с вирусом папилломы человека [3]. Заболеваемость раком ротоглотки в мире
на 2013 год составляет 142 387 человек (1% от всей онкологической патологии), в то время как в Российской Федерации — 2251 больной (0.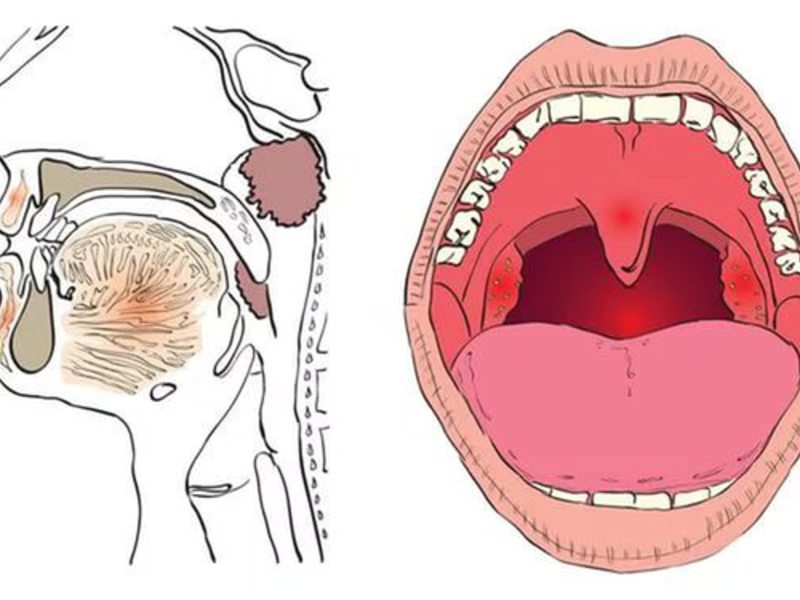 43% от всех злокачественных опухолей) [1, 3].
43% от всех злокачественных опухолей) [1, 3].
Обращают на себя внимание цифры летальности в Российской Федерации в первый год после постановки диагноза, которые составляют 40.2%. Это во
многом обусловлено тем, что до 80% больных поступают на лечение в специализированные стационары с местнораспространенной формой заболевания [1]. В настоящее время в мире существуют различные подходы к лечению рака ротоглотки, при этом основное внимание при выборе оптимального метода сконцентрировано на сохранении формы и функции органа и качестве жизни пациента [8]. При раннем раке ротоглотки возможно применение как лучевого лечения, так и хирургического в виде трансоральной лазерной микрохирургии. При сопоставимой эффективности этих методов главный вопрос — качество жизни пациента.
При применении лучевой терапии показатели безрецидивной выживаемости при раннем раке ротоглотки в зависимости от локализации первичной опухоли составляют от 68 до 90% [6, 13, 19], в то же время, при выполнении операции в виде трансоральной лазерной резекции с шейной лимфодиссекцией и адъю-вантной лучевой терапией у части больных (до 60%) показатели безрецидивной выживаемости составляют от 83 до 95% [10, 16]. Проведенный de Almeida J.R. et al. [2] анализ всех доступных опубликованных исследований по лечению раннего рака ротоглотки продемонстрировал сопоставимые результаты двух лечебных тактик: общая 2-хлетняя выживаемость составила от 84 до 96% при лучевом лечении и от 82 до 94% — при хирургическом. Эти два лечебных подхода различаются только по спектру побочных эффектов. В связи с этим некоторые авторы справедливо замечают, что хирургическое вмешательство при лечении рака ротоглотки имеет преимущество в случае, если оно проводится в самостоятельном плане, так как в противном случае комбинация хирургического и хи-миолучевого лечения, не улучшая онкологических результатов, увеличивает число и тяжесть побочных эффектов [8, 14].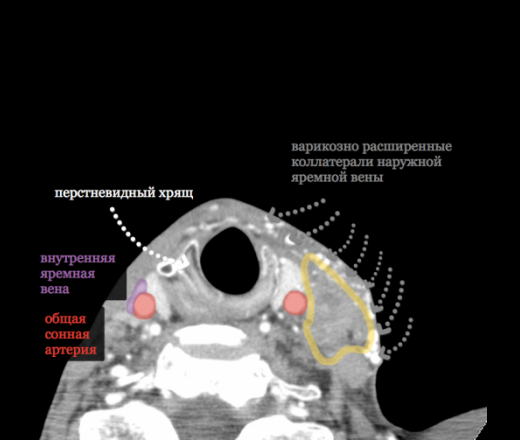 Поэтому подчеркивается, что необходим строгий отбор больных для трансоральных хирургических вмешательств, чтобы исключить необходимость проведения адъювантного лечения.
Поэтому подчеркивается, что необходим строгий отбор больных для трансоральных хирургических вмешательств, чтобы исключить необходимость проведения адъювантного лечения.
Развитие рецидива рака ротоглотки после лучевого лечения при последующем выполнении радикального хирургического вмешательства не ухудшает результатов лечения, и показатели 5-летней безрецидивной выживаемости в том случае составляют 91% при раке мягкого неба и 88% при раке небной миндалины [4, 15].
При местнораспространенном раке ротоглотки (III, IVA, IVB стадии) комплексный подход в лечении является основным, обеспечивающим лучшие онколо-
гические результаты. Учитывая распространенность опухолевого процесса, чувствительность рака ротоглотки к консервативным методам лечения, особенно при HPV+ опухолях, большинство специалистов рекомендует химиолучевое лечение в виде непрерывного курса лучевой терапии на область ротоглотки и гомолатеральную сторону шеи с вовлечением ретро-фарингеальных групп лимфатических узлов на фоне конкурентной химиотерапии производными платины. Данный метод лечения позволяет добиться локального контроля в 85% случаях при III стадии, 80% — при IVa и 43% — при IVb стадиях рака мягкого неба. В случае рецидива опухоли данной локализации выполнение хирургического вмешательства на первичном очаге и зонах регионарного метастазирования позволяет в дальнейшем добиться локорегионарного контроля в 96, 88 и 43% соответственно [4, 12]. Необходимо отметить, что в данном наблюдении выполнение хирургического вмешательства после химиолу-чевого лечения у первично неоперабельной группы пациентов (IVb стадия) почти у половины пациентов удается добиться безрецидивной 5-летней выживаемости.
При раке небной миндалины и корня языка проведение химиолучевого лечения позволяет достичь общей 5-летней выживаемости при III стадии — от 79 до 88%, а при IV — от 60 до 70% [6, 11, 15, 17, 18, 20].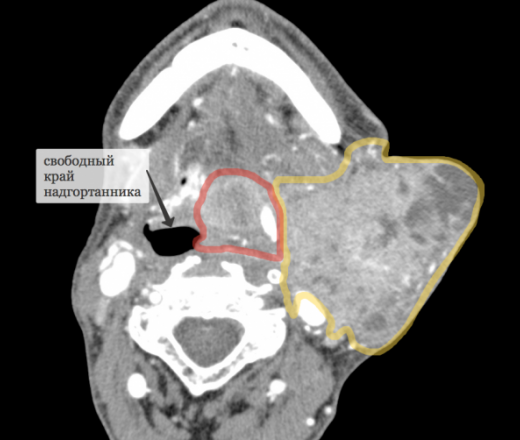 Многие авторы обращают внимание на значительное снижение общей выживаемости при IV стадии рака ротоглотки, обусловленное отдаленным метастази-рованием, частота которого в этом случае возрастает до 15% [6, 11, 17, 20]. Диагностирование рецидива у этой группы пациентов не ухудшает прогноз, так как выполнение «спасительных» операций позволяет добиться 5-летнего локального контроля в 82% случаев при Т3 распространенности первичной опухоли и 68% при Т4 [15].
Многие авторы обращают внимание на значительное снижение общей выживаемости при IV стадии рака ротоглотки, обусловленное отдаленным метастази-рованием, частота которого в этом случае возрастает до 15% [6, 11, 17, 20]. Диагностирование рецидива у этой группы пациентов не ухудшает прогноз, так как выполнение «спасительных» операций позволяет добиться 5-летнего локального контроля в 82% случаев при Т3 распространенности первичной опухоли и 68% при Т4 [15].
Приверженцы хирургического подхода при раке ротоглотки предлагают выполнять трансоральные лазерные оперативные вмешательства, несмотря на то, что в дальнейшем до 25% больных в течение года, а 10% больных в течение 2-х лет необходимо пользоваться назогастральным зондом для питания, а 80% больных необходимо послеоперационное химио-лучевое лечение. С другой стороны, хирургическое вмешательство на 1-м этапе уточняет стадию заболевания, что позволяет правильно спланировать послеоперационное лечение. По данным Smith R.V. et al. [21], после трансоральных оперативных вмешательств стадия болезни изменилась у 43% больных, что по-
влияло на тактику лечения у 21% больных. Тем не менее, авторы приводят впечатляющие цифры 2-х летней безрецидивной выживаемости — 94% и 5-летней общей выживаемости — 78% [7, 9, 16, 21]. Steiner W. et al. [22] отмечает, что по его данным локальный контроль увеличивается с 80 до 91% в случае применения послеоперационного химиолучевого лечения. Также все авторы подчеркивают, что для выполнения данных хирургических вмешательств необходим строгий отбор больных по распространенности опухолевого процесса, тогда как для проведения химиолучевого лечения это не имеет принципиального значения, важно лишь общее состояние больного и наличие сопутствующей патологии.
Исходя из вышеизложенного, наметившиеся разногласия относительно оптимальных методов лечения рака ротоглотки, как раннего, так и местно-распространенного, специалисты пытаются решить посредством проспективных многоцентровых исследований, анализируя эффективность различных лечебных подходов в сопоставимых группах. В своей работе Smith R.V. et al. [21] выявил преимущества, хотя и не достоверные, в показателях 3-х летней общей и безрецидивной выживаемости в группе больных, которым на 1-м этапе выполнена трансоральная лазерная микрохирургия, по сравнению с группой больных, получивших стандартное химиолучевое лечение: 83% и 57% (р=0.06) и 94% и 85% (р=0.08) соответственно. Исследование Ford S.E. et al. [5] показало, что при трансоральной роботизированной хирургии +\— стандартное химиолучевое лечение отмечены достоверно лучшие показатели 3-х летней безрецидивной по сравнению с обычной «открытой» операцией +\— химиолучевое лечение при раке ротоглотки: 89% и 73% соответственно (р=0.035). И, наконец, многоцентровое ретроспективное исследование White H. et al. [23] по сравнению онкологических и функциональных результатов «спасительных» хирургических вмешательств при рецидиве рака ротоглотки посредством трансоральных роботоассистированных и традиционных «открытых операций показало, что 2-х летняя безрецидивная выживаемость достоверно выше в группе роботоассистированных операций (74% и 43%, р=0.01), что достигалось во многом благодаря более низкой частоте положительных краев резекции (n=6 и n=19, p=0.007).
В своей работе Smith R.V. et al. [21] выявил преимущества, хотя и не достоверные, в показателях 3-х летней общей и безрецидивной выживаемости в группе больных, которым на 1-м этапе выполнена трансоральная лазерная микрохирургия, по сравнению с группой больных, получивших стандартное химиолучевое лечение: 83% и 57% (р=0.06) и 94% и 85% (р=0.08) соответственно. Исследование Ford S.E. et al. [5] показало, что при трансоральной роботизированной хирургии +\— стандартное химиолучевое лечение отмечены достоверно лучшие показатели 3-х летней безрецидивной по сравнению с обычной «открытой» операцией +\— химиолучевое лечение при раке ротоглотки: 89% и 73% соответственно (р=0.035). И, наконец, многоцентровое ретроспективное исследование White H. et al. [23] по сравнению онкологических и функциональных результатов «спасительных» хирургических вмешательств при рецидиве рака ротоглотки посредством трансоральных роботоассистированных и традиционных «открытых операций показало, что 2-х летняя безрецидивная выживаемость достоверно выше в группе роботоассистированных операций (74% и 43%, р=0.01), что достигалось во многом благодаря более низкой частоте положительных краев резекции (n=6 и n=19, p=0.007).
На основании вышеизложенного можно сделать вывод, что в связи с появлением новых эффективных методов хирургического лечения больных раком ротоглотки в настоящее время химиолучевой подход
уже не рассматривается как метод выбора в лечении больных раком ротоглотки. Конечно, в такой ситуации необходимо проведение крупных международных рандомизированных исследований, которые позволили бы индивидуализировать лечебный подход для каждой клинической ситуации и выбрать конкретному больному оптимальную лечебную тактику.
Несмотря на постоянное совершенствование методик лучевого лечения, схем и режимов лекарственной терапии у части больных в дальнейшем диагностируется остаточная опухоль, либо рецидив первичной опухоли. В зависимости от вида химиолучевого лечения, режимов индукционной и конкурентной полихимиотерапии, вида лучевой терапии частота полных эффектов колеблется от 60 до 80% [8, 13, 15, 19, 20]. В данной ситуации только хирургическое вмешательство, при условии, что оно выполнимо, дает больному шанс на излечение. Но операции при опухолях ротоглотки вообще, а при рецидивах после химиолучевого лечения в особенности, представляют значительные технические трудности вследствие сложности хирургического доступа, точной оценки распространенности опухоли, выраженных постлучевых изменений тканей. В связи с тем, что в Российской Федерации химиолучевой метод лечения рака ротоглотки применяется в подавляющем числе случаев: вследствие значительной распространенности первичной опухоли или регионарных метастазов, исторической традиции, отсутствия в большинстве клиник аппаратуры для трансоральных резекций, либо отсутствия специалистов или необходимого опыта по выполнению открытых операций на ротоглотке — мы в своей работе хотели бы провести анализ больных с рецидивом рака ротоглотки после химиолучевого лечения, которым в Онкологическом научном центре было выполнено хирургическое лечение.
В зависимости от вида химиолучевого лечения, режимов индукционной и конкурентной полихимиотерапии, вида лучевой терапии частота полных эффектов колеблется от 60 до 80% [8, 13, 15, 19, 20]. В данной ситуации только хирургическое вмешательство, при условии, что оно выполнимо, дает больному шанс на излечение. Но операции при опухолях ротоглотки вообще, а при рецидивах после химиолучевого лечения в особенности, представляют значительные технические трудности вследствие сложности хирургического доступа, точной оценки распространенности опухоли, выраженных постлучевых изменений тканей. В связи с тем, что в Российской Федерации химиолучевой метод лечения рака ротоглотки применяется в подавляющем числе случаев: вследствие значительной распространенности первичной опухоли или регионарных метастазов, исторической традиции, отсутствия в большинстве клиник аппаратуры для трансоральных резекций, либо отсутствия специалистов или необходимого опыта по выполнению открытых операций на ротоглотке — мы в своей работе хотели бы провести анализ больных с рецидивом рака ротоглотки после химиолучевого лечения, которым в Онкологическом научном центре было выполнено хирургическое лечение.
Под наблюдением в отделе опухолей головы и шеи Онкологического научного центра за период с 1998 по 2013 гг. находилось 65 больных с рецидивом плоскоклеточного рака ротоглотки, которым ранее было проведено химиолучевое лечение, заключавшееся в назначении 2 или реже 4 курсов полихимиотерапии по схеме PF и непрерывного курса лучевой терапии разовой дозой 2 Гр. До суммарной дозы 60-70 Гр на область ротоглотки и ипсилатеральную сторону шеи. Оценить первоначальную распространенность опухолевого процесса не представлялось возможным, так как только 6 пациентов получали консервативное противоопухолевое лечение в Онкологическом научном центре, а у большинства остальных пациентов
данные выписных эпикризов не были представлены, либо в них не указывалась стадия опухолевого процесса.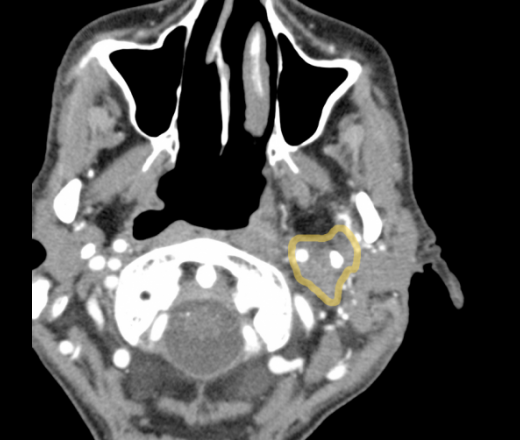
Мы разделили всех больных на 2 группы. Первая группа (26 больных (40%)) — это пациенты, у которых после окончания химиолучевого лечения в сроки от 3 до 6 месяцев при контрольном осмотре диагностирована остаточная опухоль. Вторая группа (39 пациентов (60%)) — больные, у которых после проведенного лечения диагностирован полный эффект, но через 6 месяцев или более диагностирован рецидив опухоли. Сравнительно низкий процент поражения регионарных лимфатических узлов: 42.3% и 48.7% для 1 и 2 групп соответственно, с одной стороны может говорить об эффективности предшествующего химиолучевого лечения, а с другой, о тщательном отборе больных для хирургического лечения, так как пациенты с агрессивным опухолевым процессом инфильтративного характера и со значительным поражением регионарного лимфоколлектора часто не являются кандидатами для хирургического вмешательства (табл. 1).
Средний возраст пациентов — 53.2 года, в основном (76.9%) больные находились в возрастном интервале от 40 до 70 лет. Только 10 пациентов (15.4%) были женского пола.
Локализация опухоли в ротоглотке в значительной степени определяет направления ее роста, объем предполагаемого хирургического вмешательства и необходимость и вариант реконструктивного этапа. Преимущественной локализацией опухолевого процесса была небная миндалина — 38 больных (58.5%), реже опухоль локализовалась в области корня языка — 17 больных (26.1%) и мягкого неба — 10 (15.4%).
Оценка распространенности опухолевого процесса для решения вопроса о возможности оперативного лечения и объеме операции осуществляется посредством осмотра, пальпации, ультразвуковой компьютерной томографии, рентгеновской компьютерной томографии с контрастированием, магниторе-зонансной томографии. Большое значение, особенно у лиц с тризмом II-III степени, с выраженным болевым синдромом, постлучевыми изменениями мягких тка-
ней, кожи и слизистой оболочки имеют методы лучевой диагностики. Последние позволяют не только оценить размеры первичной опухоли, но и регионарных метастазов, их распространенность по мягким тканям и клетчаточным пространствам, поражение костных структур, вовлечение в опухолевый процесс магистральных сосудов. Еще один важный, но достаточно сложный аспект лучевых методов диагностики, в особенности МРТ исследования с контрастированием — возможность дифференцировки области опухолевого поражения от постлучевых изменений и рубцово-измененных тканей. Тем не менее, следует признать, что бывают клинические ситуации, когда вопрос об объеме операции может быть решен только на операционном столе посредством тщательного осмотра измененных тканей, оценки распространенности опухолевого/постлучевого инфильтрата, а иногда выполнением срочного гистологического исследования подозрительных на опухолевую инвазию тканей. В любом случае, наличие таких клинических симптомов, как тризм, выраженный болевой синдром часто являются признаками значительной распространенности опухолевого процесса, и такие ситуации требуют тщательной оценки объема поражения. В нашем исследовании изменение объема операции вследствие обнаруженных операционных находок произведено у 6 больных (9.2%), а 3 пациента были признаны неоперабельными вследствие недиагно-стированной распространенности опухоли в область носоглотки, парафарингеальное пространство, основание черепа. Эти трое пациентов были исключены из исследования.
Последние позволяют не только оценить размеры первичной опухоли, но и регионарных метастазов, их распространенность по мягким тканям и клетчаточным пространствам, поражение костных структур, вовлечение в опухолевый процесс магистральных сосудов. Еще один важный, но достаточно сложный аспект лучевых методов диагностики, в особенности МРТ исследования с контрастированием — возможность дифференцировки области опухолевого поражения от постлучевых изменений и рубцово-измененных тканей. Тем не менее, следует признать, что бывают клинические ситуации, когда вопрос об объеме операции может быть решен только на операционном столе посредством тщательного осмотра измененных тканей, оценки распространенности опухолевого/постлучевого инфильтрата, а иногда выполнением срочного гистологического исследования подозрительных на опухолевую инвазию тканей. В любом случае, наличие таких клинических симптомов, как тризм, выраженный болевой синдром часто являются признаками значительной распространенности опухолевого процесса, и такие ситуации требуют тщательной оценки объема поражения. В нашем исследовании изменение объема операции вследствие обнаруженных операционных находок произведено у 6 больных (9.2%), а 3 пациента были признаны неоперабельными вследствие недиагно-стированной распространенности опухоли в область носоглотки, парафарингеальное пространство, основание черепа. Эти трое пациентов были исключены из исследования.
Очень важным мы считаем вопрос о состоянии нижней челюсти, так как в случае ее поражения, либо, что чаще — наличия опухолевого инфильтрата в области прикрепления наружной крыловидной мышцы в области угла нижней челюсти, необходимо выполнение сегментарной резекции последней (18 случаев (27.7%)) (рис. 1,2).
Выполнение сегментарной резекции нижней челюсти в таких случаях одновременно создает и доступ в область ротоглотки для выполнения резекции слизистой оболочки и мягких тканей.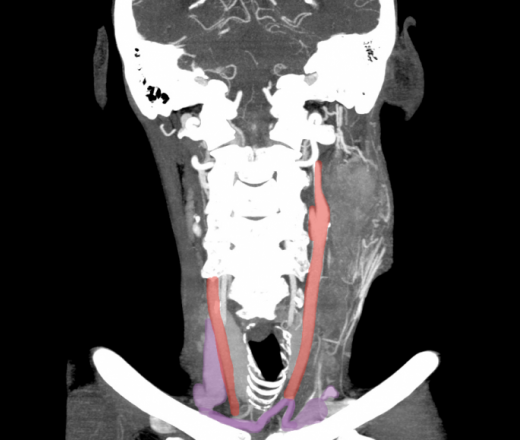 При отсутствии
При отсутствии
Таблица 1. Количество больных в группах с продолженным ростом и рецидивом рака ротоглотки
Продолженный рост/рецидив Количество больных N0 N+
Продолженный рост 26 15 11 (42.3%)
Рецидив 39 20 19 (48.7%)
Всего 65 35 (53.8%) 30 (46.2%)
Рис. 1. Компьютерная томография, аксиальный срез. Рецидив рака боковой стенки ротоглотки. Распространение опухолевого инфильтрата до кортикальной пластинники нижней челюсти
поражения нижней челюсти (рис. 2), операционный доступ создается посредством выполнения срединной мандибулотомии (39 больных (60.0%)). В нашем исследовании встречались клинические ситуации, когда возможно было выполнить хирургическое вмешательство трансорально без рассечения покровных тканей и нижней челюсти: при локализации опухоли в области мягкого неба, ограниченном опухолевом процессе в области передней небной дужки (4 случая (6.2%)).
С внедрением в клиническую практику методики и аппаратуры для трансоральной лазерной хирургии появилась возможность выполнения радикального хирургического вмешательства на области ротоглотки без нанесения дополнительной хирургической травмы в виде мандибулотомии. Мы только начали работу в этом направлении, наш опыт небольшой (4 пациента (6.2%)), но позитивный (рис. 3-6).
Объем оперативного вмешательства у больных, включенных в исследование достаточно сложно систематизировать, так как он зависел от локализации, распространенности опухоли и вида операционного
Рис. 2. Магнито-резонансная томография.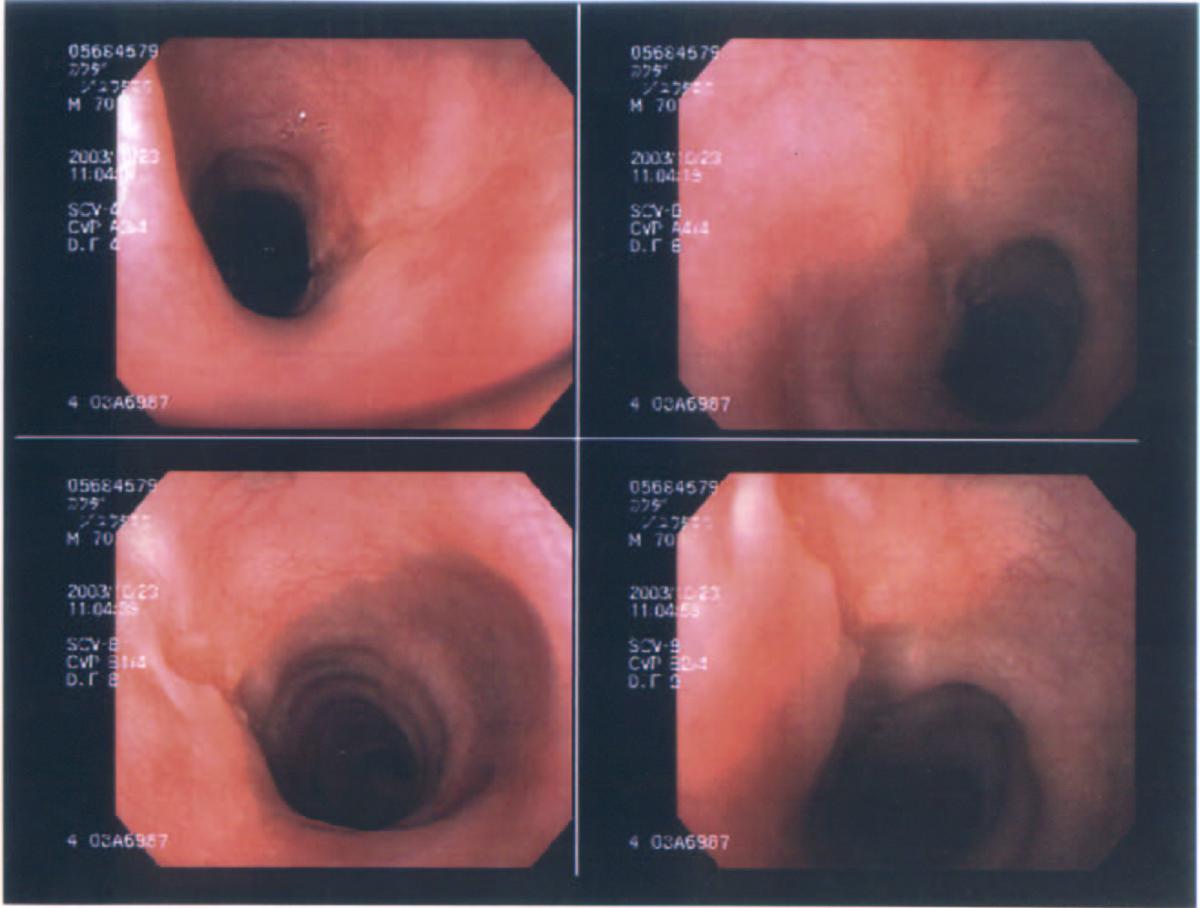 Аксиальный срез. Рецидив рака ротоглотки в области небной миндалины с распространением до наружней крыловидной мышцы
Аксиальный срез. Рецидив рака ротоглотки в области небной миндалины с распространением до наружней крыловидной мышцы
доступа. Всем больным выполнялась шейная лимфо-диссекция на гомолатеральной стороне (у 4 больных (6.2%) в виде радикальной лимфодиссекции). В случае распространения опухоли за среднюю линию (чаще при локализации опухоли в области корня языка и мягкого неба) больным выполнялась двусторонняя шейная лимфодиссекция — 7 больных (10.8%).
При резекции корня языка, мягкого неба, а также при выполнении резекции боковой стенки ротоглотки по поводу ограниченного опухолевого поражения восстановление дефекта осуществлялось посредством мобилизации окружающих мягких тканей и слизистой оболочки. Это оказалось возможным выполнить у 24 пациентов (36.9%). Осложнения, которые были отмечены в данных клинических ситуациях (12.5%) были обусловлены некрозом
При большем объеме резекции для замещения дефекта применялся различный пластический материал в виде перемещенных (57.0%) или свободных лоскутов (6.2%). В своей работе мы использовали височный фасциально-апоневротический лоскут для замещения ограниченных дефектов боковой стенки ротоглотки и
рис. 3. Пациент Г. Рецидив рака корня языка. Трансоральная лазерная резекция. Вид первичной опухоли
рис. 4. Тот же больной. Намечены границы резекции корня языка в пределах здоровых тканей
рис. 5. Тот же больной. Вид операционной раны после рис. 6. Удаленный макропрепарат в пределах здоровой резекции слизистой оболочки и подлежащих мышц
прилегающих отделов мягкого неба и ретромолярной области — 7 случаев (10.8%). Наиболее часто применялся лоскут с включением большой грудной мышцы (30 больных (46. 2%)), который обычно использовался для замещения дефекта боковой стенки ротоглотки, особенно в случае выполнения сегментарной резекции нижней челюсти. При рецидивном опухолевом процессе в области корня языка, когда выполнялась субтотальная резекция языка с оставлением культи в области корня с противоположной стороны, исполь-
2%)), который обычно использовался для замещения дефекта боковой стенки ротоглотки, особенно в случае выполнения сегментарной резекции нижней челюсти. При рецидивном опухолевом процессе в области корня языка, когда выполнялась субтотальная резекция языка с оставлением культи в области корня с противоположной стороны, исполь-
зование пластичного свободного лучевого лоскута (4 случая (6.2%) позволяло в кратчайшие сроки восстановить глотание и реабилитировать больного. Осложнения в виде частичного некроза отмечены только при использовании перемещенных лоскутов, которые были купированы на фоне местного лечения без последствий для больного (рис. 7-13).
При анализе онкологических результатов необходимо отметить, что за период наблюдения от 18 месяцев до 18 лет 34 (52.4%) пациента живут без признаков
Рис. 7. Больной Д., 65 лет. Рецидив рака ротоглотки с метастазами в лимфатические узлы шеи слева
Рис. 8. Компьютерная томография с внутривенным контрастированием. Аксиальный срез. Опухоль в области боковой стенки ротоглотки с распространением на корень языка, интенсивно накапливающая контраст. Кистозный метастаз в средней трети шеи, сдавливающий внутреннюю яремную вену, раздвигающий внутреннюю и наружную сонные артерии без их поражения
Рис. 9. Этап операции. Срединная мандибулотомия. Мобилизована левая половина подвижной части языка с корнем и боковой стенкой ротоглотки с опухолью
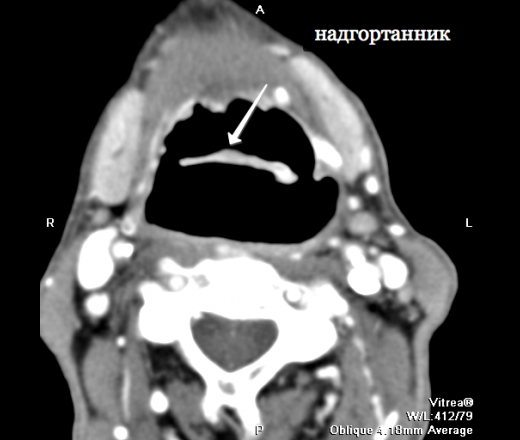
Рис. 10. Этап операции. Вид операционной раны после резекции ротоглотки (корень языка и боковой стенки ротоглотки). В глубине раны видна свободная часть надгортанника
рис. 12. Полость рта. Через 6 месяцев после операции. Дефект ротоглотки замещен кожно-мышечным лоскутом с включением большой грудной мышцы
рис. 11. Макропрепарат. Левая половина подвижной части языка с корнем и боковой стенкой ротоглотки с опухолевой язвой. Клетчатка шеи с метастатическим узлом
11. Макропрепарат. Левая половина подвижной части языка с корнем и боковой стенкой ротоглотки с опухолевой язвой. Клетчатка шеи с метастатическим узлом
заболевания. Наиболее частой причиной неудач является повторный рецидив рака ротоглотки, развившийся в период от 3 до 18 месяцев после операции у 21 больного (32.3%), реже встречается рецидив метастазов после шейной лимфодиссекции или метастазы в контралатеральные лимфатические узлы шеи — 6 пациентов (9.2%). Кроме того, у 2-х больных (3.1%) выявлены отдаленные метастазы, и еще у 2-х пациентов (3.1%) отмечено развитие метахронной злокачественной опухоли вне органов головы и шеи.
При сравнении результатов лечения в зависимости от сроков диагностирования опухоли после проведенного лечения было выявлено, что 4-х летняя общая выживаемость в группе больных с остаточной опухолью в ротоглотке составляет 68.4%, что достоверно выше, чем в группе больных с рецидивом рака ротоглотки — 50.2% (p<0.05) (рис. 14). С нашей точки зрения, это может быть обусловлено тем, что остаточная опухоль обычно имеет ограниченные размеры, как по площади, так и по глубине вследствие эффекта воздействия как лекарственного, так и лучевого лечения. Кроме того, если операция проводится в ранние сроки после окончания химиолучевого лечения (2-3 месяца), то в определенном смысле можно говорить о комбинации всех этих лечебных факторов (консервативного и хирургического) (рис. 14).
рис. 13. Внешний вид больного через 6 месяцев после операции. Удовлетворительный эстетический результат
Таблица 2. Вид используемого пластического материала для замещения дефекта ротоглотки
Вид пластического материала Всего больных Осложнения
Большая грудная мышца 30 (46.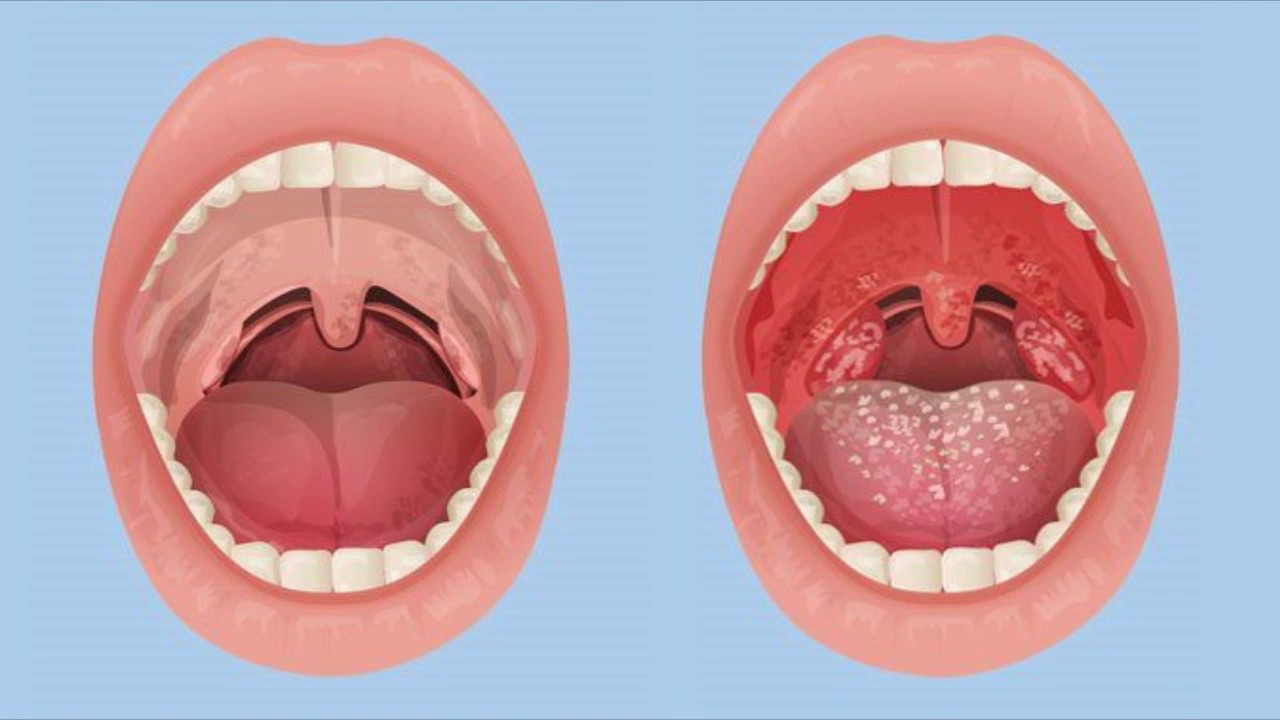 2%) 3 (10%)
2%) 3 (10%)
Височный фасциально-апоневротический лоскут 7 (10.8%) 2 (28.6%)
Лучевой свободный лоскут 4 (6.2%) —
Местные ткани 24 (36.9%) 3 (12.5%)
Всего 65 8 (12.3%)
Рис. 14. Общая выживаемость в группе больных с остаточными и рецидивными опухолями ротоглотки
Cumulative Proportion Surviving (Kaplan-Meier) 0 Complete + Censored
1,0
Time
Рис. 15. Общая выживаемость в зависимости от локализации рецидива рака ротоглотки
При анализе показателей выживаемости в зависимости от локализации опухоли в ротоглотке была выявлена достоверно худшая общая выживаемость при опухолях мягкого неба (30.0%), по сравнению с опухолями небной миндалины (64.6%) и корня языка (57.2%) (рис. 15). Это, на наш взгляд, обусловлено частым распространением опухолей мягкого неба за среднюю линию, в область носоглотки, двусторонним поражением лимфатических узлов шеи.
Таким образом, в случае неудачи химиолучевого лечения рака ротоглотки хирургическое лечение в виде трансоральной лазерной резекции или открытой операции с выполнением срединной мандибуло-томии или сегментарной резекции нижней челюсти позволяет добиться излечения у 52.4% больных. После проведенного химиолучевого лечения необходим тщательный динамический контроль за зоной первичного очага и шейно-надключичной области, так как в случае выявления остаточной опухоли оперативное лечение позволяет достичь 68.4% 4-х летней общей выживаемости, что достоверно выше, чем в группе с рецидивом опухолевого процесса — 50.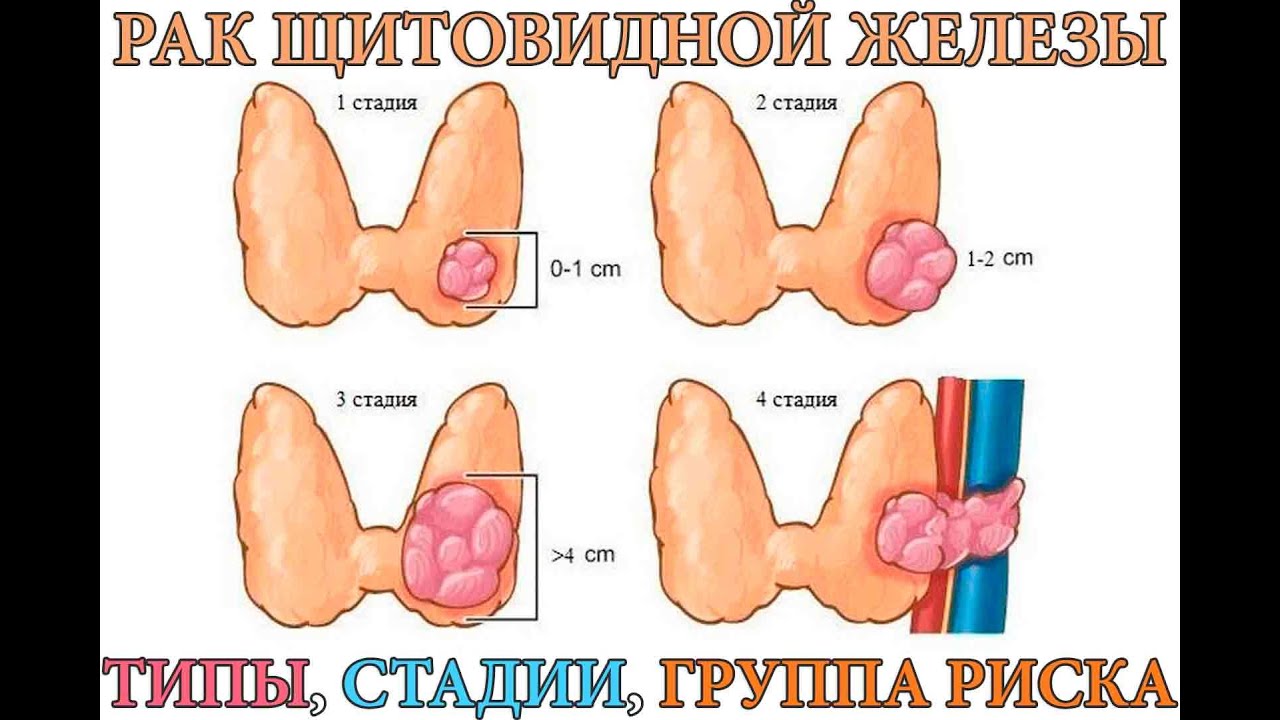 2%.
2%.
Литература
1. Давыдов М.И., Аксель Е.М. Статистика злокачественных новообразований в России и странах СНГ в 2008 г. // Вести РОНЦ РАМН. — 2009. — 20 (3). — С. 158.
2. De Almeida J.R., Byrd J.K., Wu R., et al. A systematic reviewoftransoralroboticsurgeryandradiotherapyfor early oropharynx cancer // Laryngoscope. — 2014. — 124 (9). — P. 2096-2102.
3. Chaturvedi A.K., Engels E.A., Pfeiffer R.M. et al. Human papillomavirus and rising oropharyngeal cancer incidence in the Unated States // J. Clin. Oncol. — 2011. — 29. — P. 4294-4301.
4. Chera B.S., Amdur R.J., Hinerman R.W. et al. Definitive radiation therapy for squamous cell carcinoma of the soft palate // Head Neck. — 2008. — 30. — P. 11141119.
5. Ford S.E., Brandwein-Gensler M., Carroll W.R. et al. Transoral robotic versus open surgical approaches to oropharyngeal squamous cell carcinoma by human papillomavirus status // Otolaryngol. Head Neck Surg. — 2014. — 151 (4). — P. 606-611.
6. Garden A.S., Morrison W.S., Stugis E.M. et al. IMRT for oropharyngeal carcinoma: patiet outcome and patterns of failure // Int. J. Radiat. Oncol. Biol. Phys. — 2011. — 81.
7. Grant D.C., Hinni M.L., Salassa J.R. et al. Oropharyngeal
cancer: a case of single modality with transoral laser microsurgery // Arch. Otolaryngol. Head Neck Surg. — 2009. — 135. — P. 1225-1230.
8. Harrison L.B., Sessions R.B., Kies M.S. Head and neck cancer. A multidisciplinary Approach. — 2014. — 4th edition. — Lippincott Williams and Wilkins, Philadelphia, USA.
9. Haughey B.H., Hinni M.I., Salassa J.R., et al. Transoral laser microsurgery as primary treatment for advanced stage oropharyngeal cancer: a Unated States Multicenter study // Head Neck. — 2011. — 33. — P. 1683-1694.
10. Henstrom D.K., Moore E.J., Olsen K.D. et al. Transoral resection for squamous cell carcinoma of the base of the tongue // Arch. Otolaryngol. Head Neck Surg. — 2009. — 135. — P. 1231-1238.
11. Hu K., Kumar M., Harrison L. et al. Can stage III — IY head and neck cancer patients be treated with unilateral radiotherapy? // Int. J. Radiat. Oncol. Biol. Phys. — 2011. — 81.
12. Iyer N.C., Nixon I.J., Pelmer F. et al. Surgical management of the squamous cell carcinoma of the soft palate: factors predictive of outcome // Head Neck. — 2012. — 34. — P. 1071-1080.
13. Jackson S.M., Hay J.H., Flores A.D. et al. Cancer of the tonsil: the results of ipsilateral radiation treatment // Radiother. Oncol. J. Eur. Soc. Therapeutic. Radiol. Oncol. — 1999. — 51. — P. 123-8.
14. Van Loon J.W., Smeele L.E., Hilgers F.J. et al. Outcome of transoral robotic surgery for stage I-II oropharyngeal cancer // Eur. Arch. Otorhinolaryngol. — 2015. — 272 (1). — P. 175-183.
15. Mendenhall W.M., Morris C.G., Amdur R.G. et al. Definitive radiotherapy for tonsillar squamous cell carcinoma // Am. J. Clin. Oncol. — 2006. — 29. — P. 290-297.
16. Moore E.J., Olsen S.M., Laborde R.R. et al. Long-term functional and oncologic results of transoral robotic surgery for oropharyngeal squamous cell carcinoma // Mayo Clin. Proc. Mayo Clin. — 2012. — 87. — P. 219-225.
17. Mourad W.F., Hu K., Harrison L.B. Five year outcomes of squamous cell carcinoma of the tonsil treated with radiotherapy // Am. J. Clin. Oncol. in press.
Mourad W.F., Hu K., Harrison L.B. Five year outcomes of squamous cell carcinoma of the tonsil treated with radiotherapy // Am. J. Clin. Oncol. in press.
18. OSullivan B., Warde P., Grice B. et al. The benefits and pitfalls of ipsilateral radiotherapy in carcinoma of tonsillar region // Int. J. Radiat. Oncol. Biol. Phys. — 2001. — 51. — P. 332-343.
19. Pernot M., Luporsi E., Hoffstetter S. et al. Complications following definitive irradiation for cancers of the
oral cavity and the oropharynx (in a series of 1134 patients) // Int. J. Radiat. Oncol. Biol. Phys. — 1997. — 37. — P. 577-585.
20. Setton J., Caria N., Romanyshyn D. et al. Intensity-modulated radiotherapy in the treatment of oropharyngeal cancer: an update of the Memorial Sloan-Kettering Cancer Center experience // Int. J. Radiat. Oncol. Biol. Phys. — 2012. — 82. — P. 291-298.
21. Smith R.V., Schiff B.A., Garg M. et al. The impact of transoral robotic surgery on the overall treatment of oropharyngeal cancer patients // Laryngoscope. —
2015. — 125 (10). — P. 610-615.
22. Steiner W., Fierek O., Ambrosch P. et al. Transoral laser microsurgery for squamous cell carcinoma of the base of the tongue // Arch. Otolaryngol. Head Neck Surg. — 2003. — 129. — P. 36-43.
23. White H., Ford S., Bush B. et al. Salvage surgery for recurrent cancer of the oropharynx: comparing TORS with standard open surgical approaches // JAWA Otolaryngol. Head Neck Surg. — 2013. — 139 (8). — P. 2011-2019.
Рак головы и шеи — профилактика, стадии, симптомы и методы лечения
Введение
Рак начинается, когда здоровые клетки изменяются и начинают неконтролируемо расти, образуя массу, называемую опухолью. Опухоль может быть раковой и доброкачественной. Раковая опухоль является злокачественной, то есть, может прорастать и распространяться на другие части тела. Доброкачественная опухоль может расти, но не распространяться на другие ткани.
Опухоль может быть раковой и доброкачественной. Раковая опухоль является злокачественной, то есть, может прорастать и распространяться на другие части тела. Доброкачественная опухоль может расти, но не распространяться на другие ткани.
Рак головы и шеи
Рак головы и шеи — это термин, используемый для описания ряда различных злокачественных опухолей, которые развиваются в области горла, гортани, носа, пазух и рта или в этих органах.
Большинство раковых заболеваний головы и шеи представляют собой плоскоклеточные карциномы. Этот вид онкологии начинается в клетках эпителия, который составляет тонкий слой поверхностной ткани. Непосредственно под эпителием, на некоторых участках головы и шеи имеется слой влажной ткани, называемый слизистой оболочкой. Если рак обнаружен только в плоскоклеточном слое, он называется карциномой in situ. Если рак разросся за пределы этого клеточного слоя и перешел в более глубокие ткани, он называется инвазивным плоскоклеточным раком.
Если рак головы и шеи начинается в слюнных железах, опухоль обычно классифицируется как аденокарцинома, аденоидная кистозная карцинома или мукоэпидермоидная карцинома.
Виды рака головы и шеи
Существует 5 основных видов рака головы и шеи, каждый из которых назван в соответствии с той частью тела, где он обнаружен.
- Рак гортани и гипофарингеальный рак. Гортань – составная часть голосового аппарата. Этот трубчатый орган на шее предназначен для дыхания, разговора и глотания. Он расположен в верхней части дыхательного горла, или трахеи. Гипофаринкс (пищевод) – нижний отдел горла, окруженный гортанью.
- Рак полости носа и околоносовых пазух. Носовая полость — это пространство позади носа, откуда воздух попадает в горло. Околоносовые пазухи — это заполненные воздухом области, окружающие носовую полость.
- Рак носоглотки. Носоглотка — это воздушная полость в верхней части глотки за носом.
- Рак ротовой полости и ротоглотки.
 Полость рта включает в себя рот и язык. Ротоглотка включает в себя середину горла, от миндалин до кончика голосового аппарата.
Полость рта включает в себя рот и язык. Ротоглотка включает в себя середину горла, от миндалин до кончика голосового аппарата. - Рак слюнных желез. Слюнная железа вырабатывает слюну. Слюна — жидкость, которая выделяется во рту для поддержания его влажности и содержит ферменты, расщепляющие пищу.
В области головы и шеи также могут быть локализованы другие виды онкопроцесса, но их диагностика и лечение сильно отличаются.
Факторы риска и профилактика онкологии головы
Фактор риска — все то, что увеличивает вероятность развития онкологии у человека. И хотя факторы риска зачастую влияют на развитие рака, большинство из них непосредственно его не вызывают. У некоторых людей с несколькими факторами риска, может никогда не развиться рак, а у других, не имеющих известных факторов риска, он, наоборот, возникнет. Знание своих факторов риска и обсуждение их со своим врачом поможет сделать более осознанный выбор образа жизни и медицинского обслуживания.
Существует 2 вещества, значительно увеличивающие риск развития рака головы и шеи:
- Табак. Под употреблением табака подразумевают: курение сигарет, сигар или трубок; жевательный или нюхательный табак. Это наиболее значимый фактор риска развития рака головы и шеи.
- Алкоголь. Злоупотребление алкогольными напитками повышает риск развития злокачественных новообразований. .
Совместное употребление алкоголя и табака увеличивает этот риск еще больше.
Факторы, которые могут повысить риск развития рака головы и шеи, включают также:
- Длительное пребывание на солнце. Это особенно касается рака в области губ, а также рака кожи головы и шеи.
- Вирус папилломы человека (ВПЧ). Половые отношения с человеком с ВПЧ является наиболее распространенным способом инфицирования ВПЧ. Существуют различные виды ВПЧ, называемые штаммами.
- Вирус Эпштейна-Барра (EBV). Воздействие EBV (вирус, вызывающий мононуклеоз или «моно») играет весомую роль в развитии рака носоглотки.

- Пол. У мужчин в 2–3 раза чаще развивается рак головы и шеи. Тем не менее, уровень рака головы и шеи у женщин возрастает уже несколько десятилетий.
- Возраст. Люди в возрасте от 45 лет более подвержены риску онкопроцесса.
- Плохая гигиена полости рта и зубов.
- Экологические или профессиональные ингалянты. Вдыхание различных химических соединений (лакокрасочные материалы, асбест) может повысить риск развития опасного заболевания.
- Употребление марихуаны.
- Неправильное питание. Диета с низким содержанием витаминов А и В увеличивает риски.
- Гастроэзофагеальная рефлюксная болезнь (ГЭРБ) и ларингофарингеальная рефлюксная болезнь (ЛЭРБ). Рефлюкс связан с ростом опухоли в данной области.
- Ослабленная иммунная система.
- Воздействие радиоактивного излучения. Напрямую связано с развитием онкопроцесса.
- Рака головы и шеи в анамнезе. Люди, у которых был однажды рак головы и шеи, имеют более высокий шанс развития другой злокачественной опухоли в будущем.
Профилактика
Отказ от табака — важнейшая составляющая профилактики.
- Отказ от употребления алкоголя и марихуаны.
- Регулярное применение солнцезащитного крема, в том числе бальзама для губ с достаточным солнцезащитным фактором (SPF)
- Снижение риска заражения ВПЧ путем вакцинации от ВПЧ или путем ограничения количества половых партнеров. Использование презерватива во время полового акта не может полностью защитить от ВПЧ.
- Поддержание надлежащего ухода за зубными протезами. Неудачно подобранные зубные протезы могут улавливать канцерогенные вещества из табака и алкоголя. Протезы следует снимать каждую ночь, чистить и тщательно промывать каждый день.
Последующее наблюдение и контроль
Лечение людей, у которых диагностирован рак, не заканчивается после завершения активной терапии. Лечащий врач будет продолжать проверять, не произошел ли рецидив рака, контролировать всевозможные побочные эффекты и общее состояние здоровья. Это называется последующим наблюдением. Оно состоит из регулярных медицинских осмотров и проведения анализов.
Лечащий врач будет продолжать проверять, не произошел ли рецидив рака, контролировать всевозможные побочные эффекты и общее состояние здоровья. Это называется последующим наблюдением. Оно состоит из регулярных медицинских осмотров и проведения анализов.
Контроль рецидива
Одной из целей последующего наблюдения является контроль рецидива, то есть, повторного наступления болезни. Рак рецидивирует из-за того, что в организме могут остаться небольшие скопления злокачественных клеток. Со временем эти клетки могут увеличиваться до тех пор, пока они не появятся в результатах анализов или не вызовут соответствующие симптомы. Во время последующего наблюдения лечащий врач может предоставить вам персональную информацию о риске рецидива. Ваш врач задаст конкретные вопросы о вашем здоровье. Может потребоваться сдать анализы крови или пройти визуальную диагностику в рамках регулярного последующего наблюдения. Рекомендации по последующему наблюдению зависят от нескольких факторов, включая тип и стадию первоначально диагностированного рака головы и шеи и проведенное лечение. Доктор также подскажет, какие признаки и симптомы контролировать.
Контроль долгосрочных и отложенных побочных эффектов
Лечение злокачественных опухолей сопровождается различными побочными эффектами. Долгосрочные последствия сохраняются после периода терапии. Отложенные побочные эффекты могут развиться спустя месяцы или даже годы. К долгосрочным и отсроченным последствиям могут относиться физические и эмоциональные изменения.
Обсудите со своим врачом риск развития таких побочных эффектов в зависимости от типа рака, вашего индивидуального плана лечения и общего состояния здоровья. Если известно, что проводимое лечение может вызывать некоторые отложенные эффекты, вам может потребоваться пройти определенные дополнительные методы обследования. Например, если вы получали лучевую терапию, врач порекомендует вам регулярно сдавать кровь для проверки функции щитовидной железы. Врач может направить вас к специалисту для лечения отложенных эффектов.
Реабилитация является основной частью последующего наблюдения после лечения рака головы и шеи. Пациентам может назначаться физиотерапия для поддержания двигательных функций и уровня движений, а также терапия речи и глотания для восстановления таких навыков, как разговор и прием пищи. Правильная оценка и лечение часто могут предотвратить долгосрочные проблемы с речью и глотанием. Некоторым пациентам может понадобиться освоить новые способы питания или другие способы приготовления пищи.
Больные могут выглядеть по-другому, чувствовать усталость и быть не в состоянии говорить или есть, как раньше. Многие люди испытывают депрессию. Группы поддержки помогают пациентам справиться с изменениями после лечения.
Ведение собственных медицинских записей
Вам с доктором предстоит совместно разработать индивидуальный план последующего наблюдения. Обязательно обсудите любые свои опасения по поводу собственного будущего физического или эмоционального здоровья.
Стадии
Стадия – это определение того, где расположен рак, распространен ли он, и куда, а также его влияние на другие части тела.
Врачи используют диагностические тесты для определения стадии рака; им может потребоваться информация, основанная на образцах ткани, полученных при операции, поэтому определение стадии может продолжаться до проведения всех анализов. Информация о стадии помогает врачу определить, какое лечение является оптимальным, и спрогнозировать возможность выздоровления.
Система классификации опухолей TNM
Один из способов определения стадии рака – этот система TNM. Врачи используют результаты диагностических тестов и сканирования для получения ответов на следующие вопросы:
- Опухоль (T): ее размеры и расположение?
- Лимфатические узлы (N): степень распространенности процесса на лимфатические узлы?
- Метастазы (M): распространённость рака на другие части тела?
Для определения стадии рака каждого пациента результаты объединяются. Стадия обеспечивает общий способ описания рака, чтобы врачи могли совместно планировать оптимальное лечение.
Стадия обеспечивает общий способ описания рака, чтобы врачи могли совместно планировать оптимальное лечение.
Рак головы и шеи: Симптомы и признаки
Пациенты с раком головы и шеи часто испытывают следующие симптомы или признаки. Иногда у больных с раком головы и шеи не наблюдают никаких нижеуказанных изменений. Или причиной симптома может быть неонкологическое заболевание.
- Незаживающие воспаление или рана
- Красное или белое пятно во рту
- Ком, шишка или масса в области головы или шеи, болезненное или безболезненное
- Длительно сохраняющаяся боль в горле
- Гнилостный запах изо рта, который не объясняется гигиеной
- Хрипота или осиплость голоса
- Частые носовые кровотечения и/или необычные выделения из носа
- Затруднение дыхания (в том числе и носового)
- Двоение в глазах
- Онемение в шее или слабость в затылочной области
- Боль или трудности с жеванием, проглатыванием даже маленьких кусочков пищи
- Боль в челюсти
- Кровянистые выделения в слюне или мокроте, слизи, которая выделяется в рот из дыхательных путей
- Расшатывание зубов
- Протезы, которые больше не подходят
- Необъяснимая потеря веса
- Усталость
- Боль в ушах или инфекция
Если вас беспокоят что-то из вышеперечисленного, следует обратиться к специалисту. Ваш врач, среди прочего, спросит, как долго и как часто вы испытываете симптом (симптомы). Эта беседа поможет в постановке правильного диагноза.
Если диагностирован рак, облегчение симптомов остается важной частью онкологической помощи. Это может называться паллиативной или поддерживающей терапией. Она часто начинается вскоре после постановки диагноза и продолжается в течение всего лечения.
Методы лечения онкологии головы и шеи
Стандарты оказания медицинской помощи при онкологии головы и шеи – лучшие из современных методов лечения. В качестве одного из вариантов терапии врачи рекомендуют рассмотреть клинические исследования. С помощью клинических исследований проверяется новый подход к лечению. Специалисты хотят узнать, является ли новое лечение безопасным, эффективным. Клинические исследования являются вариантом для лечения и онкологической помощи на всех стадиях рака.
С помощью клинических исследований проверяется новый подход к лечению. Специалисты хотят узнать, является ли новое лечение безопасным, эффективным. Клинические исследования являются вариантом для лечения и онкологической помощи на всех стадиях рака.
Онкологическая команда
Специалисты по раку головы и шеи обычно формируют междисциплинарную команду для лечения каждого пациента. В состав входят следующие специальности:
- Химиотерапевт: лечение с помощью лекарств, среди которых химиотерапия, иммунотерапия и таргетная терапия.
- Радиолог-онколог: специализируется на лучевой терапии.
- Хирург-онколог: лечение с помощью операции.
- Реконструктивный / пластический хирург: восстановление повреждений, вызванных лечением опухоли
- Стоматолог-ортопед: восстановление тканей в ротовой полости.
- Отоларинголог: восстановление тканей уха, горла, носа.
- Стоматолог-онколог: опыт лечения пациентов с раком головы и шеи.
- Онкологическая медсестра: специализируется на уходе за больными раком.
- Физиотерапевт: восстановление двигательной активности, физических сил.
- Логопед: восстановление навыков речи, глотания после проведенных манипуляций.
- Аудиолог: лечение и контроль проблем слуха.
- Психолог/психиатр: занимаются эмоциональными, психологическими и поведенческими потребностями больного раком и семьи пациента.
- Социальный работник. предоставляет консультации пациентам, членам семьи и группам поддержки..
- Сертифицированный диетолог-нутриционист: помогает людям понять, как правильно питаться и что есть в соответствии с их конкретным состоянием.
Пациенту может потребоваться осмотр у нескольких специалистов до того, как план лечения будет полностью разработан.
Обзор лечения
Многие раковые заболевания головы и шеи можно вылечить, особенно если они обнаружены на ранней стадии. Устранение рака является основной целью лечения, но сохранение функции соседних нервов, органов и тканей не менее важно. Планируя лечение, врачи учитывают, как лечение может повлиять на качество жизни человека.
Основные варианты терапии – хирургическая, лучевая, таргетная, химиотерапия. Операция или лучевая терапия сами по себе или в сочетании могут быть частью плана лечения.
Варианты лечения и рекомендации зависят от нескольких факторов, включая тип и стадию рака, возможные побочные эффекты, личные предпочтения и общее состояние здоровья.
Хирургическое вмешательство
Цель хирургического вмешательства заключается в удалении раковой опухоли и части здоровых тканей во время операции. При раке головы и шеи используются следующие операции:
- Лазерные операции. Этот способ может использоваться для лечения опухоли на ранней стадии, особенно если она была обнаружена в гортани.
- Удаление. Это операция по удалению раковой опухоли и части окружающих ее здоровых тканей, известных как край.
- Лимфодиссекция, или шейная диссекция. Если врач подозревает распространение раковой опухоли, он может удалить лимфатические узлы на шее. Это может быть сделано одновременно с проведением удаления опухоли.
- Реконструктивная (пластическая) хирургия. Если для хирургического лечения рака требуется удаление важного участка ткани, например, удаление челюсти, кожи, глотки или языка, может потребоваться реконструктивная или пластическая операция для замены отсутствующей ткани. Эта операция помогает восстановить внешний вид человека и функциональность отдельных органов. Логопед потребоваться, чтобы заново научить больного глотать и общаться, используя новейшие методики.
Исходя из расположения, размеров, вида рака, процесс лечения будет проходить поэтапно с проведением нескольких операций.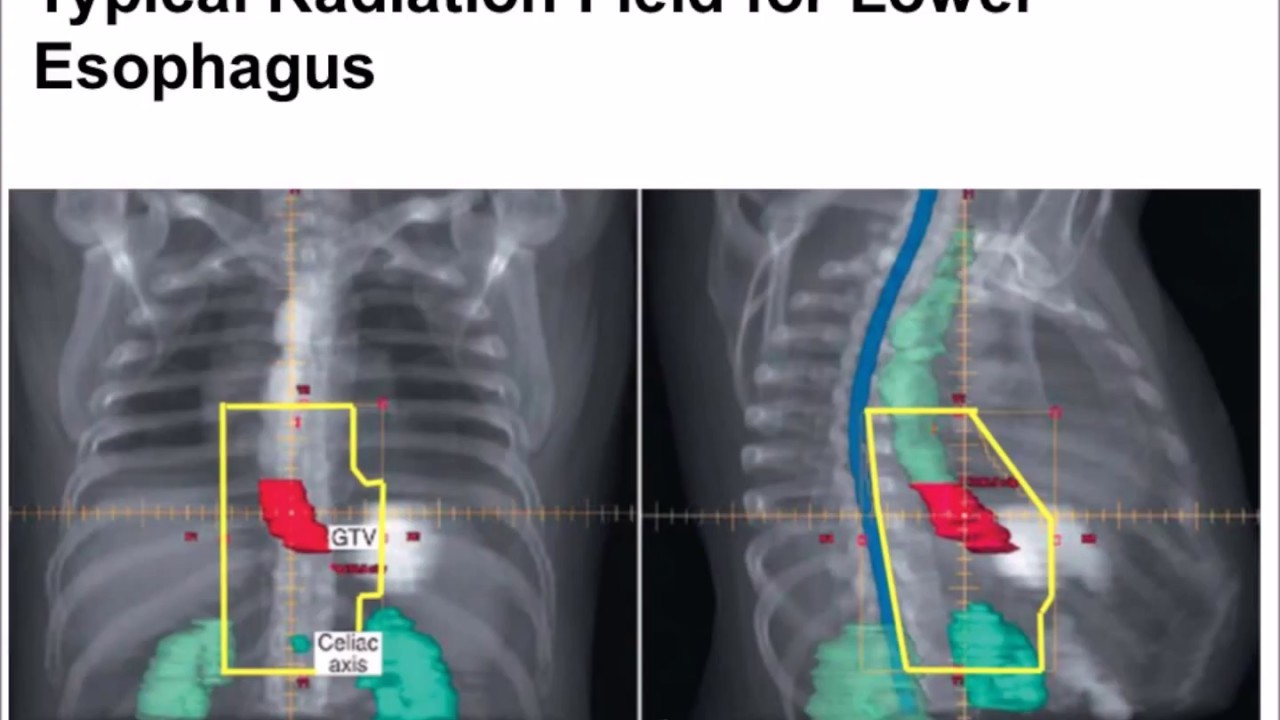 . При невозможности полного устранения опухоли рекомендуются дополнительные процедуры. Если раковые клетки остаются после оперативного вмешательства, назначают другие виды онкологической помощи (радио-, химиотерапия) в сочетанном или изолированном виде.
. При невозможности полного устранения опухоли рекомендуются дополнительные процедуры. Если раковые клетки остаются после оперативного вмешательства, назначают другие виды онкологической помощи (радио-, химиотерапия) в сочетанном или изолированном виде.
Побочные эффекты хирургического вмешательства
Неблагоприятные последствия операции зависят от способа и места ее проведения. Больным следует обсудить все нюансы побочных эффектов проводимой терапии с лечащим врачом. Наиболее распространенные негативные последствия операций в области головы и шеи – проблемы с речевым аппаратом и процессом глотания, снижение слуха. Удаление лимфатических узлов сопровождается скованностью в плечах. Кроме того, может возникнуть лимфостаз. После проведения тотальной ларингэктомии, которая заключается в удалении гортани, у людей может снизиться функция щитовидной железы, которую необходимо контролировать, например, принимая препараты гормонов щитовидной железы.
Другой вероятный побочный эффект – это отек гортани, затрудняющий дыхание. В подобном случае в трахее инструментом выполняется временный канал для нормального дыхания (трахеостома).
Некоторые пациенты после операции сталкиваются с обезображиванием лица. Для запуска или поддержания важных функций организма (например, устранение дефекта трахеостомы)может быть рекомендована реконструктивная хирургия. Пациентам следует встретиться с различными членами медицинской команды для совместного принятия решения о лечении, понять процесс выздоровления. Программы, которые помогают пациентам приспосабливаться к изменениям своей внешности, могут пригодиться как до, так и после операции.
Лучевая терапия
Лучевая терапия (радиотерапия) — это применение ионизирующего излучения для лечения злокачественных новообразований. Схема лечения содержит в себе несколько циклов процедур, проводимых через определенные временные интервалы. Радиотерапия может назначаться как отдельно, так и совместно с хирургическим вмешательством.
Дистанционная лучевая терапия – наиболее оптимальный вариант. Подразумевает действие на опухоль излучения, исходящего из расположенного за пределами организма аппарата. Особый вид наружной дистанционной лучевой терапии — модулированная по интенсивности лучевая терапия (IMRT). IОна использует передовые технологии для точного направления лучей излучения на новообразование. IMRT значительно снижает вероятность поражения здоровых участков, минимизируя возможные негативные последствия.
Протонная терапия — разновидность наружной дистанционной лучевой терапии с применением протонов. Современная медицина практически не использует протонную терапию.
Брахитерапия – контактный метод радиотерапии с применением имплантов. По способу применения может быть ручной и автоматизированной.
Перед началом лечения пациенту необходимо посетить стоматолога-онколога для решения проблемы кариеса, так как радиотерапия может усугубить кариозный процесс. Также понадобятся рекомендации логопеда для дальнейшего восстановительного периода.
Другими неприятными последствиями радиотерапии могут стать покраснение, отек контактирующего с излучением участка кожи, потеря аппетита, стоматит (язвы на внутренней поверхности щек). Пациенты жалуются на сухость во рту, ломоту в костях, утомляемость. Большинство симптомов исчезают вскоре после окончания курса лечения. Если при лечении повреждены лимфатические узлы, может возникнуть отек мягких тканей (лимфадема).
Лучевая терапия может вызвать гипотиреоз, при котором щитовидная железа (расположенная на шее) замедляет выработку гормонов, отвечающих за бодрость и активность. В таком случае эндокринолог выписывает гормоно-заместительные препараты. Если радиотерапия проводится в области шеи, необходимо периодически контролировать функцию щитовидной железы.
Медикаментозная терапия
Системная терапия — это применение лекарственных препаратов для устранения онкопроцесса. Такие препараты вводятся в кровообращение для устранения раковых клеток. Схему системного лечения составляет химиотерапевт.
Схему системного лечения составляет химиотерапевт.
Обычные способы системного лечения – установка внутривенного (ВВ) катетера в вену или проглатывание (пероральный прием) препарата.
При раке головы и шеи применяются следующие виды медикаментозной терапии:
- Химиотерапия
- Таргетная терапия
- Иммунотерапия Схема медикаментозной терапии (количество препаратов) зависит от формы и тяжести онкопроцесса.
Химиотерапия
Применение препаратов, препятствующих развитию и делению опухолевых клеток называют химиотерапией.
Схема химиотерапии схожа с радиотерапией: несколько этапов за определенное количество времени. Количество принимаемых препаратов индивидуально и зависит от многих факторов.
Негативные последствия также сугубо индивидуальны. В первую очередь наблюдаются депрессивные состояния, выпадение волос, тошноту и рвоту.
Таргетная терапия
Каждая опухоль имеет свои особенности, мишени. Вид онкологического лечения, основанного на уничтожении целевых молекул (специфических генов) и ферментов, подпитывающих жизнедеятельность злокачественных клеток. Таргетная (целевая) терапия предотвращает гибель нормальных клеток и тканей, влияя только на таргетные молекулы.
Для выбора необходимого препарата врач проводит анализ на определение белковых фракций, генов новообразования. Ингибиторы EGFR. При раке головы и шеи может назначаться лечение, направленное на специфический опухолевый белок — рецептор эпидермального фактора роста (EGFR). Исследователи обнаружили, что препараты, которые блокируют EGFR, помогают остановить или замедлить рост некоторых видов рака головы и шеи.
Агностическая противоопухолевая терапия. Ларотрэктиниб (Витракви) — это сертифицированный препарат таргетной терапии, фокусирующийся на измененных генах NTRK. Ларотрэктиниб актуален для устранения метастазов, которые по разным причинам невозможно удалить оперативным вмешательством.
Иммунотерапия
Обязательный этап лечения, предназначенный для увеличения естественной сопротивляемости организма, укрепления иммунной системы.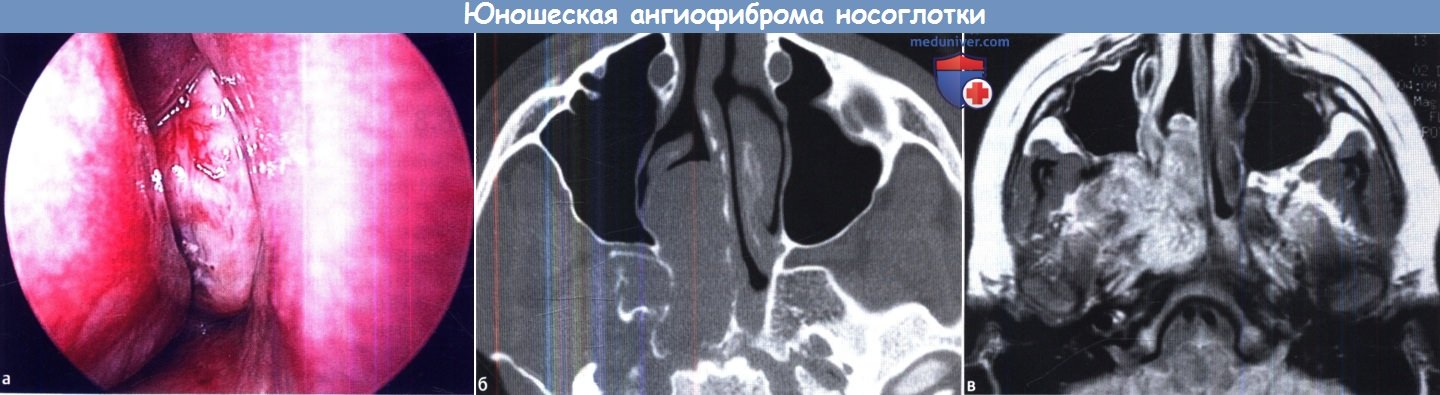 Используются вещества, вырабатываемые иммунными клетками или произведенные в лабораторных условиях.
Используются вещества, вырабатываемые иммунными клетками или произведенные в лабораторных условиях.
Пембролизумаб (Кейтруда) и ниволумаб (Опдиво) – новейшие эффективные иммунопрепараты для лечения рецидивирующего или метастатического плоскоклеточного рака головы и шеи. Пембролизумаб может назначаться отдельно, если опухоль экспрессирует определенное количество белка PD-L1. Или же его можно использовать в сочетании с химиотерапией независимо от уровня PD-L1, экспрессируемого опухолью. Ниволумаб можно использовать, если рак продолжал расти или распространяться во время лечения химиотерапией на основе платины.
Разные виды иммунотерапии могут спровоцировать различные негативные последствия. К общим побочным эффектам относятся кожные реакции, гриппоподобные симптомы, диарея и изменение веса.
Физические, психологические социальные последствия онкологии
Пациенты, принимающие онкопомощь неизбежно сталкиваются с физическими, психологическими нагрузками, а также с социальными последствиями. Управляет всеми этими факторами поддерживающая терапия (другое название – паллиативная).
Поддерживающая терапия очень разнообразна, подразумевая под собой медикаментозное лечение, изменение в питании, психологическую разгрузку.
Метастатический рак головы и шеи
Если процесс распространяется за пределы пораженного органа, врачи называют это метастатическим раком. В таком случае важно проконсультироваться у врача, имеющего опыт лечения подобных случаев. У врачей существуют разные взгляды на оптимальный стандартный план лечения. В качества варианта лечения можно также рассмотреть клинические исследования.
План лечения метастатического рака может сочетать в себе все вышеперечисленные лечебные методики онкологии.
Ремиссия и возможность выздоровления
Ремиссия – это состояние, при котором злокачественные клетки в организме и соответствующая симптоматика отсутствуют. Ремиссию также называют «отсутствием признаков заболевания».
Ремиссия бывает временной или постоянной.
Если болезнь возвращается после первичного цикла терапии, она называется рецидивирующим раком. Заболевание может повторно проявиться в том же месте (местный рецидив), рядом (регионарный рецидив) или в другом месте (отдаленный рецидив). В подобном случае необходимо провести серию свежих анализов, чтобы понять полную картину общего состояния здоровья.
Если лечение не помогает
Рак головы и шеи, к сожалению, не всегда излечим. Такой вариант событий называется прогрессирующим или терминальным раком.
Подобный диагноз является большим стрессом для больного и его близких. Потому так важно откровенно беседовать с командой медицинской помощи, объясняя свои ощущения, тревожность. Специальная подготовка и опыт помогают команде медиков оказывать поддержку больным и членам их семей. Чрезвычайно важно обеспечить человеку физический комфорт, свободу от боли и психоэмоциональную помощь.
Некоторые факты о раке полости рта
Что такое рак ротовой полости?
Рак полости рта – это атипичное разрастание клеток в тканях ротовой полости. Такие процессы могут затрагивать губы, язык, ротоглотку.
Существует два вида ракового поражения ротовой полости: рак, развивающийся непосредственно во рту, на слизистой оболочке щек, неба, языка, десен и губ (называемый раком полости рта и губ), и рак, развивающийся в глубине ротовой полости в области миндалин, именуемый раком ротоглотки.
Насколько распространен рак ротовой полости?
Согласно статистике раком ротовой полости ежегодно заболевают 13500 жителей России.
Каковы факторы риска развития рака ротовой полости?
Табакокурение в любом виде, жевание табака и систематическое употребление алкоголя – вот наиболее значимые факторы риска развития рака ротовой полости.
Раннее диагностированный рак ротовой полости, наследственная предрасположенность (наличие онкологического заболевания ротовой полости в роду) и возраст старше 40 лет также сильно увеличивают риск развития рака ротовой полости.
Носительство Вируса Папилломы Человека, (вируса, вызывающего рак шейки матки у женщин) известного как ВПЧ (HPV) 16 является серьезным фактором риска развития онкологического поражения ротовой полости, также как и носительство Вируса простого герпеса (HSV-1).
Еще одним фактором риска является кандидоз, а также солнечный свет (ультрафиолет).
25% пациентов имеющих рак ротовой полости не имели ни одного фактора риска развития онкологического заболевания.
Каков коэффициент выживаемости от рака ротовой полости?
Коэффициент выживаемости от рака полости рта удручающий, если он выявлен на запущенных стадиях. Ежегодно от рака ротовой полости умирает около 13000 человек в России, и лишь малая часть больных проживает пятилетний период.
Какие виды лечения рака ротовой полости существуют?
Раннее выявление рака ротовой полости может в значительной степени влиять на выбор того или иного метода лечения.
Лечение рака ротовой полости на ранней стадии обычно заключается в хирургическом удалении пораженных тканей. Если участок, пораженный опухолью уже велик, то хирургическим путем могут быть удалены большая доля языка, нижней челюсти или глотки.
Когда рак дает метастазы или распространяется на прочие органы пациента, лечащий врач может назначить проведение курса химиотерапии или облучения в дополнение к хирургической резекции пораженных тканей.
Как можно снизить риск развития рака ротовой полости?
Пожалуй, единственный эффективный способ снижение риска развития ракового поражениям ротовой полости – это избавиться от факторов риска: не курить, употреблять алкоголь в умеренных количествах.
Если пациент старше 40 лет, при этом курит и систематически употребляет алкоголь, то стоматолог обязан проводить визуальный осмотр ротовой полости такого пациента с применением дополнительного метода скрининга ViziLite Plus (ВизиЛайт Плюс) для более точного выявления возможных потенциально предраковых поражений слизистой оболочки рта и губ.
Если у пациента присутствуют несколько факторов риска, то необходима серьезная консультация у стоматолога на предмет возможного развития рака ротовой полости.
Статистические данные
- Более 13500 случаев заболевания раком полости рта и губ регистрируется в России ежегодно.
- Хотя рак полости рта не является самым распространенным среди прочих раков, коэффициент выживаемости обескураживает: 13500 человек умирает от рака ротовой полости в России ежегодно.
- Почти 37 человек в день в России узнают свой страшный диагноз – рак полости рта.
- 78% всех случаев заболевания раком полости рта и губ в России диагностируется на III-IV клинических стадиях, среди таких пациентов коэффициент выживаемости не превышает 5 лет. Если поставлен диагноз рака полости рта без метастазов, то 82% этих больных уверенно живут более 5 лет, а если уже есть метастазы, то лишь 28% таких больных живут более 5 лет.
- Исследования Онкоцентра JohnHopkins (США) и других медицинских учреждений показывают, что Вирус Папилломы Человека (HPV) 16, передаваемый половым путем (в том числе через поцелуи), является причиной возникновения рака полости рта и губ, преимущественно глотки и корня языка.
- Риск развития рака полости рта у мужчин в 6 — 8 раз превышает аналогичны риск у женщин.
- Лица в возрасте 65 лет и старше с наличием одного или нескольких факторов риска развития рака ротовой полости находятся в группе наивысшего риска.
- 25% жертв рака полости рта и губ не курят, не употребляют алкоголь систематически и не имеют прочих факторов риска.
- Выявление начальной стадии рака полости рта дает большой шанс излечить болезнь.
Рак носоглотки | Лечение опухолей носоглотки, онкологии на системе Кибер-Нож в Москве | «ОнкоСтоп»
Центр лучевой терапии «ОнкоСтоп» занимается лечением рака носоглотки. Мы практикуем индивидуальный подход к каждому пациенту и гарантируем высокую квалификацию и большой профессиональный опыт наших специалистов.
Нами используется радиохирургическая система КиберНож, доказавшая свою эффективность по всему миру.
Что касается стоимости наших услуг, то она вполне демократична и доступна каждому пациенту.
Рак носоглотки ДО и ПОСЛЕ лечения в центре «ОнкоСтоп»
Удаленная консультация
Причины рака носоглотки
Рак носоглотки представляет собой злокачественную опухоль, развивающуюся в верхней части глотки. Как правило, она представлена разнообразными формами плоскоклеточного рака. Места, где расположены скопления лимфоидной ткани, нередко служат очагом образования лимфом.
По статистике, раком носоглотки чаще всего страдают мужчины. Наиболее высокие показатели этого заболевания зарегистрированы в Европе и Индии. Главной причиной возникновения рака носоглотки является курение и употребление алкоголя, особенно в сочетании с курением. Две эти вредные привычки усиливают пагубное влияние друг друга на организм.
По результатам исследований, у курильщиков с многолетним стажем риск возникновения рака носоглотки повышается в 13 раз. Также на возможность возникновения опухоли влияет количество выкуриваемых сигарет в день и длительность стажа курения. Необходимо отметить, что количество употребляемого алкоголя также влияет на развитие рака носоглотки. Его риск увеличивается в 6 раз при употреблении 800 граммов крепкого алкоголя в неделю.
Вредное производство также способствует развитию рака носоглотки. Имеют значение газ и пыль, вдыхаемые занятыми, например, в целлюлозно-бумажном производстве, анилиновой, лакокрасочной промышленности и так далее.
Еще одним доказанным этиологическим фактором служит вирус папилломы человека, особенно его 16 тип. Он распространяется контактным путем и часто протекает без симптомов. Инфицированность вирусом папилломы человека увеличивает риск возникновения рака носоглотки в 30 раз.
На ранних этапах рак носоглотки протекает без видимых признаков, поэтому нередко пациенты часто обращаются к специалистам с запущенными формами заболевания.
Симптомы рака носоглотки
Симптомы рака носоглотки подразделяются на носовые, ушные и неврологические. К первым относятся:
- кровотечения;
- нарушение носового дыхания;
- боль в горле, не связанная с ОРЗ.
Ушными симптомами являются:
- ухудшение слуха;
- чувство заложенности;
- боль в ухе, не связанная с отитами.
Неврологическими симптомами являются:
- нарушение речи,
- нарушение глотания,
- парезы и параличи лицевых нервов.
Согласно классификации ВОЗ, существует 3 типа рака носоглотки:
- плоскоклеточная карцинома,
- неороговевающая карцинома,
- недифференцированная карцинома.
Первая стадия . Опухоль локализируется в пределах носоглотки, не поражая лимфоузлы и не образуя отдаленных метастазов.
Вторая стадия делится на 2 подстадии.
Подстадия 2 А. Опухоль поражает ротоглотку или полость носа, но не дает метастазов.
Подстадия 2 В. Опухоль прорастает в парафарингеальное пространство и дает метастазы до 6 сантиметров выше надключичной ямки с пораженной стороны.
Третья стадия. Опухоль прорастает в кости черепа и дает метастазы с двух сторон в шейных лимфоузлах. Пораженный ЛУ имеет размер, не превышающий 6 сантиметров.
Четвертая стадия рака носоглотки имеет 3 подстадии.
Подстадия 4 А. Опухоль прорастает в полость черепа, гортаноглотку, орбиту, подвисочную ямку, жевательные мышцы. В данный процесс могут быть вовлечены черепные нервы. Имеются метастазы в лимфоузлах с двух сторон шеи размером до 6 сантиметров.
Подстадия 4 В. Опухоль различных размеров с метастазами более 6 сантиметров либо находящимися в надключичной ямке.
Подстадия 4 С. Опухоль различных размеров, с различным количеством пораженных лимфоузлов и наличием отдаленных метастаз.
Диагностика рака носоглотки
К методам диагностики рака носоглотки относятся различные процедуры.
Пальпация и визуальный осмотр — ото-, рино-, фарингоскопия. В обязательном порядке проводится биопсия – забор материала из опухоли и увеличенных лимфоузлов. Если имеет место подозрение на непальпируемые метастазы, больному назначают УЗИ шеи.
Магнитно-резонансная томография, компьютерная томография с применением контрастного вещества. Для больных с высоким риском образования метастаз в легкие и печень проводится КТ печени и органов грудной клетки.
Сканирование костей проводится при распространенном опухолевом процессе.
Лечение рака носоглотки
На выбор метода лечения рака носоглотки влияет, прежде всего, степень распространенности опухоли. Больные с первой стадией и подстадией 2 А могут рассчитывать на исцеление лишь при помощи лучевой терапии, остальным показано химиолучевое лечение. Хирургическое вмешательство применяется крайне редко, в большинстве случаев, при рецидивах , или при неполной регрессии метастазов в лимфоузлах шеи.
Лучевая терапия проводится в суммарной очаговой дозе 70-80 Гр. Наряду с опухолью подвергаются облучению лимфоузлы шеи с двух сторон, а также заглоточные ЛУ. Лучевая терапия может дополняться брахитерапией до суммарной очаговой дозы 80 Гр., если не произошло достаточной регрессии опухоли на дозе 50-60 Гр. Подобное лечение может дать побочные эффекты — сухость во рту, боль в горле, стоматит.
Химиотерапия подразумевает использование различных препаратов, интервал между курсами лечения которыми составляет 4 недели. После химиотерапии возможны осложнения в виде слабости, тошноты, рвоты, облысения, иммунодефицита.
КиберНож
Во многих странах уже довольно давно используется радиохирургическая система КиберНож, позволяющая относительно безопасно проводить повторное облучение после неудач предыдущего лечения.
Система КиберНож – это альтернативный метод лечения для неоперабельных пациентов. Ее применение безболезненно, не требует длительного пребывания в стационаре и долгого восстановительного периода.
КиберНож обеспечивает непревзойденную точность лечения. Его излучение направляется на опухоль с субмиллиметровой точностью, не повреждая здоровые ткани организма пациента.
КиберНож подразумевает применение новейшего программного обеспечения, отслеживающего положение облучаемой опухоли, и дающего возможность максимально комфортного неинвазивного лечения, не требующего фиксации пациента, как например, при использовании Гамма-ножа.
В каждом отдельном случае стоимость определяется на основании показаний к лечению, необходимого количества фракций и плана лечения разработанного врачом радиационным онкологом и медицинским физиком.
Подробную информацию о лечении рака носоглотки на системе «КиберНож» Вы можете получить у наших специалистов центра лучевой терапии «ОнкоСтоп» по телефону +7 (495) 215-00-49
| Стоимость лечения | |
| Рак носоглотки (от 270 000) |
Точная стоимость лечения определяется только после консультации с врачом
продолжительность жизни, сколько живут с раком горла 4 стадии, можно ли вылечить рак горла 4 стадии
Раком горла в народе называют рак гортани — органа, который находится на передней поверхности шеи и соединяет глотку и трахею. Рак гортани занимает первое место среди опухолей головы и шеи. Чаще всего, от него страдают мужчины, но прогнозируется увеличение заболеваемости и среди женщин за счет все большего распространения курения.
Возможные первопричины рака гортани
Главным фактором риска, провоцирующим развитие рака горла, является курение. Уже ни для кого не секрет, что в дыму сигарет содержится более 50 видов канцерогенов, которые при контакте с клетками слизистой оболочки вызывают их злокачественную трансформацию. У людей, которые курят более 20 лет по 2 пачки в день, риск развития рака в 40-50 раз выше чем у тех, кто ограничивается хотя бы 10 сигаретами. Помимо этого, имеют значение следующие факторы:
- Злоупотребление алкоголем.
- Высокое содержание канцерогенных веществ во вдыхаемом воздухе — выхлопные газы, пары кислот и щелочей, асбест, пары бензина, промышленная пыль.
- Инфицирование онкогенными вирусами папилломы человека.
- Наличие предраковых изменений слизистой гортани — фибромы, кисты и др.
Эти факторы действуют синергично, т. е. усиливают действие друг друга. Наибольшая опасность развития рака горла — у курящих людей, занятых на вредном производстве.
Симптомы рака гортани
Клинические проявления рака горла будут зависеть от стадии процесса и расположения опухоли.
Рак вестибулярного отдела является наиболее частой. Процесс характеризуется высокой агрессивностью и ранним лимфогенным метастазированием, поскольку этот отдел гортани имеет хорошо развитую лимфатическую сеть. На ранних стадиях симптомы могут отсутствовать, но по мере прогрессирования опухоли присоединяется боль при глотании, першение в горле и чувство инородного тела. На 4 стадии, когда рак прорастает в соседние ткани, боль носит нестерпимый характер, отдает в ухо, шею или висок. Из-за больших размеров новообразования и боли при глотании, больной отказывается принимать пищу, что приводит к истощению.
Рак среднего отдела гортани является более благоприятным вариантом течения болезни, поскольку здесь нет обильной лимфатической сети и метастазирование наступает относительно редко. В этом отделе гортани располагаются голосовые связки и при возникновении на них опухоли развивается осиплость голоса вследствие их несмыкания. Симптом неуклонно нарастает, вплоть до афонии (невозможности голосообразования).
На 4 стадии заболевания опухоль прорастает за пределы голосовых связок и инфильтрирует голосовые мышцы и подлежащие ткани. При большом размере новообразования может возникнуть перекрытие гортани и затруднение дыхания. Также опухоль может распространяться на передние ткани горла, вызывая деформацию шеи.
Рак подскладочного отдела является крайне редкой локализацией. Он диагностируется менее чем в 2% от всех случаев рака гортани. Опухоль характеризуется эндофитным ростом, и может распространяться как вверх, на складочный отдел, так и вниз — на трахею. Из симптомов может наблюдаться осиплость голоса и затруднение дыхания.
При раке горла 4 стадии опухоль имеет большие размеры и распространяется на несколько отделов гортани и окружающие ткани. Для этой стадии характерны следующие симптомы:
- Дисфагия, вплоть до полной невозможности приема пищи.
- Осиплость голоса, вплоть до полной афонии.
- Нарушение дыхания из-за стеноза гортани.
- Сильная мучительная боль.
Диагностика рака гортани
Обнаружить рак горла можно посредством проведения ларингоскопии — осмотра полости гортани с помощью специального инструмента. В настоящее время отдается предпочтение гибкой ларингоскопии с помощью тонкой гибкой трубки, оснащенной волоконной оптикой. Эта процедура относительно легко переносится пациентами, при том что дает возможность полностью осмотреть гортань, в том числе и подскладочный отдел. Во время ларингоскопии берется материал для цитологического и гистологического исследования.
Для определения стадии заболевания проводятся дополнительные методы обследования с помощью КТ, МРТ и УЗИ. Такими способами устанавливается степень поражения гортани и распространения злокачественного новообразования на соседние структуры. А также определяются метастазы в лимфоузлы и отдаленные органы.
Стадийность ракового процесса
- 1 стадия — рак не выходит за пределы слизистой оболочки и подслизистой основы одного из отделов гортани.
- 2 стадия — опухоль прорастает всю толщину стенки, но не выходит за пределы одного отдела гортани.
- 3 стадия — рак распространяется на соседние отделы гортани. Имеются единичные метастазы в регионарные лимфоузлы.
- 4 стадия — рак выходит за пределы гортани, поражая соседние структуры и ткани, имеются множественные регионарные и отдаленные метастазы.
Куда метастазирует рак гортани
Рак гортани обычно метастазирует в лимфатические узлы шеи. Поэтому при наличии признаков поражения, производят шейную лимфодиссекцию с удалением жировой клетчатки и кровеносными сосудами. Эта операция не приводит к инвалидности, и пациент остается трудоспособным. Гематогенным путем опухоль метастазирует в легкие, печень и головной мозг.
Принципы лечения
Лечение рака горла 4 стадии носит паллиативный характер и в большей степени направлено на продление жизни пациента, облегчение боли и других тягостных симптомов.
Как правило, органосохраняющее лечение уже невозможно, поэтому необходимо удалять всю гортань. Это сложная инвалидизирующая операция, которая лишает человека возможности разговаривать, и дышать естественным путем — верхний отдел трахеи выводится на переднюю поверхность шеи в виде трахеостомы, куда вставляется металлическая канюля для обеспечения проведения воздуха. Однако при этом сохраняется жизнь больному, восстанавливается дыхательная функция и устраняются нестерпимые боли.
Через несколько недель после операции проводятся занятия с дефектологом, во время которых пациент учится разговаривать за счет воздуха, заглатываемого в желудок. Также есть вариант установки силиконовых голосовых протезов, но он редко реализуем на 4 стадии заболевания, поскольку удаляются не только связки, но и окружающие ткани.
Когда опухоль проросла за пределы гортани, встает вопрос о необходимости резекции соседних органов — глотки, языка или трахеи. Это еще более сложная и обширная операция, после которой пациент будет вынужден питаться через гастроназальный зонд. Как правило, такие ситуации возникают, когда больные долгое время отказываются от своевременного лечения и соглашаются на операцию только после развития серьезных симптомов.
Чтобы уменьшить объем опухоли и, соответственно, объем операции, рекомендуется выполнять комбинированное лечение в виде дооперационной лучевой терапии с последующей операцией.
Комбинированный подход при лечении распространенных опухолей больших размеров дает лучшие результаты, чем при отдельном применении лучевой терапии и хирургической операции. Он позволяет добиться радикальности лечения в 40-60% случаев, но его возможности не безграничны. Когда опухоль прорастает в крупные кровеносные сосуды или нервные стволы, хирургически удалить ее не представляется возможным, ввиду высокого риска осложнений. При неоперабельном раке назначается паллиативная лучевая терапия. Она уменьшит объем опухоли и облегчит болевой синдром.
Также в рамках паллиативного лечения на 4 стадии рака гортани применяется химиотерапия препаратами платины и фторхинолонами. Из таргетных препаратов может использоваться цетуксимаб.
Прогноз при раке гортани 4 стадии
Прогноз при раке 4 стадии неблагоприятный, результаты лечения неудовлетворительны. Пятилетняя выживаемость колеблется в пределах 15%, медиана жизни (время, за которое погибает половина пациентов) колеблется в пределах 9 мес.
Профилактика рака гортани
- Отказ от курения и употребления алкоголя.
- Применение индивидуальных средств защиты при работе с вредными парами и аэрозолями.
- Применение безопасных для человека технологий на вредных производствах.
- Своевременное обращение к врачу при развитии першения и комка в горле, осиплости голоса.
Рак полости рта и ротоглотки: Статистика
НА ЭТОЙ СТРАНИЦЕ: Вы найдете информацию о количестве людей, у которых ежегодно диагностируется рак полости рта и ротоглотки. Вы также прочтете общую информацию о том, как выжить при этих заболеваниях. Помните, что выживаемость зависит от нескольких факторов. Используйте меню для просмотра других страниц.
В этом году примерно у 54 010 взрослых (38 800 мужчин и 15 210 женщин) в Соединенных Штатах будет диагностирован рак полости рта и ротоглотки.
Заболеваемость этими видами рака у мужчин более чем в два раза выше, чем у женщин. Белые и чернокожие люди с одинаковой вероятностью будут диагностированы с ними. Рак полости рта и ротоглотки занимает восьмое место по распространенности среди мужчин. Средний возраст постановки диагноза — 62 года. Около 25% случаев заболевания встречается у людей моложе 55 лет, но эти виды рака редко встречаются у детей.
С 2008 по 2017 год заболеваемость раком полости рта и ротоглотки увеличивалась примерно на 1% в год (см. Факторы риска и профилактика) после снижения в течение нескольких лет.Большая часть этого увеличения произошла у неиспаноязычных белых людей и в группе рака ротоглотки, связанной с инфекцией ВПЧ.
По оценкам, в этом году произойдет 10 850 смертей (7620 мужчин и 3230 женщин) от рака полости рта и ротоглотки. После снижения на несколько десятилетий уровень смертности от этих двух болезней ежегодно с 2009 по 2018 год увеличивался на полпроцента.
Пятилетняя выживаемость показывает, какой процент людей живет не менее пяти лет после обнаружения рака.Процент означает количество из 100. Показатели выживаемости при раке полости рта и ротоглотки широко варьируются в зависимости от исходного местоположения и степени заболевания.
Общая 5-летняя выживаемость людей с раком полости рта или ротоглотки составляет 66%. Пятилетняя выживаемость для чернокожих составляет 50%, а для белых — 68%. Исследования показывают, что выживаемость выше у людей с раком, связанным с ВПЧ (см. Факторы риска).
Если рак диагностирован на ранней стадии, общая 5-летняя выживаемость для всех людей составляет 85%.На этом этапе диагностируется около 29% случаев рака полости рта и ротоглотки. Если рак распространился на окружающие ткани или органы и / или региональные лимфатические узлы, общая 5-летняя выживаемость составляет 67%. На этом этапе диагностируется почти половина случаев. Если рак распространился на отдаленную часть тела, общая 5-летняя выживаемость составляет 40%.
Важно помнить, что статистические данные о выживаемости людей с раком полости рта и ротоглотки являются приблизительными. Оценка основана на ежегодных данных, основанных на количестве людей с этими видами рака в Соединенных Штатах.Также каждые 5 лет специалисты измеряют статистику выживаемости. Таким образом, оценка может не отражать результаты более точной диагностики или лечения, доступного менее чем за 5 лет. Поговорите со своим врачом, если у вас есть какие-либо вопросы по поводу этой информации. Узнайте больше о статистике.
Статистика адаптирована из публикации Американского онкологического общества (ACS), Cancer Facts & Figures 2021, на веб-сайте ACS и программы по надзору, эпидемиологии и конечным результатам (SEER) Национального института рака (SEER) (источники по состоянию на февраль 2021 г.).
Следующий раздел в этом руководстве — Медицинские иллюстрации . Предлагает рисунки частей тела, часто поражаемых раком полости рта и ротоглотки. Используйте меню, чтобы выбрать другой раздел для чтения в этом руководстве.
Выживание | Рак рта | Исследования рака, Великобритания
Выживание зависит от множества различных факторов. Так что никто не может сказать вам точно, сколько вы проживете. Зависит от вашего:
- тип и стадия рака
- уровень физической подготовки
- предыдущее лечение
Это общая статистика, основанная на больших группах пациентов.Помните, они не могут сказать вам, что произойдет в вашем конкретном случае.
Ваш врач может дать вам дополнительную информацию о вашем собственном прогнозе. Вы также можете поговорить об этом с медсестрами отдела исследования рака Великобритании по бесплатному телефону 0808 800 4040 с 9 до 17 часов с понедельника по пятницу.
Выживание по этапам
В Великобритании нет доступных статистических данных по различным стадиям рака ротовой полости или конкретным видам лечения.
Следующие статистические данные взяты из Национальной сети онкологической разведки (NCIN).Они предназначены для людей с диагнозом «рак ротовой полости» в Англии и Уэльсе в период с 2004 по 2011 годы. Цифры относятся к выживаемости в течение 1 и 3 лет. На данный момент нет статистических данных о 5-летней выживаемости.
Для мужчин с диагнозом «рак полости рта (ротовой полости) 1 и 2 стадии»:
- более 90 из 100 (более 90%) выживают после рака в течение 1 года или более
- около 80 из 100 (около 80%) выживают после рака в течение 3 и более лет
Для женщин с диагнозом «рак ротовой полости 1 и 2 стадии»:
- около 95 из 100 (около 95%) выживают после рака в течение 1 года или более
- более 80 из 100 (более 80%) выживают после рака в течение 3 и более лет
Для мужчин с диагнозом рака полости рта 3 и 4 стадии:
- почти 70 из 100 (почти 70%) выживают после рака в течение года или более
- почти 50 из 100 (почти 50%) выживают после рака в течение 3 и более лет
Для женщин с диагнозом рака 3 или 4 стадии:
- Около 65 из 100 (около 65%) выживают после рака в течение года или более
- почти 50 из 100 (почти 50%) выживают после рака в течение 3 и более лет
Рак полости рта: последние тенденции выживаемости
Национальная сеть онкологической разведки, 2013 г.
Эти статистические данные относятся к относительной выживаемости.При относительной выживаемости учитывается, что некоторые люди умрут не от рака, а от других причин. Это дает более точную картину выживаемости при раке.
Выживаемость по локализации опухоли
Выживаемость при раке полости рта и ротоглотки зависит от того, где находится рак.
Эти статистические данные относятся к людям, диагностированным в Англии в период с 2009 по 2013 год.
При раке ротовой полости:
- почти 80 из 100 человек (почти 80%) переживают рак в течение 1 года или более после постановки диагноза
- около 55 из 100 человек (около 55%) выживают после рака в течение 5 лет или более после постановки диагноза
- 45 из 100 человек (45%) выживают после рака в течение 10 и более лет после постановки диагноза
При раке ротоглотки
- Около 85 из 100 (около 85%) выживают после рака в течение года или более после постановки диагноза
- около 65 из 100 (около 65%) выживают после рака в течение 5 или более лет после постановки диагноза
- Почти 60 из 100 (почти 60%) выживают после рака в течение 10 и более лет после постановки диагноза
Ротоглотка — это часть горла сразу за ртом
При раке языка:
- около 80 из 100 (около 80%) выживают после рака в течение года или более после постановки диагноза
- 60 из 100 (60%) выживают после рака в течение 5 и более лет после постановки диагноза
- Около 50 из 100 (около 50%) выживают после рака в течение 10 или более лет после постановки диагноза
Чистая выживаемость и вероятность смерти от рака от редких видов рака.
P Muller и другие
Cancer Research UK Cancer Survival Group, Лондонская школа гигиены и тропической медицины
(по состоянию на июль 2016 г.)
Эти статистические данные относятся к чистой выживаемости. Чистая выживаемость оценивает количество людей, переживших рак, а не количество людей, у которых диагностирован рак, которые еще живы. Другими словами, это выживаемость больных раком с учетом того, что некоторые люди умерли бы от других причин, если бы у них не было рака.
Что влияет на выживание
Ваш результат зависит от стадии рака, когда он был диагностирован. Это означает, насколько он велик и распространился ли он.
Перспективы рака ротовой полости также зависят от того, какая часть ротовой полости или ротоглотки поражена.
Некоторые виды рака ротоглотки вызываются вирусом папилломы человека (ВПЧ). Рак ротоглотки, содержащий ВПЧ, как правило, лучше, чем рак ротоглотки, не содержащий ВПЧ.
Об этой статистике
Термины 1 год выживания и 5 лет не означают, что вы проживете только 1 или 5 лет.Некоторые люди живут намного дольше 5 лет.
Дополнительная статистика
Более подробную статистику по раку полости рта и ротоглотки можно найти в нашем разделе «Статистика рака».
Факторы воздействия на 5-летнюю выживаемость пациентов, оперированных с раком полости рта
Резюме
Цели
Целью данного исследования является анализ клинических факторов воздействия на выживаемость и получение основных клинических данных для диагностики рак полости рта, для определения плана лечения с долгосрочным выживанием пациентов с раком полости рта.
Материалы и методы
Путем ретроспективного обзора медицинских карт были проанализированы факторы долгосрочной выживаемости. Тридцать семь пациентов из базы данных пациентов с раком полости рта, пролеченных в отделении челюстно-лицевой хирургии в больнице Пусанского национального университета в период с марта 1998 года по март 2008 года, были отобраны в рамках критериев исследования и находились под наблюдением более 5 годы. Анализируемыми факторами были пол, возраст, употребление алкоголя, курение, локализация первичной опухоли, тип рака, стадия TNM, рецидив пораженной области и метастазирование шейного лимфатического узла.5-летняя выживаемость по импакт-факторам была рассчитана статистически с использованием метода Каплана-Мейера.
Результаты
По классификации клинического TNM на 1-м посещении, было 11 (29,7%) случаев для стадии I, 11 (29,7%) случаев для стадии II, 3 (8,1%) случаев для стадии III и 12 ( 32,5%) случаев для IV стадии. 5-летняя выживаемость пациентов с раком полости рта после операции составила 75,7%, 5-летняя выживаемость, связанная с патологической стадией TNM, составила: I стадия 90,0%, II стадия 81.8%, стадия III 100% и стадия IV 45,5%; в котором достоверно наблюдалась разница в выживаемости на каждой стадии. Рецидив шейного лимфатического узла был значительным фактором влияния на выживаемость, потому что выживаемость в рецидивирующих случаях составляла только 30,0%. За время наблюдения было 15 (40,5%) пациентов с подтвержденным рецидивом, а 5-летняя выживаемость этих пациентов снизилась на 46,7%.
Заключение
Классификация клинико-патологической стадии TNM, локальный рецидив после операции и метастазирование шейного лимфатического узла после операции были проанализированы как 3 наиболее значимых фактора.
Ключевые слова: Рак полости рта, Выживаемость, Метастазы новообразования, Рецидив, классификация TNM
I. Введение
Учитывая стареющее общество с увеличенной продолжительностью жизни, процент людей с онкологическими заболеваниями увеличивается и составляет 5% от всех опухолей. возникают в области головы и шеи; половина из этих 5% влияет на полость рта. С 2000-х годов было зарегистрировано около 615 000 случаев рака полости рта, 300 000 из которых, как известно, относятся к плоскоклеточной карциноме полости рта1.Согласно отечественным исследованиям, около 2800 пациентов — или примерно 1,6% от общего числа онкологических больных — ежегодно диагностируются злокачественные опухоли в области ротовой полости и челюстно-лицевой области2.
Несмотря на развитие диагностического скринингового оборудования, операционных методов и послеоперационного ухода, имеется большое количество пациентов с запущенной стадией рака полости рта, а также высокая смертность. Из-за этой прискорбной ситуации, которая сохраняется до сих пор, продолжаются исследования и отчеты о решающих факторах, которые могут улучшить выживаемость пациентов с раком полости рта.Среди факторов, которые следует учитывать, — возраст, пол, стадия диагноза, первичный сайт и гистопатологическая классификация и т. Д. 3-6. Такие фундаментальные данные исследований необходимы, особенно для пациентов, которые еще могут быть излечены. Однако обратите внимание, что существует нехватка эпидемиологических исследований, проводимых внутри страны для пятилетнего последующего исследования, связанного с факторами, влияющими на выживаемость пациента.
В этом исследовании, путем анализа клинически важных факторов, связанных с долгосрочным выживанием пациентов с раком полости рта, и оценки этих факторов полученные базовые данные будут полезны при разработке планов диагностики и лечения пациентов с раком полости рта.
II. Материалы и методы
1. Пациенты
В этом исследовании участвовали пациенты с диагнозом «рак полости рта», подвергшиеся радикальной резекции поражения в отделении челюстно-лицевой хирургии больницы Пусанского национального университета в период с марта 1998 г. по март 2008 г. Критерии включения были следующим образом:
1) Пациент подтвердил наличие рака полости рта с помощью биопсии.
2) Пациент, у которого при первом диагнозе не было метастазов.
3) Пациент, который не лечился от очага первичной опухоли в других больницах.
4) Пациент без каких-либо других злокачественных опухолей в анамнезе.
5) Пациенты, оперированные одной хирургической бригадой с аналогичным протоколом лечения.
6) Пациент, идентифицированный как выживший после постановки диагноза на протяжении 5 лет.
Пациенты были опрошены, и их медицинские карты были проанализированы. С пациентами, которые больше не посещали врача через 5 лет, звонили, чтобы подтвердить их выживаемость; после подтверждения их выживаемости были проведены дополнительные клинические и радиологические исследования для определения факторов, влияющих на долгосрочную выживаемость.
В период наблюдения стратегия лечения нашего отделения может быть изменена на другие в зависимости от общего состояния пациента. Обратите внимание, однако, что химиотерапия перед операцией проводилась в течение 2 циклов в плановом порядке с последующим радикальным широким иссечением и рассечением шеи при необходимости. Аналогичным образом, в зависимости от гистопатологических результатов может потребоваться химиотерапия и лучевая терапия. () Путем анализа этих записей мы попытались проанализировать результаты лечения и детально оценить проблемы всех пациентов с раком полости рта.Кроме того, в ходе длительного наблюдения был проведен анализ факторов, влияющих на 5-летнюю выживаемость пациентов с раком полости рта.
Таблица 1
Протокол лечения злокачественных новообразований головы и шеи в отделении челюстно-лицевой хирургии больницы Пусанского национального университета
2. Методы
Последние 37 пациентов были проанализированы по полу, возрасту, степени употребления алкоголя. статус курения, первичная локализация, тип рака, гистопатологическая степень, стадия, расслоение шеи, комбинированная терапия, рецидив и метастазирование в шейные лимфатические узлы; Затем мы проанализировали, как эти факторы повлияли на 5-летнюю выживаемость пациента для корреляции.
Стадия TNM была классифицирована в соответствии с классификацией TNM для губ и полости рта Американского Объединенного комитета по раку (7-е издание). Каждый из влияющих факторов сравнивался и анализировался, составляя отдельные таблицы для каждого фактора. Рассматривая состояние пациентов с момента окончания последующего наблюдения, предполагалось, что выживаемость была, когда пациент был жив в течение 5 лет с момента постановки диагноза; если наблюдение было приостановлено или пациент был выписан по другим причинам, такие данные считались цензурированными.
В качестве ретроспективного клинического исследования это исследование было одобрено институциональным наблюдательным советом стоматологической больницы Пусанского национального университета (IRB № PNUDH-2013-007).
III. Результаты
1. Обзор клинических данных
В этом отчете обобщены общие клинические данные, история болезни, клиническое обследование и визуальное обследование 37 пациентов. Что касается курения, мы записали среднее количество выкуриваемых сигарет за день; для питья привычным считалось употребление более 0,5 бутылки (корейская водка, соджу) в день.В исследовании 13 пациентов были заядлыми курильщиками, а 17 — постоянными пьяницами.
Все пациенты, включенные в это исследование, получили широкое иссечение первичного участка и рассечение шеи. Типы проводимой диссекции шеи включали надподъязычную диссекцию шеи, модифицированную радикальную диссекцию шеи (mRND) и RND.
В этой статье 19 случаев относились к предоперационной химиотерапии, 17 — к послеоперационной химиотерапии и 7 — к лучевой терапии после операции в тех случаях, в том числе 2 пациента, которые последовательно получали оба вида терапии, а также 2 пациента, которые получали одновременная химиолучевая терапия.()
Таблица 2
1) Пол и возраст
Из 37 пациентов 24 (64,8%) были мужчинами и 13 (35,2%) женщинами. Пациенты до 40 лет составили 29,7%, старше 50 лет — 70,3%. Средний возраст составлял 55 лет, от 26 до 81 года. ()
Таблица 3
2) Места первичной опухоли
Раком ротовой полости больше всего поражались язык и альвеолярный гребень нижней челюсти — 11 (29,7%) случаев каждый, за которыми следуют альвеолярный гребень верхней челюсти и неба с 7 (18.9%) случаев, дно ротовой полости (FOM) с 4 (10,9%) случаями и слизистая оболочка щеки / ретромолярный треугольник с 3 (8,1%) случаями. ()
Таблица 4
3) Гистологические типы рака
Для распределения гистологии опухолей было 30 (81,1%) случаев плоскоклеточного рака (SCC), 3 (8,1%) случая аденоцистной карциномы, 1 (2,7%) случай базальноклеточного рака, 2 (5,4%) случаев меланомы и 1 (2,7%) случая остеосаркомы. ()
Таблица 5
Гистопатологический диагноз
4) стадия TNM
В клинической классификации TNM (cTNM) 11 (29.Было обнаружено, что 7% случаев относятся к стадии I, 11 (29,7%), стадии II, 3 (8,1%), стадии III и 12 (32,5%), стадии IV. Анализируя результаты послеоперационного гистопатологического образца, в классификации патологического TNM (pTNM) 11 (29,7%) случаев приходились на стадию I, 11 (29,7%), на стадию II, 4 (10,8%), на стадию III. и 11 (29,8%) для стадии IV. ()
Таблица 6
Клиническая и патологическая классификация TNM у пациентов
5) Факторы, связанные с цервикальными метастазами
Процент взаимного соответствия между cTNM и pTNM составил 83.8%. Случаев, диагностированных как метастаз в шейных лимфатических узлах (pN +), было 11 (29,7%), из них 10 (27,1%) случаев рецидива метастазов в шейные лимфатические узлы в течение 5 лет. Шейный лимфатический узел, диагностированный как клинически отрицательный (cN0), был положительным в патологическом результате (pN +) у пациентов, у которых были выявлены скрытые метастазы в лимфоузлы (3 случая). Было 15 (40,5%) пациентов с раком полости рта, у которых возник рецидив в первичном очаге или метастаз в шейных лимфатических узлах, 11 из которых подверглись резекции или расслоению шеи в области рецидива или поражению шейного отдела.У остальных 7 (18,9%) пациентов были обнаружены метастазы в легкое и основание черепа в течение 5 лет. (,)
6) Гистологическая дифференциация плоскоклеточного рака
Пациенты с SCC были классифицированы в соответствии с гистологической дифференциацией. образца. Из всех пациентов пациенты с диагнозом ПКР с помощью биопсии (n = 30) были проанализированы по категориям распространенности и выживаемости в соответствии с дифференциацией. По хорошо дифференцированному типу было 19 (63,4%) случаев, 7 (23.3%) случаев для умеренно дифференцированного типа и 4 (13,3%) случаев для низкодифференцированного типа в соответствии с гистологической дифференциацией. ()
Таблица 7
Распределение гистопатологической дифференцировки SCC
7) Первичная резекция опухоли, рассечение шеи , и методы реконструкции
У всех проанализированных пациентов в первую очередь было выполнено широкое иссечение первичного участка. Из всех пациентов, у которых, по-видимому, не было метастазов (cN0), включая пациентов, у которых клинически имелись метастазы в шейных лимфатических узлах, пациентам с раком языка T2-4 и T1 было выполнено плановое или терапевтическое рассечение шеи.При восстановлении дефекта использовались различные методы реконструкции. Методы реконструкции, использованные в этом исследовании, включают шейный лоскут, кожно-мышечный лоскут большой грудной мышцы (7 случаев), свободный лоскут лучевой кости (8 случаев), свободный лоскут малоберцовой кости (2 случая), лоскут широчайшей мышцы спины (1 случай) и глубокую огибающую подвздошную артерию. клапан (1 случай).
2. Анализ выживаемости
1) 5-летняя выживаемость
Выживаемость 37 пациентов с раком полости рта составила 75,7%. ()
2) Выживаемость согласно стадии
Выживаемость согласно pTNM показан в (стадия I: 90.0%; II стадия: 81,8%; III стадия: 100,0%; IV этап: 45,5%).
Уровень выживаемости, зависящий от стадии (логарифмический тест: P = 0,027).
3) Выживаемость согласно гистологической дифференциации
Выживаемость согласно гистологической дифференциации среди пациентов с диагнозом SCC составила 94,7% для хорошо дифференцированного типа, 57,1% для умеренно дифференцированного типа и 25,0% для низкодифференцированного типа . ()
Гистопатологическая дифференцировка-специфическая выживаемость при плоскоклеточной карциноме (логарифмический критерий: P = 0.000).
4) Выживаемость в соответствии с рецидивом первичного очага, метастазами в шейных лимфатических узлах
После операции у 15 (40,5%) пациентов наблюдался рецидив в первичном очаге или метастаз в шейных лимфатических узлах. Из этих 15 пациентов 7 (46,7%) были живы. Если рассматривать эти факторы как независимые переменные 5-летней выживаемости, частота рецидивов первичной опухоли и метастазов в шейных лимфатических узлах после операции составила 60,0% и 30,0% соответственно.Эти результаты показали значительно более низкий процент по сравнению с 86,4% и 92,6% в группе, не подвергшейся воздействию, соответственно. (,)
Коэффициент выживаемости, специфичный для рецидива (логарифмический тест: P = 0,097).
Выживаемость, специфичная для метастазов в шейных лимфоузлах (логарифмический тест: P = 0,000).
Среди 10 пациентов, у которых был рецидив шейного лимфатического узла, только 3 из них выжили в течение 5 лет.
5) Логистический регрессионный тест между факторами и выживаемостью
В этом исследовании среди пациентов с метастазами в другие органы ни один пациент не выжил более 5 лет.() В настоящее время не существует радикальных методов лечения метастатических поражений, вызванных раком полости рта, и выбор лечения этих неизлечимо больных пациентов представляет собой клинические испытания или паллиативную терапию7. Основываясь на этом, мы статистически проанализировали другие факторы, исследованные в этом исследовании, и использовали их в качестве шкалы, чтобы выяснить, как каждый из факторов влияет на снижение выживаемости. Мы обнаружили значительную взаимосвязь с послеоперационными метастазами в шейных лимфатических узлах. ()
Графики выживаемости, специфичные для отдаленных метастазов (логарифмический тест: P = 0.000).
Таблица 8
Результаты бинарного логистического регрессионного анализа корреляции между факторами и выживаемостью
IV. Обсуждение
Из 37 пациентов с раком полости рта, включенных в это исследование, 23 (62,2%) были мужчинами и 14 (37,8%) женщинами. Это представляет собой соотношение 1,6: 1, демонстрируя сопоставимый результат с процентным соотношением рака полости рта у мужчин в США, равным 60,2%, а Funk et al.8 и Kim et al.9 сообщили о процентном соотношении 65,7% мужчин и 34,3% женщин.Однако в этом исследовании пол не был связан с 5-летней выживаемостью.
В этом исследовании 13 (35,1%) пациентов были заядлыми курильщиками и 17 (46,0%) постоянно пили, что показывает более низкий процент по сравнению с предыдущими отчетами (57-65%) 9-14. По всей видимости, это было связано с предвзятостью пациентов в интервью во время госпитализации; отсюда и трудность выявления в этом отчете того факта, что курение и алкоголь могут оказывать значительное влияние на выживаемость.
Согласно исследованиям Кроллса и Хоффмана15, рак ротовой полости часто поражает людей в возрасте от 40 до 70 лет.Согласно отчету Кима и др .9, мужчины в возрасте 70 лет и женщины в возрасте 60 лет в основном страдали от рака полости рта. В этом исследовании из всех возрастных групп пациентов с раком полости рта больше всего пострадали пациенты в возрасте от 50 (в среднем 11 пациентов в возрасте от 50 до 50 лет) — со средним возрастом 55,5 лет (± 13,9). Было 11 (29,7%) пациентов моложе 40 лет и 26 (70,3%) пациентов старше 50 лет, что привело к большему количеству пациентов старшего возраста. Отметим, однако, что в этих случаях наблюдались и 26- и 28-летние пациенты с раком языка.Это форма рака полости рта, которая может поражать даже более здоровую и более молодую возрастную группу. Из 37 пациентов самым старым пациентом был 81-летний мужчина, у которого не было рецидивов метастазов в первичном очаге или шейных лимфатических узлах через год после операции, но он скончался из-за общей слабости и респираторного заболевания; таким образом, этот случай был обработан как цензурированные данные. Не было значительных изменений выживаемости пациентов с раком полости рта по возрастным группам; как факторы, которые могут повлиять на 5-летнюю выживаемость среди пожилых людей и пациентов с системными заболеваниями, однако ограничения в выборе метода лечения из-за общего состояния, возраста, связанных с пациентом осложнений и смертей, вызванных сопутствующими заболеваниями. можно рассматривать16.
Основываясь на гистопатологическом исследовании образца после операции, на ПКР приходилось более 80% результатов, показывая аналогичное соотношение общеизвестных опухолей ротовой полости17. В этом исследовании выживаемость пациентов с раком, возникшим на FOM, была самой низкой — 50,0% в течение 5 лет. Это, по-видимому, связано с трудностями с точки зрения хирургического доступа и склонностью к метастазированию в шейные лимфатические узлы с обеих сторон; Учитывая эти факты, расположение первичного поражения можно рассматривать как опасный фактор, который может повлиять на выживаемость.
Согласно Shah и Patel17, соотношение стадий TNM у пациентов с раком полости рта составляло 37% (стадия I), 36% (стадия II), 18% (стадия III) и 9% (стадия IV). В отечественных исследованиях Ким и др.9 сообщили, что из 180 пациентов с раком полости рта 31 (17,2%) случай относились к стадии I, 24 (13%), к стадии II, 14 (7,8%), к стадии III, 111 (61,7%) — к IV стадии. Было сочтено, что различие в распространенности между типами стадий связано с местом жительства, финансовым положением и культурными различиями пациентов; отсюда необходимость дополнительных эпидемиологических исследований экономической активности или уровня образования пациента, а также политики в области гигиены полости рта по месту жительства.Выявив причину высокого уровня распространенности пациентов на ранних стадиях (стадия I, II) и терминальной стадии (стадия IV) в этом исследовании, пациенты с диагнозом рака полости рта на более ранних стадиях в основном были переведены в нашу больницу, потому что это может быть выяснили случайно, когда они посещают местную клинику из-за различных основных жалоб, и другие, посещая врачей больницы после того, как они страдали от отека и боли, поскольку рак уже прогрессировал.
Соответствие cTNM и pTNM было 83.8%, касающихся надежности исследований магнитно-резонансной томографии (МРТ), компьютерной томографии (КТ) и позитронно-эмиссионной томографии-КТ (ПЭТ-КТ) перед операцией для оценки первичного очага, метастазов в шейке матки и отдаленных метастазов. В этом исследовании ПЭТ-КТ в основном использовалась для оценки метастазов в шейных лимфатических узлах или для последующего наблюдения перед операцией.
Согласно отчетам Гошена и др. 18, ПЭТ-КТ имеет точность 88%, чувствительность 100% и специфичность 77%.Когда дело дошло до отрицательной прогностической ценности пациентов с метастазами, оказалось, что она составляет 100%. В исследовании Nahmias et al .29, 192 из 1678 лимфатических узлов имели гистопатологические метастазы, при этом чувствительность и специфичность к N0, как сообщается, составили 79% и 82% соответственно; к N + — 95% и 25% соответственно. Таким образом, чувствительность и специфичность метастазов в шейке матки составили 48% и 99% соответственно. Кроме того, ПЭТ-КТ обеспечивает комфорт пациентов при выборе места облучения для лучевой терапии20.
В этом исследовании участвовали 3 пациента с признаками скрытых метастазов в шейные лимфоузлы, при этом 4 пациента дали положительный результат (cN +) при клиническом обследовании, но патологически отрицательный (pN0) на шейный лимфатический узел. При этом чувствительность исследования шейных лимфатических узлов перед операцией составила 76,9%, а специфичность — 83,3%. От cN0 потенциальные методы диагностики метастазов в шейных лимфатических узлах (пальпация, рентген, цитология тонкоигольной аспирации) зависят от количества удаленных лимфатических узлов и гистологических методов исследования лимфатических узлов21.Поэтому, когда мы выполняем операцию и лечение пациента с раком полости рта, мы должны рассматривать ПЭТ-КТ или другие исследования, осознавая необходимость рассечения шеи при метастазах скрытых лимфатических узлов, как одно из осложнений операции. Точно так же очень важны клиническое наблюдение и тщательный анализ клинических данных и диагностическое обследование в надлежащее время после операции.
Чо и Ким22 сообщили о 5-летней выживаемости 54% среди пациентов с раком полости рта в период с 1991 по 1996 год.Ким и др.9 обнаружили, что 5-летняя выживаемость пациентов с раком полости рта с 1999 по 2006 год составила 57,7%. Однако из отчета Lee et al.23, 5-летняя выживаемость пациентов с раком полости рта составила 63,2%. В этом исследовании были взяты записи пациентов, перенесших операции в период с 1998 по 2008 год, и 5-летняя выживаемость этих пациентов составила 75,7%, что было значительно выше, чем в предыдущих исследованиях.
Сравнивая соотношение пациентов на стадии IV, Lee et al.23 сообщили о 57.1%, Чо и Ким22, 61,3%, и Ким и др. 9, 61,7%. Обратите внимание, однако, что доля этого исследования была ниже (35,2%). Этиология, по-видимому, основана на других исследованиях пациентов на стадии IV, которые не подвергались хирургическому вмешательству, но получали паллиативную терапию. Однако этого нельзя сказать об этом исследовании.
Наш необычный результат III стадии (100%) для этого исследования может быть отнесен на счет небольшого количества пациентов на стадии III. Небольшое количество людей в результатах стадии III также можно увидеть в других исследованиях9,22-24.Чтобы угадать причину, ситуация, когда первичная карцинома (T3) не вызывает метастазирования в шейные лимфатические узлы, и ситуация, когда карцинома менее 4 см (T1, T2) вызывает метастазирование в шейные лимфатические узлы, маловероятна. Более того, если были пациенты T1 и T2, у которых клинически не было клинических метастазов в шейку матки, они могли иметь метастазы в шейных лимфатических узлах; если пациенты на других стадиях действительно относились к стадии III, то этим можно объяснить низкий процент стадии III.
Согласно 5-летней выживаемости в случае метастазов в шейные лимфатические узлы, в этом исследовании значимая разница 62.6% было отмечено между двумя группами; в исследовании Koo et al.25 были получены аналогичные результаты 43% и 79%. Обратите внимание, однако, что лечение клинически отрицательных шейных лимфатических узлов все еще остается спорным. Тем не менее, перед операцией важно учитывать возможность метастазирования в шейку матки. Согласно исследованию Zbären и др. 26, 20% пациентов с метастазами в шейные лимфатические узлы, которые являются pN0 при раке полости рта и при патологическом обследовании, имеют потенциал для метастазирования или рецидива.С другой стороны, О’Брайен и др. 27 заявили, что вероятность этого может составлять 30%. Аналогичным образом, Keski-Säntti et al.28 сообщили о низкой 5-летней выживаемости, составляющей 33%, для пациентов, у которых во время наблюдения подтверждены метастазы в шейку матки и которые перенесли спасительную операцию.
Таким образом, 5-летняя выживаемость больных раком полости рта с метастазами в шейные лимфатические узлы является очень важным фактором прогноза; принимая во внимание возможность метастазирования шейных лимфатических узлов, и даже если это случай cN0, следует рассмотреть возможность планирования ипсилатерального или двустороннего (кончик языка, FOM,> T3, над средней линией первичной опухоли) рассечения шеи25,29-31 .
В этом исследовании участвовали 15 (40,5%) пациентов с рецидивом первичной опухоли или метастазами в шейных лимфатических узлах, 7 из которых пережили вторую операцию. 5-летняя выживаемость при рецидиве составила 46,7%; Однако если смотреть на случаи метастазов в шейные лимфатические узлы отдельно, то 5-летняя выживаемость была ниже 30%. После операции, если рецидивирующая опухоль разрастается глубже в первичном очаге или в области шейки матки, она обычно располагается в месте, которое трудно удалить; отсюда сложность выполнения резекции из-за окружающих анатомических структур.В результате, даже с опцией спасательной хирургии, как упоминалось ранее, предполагается, что выживаемость станет еще ниже25,28,29. Более того, метастазирование в шейные лимфатические узлы само по себе предполагает возможность отдаленных метастазов, что, по-видимому, приводит к более низкой 5-летней выживаемости.
Как было установлено в этом исследовании, рак полости рта также имеет высокую вероятность рецидива, и в этом случае прогноз плохой; отсюда важность постоянного наблюдения. Последующее наблюдение в этом исследовании проводилось ежемесячно в течение 6 месяцев после операции и один раз каждые 3 месяца от 6 месяцев до 1 года после операции; от 1 года до 5 лет, только при наличии отзыва и по требованию пациента ПЭТ-КТ-исследование использовалось для тщательной проверки на предмет рецидива, метастазов в шейных лимфатических узлах и отдаленных метастазов.Согласно рекомендациям Национальной комплексной онкологической сети, касающимся рака головы и шеи, во время последующего наблюдения необходимо учитывать рецидив, риск вторичной первичной опухоли, методы лечения и осложнения30,32. Нам необходимо тщательно изучить клинические симптомы и данные пациента и, при необходимости, выполнить рентгенологическое исследование. Аналогичным образом, в руководстве предлагается, чтобы обследования КТ, МРТ и ПЭТ-КТ — с использованием радиологии и контрастирования — проводились каждый год после операции для пациентов из группы высокого риска (1) с двумя или более метастазами в лимфатические узлы (2), при этом пораженный размер отдельного лимфатического узла больше 3 см, (3) с экстравазацией распространения узлового поражения и (4) с историей предыдущего рецидива30.
Преимущество этого исследования заключается в том, что оно контролировало переменные, отбирая пациентов с раком полости рта, которые получали лечение в одной и той же хирургической бригаде из одной лаборатории. Однако из-за его ограничений для эпидемиологических исследований было рассмотрено только небольшое количество целевой группы. В будущем необходимо собрать больше данных о пациентах, чтобы определить выживаемость каждого пациента по методу лечения и проанализировать, как с учетом того же первичного очага и статуса метастазов в шейных лимфатических узлах можно использовать комбинированный метод лечения, такой как химиотерапия и лучевая терапия, проводимая с резекцией первичной опухоли — влияет на выживаемость пациента.
V. Заключение
Всего 37 пациентов с раком полости рта были проанализированы на основе пола, возраста, статуса употребления алкоголя, статуса курения, первичного очага, типа рака, стадии TNM, расслоения шеи, комбинированного лечения и пораженной области и шейной лимфатической системы метастазирование узлов, включая то, как эти факторы повлияли на 5-летнюю выживаемость каждого из пациентов.
1. 5-летняя выживаемость больных раком полости рта составила 75,68%; 5-летняя выживаемость, связанная с патологической стадией TNM, составила 90.0% на стадии I, 81,8% на стадии II, 100% на стадии III и 45,5% на стадии IV. Наблюдаемая разница в выживаемости по стадиям была статистически значимой.
2. В случае метастазов в шейных лимфатических узлах после операции 5-летняя выживаемость составила 30%; Пятилетняя выживаемость пациентов, у которых их не было, составила 92,6%, что показало значительную разницу, а также наибольшее влияние на выживаемость.
3. На основании гистопатологического исследования хорошо дифференцированный тип составляет наибольшую часть классификации гистологической дифференциации SCC.Что касается 5-летней выживаемости, то у хорошо дифференцированного типа — 94,7%, у умеренно дифференцированного — 57,1%, у слабодифференцированного — 25,0%; таким образом показывая большую разницу в выживаемости в зависимости от классификации дифференциации.
4. Два фактора — послеоперационные метастазы в шейных лимфатических узлах и отдаленные метастазы — имели положительную корреляцию с умеренным коэффициентом.
5. За период наблюдения у 15 (40,5%) пациентов был подтвержден рецидив; 5-летняя выживаемость этих пациентов составила 46.7%, что ниже общей выживаемости.
Таким образом, было установлено, что фактором, оказывающим наибольшее влияние на долгосрочную выживаемость после операции, является метастазирование в шейные лимфатические узлы после операции. Клиническая и патологическая стадия TNM и местный рецидив оказались еще одним сильным фактором, влияющим на 5-летнюю выживаемость. Таким образом, мы можем подтвердить первичную опухоль и патологические данные шейного лимфатического узла после операции и потенциально улучшить долгосрочную выживаемость пациентов посредством тщательного последующего наблюдения для выявления любых послеоперационных результатов, таких как цервикальные метастазы.
Снижение интенсивности лечения ВПЧ-положительного рака ротоглотки может снизить токсичность при сохранении функции и выживаемости
Шарлотта Бат
25 апреля 2017 г.
«Статус-кво для плоскоклеточного рака ротоглотки, ассоциированного с ВПЧ [вирусом папилломы человека], недостаточен.… Наше лечение эффективно, но связанная с ним токсичность недопустима». А ассоциированный с ВПЧ рак ротоглотки «возникает у относительно молодых пациентов», — сказал Нишант Агравал, доктор медицины , профессор и директор отделения хирургической онкологии головы и шеи Чикагского университета на многопрофильном симпозиуме по голове и шее 2016 года, спонсируемом Робертом. ЧАС.Комплексный онкологический центр Лурье Северо-Западного университета, Чикаго. 1
Наши пациенты просят нас сделать лучше и снизить токсичность.— Нишант Агравал, MD
Твитнуть эту цитату
Мы наблюдали значительный рост заболеваемости ВПЧ-ассоциированным раком ротоглотки у относительно более молодых пациентов, средний возраст постановки диагноза — 50 лет, даже у пациентов в возрасте 30 лет », — сказал д-р Агравал. «Эти пациенты имеют долгую ожидаемую продолжительность жизни — можно ожидать, что они проживут от 30 до 50 лет или даже дольше, поскольку ожидаемая продолжительность жизни продолжает расти — по сравнению с пациентами с раком головы и шеи с заболеваниями, связанными с курением, которым поставлен диагноз в возрасте 60 лет и которые, возможно, имеют еще 10–20 лет осталось жить из-за других связанных с курением раковых заболеваний и сопутствующих заболеваний.”
Длительная продолжительность жизни и возможность снижения качества жизни из-за хронических побочных эффектов текущих методов лечения рака головы и шеи являются причинами для рассмотрения возможности деинтенсификации. «Острая токсичность имеет большое значение для наших текущих методов лечения», — сказал д-р Агравал. По оценкам, 80% пациентов будут иметь токсичность 3 степени при текущем лечении, и от 25% до 60% будут «продолжать страдать от токсичности 3 степени». Побочные эффекты включают дерматит, мукозит, ксеростомию и дисфагию и могут «изменить жизнь» пациентов.
По словам Сандипа Саманта, доктора медицины , начальника отделения хирургии головы и шеи в Northwestern Medicine и председателя симпозиума, «цель деинтенсификации — снизить позднюю токсичность, сохраняя при этом высокую выживаемость и нормальное функционирование, связанное с глотанием, слюной и вкусовыми ощущениями. ” 2 Доктор Самант выступал в качестве модератора и был одним из докладчиков на основной сессии, посвященной деэскалации терапии при ВПЧ-положительном раке ротоглотки.
Два разных заболевания
«Большинство людей, занимающихся лечением ВПЧ-положительного и ВПЧ-отрицательного рака ротоглотки, осознают, что это два разных заболевания», — сказал д-р.- заявил Самант. Это утверждение было подтверждено ответами на опрос аудитории, который показал, что 70% ответили «нет» на вопрос: «Как вы думаете, следует ли лечить рак, не связанный с ВПЧ, и рак, не связанный с ним, одинаково?» и 96% ответили «нет» на последующий вопрос: «Как вы думаете, через 5 лет к ним будут относиться так же?»
Целью деинтенсификации является снижение поздней токсичности при сохранении высокой выживаемости и нормальное функционирование, связанное с глотанием, слюной и вкусом.— Сандип Самант, Мэриленд
Твитнуть эту цитату
«Вероятно, есть основания полагать, что пациенты с ВПЧ в настоящее время подвергаются чрезмерному лечению.Просто нет ясности в том, как это лечение должно быть безопасно изменено, не отказываясь от показателей выживаемости », — сказал доктор Самант.
«Связь с ВПЧ оказывает заметно положительное влияние на прогноз», — отметил д-р Агравал. В то время как большинство пациентов с раком головы и шеи на ранних стадиях «в целом чувствуют себя очень хорошо» с 5-летней выживаемостью от 70% до 90%, выживаемость пациентов с болезнью III или IV стадии, к сожалению, резко падает до 30%. 60%, сообщил доктор Агравал, «за исключением рака головы и шеи, связанного с ВПЧ», что приводит к 5-летней выживаемости, которая может превышать 85%.
Это подтверждают две статьи, — отметил д-р Агравал. Оценка 96 пациентов с раком головы и шеи III или IV стадии 3 «показывает, что при среднем периоде наблюдения около 40 месяцев пациенты с ВПЧ-положительным раком ротоглотки имеют 2-летнюю общую выживаемость 94% по сравнению с таковыми. с ВПЧ-отрицательной болезнью, у которых 2-летняя общая выживаемость составляет 58% ». Ретроспективный анализ 4 323 пациентов с запущенным плоскоклеточным раком ротоглотки, включенных в рандомизированное клиническое исследование, показал общую 3-летнюю выживаемость 82.Доктор Агравал сообщил, что 4% для ВПЧ-ассоциированного заболевания против 57,1% для ВПЧ-отрицательного заболевания и выживаемость без прогрессирования 73,7% против 43,4%.
Предикторы дисфагии
Оценка качества жизни обычно лучше для пациентов с ВПЧ-положительной реакцией, чем для пациентов с отрицательной реакцией на p16, а качество жизни «обычно улучшается до почти исходного уровня через 12 месяцев», — сказал д-р Агравал. «К сожалению, значительное количество пациентов по-прежнему страдает хронической дисфагией. Даже через 2 года после лучевой терапии у 15% пациентов была дисфункция глотания 2 степени, а у 8% — прогрессирующая дисфагия, поэтому их глотание будет ухудшаться.«У пациентов также может быть хроническая ксеростомия. «Сухость во рту улучшается, — сказал доктор Агравал, — но никогда не возвращается к 100%».
Доктор Самант рассмотрел несколько исследований факторов, связанных с дисфагией. Исследование 122 пациентов, которым была проведена радикальная лучевая терапия по поводу местнораспространенного рака головы и шеи, «обнаружило, что частота дисфагии составляет 38,5%, а единственным наиболее важным предиктором было одновременное назначение химиотерапии», — отметил доктор Самант. В исследовании, проведенном в Нидерландах 6 с участием 529 пациентов с раком головы и шеи, «наиболее важными предикторами дисфагии> 2 степени были одновременное химиолучевое лечение, ускоренное фракционирование или двустороннее облучение шеи», — заявил он.Другое исследование, проведенное в Нидерландах, показало, что вероятность дисфагии зависит от дозы облучения верхних и средних сокращающих мышц. 7 После 55 Гр «вероятность дисфагии продолжала увеличиваться почти на 20% для каждой дополнительной дозы 10 Гр», — сказал д-р Самант.
В зависимости от исследования, от 5% до 85% пациентов с дисфагией потребуется установка трубки для чрескожной эндоскопической гастростомии (ПЭГ), сообщил д-р Агравал, и «некоторые из этих пациентов остаются зависимыми от ПЭГ до конца своей долгой жизни. .«Эти пациенты нуждаются в особом приготовлении пищи, компенсаторных механизмах или ограничениях в питании. «Вы просите 50-летнего человека изменить свой образ жизни на следующие 30-40 лет», — заявил он.
«Вмешательства важны, — подчеркнул д-р Агравал. Они включают терапию раннего глотания; патология речи до, во время и после лечения; и профилактические упражнения. Однако «ключ к успеху — это деинтенсификация», — утверждал он.
Подходы к ослаблению / деэскалации
Доктор.Агравал сказал, что он был «очень удивлен» результатами исследования, которое показало, что пациенты соглашаются с незначительно более низкой выживаемостью, чтобы избежать токсичности, связанной с тяжелым лечением. В исследовании 81% пациентов указали, что они предпочитают сниженную интенсивность лечения, отмечает д-р Агравал. «Наши пациенты просят нас сделать лучше и снизить токсичность».
Доктор Агравал перечислил несколько подходов к снижению интенсификации лечения и снижению токсичности:
- Уменьшите количество методов лечения.«Мы хотим, чтобы пациенты получали одномодальную терапию или, в лучшем случае, двумерную терапию», — сказал он.
- Уменьшите интенсивность / дозу данного метода без ущерба для эффективности. Например, можно снизить дозу облучения для пациентов, которые положительно реагируют на индукционную химиотерапию. Доктор Агравал предложил исключить химиотерапию для пациентов с низким риском метастатического заболевания и лечить этих пациентов только лучевой терапией или хирургическим вмешательством.
- Попробуйте трансоральные роботизированные подходы к хирургии по сравнению с традиционными открытыми хирургическими подходами.«В большинстве академических учреждений трансоральная роботизированная хирургия преобразила уход за пациентами, и пациенты хорошо себя чувствуют», — сказал д-р Агравал. «Вы меняете 7-дневную госпитализацию на 12-часовую операцию на по существу амбулаторную процедуру, при которой пациенты остаются в больнице в течение 23 часов, глотают в тот же день или в 1 послеоперационный день, и к 2 неделям они имеют довольно хорошее функционирование и восстановление.» Он добавил, что трансоральная хирургия также обеспечивает точную патологическую стадию для надлежащего лечения пациента.
«Роль иммунотерапии еще не определена. Сейчас мы думаем об этом только при рецидиве / метастазировании, но вы также можете рассматривать это с лечебной целью, добавляя его к трансоральной роботизированной хирургии, лучевой терапии или химиотерапии », — сказал д-р Агравал. Он предсказал, что «иммунотерапия изменит правила игры в этой области, как и трансоральная роботизированная хирургия», но подчеркнул, что на данном этапе иммунотерапия не должна использоваться вне протокола или клинических испытаний в первичных условиях.
Роль индукционной терапии
«Не все пациенты с раком, связанным с ВПЧ, чувствуют себя хорошо», — напомнил участникам симпозиума Даниэль Хараф, доктор медицины , профессор кафедры радиационной и клеточной онкологии Медицинского университета Чикаго. 9 Он описал несколько исследований, направленных на определение того, является ли отдаленное заболевание проблемой для ухудшения прогноза и работает ли индукционная терапия в этих условиях.
Brockstein и его коллеги проанализировали пять испытаний с 1989 по 1998 год, в которых участвовало в общей сложности 337 пациентов с местно-регионарно распространенным раком головы и шеи. 10 Результаты сравнивались для пациентов, получавших лечение либо по протоколам типа I (интенсивная индукционная химиотерапия, режим одновременного приема двух препаратов и облучение один раз в день), либо по протоколам типа II (отсутствие индукционной терапии, режим одновременного приема трех препаратов, и облучение два раза в день).
[Индукционная химиотерапия] уменьшила отдаленные метастазы [у пациентов с раком ротоглотки], но не улучшила выживаемость.— Даниэль Хараф, MD
Твитнуть эту цитату
«Выживаемость для протоколов типа I и типа II ничем не отличалась», — сказал д-р.Об этом сообщил Хараф. Через 5 лет общая выживаемость составила 46% для пациентов, получавших протокол типа I, по сравнению с 48% для пациентов, получавших протокол типа II. Соответствующие показатели выживаемости без прогрессирования заболевания составили 59% и 62%. «Но с протоколами типа I преобладали локальные отказы», - сказал д-р Хараф. «С протоколами типа II, в которых вы избавились от индукции, вы увидели обратную картину отказов».
Частота местных отказов за 5 лет составила 31% для протоколов типа I по сравнению с 17% для протоколов типа II. Частота отдаленных отказов составила 13% для протоколов типа I по сравнению с 22% для протоколов типа II.«Локальный отказ был вызван стадией Т; отдаленная неудача была вызвана стадией N, особенно болезнью N2b или N3 », — заявил д-р Хараф.
«Данные свидетельствуют о важности отдаленного отказа», — сказал д-р Хараф. Возможно, что отдаленная неудача могла быть недооценена из-за быстрой локальной неудачи у пациентов, получающих индукционную и низкодозную сопутствующую химиотерапию, добавил он.
Уменьшение отдаленных метастазов
Испытание фазы III DeCIDE при раке головы и шеи не выявило разницы в выживаемости между пациентами, случайным образом назначенными на химиолучевую терапию с индукционной химиотерапией или без нее. 11 В исследовании участвовали «пациенты с самым высоким риском», все с болезнью N2 или N3, отметил доктор Хараф.
Через 3 года общая выживаемость составила 72,8% для пациентов, получавших химиолучевую терапию, по сравнению с 74,9% для пациентов, также получавших индукционную химиотерапию. Соответствующая выживаемость без прогрессирования составила 58,6% против 67,4%. «Местное управление было идентичным», — заявил д-р Хараф. «Отдаленные рецидивы значительно различались ( P, = 0,04). Дистанционная неудача уменьшилась, когда мы провели индукционную химиотерапию.”
Исследование было признано отрицательным, отметил доктор Хараф. «Это уменьшило отдаленные метастазы, но не улучшило выживаемость». Он указал, что исследование было закрыто досрочно и оставалось недостаточным для оценки выживаемости, а событий было недостаточно. «Нельзя предполагать, что индукционная химиотерапия не работает, потому что положительное испытание может доказать пользу, но отрицательное испытание не доказывает обратного», — сказал д-р Хараф.
Поля предельного излучения
В исследовании деэскалации объема, адаптированного к ответу, использовалась индукционная химиотерапия цисплатином, паклитакселом и цетуксимабом (Эрбитукс) для лечения отдаленных метастазов и региональных микрометастазов, а также для прогнозирования ответа и излечимости. 12 Каждые две недели пациенты с поддающимся измерению местнораспространенным плоскоклеточным раком головы и шеи, достигшие полного или частичного ответа (≥ 50% уменьшение суммы диаметров опухолей) после двух циклов индукционной химиотерапии, получали паклитаксел, фторурацил, гидроксимочевину, и лучевая терапия с дозой 1,5 Гр два раза в день только для тяжелых заболеваний, с общей дозой 75 Гр. Пациенты со стабильным заболеванием (ответ <50%, «неответчики») получали ту же комбинацию с 75 Гр для общего заболевания и 45 Гр для первого эшелона не вовлеченных узлов.
Через 3 года общая выживаемость составила 79,1% для респондентов против 83,1% для неответчиков, а соответствующая выживаемость без прогрессирования составила 79,7% против 72,0%. Местный контроль опухоли через 3 года составил 94,4% для респондеров против 79,8% для неответчиков, а соответствующие показатели удаленного контроля опухоли составили 94,3% против 89,6%.
«Большинство локальных отказов (12/13, или 92,3%) происходили в полевых условиях, и большинство из них (11/12, или 91,7%) приходилось на зону с наибольшей дозой облучения», — сообщил д-р Хараф. «При многомерном анализе, включающем характеристики опухоли и лечения, только хороший ответ на индукционную химиотерапию предсказал снижение зависимости G-трубки от лечения и через 3 и 6 месяцев после лечения», — добавил он.
OPTIMA — это продолжающееся исследование (хотя и закрытое для накопления) в Чикагском университете по стратифицирующей терапии среди 61 пациента с местно-регионарно-распространенным, ВПЧ-положительным раком головы и шеи для минимизации побочных эффектов. Пациенты получают три цикла индукционной химиотерапии карбоплатином в 1-й день и наб-паклитакселом (Abraxane) в 1-й, 8-й и 16-й дни. После радиологической оценки ответа пациенты из группы низкого риска с ответом ≥ 50% получают низкую дозу лучевой терапии тогда как пациенты с ответом от 30% до 50% получают химиолучевую терапию в низких дозах, а пациенты с ответом <30% получают стандартную химиолучевую терапию.Для пациентов из группы высокого риска пациенты с ответом ≥ 50% получают химиолучевую терапию в низких дозах, а пациенты с ответом <50% получают стандартную химиолучевую терапию.
«Индукция по-прежнему актуальна», — заявил д-р Хараф. Его можно использовать для лечения отдаленных заболеваний, для уменьшения размера радиационных полей (и тем самым для снижения токсичности) и для прогнозирования способов снижения доз при раковых заболеваниях, связанных с ВПЧ, поскольку «не все случаи ВПЧ излечиваются».
Необходимо «уважать этот рак»
Среди пациентов с ВПЧ-ассоциированным раком ротоглотки «процент излечения высок, от 80% до 90%, но не 100%, и вы должны уважать этот рак», — отметил Роберт Хаддад, доктор медицины . 13 Д-р Хаддад — руководитель центра заболеваний, программа по онкологии головы и шеи, Институт рака Дана-Фарбер и Гарвардская медицинская школа, Бостон.
«Сейчас, когда мы 15 лет в этой эпидемии ВПЧ, мы видим много отдаленных неудач с ВПЧ-положительными пациентами», — сказал он. «Молодые люди от 45 до 50 лет с опухолями шеи, положительными на ВПЧ, небольшими первичными образованиями, большими опухолями — это типичные пациенты».
«ВПЧ-положительный и ВПЧ-отрицательный рак ротоглотки — это два разных заболевания, но их нужно уважать, и оба требуют агрессивного лечения с помощью лучевой терапии, химиотерапии и хирургии», — сказал доктор.- сказал Хаддад. «В большом количестве испытаний, в которых изучалась когорта ВПЧ, вы постоянно видите лучшие результаты. Эти пациенты имеют более высокие показатели выживаемости, если сравнивать их с группой, не связанной с ВПЧ, но, опять же, вы не всех лечите. Кроме того, в некоторых из этих исследований период наблюдения был коротким, всего 2-3 года. У нас нет данных о последующем наблюдении за 5 или 10 лет ».
Болюс цисплатина каждые несколько недель
В настоящее время существует «несколько стандартов ухода — только лучевая терапия, химиотерапия / лучевая терапия, различные виды химиотерапии; вы можете сделать операцию, а затем лучевую терапию, или операцию, а потом ничего….Суть в том, что при химиолучевой терапии стандартным лечением является болюсное введение цисплатина каждые несколько недель с лучевой терапией ». Несмотря на то, что использовались еженедельные схемы, «нет данных фазы III, чтобы сказать нам, что еженедельный цисплатин так же хорош, как и болюсный цисплатин», — утверждает доктор Хаддад.
ВПЧ-положительный и ВПЧ-отрицательный рак ротоглотки — это два разных заболевания, но их нужно уважать, и оба требуют агрессивного лечения с помощью лучевой терапии, химиотерапии и хирургического вмешательства.— Роберт Хаддад, Мэриленд
Твитнуть эту цитату
Восточная кооперативная онкологическая группа (ECOG) 1308 14 Испытание среди пациентов с резектабельной плоскоклеточной карциномой ротоглотки, ассоциированной с ВПЧ, «было интересным и важным, поскольку в нем действительно использовалась стратегия индукции. Пациенты сначала получали индукционную химиотерапию, чтобы выявить полных респондентов. И эти полные респонденты подверглись деинтенсификации », — объяснил д-р Хаддад. Пациенты с клиническими полными ответами получали лучевую терапию низкой дозой с модуляцией интенсивности плюс цетуксимаб еженедельно, тогда как пациенты с частичным ответом или стабильным заболеванием получали лучевую терапию полной дозой с модуляцией интенсивности плюс цетуксимаб еженедельно.
«Из этого исследования мы узнали, что есть некоторые группы, не подходящие для деинтенсификации — пациенты T4, пациенты N2c, курильщики. У этих пациентов не было так хорошо, как у многих других пациентов, и в настоящее время они исключены из испытаний, посвященных деинтенсификации », — отметил д-р Хаддад. Через 2 года выживаемость без прогрессирования среди пациентов, получавших низкую дозу лучевой терапии с модуляцией интенсивности, составила 80%, а общая выживаемость составила 93%, но для курильщиков с анамнезом более 10 упаковок-лет выживаемость без прогрессирования составила 57%. и общая выживаемость составила 86%.Лучшие результаты лучевой терапии с модуляцией интенсивности низкими дозами были у курильщиков с менее чем 10 пачка-годами и заболеванием без T4 и N2c, у которых был 2-летний период без прогрессирования и общая выживаемость 96%.
«Этот подход остается исследовательским», — отметил д-р Хаддад. «Планируются дальнейшие исследования».
Два новых испытания
Группа радиационной терапии онкологии (RTOG) 1016 — это крупное испытание с участием почти 1000 пациентов, в котором рассматривается вопрос: «Можем ли мы использовать цетуксимаб, ингибитор рецептора эпидермального фактора роста, вместо болюсного цисплатина у пациентов с раком головы и шеи?» ДокторХаддад объяснил. Хотя испытание завершено, результатов пока нет.
Исследование ECOG E3311 для ВПЧ-положительных пациентов «сначала использует хирургическое вмешательство, чтобы выбрать пациентов, которые могут получить более низкую дозу радиации или химиолучевой терапии», — сказал доктор Хаддад. «В исследовании полностью отказываются от химиотерапии, берутся те пациенты, которые, по-видимому, относятся к группе высокого риска — с низкой классификацией T и N, — и рандомизируются эти пациенты для лечения только низкой или стандартной дозой лучевой терапии или лучевой терапии стандартной дозы с еженедельным цисплатином или карбоплатином.Это испытание фазы II, поэтому вряд ли оно изменит практику, но может позволить нам разработать более крупное испытание ».
По результатам этих двух испытаний, «у нас будет некоторое представление о том, как можно лечить пациентов с ВПЧ ротоглотки с низким объемом и низким риском заболевания. Но мы действительно нуждаемся в зрелом наблюдении за этими испытаниями, а не только через 2 или 3 года, потому что многие неудачи лечения появляются позже », — сказал д-р Хаддад. «Сейчас у нас есть пациенты, за которыми мы наблюдаем 10 или 15 лет, и мы наблюдаем те неудачи.”
Доктор Хаддад прокомментировал: «Ряд факторов, помимо ВПЧ, может иметь отношение к обсуждению деинтенсификации». Кроме того, тестирования на p16, вирусный подтип у большинства пациентов с ВПЧ-ассоциированным заболеванием, «может быть недостаточно для включения пациента в исследование по деинтенсификации».
Бросить вызов руководящим принципам
Согласно рекомендациям Национальной комплексной онкологической сети ® (NCCN ® ), «мы не должны снижать эскалацию терапии», — сказал д-р.- указал Самант. При распространенном раке ротоглотки рекомендации рекомендуют расширенную химиолучевую терапию, 70 Гр с болюсным введением цисплатина каждые 3 недели, в течение 2–3 циклов с возможностью еженедельного введения цисплатина. В руководящих принципах признается: «В целом, одновременное химиолучевое облучение сопряжено с высоким бременем токсичности».
«При добавлении химиотерапии острая токсичность увеличивается на 300%», — сказал д-р Самант, и показали три испытания RTOG (91-11, 97-03, 99-14) с использованием стандартной химиолучевой терапии или различных схем. 43% случаев тяжелой поздней токсичности. 15 В этом анализе кривая поздней токсичности «продолжает расти, пока не выровняется к 36 месяцам», — сказал доктор Самант. «Выровнялась ли она из-за того, что токсичность перестала возникать, или из-за того, что у нас нет данных? Я видел пациентов через 14 лет после одновременного химиолучевого лечения с поздней токсичностью ».
В интервью The ASCO Post доктор Самант сказал: «Мы знаем, что долгосрочная токсичность лечения рака головы и шеи связана не столько с операцией, особенно если операция проводится в консервативной трансоральной манера.Это связано с болезнью, вызванной интенсивным облучением, которое становится еще более сильным при добавлении химиотерапии. Поэтому, если вы можете удалить опухоль с помощью сохраняющей функцию трансоральной техники и удалить лимфатические узлы, вы можете избежать терапии второй линии ».
Роль первичной хирургии
“ При первичной хирургической операции, если вы иссекаете опухоль с отрицательными границами, вы получаете патологическую стратификацию риска, так что вы можете выбрать пациентов, которые не получат дальнейшего лечения или могут получить сниженную послеоперационную дозу облучения. , ограничивая использование одновременного облучения только теми пациентами, которые действительно в нем нуждаются », — сказал д-р.Самант.
В Университете Теннесси, Мемфис, опыт работы с 43 пациентами с раком ротоглотки III / IV стадии, 76% из которых были p16-положительными и 56% курильщиками, 16% не получали дополнительного лечения после операции и расслоения лимфатических узлов. «Опухоль была удалена в чистом самолете с очень тонким краем», — сообщил доктор Самант. При среднем сроке наблюдения 40 месяцев «42 из этих пациентов живы; 1 человек погиб. Преобладающим типом неудач были отдаленные метастазы…. Локорегиональных сбоев не было.”
В целом, исследования с пациентами, перенесшими хирургическое вмешательство в рамках лечения, показали более высокую общую выживаемость и выживаемость без прогрессирования заболевания. «Мы видим здесь закономерность», — сказал д-р Самант. «Если вы сделаете поправку на курение и статус ВПЧ, вы можете выйти вперед, если удалите опухоль».
Функциональные результаты
В нескольких исследованиях сравнивали функциональные результаты трансоральной роботизированной хирургии или другой первичной хирургии с химиолучевой терапией. Исследование, сравнивающее 20 последовательных пациентов, перенесших трансоральную роботизированную операцию, с 20 последовательными получателями химиолучевой терапии, показало, что функция глотания восстанавливается быстрее и ближе к норме при первичной операции, чем при химиолучевой терапии. 16
«Первичная хирургия обеспечивает сопоставимую выживаемость и, возможно, лучший результат контроля заболевания по сравнению со стандартной химиолучевой терапией», — заключил д-р Самант. Если первичная опухоль имеет небольшие размеры и поддается трансоральной резекции, преимущества хирургической деинтенсификации включают благоприятный профиль побочных эффектов, быстрое хирургическое восстановление и быстрый немедленный контроль всех известных заболеваний, а также более точную стратификацию терапии. Он добавил, что функциональные результаты также лучше. ■
Раскрытие информации: Drs.Агравал, Самант и Хараф не сообщили о потенциальных конфликтах интересов.
Список литературы
1. Агравал Н .: Почему необходима деинтенсификация? Междисциплинарный симпозиум по голове и шее, 2016 г. Представлено 4 декабря 2016 г.
2. Самант С. Хирургическая деинтенсификация. Междисциплинарный симпозиум по голове и шее, 2016 г. Представлено 4 декабря 2016 г.
3. Fakhry C, Westra WH, Li S, et al: Повышение выживаемости пациентов с плоскоклеточной карциномой головы и шеи, положительной на вирус папилломы человека, в проспективном клиническом исследовании.J Natl Cancer Inst 100: 261-269, 2008.
.4. Анг К.К., Харрис Дж., Уилер Р. и др.: Вирус папилломы человека и выживаемость пациентов с раком ротоглотки. N Engl J Med 363: 24-35, 2010.
.5. Caudell JJ, Schaner PE, Meredith RF и др.: Факторы, связанные с длительной дисфагией после радикальной лучевой терапии по поводу местнораспространенного рака головы и шеи. Int J Radiat Oncol Biol Phys 73: 410-415, 2008.
.6. Langendijk JA, Doornaert P, Rietveld DH, et al: Прогностическая модель дисфункции глотания после лечебной лучевой терапии при раке головы и шеи.Radiother Oncol 90: 189-195, 2009.
7. Levendag PC, Teguh DN, Voet P, et al: На дисфагию у пациентов с раком ротоглотки в значительной степени влияет доза лучевой терапии для верхней и средней сокращающей мышцы: зависимость доза-эффект. Radiother Oncol 85: 64-73, 2007.
8. Brotherson DC, Poon I, Le T, et al: Предпочтения пациентов в отношении деэскалации лечения рака ротоглотки. Head Neck 35: 151-159, 2013.
.9. Haraf D: Есть ли роль индукции в современном лечении HNC? Междисциплинарный симпозиум по голове и шее, 2016 г.Представлено 4 декабря 2016 г.
10. Brockstein B, Haraf DJ, Rademaker AW, et al: Модели неудач, прогностические факторы и выживаемость при локорегионально распространенном раке головы и шеи, леченном сопутствующей химиолучевой терапией: 9-летний опыт работы в нескольких учреждениях с участием 337 пациентов. Ann Oncol 15: 1179-1186, 2004.
.11. Коэн Е.Е., Каррисон Т.Г., Кочергинский М. и др.: Рандомизированное исследование фазы III индукционной химиотерапии у пациентов с местнораспространенным раком головы и шеи N2 или N3.J Clin Oncol 32: 2735-2743, 2014.
.12. Виллафлор В.М., Мелотек Дж.М., Каррисон Т.Г. и др.: Деэскалация объема, адаптированная к ответу (RAVD) при местнораспространенном раке головы и шеи. Энн Онкол 27: 908-913, 2016.
13. Хаддад Р: Деэскалация химиотерапии в эпоху рака ротоглотки, связанного с ВПЧ: пора ли? Междисциплинарный симпозиум по голове и шее, 2016 г. Представлено 4 декабря 2016 г.
14. Cmelak A, Li S, Marur S, et al: E1308: IMRT с уменьшенной дозой при резектабельной плоскоклеточной карциноме ротоглотки, ассоциированной с вирусом папилломы человека (HPV), после полного клинического ответа (cCR) на индукционную химиотерапию.Ежегодное собрание ASCO 2014. Аннотация LBA6006.
15. Machtay M, Moughan J, Trotti A, et al: Факторы, связанные с тяжелой поздней токсичностью после одновременной химиолучевой терапии для местнораспространенного рака головы и шеи: анализ RTOG. J Clin Oncol 26: 3582-3589, 2007.
16. More YI, Tsue TT, Girod DA, et al: Функциональный результат глотания после трансоральной роботизированной хирургии по сравнению с первичной химиолучевой терапией у пациентов с поздними стадиями рака ротоглотки и надгортанника. JAMA Otolaryngol Head Neck Surg 139: 43-48, 2013.
Что это такое, Симптомы, Этапы, Прогноз
Обзор
Расположение ротоглотки.Что такое рак ротоглотки?
Рак ротоглотки — это тип рака головы и шеи, при котором раковые клетки обнаруживаются в области горла, называемой ротоглоткой.
Более 90% случаев рака ротоглотки представляют собой плоскоклеточные карциномы, которые возникают из клеток с плоской поверхностью, выстилающих рот и горло.
Что такое ротоглотка?
Ротоглотка — это средняя часть горла (глотка) сразу за ртом. Ротоглотка включает заднюю часть языка (основание языка), миндалины, мягкое небо (заднюю часть неба), а также боковые стороны и стенки горла. Ротоглотка выделяет слюну, поддерживает влажность во рту и горле и помогает переваривать пищу, которую вы едите.
Насколько распространен рак ротоглотки?
По данным Американского онкологического общества, около 53000 человек в США ежегодно заболевают раком ротоглотки. Этот рак встречается у мужчин в два раза чаще, чем у женщин. В равных количествах встречается у афроамериканцев и кавказцев.
Средний возраст постановки диагноза — 62 года. Около 25% случаев рака ротоглотки встречается у людей в возрасте до 55 лет. Этот рак редко встречается у детей.
Какие факторы повышают риск рака ротоглотки?
Факторы, повышающие вероятность заболевания раком ротоглотки, включают:
- История курения.
- Употребление сильного алкоголя.
- История рака головы и шеи.
- История лучевой терапии головы и шеи.
- Заражение вирусом папилломы человека (ВПЧ), особенно ВПЧ типа 16.
Симптомы и причины
Что вызывает рак ротоглотки?
Рак — это неконтролируемое размножение и накопление аномальных клеток.Аномальные клетки возникают из-за изменений в нашей ДНК — «строительных блоках» того, кто мы есть. Многие разные вещи могут вызвать рак. В случае рака ротоглотки было показано, что употребление табачных изделий и алкоголя повреждает клетки, выстилающие рот и горло. Вирус, вызывающий инфекцию ВПЧ, вырабатывает белки, которые мешают генам, которые обычно контролируют рост клеток. Неконтролируемый рост клеток может привести к раку. В настоящее время инфекция ВПЧ является наиболее частой причиной рака ротоглотки и продолжает расти.Причины некоторых случаев рака ротоглотки неизвестны.
Каковы симптомы рака ротоглотки?
Следующее может быть признаком рака ротоглотки или других заболеваний. Обратитесь к врачу, если присутствуют какие-либо из следующих симптомов:
- Боль в горле, которая не проходит.
- Боль или затруднение при глотании.
- Не удается полностью открыть рот или шевелить языком.
- Необъяснимая потеря веса.
- Изменения голоса, которые не пропадают.
- Боль в ухе, которая не проходит.
- Комок в задней части горла или во рту.
- Шишка на шее.
- Кашляет кровью.
- Белое пятно на языке или слизистой оболочке рта, которое не исчезает.
Диагностика и тесты
Как диагностируется рак ротоглотки?
Во-первых, ваш лечащий врач изучит вашу историю болезни, спросит о вашей истории курения (если вы употребляете табачные изделия), изучит текущие и прошлые болезни и лекарства и спросит о ваших симптомах.Затем ваш врач осмотрит ваш рот, горло и шею, используя зеркало и осветительные приборы и / или оптоволоконный зонд, чтобы найти аномальные области во рту и горле, и ощупает вашу шею на предмет образований. Если будет обнаружена какая-либо патологическая ткань, будет проведена биопсия для проверки наличия раковых клеток и наличия инфекции ВПЧ. Могут быть заказаны визуализирующие обследования области горла, такие как ПЭТ, компьютерная томография или МРТ. Эти тесты дают более подробную информацию о вашем горле и любых обнаруженных новообразованиях.
Какие стадии рака ротоглотки?
Стадия — это процесс определения наличия рака и, если да, то насколько далеко он распространился.Это помогает вашей медицинской бригаде разработать план лечения. Стадии рака ротоглотки варьируются от стадии I (лучший прогноз) до стадии IV (худший прогноз). Система, разработанная Американским объединенным комитетом по раку для определения стадии рака, является сложной и содержит конкретную информацию, основанную на степени опухоли, ее распространении на близлежащие лимфатические узлы и отдаленных органах, а также на том, связан ли рак с ВПЧ. вирус. Обязательно попросите своего врача объяснить вашу стадию так, как вы понимаете.
Ведение и лечение
Как лечится рак ротоглотки?
Стадия рака, на которой расположен рак ротоглотки, ваш возраст и общее состояние здоровья определяют план лечения. Цель состоит в том, чтобы вылечить раковые клетки, сохранив при этом способность говорить и глотать как можно более нормально.
Лечение может включать один метод или комбинацию методов, которые могут включать хирургию (обычно трансоральную роботизированную хирургию), лучевую терапию, химиотерапию, таргетную лекарственную терапию и иммунотерапию.
Хирургическое вмешательство и / или лучевая терапия обычно сначала пробуют при ранней стадии рака, который имеет небольшие размеры и не распространился.
Химиотерапия используется несколькими способами:
- В сочетании с лучевой терапией вместо операции.
- Обычно в сочетании с лучевой терапией для уничтожения раковых клеток, оставшихся после операции.
- Самостоятельно или в сочетании с лучевой терапией для уменьшения более крупных опухолей перед операцией.
- Самостоятельно или в сочетании с лучевой терапией для лечения более крупных и распространенных видов рака, которые не поддаются хирургическому лечению.
Таргетная лекарственная терапия — это искусственные версии белка в вашей иммунной системе, называемого моноклональным антителом. Эти лекарства замедляют или останавливают рак, блокируя белок, необходимый раковым клеткам для деления, роста и распространения. Цетуксимаб (Эрбитукс®) — широко используемый целевой препарат для лечения рака ротоглотки.Он используется отдельно, в сочетании с лучевой терапией или другими традиционными химиотерапевтическими препаратами.
Иммунотерапия — это препараты, которые помогают собственной иммунной системе вашего организма находить и уничтожать раковые клетки. Рак умный, и раковые клетки хотят сливаться с другими клетками, а не распознавать и не атаковать иммунную систему вашего тела. Иммунотерапия отключает или включает определенные белки в собственной иммунной системе вашего тела, чтобы она могла распознавать раковые клетки и усиливать ответную реакцию организма на них.Иммунотерапия используется в качестве первого варианта лечения рака, который вернулся, или рака, который распространился. Иммунотерапия рака ротоглотки включает пембролизумаб (Кейтруда®) и ниволумаб (Опдиво®)
.Последний вариант лечения рака ротоглотки, когда другие варианты недоступны, — это участие в клиническом исследовании. Для участия в клиническом исследовании должны соблюдаться строгие критерии включения. Лекарства, находящиеся в клинических испытаниях, находятся на разных стадиях разработки в направлении одобрения Управления по санитарному надзору за качеством пищевых продуктов и медикаментов — некоторые лекарства могут оказаться безопасными и эффективными, другие — нет.Вы и ваша медицинская бригада обсудите, стоит ли рассматривать возможность участия в клиническом исследовании.
Ваша медицинская бригада будет тесно сотрудничать с вами, чтобы разработать план лечения, специально предназначенный для вашего рака, который будет включать некоторые из методов лечения, описанных выше. Не стесняйтесь спрашивать свою команду о любом аспекте вашего плана лечения.
Что такое трансоральная роботизированная хирургия?
Трансоральная роботизированная хирургия — это малоинвазивный метод лечения, позволяющий удалить через рот труднодоступные раковые образования ротоглотки.В роботизированной хирургии ваш хирург работает, сидя за консолью, а вы находитесь на соседнем операционном столе. Ваш хирург с помощью ручного и ножного управления позиционирует 3D-камеру высокого разрешения и точно направляет хирургические инструменты, прикрепленные к роботизированным манипуляторам. Роботизированная хирургия позволяет избежать больших разрезов шеи и расщепления нижней челюсти, которые требуются при традиционной хирургии. Преимущества трансоральной роботизированной хирургии включают более короткое пребывание в больнице, более быстрое выздоровление, меньшее повреждение окружающих тканей и глотательных мышц, отказ от трахеостомической дыхательной трубки и меньшее количество долгосрочных проблем с речью и глотанием.
Профилактика
Могу ли я что-нибудь сделать, чтобы предотвратить развитие рака ротоглотки?
Возможно, вы не сможете предотвратить рак ротоглотки, но вы можете предпринять шаги, чтобы снизить свой риск. Вы можете внести следующие изменения:
- Не курите.Если вы курите или употребляете табачные изделия, бросьте. Продолжение курить значительно увеличивает риск развития второго рака ротовой полости, горла, голосового аппарата или легких. Обратитесь за помощью к своему врачу. У них есть много ресурсов, и они могут помочь вам связаться с необходимой информацией или другими специалистами в области здравоохранения, которые могут помочь вам бросить курить.
- Не употребляйте алкоголь регулярно или много. Алкоголь усиливает канцерогенные эффекты табака, поэтому особенно важно избегать этого сочетания.
- Избегайте заражения вирусом папилломы человека (ВПЧ). Спросите своего врача о вакцине против ВПЧ. Наличие нескольких половых партнеров и оральный секс увеличивает риск заражения ВПЧ.
- Придерживайтесь здоровой, сбалансированной диеты и регулярно занимайтесь спортом.
- Регулярно посещайте своего врача и стоматолога. Они могут проверить ваш рот и горло и уловить любые изменения на ранней стадии их развития.
Перспективы / Прогноз
Каков прогноз (шанс выздоровления) для людей с раком ротоглотки?
Прогноз для людей с раком ротоглотки зависит от вашего возраста и общего состояния здоровья, ВПЧ-статуса опухоли, курения в анамнезе и стадии рака.Опухоли, связанные с ВПЧ, имеют значительно более высокий показатель излечения по сравнению с опухолями, не связанными с ВПЧ. Людям с раком полости рта или ротоглотки важно проходить последующие обследования до конца своей жизни, поскольку рак может возникать в близлежащих районах. Кроме того, важно исключить такие факторы риска, как курение и употребление алкоголя, которые увеличивают риск повторного рака или рецидива рака.
По данным Американского онкологического общества, пятилетняя относительная выживаемость составляет 70%.Это означает, что если у вас рак, у вас на 70% больше шансов прожить как минимум пять лет после постановки диагноза, чем у людей, у которых нет рака. Имейте в виду, что это число не учитывает ваш возраст, общее состояние здоровья, реакцию на лечение и статус ВПЧ 16. Коэффициент выживаемости не применяется, если у вас изменилась стадия рака. Также имейте в виду, что показатели выживаемости основаны на статистике, собранной пятью годами ранее, и все время становятся доступными новые методы лечения и стратегии управления.
Жить с
Какие вопросы я должен задать своему врачу, если мне поставили диагноз рака ротоглотки?
- Где именно мой рак?
- Распространился ли мой рак? Что это за этап? Что это обозначает?
- Какие анализы мне предстоит пройти?
- Какие поставщики медицинских услуг будут в моей бригаде по уходу?
- Связан ли мой рак с вирусом папилломы человека (ВПЧ)?
- Какие изменения в образе жизни мне следует сделать?
- Какой у меня план лечения? Какие у меня есть варианты?
- Каковы мои шансы на выздоровление?
- Каковы побочные эффекты лечения?
- Что будет, если рак вернется? Какие у меня варианты?
Это всего несколько вопросов.Обязательно записывайте других, когда думаете о них. Ваша медицинская бригада хочет помочь вам разобраться во всем, что касается вашего рака и лечения.
Лечение рака ротоглотки (взрослый) (PDQ®) — версия для пациента
О PDQ
Запрос данных врача (PDQ) — это обширная база данных по раку Национального института рака (NCI). База данных PDQ содержит резюме последней опубликованной информации о профилактике, обнаружении, генетике, лечении, поддерживающей терапии, а также дополнительной и альтернативной медицине.Большинство резюме представлено в двух версиях. Версии для медицинских работников содержат подробную информацию на техническом языке. Версии для пациентов написаны на понятном нетехническом языке. Обе версии содержат точную и актуальную информацию о раке, и большинство версий также доступно на испанском языке.
PDQ — это услуга NCI. NCI является частью Национальных институтов здравоохранения (NIH). NIH — это центр биомедицинских исследований при федеральном правительстве. Обзоры PDQ основаны на независимом обзоре медицинской литературы.Это не политические заявления NCI или NIH.
Цель этого обзора
В этом обзоре информации о раке PDQ содержится текущая информация о лечении рака ротоглотки у взрослых. Он предназначен для информирования и помощи пациентам, семьям и лицам, осуществляющим уход. Он не дает официальных руководящих принципов или рекомендаций для принятия решений в отношении здравоохранения.
Рецензенты и обновления
Редакционные коллегии составляют сводки информации о раке PDQ и поддерживают их в актуальном состоянии.Эти советы состоят из экспертов в области лечения рака и других специальностей, связанных с раком. Резюме регулярно пересматриваются, и в них вносятся изменения при появлении новой информации. Дата в каждой сводке («Обновлено») — это дата самого последнего изменения.
Информация в этом обзоре пациента была взята из версии для медицинских работников, которая регулярно проверяется и обновляется по мере необходимости редакционной коллегией PDQ по лечению взрослых.
Информация о клиническом испытании
Клиническое испытание — это исследование, призванное ответить на научный вопрос, например, лучше ли одно лечение, чем другое.Испытания основаны на прошлых исследованиях и на том, что было изучено в лаборатории. Каждое испытание отвечает на определенные научные вопросы, чтобы найти новые и лучшие способы помочь больным раком. Во время клинических испытаний лечения собирается информация об эффектах нового лечения и о том, насколько хорошо оно работает. Если клинические испытания покажут, что новое лечение лучше, чем то, что используется в настоящее время, новое лечение может стать «стандартным». Пациенты могут захотеть принять участие в клиническом исследовании.Некоторые клинические испытания открыты только для пациентов, которые еще не начали лечение.
Клинические испытания можно найти в Интернете на сайте NCI. Для получения дополнительной информации позвоните в Информационную службу рака (CIS), контактный центр NCI, по телефону 1-800-4-CANCER (1-800-422-6237).
Разрешение на использование данного обзора
PDQ является зарегистрированным товарным знаком. Содержимое документов PDQ можно свободно использовать как текст. Его нельзя идентифицировать как сводную информацию о раке NCI PDQ, если не отображается вся сводка и не обновляется регулярно.Тем не менее, пользователю будет разрешено написать такое предложение, как «Сводная информация о раке PDQ NCI о профилактике рака груди указывает риски следующим образом: [включить выдержку из резюме]».
Лучше всего процитировать это резюме PDQ:
Редакционная коллегия PDQ® Adult Treatment. PDQ Лечение рака ротоглотки (взрослый). Бетесда, Мэриленд: Национальный институт рака. Обновлено <ММ / ДД / ГГГГ>. Доступно по адресу: https://www.cancer.gov/types/head-and-neck/patient/adult/oropharyngeal-treatment-pdq.Дата обращения <ММ / ДД / ГГГГ>. [PMID: 26389310]
Изображения в этом резюме используются с разрешения автора (ов), художника и / или издателя для использования только в обзорах PDQ. Если вы хотите использовать изображение из сводки PDQ и не используете все сводки, вы должны получить разрешение от владельца. Он не может быть предоставлен Национальным институтом рака. Информацию об использовании изображений в этом обзоре, а также многих других изображений, связанных с раком, можно найти в Visuals Online. Visuals Online — это коллекция из более чем 3000 научных изображений.
Заявление об ограничении ответственности
Информация, содержащаяся в этом резюме, не должна использоваться для принятия решений о страховом возмещении. Более подробную информацию о страховании можно найти на сайте Cancer.gov на странице «Управление онкологическими услугами».
Свяжитесь с нами
Дополнительную информацию о том, как связаться с нами или получить помощь на веб-сайте Cancer.gov, можно найти на нашей странице «Свяжитесь с нами для получения помощи». Вопросы также можно отправить на Cancer.gov через электронную почту веб-сайта.
Факты о раке полости рта — Фонд рака полости рта
Частота встречаемости в США
В этом году около 54 000 американцев будет диагностирован рак полости рта или ротоглотки.Это приведет к более чем 9750 смертельным случаям, убивая примерно 1 человека в час, 24 часа в сутки. Из этих 54 000 человек с новым диагнозом лишь немногим более половины будут живы через 5 лет. (Примерно 57%). Это число, которое не улучшилось значительно за десятилетия. (Показатель выживаемости через 5 лет после постановки диагноза составлял в течение многих десятилетий около 50%, поэтому 57% — это улучшение за последние десять лет. Однако это связано с увеличением числа раковых заболеваний, вызванных ВПЧ16, которые более уязвимы для существующих методов лечения, что дает значительное преимущество в выживании.Итак, изменение этиологии, а не улучшение раннего обнаружения или лечения; которые относительно не изменились по сравнению с десятилетней давностью, не являются основной причиной улучшения.) Смертность от рака полости рта выше, чем от рака, о котором мы обычно слышим, таких как рак шейки матки, лимфома Ходжкина, рак гортани, рак яичек. , и много других. Если расширить определение рака полости рта и ротоглотки, включив в него рак гортани, число диагностированных случаев вырастет примерно до 54000 человек и 13500 смертей в год в США.С. в одиночку. Во всем мире проблема гораздо серьезнее: ежегодно выявляется более 450 000 новых случаев. Обратите внимание, что данные ВОЗ о заболеваемости в мире, хотя и являются наилучшими из имеющихся, это оценки, которые пользователям следует принимать во внимание с некоторыми оговорками. Сбор и представление данных в некоторых странах проблематичны, несмотря на профессиональные усилия ВОЗ по обеспечению точности.
Статистика мировых событий
Рак полости рта является частью группы раковых заболеваний, обычно называемых раком головы и шеи, и среди всех раковых заболеваний головы и шеи они составляют около 85% этой категории.Рак головного мозга представляет собой отдельную категорию рака и не входит в группу рака головы и шеи.
Исторически уровень смертности, связанной с этим раком, особенно высок не потому, что его трудно обнаружить или диагностировать, а потому, что рак обычно обнаруживается на поздних стадиях его развития. Сегодня (2019 г.) это утверждение по-прежнему верно, поскольку в США нет всеобъемлющей программы по оппортунистическому скринингу на болезнь, и без этого более позднего обнаружения более распространено.Еще одним препятствием на пути к раннему открытию (и приводящему к лучшим результатам) является появление вируса HPV16, который в большей степени увеличивает заболеваемость раком полости рта, особенно в задней части рта (ротоглотка, миндалины, основание ротовой полости). области языка), которые во многих случаях не вызывают видимых повреждений или обесцвечивания, которые исторически были ранними предупреждающими признаками процесса заболевания в передней (передней) части рта.
Часто рак ротовой полости обнаруживают только тогда, когда рак метастазирует в другое место, скорее всего, в лимфатические узлы шеи.Прогноз на этом этапе обнаружения значительно хуже, чем при обнаружении локализованной внутриротовой области. Помимо метастазов, на этих более поздних стадиях первичная опухоль успела проникнуть глубоко в местные структуры.
Рак полости рта особенно опасен, потому что на ранних стадиях он может быть не замечен пациентом, поскольку он часто может процветать, не вызывая боли или симптомов, которые они могут легко распознать, и потому что он имеет высокий риск образования второй первичной опухоли.Это означает, что пациенты, пережившие первую встречу с болезнью, имеют в 20 раз более высокий риск развития второго рака. Этот повышенный фактор риска может длиться от 5 до 10 лет после первого случая. Существует несколько типов рака полости рта, но около 90% из них — плоскоклеточный рак. Другими гораздо менее распространенными видами рака полости рта являются рак ACC и MEC, которые для сравнения относительно редки, но очень смертоносны, поскольку глубина знаний о них намного меньше, чем SCC. По оценкам, это примерно 3 доллара.2 миллиарда тратятся в Соединенных Штатах ежегодно на лечение рака головы и шеи. (Номера 2010 г.)
Дополнительная информация о редких формах рака полости рта.
Возраст, пол, раса и этническая принадлежность
Демографические данные тех, кто заболел этим раком, некоторое время оставались неизменными. В то время как исторически большинство людей были старше 40 лет на момент открытия, сейчас это происходит чаще у людей моложе этого возраста. Точные причины для людей, пострадавших в более молодом возрасте, теперь становятся более ясными в рецензируемых исследованиях, которые выявляют вирусную этиологию (причину), вирус папилломы человека версии 16.Есть также ссылки на молодых мужчин и женщин, которые употребляют обычный «бездымный» жевательный или сплевывающий табак. Некоторые пропагандируют его как более безопасную альтернативу курению, но на самом деле не доказано, что он значительно безопаснее для тех, кто его употребляет, когда речь идет о раке полости рта. Кампании по обеспечению безопасности бездымного табака уже начаты, но очевидно, что, хотя это может снизить риск рака легких, оно оказывает негативное влияние на уровень заболеваемости раком полости рта, поджелудочной железы, пародонтоза и хронические инфекции, которые он вызывает связывайте это также с сердечными заболеваниями.Успехи в борьбе с раком легких могут быть достигнуты, но будут новые потери в других областях. К другим новым растворимым продуктам из бездымного табака относятся неоднозначно, и до тех пор, пока их использование не будет подтверждено приемлемыми исследованиями, мы рекомендуем избегать их.
В настоящее время также подтверждено, что в более молодой возрастной группе, включая тех, кто никогда не употреблял табачные изделия, есть причина, связанная с вирусом HPV16. Доказано, что вирус папилломы человека, особенно его версия 16, передается половым путем между партнерами, и неопровержимо причастен к увеличению числа молодых некурящих пациентов с раком ротоглотки.Это тот же самый вирус, который является возбудителем, наряду с другими версиями вируса, более чем в 90% всех случаев рака шейки матки. Фонд считает, что, основываясь на недавних открытиях в рецензируемых опубликованных данных за последние несколько лет, у людей в возрасте до 50 лет ВПЧ16 может даже заменить табак в качестве основного возбудителя болезни в инициации процесса болезни. задняя полость рта / ротоглотка, преимущественно в миндалинах и у основания языка.
С гендерной точки зрения, на протяжении десятилетий рак полости рта поражал 6 мужчин на каждую женщину.Теперь это соотношение стало по 2 мужчины на каждую женщину перед заболеванием ротовой полости. Опять же, хотя опубликованных исследований не существует, чтобы сделать окончательные выводы, мы, вероятно, обнаружим, что это увеличение связано с изменениями образа жизни, в первую очередь с увеличением числа курящих женщин за последние несколько десятилетий. Рак встречается у чернокожих в два раза чаще, чем у белых, и статистика выживаемости черных в течение пяти лет также хуже — 33% по сравнению с 55% среди белых. Как и в приведенных выше примерах, вряд ли мы найдем этому генетическую причину.Выбор образа жизни по-прежнему остается главной причиной. В этих опубликованных статистических данных не учитываются такие социально-экономические факторы, как уровень доходов, образование, доступность надлежащего медицинского обслуживания и повышенное употребление табака и алкоголя различными этническими группами, но все эти факторы, вероятно, играют роль в том, кто разовьет болезнь. . При раке ротоглотки преобладают мужчины 4-1 над женщинами и белые мужчины над чернокожими мужчинами.
Факторы риска
Понимание причинных факторов рака поможет предотвратить болезнь.Возраст часто называют фактором риска рака полости рта, поскольку исторически он встречается у людей старше 40 лет. Возраст диагностированных пациентов может указывать на временной компонент биохимических или биофизических процессов стареющих клеток, который допускает злокачественную трансформацию, или, возможно, , компетентность иммунной системы снижается с возрастом. Самые последние данные (конец 2008-2011 гг.) Заставляют нас полагать, что наиболее быстрорастущим сегментом популяции рака полости рта являются некурящие люди в возрасте до пятидесяти лет, что свидетельствует о смене парадигмы причины заболевания и места, где это чаще всего встречается в ротовой полости.Рак передней части ротовой полости, табак и алкоголь снизились вместе с соответствующим сокращением курения, а участки задней части полости рта, связанные с вирусной причиной ВПЧ16, увеличились. Таким образом, говоря в общих чертах, многие называют эти два совершенно разных рака (ротовой полости и ротоглотки) «раком полости рта», и, хотя это технически неточно, они считаются нормальным явлением в общедоступных сообщениях.
Однако вполне вероятно, что совокупный ущерб от других факторов, таких как употребление табака, алкоголь и стойкие вирусные инфекции, такие как ВПЧ, являются настоящими виновниками чего-то вроде слабости иммунной системы или возраста.Например, может потребоваться несколько десятилетий курения, чтобы ускорить развитие рака. При этом употребление табака во всех его формах занимает первое место в списке факторов риска истинного рака полости рта у лиц старше 50 лет. Исторически по крайней мере 75% людей, которым был поставлен диагноз в возрасте 50 лет и старше, были потребителями табака. Этот процент сейчас меняется, и точные проценты еще предстоит окончательно определить и опубликовать, поскольку новые данные, связанные с сокращением употребления табака, очень быстро меняют динамику.Когда вы комбинируете табак с чрезмерным употреблением алкоголя, ваш риск значительно увеличивается, так как два действия действуют синергетически. У тех, кто курит и пьет, риск развития рака полости рта в 15 раз выше, чем у других. Не похоже, что вирусная причина ВПЧ16 должна действовать синергетически с табаком или алкоголем, а ВПЧ16 представляет собой совершенно уникальный и независимый процесс заболевания в ротоглотке.
Табак и алкоголь, по сути, являются химическими факторами, но их также можно рассматривать как факторы образа жизни, поскольку мы в некоторой степени контролируем их.Помимо этого, существуют физические факторы, такие как воздействие ультрафиолетового излучения. Это возбудитель рака губы, а также других видов рака кожи. Рак губы — это один из видов рака полости рта, число которых за последние несколько десятилетий сократилось. Вероятно, это связано с возросшим пониманием вредных последствий длительного воздействия солнечного света и использованием солнцезащитных кремов для защиты. Другой физический фактор — воздействие рентгеновских лучей. Во время обследований регулярно делаются рентгенограммы, и в стоматологическом кабинете они безопасны, но помните, что радиационное воздействие накапливается в течение всей жизни.Он был причастен к нескольким видам рака головы и шеи.
Биологические факторы включают вирусы и грибки, которые были обнаружены в связи с раком полости рта. Вирус папилломы человека, особенно ВПЧ16, был окончательно причастен к раку ротоглотки (ротоглотки, основание языка, миндалин и крипта, а также сами миндалины), и только в очень небольшой популяции они были причастны к развитию рака. рак передней части ротовой полости. ВПЧ — распространенный вирус, передающийся половым путем, которым сегодня заражено около 40 миллионов американцев.Существует около 200 штаммов ВПЧ, большинство из которых считаются безвредными. У большинства американцев в течение жизни будет какая-либо версия ВПЧ, и они даже будут подвержены онкогенным / вызывающим рак версиям этого вируса. Но только примерно у 1% инфицированных отсутствует иммунный ответ на штамм HPV16, который является основным возбудителем рака шейки матки (с HPV18), рака заднего прохода и полового члена и в настоящее время является известной причиной рака ротоглотки. Что ж. Итак, мы хотим внести ясность. Заражение даже вирусом ВПЧ высокого риска не означает, что у вас разовьется рак ротовой полости.Иммунная система большинства людей избавляется от инфекции до того, как появится возможность злокачественного новообразования. Вполне вероятно, что изменения в сексуальном поведении молодых людей за последние несколько десятилетий и продолжающиеся сегодня, увеличивают распространение ВПЧ и его онкогенных версий. Есть и другие второстепенные факторы риска, связанные с раком полости рта, но , а не , участвуют в их развитии. К ним относятся красный плоский лишай, воспалительное заболевание мягких тканей полости рта и генетическая предрасположенность.Подробнее о ВПЧ и раке полости рта
Подробнее о вирусах и всех видах рака
Есть исследования, которые показывают, что диета с низким содержанием фруктов и овощей может быть фактором риска, и что, наоборот, диета с высоким содержанием этих продуктов может иметь защитное значение от многих типов рака. Подробнее о питании и раке Очевидно, что рак — это очень сложная группа заболеваний, и диету нельзя рассматривать как отдельный причинный фактор для инициирования каскада клеточных событий, которые изменяют клетку от нормальной к злокачественной.
Возможные признаки и симптомы
Одна из настоящих опасностей этого рака заключается в том, что на ранних стадиях он может остаться незамеченным. Это может быть безболезненно, и небольшие физические изменения могут быть очевидными. Хорошая новость заключается в том, что ваш врач или стоматолог во многих случаях может увидеть или почувствовать предшествующие тканевые изменения или реальный рак, пока он еще очень мал или находится на самых ранних стадиях. Подробнее о стадиях рака. Это может быть белое или красное пятно ткани во рту или небольшая затвердевшая язва, которая выглядит как обычная язвенная болезнь.Поскольку во рту очень много доброкачественных изменений тканей, а некоторые вещи, такие простые, как укус на внутренней стороне щеки, могут имитировать вид опасного изменения ткани, важно, чтобы любая болезненная или обесцвеченная область ваш рот, , который не заживает в течение 14 дней, осмотрел профессионал. Другие симптомы включают: безболезненное уплотнение или образование, которое может ощущаться во рту или на шее, боль или затруднение при глотании, разговоре или жевании, любые бородавчатые образования, хрипота, которая сохраняется в течение длительного времени, или любое онемение в области рта / лица.Односторонняя стойкая боль в ухе также может быть предупреждающим знаком.
За исключением губ, которые больше не являются основным местом возникновения, наиболее частыми областями развития рака полости рта в передней (передней) части рта являются язык и дно рта. У людей, употребляющих жевательный табак, они могут развиваться в борозде между губой или щекой и мягкими тканями (деснами), покрывающими нижнюю челюсть (нижнюю челюсть), где табачная пробка постоянно удерживается. Есть также небольшое количество видов рака, уникальных для слюнных желез, а также очень опасная меланома.Хотя их частота меньше, чем у других видов рака полости рта, они составляют небольшой процент от общей заболеваемости. В США рак твердого неба — редкость, хотя и известная. Основание языка в задней части рта, ротоглотка (задняя стенка глотки) и столбы миндалин, а также крипта миндалин и сама миндалина — это другие места, где он сейчас встречается чаще, особенно у молодых некурящих людей. Если ваш стоматолог или врач решат, что область является подозрительной, единственный способ точно узнать, является ли это чем-то опасным, — это сделать биопсию этой области.Это не больно, недорого и занимает мало времени. Важно как можно раньше поставить точный диагноз. Возможно, ваш стоматолог или врач направят вас к специалисту для проведения биопсии. Это не повод для беспокойства, это нормальная часть обращения, которое происходит между врачами разных специальностей. Подробнее о биопсии и диагностике
Узнайте, как пройти обычный осмотр ротовой полости и необходимые инструменты, на веб-сайте «Проверьте свой рот».
Как развивается рак полости рта
Мы знаем, что все виды рака (неопластические трансформации) возникают в результате изменений (мутаций) генов, контролирующих поведение клеток. Мутировавшие гены могут привести к тому, что клетка будет расти и размножаться с неконтролируемой скоростью, неспособна восстанавливать повреждение ДНК внутри себя или отказывается самоуничтожаться или умирать (апоптоз). Чтобы превратить клетку в злокачественную, требуется более одной мутации. Определенные классы генов необходимо мутировать несколько раз, чтобы в результате образовалась неопластическая клетка, которая затем неконтролируемо растет.Когда клетка действительно мутирует до этого момента, она способна передавать мутации всему своему потомству при делении. Генетические ошибки случайно происходят каждый день в процессе замены миллиардов клеток нашим телом. Помимо этих случайных явлений, генетические ошибки могут передаваться по наследству, быть вызваны вирусами или развиваться в результате воздействия химических веществ или радиации. В нашем организме обычно есть механизмы, которые разрушают эти аномальные клетки. Сейчас мы выясняем некоторые причины, по которым этого не происходит и возникают раковые заболевания.
Лечение
После постановки окончательного диагноза и постановки рака можно начинать лечение. Лечение рака полости рта — это в идеале междисциплинарный подход, включающий усилия хирургов, онкологов-радиологов, онкологов-химиотерапевтов, практикующих стоматологов, диетологов, а также специалистов по реабилитации и восстановлению. Фактические лечебные методы лечения обычно представляют собой химиотерапию с одновременным облучением, иногда в сочетании с хирургическим вмешательством.Химиотерапия, способная убивать раковые клетки, в настоящее время не используется в качестве монотерапии рака полости рта. Это мощный компонент лечения, добавленный для уменьшения возможности метастазирования, сенсибилизации злокачественных клеток к радиации, уменьшения размера любого злокачественного новообразования до операции или для тех пациентов, у которых подтверждены отдаленные метастазы заболевания.
Подробнее о метастазах рака
До начала лечебного лечения, вероятно, будут удовлетворены другие потребности в области гигиены полости рта.Цель — снизить вероятность развития посттерапевтических осложнений. Зубы с плохим прогнозом из-за проблем с пародонтом, кариеса и т. Д. Могут быть удалены. Важно избегать постлучевой хирургической операции, поскольку иногда она может вызвать остеонекроз — состояние, которое может развиться, когда ткань, поврежденная радиацией, обнажает подлежащую кость и остается хронически незаживающей. Облученная кость, которая потеряла способность эффективно восстанавливаться из-за уменьшенного кровоснабжения, может создать хроническую ситуацию, которую трудно вылечить.По возможности следует избегать новых удалений или других стоматологических операций после лечения, а при необходимости их проводить только кто-то, кто работает в тандеме с вашей бригадой лечения рака и знаком с уникальными потребностями пациентов, подвергшихся облучению. Перед началом лечения, вероятно, также будет проведена тщательная профилактика или очистка.
Переносится ли пациенту хирургическое вмешательство, лучевая терапия и хирургическое вмешательство или лучевая терапия, хирургическая операция или химиотерапия, зависит от стадии развития рака.Каждый случай индивидуален. Подробнее о лучевой терапии, хирургии, химиотерапии, иммунотерапии и таргетной терапии. Пациенты с раком, пролеченные на ранних стадиях, могут иметь незначительное обезображивание после лечения. Для тех, у кого рак обнаружен на более поздней стадии, результаты хирургического удаления болезни могут потребовать реконструкции частей их ротовой полости или черт лица. Может потребоваться дополнительная терапия для улучшения речи, пережевывания и глотания пищи, проблем, связанных с отсутствием функции слюны, а также для изготовления зубных или лицевых протезов.
Чрезвычайно подробный обзор рака полости рта во всех отношениях.
Биотерапия и текущие исследования
Каждая фаза развития рака потенциально открывает путь к поиску нового метода лечения. Исследования этих механизмов привели к новым открытиям в методах лечения, основанных на молекулах и генах, участвующих в процессе рака. Апоптоз (нормальная запрограммированная смерть и замена клеток), ингибиторы ангиогенеза, генетические «коктейли», ингредиенты которых могут стимулировать активность иммунной системы, специфичную для конкретной опухоли, ингибиторы иммунных контрольных точек, которые позволяют иммунной системе атаковать рак, ранее игнорировавшийся, CAR T- клеточная терапия, ингибиторы EGFR, вирусы, которые убивают только определенные раковые клетки, и методы, которые позволят заменить поврежденный ген супрессора опухолей p53, все в настоящее время исследуются.Вполне возможно, что в течение нашей жизни мы увидим способы лечения рака на основе этого продолжающегося исследования. Таргетные методы лечения, такие как использование моноклональных антител, теперь являются одобренными FDA дополнительными препаратами для борьбы с раком головы и шеи. Подробнее о таргетной терапии
Химиопрофилактика
В конечном итоге конечной целью является профилактика рака и рецидивов. Эти ссылки приведут вас к текущим взглядам на эту тему.
Профилактика рака: сильная наука и настоящая медицина
.
 Полость рта включает в себя рот и язык. Ротоглотка включает в себя середину горла, от миндалин до кончика голосового аппарата.
Полость рта включает в себя рот и язык. Ротоглотка включает в себя середину горла, от миндалин до кончика голосового аппарата.