Симптомы и лечение хламидийной пневмонии
Симптомы и лечение хламидийной пневмонии
- Обновлено: 07.07.2016 09:11
- Опубликовано: 07.07.2016 09:11
Хламидийная пневмония может быть вызвана несколькими видами микроорганизмов, которые вызывают различные проявления у детей и взрослых. Наиболее часто в патогенезе участвуют хламидия пневмония (Chlamydia pneumoniae) или хламидофила пневмония (Сhlamidophila).
Особенности паразитирования хламидии в организме человека.
Хламидии – внутриклеточные паразиты, не способные существовать вне клетки хозяина. Передаются воздушно капельным путем.
Chlamydia pneumoniae вызывает заболевания верхних дыхательных путей и воспаление легких у детей. Обсуждается вопрос о возможности влияния данного возбудителя на возникновение бронхиальной астмы и аутоиммунных заболеваний.
Симптомы данной атипичной формы.
Клинические симптомы у детей наиболее часто развиваются с явлений острой вирусной инфекции. Хламидийная пневмония относится к атипичным формам, и вначале маскируются под следующие заболевания: фарингит; ринит; ларингит; синусит; бронхит; отит.
На этом фоне появляются симптомы: повышение температуры тела, недомогание, боль в мышцах, слабость, ознобы не характерны. Настораживать должен сухой приступообразный кашель, переходящий в продуктивный с небольшим количеством слизисто-гнойной мокроты. Неяркие симптомы часто затрудняют диагностику пневмонии, что не позволяет начать своевременное лечение.
Инфкция у детей и новорожденных.
У детей до 6 месяцев хламидиоз пневмония передается «вертикально» от зараженной матери внутриутробно или при прохождении по родовым путям. Симптомы заражения сочетают в себе проявления конъюнктивита с воспалением верхних дыхательных путей.
Респираторные инфекции при микоплазмозе пневмония.
Хотя Mycoplasma pneumoniae известна в первую очередь как возбудитель атипичной пневмонии, вызванная ею инфекция чаще всего протекает как микоплазменный трахеобронхит. Больные жалуются на боль в горле, головную боль, озноб, насморк, недомогание. Слизистая зева при микоплазменном трахеобронхите гиперемирована; шейные лимфоузлы, как правило, не увеличены. Возможными осложнениями микоплазменного трахеобронхита могут являться — менингит и отит.
Тяжесть вызванных Mycoplasma pneumoniae инфекций колеблется в довольно широких пределах. Тяжелая микоплазменная пневмония может возникать у здоровых до того детей и взрослых любого возраста. Микоплазменная пневмония способна осложниться абсцессом легкого, пневматоцеле, поражением целой доли, дыхательной недостаточностью, плевритом. Небольшой плевральный выпот выявляется при микоплазменной пневмонии у 20% больных.
Иногда Mycoplasma pneumoniae обнаруживается в выпоте и при относительно тяжелом плеврите — микоплазменном плеврите.
.
Внелегочные осложнения микоплазмоза.
Поражения нервной системы при микоплазмозе.
Описаны менингоэнцефалит, серозный менингит, энцефалит, восходящий паралич и поперечный миелит, вызванные микоплазмозом.При поражении центральной нервной системы (ЦНС) микоплазмозом — выздоровление обычно идет медленно, а в некоторых случаях наблюдаются остаточные дефекты. Возможны смертельные исходы. Попытки доказать проникновение Mycoplasma pneumoniae в ЦНС долгое время терпели неудачу
Кардиологические осложнения при микоплазмозе считаются редкими, но истинная их частота неизвестна. Дисфункция миокарда часто обусловлена гемолитической анемией; иногда картина напоминает инфаркт миокарда. При микоплазмозе описаны перикардит, миокардит, гемоперикард, сердечная недостаточность, полная АВ-блокада. Выраженные изменения ЭКГ иногда обнаруживают в отсутствие жалоб. Иногда Mycoplasma pneumoniae бывает единственным микроорганизмом, выделяемым из перикардиального выпота и ткани сердца.
Выраженные изменения ЭКГ иногда обнаруживают в отсутствие жалоб. Иногда Mycoplasma pneumoniae бывает единственным микроорганизмом, выделяемым из перикардиального выпота и ткани сердца.
Поражение кожи и слизистых при микоплазмозе.
Поражение кожи и слизистых встречается у 25% больных микоплазмозом. Чаще всего это – пятнисто-папулезная и везикулярная сыпь. У половины больных с сыпью наблюдаются афты и конъюнктивит. Во многих случаях в мазках из зева и содержимом везикул обнаруживают Mycoplasma pneumoniae.
Суставные проявления микоплазмоза.
Иногда при микоплазмозе наблюдается поражение суставов, в том числе артрит. Описан синдром, напоминающий ревматическую атаку.
Другие осложнения микоплазмоза.
Приблизительно у 25% больных вызванные Mycoplasma pneumoniae инфекции сопровождаются тошнотой, рвотой или поносом.
Определение антител классов G (IgG) к хламидии пневмонии (Chlamydia pneumoniae) в крови
АНМО «Ставропольский краевой клинический консультативно-диагностический центр»:
355017, г. Ставрополь, ул. Ленина 304
Ставрополь, ул. Ленина 304 (8652) 951-951, (8652) 35-61-49 (факс)
(8652) 951-951, (8652) 31-51-51 (справочная служба)
Посмотреть подробнееОбособленное подразделение «Диагностический центр на Западном обходе»:
355029 г. Ставрополь, ул. Западный обход, 64(8652) 951-951, (8652) 31-51-51 (контактный телефон)
(8652) 31-68-89 (факс)
Посмотреть подробнееКлиника семейного врача:
355017 г. Ставрополь, пр. К. Маркса, 110 (за ЦУМом)(8652) 951-951, (8652) 31-51-51 (контактный телефон)
(8652) 31-50-60 (регистратура)
Посмотреть подробнееНевинномысский филиал:
357107, г. Невинномысск, ул. Низяева 1(86554) 95-777, 8-962-400-57-10 (регистратура)
Обособленное структурное подразделение в г. Черкесске :
Черкесске :
8(8782) 26-48-02, +7-988-700-81-06 (контактные телефоны)
Посмотреть подробнееОбособленное структурное подразделение в г. Элисте :
358000, г. Элиста, ул. Республиканская, 478(989) 735-42-07 (контактные телефоны)
Посмотреть подробнее(8652) 951-951, (8652) 35-61-49 (факс)
(8652) 951-951, (8652) 31-51-51 (справочная служба)
Посмотреть подробнееОбособленное структурное подразделение на ул. Савченко, 38 корп. 9:
355021, г. Ставрополь, ул. Савченко, 38, корп. 98 (8652) 316-847 (контактный телефон)
Посмотреть подробнееОбособленное структурное подразделение на ул.
8(8652) 951-943 (контактный телефон)
Посмотреть подробнееОбособленное структурное подразделение в г. Михайловске:
358000, г. Михайловск, ул. Ленина, 201 (в новом жилом районе «Акварель»).8(988) 099-15-55 (контактный телефон)
Посмотреть подробнееChlamydophila ( Chlamydia ) pneumonia. Медико-биологический Союз
Chlamydophila ( Chlamydia ) pneumonia
Манзенюк И. Н., Воробьева М. С., Государственный научно-исследовательский институт стандартизации и контроля медицинских иммунобиологических препаратов им. Л. А. Тарасевича
Chlamydia pneumonia — патогенный облигатный внутриклеточный грамотрицательный микроорганизм, элементарные тельца которого при электронномикроскопическом исследовании имеют типичную грушеподобную форму, в отличие от округлых элементарных телец других видов хламидий. Штамм Chlamydia pneumonia получил название в результате слияния буквенных обозначений двух первичных изолятов TW-183 (изолирован из глаза ребенка в 1965 г. на Тайване) и AR-39 (идентифицирован из респираторного тракта в 1983 г. в США). Штаммы TWAR (Taiwan acute respiratory agent) выявлены только у человека, и изначально описывались как штаммы С. psittaci, но последующие исследования, в частности на молекулярном уровне, позволили уточнить классификацию TWAR-штамма, который был выделен в отдельный вид.
Штамм Chlamydia pneumonia получил название в результате слияния буквенных обозначений двух первичных изолятов TW-183 (изолирован из глаза ребенка в 1965 г. на Тайване) и AR-39 (идентифицирован из респираторного тракта в 1983 г. в США). Штаммы TWAR (Taiwan acute respiratory agent) выявлены только у человека, и изначально описывались как штаммы С. psittaci, но последующие исследования, в частности на молекулярном уровне, позволили уточнить классификацию TWAR-штамма, который был выделен в отдельный вид.
Рис. 1. Цикл размножения хламидий.
Таксономия
Еще недавно С. pneumonia входила в порядок Chlamydiales, семейство Chlamydiaceae, род Chlamydia, который включал виды С. pneumonia, С. psittaci, С. trachomatis, С. percorum, и включала один серотип TWAR. Фундаментальные исследования в области систематики и генетики хламидий, проведенные Everett и др. [1, 2], полный сиквенс геномов С. trachomatis и С. pneumonia, анализ рибосомального оперона и открытие облигатных внутриклеточных микроорганизмов, имеющих схожий с хламидиями цикл развития, позволили уточнить таксономическое положение ряда представителей порядка Chlamydiales и предложить новую классификацию хламидий. Использование различных методов анализа — биохимического, серологических реакций, ДНК-анализа, сравнения протеиновых профилей, — а также различия в морфологии позволили по-новому разделить виды внутри рода хламидий. Из данных, представленных в таблице 1, видно, что внесены поправки в семейство Chlamydiaceae, которое теперь включает два рода собственно Chlamydia и новый род Chlamydophila, в который перешли виды Chlamydia pecorum, Chlamydia pneumonia и Chlamydia psittaci.
Использование различных методов анализа — биохимического, серологических реакций, ДНК-анализа, сравнения протеиновых профилей, — а также различия в морфологии позволили по-новому разделить виды внутри рода хламидий. Из данных, представленных в таблице 1, видно, что внесены поправки в семейство Chlamydiaceae, которое теперь включает два рода собственно Chlamydia и новый род Chlamydophila, в который перешли виды Chlamydia pecorum, Chlamydia pneumonia и Chlamydia psittaci.
ДНК-анализ последовательностей гена ompA указывает, что аминокислотный состав последовательностей основного белка наружной мембраны (МОМР) варьирует у всех штаммов С. pneumonia в пределах < 6 %, в то время как у других видов хламидий — >30 %.
Генетические (анализ ДНК-последовательностей генов рРНК, kdtA (KDO-трансфераза, 60 кДа-белка, богатого цистеином) и биологические различия позволили выделить биовары внутри вида С. pneumonia. Он объединяет три биовара — TWAR, Koala и Equine. Эталонным штаммом для С. pneumonia является TW-183T.
Эталонным штаммом для С. pneumonia является TW-183T.
Умеренно патогенные изоляты биовара Koala выделены от сумчатых животных (Phascolarctos cinereus) в Австралии из глаз и мочевыводящих путей.
Биовар Equine вызывает асимптоматическую инфекцию и включает только один штамм N16, изолированный из респираторного тракта лошадей.
Широкий спектр заболеваний и синдромов, многие из которых имеют хроническое течение, связывают именно с С. pneumonia. Первоначально штаммы С. pneumonia были изолированы как респираторные патогены от людей. В дальнейшем были выделены штаммы С. pneumonia от коал и лошадей, по своим генетическим и антигенным характеристикам похожие на человеческие изоляты.
Заболеваемость данным патогеном во всем мире высокая, и большинство людей на протяжении жизни встречается с возбудителем неоднократно. С. pneumonia передается от человека к человеку воздушно-капельным путем. Отсутствуют случаи заражения от животных и птиц. Отмечено, что антитела к С. pneumonia у мужчин наблюдаются чаще, чем у женщин, в то время как у женщин преобладают антитела к С. trachomatis. Имеются некоторые сведения о периодичности инфекции: двух-трехлетний период увеличения числа заболевших инфекциями, вызванными С. pneumonia, с последующим четырех — пятилетним периодом снижения количества больных [З].
Отмечено, что антитела к С. pneumonia у мужчин наблюдаются чаще, чем у женщин, в то время как у женщин преобладают антитела к С. trachomatis. Имеются некоторые сведения о периодичности инфекции: двух-трехлетний период увеличения числа заболевших инфекциями, вызванными С. pneumonia, с последующим четырех — пятилетним периодом снижения количества больных [З].
Молекулярно-биологические характеристики Chlamydia pneumonia
Полностью секвенирован геном С. pneumonia (штаммы CWL-029 и AR-39), размер его составляет 1 230.230 т. п. н. для CWL-029 и 1 229.3 т. п. н. (1 052 гена) для AR-39. Он оказался больше ранее секвенированного генома С. trachomatis. Сравнение секвенированных геномов штаммов CWL-029 и AR-39 показало их индентичность на 99.9 %, однако AR-39 содержит новый одноцепочечный ДНК-бактериофаг phiCPAR39 (4.2 т. п. н.) [4]. Рестрикционный анализ генома С. pneumonia показал, что каждая из рестриктаз Not1 и Asс1 гидролизует геном на два фрагмента, а совместная рестрикция ими образует три фрагмента. Аналогичную картину дает гидролиз хромосомной ДНК С. pneumonia рестриктазой Sfi [5]. Гомология ДНК С. trachomatis и С. pneumonia составляет 10 %. Изоляты С. pneumonia, выделенные от людей, не содержат плазмид, в то время как штамм N16 С. pneumonia, выделенный от лошадей, содержит криптическую плазмиду (рСрпЕ1) размером 7.362 т. п. н. Данная плазмида полностью секвенирована, создана ее физическая и генетическая карты [б].
Аналогичную картину дает гидролиз хромосомной ДНК С. pneumonia рестриктазой Sfi [5]. Гомология ДНК С. trachomatis и С. pneumonia составляет 10 %. Изоляты С. pneumonia, выделенные от людей, не содержат плазмид, в то время как штамм N16 С. pneumonia, выделенный от лошадей, содержит криптическую плазмиду (рСрпЕ1) размером 7.362 т. п. н. Данная плазмида полностью секвенирована, создана ее физическая и генетическая карты [б].
Штаммы С. pneumonia содержит липополисахарид, МОМР, отр-2, отр-3, а также набор белков 90-100 кДа. Последние объединены в семейство протеинов, идентифицированных как Pomps или Pmps (полиморфные мембранные протеины). Большинство Pomps-генов было открыто при сиквенсе генома С. pneumonia и представляют собой гетерогенную группу из 21 гена с некоторыми общими характеристиками. В то же время протеиновый профиль С. pneumonia отличается от других представителей родов Chlamydia и Chlamydophila. Сравнительная оценка протеиновых полос различных штаммов С. pneumonia показала их идентичность, различия наблюдались лишь в количественных пропорциях.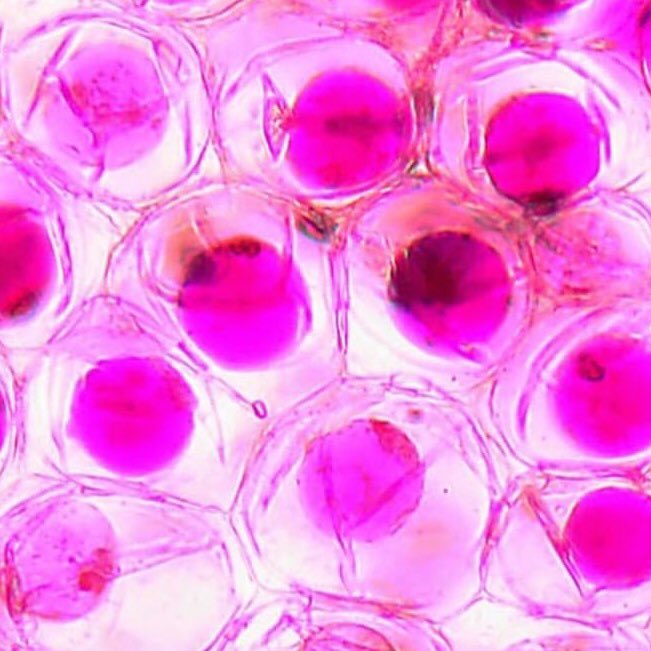 Все штаммы выявили наибольшее количество протеинов с молекулярным весом 98, 70, 54, 40 и 30 кДа. В иммуноблоте показано наличие у всех штаммов видоспецифическго протеина 54 кДа, играющего важную роль в иммунном ответе, а также показана реакция с 43 и 46 кДа протеинами [7]. В Вестерн-блоте также показано, что МОМР-белокне является иммуногенным для С. pneumonia, не связан с иммунным ответом в организме человека и в отличие от С. trachomatis и С. psittaci не имеет поверхностной локализации и тесно связан с ЛПС. Возможно, что иммуногенный протеин 98 кДа закрывает МОМР-белок [8, 9].
Все штаммы выявили наибольшее количество протеинов с молекулярным весом 98, 70, 54, 40 и 30 кДа. В иммуноблоте показано наличие у всех штаммов видоспецифическго протеина 54 кДа, играющего важную роль в иммунном ответе, а также показана реакция с 43 и 46 кДа протеинами [7]. В Вестерн-блоте также показано, что МОМР-белокне является иммуногенным для С. pneumonia, не связан с иммунным ответом в организме человека и в отличие от С. trachomatis и С. psittaci не имеет поверхностной локализации и тесно связан с ЛПС. Возможно, что иммуногенный протеин 98 кДа закрывает МОМР-белок [8, 9].
С. pneumonia обладает системой секретирования III типа. Эта система является вирулентно ассоциированным механизмом, который не только осуществляет экспорт белков из грамотрицательных бактерий, но и усиливает их проникновение в цитозоль эукариотной клетки, в которой локализуется возбудитель, позволяя ему инвазировать хозяйскую клетку и разрушать ее защитные механизмы. Эта система известна для многих грамотрицательных патогенов растений и животных, таких как Yersinia, Shigella, Salmonella, энтеропатогенных Е. coli и Pseudomonas и т. д. Предполагают возможность секретирования данной системой в клетку хозяина фактора, ингибирующего апоптоз (запрограмированную гибель) этой клетки [10]. У хламидий в III тип секретирования вовлечены по крайней мере четыре не связанных геномных локуса, организованных в три геномных кластера, с которых транскрибируется полицистронная мРНК [11].
coli и Pseudomonas и т. д. Предполагают возможность секретирования данной системой в клетку хозяина фактора, ингибирующего апоптоз (запрограмированную гибель) этой клетки [10]. У хламидий в III тип секретирования вовлечены по крайней мере четыре не связанных геномных локуса, организованных в три геномных кластера, с которых транскрибируется полицистронная мРНК [11].
Клиника
Хламидии являются причиной разнообразной патологии у человека, которая включает не только хорошо известные и типичные для хламидийной инфекции трахому и урогенитальные заболевания (С. trachomatis), пневмонии (С. psittaci), инфекции верхнего респираторного тракта (С. pneumonia). Список заболеваний, которые, возможно, ассоциируются с хламидийной инфекцией, обширен и постоянно растет. Он включает острые и хронические заболевания типа астмы, рака легкого, артритов, саркоидоза и т. д. (таблица 2).
Таблица 2. Инфекционная патология у человека, вызываемая или ассоциируемая (в качестве кофактора) с Chlamydia pneumonia.
|
Патология респираторного тракта |
Патология сердечно-сосудистой системы |
Патология центральной нервной системы |
Патология других органов и тканей организма |
|
Синуситы Фарингиты Отиты Бронхиты Пневмонии Эмфизема Рак легкого Хроническая обструктивная легочная патология |
Острый инфаркт миокарда Реактивные васкулиты Аневризма Атеростклероз |
Болезнь Альцгеймера Множественный склероз Энцефалиты Менингоэнцефалиты Миелиты |
Реактивные артриты Саркоидоз Эритрема узловатая Острый лимфаденит Диабетическая нефропатия |
Недавно открытые хламидоподобные микроорганизмы (Simkaniae negevensis), образовавшие новое семейство в порядке Chlamydiales Simkaniaceae, вызывают пневмонии у взрослых и бронхиолиты у детей [12].
Патология респираторного тракта
Первичная связь С. pneumonia с разнообразной патологией верхних и нижних дыхательных путей у человека была установлена 10 лет назад. Данный возбудитель является важным этиологическим агентом респираторных заболеваний среди молодых людей, у которых инфекция часто протекает бессимптомно или в легкой форме и в ряде случаев остается нераспознанной. С. pneumonia является также причиной серьезных заболеваний дыхательного тракта у пожилых людей (пневмонии и бронхиты с выраженной симптоматикой). На долю этого вида хламидий приходится примерно 25 % всех случаев респираторных заболеваний, включая до 10 % эндемических пневмоний (до 50 % эпидемических), 5 % случаев острых и хронических бронхитов и 2 % фарингитов. Инкубационный период составляет приблизительно 21-30 дней [13, 14]. Возбудитель вызывает хронические риниты, фарингиты, острые отиты среднего уха [15], синуситы, гриппоподобные заболевания, обнаруживается в аденоидах у детей. В странах Европы и США инфекции, вызванные С. pneumonia, обычно не встречаются у детей в возрасте до 5 лет, но с высокой частотой роста (5-10 % ежегодно) выявляются у детей в возрасте 5-15 лет, а затем с более низкой частотой нарастания (1-2 % ежегодно) продолжает увеличиваться во всех возрастных группах. Антитела от первой инфекции сохраняются в течение 3-5 лет. К 20 годам более 50 % населения развитых стран имеют антитела к данному возбудителю. Прирост количества антител продолжается в течение всей жизни, достигая в пожилом возрасте до 80 % среди мужчин и до 70 % среди женщин. Возможно, это связано с хронизацией инфекции. Так, японские исследователи показали, что более часто инфекция встречается у подростков. Распространенность антител к С. pneumonia среди населения в Японии в среднем составляет 58.1 % [16]. Возможно, что в ряде случаев они свидетельствуют о наличии хронической инфекции [17, 18]. Титры антител к инфекциям, вызванным С. pneumonia, часто значительно превышают титры антител к инфекциям, обусловленным С.
В странах Европы и США инфекции, вызванные С. pneumonia, обычно не встречаются у детей в возрасте до 5 лет, но с высокой частотой роста (5-10 % ежегодно) выявляются у детей в возрасте 5-15 лет, а затем с более низкой частотой нарастания (1-2 % ежегодно) продолжает увеличиваться во всех возрастных группах. Антитела от первой инфекции сохраняются в течение 3-5 лет. К 20 годам более 50 % населения развитых стран имеют антитела к данному возбудителю. Прирост количества антител продолжается в течение всей жизни, достигая в пожилом возрасте до 80 % среди мужчин и до 70 % среди женщин. Возможно, это связано с хронизацией инфекции. Так, японские исследователи показали, что более часто инфекция встречается у подростков. Распространенность антител к С. pneumonia среди населения в Японии в среднем составляет 58.1 % [16]. Возможно, что в ряде случаев они свидетельствуют о наличии хронической инфекции [17, 18]. Титры антител к инфекциям, вызванным С. pneumonia, часто значительно превышают титры антител к инфекциям, обусловленным С. trachomatis. Антитела к C.trachomatis выявляются в сексуально активном возрасте и не превышают 20 % от общего количества населения. В менее развитых странах Азии и Африки TWAR-инфекция наблюдается и у детей в возрасте до 5 лет [13]. Предполагается, что каждый человек в течение жизни инфицируется этим микроорганизмом, многие даже неоднократно. Финскими исследователями показано, что инфекция, вызванная TWAR-штаммами, обуславливает менее тяжелое течение заболевания при последующей реинфекции [14]. Вопрос развития иммунитета к данному возбудителю спорный и требует дальнейшего изучения. Необъяснимым остается и факт более высокого выявления антител у мужчин старше 20 лет по сравнению с женщинами [14].
trachomatis. Антитела к C.trachomatis выявляются в сексуально активном возрасте и не превышают 20 % от общего количества населения. В менее развитых странах Азии и Африки TWAR-инфекция наблюдается и у детей в возрасте до 5 лет [13]. Предполагается, что каждый человек в течение жизни инфицируется этим микроорганизмом, многие даже неоднократно. Финскими исследователями показано, что инфекция, вызванная TWAR-штаммами, обуславливает менее тяжелое течение заболевания при последующей реинфекции [14]. Вопрос развития иммунитета к данному возбудителю спорный и требует дальнейшего изучения. Необъяснимым остается и факт более высокого выявления антител у мужчин старше 20 лет по сравнению с женщинами [14].
Важная особенность данного возбудителя — способность к персистенции. Кроме того, он способен вызывать патологию респираторного тракта в виде микст-инфекции — в ассоциации с другими респираторными патогенами [14]. С. pneumonia — потенциальный индуктор цитокинов; обладая биологически активным липополисахаридом, может индуцировать хроническую инфекцию в альвеолярных макрофагах, полученных методом in vitro. Причем включения, содержащие размножающийся патоген, способны сохраняться до 120 часов. In vitro на клеточных культурах С. pneumonia стимулирует продукцию бета-интерлейкина-1, гамма-интерферона и альфа-TNF, а также интерлейкина-8 и интерлейкина-6 [19]. Альвеолярные макрофаги отвечают на инфекцию окислительными реакциями, продукцией альфа-TNF, бета-интерпейкина-1 и интерлейкина-8. Установлено, что антимикробный ответ медиаторов не может уничтожить возбудителя и задержать его репликацию, но может усилить местный воспалительный ответ на С. pneumonia [20]. Попадая в кровь, возбудитель способен вызывать разнообразную экстрапульмональную патологию, становясь причиной кардитов, артритов и т. д.
Причем включения, содержащие размножающийся патоген, способны сохраняться до 120 часов. In vitro на клеточных культурах С. pneumonia стимулирует продукцию бета-интерлейкина-1, гамма-интерферона и альфа-TNF, а также интерлейкина-8 и интерлейкина-6 [19]. Альвеолярные макрофаги отвечают на инфекцию окислительными реакциями, продукцией альфа-TNF, бета-интерпейкина-1 и интерлейкина-8. Установлено, что антимикробный ответ медиаторов не может уничтожить возбудителя и задержать его репликацию, но может усилить местный воспалительный ответ на С. pneumonia [20]. Попадая в кровь, возбудитель способен вызывать разнообразную экстрапульмональную патологию, становясь причиной кардитов, артритов и т. д.
Рис. 2. Циклы развития Chlamidia.
С. pneumonia связывают с хронической ооструктивнои легочной патологией (ХОЛП), развитием эмфиземы легкого и астмы. Исследования с помощью ПЦР-анализа и выявления IgA (как маркера хронической инфекции) показали присутствие возбудителя в большинстве случаев хронической легочной инфекции.
Острая инфекция респираторного тракта, вызываемая С. pneumonia, может привести к развитию хронического астматического процесса из-за дальнейшей возможной хронизации инфекционного процесса и продуцирования в легких хламидийных компонентов, обладающих аллергенным действием [17]. Так, отмечено, что у взрослых в семь раз выше риск развития астмы после перенесенной инфекции, вызванной С. pneumonia. Ряд исследователей рекомендуют при диагностированной хронической астме провести обследование на предмет возможного хронического инфицирования С. pneumonia [21, 22]. В 18 контролируемых эпидемиологических исследованиях (более 4000 случаев) с использованием ПЦР-анализа, иммунофлюоресцентного метода для выявления антигена, ИФА для выявления специфических секреторных IgA (sIgA) и/или специфических сывороточных IgA, IgG и т. д. связь между инфицированием С. pneumonia и астмой обнаружена в 15 исследованиях. В восьми сообщениях и в описании еще 13 случаев инфекции С. pneumonia (всего более 100 больных) отмечено значительное улучшение, а в ряде случаев полное исчезновение симптомов астмы после пролонгированной антибиотикотерапии, направленной против С. pneumonia. Связь С. pneumonia с ХОЛП (более 1 000 случаев) была отмечена в пяти сообщениях из шести [13, 23]. У более чем 50 % детей, страдающих астмой, выявляются специфические IgE. Больные астмой имеют более высокие уровни IgA анти-Нsp60, чем больные с сердечно-сосудистой патологией. Полагают, что данные иммуноглобулины могут служить маркером для астматического процесса, вызванного С. pneumonia. Необходимы широкомасштабные эпидемиологические исследования для изучения роли этого патогена в патогенезе астмы.
pneumonia. Связь С. pneumonia с ХОЛП (более 1 000 случаев) была отмечена в пяти сообщениях из шести [13, 23]. У более чем 50 % детей, страдающих астмой, выявляются специфические IgE. Больные астмой имеют более высокие уровни IgA анти-Нsp60, чем больные с сердечно-сосудистой патологией. Полагают, что данные иммуноглобулины могут служить маркером для астматического процесса, вызванного С. pneumonia. Необходимы широкомасштабные эпидемиологические исследования для изучения роли этого патогена в патогенезе астмы.
С. pneumonia (TWAR), как и Mycoplasma pneumoniae, Legionella spp., C. psittaci, Coxiella burnetti и другие патогены, вызывает у людей атипичные пневмонии, характеризующиеся бронхо-легочным поражением, а также наличием других системных органных поражений. Для инфекции характерно клиническое течение средней тяжести, но возможно и тяжелое, с летальным исходом. Тяжелое течение чаще наблюдается у пожилых людей и у лиц с хроническими заболеваниями сердечнососудистой системы и респираторного тракта. Описаны спорадические случаи, эпидемические (особенно в закрытых коллективах) и внутрибольничные вспышки. Финскими исследователям описаны эпидемические вспышки среди рекрутов, продолжавшиеся пять-семь месяцев [24]. Соотношение заболевших — 60-80 на 1 000 мужчин. В доэпидемический период заболеваемость пневмонией, вызванной С. pneumonia, оценивалась как 1 на 1 000 человек. В среднем инкубационный период составил 28 дней (21 день для семейных пар). Среди студентов, больных пневмонией, С. pneumonia выявляют в 12 % случаев. Кроме того, С. pneumonia способна вызывать заболевания нижних дыхательных путей у ВИЧ-инфицированных больных [25].
Описаны спорадические случаи, эпидемические (особенно в закрытых коллективах) и внутрибольничные вспышки. Финскими исследователям описаны эпидемические вспышки среди рекрутов, продолжавшиеся пять-семь месяцев [24]. Соотношение заболевших — 60-80 на 1 000 мужчин. В доэпидемический период заболеваемость пневмонией, вызванной С. pneumonia, оценивалась как 1 на 1 000 человек. В среднем инкубационный период составил 28 дней (21 день для семейных пар). Среди студентов, больных пневмонией, С. pneumonia выявляют в 12 % случаев. Кроме того, С. pneumonia способна вызывать заболевания нижних дыхательных путей у ВИЧ-инфицированных больных [25].
Не исключено, что С. pneumonia отягощает патогенез хронического бронхита. Следует отметить, что в ряде случаев интенсивный курс лечения, направленный на удаление возбудителя, стабилизирует течение заболевания. При хроническом бронхите выявление IgG не всегда является достоверным маркером, т. к. инфекция диагностируется менее чем в 10% случаев. Выявление специфических IgA в сыворотке, наличие специфических секреторных IgA и ДНК в слюне свидетельствует о возможности присутствия данного возбудителя в легких более чем у 50% больных хроническим бронхитом, особенно у курильщиков, снижение клеточного иммунитета которых способствует инфицированию С. pneumonia [17].
Выявление специфических IgA в сыворотке, наличие специфических секреторных IgA и ДНК в слюне свидетельствует о возможности присутствия данного возбудителя в легких более чем у 50% больных хроническим бронхитом, особенно у курильщиков, снижение клеточного иммунитета которых способствует инфицированию С. pneumonia [17].
Ряд исследователей отмечают, что инфекция, вызываемая С. pneumonia, достаточно часто выявляется у курящих больных раком легкого. Считают, что данный возбудитель может быть независимым фактором риска в развитии рака легкого. У курящих больных раком С. pneumonia диагностируется в 90% случаев. В результате иммуносупрессионного эффекта курения в ряде случаев на фоне хронического бронхита активизируется хроническая инфекция, вызываемая С. pneumonia. Специфические IgA обнаруживались значительно чаще в группе больных раком легкого, чем в контрольных группах, включающих группу здоровых и группу больных с сердечно-сосудистой патологией, а также лиц с таким фактором риска, как курение [26, 27].
Сердечно-сосудистая патология
Многочисленными исследованиями установлена связь хронической инфекции С. pneumonia как фактора риска с развитием сердечной патологии. Это подтверждается сероэпидемиологическими исследованиями, наличием белков данного возбудителя в циркулирующих иммунных комплексах и присутствием ЛПС-содержащих иммунных комплексов. Хроническая хламидийная инфекция кардиоваскулярной системы может быть связана с атеросклерозом, аневризмой аорты, острым инфарктом миокарда, с хронической сердечно-сосудистой патологией, миокардитами [28-33]. Японскими исследователями показана взаимосвязь между развитием гипертензии у людей и наличием инфекции, вызванной С. pneumonia [34]. Установлена высокая частота персистирования С. pneumonia в верхних отделах респираторного тракта у пациентов с ишемической болезнью сердца [35]. В то же время неясно, служит ли толчком к развитию болезни персистирующая инфекция или реинфекция [36]. Известно, что инфекция может воздействовать на липидный обмен. В отличие от пневмоний, вызванных другими возбудителями, при острой пневмонии, вызванной С pneumonia, отмечено снижение количества высоконасыщенных липопротеинов и увеличение триглицеридов [37]. Попытка связать наличие IgG к С. pneumonia и высокого уровня липопротеинов в крови с острыми мозговыми нарушениями не привела к успеху [38]. В отдельных работах показана возможная связь между атерогенным липидным профилем и наличием специфических антител к С. pneumonia. Возможно, изменения в липидном профиле могут лежать в основе связи С. pneumonia с ишемической болезнью сердца [39], что было продемонстрировано в случаях ангиографически подтвержденной ишемической болезни сердца [40]. Как показали исследования, сердечно-сосудистая патология, опосредованная С. pneumonia, индуцируется антигенной мимикрией возбудителя к специфическому протеину сердечной мышцы. Установлена гомология нуклеотидных последовательно-стей тяжелой цепи сердечного специфичного мышечного альфа-миозина с богатым цистеином мембранным протеином 60 кДа С.
В отличие от пневмоний, вызванных другими возбудителями, при острой пневмонии, вызванной С pneumonia, отмечено снижение количества высоконасыщенных липопротеинов и увеличение триглицеридов [37]. Попытка связать наличие IgG к С. pneumonia и высокого уровня липопротеинов в крови с острыми мозговыми нарушениями не привела к успеху [38]. В отдельных работах показана возможная связь между атерогенным липидным профилем и наличием специфических антител к С. pneumonia. Возможно, изменения в липидном профиле могут лежать в основе связи С. pneumonia с ишемической болезнью сердца [39], что было продемонстрировано в случаях ангиографически подтвержденной ишемической болезни сердца [40]. Как показали исследования, сердечно-сосудистая патология, опосредованная С. pneumonia, индуцируется антигенной мимикрией возбудителя к специфическому протеину сердечной мышцы. Установлена гомология нуклеотидных последовательно-стей тяжелой цепи сердечного специфичного мышечного альфа-миозина с богатым цистеином мембранным протеином 60 кДа С. pneumonia, что может индуцировать аутоиммунные процессы в сердечной патологии [41]. Установлено, что инфекция, вызываемая С. pneumonia, ведет к репрессии антикоагулянтного протеина — тромбомодулина на поверхности эндотелиальных клеток, выстилающих стенки сосудов. Нарушение гомеостаза эндотелия в ответ на инфекцию по отношению к прокоагулянтам может приводить к увеличению локального тромбообразования и коронарной болезни сердца [42].
pneumonia, что может индуцировать аутоиммунные процессы в сердечной патологии [41]. Установлено, что инфекция, вызываемая С. pneumonia, ведет к репрессии антикоагулянтного протеина — тромбомодулина на поверхности эндотелиальных клеток, выстилающих стенки сосудов. Нарушение гомеостаза эндотелия в ответ на инфекцию по отношению к прокоагулянтам может приводить к увеличению локального тромбообразования и коронарной болезни сердца [42].
Сероэпидемиологические исследования, проведенные в ряде индустриально развитых стран мира и основанные на исследовании специфических IgG и IgA, специфических иммунных комплексов, показали, что острый инфаркт миокарда у абсолютного большинства больных связан с сероконверсией против ЛПС-эпитопов С. pneumonia [43], что может быть следствием обострения хронической болезни, вызванной С. pneumonia [17] IgG1 является наиболее общим подклассом среди антител к ЛПС С. pneumonia [44]. У пациентов с острым инфарктом миокарда обнаруживаются более высокие показатели значений специфических IgA. Вместе с тем, необходимы более углубленные исследования, чтобы оценить роль внутриклеточных патогенов, прежде всего С. pneumonia, в развитии острых сердечнососудистых синдромов [45].
Вместе с тем, необходимы более углубленные исследования, чтобы оценить роль внутриклеточных патогенов, прежде всего С. pneumonia, в развитии острых сердечнососудистых синдромов [45].
Рис 3. Электронная микроскопия. Chlamidia pneumonia в коронарной артерии. Внутри пенистых клеток в ткани взятой ихз атеромы коронарной артерии эндосомы содержат грушевидные элементарные тельца C. Pneumonia (Cambell L.A. et al., 2001).
Из представленных выше данных следует, что необходимо проведение широкомасштабных клинических исследований, направленных на оценку эффективности применения антихламидийных антибиотиков в лечении ишемической сердечно-сосудистой патологии, с учетом возможной роли Chlamydia pneumonia в атерогенезе. Определенная связь этих факторов подтверждается многочисленными эпидемиологическими и гистологическими исследованиями, в том числе и на животных [46-51].
Три небольших пилотных испытания по изучению эффективности применения этиотропной терапии в лечении ишемической сердечно-сосудистой патологии уже были проведены. В двух из них была подтверждена положительная роль антибиотикотерапии в улучшении состояния пациентов с сердечно-сосудистой патологией, в одном исследовании положительный эффект не отмечен. Из-за небольшого числа пациентов, взятых в эти испытания, нельзя достоверно ответить, является ли применение антибиотикотерапии у больных с сердечно-сосудистой патологией удачной. В настоящее время продолжаются по крайней мере два подобных клинических испытания, которые могут дать ответ на вопрос: “может ли применение антибиотиков замедлить развитие коронарной патологии”. Это WIZARD-испыта-ния, спонсируемые “Pfizer Co”, и ACES-испытания, проводимые “National Heart Lung and Blood Institute”. В испытаниях участвуют 3500 — 4000 пациентов с доказанной сердечно-сосудистой патологией, которые наблюдаются на протяжении четырех лет с момента начала испытаний. В качестве антибиотика в обоих испытаниях используется азитромицин. В WIZARD-испытаниях пациенты получают 600 мг азитромицина и плацебо однократно в неделю в течение 3 месяцев.
В двух из них была подтверждена положительная роль антибиотикотерапии в улучшении состояния пациентов с сердечно-сосудистой патологией, в одном исследовании положительный эффект не отмечен. Из-за небольшого числа пациентов, взятых в эти испытания, нельзя достоверно ответить, является ли применение антибиотикотерапии у больных с сердечно-сосудистой патологией удачной. В настоящее время продолжаются по крайней мере два подобных клинических испытания, которые могут дать ответ на вопрос: “может ли применение антибиотиков замедлить развитие коронарной патологии”. Это WIZARD-испыта-ния, спонсируемые “Pfizer Co”, и ACES-испытания, проводимые “National Heart Lung and Blood Institute”. В испытаниях участвуют 3500 — 4000 пациентов с доказанной сердечно-сосудистой патологией, которые наблюдаются на протяжении четырех лет с момента начала испытаний. В качестве антибиотика в обоих испытаниях используется азитромицин. В WIZARD-испытаниях пациенты получают 600 мг азитромицина и плацебо однократно в неделю в течение 3 месяцев. В ACES-испытаниях лечение продолжается в течение года. Столь длительное лечение обусловлено трудностями в успешном лечении хронической хламидийной инфекции. Судить об эффективности лечения будут по количеству летальных случаев, обусловленных сердечнососудистой патологией, инфарктов миокарда в опытной и контрольной группах, показателях реконвалесценции, госпитализации и т. д. В то же время до получения окончательных результатов этих испытаний не рекомендуется использовать антибиотикотерапию для предотвращения осложнений сердечно-сосудистой патологии и атеросклероза.
В ACES-испытаниях лечение продолжается в течение года. Столь длительное лечение обусловлено трудностями в успешном лечении хронической хламидийной инфекции. Судить об эффективности лечения будут по количеству летальных случаев, обусловленных сердечнососудистой патологией, инфарктов миокарда в опытной и контрольной группах, показателях реконвалесценции, госпитализации и т. д. В то же время до получения окончательных результатов этих испытаний не рекомендуется использовать антибиотикотерапию для предотвращения осложнений сердечно-сосудистой патологии и атеросклероза.
Атеросклероз сердечно-сосудистой системы является основной причиной смертности населения в развитых странах. Выявлен ряд факторов риска атеросклеротического поражения сосудов, к числу которых относятся наследственность, гиперхолестеринемия, нарушенный обмен веществ, артериальная гипертензия, курение, сахарный диабет, ожирение и гиподинамия. Кроме того, есть определенные основания предполагать, что одним из таких факторов может являться инфекционный процесс. Бактериальная теория атеросклероза, впервые выдвинутая еще более ста лет назад, вновь приобретает все больший научный и практический интерес и имеет ряд доказательств.
Бактериальная теория атеросклероза, впервые выдвинутая еще более ста лет назад, вновь приобретает все больший научный и практический интерес и имеет ряд доказательств.
Рис.4. Иммуногисто-химическое окрашивание. С.pneumonia в фибролипидных бляшках из атеромы коронарной артерии. А — положительное окрашивание специфическими моноклональными антителами. Пенистые клетки (из фибролипидных бляшек), содержащие С.pneumonia. В — отрицательное окрашивание нормального контрольного образца (Cambell LA. et al,, 2001).
По данным ряда авторов [28, 29, 33, 52, 53], атеросклероз может быть результатом хронической персистентной инфекции, вызванной С. pneumonia. Главными аргументами в пользу хламидийной этиологии этого заболевания являются корреляция сердечно-сосудистой патологии и других атеросклеротических поражений с динамикой выявления специфических антител против С. pneumonia, что было показано в сероэпидемических исследованиях, проведенных в Финляндии, Швеции, США, Германии, Великобритании и Нидерландах и основанных на измерении IgG и IgA или специфических иммунных комплексов [54]. К настоящему времени проведено около 50 сероэпидемиологических исследований по выявлению TWAR-антител при различных атеросклеротических заболеваниях. Более чем в 40 исследованиях обнаружена связь между присутствием специфических антител и заболеванием, в некоторых исследованиях она не прослеживалась. Частота выявления антител к С. pneumonia у лиц с доказанной сердечно-сосудистой патологией составляла в проведенных исследованиях 80-85 %. При этом в ряде случаев отмечено отсутствие специфических антител у пожилых людей с атеросклерозом [55].
К настоящему времени проведено около 50 сероэпидемиологических исследований по выявлению TWAR-антител при различных атеросклеротических заболеваниях. Более чем в 40 исследованиях обнаружена связь между присутствием специфических антител и заболеванием, в некоторых исследованиях она не прослеживалась. Частота выявления антител к С. pneumonia у лиц с доказанной сердечно-сосудистой патологией составляла в проведенных исследованиях 80-85 %. При этом в ряде случаев отмечено отсутствие специфических антител у пожилых людей с атеросклерозом [55].
Рис. 5. Течение инфекции в атеросклерозе перед реактивным артритом.
Данный возбудитель удается выявить различными методиками (ПЦР, иммуногистология, электронная микроскопия, культуральный метод) из тканей атеросклеротических бляшек стенок артерий, при отсутствии такового в нормальной ткани стенок артериальных артерий [13, 17, 18, 56, 57]. Показана возможность инфицирования и размножения С. pneumonia в клетках-мишенях атеросклероза (эндотелий, макрофаги, мышечные клетки) в опытах in vitro при исследовании эндотелиальных клеток сосудов человека, а также при моделировании инфекции у животных [19, 58]. Отмечено, что хламидийный белок теплового шока (Hsp 60) обнаруживается в атеросклеротической бляшке в значительном количестве вместе с аналогичным эндогенным белком человека. Этот белок может являться активным важную роль в атерогенезе, стимулируя выработку макрофагами альфа-фактора некроза опухоли и экспрессию металлопротеиназ, желатиназы 92 кДа и способствуя разрушению тканей сосудов [59, 60]. Показано, что эндотелиальные клетки в ответ на проникновение С. pneumonia увеличивают экспрессию генов цитокинов (интерлейкин-1), хемокинов (интерлейкин-8 и моноцитарный хемотаксический протеин 1), клеточных факторов роста (гепаринсвязанный эпидермальноподобный фактор, основной фибробластный фактор и т.д.), внутриклеточных киназ и поверхностных клеточных рецепторов с сигнальной транедуцирующей активностью [61].
pneumonia в клетках-мишенях атеросклероза (эндотелий, макрофаги, мышечные клетки) в опытах in vitro при исследовании эндотелиальных клеток сосудов человека, а также при моделировании инфекции у животных [19, 58]. Отмечено, что хламидийный белок теплового шока (Hsp 60) обнаруживается в атеросклеротической бляшке в значительном количестве вместе с аналогичным эндогенным белком человека. Этот белок может являться активным важную роль в атерогенезе, стимулируя выработку макрофагами альфа-фактора некроза опухоли и экспрессию металлопротеиназ, желатиназы 92 кДа и способствуя разрушению тканей сосудов [59, 60]. Показано, что эндотелиальные клетки в ответ на проникновение С. pneumonia увеличивают экспрессию генов цитокинов (интерлейкин-1), хемокинов (интерлейкин-8 и моноцитарный хемотаксический протеин 1), клеточных факторов роста (гепаринсвязанный эпидермальноподобный фактор, основной фибробластный фактор и т.д.), внутриклеточных киназ и поверхностных клеточных рецепторов с сигнальной транедуцирующей активностью [61]. Цитокиновый ответ на проникновение С. pneumonia, по-видимому, может играть роль в развитии локального воспаления в местах инфекции (сосуды) [19]. А ЛПС С. pneumonia стимулирует накопление макрофагами эфиров холестерина в присутствии липопротеидов низкой плотности, индуцируя образование “пенистых” клеток. Экспериментально доказана способность штаммов С. pneumonia индуцировать атеросклеротические изменения в клетках стенок сосудов у кролика [62-64].
Цитокиновый ответ на проникновение С. pneumonia, по-видимому, может играть роль в развитии локального воспаления в местах инфекции (сосуды) [19]. А ЛПС С. pneumonia стимулирует накопление макрофагами эфиров холестерина в присутствии липопротеидов низкой плотности, индуцируя образование “пенистых” клеток. Экспериментально доказана способность штаммов С. pneumonia индуцировать атеросклеротические изменения в клетках стенок сосудов у кролика [62-64].
С. pneumonia способна инфицировать несколько типов клеток, включая моноцитпроизводные макрофагов, играющих существенную роль в развитии атеросклероза. Однако персистенция С. pneumonia в мононуклеарных клетках плохо изучена [65]. Имеется ряд сообщений, подтверждающих присутствие ДНК С. pneumonia в периферийных мононуклеарных клетках крови у пациентов с коронарной ангиографией, причем чаще у курильщиков [66]. С. pneumonia может участвовать в локальном иммунном ответе и через инфицированные макрофаги расширять зоны атеросклеротических повреждений. Хроническая инфекция С. pneumonia у нормолипидных мышей индуцирует воспалительные изменения, но не атеросклеротические изменения стенок сосудов. На этой же лабораторной модели инфекции показано, что атерогенный эффект С. pneumonia развивается при наличии гиперлипидемии [67]. Показано, что на фоне диетиндуцируемой гиперлипидемии у мышей с дефицитом LDL-рецепторов происходит индукция и развитие атерогенеза, которое может быть обусловлено инфекцией, вызываемой С. pneumonia [68]. В то же время лечение азитромицином не уменьшает размер развившихся атеросклеротических повреждений в экспериментах на инфицированных мышах. Предполагают, что лечение острой инфекции С. pneumonia антихламидийными препаратами, возможно, оказывает профилактическое противоатерогенное действие данного возбудителя [69].
Хроническая инфекция С. pneumonia у нормолипидных мышей индуцирует воспалительные изменения, но не атеросклеротические изменения стенок сосудов. На этой же лабораторной модели инфекции показано, что атерогенный эффект С. pneumonia развивается при наличии гиперлипидемии [67]. Показано, что на фоне диетиндуцируемой гиперлипидемии у мышей с дефицитом LDL-рецепторов происходит индукция и развитие атерогенеза, которое может быть обусловлено инфекцией, вызываемой С. pneumonia [68]. В то же время лечение азитромицином не уменьшает размер развившихся атеросклеротических повреждений в экспериментах на инфицированных мышах. Предполагают, что лечение острой инфекции С. pneumonia антихламидийными препаратами, возможно, оказывает профилактическое противоатерогенное действие данного возбудителя [69].
Рис. 6. Возможные механизмы вовлечения C. pneumonia в атерогенез.
Таким образом, исследования различных авторов показывают, что колонизация С. pneumonia стенок артерии при хроническом инфекционном процессе приводит к дисфункции и нарушению гомеостаза эндотелия сосудов, способствуя развитию атеросклеротического процесса и хронической сердечно-сосудистой патологии. Этому, возможно, способствует неоднократное в течение жизни реинфицирование человека С. pneumonia, которое приводит к активации вялотекущего аутоиммунного процесса, Т-клеточного звена иммунитета, поддерживая таким образом интрамуральный хронический воспалительный процесс.
pneumonia стенок артерии при хроническом инфекционном процессе приводит к дисфункции и нарушению гомеостаза эндотелия сосудов, способствуя развитию атеросклеротического процесса и хронической сердечно-сосудистой патологии. Этому, возможно, способствует неоднократное в течение жизни реинфицирование человека С. pneumonia, которое приводит к активации вялотекущего аутоиммунного процесса, Т-клеточного звена иммунитета, поддерживая таким образом интрамуральный хронический воспалительный процесс.
Возможно, что не только С. pneumonia, но и другие возбудители в атеросклеротической бляшке, таких как цитомегаловирус, вирус герпеса, Porphyromonas gingivalis и Streptococcus sanguis, могут вызывать повреждение клеток сосудов, приводя в дальнейшем, в ассоциации с классическими факторами риска, к развитию сердечно-сосудистой патологии и появлению атероскперотических изменений в сосудах [70-72].
Известно, что аневризма брюшной аорты чаще диагностируется у пожилых курящих мужчин с хроническим бронхитом. С помощью иммуногистохимического анализа удалось детектировать ЛПС хламидий в аневризме брюшной аорты в биоптатном материале у пациентов после операции. У большинства пациентов удалось детектировать белковые антигены С. pneumonia и ДНК возбудителя с помощью иммунологических методов исследования и ПЦР-анализа [73| Отмечено частое присутствие С. pneumonia в измененных тканях брюшной аорты при аневризме в живой, репликативной форме. Данные больные имеют более высокие серологические маркеры для инфекции С. pneumonia, чем в контроле. Аневризма стенки сосуда ха рактеризуется дегенерацией эластина и коллагена, а также инфильтрацией ее макрофагами и В-клетками [74]. У изолятов С. pneumonia установлена протеазная активность, которая способствует деструктивному действию данного возбудителя на стенки сосудов.
С помощью иммуногистохимического анализа удалось детектировать ЛПС хламидий в аневризме брюшной аорты в биоптатном материале у пациентов после операции. У большинства пациентов удалось детектировать белковые антигены С. pneumonia и ДНК возбудителя с помощью иммунологических методов исследования и ПЦР-анализа [73| Отмечено частое присутствие С. pneumonia в измененных тканях брюшной аорты при аневризме в живой, репликативной форме. Данные больные имеют более высокие серологические маркеры для инфекции С. pneumonia, чем в контроле. Аневризма стенки сосуда ха рактеризуется дегенерацией эластина и коллагена, а также инфильтрацией ее макрофагами и В-клетками [74]. У изолятов С. pneumonia установлена протеазная активность, которая способствует деструктивному действию данного возбудителя на стенки сосудов.
Патология центральной нервной системы
Рядом авторов показано развитие неврологических осложнений у больных с инфекциями, вызванными С. trachomatis и С psittaci. Имеется ряд сообщений о возможной связи нервной патологии с инфицированном хламидиями, в частности сообщается о роли С. pneumonia в возникновении острых инфекций ЦНС: энцефалиты, менингиты, менингоэнцефалиты, миелиты и синдрома Guillain-Barre.
trachomatis и С psittaci. Имеется ряд сообщений о возможной связи нервной патологии с инфицированном хламидиями, в частности сообщается о роли С. pneumonia в возникновении острых инфекций ЦНС: энцефалиты, менингиты, менингоэнцефалиты, миелиты и синдрома Guillain-Barre.
Предполагают, что С. pneumonia играет роль в развитии цереброваскулярной патологии, особенно если наблюдается связь с курением, скоротечными ишемическими приступами, а также на фоне развития атеросклероза каротидной артерии. Отмечено четырехкратное увеличение риска развития цереброваскулярной болезни при наличии инфекции С. pneumonia [76].
В последние годы появляются сообщения о роли С. pneumonia в развитии наиболее важных патологий в ЦНС — множественного склероза и болезни Альцгеймера. Имеется ряд непрямых доказательств о возможной инфекционной и воспалительной этиологии болезни Альцгеймера. При сравнительном изучении патологоанатомических образцов головного мозга от пациентов в последней стадии болезни Альцгеймера и от контрольной группы (отсутствие данного заболевания) американскими исследователями установлена возможная связь С. pneumonia с болезнью Альцгеймера. При использовании широкого арсенала современных диагностических методов (ПЦР-анализ, включая RT-ПЦР; электронную и иммуноэлектронную микроскопию, иммуногистохимию и иммунозонды, а также культуральные методы исследования) было показано наличие живого (элементарные, ретикулярные тельца и ДНК хламидий, положительные культуральные высевы) и транскрипционно активного (транскрипты РНК двух важнейших генов) возбудителя С. pneumonia в участках головного мозга, пораженного болезнью Альцгеймера [77, 78]. Ряд других исследований подтверждают связь С. pneumonia с tau-ассоциированной нейрофибриллярной патологией [79]. В других исследованиях показано, что мозг, пораженный болезнью Альцгеймера, содержит незначительное количество копий ДНК С. pneumonia. По-видимому, различия, обнаруживаемые в исследованиях различных авторов, могут быть обусловлены низкой чувствительностью существующих методов ПЦР-анализа, недостаточным количеством образцов, взятых из различных мест мозга, пораженного данной патологией.
pneumonia с болезнью Альцгеймера. При использовании широкого арсенала современных диагностических методов (ПЦР-анализ, включая RT-ПЦР; электронную и иммуноэлектронную микроскопию, иммуногистохимию и иммунозонды, а также культуральные методы исследования) было показано наличие живого (элементарные, ретикулярные тельца и ДНК хламидий, положительные культуральные высевы) и транскрипционно активного (транскрипты РНК двух важнейших генов) возбудителя С. pneumonia в участках головного мозга, пораженного болезнью Альцгеймера [77, 78]. Ряд других исследований подтверждают связь С. pneumonia с tau-ассоциированной нейрофибриллярной патологией [79]. В других исследованиях показано, что мозг, пораженный болезнью Альцгеймера, содержит незначительное количество копий ДНК С. pneumonia. По-видимому, различия, обнаруживаемые в исследованиях различных авторов, могут быть обусловлены низкой чувствительностью существующих методов ПЦР-анализа, недостаточным количеством образцов, взятых из различных мест мозга, пораженного данной патологией. Этими же исследователями отмечено, что в 85.7% (18 из 21) случаях с помощью ПЦР-анализа подтверждено обнаружение ДНК С. pneumonia в постмортальных образцах мозга, пораженных болезнью Альцгеймера, при отрицательных данных в контрольной группе (0 из 10). Авторы указывают на необходимость повышения чувствительности существующих методов ПЦР-анализа для обнаружения ДНК С. pneumonia. Данные исследования предполагают, что С. pneumonia может быть кофактором развития последней стадии болезни Альцгеймера.
Этими же исследователями отмечено, что в 85.7% (18 из 21) случаях с помощью ПЦР-анализа подтверждено обнаружение ДНК С. pneumonia в постмортальных образцах мозга, пораженных болезнью Альцгеймера, при отрицательных данных в контрольной группе (0 из 10). Авторы указывают на необходимость повышения чувствительности существующих методов ПЦР-анализа для обнаружения ДНК С. pneumonia. Данные исследования предполагают, что С. pneumonia может быть кофактором развития последней стадии болезни Альцгеймера.
Множественный склероз — одно из наиболее распространенных демиелинизирующих заболеваний человека. Известно, что многие факторы могут быть вовлечены в патогенез развития множественного склероза. Этиология данного заболевания до настоящего времени окончательно не определена. Имеются данные, аргументирующие возможную инфекционную этиология множественного склероза. В своей работе Sriam et al. [80] сообщает о возможной связи С. pneumonia с множественным склерозом. Приведены данные о первом случае связанного с С. pneumonia множественного склероза, при котором наблюдаются ли клиническое улучшение на фоне терапии антихламидийными препаратами. В другом исследовании с помощью ПЦР-анализа, серологических и культуральных методов исследования показано преобладание С. pneumonia в спинномозговой жидкости у больных с множественным склерозом по сравнению с контрольными группами. В то же время имеются данные других исследователей, показавшие отрицательные результаты в ПЦР-анализе и культуре клеток при изучении образцов спинномозговой жидкости от 99 больных (48 с множественным склерозом и 51 контроль) или низкие показатели обнаружения ДНК С.pneumonia с помощью ПЦР-анализа при изучении образцов спинномозговой жидкости от 37 больных множественным склерозом (только в 13%) и отсутствие ее в контрольной группе [81, 82]. При серологическом исследовании другими авторами показано наличие антител к С. pneumonia в спинномозговой жидкости у 8 из 22 больных множественным склерозом. Сделана попытка изоляции культуры С. pneumonia из образцов спинномозговой жидкости у больных с множественным склерозом, что удалось только в 1.
pneumonia множественного склероза, при котором наблюдаются ли клиническое улучшение на фоне терапии антихламидийными препаратами. В другом исследовании с помощью ПЦР-анализа, серологических и культуральных методов исследования показано преобладание С. pneumonia в спинномозговой жидкости у больных с множественным склерозом по сравнению с контрольными группами. В то же время имеются данные других исследователей, показавшие отрицательные результаты в ПЦР-анализе и культуре клеток при изучении образцов спинномозговой жидкости от 99 больных (48 с множественным склерозом и 51 контроль) или низкие показатели обнаружения ДНК С.pneumonia с помощью ПЦР-анализа при изучении образцов спинномозговой жидкости от 37 больных множественным склерозом (только в 13%) и отсутствие ее в контрольной группе [81, 82]. При серологическом исследовании другими авторами показано наличие антител к С. pneumonia в спинномозговой жидкости у 8 из 22 больных множественным склерозом. Сделана попытка изоляции культуры С. pneumonia из образцов спинномозговой жидкости у больных с множественным склерозом, что удалось только в 1. 7 % случаев [83]. Анализ проведенных исследований в целом может свидетельствовать о возможности того, что инфекция С. pneumonia является пусковым механизмом аутоиммунных процессов у больных множественным склерозом, а выявление возбудителя различными методами может зависеть от стадии заболевания. Необходимо отметить, что определение роли С. pneumonia в развитии множественного склероза требует дополнительных исследований.
7 % случаев [83]. Анализ проведенных исследований в целом может свидетельствовать о возможности того, что инфекция С. pneumonia является пусковым механизмом аутоиммунных процессов у больных множественным склерозом, а выявление возбудителя различными методами может зависеть от стадии заболевания. Необходимо отметить, что определение роли С. pneumonia в развитии множественного склероза требует дополнительных исследований.
Другая патология
Хламидии могут размножаться в клетках ретикулоэндотелиальной системы. В связи с этим некоторые исследователи предполагают наличие возможной связи между хламидиями и лимфомой. Так, известно, что Helicobacter pylori связана с В-клеточной лимфомой желудка. В одной исследовательской работе показано, что у пациентов с лимфомой значительно чаще выявляются специфические иммунные комплексы, связанные с С. pneumonia и С. trachomatis, чем в контрольной группе [84]. В то же время отсутствуют четкие данные, подтверждающие связь между хламидийной инфекцией и развитием лимфомы. Некоторые из представителей хламидий, например биовар венерической лимфогранулемы С. trachomatis, может явиться причиной гигантских клеточных преобразований и хронического гранулематоза.
Некоторые из представителей хламидий, например биовар венерической лимфогранулемы С. trachomatis, может явиться причиной гигантских клеточных преобразований и хронического гранулематоза.
Имеется ряд сообщений, посвященных связи С. pneumonia с саркоидозом и хроническим гранулематозным воспалением, реактивными васкулитами, цистическим фиброзом, с узловатой эритемой, реактивными артритами [13], острым лимфаденитом [85]. Японскими исследователями обнаружена взаимосвязь хронической инфекции С. pneumonia с диабетической нефропатией. Ими же показано более чем четырехкратное увеличение риска развития нефропатии в группах больных, имеющих высокий процент выявляемости антител к С. pneumonia [86]. В таблице 2 эти данные обобщены. Типично, что все эти нарушения, как правило, возникают после инфицирования респираторного тракта С. pneumonia [17].
Ряд исследований подтверждает, что хламидии в суставах присутствуют в измененной, персистирующей и труднокультивируемой форме. С. pneumonia может играть роль в патогенезе некоторых артритов [87]. При поражении суставов ДНК С. pneumonia обнаруживают в синовиальной жидкости приблизительно в 20% исследований. Однако необходимо отметить, что данный микроорганизм играет значительно меньшую роль при артритах, чем С. trachomatis [88].
С. pneumonia может играть роль в патогенезе некоторых артритов [87]. При поражении суставов ДНК С. pneumonia обнаруживают в синовиальной жидкости приблизительно в 20% исследований. Однако необходимо отметить, что данный микроорганизм играет значительно меньшую роль при артритах, чем С. trachomatis [88].
Диагностика
Диагностика как острой, так и хронической (персистирующей) инфекции С. pneumonia затруднена из-за особенностей ее течения, низкой концентрации возбудителя в месте инфекции, наличием перекрестных серологических реакций. К сожалению, на сегодняшний день отсутствуют стандартизованные методы в выявлении антигенов, антител и ДНК С. pneumonia отмечены значительные различия в результатах исследовании при использовании тест-систем различных производителей. В связи с этим актуальной в настоящее время является проблема стандартизации технологий производства, методов применения и качества препаратов, используемых в постановке диагноза инфекции, вызванной С. pneumonia.
pneumonia.
Культуральный метод диагностики, достаточно хорошо зарекомендовавший себя при диагностике инфекций, вызываемых С. trachomatis, менее эффективен при изоляции С. pneumonia. Отмечено, что возбудитель плохо размножается в культуре клеток, обычно используемых для культивирования хламидий, а некоторые штаммы С. pneumonia не размножаются в куриных эмбрионах, в связи с чем многие лаборатории мира имеют большие трудности как при изоляции возбудителя из клинических образцов при острой инфекции, так и при дальнейшем культивировании С. pneumonia. При хронических формах инфекции С. pneumonia в большинстве случаев культуральный метод диагностики практически дает отрицательные результаты. В настоящее время не выявлена культура клеток, наиболее чувствительная для изоляции штаммов С. pneumonia. Чаще всего для этой цели используются перевиваемые линии клеток HL и Нер-2. Имеются лишь отдельные сообщения об успешной изоляции штаммов С. pneumonia от пациентов с бессимптомной формой инфекции и негативной серологией. Показано, что успешной изоляции возбудителя можно достигнуть при позитивной сероконверсии в 50% случаев. Имеются данные, что штаммы С. pneumonia у различных групп населения могут обладать различным клеточным тропизмом и активностью размножения в культуре клеток. Необходима стандартизация культурального метод диагностики, особенно в отношении наиболее чувствительны линий клеток, условий инфицирования, пассирования и идентификации выделенных штаммов хламидий [89].
Показано, что успешной изоляции возбудителя можно достигнуть при позитивной сероконверсии в 50% случаев. Имеются данные, что штаммы С. pneumonia у различных групп населения могут обладать различным клеточным тропизмом и активностью размножения в культуре клеток. Необходима стандартизация культурального метод диагностики, особенно в отношении наиболее чувствительны линий клеток, условий инфицирования, пассирования и идентификации выделенных штаммов хламидий [89].
Иммуноферментный анализ используют для выявления общего группового ЛПС-антигена, который присутствует у всех хламидий. Перспективным является метод иммуногистохимического окрашивания биопсийных препаратов тканей с использованием специфических моноклональных антител к С. pneumonia и стрептавидин-биотиновой технологии [90].
Иммунофлюоресцентный анализ, направленный на выявление антигенов С. pneumonia, не обладает высокой чувствительностью при анализе фарингеальных мазков. Из-за разнообразия фарингеальной микрофлоры поиск элементарных телец С. pneumonia в образцах затруднен. Чувствительность данного метода составляет 20-60%, а специфичность зависит от навыков персонала.
Из-за разнообразия фарингеальной микрофлоры поиск элементарных телец С. pneumonia в образцах затруднен. Чувствительность данного метода составляет 20-60%, а специфичность зависит от навыков персонала.
Серологические методы исследования наиболее широко применяются в диагностике инфекций, вызываемых С. pneumonia. Первую связь С. pneumonia с болезнью у человека продемонстрировал Saikku [14], используя микроиммунофлюоресцентный метод (МИФ), которой является золотым стандартом в серологии. В то же время имеется ряд проблем, связанных с использованием МИФ-серологии: нестандартность реагентов, методов оценки результатов анализа, различия используемых диагностических критериев. Описаны значительные межлабораторные вариации в результатах МИФ-диагностики, в частности при оценке титров исследуемых сывороток. Наиболее результативной является комплексная диагностика при использовании различных методов. Показано, что четырехкратное увеличение титров антител к С. pneumonia в комбинации с результатами ПЦР-анализа или культурального метода — наилучший диагностический критерий наличия острой инфекции. При серодиагностике присутствие IgM-антител подтверждает острую или недавнюю инфекцию, высокие титры к IgA и/или IgG подтверждают наличие острой или манифестной хронической инфекции. Антитела класса М вырабатываются, как правило, на ЛПС С. pneumonia при первичной инфекции, а антитела класса А являются маркерами реинфицирования. Детекция специфических IgG в одном образце сыворотки имеет ограниченную диагностическую ценность. Только значительное увеличение титров специфических антител класса G в парных сыворотках дает возможность предполагать наличие острой или манифестной инфекции С. pneumonia. Серологическое исследование, проводимое без ДНК-анализа или культурального метода диагностики, а также при отсутствии парных сывороток, носит ретроспективный анализ.
При серодиагностике присутствие IgM-антител подтверждает острую или недавнюю инфекцию, высокие титры к IgA и/или IgG подтверждают наличие острой или манифестной хронической инфекции. Антитела класса М вырабатываются, как правило, на ЛПС С. pneumonia при первичной инфекции, а антитела класса А являются маркерами реинфицирования. Детекция специфических IgG в одном образце сыворотки имеет ограниченную диагностическую ценность. Только значительное увеличение титров специфических антител класса G в парных сыворотках дает возможность предполагать наличие острой или манифестной инфекции С. pneumonia. Серологическое исследование, проводимое без ДНК-анализа или культурального метода диагностики, а также при отсутствии парных сывороток, носит ретроспективный анализ.
Классический метод диагностики — реакция связывании комплемента — может быть использована в серологической ни агностике первоначальной инфекции, однако этот тест малочувствителен у пациентов с реинфекциями, может давать перекрестные реакции с другими видами хламидий, такими как С. psittaci.
psittaci.
В последние годы разработаны специфические ELISA тест-системы, направленные на выявление видоспецифических антител классов G, А, М к С. pneumonia. Эти тест-системы в настоящее время повсеместно используются в клинической практике. При диагностике с применением серологических методов исследователь сталкивается с трудностями интерпретации получаемых результатов. Так как антитела к С. pneumonia обычно присутствуют в старшей возрастной группе и у здоровых, то соотнесение их с определенной стадией болезни может быть затруднено. В то же время продолжительное присутствии короткоживущих IgA может служить индикатором манифестации хронической инфекции. Отмечено, что титры IgG к С. pneumonia были выше в сыворотках с сопутствующими IgA-антителами. IgA никогда не детектировались в сыворотке без специфических IgG. IgG1 являются наиболее распространенным субклассом G-антител к С. pneumonia [91]. При инфекциях, осложненных С. trachomatis, титры антител к С. pneumonia часто меньше, чем титры антител к С. trachomatis. Наличие высоких титров IgG к С. pneumonia в контрольных группах, возможно, связано с высоким уровнем общего IgG. Наилучший маркер хронической инфекции С. pneumonia — иммунные комплексы и IqA [92].
trachomatis. Наличие высоких титров IgG к С. pneumonia в контрольных группах, возможно, связано с высоким уровнем общего IgG. Наилучший маркер хронической инфекции С. pneumonia — иммунные комплексы и IqA [92].
ПЦР-анализ, как и другие методы амплификации нуклеиновых кислот, является потенциально ценным диагностическим инструментом, который способен улучшить диагностику не только ранней, но и хронической (персистирующей) инфекции, вызываемой С. pneumonia. Клиническими образцами для ДНК анализа могут служить назофарингеальные смывы, ткани пораженных сосудов или органов, мононуклеарные клетки периферической крови. При диагностике с помощью ПЦР-анализа следует учитывать интервал между развитием клинических симптомов и забором образца, при этом чем больше интервал, тем вероятнее обнаружение ДНК в мононуклеарных клетках. Это является маркером возможного присутствия С. pneumonia в сосудистой стенке, в частности в атеросклеротической бляшке. Кроме того, этот метод может быть новым “золотым стандартом” для диагностики хронической инфекции С. pneumonia у больных ХОЛП — как маркер присутствия возбудителя в нижних отделах респираторного тракта. Однако необходимо отметить, что ДНК-методы амплификации С. pneumonia недостаточно стандартизованы. Необходима отработка и оптимизация процедур выделения нуклеиновых кислот из различных клинических образцов (возможно, нескольких), проведение различных методов ДНК-амплификаций [93]. Отмечены существенные различия в оценке чувствительности и специфичности ПЦР-анализа, используемого для выявления ДНК С. pneumonia в клинических образцах [94]. Необходима отработка методов экстракции ДНК С. pneumonia из ткани сосудов, удаление соответствующих ингибиторов ПЦР-реакции. Большое значение в ДНК-диагностике инфекций, вызванных С. pneumonia, приобретают методы ДНК-амплификаций, которые легко автоматизировать и стандартизовать, в частности, SDA-метод [95] и новый метод DIG-PCR-EIA, который имеет большую чувствительность по сравнению с обычной двухпраймерной или nested-ПЦР [96].
pneumonia у больных ХОЛП — как маркер присутствия возбудителя в нижних отделах респираторного тракта. Однако необходимо отметить, что ДНК-методы амплификации С. pneumonia недостаточно стандартизованы. Необходима отработка и оптимизация процедур выделения нуклеиновых кислот из различных клинических образцов (возможно, нескольких), проведение различных методов ДНК-амплификаций [93]. Отмечены существенные различия в оценке чувствительности и специфичности ПЦР-анализа, используемого для выявления ДНК С. pneumonia в клинических образцах [94]. Необходима отработка методов экстракции ДНК С. pneumonia из ткани сосудов, удаление соответствующих ингибиторов ПЦР-реакции. Большое значение в ДНК-диагностике инфекций, вызванных С. pneumonia, приобретают методы ДНК-амплификаций, которые легко автоматизировать и стандартизовать, в частности, SDA-метод [95] и новый метод DIG-PCR-EIA, который имеет большую чувствительность по сравнению с обычной двухпраймерной или nested-ПЦР [96].
Чувствительность к антибактериальным препаратам. Лечение.
Лечение.
Открытие новых возбудителей требует разработки новых методов в диагностике и лечении малоизученных хронических заболеваний. С. pneumonia не является исключением. Обобщенные сведения о чувствительности штаммов С. pneumonia к антибактериальным препаратам представлены в таблице 3 [97].
Таблица 3. Чувствительность штаммов С. pneumonia к антибактериальным препаратам.
|
Антибактериальные препараты |
МПК90, мкг/мл |
|
Пенициллин G |
>100 |
|
Ампициллин |
>100 |
|
Тетрациклин |
0,05-1,0 |
|
Доксициклин |
0,06-0,25 |
|
Миноциклин |
0,016-0,063 |
|
Эритромицин |
0,01-1,0 |
|
Азитромицин |
0,06-0,5 |
|
Кларитромицин |
0,004-1,0 |
|
Офлоксацин |
0,125-2,0 |
|
Ципрофлоксацин |
16,0 |
|
Спарфлоксацин |
<0,5 |
|
Грепафлоксацин |
<0,5 |
|
Левофпоксацин |
0,125-0,5 |
|
Моксифлоксацин |
<0,5 |
|
Тровафлоксацин |
<0,5 |
|
Гемифлоксацин |
<0,25 |
|
Троспектиномицин |
>400 |
|
Супьфисоксазол |
10-20 |
In vitro С. pneumonia обладает резистентностью к ряду представителей беталактамных антибиотиков (пенициллины и цефалоспорины) [98]. Возбудитель чувствителен к эритромицину, кларитромицину, азитромицину (МПК90 < 0,5 мкг/мл) [99, 100]. Новый представитель макролидов HMR 3647 in vitro обладает высокой чувствительностью против штаммов С. pneumonia. Его МПК90 составила 0,25 мкг/мл (диапазон от 0,15 до 2 мкг/мл) [98,101-106].
pneumonia обладает резистентностью к ряду представителей беталактамных антибиотиков (пенициллины и цефалоспорины) [98]. Возбудитель чувствителен к эритромицину, кларитромицину, азитромицину (МПК90 < 0,5 мкг/мл) [99, 100]. Новый представитель макролидов HMR 3647 in vitro обладает высокой чувствительностью против штаммов С. pneumonia. Его МПК90 составила 0,25 мкг/мл (диапазон от 0,15 до 2 мкг/мл) [98,101-106].
Штаммы С. pneumonia чувствительны к ряду представителей новейших фторхинолоновых препаратов IV поколения: грепафлоксацину, левофлоксацину, моксифлоксацину, тровафлоксацину и др. (МПК90 < 0,5 мкг/мл). Наиболее активным из них является гемифлоксацин (МПК90 < 0,25 мг/мл) [100, 107, 108].
Исследование минимальных подавляющих концентраций (МПК) нового фторхинолонового препарата АМ-1155 в отношении штаммов С. pneumonia показало, что диапазон МПК90 составил от 0,063 до 0,125 мкг/мл. Данный препарат обладает активностью, схожей с спарфлоксацином и тосуфлоксацином. В то же время она была выше активности левофлоксацина и ципрофлоксацина в 4 и 16 раз соответственно, но ниже, чем кларитромицина и миноциклина (диапазон МПК от 0,016 до 0,031 и от 0,016 до 0,063 мкг/мл соответственно) [109].
В то же время она была выше активности левофлоксацина и ципрофлоксацина в 4 и 16 раз соответственно, но ниже, чем кларитромицина и миноциклина (диапазон МПК от 0,016 до 0,031 и от 0,016 до 0,063 мкг/мл соответственно) [109].
Макролиды, рокситромицин, азитромицин, кларитромицин, доксициклин и миноциклин, а также некоторые представители фторхинолоновых препаратов III и IV поколений являются потеннциальными антихламидийными препаратами, которые могут использоваться в случаях неосложненной инфекции, вызванной С. pneumonia. Отмечено, что не всегда после проведенного стандартного курса (7-10 дней) антимикробной терапии при остром респираторном заболевании, вызванном С. pneumonia, происходит эрадикация возбудителя. При пневмониях хламидийной этиологии высокой эффективностью обладают новые макролиды и фторхинолоны. Например, тровафлоксацин обладает большей эффективностью в лечении инфекций дыхательных пуши, вызванных хламидиями, по сравнению с офлоксацином и ципрофлоксацином [ПО]. В то же время имеются данные о полном излечении больных с хламидийной пневмонией при использовании офлоксацина [97],
В то же время имеются данные о полном излечении больных с хламидийной пневмонией при использовании офлоксацина [97],
В сравнительных исследованиях было показано, что азитромицин более эффективен, чем эритромицин, в лечении атипичных пневмоний. Данные препараты являются основой лечения хламидийных и микоплазменной пневмоний. Азитромицин при однократном применении в течение 5 дней оказывает терапевтический эффект, схожий с использованием амоксициллинклавулоновой кислоты и эритромицина, назначаемыми три раза в день в течение 10 дней. Кроме того, данный препарат обладает меньшими побочными эффектами [111], и обычный курс химиотерапии при инфекции дыхательных путей составляет, по данным различных авторов, 5-10-14 дней при суточной дозировке 1,5 г. Тетрациклиновые антибиотики относят к группе альтернативных препаратов при пневмониях, вызванных данным возбудителем, и назначаются в течение 2-3 недель [112]. Эффективность лечения пневмоний, вызванных С. pneumonia, моксифлоксацином (новый хинолоновый препарат) у взрослых оценивают в 70%, кларитромицином — 79%, азитромицином — до 83% и эритромицином — 86%.
Имеются данные об успешном лечении астмы после инфекции С. pneumonia у взрослых при проведении месячного курса терапии макролидами или антибиотиками тетрациклинового ряда. 6-12-недельный курс печения этими препаратами рекомендован при реактивных артритах хпамидийной этиологии.
Ранее уже сообщалось, что С. pneumonia и специфические Т-лимфоциты С. pneumonia часто присутствуют в стенке аневризмы брюшной аорты, что подтверждает возможную роль этого микроорганизма в патогенезе данного заболевания. Исследования на 36 больных с аневризмой брюшной аорты показали, что использование антимикробной терапии (доксициклин 150 мг/сутки), направленной на элиминацию возбудителя, уменьшает рост аневризмы. Эти результаты подтверждены ультрасонографией при наблюдении больных в течение 18 месяцев в группах, получавших антибиотик (19 человек) и плацебо (17 человек) [113].
Изучение влияния антибактериальных препаратов на течение инфаркта миокарда и атеросклероза, кофактором которых, возможно, является С. pneumonia, требует всесторонних и углубленных исследований. По-видимому, в таких случаях будет необходима продолжительная терапия в течение 6-12 недель [46]. В то же время при хроническом процессе, особенно если речь идет об атеросклерозе или астме и наличии персистирующей инфекции С. pneumonia, длительность терапии установить довольно сложно, так как неизвестно, как долго могут выявляться в тканях организма ДНК от погибших хламидий (мишень для ПЦР-анализа) или антигены С. pneumonia (мишень для ICC). Вследствие этого трудно установить длительность курсов лечения азитромицином, которое приводило бы к эрадикации живых клеток С. pneumonia из ткани легкого или пораженных сосудов сердца. По-видимому, длительные курсы (4-6 недель) антибиотикотерапии необходимы при инфицировании С. pneumonia глубоких тканей и органов. Так как культуру С. pneumonia изолировать при наличии хронической инфекции очень трудно, то в качестве теста эффективности лечения вызываемой ею инфекции возможно использование метода RT-ПЦР-анализа [114].
pneumonia, требует всесторонних и углубленных исследований. По-видимому, в таких случаях будет необходима продолжительная терапия в течение 6-12 недель [46]. В то же время при хроническом процессе, особенно если речь идет об атеросклерозе или астме и наличии персистирующей инфекции С. pneumonia, длительность терапии установить довольно сложно, так как неизвестно, как долго могут выявляться в тканях организма ДНК от погибших хламидий (мишень для ПЦР-анализа) или антигены С. pneumonia (мишень для ICC). Вследствие этого трудно установить длительность курсов лечения азитромицином, которое приводило бы к эрадикации живых клеток С. pneumonia из ткани легкого или пораженных сосудов сердца. По-видимому, длительные курсы (4-6 недель) антибиотикотерапии необходимы при инфицировании С. pneumonia глубоких тканей и органов. Так как культуру С. pneumonia изолировать при наличии хронической инфекции очень трудно, то в качестве теста эффективности лечения вызываемой ею инфекции возможно использование метода RT-ПЦР-анализа [114]. Проведенные в ФРГ исследования на людях в возрасте 50-69 лет показали, что по сравнению с пенициллином макропиды имеют возможный профилактический эффект в развитии кардиоваскулярных симптомов на протяжении первых шести месяцев [115].
Проведенные в ФРГ исследования на людях в возрасте 50-69 лет показали, что по сравнению с пенициллином макропиды имеют возможный профилактический эффект в развитии кардиоваскулярных симптомов на протяжении первых шести месяцев [115].
Специфическая профилактика
Специфическая профилактика отсутствует. В настоящее время проводятся исследования по разработке ДНК-вакцин, содержащих гены, кодирующие МОМР, отр-2 и Hsp 60, которые в экспериментах на животных показали обнадеживающие результаты, свидетельствующие о возможности создания вакцины против С. pneumonia [116, 117].
Заключение
Рассмотренный патоген С. pneumonia является причиной развития разнообразных патологических состояний у человека, который на протяжении жизни может часто подвергаться реинфекции данным микроорганизмом.
Сведения о заболеваемости людей, вызванной Chlamydia pneumonia, в России практически отсутствуют в отечественной литературе. Отсутствуют и сертифицированные тест-системы дня диагностики данного возбудителя. Не разработаны также средства специфической профилактики заболеваний, вызываемых С. pneumonia. Авторы надеются, что представленные в настоящем обзоре сведения привлекут внимание клиницистов к многообразной патологии, вызываемой данным возбудителем, и окажутся полезными для специалистов, разрабатывающих средства диагностики, лечения и профилактики инфекций, вызванных С. pneumonia.
Отсутствуют и сертифицированные тест-системы дня диагностики данного возбудителя. Не разработаны также средства специфической профилактики заболеваний, вызываемых С. pneumonia. Авторы надеются, что представленные в настоящем обзоре сведения привлекут внимание клиницистов к многообразной патологии, вызываемой данным возбудителем, и окажутся полезными для специалистов, разрабатывающих средства диагностики, лечения и профилактики инфекций, вызванных С. pneumonia.
Литература
1. Everett К. D. E, Bush R. В., Andersen A. A. Emended description of the order Chlamydiales, proposal of Parachlamydiaceae fam. nov. and Simkaniaceae fam. nov., each containing one monotypic genus, revised taxonomy of the family Chlamydiaceae, including a new genus and five species, and standards for the identification organisms // International Journal of Systematic bacteriology. 1999. 49. P. 415-440.
2. Rurangirwa F. R., Dilbeck P. M., Crawford Т. В., McGuire T. C., McElwain T. F. Analysis of the 16S rRNA gene of micro-organism WSU 86-1044 from an aborted bovine foetus reveals that it is a member of the order Chlamydiales: proposal of Waddliaceae fam. nov., Waddlia chondrophila gen. nov., sp. nov. // Int. J. Syst. Bacteriol. 1999. Apr. 49. P. 577-81
В., McGuire T. C., McElwain T. F. Analysis of the 16S rRNA gene of micro-organism WSU 86-1044 from an aborted bovine foetus reveals that it is a member of the order Chlamydiales: proposal of Waddliaceae fam. nov., Waddlia chondrophila gen. nov., sp. nov. // Int. J. Syst. Bacteriol. 1999. Apr. 49. P. 577-81
3. Intracellular bacterial Infections / Ed. J. C. Pechere. 1996. P. 53-59.
4. Read T. D., Brunham R. C., Eisen J., Fraser C. M. The genomics of chlamydia species // Abstracts of Proceedings of the IV Meeting of the European Society for Chlamydial Research. Helsinki, Finland, 20-23 August 2000. P. 29.
5. Wuppermann F. N., Schwab J. et al. Physical and genetic mapping of the chlamydia pneumonia genome // Abstracts of Proceedings of the 3rd Meeting of the European Society for Chlamydial Research. Vienna, Austria, 11-14 September 1996. P. 42.
6. Thomas N. S., Storey C. et al. The cryptic plasmid of Chlamydia pneumoniae: complete nucleotide sequence reveals a deletion in ORF1 // Ibid. P. 44.
P. 44.
7. Wiedmann-AI-Ahmad M., Schon G., Freidank H. Protein patterns of Chlamydia pneumonia strains and immunoblot analysis // Ibid. P. 56.
8. Knudsen K., Madsen A. S. et al. Differences in the outer membrane complex between Chlamydia pneumonia and chlamydia trachomatis // Ibid. P. 17.
9. Mygind P., Birkelund and Christiansen. Prevalence of antibodies to Chlamydia outer membrane protein 2, GroEL and DnaK in suspected acute C. pneumonia Infections // Ibid.
10. Егоров A. M., Сазыкин Ю. О. Хламидии: Молекулярная организация клетки и некоторые особенности патогенеза инфекций // Антибиотики и химиотерапия. 2000. 45. 4. С. 3-5.
11. Schuhmacher A., Melchers К. et al. The type III secretion system of Chlamydia pneumoniae // Abstracts of Proceedings of the IV Meeting of the European Society for Chlamydial Research. P. 47.
12. Friedman M. G., Birkeback N. et al. Serologic evidence for infection with Simkania negevensis in Denmark and its possible assaciation with chronic cough // Ibid. P. 258.
Serologic evidence for infection with Simkania negevensis in Denmark and its possible assaciation with chronic cough // Ibid. P. 258.
13. Grayston J. T. Epidemiology of Chlamydia pneumonia (TWAR) // Abstracts of Proceedings of the 3rd Meeting of the European Society for Chlamydial Research. P. 2111-212.
14. Kauppinen M., Saikku P. Pneumonia due to Chlamydia pneuminiae: prevalence, clinical features, diagnosis and treatment // Clinical Infectious Diseases. 1995. 21. P. 244-252.
15. Block S. L., Hammerschlag M. R., Hedrick J. et al. Chlamydia pneumoniae in acute otitis media // Pediatr. Infect. Dis. J. 1997. Sep. 16(9). P 858-62.
16. Dake Y., Enomoto Т., Shibano A., Sakoda Т., Saito Y., Takahashi M. Epidemiologic study of Chlamydia pneumoniae with ELISA // Nippon Jibiinkoka Gakkai Kaiho. 1998. Nov. 101 (11). P. 1316-20.
17. Saikku P. Chronic Chlamydia pneumoniae infections //Abstracts of Proceedings of the 3rd Meeting of the European Society for Chlamydial Research. P. 215-218.
P. 215-218.
18. Wong Y. K., Gallagher P. J., Wardc M. E. Chlamydia pneumonia and atherosclerosis // Heart. 1999. 81. P. 232-238.
19. Quinn T. C., Gaydos C. A. In vitro infection and pathogenesis of Chlamydia pneumoniae in endovascular cells // Am. Heart J. 1999. Nov. 138 (5 Pt 2). P. 507-511.
20. Redecke V., Dalhoff K., Bohnet S., Braun J., Maass M. Interaction of Chlamydia pneumoniae and human alveolar macrophages: infection and inflammatory response // Am. J. Respir. Cell. Mol. Biol. 1998. Nov. 19(5). P. 721-7.
21. Hahn D. L., McDonald R. Can acute Chlamydia pneumoniae respiratory tract infection initiate chronic asthma? // Ann. Allergy Asthma Immunol. 1998. Oct. 81(4). P. 339-44.
22. Ramos P., Arrictu L., Samaniego S. et al. Chlamydia pneumoniae infection in astma and coronary heart patients: serology study // Abstracts of Proceedings of the IV Meeting of the European Society for Chlamydial Research. P. 135.
P. 135.
23. Hahn D. L. Chlamydia pneumoniae, asthma, and COPD: what is the evidence? // Ann. Allergy Asthma Immunol. 1999. Oct. 83(4). P. 271-88, _291, 291-2.
24. Kleemola M., Saikku P., Visakorpi R., Wang S. P., Grayston J. T. Epidemics of pneumoniae caused by TWAR, anew Chlamydia organ-ism, in military trainees in Finland // J. Infect. Dis. 1988. 157. P. 230-236.
25. Comandini U. V., Maggi P., Santopadre P., Monno R., Angarano G., Vullo V. Chlamydia pneumoniae respiratory infections among patients infected with the human immunodeficiency virus // Eur. J. Clin. Microbiol. Lnfect. Dis. 1997. Oct. 16(10). P. 720-6.
26. Koyi H., Branden E., Gnarpe J. et al. Chlamydia pneumoniae may be associated with lung cancer: Preliminary report on a seroepidemiological study // APMIS. 1999. Sep. 107(90). P. 828-32.
27. Gencay M., Tamm M. et al. Chronic C. pneumoniae infection is assaciated with epithelial cell carcinoma // Abstracts of Proceedings of the IV Meeting of the European Society for Chlamydial_Research.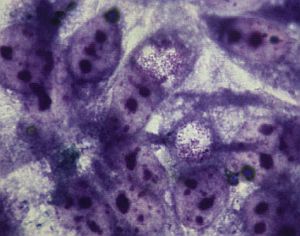 P. 259.
P. 259.
28. Danesh J., Collins R., Peto R. Chronic infections and coronary heart disease: is there a link? // Lancet. 1997. Vol. 350. P. 430-6.
29. Laurila A., Bloigu A., Nayha S. et al. Chronic Chlamydia pneumoniae infection is associated a serum lipid profile known to be a risk factor for atherosclerosis // Arterioscler. Thromb. Vase. Biol. 1997. Vol. 17. P 2910-13.
30. Ridker P. M., Kundsin R. В., Stampfer M. J. et al. Prospective study of Chlamydia pneumoniae IgG seropositivity and risks offuture myocardial infarction // Circulation, 1999. Vol. 99, P. 1161-64.
31. Saikku P., Leinonen M., Manila K. et al. Serologic evidence of an association of a novel Chlamydia, TWAR, with chronic coronary heart disease and acute myocardial infarction // Lancet. 1988. 2. P. 983-6.
32. Saikku P., Leinonen M., Tenkanen L. et al. Chronic Chlamydia pneumoniae infection as a risk factor for coronary heart disease in the Helsinki Heart Study //Ann. Intern Med. 1992. Vol. 116, P, 273-8.
Intern Med. 1992. Vol. 116, P, 273-8.
33. Meniconi A., Noll G., Luscher T. F. Is arteriosclerosis an infectious disease? // Schweiz. Rundsch. Med. Prax. 1998. Vol. 87. P. 64-74.
34. Nishimura M., Ushiyama M., Nanbu A., Mashida C., Kawagoe K., Yoshimura M. Inverse association of Chlamydia pneumoniae infection with high blood pressure in Japanese adults // Am. J. Hypertens. 2001. Jan. 14(1). P. 20-6.
35. Gabriel A. S., Gnarpe H., Hallander H. et al. The prevalence of chronic Chlamydia pneumoniae infection as detected by polymerase chain reaction in pharyngeal samples from patients with ischaemic heart disease // Europ. Heart J. 1998. Vol. 19, P 1321-7.
36. Grayston J. T. Chlamydia pneumoniae, strain TWAR pneumoniae // Annu. Rev. Med. 1992. 43. P. 317-23.
37. Leinonen M., Saikku P. Interaction of Chlamydia pneumoniae infection with other risk factors of atherosclerosis // Am. Heart J. 1999. Nov. 138(5 Pt 2). P. 504-6.
Heart J. 1999. Nov. 138(5 Pt 2). P. 504-6.
38. Glader C. A., Stegmayr B. et al. Chlamydia pneumoniae Antibodies and High Lipoprotein(a) Levels Do Not Predict Ischemic Cerebral Infarctions: Results From a Nested Case-Control Study in Northern Sweden // Stroke. 1999. Oct. 30(10). P. 2013-18.
39. Murray L. J., O»Reilly D. P., Ong G. M., O»Neill C., Evans A. E., Bamford K. B. Chlamydia pneumoniae antibodies are associated with an atherogenic lipid profi1e// Heart. J. 999. Mar 81(3). P. 239-44.
40. Thorn D. H., Wang S. P., Grayston J. T. et al. Chlamydia pneumoniae strain TWAR antibody and angiographically demonstrated coronary artery disease //Arterioscler. J Thromb. 1991. Vol. 11. P. 547-51.
41. Bachmaier K., Neu N., de la Maza L. M., Pal S., Hessel A., Penninger J. M. Chlamydia Infections and Heart Disease Linked Through Antigenic Mimicry // Science. 1999. Feb. 26. 283 (5406). P. 1335-9.
42.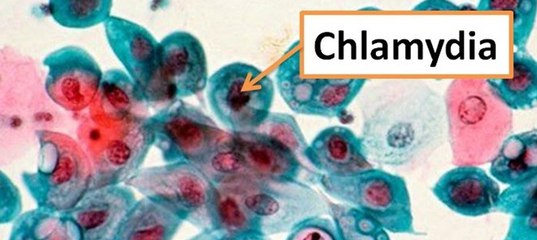 Tiran В., Tiesenhausen K., Karpf E. et al. LPS IgG antibodies are a marker for endovascular presence of Chlamydia pneumoniae in the atherosclerotic carotid artery // Abstracts of Proceedings of the IV Meeting of the European Society for Chlamydial Research. P. 295.
Tiran В., Tiesenhausen K., Karpf E. et al. LPS IgG antibodies are a marker for endovascular presence of Chlamydia pneumoniae in the atherosclerotic carotid artery // Abstracts of Proceedings of the IV Meeting of the European Society for Chlamydial Research. P. 295.
43. Weib В., Wuppermann F. N. et al. Chlamydia pneumonia infection alters gene expression in endotelial cells // Ibid. P. 297.
44. Anttila Т., Leinonen M., Surcel H. M., Von Hertzen L., Bloigu A., Seppala I., Saikku P. IgG subclass-specific antibodies in Chlamydia pneumoniae infections // Scand. J. Infect. Dis. 1998. 30 (4). P. 381-6.
45. Gurfinkel E. P., Bozovich G. Emerging role of antibiotics in atherosclerosis // Am. Heart J. 1999. Nov. 138(5 Pt 2). P. 537-8.
46. Stille W., Dittmann R. Arteriosclerosis as a sequela of chronic Chlamydja pneumoniae infection // Herz. 1998. May 23(3). P. 185-92.
47. Meier C., Derby L. , Jick S. et al. Antibiotics and risk of subsequent first-time acute myocardial infarction // JAMA. 1999. 281. P. 427-31.
, Jick S. et al. Antibiotics and risk of subsequent first-time acute myocardial infarction // JAMA. 1999. 281. P. 427-31.
48. Martin D., Bursill J., Qui M. R. et al. Alternative hypothesis for efficacy of macrolides in acute coronary syndromes // Lancet. 1998. 351. P. 1858-9.
49. Gupta S., Leatham E. W., Carrington D. et al. Elevated Chlamydia pneumoniae antibodies, cardiovascular events, and azithromycin in male survivors of myocardial infarction // Circulation. 1997. Vol. 96. P. 404-7.
50. Gurfinkel E., Bozovich G., Beck E. et al., for the ROXIS Study Group. Treatment with the antibiotic roxithromycin in patients with acute non-Q-wave coronary syndromes: The final report of the ROXIS study // Europ. Heart J. 1999. Vol. 20. P. 121-7.
51. Folsom A. Antibiotics for prevention of myocardial infarction? Not yet! // JAMA. l999. 281. P. 461-2.
52. Weiss S. M., Roblin P. M., Gaydos C.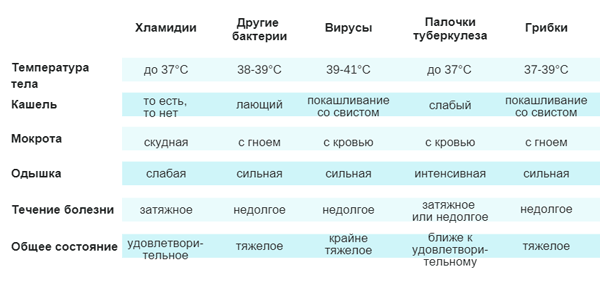 A. et al. Failure to detect Chlamydia pneumoniae in coronary atheromas of patients undergoing atherectomy // J. Infect. Dis. 1996. Vol. 173. P. 957-62.
A. et al. Failure to detect Chlamydia pneumoniae in coronary atheromas of patients undergoing atherectomy // J. Infect. Dis. 1996. Vol. 173. P. 957-62.
53. Libby P., Egan D., Skarlatos S. Roles of infectious agents in atherosclerosis and restenosis. // Circulation. 1997. 96. P. 409-10.
54. Saikku P. Epidemiology of Chlamydia pneumoniae in atherosclerosis // Am. Heart J. 1999. Nov. 138(5 Pt 2). P. 500-3.
55. Grayston J. T. Chlamydia pneumoniae (TWAR) and coronary heart disease: from hypothesis to treatment // Abstracts of Proceedings of the IV Meeting of the European Society for Chlamydial Research. P. 380-381.
56. Dean D., Molestina R. et al. Molecular and biological characterization of a unique isolate of chlamydia pneumonia from a coronary atheroma // Abstracts of Proceedings of the 3rd Meeting of the European Society for Chlamydial Research. P. 43.
57. Sessa R., Pietro M. D., Schiavoni G. et al. Prevalence of Chlamydia pneumoniae DNA in atherosclerotic plaques of carotid arteries // Abstracts of Proceedings of the IV Meeting of the European Society for Chlamydial Research. P. 288.
D., Schiavoni G. et al. Prevalence of Chlamydia pneumoniae DNA in atherosclerotic plaques of carotid arteries // Abstracts of Proceedings of the IV Meeting of the European Society for Chlamydial Research. P. 288.
58. Byrne G. I., Kalayoglu M. V. Chlamydia pneumoniae and atherosclerosis: Links to the disease process // Am. Heart J. 1999. Nov. 138 (5 Pt 2). P. 488-90.
59. Vehmaan-Kreula P., Puolakkainen M., Sarvas M., Welgus H. G., Kovanen P. T. Chlamydia pneumoniae proteins induce secretion of the 92-kDa gelatinase by human monocyte-derived macrophages // Arterioscler. Thromb. Vase. Biol. 2001. Jan. 21(1). P. E1-8.
60. Grayston J. T, Kuo C. C., Coulson A. S. et al. Chlamydia pneumoniae (TWAR) in atherosclerosis of the carotid artery // Circulation. 1995. Vol. _92. P. 3397-3400.
61. Coombes В. К., Mahony J. В. cDNA array analysis of altered gene expression in human endothelial cells in response to Chlamydia pneumoniae infection // Infect. Immun. 2001. Mar 69(3). P. 1420-7.
Immun. 2001. Mar 69(3). P. 1420-7.
62. Dunne M. WIZARD and the design of trials for secondary prevention ofatherosclerosis with antibiotics // Am. Heart J. 1999. Nov. 138(5 Pt 2). P. 542-4.
63. Fong I. W., Chiu В., Viira E., Jang D., Mahony J. B. De novo induction of atherosclerosis by chlamydia pneumoniae in a rabbit model // Infect. Immun. 1999. Nov 67(11). P. 6048-55.
64. Laitinen K., Laurila A., Pyhala L., Leinonen M., Saikku P. Chlamydia pneumoniae infection induces inflammatory changes in the aortas of rabbits // Infect. Immun. 1997. Nov 65(11). P. 4832-5.
65. Airenne S., Surcel H. M., Alakarppa H., Laitinen K., Paavonen J., Saikku P., Laurila A. Chlamydia pneumoniae infection in human monocytes // Infect. Immun. Mar 67(3). P. 1445-9.
66. Smiega M., Chong S., Natarajan M. et al. Circulating Chlamydia pneumoniae DNA is associated with smoking and season in coronary angiography patients // Abstracts of Proceedings of the IV Meeting of the European Society for Chlamydial Research. P. 291.
P. 291.
67. Blessing E., Campbell L. A., Rosenfeld M., Kuo С. С. Infection with chlamydia pneumoniae accelerates the induction and progression of atherosclerosis in diet induced hypercholesteremic С 57 BL/6S mice. P. 247.
68. Liu L, Hu H., Ji H., Murdin A. D., Pierce G. N., Zhong G. Chlamydia pneumoniae infection significantly exacerbates aortic atherosclerosis in an LDLR-/- mouse model within six months // Mol. Cell. Biochem. 2000. Dec. 215(1-2). P. 123-8.
69. Rothstein N. M., Quinn T. С., Madico G., Gaydos С. A., Lowenstein С. J. Effect of Azithromycin on Murine Arteriosclerosis Exacerbated by Chlamydia pneumoniae // J. Infect. Dis. 2001. Jan. 183(2). P. 232-8.
70. Chiu B. Multiple infections in carotid atherosclerotic plaques // Am. Heart J. 1999. Nov. 138 (5 Pt 2). P. 534-6.
71. Coles K. A., Plant A. J., Riley T. V., Smith D. W., McQuillan B. M., Thompson P. L. Lack of association between seropositivity to Chlamydia pneumoniae and carotid atherosclerosis // Am. J. Cardiol. I999. Oct. 1. 84(7). P. 825-8.
J. Cardiol. I999. Oct. 1. 84(7). P. 825-8.
72. Valtonen V. V. Role of infections in atherosclerosis // Am. Heart J. 1999. Nov. 138 (5 Pt 2). P. 825-8.
73. Maraha В., den Heijer M., Wullink M., van der Zee A. et al. Detection of Chlamydia pneumoniae DNA in buffy-coat samples of patients with abdominal aortic aneurysm // Eur. J. Clin. Microbiol. Infect. Dis. 2001. Feb. 20(2). P. 111-6.
74. Karlsson L, Gnarpe J., Naas J. et al. Detection of viable Chlamydia pneumoniae in abdominal aortic aneurysms // Abstracts of Proceedings of the IV Meeting of the European Society for Chlamydial Research. P. 266.
75. Blasi F, Denti F, Erba M. et al. Detection of Chlamydia pneumoniae but not Helicobacter pylori in atherosclerotic plaques of aortic aneurisms // J. Clin. Microbiology. 1996. Vol. 34. P. 2766-9.
76. Wimmer M. L. J., Hobert R. L Chlamydia pneumoniae and Neurological Disorders // Abstracts of Proceedings of the IV Meeting of the European Society for Chlamydial Research. P. 261-2.
P. 261-2.
77. Balin В. J., Gerard H. C., Arking E. J., Appelt D. M., Branigan P. J., Abrams J. Т., Whittum-Hudson J. A., Hudson A. P. Identification and localization of Chlamydia pneumoniae in the Alzheimer»s Brain // Med. Microbiol. Immunol. (Berl.). 1998. Jun. 187(1). P. 23-42.
78. Ossewaarde J. M., Gielis-Proper S. K., Meijer A., Roholl P. J. M. Chlamydia pneumoniae antigenes are present in the brains of Alzheimer patients, but not in the brains of patients with other dementia»s // Abstracts of Proceedings of the IV Meeting of the European Society for Chlamydial Research. P. 284.
79. Machony J., Wouife J., Munoz D. et al. Chlamydia pneumoniae in the alzheimer»s brain — is DNA detection hampered by low copy number? // Ibid.
80. Sriram S., Stratton C. W., Yao S., Tharp A., Ding L., Bannan J. D., Mitchell W. M. Chlamydia pneumoniae infection of the central nervous system in multiple sclerosis // Ann. Neurol. 1999. Jul. 46(1). P. 6-14.
Neurol. 1999. Jul. 46(1). P. 6-14.
81. Zuzak К. В., Theodore M., Kayfman M. et al. Lack of detection of Chlamydia pneumoniae by PCR and tissue culture in cerebrospinal fluids from multiple sclerosis patients and controls // Abstracts of Proceedings of the IV Meeting of the European Society for Chlamydial Research. P. 303.
82. Marcos M. A., Sanz A., Vidal J. Lack of detection of Chlamydia pneumoniae in cereprospinal fluid from patients with multiple sclerosis // Ibid. P. 278.
83. Miyashita N., Saida Т., Matsui M. et al. Does Chlamydia pneumoniae play a role in pathogenesis of multiple sclerosis // lbid. P. 280.
84. Paavonen J. Chlamydia and cancer // Ibid. P. 239-40.
85. Otzipka E., Fenner Th. et al. Chlamydia pneumoniae and lymphadenitis: Possibility of early diagnosis — follow up by defined Chlamydia rLPS-Serology: A case report // Abstracts of Proceedings of the 3rd Meeting of the European Society for Chlamydial Research. P. 231.
P. 231.
86. Kanauchi M., Kawano Т., Dohi К. Association of Chlamydia pneumoni-ae infection with diabetic nephropathy // Diabetes Res. Clin. Pract. 2000 Jan. 47(1). P. 45-8.
87. Schumacher H. Ft., Jr, Gerard H. C. et al. Lower prevalence of ff Chlamydia pneumoniae DNA compared with Chlamydia trachomatis 1-p DNA in synovial tissue of arthritis patients // Arthritis Rheum. 1999. Sep. 42(9). P. 1889-93.
88. Schumacher R. H., Jr. Chlamydial artritis // Abstracts of Proceedings of the IV Meeting of the European Society for Chlamydial Research. P. 229-30.
89. Boman J. Diagnosis of Chlamydia pneumoniae infections // Ibid. P. 65-58.
90. Naas J., Gnarpe J. A. Demonstration of Chlamydia pneumoniae in tissue by immunohistoctemistry // APMIS. 1999. Sep 107(9). P. 882-6.
91. Anttila T, Leinonen M., Surcel H. M., von Hertzen L. et al. IgG subclass-specific antibodies in Chlamydia pneumoniae infections // Scand. J. Infect. Dis. 1998. 30 (4). P. 381-6.
J. Infect. Dis. 1998. 30 (4). P. 381-6.
92. Saikku P. Diagnosis of acute and chronic Chlamydia pneumoniae infections // Abstract Proceeding of the Eighth International Symposium on Human Chlamydia Infections, 19-24 June 1994. P. 163-72.
93. Farholt S., Boman J. et al. Chlamydia pneumoniae PCR: quality control is needed. P. 95.
94. Apfalter P., Blasi F., Boman J., Gaydos C. A. et al. Multicenter Comparison Trial of DNA Extraction Methods and PCR: Assays for Detection of Chlamydia pneumoniae in Endarterectomy Specimens // J. Clin. Microbiol. 2001. Feb. 39(2). P. 519-24.
95. Apfalter P., Durack D. T. and Gaydos C. A. Detection of Chlamydia pneumoniae by real-time strand displacment // Abstracts of Proceedings of the IV Meeting of the European Society for Chlamydial Research. P. 99.
96. Gnarpe J., Lindquist L. A new DIG-PCR-EIA method for the detection of Chlamydia pneumoniae DNA in clinical samples // APMIS. 2000. Sep. 108(9). P. 626-32.
2000. Sep. 108(9). P. 626-32.
97. Манзенюк И. H., Воробьева M. С., Ямникова С. С. Пневмония, вызванная Chlamydophila (Chlamydia) pneumoniae: клиника, диагностика и лечение // Антибиотики и химиотерапия. 2001. 46. 1. С. 22-29.
98. Kuo С. С. and Grayston J. T. In vitro drug susceptibility of Chlamydia sp. Strain TWAR // Antimicrob. Agents Chemother. 1988. 32. P. 257.
99. Roblin P. M., Hammerschlag M. R. Microbiologic efficacy of azithromycin and susceptibilities to azithromycin of isolates of Chlamydia pneumoniae from adults and children with community-acquired pneumonia // Antimicrob. Agents Chemother. 1998. Jan. 42(1). P. 194-6.
100. Roblin P. M., Kutlin A. et al. Activity of grepafloxacin and other fluoroquinolones and newer macrolides recent clinical isolates of Chlamydia pneumonia // J. Antimicrob. Agents. 1999. Jul. 12(2). P. 181-4.
101. Roblin P. M., Hammerschlag M. R. In vitro activity of a new ketolide antibiotic, HMR 3647, against Chlamydia pneumoniae // Antimicrob. Agents Chemother. 1998. Jun. 42(6). P. 1515-6.
In vitro activity of a new ketolide antibiotic, HMR 3647, against Chlamydia pneumoniae // Antimicrob. Agents Chemother. 1998. Jun. 42(6). P. 1515-6.
102. Cooper M. A., Baldwin D., Matthews R. S. et al. In vitro susceptibility of Chlamydia pneumoniae (TWAR) to seven antibiotics // J. Antimicrob. Chemother. 1991. 28. P. 407.
103. Hammerschlag M. R., Qumei K. K. and Roblin P. M. In vitro activity of azithromycin, clarithromycin, L-ofloxacin and other antibiotics against Chlamydia pneumoniae // Antimicrob. Agents Chemother. 1992. 36. P. 1573.
104. Welsh L. E., Gaydos C. A. and Quinn Т. С. In vitro evaluation of activities of azithromycin, erythromycin and tetracycline against Chlamydia trachomatis and Chlamydia pneumoniae // Ibid. P. 291.
105. Id. In vitro activities of azithromycin, clarithromycin, erythromycin and tetracycline against 13 strains of Chlamydia pneumoniae // Antimicrob. Agents Chemother. 1996. 40. P. 212-14.
1996. 40. P. 212-14.
106. Gnarpe J., Eriksson K., Gnarpe H. In vitro activities of azitromycin and doxycicline against 15 isolates of Chlamydia pneumoniae // Ibid. P. 184.
107. Roblin P. M., Reznik T, Kutlin A., Hammerschlag M. R. In Vitro Activities of Gemifloxacin (SB 265805, LB20304) against Recent Clinica Isolates of Chlamydia pneumoniae // Antimicrob. Agents Chemother. 1999. Nov. 43(11). P. 2806-7.
108. Roblin P. M., Hammerschlag M. R. In vitro activity of GAR-936 against Chlamydia pneumoniae and Chlamydia trachomatis // Int. J. Antimicrob. Agents. 2000. Sep. 16(1). P. 61-3.
109. Miyashita N, Niki Y, Kishimoto T, Nakajima M, Matsushima T. In vitro and in vivo activities of AM-1155, a new fluoroquinolone, against Chlamydia spp. // Antimicrob Agents Chemother. 1997. Jun. 41(6). P. 1331-4.
110. Pechere J. C., Gootz T. D. Bacteriological activity of trovafloxacin, a new quinolone, against respiratory tract pathogens // Eur. J. Clin. Microbiol. Infect. Dis. 1998. 17 (6). P. 405-12.
J. Clin. Microbiol. Infect. Dis. 1998. 17 (6). P. 405-12.
111. Harris J. A., Kolokathis A., Campbell M., Cassell G. H., Hammerschlag M. R. Safety and efficacy of azithromycin in the treatment of community-acquired pneumonia in children // Pediatr. Infect. Dis. J. 1998. Oct. _ 17(10). P. 865-71.
112. Hammerschlag M. R. Antimicrobial susceptibility and therapy of infections caused by Chlamydia pneumoniae // Antimicrob. Agents Chemother. 1994. J38_P. J 873-8.
113. Mosorin M., Juvonen J., Surcel H. M. et al. Doxicyclin decreases the growth rate of abdominal aortic aneureysm prospective, randomized, double blinded study // Abstracts of Proceedings of the IV Meeting of _the European Society for Chlamydial Research. P. 399.
114. Hang D., Cambell L. A., Kuo С. С. Failure of four and six weeks of treatment to eradicate evidence of Chlamydia pneumoniae from human lung and vascular tissue: pathology case reports // Ibid. P. 395.
P. 395.
115. Ostergaard L., Sorensen H. Т., Lindholt J. et.al. Risk of cardio-vascular events in patients aged 50-70 years treated with macrolides versus penicillins // Ibid. P. 421.
116. Pentila Т., Vuola J. M., Puurala V. et al. Immunity to Chlamydia pneumoniae induced by DNA vaccination // Ibid. P. 403.
117. Penttila Т., Vuola J. M., Puurula V, Anttila M., San/as M., Rautonen N., Makela P. H., Puolakkainen M. Immunity to Chlamydia pneumoniae induced by vaccination with DNA vectors expressing a cytoplasmic protein (Hsp60) or outer membrane proteins // Vaccine. 2000. Dec. 8. 19(9-10). P. 1256-65.
Хламидии — Инфекционные болезни — Справочник MSD Профессиональная версия
Поскольку хламидийная генитальная инфекция настолько распространена и часто является бессимптомной, или вызывает только незначительные или неспецифические симптомы (особенно у женщин), ЦКЗ (CDC) рекомендует плановый скрининг людей без проявления симптомов из группы высокого риска заболевания, передающимся половым путем (см. Руководство 2015 г по лечению болезней, передающихся половым путем [2015 Sexually Transmitted Diseases Treatment Guidelines]).
К лицам, подлежащим скринингу, относятся:
Небеременным женщинам (в том числе, женщинам, имеющим половые контакты с женщинами) рекомендован ежегодный скрининг, если они:
-
Сексуально активны и < 25
-
Иимеют предшествующие случаи ЗППП в анамнезе
-
Ведут половую жизнь, сопряженную с высоким риском (например, вступают в половую связь с новым партнером или несколькими половыми партнерами, занимаются проституцией)
-
Имеют партнера с ЗППП или находящегося в группе высокого риска
У беременных проводят скрининг во время их первоначальной дородовой консультации; у тех, кто < 25 или имеют факторы риска, еще раз проводят скрининг в течение III триместра.
Гетеросексуальным мужчинам не проводят скрининг, за исключением случаев с высокой распространенностью хламидийной инфекции, включая подростков или клинику ЗППП либо при поступлении в исправительные учреждения.
мужчинам, имеющим половые контакты с мужчинами, проводят скрининг, если они были сексуально активны в течение предыдущего года:
-
Для «вводящего» партнёра при анальном сексе – анализ мочи
-
Для «принимающего» партнёра при анальном сексе – ректальный смыв
-
При оральном сексе – смыв из глотки
Хламидия (Chlamydia pneumoniae) (антитела класса IgМ)
Хламидия — это грамотрицательная бактерия округлой формы диаметром до 350 нм, живущая и размножающаяся только в организме человека без потребности в кислороде. Внутриклеточный микроорганизм, т.к. паразитирует внутри клеток хозяина. Переносчиками других хламидий и хламидофил могут быть еще птицы, попугаи и млекопитающие. Этот микроорганизм неустойчив к воздействиям вне организма. Является возбудителем заболеваний респираторного тракта человека, такими, как острые и хронические пневмонии, бронхиты, ларингиты. Изучается влияние C. Pneumoniae на развитие бронхиальной астмы, атеросклероза, миокардита, менингоэнцефалита, реактивного артрита, синдрома Гийена-Барре.
Путь заражения хламидией рneumoniae воздушно-капельный Источники заражения – больные и носители этой бактерии. После проникновения в организм она прикрепляется к внешней мембране клеток, проникает внутрь и начинает паразитическое существование, используя клетки хозяина. Инкубационный период 2-4 недели. Клетки, чувствительные к этой бактерии, выстилают слизистую оболочку дыхательных органов человека. Чаще всего последствием заражения становится пневмония. Но в связи с расширением списка заболеваний, предположительным возбудителем которых она является, пересматриваются и исследуются другие возможные пути ее передачи и распространения. Предполагается, что каждые четыре года заболеваемость из-за этой бактерии увеличивается. Также отмечается большой процент пожилых людей, у которых диагностируется пневмония, вызванная хламидией рneumoniae. У пожилых людей заболевание обычно протекает в более тяжелой форме из-за слабого иммунитета и наличия различных сопутствующих хронических заболеваний, симптомы становятся более выраженными, к тому же в этом возрасте зачастую происходит реинфекция И, если изначально заражение хламидиозом происходит в возрасте от 7 до 40 лет, то повторное инфицирование – в пожилом. Заболевание развивается по двум типам: остро или постепенно, в обоих случаях симптомы сходны.
Затруднения при установлении этиологического диагноза связаны с тем, что в отличие от бактериальных пневмоний, при хламидийной пневмонии отсутствуют отчетливые физикальные и рентгенологические признаки, а также характерные изменения в периферической крови. В этих условиях необходимо использовать лабораторные методы диагностики (ИФА, ПЦР и др.).
Диагностика заболеваний, вызванных хламидией рneumoniae проводится прямым и непрямым методами в комплексе. Прямой метод — выделение ДНК хламидии рneumoniae в соскобах с задней стенки глотки или из крови.
Серологическая диагностика основывается на обнаружении антител классов IgM, IgA и IgG. Антитела класса М – маркер острой инфекции. Они выявляются через 2-4 недели от начала клинических проявлений, являясь ранним серологическим маркером, и циркулируют не более 2 месяцев. Антитела класса А – маркер текущей и недавней инфекцией. Появляются в крови через 4-6 недель от начала заболевания, долго циркулируют в крови, не менее полугода. Длительное определение IgA свидетельствует о хроническом течении заболевания.
Антитела класса G выявляются в крови на 6-8 неделе от начала заболевания и определяются длительное время после выздоровления – до 3 лет. Эти антитела не обеспечивают протективного иммунитета, возможно повторное заражение. Длительное выявление высоких титров IgG свидетельствует также о хроническом течении заболевания.
Показания для исследования на антититела класса М к хламидии pneumonia:
- Длительный кашель, фарингиты, синуситы, отиты, ларингиты, острые и хронические заболевания верхних дыхательных путей
- Часто болеющие дети
- С целью определения стадии заболевания — острое течение, реактивация или реинфекция;
- Оценка эффективности проводимого лечения (наряду с исследованием методом ПЦР).
- Установление хламидийной этиологии экстрагенитальных поражений
- артриты, пневмонии, заболевания глаз
Необходимо воздержаться от приема пищи в течение 2-3 часов.
Между нами, девочками
Вовремя начатое лечение хламидиоза – залог вашего здоровья и здоровья ваших детей
«Вам надо сдать анализ на хламидии» – такую рекомендацию нередко дают женщинам, обратившимся к врачу с неясными симптомами, особенно в мочеполовой системе, а также тем, кто решил родить ребенка. Многие слышали про хламидиоз, или хламедийную инфекцию, но что это такое, чем вызывается, знают не все.
Коварные микроорганизмы
Хламидии – это микроорганизмы, обитающие в организме человека и животных и вызывающие различные заболевания, такие как урогенитальный хламидиоз, а также трахома, пневмония, респираторные болезни, артрит, энцефаломиокардит, венерический лимфогрануломатоз. Хламидии интересны тем, что обладают свойствами как бактерий, так и вирусов. Это очень маленькие микроорганизмы, имеющие основные признаки бактерий, но они могут существовать и внутри клеток, что объединяет их с вирусами. И еще, так же как и вирусы, хламидии на некоторых этапах развития не поддаются действию антибиотиков.
Хламидии живут в клетках эпителия, поэтому поражают слизистые оболочки, которые выстланы эпителиальными клетками. Это, безусловно, патогенные микроорганизмы, в отличие, например, от уреаплазмы.
В роду Chlamydia выделяют четыре вида. Но наиболее распространенный и опасный, встречающийся только у человека, – хламидия трахоматис (Chlamydia trachomatis), а урогенитальный хламидиоз, который она вызывает, – одна из самых часто встречающихся инфекций. Заражение этой инфекцией происходит в большинстве случаев при сексуальном контакте, поэтому хламидиоз относят к ЗППП – заболеваниям, передающимся половым путем, или венерическим болезням.
Поселяясь на слизистых оболочках мочеполового тракта: маточных труб, канала шейки матки, уретры — хламидия трахоматис вызывает развитие воспаления в мочеполовых органах. При не выявленной и не пролеченной инфекции процесс в конечном итоге переходит в хроническую форму, давая серьезные осложнения, в том числе и бесплодие.
Хламидия трахоматис поражает как мужчин, так и женщин, но для последних эта инфекция особенно опасна. Дело в том, что у женщин хламидиоз на первых этапах протекает без видимых проявлений. Врачи считают, что шестьдесят-семьдесят процентов пациенток не имеют никаких субъективных симптомов заболевания. Поэтому они обращаются к врачу только тогда, когда воспаление переходит в хроническую стадию, распространяется на другие органы и вызывает различные заболевания мочеполовой сферы.
Симптомы и лечение
Как же происходит заражение хламидиями у женщин? Чаще всего первоначально поражается канал шейки матки и развивается цервицит. Оттуда инфекция может распространиться на внутренние оболочки матки, что приведет к их воспалению – эндометриту. В результате беременность и развитие плода становятся невозможными. Из пораженной матки хламидии проникают на половые органы, расположенные выше: маточные трубы и яичники. Сальпингит, или воспаление маточных труб, нередко вызывает их непроходимость и, как следствие, бесплодие.
Инфекция может поражать и мочеиспускательный канал, приводя к уретриту. Половые пути женщины через маточные трубы соединяются с полостью живота, поэтому хламидии могут проникать и на слизистые оболочки органов живота, способствуя развитию в них воспалительных процессов и образованию спаек.
Если женщина беременна, то инфекция может передаться малышу, когда он проходит через родовые пути. А это грозит ему такими заболеваниями, как конъюнктивит пневмония, вульвовагинит, уретрит. Возможно поражение и других органов ребенка.
Особенность хламидии трахоматис состоит в том, что после перенесенной инфекции иммунитет к ней не вырабатывается, поэтому хламидиозом можно заражаться неоднократно.
Чем еще опасна хламидия трахоматис? Сегодня специалисты установили, что эта инфекция вызывает серьезные нарушения иммунитета, а это, в свою очередь, грозит развитием различных осложнений, в том числе болезней суставов и внутренних органов. Одно из тяжелых осложнений хламидиоза – болезнь (или синдром) Рейтера. Это одновременное поражение суставов, глаз и мочеполовых органов. Правда, болеют ей преимущественно молодые мужчины.
Чтобы избежать этих серьезных последствий хламидиоза, рекомендуется обследоваться на хламидии женщинам, входящим в группы риска:
• с воспалительными заболеваниями половых органов, особенно с эрозией шейки матки и цервицитом;
• страдающим бесплодием на протяжении двух-трех лет;
• женщинам с осложненной беременностью (угроза прерывания, лихорадка неясной природы, многоводие), а также тем, у кого предыдущие беременности проходили с патологиями (выкидыш, замершая беременность, преждевременные роды и т.д.).
Ну и чтобы свести к минимуму возможность заражения, желательно упорядочить половые связи (помните: хламидиоз передается половым путем) и предохраняться во время секса.
Дорогие женщины, берегите свое здоровье!
Т.И.Попова, врач-гинеколог ТОГБУЗ «ГКБ №3 г.Тамбова»
Материал опубликован в газете «Тамбовский курьер»
Медицинский центр «Консультант» — Серологические исследования
Микоплазма pneumoniae
Микоплазма pneumoniae относится к классу микоплазм, занимая промежуточное положение между вирусами, бактериями и простейшими. Паразитируя на клеточных мембранах, они вызывают заболевания респираторного тракта. Легочная инфекция чаще встречается в организованных коллективах с тесными контактами (в дошкольных, школьных учреждениях , военнослужащие и др.), возможны семейные случаи инфекции. Заболеваемость чаще регистрируется в осенне-зимний и весенний периоды. Восприимчивость к инфекции выше у мальчиков, чем у девочек.
Микоплазменная пневмония – заболевание из групп атипичных пневмоний, которое составляет до 15-20 % от всех случаев внебольничных пневмоний. Источником инфекции являются как больные, так и носители. Заражение происходит воздушно-капельным путем. Инкубационный период длится 2-3 недели. Заболевание сопровождается катаральными и респираторными проявлениями (заложенность носа, першение в горле, приступами навязчивого мало продуктивного кашля), интоксикационным синдромом (субфебрилитетом, слабостью, головной болью, миалгией), явлениями диспепсии (дискомфорт в ЖКТ). Наиболее тяжело переносят пневмонию маленькие дети, а также люди с ослабленной иммунной системой, например больные ВИЧ. Микоплазма пневмония ассоциируется также с нереспираторными заболеваниями, такими как менингиты, энцефалиты, панкреатиты и др. Без данных лабораторных исследований, на основании только клинической картины, дифференцировать микоплазменную инфекцию от ОРЗ практически невозможно.
Лабораторная диагностика заболевания Микоплазма pneumoniae осуществляется в основном серологическими методами, которые позволяют выявлять в крови больного специфические антитела класса А, М, G, а также методом ПЦР.
В лаборатории нашего центра проводятся исследование на маркеры микоплазменной инфекции:
- Антитела класса IgA к микоплазме pneumoniae, которые вырабатываются в организме в период выраженных клинических проявлений и являются показателем текущего заболевания. Выявление антител класса А к микоплазме пневмония более актуально среди взрослых, чем антитела класса М, которые могут отсутствовать при повторном инфицировании.
- Антитела класса IgМ к микоплазме pneumoniae. Первыми в ответ на попадание инфекции в организм иммунная система вырабатывает специфические иммуноглобулины класса М, которые достигают пикового уровня через 1-4 недели, затем снижаются и сохраняются до нескольких месяцев. Обнаружение IgM к микоплазме pneumoniae в крови свидетельствует об остром периоде микоплазменной инфекции. Выявление этих антител наиболее целесообразно в педиатрической практике. Иммунитет не является стойким, возможны случаи повторной инфекции.
- Антитела класса IgG, специфичные к микоплазме pneumoniae, появляются позже, чем антитела класса А, М и сохраняются длительное время (более года).
Хламидия pneumoniae
Хламидия пневмония – это возбудитель, занимающий промежуточное положение между вирусом и бактерией, который вызывает хронические инфекции верхних дыхательных путей, бронхиты, пневмонии и их осложнения. Инфекция может длительно персистировать в организме, утяжеляя течение бронхиальной астмы, хронического астматического бронхита. Результаты клинических исследований последних лет говорят о повреждающем влияние хламидий на эндотелий сосудов, который является пусковым и движущим механизмом образования атеросклеротических бляшек.
Клинические проявления хламидийной пневмонииНаиболее часто хламидийная пневмония, встречается у взрослых, особенно у лиц среднего и пожилого возраста. Сезонной закономерности распространения не выявлено. Механизм передачи-аэрогенный, путь передачи- воздушно-капельный. Инкубационный период составляет 2-4 недели. Обычно хламидийная пневмония начинается с респираторного синдрома, проявляющегося трахеобронхитом, назофарингитом, ларингитом; протекает с субфебрильной температурой, малопродуктивным, мучительным кашлем; характеризуется наличием внелегочных проявлений – кожных, суставных, гематологических, гастроэнтерологических, неврологических и других, а также не типичными лабораторными показателями-отсутствием лейкоцитоза и нейтрофильного сдвига в периферической крови. Рентгенологические изменения в легких отмечаются усилением легочного рисунка.
Стандартом серологической диагностики хламидийной инфекции на сегодня является ИФА метод (определение Ig M, Ig G антител в сыворотке крови). По динамике уровня специфических антител, можно установить характер и стадию заболевания.
В лаборатории нашего центра проводятся исследование на маркеры хламидийной инфекции:
- Антитела класса М к хламидии pneumoniae, которые появляются примерно через 3 недели после начала заболевания в невысоких титрах и начинают снижаться через 2 месяца.
- Антитела класса G к хламидии pneumoniae могут не выявляться до 6-8 недель от начала заболевания, затем титры быстро возрастают, достигая высоких уровней. Иммуноглобулины класса G могут выявляться до 3 лет. Стойкого иммунитета к хламидии пневмония не возникает.
Chlamydia Pneumoniae Infections — HealthyChildren.org
Когда вы слышите слово chlamydia, вы можете подумать о заболевании, передающемся половым путем (ЗППП) под этим названием. ЗППП вызывается Chlamydia trachomatis, одним видом из бактерий Chlamydia . Другой вид, называемый Chlamydia (или Chlamydophila ), pneumoniae, , вызывает респираторные заболевания. Эти легочные инфекции распространяются так же, как и многие другие респираторные заболевания.Они передаются от человека к человеку напрямую через кашель или чихание и косвенно от микробов на руках или других предметах. Пик числа этих инфекций приходится на детей школьного возраста от 5 до 15 лет.
Признаки и симптомы
Болезни, вызываемые C pneumoniae , могут вызывать продолжительный кашель, бронхит и пневмонию, а также боль в горле, ларингит, инфекции уха и синусит. Обычно они начинаются постепенно с боли в горле, за которой через неделю или больше следует кашель.Кашель может длиться от 2 до 6 недель. В некоторых случаях у ребенка может развиться бронхит или пневмония в легкой форме. В то время как у некоторых инфицированных детей симптомы проявляются от слабых до умеренных или вообще отсутствуют, у других инфекция может быть более тяжелой.
Как ставится диагноз?
Многие случаи C pneumoniae диагностируются педиатром после физического осмотра ребенка и изучения его симптомов. Врач также может назначить анализы крови, которые обнаруживают антитела к бактериям.Однако для того, чтобы антитела проявились в крови, может потребоваться неделя или больше. Хотя существуют специальные лаборатории, которые могут оценивать образцы мазков из носа или горла, в настоящее время нет надежных коммерчески доступных исследований.
Лечение
Выздоровление от респираторной инфекции Chlamydia может быть медленным. Ваш педиатр может назначить антибиотики, такие как эритромицин или тетрациклин, чтобы избавиться от инфекции и помочь вашему ребенку быстрее поправиться.
Профилактика
Чтобы снизить вероятность заражения вашего ребенка инфекцией C pneumoniae , ему следует соблюдать правила гигиены, включая частое мытье рук.
Информация, содержащаяся на этом веб-сайте, не должна использоваться вместо медицинской помощи и рекомендаций вашего педиатра. Ваш педиатр может порекомендовать различные варианты лечения в зависимости от индивидуальных фактов и обстоятельств.
Chlamydia Pneumoniae (Chlamydophila) — Консультант по инфекционным заболеваниям
ОБЗОР: Что нужно знать каждому врачу
Название и классификация возбудителя
Chlamydia pneumoniae — внутриклеточный организм с клеточной мембраной, но без клеточной стенки
Во многих исследованиях это третья или четвертая по частоте причина внебольничной пневмонии (ВП).Однако, учитывая трудности в постановке точного этиологического диагноза инфекции этим микроорганизмом, все еще существуют некоторые разногласия относительно того, является ли это основным патогеном при ВП.
Часто встречаются сочетанные инфекции S. pneumoniae и M. pneumoniae.
C. pnemoniae вызывает целый ряд хронических заболеваний, таких как атеросклероз, астма, артрит, рассеянный склероз и многие другие. Однако доказательства наличия причинной связи в большинстве из них неубедительны.
Большинство эмпирических методов лечения ВП антибиотиками относятся к C. pneumoniae.
Хламидии — облигатные внутриклеточные бактериальные патогены. Недавний таксономический анализ рода Chlamydia показал, что существует два рода — Chlamydia и Chlamydophila. Хламидофила имеет следующие виды: C. пекорум, вызывающий инфекцию у крупного рогатого скота, овец и коал; C. pneumoniae и C. psittaci; C. abortus, вызывающий аборт у овец и крупного рогатого скота; C. cavieae, вызывающая конъюнктивит морских свинок; и С.felis, вызывающий кератоконъюнктивит у кошек.
C. pneumoniae имеет грамотрицательную клеточную стенку и уникальный цикл развития с элементарными (инфекционная частица) и сетчатыми (внутриклеточная репликативная частица) телами. После заражения элементарные тельца (диаметром 200-400 нм) прикрепляются к клетке-хозяину за счет электростатического связывания и проникают в клетку посредством эндоцитоза. Элементарные тела (EB) дифференцируются в сетчатые тела (RB), которые подвергаются двойному делению. Примерно через 36 часов сетчатые тела (RB) снова дифференцируются в элементарные тела (EB).В клетке накапливается большое количество EB (примерно 500-1000), но функция клетки-хозяина не нарушается. Эти большие скопления, или микроколонии, называются внутрицитоплазматическими включениями. Во время этого процесса хламидийные антигены высвобождаются на поверхность клетки-хозяина, вызывая иммунный ответ. Высвобождение ЭБ происходит с помощью нескольких процессов, включая экструзию включения. Также вероятно, что C. pneumoniae переходит в устойчивое состояние, когда он метаболически неактивен и на этой стадии не зависит от терапии антибиотиками.Гамма-интерферон, антибиотики и недостаток питательных веществ являются вероятными факторами устойчивости C. pneumoniae.
C. pneumoniae была обнаружена в ходе исследований трахомы в 1960-х доктором Т. Грейстоном и его коллегами. Первоначально эти исследователи назвали недавно обнаруженный организм TWAR в честь своих первых двух изолятов TW-183 (TW для Twain) и AR-39 (AR для острых респираторных заболеваний). Существует только один серотип C. pneumonia, и все изоляты от людей на сегодняшний день имеют высокий процент (> 98%) родства.
C. pneumoniae — единственный вид, у которого есть ген udk, кодирующий уридинкиназу. Секвенирование штамма коалы C.pneumoniae позволяет предположить, что люди заразились этой инфекцией зоонозно.
Какое лечение лучше всего?
Предпочтительные противомикробные агенты включают Доксициклин 100 два раза в день в течение 14-21 дней; азитромицин 1,5 г перорально в течение 5 дней; кларитромицин 500 мг 2 раза в день в течение 10 дней; левофлоксацин 500 мг перорально или внутривенно 1 раз в сутки в течение 7-14 дней.
Данные о лечении ограничены.Исследования с использованием культуры показали, что макролиды (эритромицин, кларитромицин, азитромицин) и хинолоны (левофлоксацин и моксифлоксацин) уничтожают микроорганизмы в 70-86% случаев. Клиническое улучшение обычно наступает, несмотря на стойкость организма.
Устойчивость к хинолонам in vitro связана с точечной мутацией в гене GyrA.
Как пациенты заражаются этой инфекцией и как предотвратить ее распространение среди других пациентов?
Эпидемиология
С.pneumoniae — распространенный респираторный патоген. Инфекция часто происходит в детстве и подростковом возрасте, а к зрелому возрасту инфицировано около 80% населения. Бессимптомные респираторные инфекции встречаются у 2-5% взрослых и детей. Роль такой инфекции неясна. Нет сезонных колебаний, хотя есть предположение о четырехлетнем цикле заболеваемости C. pneumoniae pneumonia. Пневмония, вызванная этим организмом, встречается во всем мире. В одном исследовании на его долю приходилось 8% случаев в Северной Америке, 7% в Европе, 6% в Латинской Америке и 5% в Азии / Африке.Ставки самые высокие среди лиц младше 1 года и старше 70 лет.
Часто встречаются сочетанные инфекции S. pneumoniae и M. pneumoniae.
Взрослые, серопозитивные по C. pneumoniae, с большей вероятностью имели более высокий индекс массы тела, курили в настоящее время и имели хроническую обструктивную болезнь легких и более высокое систолическое артериальное давление, чем серонегативные субъекты.
Заражение через капельное заражение произошло во время лабораторной аварии.C. pneumoniae может выжить на столешнице до 30 часов. Описано распространение в семьях, призывниках и домах престарелых. Интересно, что по крайней мере в одной вспышке в доме престарелых те, кто имел более высокий уровень физической активности, были более подвержены заражению. Контакт с инфицированными обитателями дома престарелых был фактором риска заражения персонала.
Нет сезонных различий в заболеваемости C. pneumonia, и заболеваемость остается стабильной.
Проблемы инфекционного контроля
В повседневной практике нет проблем с инфекционным контролем, так как редко кто знает, что инфекция вызвана этим микроорганизмом.Однако в случае вспышки, вызванной C. pneumoniae, или если вы знаете, что респираторная инфекция вызвана этим организмом, следует соблюдать респираторные меры предосторожности.
В настоящее время вакцины нет, и противоинфекционная профилактика не рекомендуется.
Каковы клинические проявления заражения этим организмом?
Наиболее частыми проявлениями являются инфекции дыхательных путей, проявляющиеся в виде пневмонии или фарингита.
Инкубационный период 21 день.Продолжительность симптомов до госпитализации составляла 4,6 дня для C. pneumoniae по сравнению с 12,9 дней для пациентов с другими причинами пневмонии. Заболевание варьируется от легкой до очень тяжелой. Большинство случаев имеют легкую и среднюю степень тяжести. Симптомы неспецифичны. Охриплость голоса чаще связана с пневмонией, вызванной C. pneumoniae, чем с другими респираторными патогенами. Лихорадка может сопровождаться миалгией и ознобом, а затем кашлем. Кашель, вероятно, является наиболее заметным признаком болезни. Кашель и недомогание могут сохраняться в течение нескольких месяцев, несмотря на терапию антибиотиками.Это может вызвать пневмонию у хозяина с ослабленным иммунитетом.
При сравнении симптомов и признаков 18 пациентов с серологическим диагнозом C. pneumoniae с 282 пациентами с внебольничной пневмонией, у которых антитела к C. pneumoniae были отрицательными, различий в симптомах или клинических проявлениях не выявлено. В этом исследовании 61% пациентов с C. pneumoniae имели количество лейкоцитов более 10 000 на микролитр. Во многих описаниях пневмонии, вызванной C. pneumoniae, количество лейкоцитов считается нормальным.Продолжительность пребывания в больнице для пациентов с C. pneumoniae была больше — 9 плюс-минус 7,3 дня по сравнению с 7,58 плюс-минус 3,49 дня для пациентов с C. pneumoniae и сопутствующим патогеном. Уровень смертности от C. pneumoniae составил 4,9%, что незначительно отличалось от остальных случаев пневмонии.
В одном исследовании у пациентов с пневмонией, вызванной C. pneumoniae, была большая вероятность развития застойной сердечной недостаточности, чем у пациентов с пневмококковой пневмонией. Это может быть отражением более старшего возраста, так как средний возраст был 67 и 55 лет для C.pneumoniae и S.pneumoniae соответственно.
Рентгенологические проявления C. pneumoniae во многом такие же, как показано выше, и не являются специфическими для этого заболевания. При обзоре компьютерно-томографических характеристик 40 пациентов с пневмонией, вызванной C. pneumoniae, по сравнению с 42 пациентами с пневмонией Mycoplasma pneumoniae, выявлены следующие особенности:
Затухание в матовом стекле (n = 38) и ацинарные паттерны (n = 28) были основными результатами КТ при пневмонии C. pneumoniae.
Ацинарный паттерн и плевральный выпот чаще наблюдались у пациентов с пневмонией, вызванной M. pneumoniae.
Центрилобулярные узелки и утолщение стенок бронхов встречались реже, чем при пневмонии M. pneumoniae.
C. pneumoniae и хронические заболевания
Астма
Хроническая стойкая инфекция C. pneumoniae связана с астмой, артритом и атеросклерозом.
В начале 1990-х работники в США сообщили о связи между серологическими признаками острой C.pneumoniae и астма. С тех пор в разных странах был проведен ряд исследований, чтобы определить, действительно ли это связь. Интраназальная инокуляция мышей C. pneumoniae приводит к стойкой гиперчувствительности дыхательных путей и воспалению дыхательных путей. В недавнем систематическом обзоре делается вывод, что C. pneumoniae, по-видимому, больше связана с персистированием астмы, чем с обострениями. Кокрановский обзор лечения марколидом хронической астмы выявил общий положительный эффект на симптомы и эозинофильные маркеры воспаления.
Атеросклероз
Воспаление — важный, но малоизученный фактор развития атеросклероза. Традиционные факторы риска гипертонии, дислипидемии, табакокурения, ожирения и семейного анамнеза не полностью объясняют, как воспаление способствует прогрессированию атеросклероза. Таким образом, внимание обращено на возможность того, что микробные инфекции и иммунологические механизмы играют роль в патогенезе атеросклероза.Исследование случай-контроль, проведенное в Финляндии в 1988 году, показало, что пациенты с ишемической болезнью сердца чаще имеют антитела к C. pneumoniae, чем контрольные субъекты. С тех пор было проведено множество исследований, пытающихся установить, что C. pneumoniae действительно играет роль в развитии атеросклероза. Серологические исследования и исследования изоляции не подтвердили причинно-следственную связь. В значительной степени это связано с межлабораторными различиями в используемых методах. Например, контаминация часто встречается при вложенной полимеразной цепной реакции (ПЦР), но в меньшей степени при ПЦР в реальном времени.В более позднем подходе использовался количественный анализ липополисахарида хламидии. При использовании этого подхода была выявлена корреляция между уровнями cLPS в сыворотке крови и уровнями С-реактивного белка при остром инфаркте миокарда и нестабильной стенокардии.
Другой подход — использовать терапию антибиотиками, чтобы повлиять на исход ишемической болезни сердца. Мета-анализ 11 рандомизированных испытаний, в которых приняли участие 19 217 пациентов, которые использовали различные антибиотики и разную продолжительность наблюдения, не обнаружил эффекта от антибиотиков, и действительно, пять из более крупных исследований отдают предпочтение плацебо.
Исследователи сейчас используют протеомный подход к этой проблеме. Восемь (RpoA, MOMP, YscC, Pmp10, PorB, Pmp21-m, GroEL и Cpaf-c) из 31 антигенов C. pneumoniae показали более высокую реактивность с сыворотками от ПЦР-положительных доноров с использованием метода двумерного гель-иммуноблоттинга. Кроме того, ответ антител у субъектов с положительной реакцией на ДНК C. pneumonia показал реактивность по отношению к антигенам, селективно повышенную во время персистенции C. pneumoniae.
С.пневмонии и рассеянный склероз
Chlamydia pneumoniae — один из длинного списка (более 20) вирусов и бактерий, которые были вовлечены в этиологию рассеянного склероза за последние 50 лет. Действительно, самые последние разногласия в этой области заключаются в том, что расширение и стентирование стенозированных шейных вен приводит к заметному улучшению симптомов рассеянного склероза (РС). Гипотеза заключается в том, что C. pneumoniae действует как кофактор для усиления уже установленного воспалительного и демиелинизирующего процесса при РС.На сегодняшний день нет доказательств роли C. pneumoniae в развитии рассеянного склероза.
C. pneumoniae и болезнь Альцгеймера
В одном исследовании большая часть образцов головного мозга пациентов с болезнью Альцгеймера была положительной на C. pneumonia в ПЦР, в то время как образцы головного мозга, не относящиеся к контрольной группе, не страдающие болезнью Альцгеймера, не были. В одном исследовании 3-месячный курс доксициклина был назначен пациентам с AD, и через 6 месяцев в группе лечения наблюдалось меньшее снижение когнитивных функций, чем в контрольной группе.
C. pneumoniae и реактивный артрит
В 1916 году был отмечен воспалительный артрит после эпизода дизентерии. С тех пор несколько видов бактерий, включая C. pneumonia, были замешаны в реактивном артрите (синдром Рейтера). Тринадцать процентов из 200 пациентов с различными артритами и синовиальной биопсией дали положительный результат на C. pneumoniae с помощью ПЦР. Как и в случае с другими хроническими заболеваниями, роль C. pneumoniae в реактивном артрите далеко не ясна.
Какие общие осложнения связаны с инфицированием этим возбудителем?
Как идентифицировать организм?
C. pneumoniae имеет уникальный цикл развития с элементарными (инфекционная частица) и сетчатыми (внутриклеточная репликативная частица) телами. После заражения элементарные тельца (диаметром 200-400 нм) прикрепляются к клетке-хозяину за счет электростатического связывания и проникают в клетку путем эндоцитоза. Элементарные тела дифференцируются в сетчатые тела, которые подвергаются двойному делению.Примерно через 36 часов RB снова дифференцируются в EB. В клетке накапливается большое количество EB (около 500-1000), но функция клетки-хозяина не нарушается. Эти большие скопления или микроколонии называются внутрицитоплазматическими включениями. Во время этого процесса хламидийные антигены высвобождаются на поверхность клетки-хозяина, вызывая иммунный ответ. Высвобождение ЭБ происходит с помощью нескольких процессов, включая экструзию включения. Также вероятно, что C. pneumoniae переходит в устойчивое состояние, когда он метаболически неактивен и на этой стадии не зависит от терапии антибиотиками.Гамма-интерферон, антибиотики и недостаток питательных веществ являются вероятными факторами устойчивости C. pneumoniae.
C. pneumoniae можно выделить в культуре ткани с использованием клеток HEp-2. Образцы мазков из носоглотки или глотки, собранные с помощью тампонов из дакрона с алюминиевым стержнем или пластмассовым стержнем, имеют важное значение, поскольку альгинат кальция или ватные наконечники и деревянные стержни могут подавлять рост микроорганизмов в культуре ткани и могут быть токсичными для клеток. Через 72 часа инкубации рост можно определить с помощью иммунофлуоресцентного красителя.Для обнаружения роста может потребоваться более одного прохода.
ПЦР все еще является исследовательским тестом.
Вероятно, лучше всего подойдет тест на микроиммунофлуоресценцию (MIF). Иммуноферментный анализ (ELISA) легче выполнять. Поскольку C. pneumoniae является внутриклеточным организмом, неудивительно, что существует слабая корреляция между прямым обнаружением организма с использованием изоляции или ПЦР и серологией. Трудности использования серологии для этиологического диагноза инфекции C. pneumoniae иллюстрируются двумя исследованиями пневмонии, в которых у 7-13% пациентов были положительные культуры на C.pneumoniae и 7-18% имели положительную серологию MIF. Единственная проблема в том, что это были разные пациенты.
Точный лабораторный диагноз инфекции C. pneumoniae зависит от высокой квалификации лабораторных работников и доступа к средствам для культивирования тканей.
Как этот организм вызывает болезнь?
По большей части механизмы того, как C. pneumoniae вызывает повреждение тканей, неизвестны. Однако о том, как C.trachomatis вызывает повреждение тканей, и многие из тех же механизмов могут действовать в отношении C. pneumoniae. Хламидийный белок теплового шока 60 (hsp 60) вызывает антительный ответ, связанный с повреждением глаз и половых путей, когда C. trachomatis заражает эти области. Существует предположение, что продолжающийся синтез hsp 60 во время латентного периода C. pneumoniae в дыхательных путях может быть связан с персистированием астмы.
КАКИЕ ДОКАЗАТЕЛЬСТВА для конкретных рекомендаций по ведению и лечению?
Hammerschlag, MR.«Достижения в борьбе с инфекциями». Expert Rev Anti-Infect Ther. т. 1. 2003. С. 493-504. (В этом источнике обобщены данные многоцентровых исследований, в которых для диагностики C. pneumoniae использовались культуры. Лечение эритромицином, кларитромицином, азитромицином, левофлоксацином и моксифлоксацином было примерно на 70-80% эффективным в уничтожении C. pneumoniae из носоглотки у детей и взрослых с внебольничная пневмония.)
Copyright © 2017, 2013 ООО «Поддержка принятия решений в медицине».Все права защищены.
Ни один спонсор или рекламодатель не участвовал, не одобрял и не платил за контент, предоставляемый Decision Support in Medicine LLC. Лицензионный контент является собственностью DSM и защищен авторским правом.
Хламидийные пневмонии: обзор, патофизиология, эпидемиология
Burillo A, Bouza E. Chlamydophila pneumoniae. Инфекция Dis Clin North Am . 2010 24 марта (1): 61-71. [Медлайн].
Crosse BA.Пситтакоз: клинический обзор. J Заражение . 1990 21 ноября (3): 251-9. [Медлайн].
Jain S, Self WH, Wunderink RG и др., Для исследовательской группы CDC EPIC. Внебольничная пневмония, требующая госпитализации среди взрослых в США. N Engl J Med . 2015 30 июля. 373 (5): 415-27. [Медлайн]. [Полный текст].
Ewig S, Torres A. Является ли Chlamydia pneumoniae важным патогеном у пациентов с внебольничной пневмонией ?. Eur Respir J .2003 май. 21 (5): 741-2. [Медлайн]. [Полный текст].
Cilloniz C, Ewig S, Polverino E, et al. Микробная этиология внебольничной пневмонии и ее отношение к степени тяжести. Грудь . 2011 Апрель 66 (4): 340-6. [Медлайн]. [Полный текст].
Blasi F, Tarsia P, Aliberti S. Chlamydophila pneumoniae. Clin Microbiol Infect . Январь 2009. 15 (1): 29-35. [Медлайн].
Dumke R, Schnee C, Pletz MW и др., Для исследовательской группы Capnetz Study Group.Mycoplasma pneumoniae и Chlamydia spp. инфекция при внебольничной пневмонии, Германия, 2011-2012 гг. Emerg Infect Dis . 2015 21 марта (3): 426-34. [Медлайн]. [Полный текст].
Choroszy-Krol I, Frej-Madrzak M, Jama-Kmiecik A, Sarowska J, Gosciniak G, Pirogowicz I. Заболеваемость Chlamydophila pneumoniae у детей в 2007-2010 гг. Ад Эксп Мед Биол . 2013. 788: 83-7. [Медлайн].
Арнольд Ф.В., Саммерсгилл Дж. Т., Ладжой А.С. и др. Для исследователей Организации внебольничной пневмонии (CAPO).Мировая перспектива атипичных патогенов внебольничной пневмонии. Am J Respir Crit Care Med . 15 мая 2007 г. 175 (10): 1086-93. [Медлайн]. [Полный текст].
Fajardo KA, Zorich SC, Voss JD, Thervil JW. Вспышка пневмонии, вызванная Chlamydophila pneumoniae, среди курсантов Академии ВВС США, Колорадо, США. Emerg Infect Dis . 2015, 21 июня (6): 1049-51. [Медлайн]. [Полный текст].
Центры по контролю и профилактике заболеваний.Сборник мер по борьбе с инфекцией Chlamydia psittaci среди людей (пситтакоз) и домашних птиц (птичий хламидиоз), 2000. MMWR Recomm Rep . 2000 14 июля. 49: 3-17. [Медлайн]. [Полный текст].
Центры по контролю и профилактике заболеваний. Сводка болезней, подлежащих уведомлению — США, 2010 г. MMWR Morb Mortal Wkly Rep . 2012 июн 1. 59 (53): 1-111. [Медлайн]. [Полный текст].
Tipple MA, Beem MO, Saxon EM. Клиническая характеристика афебрильной пневмонии, связанной с инфекцией Chlamydia trachomatis, у детей младше 6 месяцев. Педиатрия . 1979 Февраль 63 (2): 192-7. [Медлайн].
Edelman RR, Hann LE, Simon M. Chlamydia trachomatis pneumonia у взрослых: внешний вид на рентгенограмме. Радиология . 1984 августа 152 (2): 279-82. [Медлайн].
Sharma L, Losier A, Tolbert T, Dela Cruz CS, Marion CR. Атипичная пневмония: обновленная информация о Legionella, Chlamydophila и Mycoplasma pneumonia. Clin Chest Med . 2017 Март 38 (1): 45-58. [Медлайн]. [Полный текст].
Choroszy-Krol I, Frej-Madrzak M, Hober M, Sarowska J, Jama-Kmiecik A. Инфекции, вызванные Chlamydophila pneumoniae. Адвен Клин Эксп Мед . 2014 янв-фев. 23 (1): 123-6. [Медлайн]. [Полный текст].
Gacouin A, Revest M, Letheulle J, et al. Отличительные особенности внебольничной пневмонии (ВП), вызванной Chlamydophila psittaci, и ВП, вызванной Legionella pneumophila, поступившей в отделение интенсивной терапии (ОИТ). Eur J Clin Microbiol Infect Dis .2012 31 октября (10): 2713-8. [Медлайн].
Cunha BA. Атипичные пневмонии: клинический диагноз и значение. Clin Microbiol Infect . 2006 май. 12 Дополнение 3: 12-24. [Медлайн].
[Рекомендации] Baron EJ, Miller JM, Weinstein MP, et al. Руководство по использованию микробиологической лаборатории для диагностики инфекционных заболеваний: рекомендации Американского общества инфекционных болезней (IDSA) и Американского общества микробиологов (ASM) 2013 г. (a). Клиническая инфекция . 2013 57 августа (4): e22-e121. [Медлайн]. [Полный текст].
She RC, Thurber A, Hymas WC, et al. Ограниченная полезность посева на Mycoplasma pneumoniae и Chlamydophila pneumoniae для диагностики инфекций дыхательных путей. Дж. Клин Микробиол . 2010 Сентябрь 48 (9): 3380-2. [Медлайн]. [Полный текст].
Бенитес А.Дж., Турман К.А., Диаз М.Х., Конклин Л., Кендиг Н.Е., Винчелл Дж.М. Сравнение ПЦР в реальном времени и микроиммунофлуоресцентного серологического анализа для выявления инфекции chlamydophila pneumoniae в ходе расследования вспышки. Дж. Клин Микробиол . 2012 января 50 (1): 151-3. [Медлайн]. [Полный текст].
Kumar S, Hammerschlag MR. Острая респираторная инфекция, вызванная Chlamydia pneumoniae: современное состояние методов диагностики. Клиническая инфекция . 2007 15 февраля. 44 (4): 568-76. [Медлайн].
Smith KA, Bradley KK, Stobierski MG, Tengelsen LA; Национальная ассоциация государственных ветеринаров общественного здравоохранения Комитет по сборнику пситтакоза. Сборник мер по борьбе с инфекцией Chlamydophila psittaci (ранее Chlamydia psittaci) среди людей (пситтакоз) и домашних птиц, 2005 г. J Am Vet Med Assoc . 2005 15 февраля. 226 (4): 532-9. [Медлайн].
Виллегас Э., Сорлозано А., Гутьеррес Дж. Серологическая диагностика инфекции Chlamydia pneumoniae: ограничения и перспективы. J Med Microbiol . 2010 ноябрь 59 (Pt 11): 1267-74. [Медлайн].
Littman AJ, Джексон Лос-Анджелес, White E, Thornquist MD, Gaydos CA, Vaughan TL. Межлабораторная надежность теста микроиммунофлуоресценции для измерения титров антител к Chlamydia pneumoniae-специфическим иммуноглобулинам A и G. Clin Diagn Lab Immunol . 2004 г., май. 11 (3): 615-7. [Медлайн]. [Полный текст].
[Рекомендации] Манделл Л.А., Вундеринк Р.Г., Анзуето А. и др. От Общества инфекционных болезней Америки и Американского торакального общества. Общество инфекционных болезней Америки / Американское торакальное общество согласовали руководящие принципы ведения внебольничной пневмонии у взрослых. Клиническая инфекция . Март 2007. 44: Приложение 2: S27-72. [Медлайн]. [Полный текст].
[Рекомендации] Доуэлл С.Ф., Peeling RW, Боман Дж. И др., Для C.pneumoniae Участники семинара. Стандартизация анализов на Chlamydia pneumoniae: рекомендации Центров по контролю и профилактике заболеваний (США) и Лабораторного центра контроля заболеваний (Канада). Клиническая инфекция . 2001 15 августа. 33 (4): 492-503. [Медлайн]. [Полный текст].
Пирс В.М., Элкан М., Лит М., Макгоуэн К.Л., Ходинка Р.Л. Сравнение системы FilmArray технологии Айдахо с ПЦР в реальном времени для обнаружения респираторных патогенов у детей. Дж. Клин Микробиол .2012 Февраль 50 (2): 364-71. [Медлайн]. [Полный текст].
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. FDA расширяет использование респираторной панели FilmArray. Новости и события . 15 мая 2012 г. Доступно по адресу http://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm304177.htm.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA). Выпуск новостей. FDA расширяет использование респираторной панели FilmArray. Доступно по адресу http://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm304177.htm. Доступ: 26 февраля 2013 г.
Дыхательная панель BioFire Diagnostics Inc. FilmArray. Доступно по адресу http://www.biofiredx.com/pdfs/FilmArray/InfoSheet,%20FilmArray%20Respiratory%20Panel-0229.pdf. Доступ: 12 августа 2015 г.
Хвидстен Д., Хальворсен Д.С., Бердал Б.П., Гуттеберг Т.Дж. Диагностика Chlamydophila pneumoniae: важность методологии в отношении времени отбора проб. Clin Microbiol Infect . Январь 2009. 15 (1): 42-9.[Медлайн].
Basarab M, Macrae MB, Curtis CM. Атипичная пневмония. Curr Opin Pulm Med . 2014 май. 20 (3): 247-51. [Медлайн].
[Рекомендации] Balsamo G, Maxted AM, Midla JW, et al. Сборник мер по борьбе с инфекцией Chlamydia psittaci среди людей (пситтакоз) и домашних птиц (птичий хламидиоз), 2017. J Avian Med Surg . 2017 Сентябрь 31 (3): 262-82. [Медлайн]. [Полный текст].
[Рекомендации] Отдел профилактики ЗППП, Национальный центр профилактики ВИЧ / СПИДа, вирусных гепатитов, ЗППП и туберкулеза, Центры по контролю и профилактике заболеваний.Руководство по лечению болезней, передаваемых половым путем (ЗППП), 2015 г. Центры по контролю и профилактике заболеваний. 4 июня 2015 г. Доступно по адресу https://www.cdc.gov/std/tg2015/chlamydia.htm. Дата обращения: 10 ноября 2107 г.
Kohlhoff SA, Huband MD, Hammerschlag MR. Активность нового ингибитора ДНК-гиразы AZD0914 против Chlamydia trachomatis и Chlamydia pneumoniae in vitro. Антимикробные агенты Chemother . 2014 декабрь 58 (12): 7595-6. [Медлайн]. [Полный текст].
Biedenbach DJ, Huband MD, Hackel M, de Jonge BL, Sahm DF, Bradford PA.In vitro активность AZD0914, нового ингибитора бактериальной ДНК-гиразы / топоизомеразы IV, против клинически значимых грамположительных и привередливых грамотрицательных микроорганизмов. Антимикробные агенты Chemother . 2015 Октябрь 59 (10): 6053-63. [Медлайн]. [Полный текст].
van Rensburg DJ, Perng RP, Mitha IH, et al. Эффективность и безопасность немоноксацина по сравнению с левофлоксацином при внебольничной пневмонии. Антимикробные агенты Chemother . 2010 г., 54 (10): 4098-106. [Медлайн].[Полный текст].
Лю И, Чжан И, Ву Дж и др. Рандомизированное двойное слепое многоцентровое исследование фазы II, в котором сравнивали эффективность и безопасность перорального немоноксацина и перорального левофлоксацина при лечении внебольничной пневмонии. J Microbiol Immunol Infect . 2017 Декабрь 50 (6): 811-20. [Медлайн]. [Полный текст].
Kohlhoff SA, Hammerschlag MR. Лечение хламидийных инфекций: обновление 2014 г. Эксперт Опин Фармакотер .2015 16 февраля (2): 205-12. [Медлайн].
Роблин PM, Hammerschlag MR. Микробиологическая эффективность азитромицина и чувствительность к азитромицину изолятов Chlamydia pneumoniae от взрослых и детей с внебольничной пневмонией. Антимикробные агенты Chemother . 1998, январь, 42 (1): 194-6. [Медлайн]. [Полный текст].
Hammerschlag MR, Роблин PM. Микробиологическая эффективность левофлоксацина для лечения внебольничной пневмонии, вызванной Chlamydia pneumoniae. Антимикробные агенты Chemother . 2000 Май. 44 (5): 1409. [Медлайн]. [Полный текст].
Эларгуби А., Верховен П.О., Граттард Ф., Стефан Дж.Л., Ричард О., Поццетто Б. Острый энцефалит, связанный с респираторной инфекцией, вызванной Chlamydophila pneumoniae. Med Mal Infect . 2013 авг. 43 (8): 345-9. [Медлайн].
Керн Дж. М., Маасс В., Маасс М. Молекулярный патогенез хронической инфекции Chlamydia pneumoniae: краткий обзор. Clin Microbiol Infect .Январь 2009. 15 (1): 36-41. [Медлайн].
Gillissen A, Paparoupa M. Воспаление и инфекции при астме. Клин Респир Дж . 2015 июл.9 (3): 257-69. [Медлайн].
Ивен М.М., Хойманс В.Ю. Участие Chlamydia pneumoniae в развитии атеросклероза: дополнительные доказательства отсутствия доказательств. Дж. Клин Микробиол . 2005, январь, 43 (1): 19-24. [Медлайн].
Andraws R, Berger JS, Brown DL. Влияние антибактериальной терапии на исходы пациентов с ишемической болезнью сердца: метаанализ рандомизированных контролируемых исследований. ЯМА . 1 июня 2005 г. 293 (21): 2641-7. [Медлайн]. [Полный текст].
Grayston JT. Инфекции, вызванные штаммом Chlamydia pneumoniae TWAR. Клиническая инфекция . 1992 15 ноября (5): 757-61. [Медлайн].
Fine MJ, Smith MA, Carson CA, et al. Прогноз и исходы пациентов с внебольничной пневмонией. Метаанализ. ЯМА . 1996, 10 января. 275 (2): 134-41. [Медлайн].
Файл TM Jr, Tan JS, Plouffe JF.Роль атипичных патогенов: Mycoplasma pneumoniae, Chlamydia pneumoniae и Legionella pneumophila в респираторной инфекции. Инфекция Dis Clin North Am . 1998 Сентябрь 12 (3): 569-92, vii. [Медлайн].
Marrie TJ, Peeling RW, Reid T., De Carolis E. Виды хламидий как причина внебольничной пневмонии в Канаде. Eur Respir J . 2003 май. 21 (5): 779-84. [Медлайн]. [Полный текст].
Cipriano A, Machado A, Santos FV, Abreu MA, Castro RS.[Пситтакоз человека: отчет о болезни]. Порт Acta Med . 2019 28 февраля. 32 (2): 161-4. [Медлайн].
Kohlhoff SA, Huerta N, Hammerschlag MR. In vitro активность омадациклина против Chlamydia pneumoniae . Антимикробные агенты Chemother . 2019 Февраль 63 (2): [Medline]. [Полный текст].
Chlamydia pneumoniae часто обнаруживается в крови после острой легочной инфекции
В редакцию:
Облигатная внутриклеточная бактерия Chlamydia pneumoniae — частая причина острых респираторных инфекций с распространенностью во всем мире до 70% 1.Было высказано предположение, что персистенция бактерий после острой инфекции дыхательных путей или атеросклеротических кровеносных сосудов участвует в патогенезе хронических воспалительных заболеваний, таких как хроническая обструктивная болезнь легких и атеросклероз 2, 3. На животных моделях было показано, что после острого Инфекция легких C. pneumoniae , патоген системно распространяется в кровотоке с использованием моноцитов крови в качестве вектора 4, 5. Однако данные, подтверждающие эту гипотезу у людей, все еще отсутствуют.Из наблюдений in vitro, известно, что инфицирование C. pneumoniae моноцитов крови человека приводит к нерепликативному, но жизнеспособному состоянию патогена, который невосприимчив к лечению антибиотиками 6.
Целью данного исследования был анализ распространяется ли C. pneumoniae системно из легких в кровь у пациентов с острой инфекцией нижних дыхательных путей (LRTI). Пациенты, выздоравливающие после острой инфекции легких, вызванной C. pneumoniae , наблюдались на наличие C.pneumoniae в крови во время последующих визитов (через 30 и 90 дней после инфицирования) и по сравнению с пациентами после инфицирования Streptococcus pneumoniae .
Пациенты, поступающие в отделение неотложной помощи или амбулаторные отделения университетской больницы Шлезвиг-Гольштейн, кампус Любек (Любек, Германия) с рентгенологически подтвержденной нетяжелой внебольничной пневмонией (ВП) или тяжелой ИДПТ с лихорадкой, продуктивным кашлем и положительными результатами аускультативного исследования. протестировано в течение 3-летнего периода на наличие C.pneumoniae или S. pneumoniae в качестве возбудителей заболевания. Критериями включения были способность производить мокроту, выполнять функциональный тест легких и готовность вернуться для последующих посещений после выздоровления от острой инфекции; Исключались пациенты с иммунодефицитом и пациенты из домов престарелых. Первоначально было набрано 42 пациента с подтвержденной инфекцией C. pneumoniae или S. pneumoniae (CAP: n = 40; острый бронхит: n = 2).Чтобы преодолеть различия в частотах инфицирования C. pneumoniae и S. pneumoniae при острых респираторных инфекциях, набор пациента S. pneumoniae проводился после набора пациента C. pneumoniae . Три пациента с инфекцией C. pneumoniae были исключены из анализа из-за отзыва согласия или потери наблюдения. Клинические характеристики пациентов были задокументированы в день 0, 30 день (первый визит) и 90 день (второй визит).Образцы дыхательных путей и крови брали при поступлении и при каждом последующем посещении с дополнительными тестами функции легких при первом и втором посещении.
Диагностика инфекции, вызванной S. pneumoniae , была проведена на основании анализа культур респираторных образцов и крови, а также обнаружения пневмококкового антигена в моче (Binax NOW ® ; Inverness Medical International, Cranfield, UK). Образцы спонтанной или индуцированной мокроты (10-минутная ингаляция с 3% раствором NaCl) отбирались при каждом посещении для обнаружения S.pneumoniae (культура кровяного агара в соответствии с рекомендациями Института клинических и лабораторных стандартов (Уэйн, Пенсильвания, США)) или C. pneumoniae (ПЦР). Выделение моноцитов периферической крови (PBMC) из слепых образцов крови с ЭДТА и обнаружение C. pneumoniae с помощью ПЦР выполняли, как описано ранее 6. Протокол исследования был одобрен этическим комитетом Университета Любека (№: 01-148). ). Все пациенты были проинформированы о цели исследования и дали письменное согласие.Статистический анализ проводился с помощью программного обеспечения SPSS (SPSS Inc., Чикаго, Иллинойс, США) с использованием t-критерия для анализа непарных параметрических параметров и U-критерия Манна – Уитни для анализа непарных непараметрических параметров. Номинальные масштабированные параметры анализировали с использованием критерия хи-квадрат.
Всего в исследование были включены 39 пациентов. У 18 пациентов C. pneumoniae было обнаружено в мокроте как возбудитель острой респираторной инфекции, в том числе 16 пациентов с ВП и два пациента с острым бронхитом.21 пациент с инфекциями S. pneumoniae соответствовал критериям ВП. Характеристики пациентов в обеих группах не различались, за исключением того, что пациенты в группе S. pneumoniae были значительно старше (p <0,05) (таблица 1). На момент госпитализации у пациентов, страдающих инфекцией, вызванной S. pneumoniae , были сравнительно более высокие системные воспалительные маркеры, например . C-реактивный белок и количество лейкоцитов.
Таблица 1– Характеристики пациента на момент поступленияДля исследования системного распространения C.pneumoniae , образцы крови для C. pneumoniae ПЦР были взяты в течение 30 и 90 дней (первое и второе посещение соответственно) после заражения. PBMC пациентов, выздоравливающих после острой инфекции легких, вызванной C. pneumoniae , были значительно чаще положительными на хламидийную ДНК в течение 30 дней после инфицирования по сравнению с контрольной группой S. pneumoniae (72,7% против 17%, p = 0,007) (рисунок 1). Обнаружение ДНК C. pneumoniae в циркулирующих лейкоцитах с помощью ПЦР ранее было показано как ценный инструмент для идентификации C.pneumoniae, носителей 7. Общая распространенность C. pneumoniae положительная ДНК была обнаружена у 18,5% здоровых доноров крови и до 59% у пациентов, страдающих ишемической болезнью сердца 8, 9. Наши данные показывают, что частота обнаружения C y. pneumoniae в крови быстро увеличивается (через 30 дней после заражения), но не увеличивается (через 90 дней после заражения) после острой инфекции легких, вызванной C. pneumoniae (рис. 1).
Рисунок 1–Частота обнаружения ДНК Chlamydia pneumoniae в моноцитах периферической крови (PBMC) пациентов после острой респираторной инфекции C.pneumoniae (▪) или Streptococcus pneumoniae (▴). Фракции PBMC образцов цельной крови были значительно чаще C. pneumoniae ДНК-положительными (ПЦР) через 30 дней после инфицирования (визит 1) у пациентов с острой инфекцией C. pneumoniae по сравнению с пациентами с инфекцией S. pneumoniae . # : p = 0,007.
Инфекции, вызванные C. pneumoniae , составляют 0,9–13% ВП во всем мире и, по всей видимости, появляются эпидемически в течение многих лет 10.В связи с этим проспективные исследования, анализирующие исходы у пациентов, страдающих острой респираторной инфекцией C. pneumoniae с течением времени, сложно проводить и до сих пор отсутствуют. Модели на животных предполагают, что C. pneumoniae может распространяться из легких в кровоток после начальной инфекции нижних дыхательных путей с использованием моноцитов крови в качестве вектора 4. Как C. pneumoniae ДНК постоянно обнаруживается в различных пропорциях бессимптомных здоровых Тем не менее, клиническое значение персистенции хламидий в легких, а также в мононуклеарных клетках крови, полностью не изучено 11.Таким образом, C. pneumoniae может сохраняться в легких в течение многих месяцев после острой инфекции, несмотря на длительные курсы терапии тетрациклином или доксициклином 10. Напротив, Blasi et al. 12 показали, что у пациентов с хроническим бронхитом легкой и средней степени тяжести обнаружение ДНК C. pneumoniae в PBMC было связано с более высокой частотой обострений. Они также показали, что устойчивый клиренс C. pneumoniae из крови после лечения азитромицином был достигнут только у 29% пациентов 12.Это может быть связано с низкой восприимчивостью стойких хламидий к терапии макролидами 6, но также может указывать на системное распространение мертвых C. pneumoniae внутри PBMC из хронического резервуара, поскольку внутриклеточный рост и потомство C. pneumoniae серьезно нарушено в первичных моноцитах и макрофагах, происходящих из моноцитов 13.
Ограниченный размер нашего исследования не позволяет сделать однозначных выводов относительно взаимосвязи между диссеминацией C. pneumoniae и клиническим течением.Тем не менее, выздоровление от пневмонии и изменения в лечении не различались между пациентами с обнаружением ДНК C. pneumoniae в крови или без нее. Кроме того, между обеими группами не наблюдалось значительных изменений функции легких или высвобождения провоспалительных цитокинов в мокроте или крови с течением времени (данные не показаны).
В заключение, системное распространение C. pneumoniae из легких в кровь после острой респираторной инфекции наблюдается у 70% пациентов в течение 30 дней после заражения.Тем не менее, клиническая значимость этих результатов в отношении разрешения болезни и патогенеза хронических сосудистых и легочных заболеваний требует дальнейших исследований.
Благодарности
Мы благодарны У. Кнупперцу и Х. Рихарцу (Медицинская клиника III, Университетская клиника Шлезвиг-Гольштейн, кампус Любек, Германия) за отличную техническую поддержку.
Сноски
Заявление о поддержке
Эта работа была поддержана Федеральным министерством образования и исследований Германии (Bundesministerium für Bildung und Forschung), Competence Network CAPNETZ (TP A6) и Европейской инициативой по борьбе с хламидийными инфекциями с помощью объективной геномики (ECIBUG) в рамках ERANET PathoGenoMics (BMBF).
Заявление о заинтересованности
Не объявлено.
Является ли Chlamydia Pneumoniae ИППП?
Как этого избежать?
Трудно избежать — как и другие респираторные инфекции, хламидийная пневмония передается от человека к людям, когда больной кашляет или чихает при тесном контакте с другим человеком, вдыхая бактерии.
Не существует вакцины или лечения иммунизацией для предотвращения инфекции — это означает, что невероятно важно всегда соблюдать правила личной гигиены, чтобы защитить себя и других от бактерий. Например, по:
- Регулярное мытье рук водой с мылом
- Чихание в ткань или вдали от других (если у вас нет ткани)
- Безопасное выбрасывание использованных салфеток
- Прикрывать рот при кашле
Лучший совет — избегать тесного контакта с кем-либо, кто болен инфекцией Chlamydia pneumoniae — если вы не можете избежать тесного контакта с кем-то больным, обратитесь к врачу за советом о том, как минимизировать риск заражения.Они могут порекомендовать вам надеть маску или перчатки на короткое время или в редких случаях назначить вам профилактическое лечение.
Вам не следует заболеть, если вы провели короткое время с человеком, инфицированным Chlamydia pneumoniae.
У кого больше шансов получить? — заболеть Chlamydia pneumoniae может любой человек в любом возрасте. Однако впервые инфекции намного чаще встречаются у детей и молодых людей. Повторное заражение бактериями чаще всего встречается у пожилых людей.
Воздействие на рабочем месте — вы подвергаетесь более высокому риску заражения, если вы живете или работаете регулярно в очень людных местах, где обычно возникают вспышки Chlamydia pneumoniae. К ним относятся:
- Совместное проживание (например, семейные дома или студенческие общежития)
Возраст и риск — у вас немного больше шансов получить осложнения, связанные с Chlamydia pneumoniae (например, пневмония), если вам 65 лет и старше. Поговорите со своей медсестрой или врачом, если вас беспокоит риск заражения или развития осложнений от инфекции Chlamydia pneumoniae.
Хламидийная пневмония — обзор
Chlamydia pneumoniae и мозгCP способны проникать и инфицировать самые разные клетки человека, такие как эпителиальные, эндотелиальные, миокардиальные и гладкомышечные клетки, а также макрофаги, моноциты, и лимфоциты. Этот жук может распространяться по всему телу после контакта с респираторной инфекцией. Конечно, присутствие ДНК ЦП в мононуклеарных клетках периферической крови убедительно свидетельствует о том, что такое распространение может происходить в ряде различных тканей.Более тревожным является то, что инфекция, вызванная ХП, может проходить через гематоэнцефалический барьер через лейкоциты, что указывает на механизм, с помощью которого организм может проникать в центральную нервную систему (ЦНС). Это может объяснить доставку организма в ЦНС и привести к хроническим травмам и заболеваниям, таким как деменция и AD.
Инфекция является триггером воспаления, и многие болезни старения связаны с воспалением. Но ключевой вопрос заключается в том, как ЦП может преодолеть гематоэнцефалический барьер и попасть в мозг? Предполагалось, что мозг имеет значительный барьер для патогенов.Некоторые типы клеток крови могут переносить ХП через гематоэнцефалический барьер, распространять организм в сосуды головного мозга и вызывать нейровоспаление. Демонстрация ХП гистопатологически (исследование пораженных тканей на микроскопическом уровне) при деменции с поздним началом болезни Альцгеймера предполагает связь между инфекцией центральной нервной системы и ХП и признаками и симптомами БА.
Д-р Брайан Балин из отдела биомедицинских наук Филадельфийского колледжа остеопатической медицины, Филадельфия, Пенсильвания, является лидером в выявлении патогенов, особенно церебрального паралича, в головном мозге больных Альцгеймером.В своей публикации 2003 г., озаглавленной « Инфекция Chlamydia pneumoniae», способствует трансмиграции моноцитов через эндотелиальные клетки головного мозга человека , доктор Балин объясняет миграцию ЦП в головной мозг при БА [36].
Мы исследовали влияние Chlamydia pneumoniae на эндотелиальные клетки головного мозга человека (тонкий слой клеток, выстилающий внутреннюю поверхность кровеносных сосудов) и человеческие моноциты (белые кровяные тельца иммунной системы) в качестве механизма проникновения в кровь. -мозговой барьер (BBB) при болезни Альцгеймера (AD).Эндотелиальные клетки головного мозга человека и моноциты периферической крови могут быть ключевыми компонентами в контроле проникновения C. pneumoniae в мозг человека. Наши результаты показывают, что C. pneumoniae инфицирует кровеносные сосуды и моноциты в тканях мозга при БА по сравнению с нормальной тканью мозга.… Таким образом, инфекция на уровне сосудистой сети (системы кровообращения) может быть ключевым инициирующим фактором в патогенезе нейродегенеративных заболеваний, таких как спорадическая AD.
Следующий важный вопрос, на который необходимо ответить после понимания того, как ЦП попадает в мозг, — как болезнь распространяется по мозгу? Несколько исследователей приняли эстафету и возглавили это расследование.Одна статья по этой теме называется Прионоподобная передача агрегатов белка при нейродегенеративных заболеваниях [37]. Авторы из Франции, Швеции и США заявляют:
Нейродегенеративные заболевания обычно связаны с накоплением внутриклеточных или внеклеточных агрегатов белка. Недавние исследования показывают, что эти агрегаты способны пересекать клеточные мембраны и могут непосредственно способствовать распространению патогенеза нейродегенеративных заболеваний.Мы предполагаем, что однажды инициированные невропатологические изменения могут распространяться «подобно прионам» и что прогрессирование заболевания связано с межклеточным переносом патогенных белков. Таким образом, перенос обнаженных инфекционных частиц между клетками может стать целью для новых методов лечения, изменяющих болезнь.
Подразумевается, что болезнь распространяется через перенос белков, возможно, через «голые» инфекционные частицы. Предполагается, что эти частицы «прионного» типа не являются живыми существами.Однако могут ли эти предполагаемые «голые» частицы на самом деле быть трудными для обнаружения внутриклеточных инфекционных видов, таких как спирохеты или вирусы? В этом случае лечение не будет таким, как указано в приведенной выше цитате.
- Определение приона
инфекционного агента, состоящего из белка в неправильно свернутой форме. Это центральная идея прионной гипотезы, которая остается дискуссионной. Это будет контрастировать со всеми другими известными инфекционными агентами (вирус / бактерия / гриб / паразит), которые должны содержать нуклеиновые кислоты (ДНК, РНК или и то, и другое).
Другая важная статья, опубликованная Институтом неврологии Университетского колледжа Лондона в 2012 году, называется « Распространение нейродегенеративного заболевания » [38]. Авторы подтверждают, что до недавнего времени только прионная болезнь имела распространение болезни. Далее они говорят: «Первое доказательство того, что белки, отличные от прионов, могут быть патологическими, было описано в 1994 году, когда введение ткани мозга пациента с БА в мозг старых мартышек сопровождалось посевом бета-амилоидных бляшек. .Исследование продолжает подтверждать их гипотезу рядом других важных фактов, которые, по-видимому, параллельны распространению «прионных инфекционных агентов».
Может быть, болезнь распространяется через белки, или может быть другое объяснение? Может ли быть, что в белковом материале присутствуют стелс-патогены, и это является причиной распространения болезни? Или может быть, что эти инфекционные виды инициируют образование белковых материалов, которые затем распространяются? Наука, вероятно, еще не предлагает окончательного ответа, но давайте исследуем эти возможности, вернув наше внимание к КП.
В последние годы постепенно увеличивается количество доказательств участия CP в неврологических заболеваниях. Это подтверждается, в частности, обнаружением геномного материала микроорганизма в спинномозговой жидкости (CSF) пациентов с MS, AD, менингоэнцефалитом и нейроповеденческими расстройствами. Первая статья, в которой сообщалось о связи между инфекцией ХП и БА, была опубликована в 1998 году Балиным и соавторами под названием Идентификация и локализация Chlamydia pneumoniae в мозге Альцгеймера [39].Авторы обнаружили, что 90% головного мозга с БА были положительными на ХП, и этот организм был обнаружен в различных отделах мозга (гиппокамп, мозжечок, височная кора и префронтальная кора). ХП распространилась по мозгу! Все эти области мозга проявляли признаки AD, включая клубки и бляшки. Результаты электронной микроскопии выявили ЦП в ткани головного мозга, а методы влажной химии указали на сильную «маркировку» ЦП в участках мозга, наиболее затронутых БА, в то время как в контроле не было отмечено «маркировки».
Важно отметить, что CP был тесно связан с бляшками и клубками AD, и было показано, что эти «колонии» CP являются метаболически активными организмами. В отчете Балина была обнаружена сильная связь генотипа APOE-4 и инфекции CP, предполагая, как показано при реактивном артрите, что ген APOE-4 может способствовать некоторым аспектам распространения CP при AD [40]. Что еще более важно, в контексте распространения болезни имеет ли смысл, что если белки содержат активные бактерии CP, то именно бактерии CP ответственны за распространение болезни, по крайней мере частично?
Исследование Балина привлекло большое внимание общественности и ученых, и другие лаборатории воспроизвели его результаты.В 2000 году два независимых исследователя обнаружили ХП в головном мозге пациентов с нейродегенеративными заболеваниями, подтвердив результаты Балина [41,42]. Другое исследование 2000 года под названием Неспособность обнаружить chlamydia pneumoniae в срезах мозга пациентов с болезнью Альцгеймера предлагает противоположную точку зрения [43]. Однако как насчет других 50+ инфекционных видов, которые могут привести к нейродегенерации? В 2006 г. Джерард продемонстрировал ЦП в 80% образцов AD и 11% контрольных [44]. Это более позднее исследование снова показало, что организм был активен.Кроме того, они продемонстрировали, что астроциты, микроглия и нейроны все служили клетками-хозяевами для CP в головном мозге AD, и что инфицированные клетки были обнаружены в непосредственной близости от бляшек и клубков в головном мозге AD.
За годы, прошедшие после первоначальных исследований Балина, исследования позволили лучше понять механизмы инфекции как потенциальной причины БА. Вот некоторые из признанных идей:
- •
Количество CP, обнаруженное в головном мозге при БА, по-видимому, зависит от генотипа APOE.
- •
Заражение ЦП сосудистой системы облегчает доступ ЦП к нервной системе и мозгу.
- •
CP может быть ответственным за вредное ослабление «плотных соединений».
- •
Инфекция ЦП через обонятельные пути способствует образованию внеклеточных амилоидоподобных бляшек, что позволяет предположить, что это может быть основным триггером БА. Носовые ходы являются вероятной мишенью для инфекции.После проникновения в главную обонятельную луковицу и обонятельную кору может произойти потенциальное повреждение и / или гибель клеток, что создает почву для дальнейшего повреждения нейронов.
Научные знания, касающиеся БА и инфицирования ХП, продолжают расти. Стандартизация диагностических методов, безусловно, позволит повысить сопоставимость исследований. Однако следует рассматривать другие системные инфекции как потенциальные факторы патогенеза БА. То есть отсутствие обнаружения C.pneumoniae не означает, что инфекция не участвует в процессе БА. Болезнь Лайма и некоторые другие бактерии-невидимки могут присутствовать вместе с ХП или в его отсутствие. При сердечно-сосудистых заболеваниях Отт указал, что пораженная ткань в среднем содержит 8–12 отдельных микробных образований [24].
Балин и др. продолжал лидировать, связывая CP с AD. Их статья в журнале Journal of Alzheimer’s Disease под названием Chlamydophila pneumoniae и этиология болезни Альцгеймера с поздним началом дает правдоподобное объяснение того, как CP и, возможно, подобные инфекционные виды в целом способствуют деградационному процессу старения, который Нашей эры [45].Резюме воспроизведено здесь:
Спорадическая болезнь Альцгеймера с поздним началом (НАГРУЗКА) — это несемейное прогрессирующее нейродегенеративное заболевание, которое в настоящее время является наиболее распространенной и тяжелой формой деменции у пожилых людей. Эта деменция является прямым результатом повреждения и потери нейронов, связанных с накоплением аномальных белковых отложений в головном мозге. За последние 20 лет были достигнуты большие успехи в понимании патологических образований, которые возникают в головном мозге БА, как для семейной БА (~ 5% всех случаев), так и НАГРУЗКИ (~ 95% всех случаев).
Наблюдаемая невропатология включает: нейритные сенильные бляшки (NSP), нейрофибриллярные клубки (NFT), нейропильные нити (NP) и часто отложения цереброваскулярного амилоида. Генетический, биохимический и иммунологический анализы предоставили относительно подробные сведения об этих сущностях, но наше понимание «триггерных» событий, ведущих к множеству каскадов, приводящих к этой патологии и нейродегенерации, все еще весьма ограничено. По этой причине этиология БА, в частности НАГРУЗКА, остается неясной.Однако ряд недавних и продолжающихся исследований выявил причастность инфекции к этиологии и патогенезу НАГРУЗКИ. В этом обзоре особое внимание уделяется инфицированию Chlamydophila (Chlamydia) pneumoniae при НАГРУЗКЕ и тому, как эта инфекция может выступать в качестве «триггера или инициатора» в патогенезе этого заболевания.
Балин в своем аннотации сослался на ряд недавних и продолжающихся исследований. Вот список отчетов и исследовательских работ с разбивкой по годам и названиям, в которых обсуждается связь между AD и CP.
1998: Chlamydia pneumoniae: новый патоген болезни Альцгеймера. [46]
1998: Идентификация и локализация Chlamydia pneumoniae в головном мозге Альцгеймера. [39]
1999: Ультраструктурный анализ Chlamydia Pneumoniae в мозге Альцгеймера. [47]
2000: Chlamydia pneumoniae в мозге Альцгеймера — обнаружению ДНК препятствует низкое количество копий. [48]
2000: Идентификация Chlamydia pneumoniae в мозге Альцгеймера.[49]
2001: Каковы доказательства связи между Chlamydia pneumoniae и болезнью Альцгеймера с поздним началом? [50]
2002: Инфекция Chlamydia Pneumoniae в моноцитах человека и эндотелиальных клетках головного мозга: инициирующие факторы в развитии болезни Альцгеймера. [51]
2002: Патология мозга молодых нетрансгенных мышей balb / c после инфицирования chlamydia pneumoniae: модель позднего начала / спорадической болезни Альцгеймера.[52]
2003: Chlamydia Pneumoniae в спинномозговой жидкости пациентов с болезнью Альцгеймера и в атеросклеротических бляшках. [53]
2004: Chlamydia pneumoniae в патогенезе болезни Альцгеймера. Chlamydia pneumoniae. [54]
2004: Связан ли хламидиоз с болезнью Альцгеймера? [55]
2004: Влияние инфекционного процесса chlamydia pneumoniae на нейронные клетки: последствия для болезни Альцгеймера.[56]
2004: индукция патологии, подобной болезни Альцгеймера, и выделение жизнеспособного организма из мозга мышей BALB / c после заражения хламидиозом. [57]
2005: Chlamydia pneumoniae как потенциальный этиологический агент при спорадической болезни Альцгеймера. [58]
2005: нагрузка Chlamydia pneumoniae в головном мозге Альцгеймера варьируется в зависимости от генотипа APOE. [59]
2006: Активность каспазы ингибируется в нейрональных клетках, инфицированных Chlamydia pneumoniae: последствия для апоптоза при болезни Альцгеймера.[60]
2006: Изоляты Chlamydia pneumoniae из головного мозга Альцгеймера плохо связаны с другими штаммами этого организма. [61]
2006: Chlamydophila (Chlamydia) pneumoniae в мозге Альцгеймера. [62]
2006: Инфекция Chlamydophila (Chlamydia) pneumoniae астроцитов и микроглии человека в культуре проявляет активный, а не постоянный фенотип. [63]
2006: Изоляты Chlamydia pneumoniae из мозга Альцгеймера, инфицирующие культивируемые астроциты и микроглию человека, демонстрируют активный, а не постоянный рост.[64]
2007: Оценка CSF-Chlamydia pneumoniae, CSF-tau и CSF-Abeta42 при болезни Альцгеймера и сосудистой деменции. [65]
2007: Метод диагностики болезни Альцгеймера путем обнаружения chlamydia pneumoniae. [66]
2008: индукция амилоидного процессинга в астроцитах и нейронных клетках, коинфицированных вирусом простого герпеса 1 и Chlamydophila (Chlamydia) pneumoniae: связь инфекционного процесса с болезнью Альцгеймера.[67]
2009: Использование магнитно-резонансной томографии для оценки хламидиоза как этиологического агента при болезни Альцгеймера. [68]
2010: Анализ моноцитов, инфицированных Chlamydia pneumoniae, после инкубации с новым пептидом, acALY18: потенциальное лечение инфекции при болезни Альцгеймера. [69]
2010: Инфекция Chlamydia pneumoniae и болезнь Альцгеймера: связь, которую нужно помнить? [70]
2010: Иммуногистологическое обнаружение Chlamydia pneumoniae в головном мозге при болезни Альцгеймера.[71]
2011: Человеческие моноциты, обонятельный нейроэпителий и нейрональные клетки с Chlamydia pneumoniae изменяют экспрессию генов, связанных с болезнью Альцгеймера. [72]
2012: Анализ регуляции гена инфламмасомы после инфицирования моноцитов THP1 Chlamydia pneumoniae: последствия для болезни Альцгеймера. [73]
2012: Инфекция Chlamydia Pneumoniae изменяет регуляцию и процессы связанных с кальцием генов в нейрональных клетках и моноцитах: последствия для болезни Альцгеймера.[74]
2013: Инфекция нейронных клеток Chlamydia pneumoniae вызывает изменения в экспрессии связанных с кальцием генов, соответствующие болезни Альцгеймера. [75]
2013: Анализ регуляции аутофагии и инфламмасом в нейрональных клетках и моноцитах, инфицированных Chlamydia Pneumoniae: последствия для болезни Альцгеймера. [76]
2014: Электронная микроскопия выявляет морфологические формы Chlamydia pneumoniae в образцах крови пациентов с легкими когнитивными нарушениями (MCI) и болезнью Альцгеймера (AD) (LB81).[77]
Советы из других журналов — Американский семейный врач
Советы из других журналов
Am Fam Physician. , 1 февраля 2000 г.; 61 (3): 792-794.
Chlamydia pneumoniae, возбудитель инфекций средних и нижних дыхательных путей, называется «атипичным» организмом, поскольку клинические проявления часто менее драматичны, чем болезнь, вызванная Streptococcus pneumoniae или Haemophilus influenzae. Однако руководящие принципы лечения внебольничной пневмонии требуют добавления макролидного антибиотика к бета-лактамному препарату, поскольку клинические проявления пациента часто не позволяют врачу поставить точный бактериологический диагноз.Исследования показали, что C. pneumoniae вызывает от 6 до 10 процентов случаев внебольничной пневмонии, требующей госпитализации. Чтобы уточнить клинические данные у пациентов, инфицированных C. pneumoniae, File, Jr. и его коллеги провели проспективное исследование пациентов, поступивших в больницу с диагнозом пневмония.
Включенные пациенты были взрослыми, у которых были различные клинические симптомы респираторного заболевания, плюс новый инфильтрат на рентгенограмме грудной клетки, соответствующий пневмонии.На момент поступления пациенты заполнили анкету из более чем 100 вопросов об их симптомах и истории болезни. У всех пациентов были взяты культуры крови и мокроты. Другие культуры на вирусы и микобактерии были выборочно получены лечащим врачом. У всех пациентов был взят образец мочи для обнаружения антигена Legionella. Наконец, во всех случаях были взяты парные пробы сыворотки крови на Legionella, Mycoplasma pneumoniae и C. pneumoniae с интервалом от четырех до шести недель. Эти серологические тесты проводились в Центрах по контролю и профилактике заболеваний.Диагноз инфекции C. pneumoniae ставился при четырехкратном или более увеличении титра антител, единичном титре IgG более 1: 512 или титре IgM более 1:16.
В ходе исследования было диагностировано около 1200 случаев пневмонии. Из них достоверная инфекция C. pneumoniae была обнаружена у 26 (2,4 процента) пациентов, а возможная инфекция C. pneumoniae — у 6,5 процента. Авторы анализировали данные только в определенных случаях. Считалось, что у семи пациентов с ранним титром антител IgM была первичная инфекция; 18 пациентов с исходным титром IgG с последующим увеличением как минимум в 4 раза были повторно инфицированы; один пациент был исключен из-за неубедительности результатов теста.
Средний возраст пациентов с определенной инфекцией C. pneumoniae составлял 55 лет (от 21 до 82 лет) с равным распределением мужчин и женщин. Сорок процентов пациентов были курильщиками, а у 50 процентов в анамнезе была внебольничная пневмония.
Наиболее частой рентгенологической находкой был локализованный сегментарный инфильтрат. Среднее количество лейкоцитов составляло 12700 на мм 3 (12,7 × 10 9 на литр). Средняя продолжительность заболевания до госпитализации составляла семь дней.
При дальнейшей оценке пациентов с первичной инфекцией и повторной инфекцией было отмечено, что вновь инфицированные пациенты, как правило, были моложе (средний возраст: 38 по сравнению с 63 годами), имели более высокую среднюю температуру и реже хрипы. Клинические характеристики 26 пациентов с инфекцией C. pneumoniae указаны в прилагаемой таблице.
Посмотреть / распечатать таблицу
Характеристики * пневмонии, вызванной Chlamydia pneumoniae
| Симптом | Процент пациентов | ||
|---|---|---|---|
Вирусный продром | продуктивная) | 88 (50) | |
Лихорадка | 80 | ||
Одышка | 73 | ||
| 33 | |||
| 40 910 910 | |||
Тошнота | 73 | ||
Головная боль | 56 | ||
Миалгия | 50 | ||
Ринит 9 1033 | 46 | ||
Диарея | 42 | ||
Боль в горле | 42 | ||
Охриплость 910 940 | 15 |
Характеристики * пневмонии, вызванной Chlamydia pneumoniae
| Симптом | Процент пациентов | |
|---|---|---|
Вирусный продуктивность | 910 ) | 88 (50) |
Лихорадка | 80 | |
Одышка | 73 | |
| 910 910 910 910 910 | ||
Тошнота 900 15 | 73 | |
Головная боль | 56 | |
Миалгия | 50 | |
Боль в груди | ||
| 910 940 940 940 940 940 940 940 | 46 | |
Диарея | 42 | |
Боль в горле | 42 | Охриплость | 910 940 910 900 910 910 910 910 910 910 910 | 15 |
Авторы отмечают, что нет никаких специфических признаков и симптомов, уникальных для инфекции C.
