МАТЕРИАЛЫ КОНГРЕССОВ И КОНФЕРЕНЦИЙ: VIII РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС
VIII РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС
РЕЗУЛЬТАТЫ ХИМИОЛУЧЕВОГО ЛЕЧЕНИЯ РАКА ГОРТАНИ Т3N0М0
И.С. Матакова
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва
Рак гортани составляет 1-4% в общей структуре заболеваемости населения злокачественными новообразованиями. Среди злокачественных опухолей верхних дыхательных путей его встречают наиболее часто (65-70%), и в последние годы отмечается тенденция к неуклонному росту числа больных с этой патологией. Согласно статистическим исследованиям за последние 10 лет заболеваемость раком гортани в России увеличилась на 20%. Причем при первичном обращении у 60-70% диагностируются местно-распространенные формы заболевания и только в 30-40% — ограниченные опухолевые поражения.
На протяжении длительного времени интенсивно изучаются возможности консервативного лечения местно-распространенного рака гортани. С этой целью проводятся различные программы лучевой терапии или комбинации облучения с полихимиотерапией.
В клинике опухолей верхних дыхательно-пищеварительных путей ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России за период с 1984-1999 гг. консервативное лечение рака гортани Т3N0М0, что соответствует III стадии заболевания по системе ТНМ, проведено 217 больным, из них мужчин было 209 (96,3%), женщин – 8; возраст составил от 18 до 80 лет. При морфологическом исследовании у всех больных определялась плоскоклеточная форма рака, у 119 (54,8%) пациентов – плоскоклеточный рак с ороговением, а у 98 (45,2%) – плоскоклеточный рак без указания степени дифференцировки. Поражение вестибулярного отдела отмечено значительно чаще (63,4%), чем складочного (5,3%). Приведенные цифры согласуются со статистиками других клиник.
По образному выражению профессора Д.И. Зимонта, через всю историю развития методов терапии рака гортани «красной нитью проходит стремление примирить трудно согласуемые между собой положения: необходимость радикальной операции и возможность сохранения этого органа». Не останавливаясь на истории, которая по существу началась только с момента изобретения в 1854 г. непрямой ларингоскопии, хотелось бы подчеркнуть, что именно стремление сохранить гортань со всеми ее функциями при радикальном лечении рака предопределило развитие органосохраняющего химиолучевого лечения местно-распространенного рака гортани, в частности Т3Н0М0. Современная терапевтическая тактика при раке гортани Т3Н0М0 подразумевает под собой проведение химиолучевого лечения. Химиотерапия, которая раньше применялась только как метод лечения больных с распространенными опухолями, имеющими рецидивы и метастазы, при неоперабельных или нерадикально удаленных опухолях в настоящее время используется в качестве неоадъювантной индукционной терапии с целью уменьшения объема хирургического вмешательства или же в сочетании с лучевой терапией для проведения органосохраняющего лечения. Таким образом, у значительного числа больных сохраняется гортань и значительно повышается качество жизни.
Лучевая терапия проводилась в традиционной форме с использованием двух противолежащих полей, проецированных на боковые поверхности шеи с захватом всей гортани и путей регионарного метастазирования. Лучевой терапии в самостоятельном варианте подвергнуто 89 больных раком гортани Т3N0М0. 46 пациентов получали стандартный вариант лучевого лечения: 2 Гр ежедневно, 5 раз в неделю в режиме расщепленного курса. Суммарная очаговая доза 66-70 Гр. Безрецидивное течение заболевания отмечено у 25 больных (54,4%), неудачи лечения — у 21 (45,6%) больного. 5-летняя выживаемость после дополнительного хирургического лечения рецидивов составила 67,5%. Поздние лучевые повреждения диагностированы у 19,5% больных.
Лучевая терапия в варианте мультифракционирования дозы по 1,1 Гр 2 раза в день с интервалами в 4 часа, также в режиме расщепленного курса проведена 43 больным. Без рецидива заболевания с сохраненной гортанью живы 29 (67,1%) больных. Неудачи составили 32,9% (14 больных). Поздние лучевые повреждения отмечены лишь в 9% случаев. 5-летняя выживаемость в этой группе – 74,5%. Результаты убедительно свидетельствуют о несомненном преимуществе мультифракционного облучения по сравнению с возможностями стандартной лучевой терапии. Эти преимущества касаются как частоты и выраженности постлучевых повреждений и поздних осложнений, так и показателей клинического эффекта, длительности безрецидивного течения и общей выживаемости больных. Таким образом, можно сказать, что лучевой метод лечения местно-распространенного рака гортани привлекает возможностью избежать калечащей операции, однако применение его в самостоятельном варианте на современном этапе лечения недостаточно.
Одним из перспективных путей повышения эффективности лучевой терапии является использование химических соединений. В клинической практике продолжается изучение возможностей современных противоопухолевых препаратов (в основном производных платины, 5-фторурацила, блеомицина и других) в лечении больных местно-распространенным раком гортани в комбинации с известными методами облучения с целью достижения лучших результатов и избежания калечащих операций.
Комплексное химиолучевое лечение плоскоклеточного рака гортани Т3N0М0 проведено 128 больным. Практически во всех схемах полихимиотерапии присутствовали цисплатин и 5-фторурацил, которые хорошо зарекомендовали себя при лечении данного заболевания. Кроме того, применялись такие препараты как блеомицетин и лейковорин.
Лечение начиналось с проведения одного или двух курсов полихимиотерапии, далее проводилось облучение первичной опухоли и зон регионарного метастазирования в режиме мультифракционирования по расщепленному курсу.
Противопоказаниями к применению химиолучевой терапии являются стеноз гортани П-Ш степени, перихондрит, опухолевое поражение хрящей (щитовидного или черпаловидного), декомпенсированные заболевания сердечно-сосудистой системы, печени и почек, язвенная болезнь желудка и 12-перстной кишки, сахарный диабет в стадии декомпенсации, открытые формы туберкулеза легких. При отсутствии этих противопоказаний мы считаем, что лечение рака гортани необходимо начинать с полихимиотерапии.
15 пациентам проведен 1 курс полихимиотерапии цисплатином, 5-фторурацилом, блеомицетином и мультифракционное облучение. Безрецидивное течение заболевания отмечено у 11 (73,3%) больных, остаточные опухоли и рецидивы диагностированы у 4 (26,7%) больных; 5-летняя выживаемость составила 76%.
Два курса полихимиотерапии цисплатином, 5-фторурацилом и блеомицетином и лучевая терапия в режиме мультифракционирования проведены 63 больным. Без рецидива живы 86,8% больных (33 человека), неудачи составили 13,2%, 5-летняя выживаемость – 87%.
50 больным проведено лечение цисплатином, 5-фторурацилом, лейковорином (2 курса) и лучевая терапия в суммарной очаговой дозе 66-72 Гр в режиме мультифракционирования. Неудачи отмечены у 8% (2 человека), а без рецидива с сохраненной гортанью живы 92% (23) пациентов; 5-летняя выживаемость – 92%.
Таким образом, 5-летняя выживаемость при проведении полихимиотерапии цисплатином, 5-фторурацилом и лейковорином оказалась выше по сравнению с другими применяемыми схемами.
 В нашем исследовании 15 (6,9%) пациентам проведен 1 курс полихимиотерапии и 113 (93,1%) – 2 курса. Из них 37 больным полихимиотерапия проводилась до начала лучевого лечения и 76 – 1 курс до проведения лучевого лечения и еще 1 — после подведения к опухоли и зонам регионарного метастазирования дозы 40 Гр. Далее, после двухнедельного перерыва и констатации регрессии опухолевого процесса (уменьшение новообразования более чем на 50%) рекомендовано продолжение лучевой терапии в режиме мультифракционирования до суммарной очаговой дозы 68-72 Гр. 5-летняя выживаемость при проведении 2 циклов полихимиотерапии до облучения составила 78,1% против 84,7% при проведении лекарственного лечения до и в процессе облучения.
В нашем исследовании 15 (6,9%) пациентам проведен 1 курс полихимиотерапии и 113 (93,1%) – 2 курса. Из них 37 больным полихимиотерапия проводилась до начала лучевого лечения и 76 – 1 курс до проведения лучевого лечения и еще 1 — после подведения к опухоли и зонам регионарного метастазирования дозы 40 Гр. Далее, после двухнедельного перерыва и констатации регрессии опухолевого процесса (уменьшение новообразования более чем на 50%) рекомендовано продолжение лучевой терапии в режиме мультифракционирования до суммарной очаговой дозы 68-72 Гр. 5-летняя выживаемость при проведении 2 циклов полихимиотерапии до облучения составила 78,1% против 84,7% при проведении лекарственного лечения до и в процессе облучения.Кроме того, эффективность химиолучевого лечения, как указывалось выше, определялась особенностями проведения лучевой терапии, а именно: режимом фракционирования дозы, длительностью перерыва между 1 и 2 этапами облучения, величинами разовых и суммарных очаговых доз, наличием вынужденного перерыва для купирования острой лучевой реакции и т.д.
Таким образом, необходимо сказать о том, что проведение расщепленного курса облучения в режиме мультифракционирования позволяет подвести суммарную очаговую дозу до 70-72 Гр без увеличения частоты постлучевых осложнений и в сочетании с двумя курсами полихимиотерапии (до начала облучения и после 1-го этапа) цисплатином, 5-фторурацилом и лейковорином является оптимальным при химиолучевом лечении рака гортани Т3N0М0. Вместе с тем, проведенное исследование не исчерпывает всех аспектов данной проблемы и, несомненно, требует дальнейшей работы в этом направлении.
Лечение рака гортани в клиниках Германии: цена
Рак гортани — это злокачественное новообразование, которое рождается из эпителия горла. По статистике, 60-70% всех опухолей органов дыхания приходится именно на новообразования в горле.
Факты:
- Рак гортани чаще всего диагностируют у мужчин.
- Самый высокий риск образования в возрасте 40-60 лет.
- Симптомы рака горла схожи со многими другими признаками типичных болезней, поэтому пациенты чаще всего обращаются к врачу тогда, когда заболевание уже на запущенной стадии.
Причины заболевания
Зачастую причины возникновения рака определить у специалистов не получается, можно лишь предполагать, что стало пусковым моментом, который спровоцировал развитие болезни:
- курение, причем не только активное, но и пассивное;
- носительство вируса папилломы человека;
- хронические тонзиллиты, трахеиты;
- снижение иммунного статуса.
Также имеет место наследственная предрасположенность.
Симптомы рака гортани
На ранних стадиях признаки рака напоминают банальную простуду: болезненность при глотании, увеличение шейных лимфоузлов, осиплость, першение в горле.
На более запущенных стадиях возникают: боль в слуховом аппарате, сухой кашель более месяца, в области шеи может образоваться некое видимое пальпируемое образование. На самых запущенных стадиях симптомы более специфичны: сильная боль, постоянная осиплость, нарушение глотания, чувство инородного тела в горле.
Диагностика заболевания в Германии
Вовремя проведенная диагностика рака гортани дает высокую гарантию эффективности дальнейшего лечения и выздоровления. Таким образом минимизируется вред, наносимый организму, уменьшаются затраты на лечение и дальнейшую реабилитацию. К сожалению, не все российские медучреждения могут своевременно предоставить пациенту качественные диагностические мероприятия. Это связано с рядом проблем, характерных для российской действительности:
- недостаточное техническое оснащение медицинских центров;
- нехватка персонала;
- недоступность высокотехнологичных видов диагностики в глубинке, заставляющая терять время.

Эти и другие факторы заставляют искать другие возможности, такие, как обследование организма за рубежом и, при необходимости, последующее лечение рака гортани в Германии.
Для диагностики, помимо традиционных и привычных способов, используют инновационные методы ПЭТ КТ и ПЭТ МРТ (позитронно-эмиссионная томография), которые способны не только обнаружить очаги болезни, но и могут быть использованы для дальнейшего лечения новообразования и оценки результатов терапии. Все это позволяет оценить степень поражения слизистой, кровоснабжение и наличие ракового дефекта, а также обнаружить отдаленные очаги метастазирования. Для более точной диагностики делают УЗИ шеи, изучая локализацию опухоли.
Лечение рака гортани в Германии
В Дрезденской университетской клинике используется новейший метод лечения опухолей, расположенных в труднодоступных местах, таких как гортань, – это протонно-лучевая терапия. Преимуществом этого метода является возможность точной локализации места облучения. Здоровые ткани при этом не повреждаются. Подходы к лечению для всех пациентов разные в зависимости от индивидуальных особенностей: стадии заболевания, типа опухоли, возраста, наличия метастаз. Лечение подбирают таким образом, чтобы не только радикально удалить новообразование, но и исключить появление рецидивов. Большое внимание уделяется сохранению качества жизни пациентов. В зависимости от полученного эффекта после терапии делают выбор: хирургическое лечение или динамическое наблюдение. Таким образом, практикуется безоперационное лечение рака горла в Германии. Радикальный метод удаления предполагает удаление не только опухоли, но и части здоровых тканей, которые прилегают к новообразованию.
Компания Intermedius Health поможет вам с получением визы, организацией переезда, необходимыми обследованиями и лечением рака гортани в Германии.
- Стоимость телеконсультации зависит от квалификации врача, а также предоставления переводческих услуг.

- Итоговая стоимость включает в себя цену за консультацию специалиста, а также организацию и устный перевод телеконсультации.
- Длительность телеконсультации от 20 до 30 минут.
от 257,00 € до 475,00 €
РАСПРОСТРАНЕННЫЙ РАК ГОРТАНИ: ОБЗОР ЛИТЕРАТУРЫ | Раджабова
1. Talamini R., Bosetti C., La Vecchia C., Dal Maso L., Levi F., Bidoli E., Negri E., Pasche C., Vaccarella S., Barzan L., Franceschi S. Combined effect of tobacco and alcohol on laryngeal cancer risk: a case-control study. Cancer Causes Control. 2002 Dec; 13(10): 957–64.
2. Anantharaman D., Marron M., Lagiou P., Samoli E., Ahrens W., Pohlabeln H., Slamova A., Schejbalova M., Merletti F., Richiardi L., Kjaerheim K., Castellsague X., Agudo A., Talamini R., Barzan L., Macfarlane T.V., Tickle M., Simonato L., Canova C., Conway D.I., McKinney P.A., Thomson P., Znaor A., Healy C.M., McCartan B.E., Hashibe M., Brennan P., Macfarlane G.J. Population attributable risk of tobacco and alcohol for upper aerodigestive tract cancer. Oral Oncol. 2011 Aug; 47(8): 725–31. doi: 10.1016/j.oraloncology.2011.05.004.
3. Cheremisina O.V., Choinzonov E.L., Pankova O.V., Menshikov K. Yu. Chronic hypeplastic laryngitis as a criterion for defining groups at high risk of laryngeal cancer. Russian otorinolaryngology. 2013; 2 (63): 84–89. (in Russian).
(in Russian).
4. Wang X., Lin S., Yu I., Qiu H., Lan Y., Yano E. Causespecific mortality in a Chinese chrysotile textile worker cohort. Cancer Sci. 2013 Feb; 104(2): 245–9. doi: 10.1111/cas.12060.
5. Offermans N.S., Vermeulen R., Burdorf A., Goldbohm R.A., Kauppinen T., Kromhout H., van den Brandt P.A. Occupational asbestos exposure and risk of pleural mesothelioma, lung cancer, and laryngeal cancer in the Prospective Netherlands Cohort Study. J Occup Environ Med. 2014 Jan; 56(1): 6–19. doi: 10.1097/JOM.0000000000000060.
6. Paget-Bailly S., Cyr D., Luce D. Occupational exposures and cancer of the larynx-systematic review and meta-analysis. J Occup Environ Med. 2012 Jan; 54(1): 71–84. doi: 10.1097/JOM.0b013e31823c1343.
7. Garavello W., Turati F., Bosetti C., Talamini R., Levi F., Lucenteforte E., Chiesa F., Franceschi S., La Vecchia C., Negri E. Family history of cancer and the risk of laryngeal cancer: a case-control study from Italy and Switzerland. Int J Cancer. 2012 Feb 1; 130(3): 665–70. doi: 10.1002/ijc.26055.
8. Bidoli E., Bosetti C., La Vecchia C., Levi F., Parpinel M., Talamini R., Negri E., Maso L.D., Franceschi S. Micronutrients and laryngeal cancer risk in Italy and Switzerland: a case-control study. Cancer Causes Control. 2003 Jun; 14(5): 477–84.
9. Gallus S., Talamini R., Giacosa A., Montella M., Ramazzotti V., Franceschi S., Negri E., La Vecchia C. Does an apple a day keep the oncologist away? Ann Oncol. 2005; 16: 1841–4. doi.org/10.1093/annonc/mdi361.
10. Aune D., De Stefani E., Ronco A., Boffetta P., Deneo-Pellegrini H., Acosta G., Mendilaharsu M. Legume intake and the risk of cancer: a multisite case-control study in Uruguay. Cancer Causes Control. 2009; 20: 1605–15. doi: 10.1007/s10552-009-9406-z.
Aune D., De Stefani E., Ronco A., Boffetta P., Deneo-Pellegrini H., Acosta G., Mendilaharsu M. Legume intake and the risk of cancer: a multisite case-control study in Uruguay. Cancer Causes Control. 2009; 20: 1605–15. doi: 10.1007/s10552-009-9406-z.
11. van Dijk B.A., Karim-Kos H.E., Coebergh J.W., Marres H.A., de Vries E. Progress against laryngeal cancer in The Netherlands between 1989 and 2010. Int J Cancer. 2013; 134: 674–81. doi.org/10.1002/ijc.28388.
12. Edge S.B., Byrd D.R., Compton C.C., Fritz A.G., Greene F.L., Trotti A. Larynx AJCC Cancer Staging Manual. 7th ed. New York: Springer; 2010: 57–62.
13. McCoul E.D., Har-El G. Meta-analysis of impaired vocal cord mobility as a prognostic factor in T2 glottic carcinoma. Arch Otolaryngol Head Neck Surg. 2009 May; 135(5): 479–86. doi: 10.1001/archoto.2009.47.
14. Department of Veterans Affairs Laryngeal Cancer Study Group, Wolf G.T., Fisher S.G., Hong W.K., Hillman R., Spaulding M., Laramore G.E., Endicott J.W., McClatchey K., Henderson W.G. Induction chemotherapy plus radiation compared with surgery plus radiation in patients with advanced laryngeal cancer. N Engl J Med. 1991; 324: 1685–90. doi: 0.1056/NEJM199106133242402.
15. Sheahan P., Ganly I., Rhys-Evans P.H., Patel S.G. Tumors of the Larynx. Principles and Practice of Head and Neck Surgery and Oncology. London: Informa; 2009. 658.
16. Forastiere A.A., Goepfert H., Maor M., Pajak T.F., Weber R., Morrison W., Glisson B., Trotti A., Ridge J.A., Chao C., Peters G., Lee D.J., Leaf A., Ensley J. , Cooper J. Concurrent chemotherapy and radiotherapy for organ preservation in advanced laryngeal cancer. N Engl J Med. 2003; 349: 2091–8. doi: 10.1056/NEJMoa031317.
, Cooper J. Concurrent chemotherapy and radiotherapy for organ preservation in advanced laryngeal cancer. N Engl J Med. 2003; 349: 2091–8. doi: 10.1056/NEJMoa031317.
17. Ambrosch P. The role of laser microsurgery in the treatment of laryngeal cancer. Curr Opin Otolaryngol Head Neck Surg. 2007; 15: 82–8. doi: 10.1097/MOO.0b013e3280147336.
18. Cheremisina O.V., Vusik M.V., Soldatov A.N., Reiner I.B. Endoscopic laser technologies in clinical oncology. Siberian Journal of Oncology. 2007; 4: 5–11. (in Russian).
19. Sperry S.M., Rassekh C.H., Laccourreye O., Weinstein G.S. Supracricoid partial laryngectomy for primary and recurrent laryngeal cancer. JAMA Otolaryngol Head Neck Surg. 2013; 139: 1226–35. doi. org/10.1001/jamaoto.2013.4990.
20. Page C., Mortuaire G., Mouawad F., Ganry O., Darras J., Pasquesoone X., Chevalier D. Supracricoid laryngectomy with cricohyoidoepiglottopexy (CHEP) in the management of laryngeal carcinoma: oncologic results. A 35-year experience. Eur Arch Otorhinolaryngol. 2013 May; 270(6): 1927–32. doi: 10.1007/s00405-012-2300-4.
21. Clayburgh D.R., Graville D.J., Palmer A.D., Schindler J.S. Factors associated with Supracricoid laryngectomy functional outcomes. Head Neck. 2013; 35: 1397–403. doi.org/10.1002/hed.23144.
22. Pinar E., Imre A., Calli C., Oncel S., Katilmis H. Supracricoid partial laryngectomy: analyses of oncologic and functional outcomes. Otolaryngol Head Neck Surg. 2012 Dec; 147(6): 1093–8. doi: 10.1177/0194599812457334.
23. Park J.O., Joo Y.H., Cho K.J., Kim N.G., Kim M.S. Functional and oncologic results of extended supracricoid partial laryngectomy. Arch Otolaryngol Head Neck Surg. 2011 Nov; 137(11): 1124–9. doi: 10.1001/archoto.2011.182.
Park J.O., Joo Y.H., Cho K.J., Kim N.G., Kim M.S. Functional and oncologic results of extended supracricoid partial laryngectomy. Arch Otolaryngol Head Neck Surg. 2011 Nov; 137(11): 1124–9. doi: 10.1001/archoto.2011.182.
24. Benito J., Holsinger F.C., Perez-Martin A., Garcia D., Weinstein G.S., Laccourreye O. Aspiration after supra-cricoid partial laryngectomy: incidence, risk factors, management, and outcomes. Head Neck. 2011 May; 33(5): 679–85. doi: 10.1002/hed.21521.
25. Raffia M., Hassoun M.S., Abdel Fattah Ale F., Barden H. Experience with supracricoid laryngectomy variants. Head Neck. 2011 Aug; 33(8): 1177–83. doi: 10.1002/hed.21593.
26. Laccourreye O., Hans S., Borzog-Grayeli A., Maulard-Durdux C., Brasnu D., Housset M. Complications of postoperative radiation therapy after partial laryngectomy in supraglottic cancer: a long-term evaluation. Otolaryngol Head Neck Surg. 2000; 122: 752–7. doi: 10.1067/mhn.2000.98756.
27. Spriano G., Antognoni P., Sanguineti G., Sormani M., Richetti A., Ameli F., Piantanida R., Luraghi R., Magli A., Corvo R., Tordiglione M., Vitale V. Laryngeal long-term morbidity after supraglottic laryngectomy and postoperative radiation therapy. Am J Otolaryngol. 2000; 21: 14–21. doi: 10.1016/S0196-0709(00)80119-2.
28. Caicedo-Granados E., Beswick D.M., Christopoulos A., Cunningham D.E., Razfar A., Ohr J.P., Heron D.E., Ferris R.L. Oncologic and functional outcomes of partial laryngeal surgery for intermediate-stage laryngeal cancer. Otolaryngol Head Neck Surg. 2013 Feb; 148(2): 235–42. doi: 10.1177/0194599812466367.
29. Canis M., Martin A., Ihler F., Wolff H.A., Kron M., Matthias C., Steiner W. Transoral laser microsurgery in treatment of pT2 and pT3 glottic laryngeal squamous cell carcinoma results of 391 patients. Head Neck. 2014 Jun; 36(6): 859–66. doi: 10.1002/hed.23389.
Canis M., Martin A., Ihler F., Wolff H.A., Kron M., Matthias C., Steiner W. Transoral laser microsurgery in treatment of pT2 and pT3 glottic laryngeal squamous cell carcinoma results of 391 patients. Head Neck. 2014 Jun; 36(6): 859–66. doi: 10.1002/hed.23389.
30. Suárez C., Rodrigo J.P., Silver C.E., Hartl D.M., Takes R.P., Rinaldo A., Strojan P., Ferlito A. Laser surgery for early to moderately advanced glottic, supraglottic, and hypopharyngeal cancers. Head Neck. 2012; 34: 1028–35. doi: 10.1002/hed.21766.
31. Hinni M.L., Salassa J.R., Grant D.G., Pearson B.W., Hayden R.E., Martin A., Christiansen H., Haughey B.H., Nussenbaum B., Steiner W. Transoral laser microsurgery for advanced laryngeal cancer. Arch Otolaryngol Head Neck Surg. 2007; 133: 1198–204. doi: 10.1001/archotol.133.12.1198.
32. Mantsopoulos K., Psychogios G., Bohr C., Zenk J., Kapsreiter M., Waldfahrer F., Iro H. Primary surgical treatment of T3 glottic carcinoma: long-term results and decision-making aspects. Laryngoscope. 2012 Dec; 122(12): 2723–7. doi: 10.1002/lary.23580.
33. Richard J.M., Sancho-Garnier H., Pessey J.J., Luboinski B., Lefebvre J.L., Dehesdin D., Stromboni-Luboinski M., Hill C. Randomized trial of induction chemotherapy in larynx carcinoma. Oral Oncol 1998; 34: 224–8. doi: 10.1016/S1368-8375(97)00090-0.
34. Forastiere A.A., Zhang Q., Weber R.S., Maor M.H., Goepfert H., Pajak T.F., Morrison W., Glisson B., Trotti A., Ridge J.A., Thorstad W., Wagner H., Ensley J.F., Cooper J.S. Long-term results of RTOG 91-11: a comparison of three non-surgical treatment strategies to preserve the larynx in patients with locally advanced larynx cancer. J Clin Oncol. 2013 Mar 1; 31(7): 845–52. doi: 10.1200/JCO.2012.43.6097.
J Clin Oncol. 2013 Mar 1; 31(7): 845–52. doi: 10.1200/JCO.2012.43.6097.
35. Machtay M., Moughan J., Trotti A., Garden A.S., Weber R.S., Cooper J.S., Forastiere A., Ang K.K. Factors associated with severe late toxicity after concurrent chemoradiation for locally advanced head and neck cancer: an RTOG analysis. J Clin Oncol. 2008 Jul 20; 26(21): 3582–9. doi: 10.1200/JCO.2007.14.8841.
36. Ghadjar P., Simcock M., Zimmermann F., Betz M., Bodis S., Bernier J., Studer G., Aebersold D.M.; Swiss Group for Clinical Cancer Research (SAKK). Predictors of severe late radiotherapy-related toxicity after hyperfractionated radiotherapy with or without concomitant cisplatin in locally advanced head and neck cancer. Secondary retrospective analysis of a randomized phase III trial (SAKK 10/94). Radiother Oncol. 2012; 104: 213–18. doi: 10.1016/j.radonc.2012.05.004.
37. Wang J.J., Goldsmith T.A., Holman A.S., Cianchetti M., Chan A.W. Pharyngoesophageal stricture after treatment for head and neck cancer. Head Neck. 2012; 34: 967–73. doi: 10.1002/hed.21842.
38. Citrin D., Mansueti J., Likhacheva A., Sciuto L., Albert P.S., Rudy S.F., Cooley-Zgela T., Cotrim A., Solomon B., Colevas A.D., Russo A., Morris J.C., Herscher L., Smith S., Van Waes C. Long-term outcomes and toxicity of concurrent paclitaxel and radiotherapy for locally advanced head-and-neck cancer. Int J Radiat Oncol Biol Phys. 2009; 74: 1040–6. doi: 10.1016/j.ijrobp.2008.09.053.
39. Pointreau Y., Garaud P., Chapet S., Sire C., Tuchais C., Tortochaux J., Faivre S., Guerrif S., Alfonsi M., Calais G. Randomized trial of induction chemotherapy with cisplatin and 5-fluorouracil with or without docetaxel for larynx preservation. J Natl Cancer Inst. 2009 Apr 1; 101(7): 498–506. doi: 10.1093/jnci/djp007.
J Natl Cancer Inst. 2009 Apr 1; 101(7): 498–506. doi: 10.1093/jnci/djp007.
40. Posner M.R., Hershock D.M., Blajman C.R., Mickiewicz E., Winquist E., Gorbounova V., Tjulandin S., Shin D.M., Cullen K., Ervin T.J., Murphy B.A., Raez L.E., Cohen R.B., Spaulding M., Tishler R.B., Roth B., Viroglio Rdel C., Venkatesan V., Romanov I., Agarwala S., Harter K.W., Dugan M., Cmelak A., Markoe A.M., Read P.W., Steinbrenner L., Colevas A.D., Norris CM Jr., Haddad R.I.; TAX 324 Study Group. Cisplatin and fluorouracil alone or with docetaxel in head and neck cancer. N Engl J Med. 2007; 357: 1705–15. doi: 10.1056/NEJMoa070956.
41. Urba S., Wolf G., Eisbruch A., Worden F., Lee J., Bradford C., Teknos T., Chepeha D., Prince M., Hogikyan N., Taylor J. Single-cycle induction chemotherapy selects patients with advanced laryngeal cancer for combined chemoradiation: a new treatment paradigm. J Clin Oncol. 2006; 24: 593–8. doi: 10.1200/JCO.2005.01.2047.
42. Worden F.P., Moyer J., Lee J.S., Taylor J.M., Urba S.G., Eisbruch A., Teknos T.N., Chepeha D.B., Prince M.E., Hogikyan N., Lassig A.A., Emerick K., Mukherji S., Hadjiski L., Tsien C.I., Miller T.H., Wallace N.E., Mason H.L., Bradford C.R., Wolf G.T. Chemoselection as a strategy for organ preservation in patients with T4 laryngeal squamous cell carcinoma with cartilage invasion. Laryngoscope. 2009 Aug; 119(8): 15107. doi: 10.1002/lary.20294.
43. Ganly I., Patel S.G., Matsuo J., Singh B., Kraus D.H., Boyle J., Wong R.J., Lee N., Pfister D.G., Shaha A.R., Shah J.P. Predictors of outcome for advanced-stage supraglottic laryngeal cancer. Head Neck. 2009 Nov; 31(11): 1489–95. doi: 10.1002/hed.21113.
44. Nguyen-Tan P.F., Le Q.T., Quivey J.M., Singer M., Terris D.J., Goffinet D.R., Fu K.K. Treatment results and prognostic factors of advanced T34 laryngeal carcinomas: the University of California, San Francisco (UCSF) and Stanford University Hospital (SUH) experience. Int J Radiat Oncol Biol Phys. 2001; 50: 1172–80. doi: 10.1016/S03603016(01)01538-3.
Nguyen-Tan P.F., Le Q.T., Quivey J.M., Singer M., Terris D.J., Goffinet D.R., Fu K.K. Treatment results and prognostic factors of advanced T34 laryngeal carcinomas: the University of California, San Francisco (UCSF) and Stanford University Hospital (SUH) experience. Int J Radiat Oncol Biol Phys. 2001; 50: 1172–80. doi: 10.1016/S03603016(01)01538-3.
45. Basheeth N., O’Leary G., Sheahan P. Pharyngocutaneous fistula after salvage laryngectomy: impact of interval between radiotherapy and surgery, and performance of bilateral neck dissection. Head Neck. 2014 Apr; 36(4): 580–4. doi: 10.1002/hed.23337
46. Chen A.Y., Halpern M. Factors predictive of survival in advanced laryngeal cancer. Arch Otolaryngol Head Neck Surg. 2007 Dec; 133(12): 1270–6.
47. Mendenhall W.M., Parsons J.T., Mancuso A.A., Pameijer F.J., Stringer S.P., Cassisi N.J. Definitive radiotherapy for T3 squamous cell carcinoma of the glottic larynx. J Clin Oncol. 1997; 15: 2394–402. doi: 10.1200/JCO.1997.15.6.2394.
48. Spaulding C.A., Gillenwater A., Constable W.C., Hahn S.S., Kersh C.R. Prognostic value of vocal cord fixation with respect to treatment in cancers of the supraglottis and pyriform sinus. Laryngoscope. 1987; 97: 1450–3. doi: 10.1288/00005537-198712000-00013.
49. Singer S., Wollbrück D., Dietz A., Schock J., Pabst F., Vogel H.J., Oeken J., Sandner A., Koscielny S., Hormes K., Breitenstein K., Richter H., Deckelmann A., Cook S., Fuchs M., Meuret S. Speech rehabilitation during the first year after total laryngectomy. Head Neck. 2013 Nov; 35(11): 1583–90. doi: 10.1002/hed.23183.
50. Chone C.T., Gripp F.M., Spina A.L., Crespo A.N. Primary versus secondary tracheoesophageal puncture for speech rehabilitation in total laryngectomy: long-term results with indwelling voice prosthesis. Otolaryngol Head Neck Surg. 2005 Jul; 133(1): 89–93.
Chone C.T., Gripp F.M., Spina A.L., Crespo A.N. Primary versus secondary tracheoesophageal puncture for speech rehabilitation in total laryngectomy: long-term results with indwelling voice prosthesis. Otolaryngol Head Neck Surg. 2005 Jul; 133(1): 89–93.
51. Bozec A., Poissonnet G., Chamorey E., Demard F., Santini J., Peyrade F., Ortholan C., Benezery K., Thariat J., Sudaka A., Anselme K., Adrey B., Giacchero P., Dassonville O. Results of vocal rehabilitation using tracheoesophageal voice prosthesis after total laryngectomy and their predictive factors. Eur Arch Otorhinolaryngol. 2010 May; 267(5): 751–8. doi: 10.1007/s00405-009-1138-x.
52. Cocuzza S., Bonfiglio M., Grillo C., Maiolino L., Malaguarnera M., Martines F., Serra A. Post laryngectomy speech rehabilitation outcome in elderly patients. Eur Arch Otorhinolaryngol. 2013 May; 270(6): 1879–84. doi: 10.1007/s00405-013-2430-3.
53. Lassaletta L., Garcia-Pallares M., Morera E., Bernaldez R., Gavilan J. T3 glottic cancer: oncologic results and prognostic factors. Otolaryngol Head Neck Surg. 2001; 124: 556–60. doi: 10.1067/mhn.2001.115498.
54. Nikolaou A., Markou K., Petridis D., Vlachtsis K., Nalbantian M., Daniilidis L. Factors influencing tumour relapse after total laryngectomy. B-ENT. 2005; 1: 1–10.
55. Kowalski L.P., Batista M.B., Santos C.R., Scopel A., Salvajolli J.V., Torloni H. Prognostic factors in T3, N0-1 glottic and transglottic carcinoma. A multifactorial study of 221 cases treated by surgery or radiotherapy. Arch Otolaryngol Head Neck Surg. 1996; 122: 77–82. doi: 10.1001/archotol.1996.01890130069011.
56. Basheeth N., Khan H., O’Leary G., Sheahan P. Oncologic outcomes of total laryngectomy: impact of margins and preoperative tracheostomy. Head Neck. 2015 Jun; 37(6): 862–9. doi: 10.1002/hed.23681.
Basheeth N., Khan H., O’Leary G., Sheahan P. Oncologic outcomes of total laryngectomy: impact of margins and preoperative tracheostomy. Head Neck. 2015 Jun; 37(6): 862–9. doi: 10.1002/hed.23681.
57. Hutcheson K.A., Lewin J.S., Sturgis E.M., Risser J. Multivariable analysis of risk factors for enlargement of the tracheoesophageal puncture after total laryngectomy. Head Neck. 2012 Apr; 34(4): 557–67. doi: 10.1002/hed.21777.
58. Patel U.A., Moore B.A., Wax M., Rosenthal E., Sweeny L., Militsakh O.N., Califano J.A., Lin A.C., Hasney C.P., Butcher R.B., Flohr J., Arnaoutakis D., Huddle M., Richmon J.D. Impact of pharyngeal closure technique on fistula after salvage laryngectomy. JAMA Otolaryngol Head Neck Surg. 2013 Nov; 139(11): 1156–62. doi: 10.1001/jamaoto.2013.2761.
59. Oosthuizen J.C., Leonard D.S., Kinsella J.B. The role of pectoralis major myofascial flap in salvage laryngectomy: a single surgeon experience. Acta Otolaryngol. 2012 Sep; 132(9): 1002–5. doi: 10.3109/00016489.2012.672768.
60. Righini C., Lequeux T., Cuisnier O., Morel N., Reyt E. The pectoralis myofascial flap in pharyngolaryngeal surgery after radiotherapy. Eur Arch Otorhinolaryngol. 2005; 262: 357–61. doi: 10.1007/s00405004-0827-8.
61. Gil Z., Gupta A., Kummer B., Cordeiro P.G., Kraus D.H., Shah J.P., Patel S.G. The role of pectoralis major muscle flap in salvage total laryngectomy. Arch Otolaryngol Head Neck Surg. 2009; 135: 1019–23. doi: 10.1001/archoto.2009.126.
62. Scola B., Fernandez-Vega M., Martinez T., Fernandez-Vega S., Ramirez C. Management of cancer of the supraglottis. Otolaryngol Head Neck Surg. 2001; 124: 195–8. doi: 10.1067/mhn.2001.112202.
63. Hicks W.L.Jr., Kollmorgen D.R., Kuriakose M.A., Orner J., Bakamjian V.Y., Winston J., Loree T.R. Patterns of nodal metastasis and surgical management of the neck in supraglottic laryngeal carcinoma. Otolaryngol Head Neck Surg. 1999; 121: 57–61. doi: 10.1016/S01945998(99)70125-7.
64. Ferlito A., Silver C.E., Rinaldo A. Selective neck dissection (IIA, III): a rational replacement for complete functional neck dissection in patients with N0 supraglottic and glottic squamous carcinoma. Laryngoscope. 2008; 118: 676–9. doi: 10.1097/MLG.0b013e31815f6f25.
65. Candela F.C., Shah J., Jaques D.P., Shah J.P. Patterns of cervical node metastases from squamous carcinoma of the larynx. Arch Otolaryngol Head Neck Surg. 1990; 116: 432–5. doi: 10.1001/archotol.1990.01870040054013.
66. Khafif A., Fliss D.M., Gil Z., Medina J.E. Routine inclusion of level IV in neck dissection for squamous cell carcinoma of the larynx: is it justified? Head Neck. 2004; 26: 309–12. doi.org/10.1002/hed.10390.
67. Ozturkcan S., Katilmis H., Ozdemir I., Tuna B., Guvenc I.A., Dundar R. Occult contralateral nodal metastases in supraglottic laryngeal cancer crossing the midline. Eur Arch Otorhinolaryngol. 2009 Jan; 266(1): 117–20. doi: 10.1007/s00405-008-0721-x.
68. Davis R.K., Kriskovich M.D., Galloway E.B., Buntin C.S., Jepsen M.C. Endoscopic supraglottic laryngectomy with postoperative irradiation. Ann Otol Rhinol Laryngol. 2004; 113: 132–8. doi: 10.1177/000348940411300210.
69. Alpert T.E., Morbidini-Gaffney S., Chung C.T., Bogart J.A., Hahn S.S., Hsu J., Kellman R.M. Radiotherapy for the clinically negative neck in supraglottic laryngeal cancer. Cancer J. 2004; 10: 335–8. doi: 10.1097/00130404-200411000-00001.
70. de Bree R., Leemans C.R., Silver C.E., Robbins K.T., Rodrigo J.P., Rinaldo A., Takes R.P., Shaha A.R., Medina J.E., Suárez C., Ferlito A. Paratracheal lymph node dissection in cancer of the larynx, hypopharynx, and cervical esophagus: the need for guidelines. Head Neck. 2011; 33: 912–16. doi: 10.1002/hed.21472.
71. Chan A.W., Ancukiewicz M., Carballo N., Montgomery W., Wang C.C. The role of postradiotherapy neck dissection in supraglottic carcinoma. Int J Radiat Oncol Biol Phys. 2001; 50: 367–75. doi: 10.1016/S03603016(01)01468-7.
72. Forest V.I., Nguyen-Tan P.F., Tabet J.C., Olivier M.J., Larochelle D., Fortin B., Gélinas M., Soulières D., Charpentier D., Guertin L. Role of neck dissection following concurrent chemoradiation for advanced head and neck carcinoma. Head Neck. 2006; 28: 1099–105. doi: 10.1002/hed.20479.
73. Corry J., Peters L., Fisher R., Macann A., Jackson M., McClure B., Rischin D. N2-N3 neck nodal control without planned neck dissection for clinical/radiologic complete responders-results of Trans Tasman Radiation Oncology Group Study 98.02. Head Neck. 2008 Jun; 30(6): 737–42. doi: 10.1002/hed.20769.
74. Hamoir M., Ferlito A., Schmitz S., Hanin F.X., Thariat J., Weynand B., Machiels J.P., Grégoire V., Robbins K.T., Silver C.E., Strojan P., Rinaldo A., Corry J., Takes R.P. The role of neck dissection in the setting of chemoradiation therapy for head and neck squamous cell carcinoma with advanced neck disease. Oral Oncol. 2012; 48: 20310. doi: 10.1016/j.oraloncology.2011.10.015.
75. Liu X.K., Li Q., Zhang Q., Su Y., Shi Y.X., Li H., Zeng Z.Y., Guo Z.M. Planned neck dissection before combined chemoradiation in organ preservation protocol for N2–N3 of supraglottic or hypopharyngeal carcinoma. ORL J Otorhinolaryngol Relat Spec. 2012; 74(2): 64–9. doi: 10.1159/000333111.
76. Amit M., Hilly O., Leider-Trejo L., Popovtzer A., Gutfeld O., Shvero J., Fliss D.M., Cohen J.T., Bachar G., Gil Z. The role of elective neck dissection in patients undergoing salvage laryngectomy. Head Neck. 2013 Oct; 35(10): 1392–6. doi: 10.1002/hed.23145.
77. Wax M.K., Touma B.J. Management of the N0 neck during salvage laryngectomy. Laryngoscope. 1999; 109: 4–7. doi: 10.1097/00005537199901000-00002.
78. Basheeth N., O’Leary G., Sheahan P. Elective neck dissection for no neck during salvage total laryngectomy: findings, complications, and oncological outcome. JAMA Otolaryngol Head Neck Surg. 2013 Aug 1; 139(8): 790–6. doi: 10.1001/jamaoto.2013.3995.
79. Farrag T.Y., Lin F.R., Cummings C.W., Koch W.M., Flint P.W., Califano J.A., Broussard J., Bajaj G., Tufano R.P. Neck management in patients undergoing postradiotherapy salvage laryngeal surgery for recurrent/ persistent laryngeal cancer. Laryngoscope. 2006; 116: 1864–6. doi: 10.1097/01.mlg.0000234917.08822.cd.
80. Bohannon I.A., Desmond R.A., Clemons L., Magnuson J.S., Carroll W.R., Rosenthal E.L. Management of the N0 neck in recurrent laryngeal squamous cell carcinoma. Laryngoscope. 2010; 120: 58–61. doi: 10.1002/lary.20675.
81. Dagan R., Morris C.G., Kirwan J.M., Werning J.W., Vaysberg M., Amdur R.J., Mendenhall W.M. Elective neck dissection during salvage surgery for locally recurrent head and neck squamous cell carcinoma after radiotherapy with elective nodal irradiation. Laryngoscope. 2010; 120: 945–52. doi: 10.1002/lary.20854.
82. Yao M., Roebuck J.C., Holsinger F.C., Myers J.N. Elective neck dissection during salvage laryngectomy. Am J Otolaryngol. 2005; 26: 388–92. doi: 10.1016/j.amjoto.2005.05.002.
83. Раджабова З.А., Левченко Е.В., Дунаевский И.В., Горохов Л.В., Котов М.А., Хандогин Н.В., Ракитина Д.А., Нажмудинов Р.А., Гиршович М.М., Тюряева Е.И., Ткаченко Е.В., Пономарева О.И. Анализ результатов комбинированного лечения пациентов с верифицированным раком шейного отдела пищевода и гортаноглотки с применением хирургического лечения с одномоментной пластикой дефекта. Опухоли головы и шеи. 2016; 6(3): 61–63. doi: 10.17650/2222-1468-2016-6-3-61-63.
Рак гортани и гортаноглотки
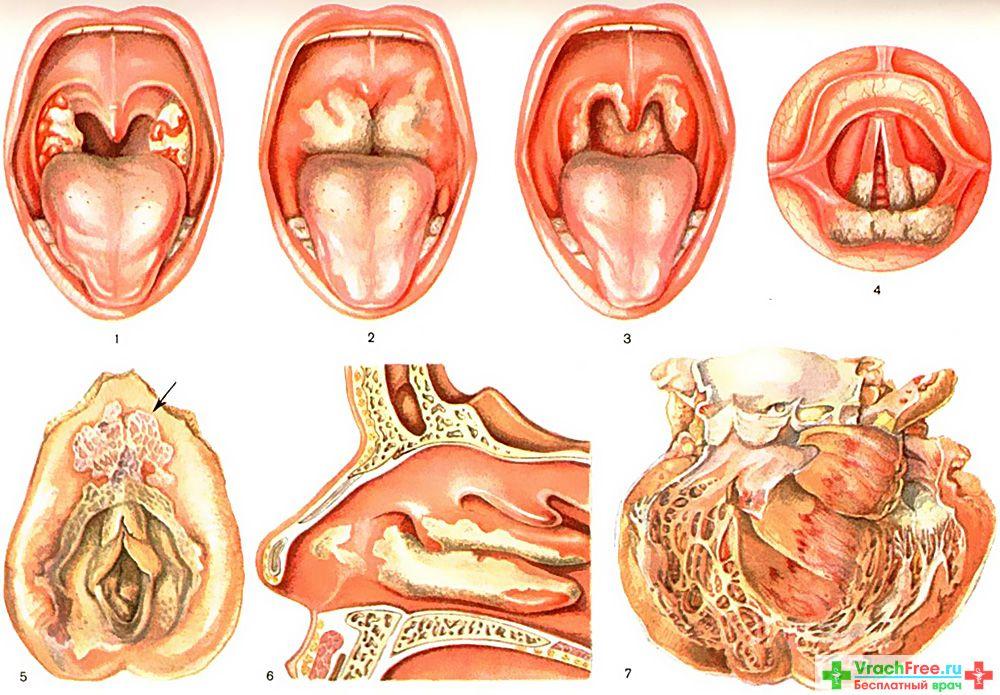
В 95% случаев опухоли гортани представлены плоскоклеточным раком. Этот вид рака возникает постепенно в результате изменения клеток под воздействием курения и употребления алкоголя. Не все предопухолевые состояния превращаются в истинный рак. Если, например, прекратить курение, то предопухолевые изменения могут исчезнуть.
Тем не менее, в ряде случаев предопухолевые состояния превращаются в рак. Ранняя стадия носит название рака in situ (т.е. в одном месте). В некоторых случаях такой рак может исчезнуть самостоятельно, в некоторых — его можно удалить, например, с помощью лазера. Без лечения рак in situ чаще всего может превратиться в истинный рак со способностью к дальнейшему распространению.
В 2002 году в России число первично выявленных опухолей гортани составило 7001 случай. При этом у 50% больных диагностирована 3 стадия заболевания. Опухоли гортани выявлялись у мужчин в 21 раз чаще, чем у женщин. Наиболее часто рак гортани имели люди в возрасте 65-74 лет. За этот период выявлено 1598 случаев опухолей гортаноглотки.
Предполагается, что в 2004 г. в США будет диагностировано приблизительно 10270 случаев рака гортани, при этом 3830 из них могут умереть. За этот же период будет выявлено около 2500 случаев рака гортаноглотки.
Эти виды рака возникают чаще всего у курильщиков, поэтому у них могут развиться и опухоли в других, близлежащих органах и областях — легких и полости рта. Больным раком гортани и гортаноглотки рекомендуется срочно прекратить курение и употребление алкоголя.
Причины возникновения рака гортани и гортаноглотки и возможность профилактики
Факторы риска
Курение. Большинство больных данным видом рака являются курильщиками. Риск рака гортани и гортаноглотки у курящих людей во много раз превышает риск у некурильщиков. Чем больше курит человек, тем выше у него риск рака.
Употребление алкоголя. У людей, потребляющих алкоголь в большом количестве, риск рака гортани значительно повышен. В случае сочетания курения и употребления алкоголя этот риск повышается еще более значительно.
Диета. Некачественное питание обычно характерно для людей, употребляющих алкоголь. Нехватка витаминов группы В, А и ретиноидов может играть роль в развитии рака гортани и гортаноглотки.
Вирус папилломы человека (HPV). Эти вирусы вызывают бородавки на кистях, стопах и других местах. Некоторые вирусы могут явиться причиной таких бородавок на половых органах. Кроме того, эти вирусы могут в отдельных случаях играть важную роль в развитии рака гортани и гортаноглотки.
Ослабление иммунной системы. Рак гортани и гортаноглотки чаще встречается у людей с ослабленной иммунной системой. Это может быть связано с врожденными заболеваниями, СПИДом и применением препаратов, применяемых при трансплантации органов.
Профессиональные вредности. Контакты с древесной пылью, красками и некоторыми химическими веществами может увеличить риск рака гортани и гортаноглотки.
Пол. У мужчин опухоли гортани встречаются в 4-5 раз чаще, чем у женщин. В прошлые годы мужчины больше курили и употребляли спиртные напитки по сравнению с женщинами. В настоящее время ситуация изменилась, и риск рака гортани у женщин увеличивается.
Возраст. Эти опухоли редко встречаются в молодом возрасте. Большинство больных раком гортани и гортаноглотки находятся в возрасте 60-70 лет.
Раса. Рак гортани и гортаноглотки чаще выявляется среди афроамериканцев, чем у белых.
У большинства людей этот вид рака можно предотвратить. Это возможно при отказе от курения и употребления алкоголя наряду с соблюдением техники безопасности при работе с канцерогенными веществами.
Неправильное питание и недостаток витаминов могут быть связаны с возникновением рака. Лучше правильно и сбалансировано питаться, чем полагаться на таблетированные витамины. Потребление большого количества фруктов и овощей и снижение потребления мясных и жирных продуктов является залогом хорошего здоровья.
Выявление рака гортани и гортаноглотки
У многих больных рак гортани можно обнаружить на ранних стадиях. Опухоли голосовых связок выявляются обычно на ранних стадиях, так как они вызывают осиплость голоса. Необходимо обратиться к врачу, если появились следующие жалобы:
- Непроходящая боль в горле
- Постоянный кашель
- Затруднение глотания или боль при глотании
- Непроходящая боль в ухе
- Затрудненное дыхание
- Похудение
- Осиплость голоса на протяжении 2 и более недель
- Появление припухлости или опухоли на шее
При подозрении на рак гортани и гортаноглотки больной направляется к специалисту по опухолям области головы и шеи. Гортань и гортаноглотка расположены глубоко, поэтому диагностика представляет определенные трудности. С помощью специального инструмента, представляющего собой гибкую тонкую трубку с осветителем и вводимого через нос или рот, тщательно исследуются полость носа, гортань и гортаноглотка. В случае выявления подозрительного очага или опухоли выполняется биопсия (взятие кусочка ткани для исследования).
Компьютерная томография (КТ) дает возможность определить размеры опухоли и ее распространение по лимфатическим узлам и окружающим тканям.
Магнитно-резонансная томография (МРТ) позволяет более детально, чем компьютерная томография, исследовать структуры тела, особенно головной и спинной мозг.
Контрастное исследование пищевода с барием дает возможность получить дополнительную информацию об опухоли.
Биопсия является единственным методом, дающим возможность с уверенностью судить о наличии рака. Биопсия может заключаться во взятии кусочка ткани или пункции опухоли иглой.
Лечение рака гортани и гортаноглотки
При решении вопроса о лечении больных раком гортани учитываются тип опухоли и стадия (степень распространения) заболевания. Кроме того, принимается во внимание возраст больного, его общее состояние, а также мнение пациента.
Применяются три основных метода лечения больных раком гортани и гортаноглотки: операция, облучение и химиотерапия. Иногда используется комбинация из двух или всех трех видов терапии. Если рак, по какой-то причине нельзя излечить полностью, то целью лечения является удаление или уничтожение большей части опухоли. Иногда лечение направлено на облегчение симптомов болезни. Такое лечение называется паллиативным.
Рак горла — клиника «Добробут»
Под термином «рак горла» наиболее часто подразумевается первичный рак гортани. Несмотря на его достаточно низкую встречаемость (порядка 3% от всех онкозаболеваний), в структуре злокачественных новообразований ЛОР органов на его долю приходится 50-60%. По отношению к голосовым связкам, в гортани принято условно выделять три отдела: верхний (над связками), средний (в месте их расположения) и нижний, расположенный под ними:
- подавляющее число (около 65%) злокачественных образований приходится на средний отдел;
- 30-35% — на верхний;
- на нижнюю часть гортани или вовлечение в процесс нескольких отделов приходится около 5-10%.
В структуре онкологической заболеваемости раком гортани с явным преимуществом «лидируют» мужчины. На их долю приходится 2,8%, в то время как на долю женщин всего 0,16%.
Заболевание часто развивается на фоне гиперпластического ларингита с кератозом, папиллом и других фоновых процессов. Наиболее значимыми из них являются:
- Папиллома/папилломатоз, озлокачествление которых наблюдаются почти в 40% случаев.
- Пахидермии (наросты эпидермиса), расположенные преимущественно вблизи отростков черпаловидных хрящей.
- Дискератозы — лейкокератозы, лейкоплакии (ороговение слизистой).
- Фибромы в задней части голосовых складок.
- Рубцовый процесс, вызванный ожогом, некоторыми инфекциями.
Гистологически рак горла на 98% относится к плоскоклеточному раку, развивающемуся из клеток гортанной слизистой. Частота образования метастаз наблюдается в 25-50% случаев и происходит преимущественно лимфогенным путем по направлению в регионарные лимфоузлы. Этому способствуют специфика анатомического строения лимфатической системы шеи.
Основные факторы риска
Основными факторами риска являются табак и алкоголь. У курильщиков, а также лиц, злоупотребляющих жевательными смесями и алкогольсодержащими напитками, риск развития первичных/повторных злокачественных образований повышен в 6–10 раз. При этом величина относительного риска статистически достоверно коррелирует с продолжительностью (стажем) курения и его интенсивностью (количеством выкуриваемых сигарет). Такая же зависимость наблюдается и при злоупотреблении алкоголем.
Онкогенные вирусы папилломы человека, роль которых за последнее десятилетие значительно выросла, в некоторых возрастных группах оттеснили табак и алкоголь-обусловленные факторы.
Неблагоприятная экологическая атмосфера в зоне проживания либо на работе (занятость на производстве при контакте с асбестом, парами различных кислот, фенолом, бензолом).
Лучевая терапия, проведенная в области головы/шеи.
Генетическая предрасположенность.
Симптомы рака горла
Клиническая симптоматика определяется локализацией, распространенностью, характером роста, наличием метастазов. Соответственно, проявления рака горла варьируют в широких пределах.
На нулевой стадии заболевания («рак на месте») какая-либо выраженная специфическая симптоматика практически отсутствует. Это мешает распознать рак горла и способствует более позднему обращению в медучреждение.
На ранней стадии преобладает симптоматика со стороны горла – периодическое першение, охриплость, болезненность, изменение голоса, эпизодический/постоянный сухой кашель, которые не проходят после применения болеутоляющих и противокашлевых средств, в отличие от простудных заболеваний. Может присутствовать субфебрильная температура (постоянно повышенная температура), отмечаться увеличение подчелюстных и шейных лимфоузлов.
При дальнейшем росте опухоли в гортани (при поражении голосовых складок и вовлечении в процесс окружающих тканей) появляются такие признаки рака горла, как:
- осиплость голоса, переходящая в афонию;
- кажется, будто в горле находится инородное тело;
- чувствуется боль во время глотания;
- головные боли;
- расстройства сна, раздражительность.
При раке подскладочного отдела пациенты отмечают затруднение дыхания, боли в горле, распространяющиеся на всю шею. На дальнейших стадиях заболевания, при распаде опухоли могут появляться:
- неприятный запах и выделения мокроты, часто с примесью крови изо рта/носа;
- резкая потеря веса с развитием нутрицидной, преимущественно белково-энергетической недостаточности.
Стадии рака горла
При установлении диагноза выделяют несколько стадий.
Рак горла 1 стадии. Опухоль ограничена маленьким участком слизистой/подслизистым слоем, распологается в пределах одного отдела гортани. Функция голосового связочного аппарата и подвижность гортани не нарушена.
Рак горла 2 стадии. Распространение в слизисто-подслизистом слое всего отдела гортани, частично выходящее за его пределы. Нарушается подвижность голосовых связок.
Рак горла 3 стадии. Наблюдается прорастание в окружающие ткани прилегающих отделов. Метастазы распространяются в регионарные лимфоузлы.
Рак горла 4 стадии. Опухоль охватывает большую часть ткани гортани, метастазы в узлы лимфы, в различные отдаленно расположенные органы.
Диагноз ставится на основании данных инструментального обследования гортани (ларингоскопия, МРТ, КТ) и результатов биопсии опухоли.
Методы лечения рака горла
Возможности лечения рака горла постоянно совершенствуются, что обусловлено широким внедрением в практику органосохраняющих малоинвазивных методов на основе использования новых типов лазерных и эндоскопических аппаратов. Стратегия лечения рака горла определяется его стадией.
При обнаружении заболевания на раннем этапе, наиболее эффективный метод — удаление местно-распространенной опухоли (в различном объеме – субтотальные и тотальные резекции гортани). Операция проводится как традиционным хирургическим способом, так и с использованием лазера (эндоскопическая лазерная деструкция опухоли) или при их комбинации. При этом предпочтение отдается органосохраняющим хирургическим вмешательствам и проведению реконструктивных операций с использованием различных эндопротезов (в частности, на основе никелида титана). Это позволяет более эффективно восстанавливать дыхательную/голосовую функции пациентов и увеличить безрецидивную пятилетнюю выживаемость до 82%.
Широкое применение в лучевой терапии нашел метод лечения в условиях гипербарической оксигенации (при насыщении кислородом в барокамере). Он позволяет добиться гораздо более эффективной деструкции опухоли, быстрой регенерации, уменьшить риск развития рубцовой деформации и минимизировать негативное влияния ионизирующего излучения на прилегающие ткани. Лучевая терапия позволяет вылечить рак горла в 75-80% случаев у пациентов с I — II стадиями, и до 30-40% пациентов с III стадией. При наличии регионарных/отдаленных метастазов, как компонент комбинированного лечения может использоваться и химиотерапия, с целью достижения более благоприятных результатов.
Профилактика рака горла
Своевременно проводимые профилактические мероприятия позволяют избежать появления рака гортани. К основным мерам профилактики, позволяющим снизить риск развития рака горла, относятся:
- Прекращение/ограничение табакокурения, в том числе и пассивного курения (вдыхание дыма при курении другими лицами), злоупотребление алкоголесодержащими напитками. Сочетание курения с употреблением алкоголя значительно увеличивает риск заболеть раком горла.
- При работе в зоне риска обязательно применять соответствующие индивидуальные средства защиты.
- Соблюдение гигиены полости рта.
- Своевременное и адекватное лечение хронических заболеваний носоглотки и гортани (тонзиллиты, ларингиты, фарингиты) с их полным излечением.
- Своевременное выявление доброкачественных опухолей слизистой оболочки полости рта (папиллом, фибром, гиперплазии слизистой) при посещении стоматолога с биопсией образования. При выявлении папиллом вирусной этиологии необходимо хирургическое удаление новообразования с обязательным прохождением иммуномодулирующего и противовирусного лечения.
Почему так важно вовремя посетить онколога
При подозрении на малигнизацию (озлокачествление) необходимо пройти консультацию у врача онколога, поскольку только ранняя диагностика рака горла позволяет рассчитывать на успешное лечение.
В целом эффективность терапии и прогноз определяется стадией заболевания, на которой начато активное лечение. Что касается прогноза, то медиана 5-летней выживаемости варьируется в широком диапазоне:
- на нулевой стадии («рак на месте» – in situ), в случаях выявления заболевания, успех составляет около 100-90%;
- на 1-й стадии — 80%;
- 2-й — 70%;
- 3-й — 50%;
- на 4-й, при наличии метастазов, выживаемость составляет около 18,5%.
Статистика не оставляет сомнений — чем раньше идентифицировано заболевание и посещен онколог, тем больше у пациента шансов победить рак горла.
Рак гортани: Причины,Симптомы,Лечение | Doc.ua
Классификация патологии разработана на основании места образования опухоли. Гортань условно состоит их трех отделов – надсвязочного, что над голосовыми связками, голосового аппарата или связок, подсвязочного отдела (ниже голосовых связок).Симптомы рака гортаниотличаются в зависимости от того, где размещается новообразование.
Рак надсвязочного отдела – характерен быстрый рост, быстрое образование вторичных очагов опухоли – метастаз в других органах. Это – самая распространенная форма патологии. Менее стремительно развивается рак голосовых связок. Прогноз более благоприятный, поскольку больной, как правило, своевременно обращается за медицинской помощью из-за возникшей охриплости голоса.
Наиболее редким видом злокачественной опухоли гортани является рак подскладочного отдела. Он тоже имеет неблагоприятный прогноз, поскольку развитие патологии происходит несколько глубже – в прослойке между слизистой и мышечным слоем. Ввиду этого выявляют заболевание, в большинстве своем, на поздних стадиях. Данная разновидность опухолей горла является самой редкой. Также различают опухоль в зависимости от характера роста. По этому критерию она бывает экзофитной (рост в просвет) и эндофитной (рост вглубь ткани).
ПричиныОдним из основных факторов риска являются вредные привычки – курение и употребление спиртных напитков. Статистические данные говорят о том, что большинство пациентов с этим диагнозом – курильщики. Вызвать развитие заболевания могут неблагоприятные условия окружающей среды – сильная запыленность, повышенная температура воздуха, высокое содержание в атмосфере сажи, фенольных смол, бензола и др. Рак горла – профессиональная болезнь. Ей зачастую страдают люди профессий, испытывающих большие нагрузки на голосовые связки – певцы, ораторы, преподаватели и др.
Существует группа заболеваний, которые считаются предраковыми состояниями и с большой долей вероятности перерождаются в онкологию. К ним относят хроническое воспаление гортани (ларингит), гиперплазию гортани (чрезмерное разрастание клеток органа), лейкоплакию и кератоз, контактные язвы, а также папилломы, кисты и контактные гранулемы, являющиеся доброкачественными опухолями. Также к факторам риска относят и заболевания эндокринной системы, поскольку гортань – гормонально зависимый орган.
СимптомыПри раке надсвязочного отдела симптомы невыразительны или совсем отсутствуют, поэтому человек долгое время не обращается к доктору. Больной может ощущать сухость и першение, жаловаться на отсутствие чувствительности в области горла. Периодически появляется осиплость голоса, покашливание. Эти симптомы часто путают с простудой. Из ярко выраженных имптомов такого рака горла – ощущение инородного тела в горле, боль при глотании, отдающая в область уха со стороны опухоли. Со временем она становится постоянной. Из-за боли больной меньше ест, теряет в весе, что может привести к истощению.
Признаки рака горла в области голосового аппарата – охриплость, вплоть до потери голоса и перехода на шепот. С разрастанием новообразования появляется затрудненность дыхания, одышка – ощущение, что не хватает воздуха, дыхание становится звучным, шипящим или свистящим – такое явление называют «стридор». Возможно кровохарканье, запах гнили изо рта.
При раке подсвязочного отдела просвет гортани сужается, что приводит к одышке и нарушению дыхания, появляется сухой кашель, затем охриплость. Появляется боль, которая связана с интеграцией опухоли в хрящ. На поздних стадиях, как и в предыдущем случае, появляется неприятный, гнилой запах изо рта и кровохарканье.
ДиагностикаДиагностика рака гортани включает:
- сбор анамнеза;
- осмотр ларингоскопом, фиброларингоскопом;
- компьюетрная томография;
- биопсия;
- рентгенологические методы исследования.
Методы терапии выбирают в зависимости от стадии и тяжести заболевания, а также от чувствительности новообразования к тому или иному виду лечения. Хирургическое лечение рака гортани заключается в частичном (резекция) или полном (ларингоэктомия) удалении гортани. Удалению подлежат и вторичные опухолевые очаги, или метастазы – если такие есть. Хирургическое вмешательство проводят при небольших размерах новообразования, когда опухоль находится на I, II стадиях болезни.
Лечение рака горла проводится по комбинированной схеме: до и после проведения операции пациент проходит курс лучевой терапии. Это позволяет значительно уменьшить размер опухоли и метастаз. Иногда требуется провести несколько сеансов облучения. Лучевую терапию не применяют при диагнозе «перихондрит хрящей гортани», когда опухоль перешла на кровеносные сосуды и пищевод, образовались обширные отдаленные или регионарные метастазы. Данный метод не используется также, если пациент пребывает в тяжелом состоянии.
Лучевая терапия проводится на III–IV стадиях рака горла развития заболевания до операции. Облучению подлежит вся шея. Операция выполняется через 3–4 недели. Химиотерапия при данном заболевании малоэффективна и не может использоваться как самостоятельный метод терапии. В совокупности с другими методиками назначается при надскладочном раке. После прохождения курса лечения пациент находится под контролем специалистов. Первые полгода он должен посещать врача ежемесячно, вторые полгода – раз в полтора-два месяца, в последующие годы – несколько реже. Если начать комбинированное лечение на І, ІІ стадиях заболевания, то пятилетняя выживаемость достигает 90 %. Для ІІІ стадии прогноз ухудшается до 67 %. После лечения важно пройти курс послеоперационной реабилитации, особенно если имела место радикальная терапия. Такие пациенты нуждаются в обучении речи.
Рак гортани| Блог UNIM
Рак гортани составляет до 2% от всех злокачественных опухолей, 96% заболевших – мужчины, обычно старше 40 лет. Рак гортани развивается чаще всего развивается в области голосовых связок (средний), реже в надсвязочном (вестибулярный) отделе, и примерно в 5% в подсвязочном отделе. Несмотря на то, что расположение опухоли позволяет обнаружить ее на ранних стадиях, более 50% больных с раком надсвязочного отдела обращаются за помощью, уже имея метастазы в регионарных лимфатических узлах. Рак области голосовых связок метастазирует реже и позже.
Среди причин, вызывающих этот вид рака — курение, усугубляющееся избыточным потреблением алкоголя. В 20% случаев в ткани опухоли определяется вирус папилломы человека (обычно 16 тип), также выявлена связь рака гортани (подсвязочной локализации) с вирусом Эпштейн-Барр (до 40%).
Симптомы рака гортани на ранних стадиях отсутствуют, затем появляются жалобы на неловкость и поперхивание при глотании, позже – боль. При раке голосовых связок основной симптом – охриплость голоса, переходящая в афонию (его потерю). При подскладочной локализации пациенты жалуются на затруднение дыхание, осиплость голоса, а при распространенном раке – кашель с мокротой, гнилостный запах изо рта.
Комплекс диагностических мероприятий при подозрении на рак гортани включает осмотр, пальпацию гортани и лимфатических узлов шеи, орофарингоскопия, ларинго- и гипофарингоскопия (зеркальная или эндоскопическая, фиброларингоскопия) с биопсией опухоли и обязательным гистологическим исследованием, ультразвуковое исследование шеи, компьютерная томография органов грудной клетки, ЭКГ и комплекс лабораторных исследований. Желательно выполнение магнитно-резонансной томографии или КТ с контрастированием области первичного очага.
Диагноз рака гортани выставляется только после гистологической верификации диагноза. Наиболее частым гистологическим вариантом рака гортани является плоскоклеточный рак. Реже встречаются нейроэндокринные карциномы, рак малых слюнных желез, мукоэпидермоидный рак, меланома слизистых оболочек. От гистологического типа опухоли, ее локализации и распространенности, зависят тактика лечения и прогноз заболевания.
Основным методом лечения рака гортани является лучевая терапия (при локализованных опухолях). При распространенном раке лучевая терапия проводится после хирургического лечения и иногда сочетается с химиотерапией.
Рак гортани | Johns Hopkins Medicine
Гортань, обычно называемая голосовым ящиком, представляет собой покрытый хрящом орган с тремя важнейшими функциями:
- Производство звука
- Поддержание открытого дыхательного пути
- Закрытие дыхательных путей во время глотания для предотвращения аспирации.
При лечении заболеваний гортани, включая рак, необходимо учитывать эти функции.
Анатомия гортани
Гортань делится на три анатомических области или уровня:
- Supraglottis: Ткани над звукоизлучающими структурами
- Glottis: Звуковые голосовые связки
- Subglottis: Область ниже голосовых связок, но выше дыхательного горла или трахеи.
Симптомы и лечение рака гортани в некоторой степени зависят от пораженного (ых) региона (ов).
Что такое рак гортани?
Большинство видов рака, возникающих в гортани, начинаются на поверхности слизистой оболочки и называются плоскоклеточной карциномой (SCC). Гораздо менее распространенными формами рака гортани являются рак слюнных желез, возникающий из крошечных слюнных желез под слизистой оболочкой, или рак, возникающий из мышц, хрящей или других структурных тканей (сарком). SCC гортани связан с курением, хотя влияние пассивного курения и влияние курения в прошлом менее очевидны.Некоторые случаи рака гортани возникают без известных факторов риска.
Каковы симптомы рака гортани?
Ранний рак гортани может вообще не иметь никаких симптомов. Небольшие разрастания голосовых связок могут вызывать охриплость голоса или кашель, что повышает вероятность ранней диагностики рака голосовой щели. Ранний рак надгортанника (над голосовыми связками) может вызывать боль, которая может усиливаться при глотании, и боль может ощущаться так, как будто она затрагивает ухо, явление, известное как отраженная ушная боль.
Рак гортани средней и тяжелой степени может вызывать:
- Затрудненное или болезненное глотание
- Затрудненное дыхание
- Шумное дыхание
- Сильная охриплость
- Кровохарканье (кровохарканье)
- Масса или рост на шее
Как диагностируется рак гортани?
Медицинские работники не могут осмотреть гортань без специального оборудования. Гортань можно увидеть с помощью гортанного зеркала или оптоволоконного телескопа с видеокамерой.Рак обычно вызывает изменения внешнего вида слизистой оболочки или симметричных структур гортани, которые можно увидеть с помощью этих устройств. Его также можно обнаружить с помощью рентгенографии, включая МРТ, компьютерную томографию или ультразвук.
При обнаружении подозрительного поражения гортани проводится дополнительное обследование для подтверждения диагноза путем взятия небольшого образца ткани. Из-за чувствительности гортани в большинстве случаев это необходимо делать под общим наркозом в операционной.В то же время хирург может собрать важную информацию о размере опухоли путем более тщательной визуализации и непосредственного прикосновения к тканям. ПЭТ / КТ или другое визуализационное исследование может быть выполнено для оценки состояния лимфатических узлов и возможного распространения.
Как лечится рак гортани?
Лечение рака гортани определяется:
- Тип рака
- Степень или стадия опухоли
- Точные участки гортани, пораженные опухолью.
Для большинства видов рака, включая рак гортани, доступны три вида лечения:
- Хирургия
- Лучевая терапия
- Химиотерапия
Ранний рак гортани
Ранние виды рака (меньшие опухоли с минимальным поражением гортани) можно успешно лечить с помощью только одного из этих видов лечения; на более поздних стадиях рака может потребоваться комбинированная терапия с использованием двух или всех трех типов лечения.
Отдельные ранние формы рака голосовых связок (голосовой щели) и надгортанника (над голосовыми связками) можно удалить через рот с помощью минимально инвазивной хирургии, такой как робот или лазер. Если вы не являетесь кандидатом на операцию, альтернативным лечением является полный курс лучевой терапии.
Продвинутый рак гортани
Раковые опухоли среднего размера часто лечат комбинацией химиотерапии и лучевой терапии. Очень обширные раковые образования, которые уже вышли за пределы хрящевой стенки голосового аппарата или вызвали нарушение функции гортани, лечат хирургическим вмешательством с последующей лучевой терапией.
Типы операций по удалению рака гортани
Хирурги головы и шеи используют ряд хирургических процедур для лечения отдельных видов рака гортани, включая подходы, которые сохраняют три функции гортани. В наиболее обширных случаях хирургическое вмешательство должно удалить всю гортань (полная ларингэктомия), процедура, которая разделяет дыхательный и глотательный проходы, обеспечивая безопасное безопасное дыхание и возобновление нормальной диеты, но с постоянным дыхательным отверстием в шее.Пациенты, перенесшие тотальную ларингэктомию, могут возобновить речь, используя один из нескольких подходов, таких как голосовой протез или электроглотка.
Лечение рака гортани | MHealth.org
Источник: Национальный исследовательский институт рака, www.cancer.gov
Лечение рака гортани
Общая информация о раке гортани
Рак гортани — это заболевание, при котором злокачественные (раковые) клетки образуются в тканях гортани.
Гортань — это часть глотки между основанием языка и трахеей. Гортань содержит голосовой шнуры, которые вибрируют и издают звук, когда воздух направлен против их. Звук разносится эхом через глотку, рот и нос, заставляя человека голос.
Гортань состоит из трех основных частей:
- Надгортанника: верхняя часть гортани над голосовыми связками, включая надгортанник.
- Glottis: The средняя часть гортани, где расположены голосовые связки.
- Подсвязь: нижняя часть гортани между голосовыми связками и трахеей (дыхательное горло).
Анатомия гортани. Три части гортани — это надгортанник (включая надгортанник), голосовая щель (включая голосовые связки) и подгортанник.
Большинство видов рака гортани формируются в плоскоклеточных клетках — тонких плоских клетках, выстилающих внутреннюю часть гортани.
Рак гортани — это разновидность рака головы и шеи.
Употребление табачных изделий и чрезмерное употребление алкоголя могут повлиять на риск рака гортани.
Все, что увеличивает риск заболевания, называется фактор риска. Наличие фактора риска не означает, что вы заболеть раком; отсутствие факторов риска не означает, что вы будете не заболеть раком. Поговорите со своим врачом, если считаете, что подвергаетесь риску.
Признаки и симптомы рака гортани включают боль в горле и боль в ухе.
Эти и другие признаки и симптомы могут быть вызваны раком гортани или прочие условия.Проконсультируйтесь с врачом, если у вас есть одно из следующих событий:
- Не проходит боль в горле или кашель.
- Проблемы или боль при глотании.
- Боль в ухе.
- Шишка в шее или горле.
- Изменение или охриплость голоса.
Тесты, которые исследуют горло и шею, используются для выявления (найти), диагностировать и определить стадию рака гортани.
Могут использоваться следующие тесты и процедуры:
- Физический осмотр горла и шеи : Осмотр для проверки горла и шеи на наличие аномальных участков.Врач ощупывает внутреннюю часть рта пальцем в перчатке и осматривает рот и горло небольшим зеркало с длинной ручкой и свет. Это будет включать проверку щек и губ изнутри; десны; спина, крыша и дно рта; верхняя, нижняя и боковые части языка; и горло. Шея будет прощупываться на предмет увеличения лимфатических узлов. Также будет записан анамнез пациента, его привычки в отношении здоровья, перенесенные болезни и лечение.
- Биопсия : Удаление клеток или тканей, чтобы их мог рассмотреть под микроскопом патологоанатом для проверки признаков рака.Образец ткани может быть удален во время одной из следующих процедур:
- Ларингоскопия : A процедура осмотра гортани (голосового аппарата) на предмет аномальных участков. Зеркало или ларингоскоп (тонкий трубчатый инструмент с подсветкой и линзой для обзора) вводится через рот, чтобы увидеть гортань. Для удаления образцов ткани можно использовать специальный инструмент на ларингоскопе.
- Эндоскопия : A процедура для осмотра органов и тканей внутри тела, таких как горло, пищевод и трахея, на предмет аномальных участков.Эндоскоп (тонкая светящаяся трубка с источником света и линзой для просмотра) вводится через отверстие в теле, например, во рту. Для удаления образцов ткани можно использовать специальный инструмент на эндоскопе.
- Компьютерная томография (CAT scan) : процедура, которая делает серию подробных снимков участков внутри тела, сделанных под разными углами. Снимки сделаны компьютером, подключенным к рентгеновскому аппарату. Краситель можно ввести в вену или проглотить, чтобы органы или ткани были видны более четко.Эта процедура также называется компьютерной томографией, компьютерной томографией или компьютерной аксиальной томографией.
- МРТ (магнитно-резонансная томография) : процедура, при которой используются магнит, радиоволны и компьютер для создания серии подробных снимков участков внутри тела. Эта процедура также называется ядерной магнитно-резонансной томографией (ЯМРТ).
- ПЭТ-сканирование (позитронно-эмиссионная томография) : процедура для поиска злокачественных опухолевых клеток в организме. В вену вводят небольшое количество радиоактивной глюкозы (сахара).Сканер ПЭТ вращается вокруг тела и делает снимок того, где глюкоза используется в организме. Клетки злокачественных опухолей отображаются ярче, потому что они более активны и потребляют больше глюкозы, чем нормальные клетки.
- Сканирование костей : процедура проверки наличия в кости быстро делящихся клеток, например раковых. Очень небольшое количество радиоактивного материала вводится в вену и проходит через кровоток. Радиоактивный материал собирается в костях и обнаруживается сканером.
- Бариевая глотка : серия рентгеновских снимков пищевода и желудка. Пациент пьет жидкость, содержащую барий (серебристо-белое металлическое соединение). Жидкость покрывает пищевод и желудок, делают рентген. Эта процедура также называется серией верхних отделов желудочно-кишечного тракта.
- Ларингоскопия : A процедура осмотра гортани (голосового аппарата) на предмет аномальных участков. Зеркало или ларингоскоп (тонкий трубчатый инструмент с подсветкой и линзой для обзора) вводится через рот, чтобы увидеть гортань.Для удаления образцов ткани можно использовать специальный инструмент на ларингоскопе.
- Эндоскопия : A процедура для осмотра органов и тканей внутри тела, таких как горло, пищевод и трахея, на предмет аномальных участков. Эндоскоп (тонкая светящаяся трубка с источником света и линзой для просмотра) вводится через отверстие в теле, например, во рту. Для удаления образцов ткани можно использовать специальный инструмент на эндоскопе.
Некоторые факторы влияют на прогноз (шанс восстановления) и варианты лечения.
Прогноз (шанс на выздоровление) зависит от следующего:
- Стадия заболевания.
- Расположение и размер опухоли.
- Степень опухоли.
- Возраст, пол и общее состояние здоровья пациента, в том числе наличие у пациента анемии.
Варианты лечения зависят от следующего:
- Стадия заболевания.
- Расположение и размер опухоли.
- Сохранение способности пациента говорить, есть и дышать как можно более нормальной.
- Возврат ли рак (рецидив).
Курение табака и употребление алкоголя снижают эффективность лечение рака гортани. Пациенты с раком гортани, которые продолжают курить и пить, с меньшей вероятностью будут излечены и с большей вероятностью у них разовьется вторая опухоль. После лечения рака гортани, важно частое и тщательное наблюдение.
Стадии рака гортани
После постановки диагноза рака гортани проводятся анализы на узнать, распространились ли раковые клетки в гортани или в другие части тело.
Процесс, используемый для определения того, распространился ли рак в гортань или другие части тела называется постановкой. Информация собранные в процессе стадирования определяют стадию заболевания. Важно знать стадия заболевания, чтобы спланировать лечение. Результаты некоторых тестов, используемых для диагностики рака носовой полости, также часто используются для определения стадии заболевания.
Рак распространяется по организму тремя способами.
Рак может распространяться через ткани, лимфатическую систему и кровь:
- Ткань.Рак распространяется от того места, где он возник, в близлежащие районы.
- Лимфатическая система. Рак распространяется оттуда, где он возник, попадая в лимфатическую систему. Рак распространяется по лимфатическим сосудам в другие части тела.
- Кровь. Рак распространяется от того места, где он возник, попадая в кровь. Рак распространяется по кровеносным сосудам в другие части тела.
Рак может распространяться от того места, где он возник, на другие части тела.
Когда рак распространяется на другую часть тела, это называется метастазированием.Раковые клетки отрываются от того места, где они возникли (первичная опухоль), и перемещаются по лимфатической системе или крови.
- Лимфатическая система. Рак попадает в лимфатическую систему, проходит по лимфатическим сосудам и образует опухоль (метастатическую опухоль) в другой части тела.
- Кровь. Рак попадает в кровь, проходит по кровеносным сосудам и образует опухоль (метастатическую опухоль) в другой части тела.
Метастатическая опухоль — это тот же тип рака, что и первичная опухоль.Например, если рак гортани распространяется на легкие, раковые клетки легкого на самом деле являются клетками рака гортани. Заболевание представляет собой метастатический рак гортани, а не рак легких.
Для рака гортани используются следующие стадии:
Стадия 0 (карцинома in situ)
На стадии 0 аномальные клетки обнаруживаются в слизистой оболочке гортани. Эти аномальные клетки могут стать раком и распространиться на близлежащие нормальные ткани. Стадия 0 также называется карциномой в на месте.
Стадия I
На I стадии образовался рак.Рак гортани I стадии зависит от того, где начался рак в гортани:
- Надгортанник: Рак находится только в одной области надгортанника, а голосовые связки могут двигаться как обычно.
- Glottis: Рак находится в одной или обеих голосовых связках, и голосовые связки могут нормально двигаться.
- Подсвязь: Рак находится только в подсвязке.
Стадия II
На стадии II рак только в гортани. Рак гортани II стадии зависит от того, где начался рак в гортани:
- Надгортанник: рак находится в более чем одной области надгортанник или окружающие ткани.
- Glottis: Рак распространился на надгортанник и / или подсвязка и / или голосовые связки не могут нормально двигаться.
- Subglottis: Рак распространился на одну или обе голосовые связки, что может нормально не двигаться.
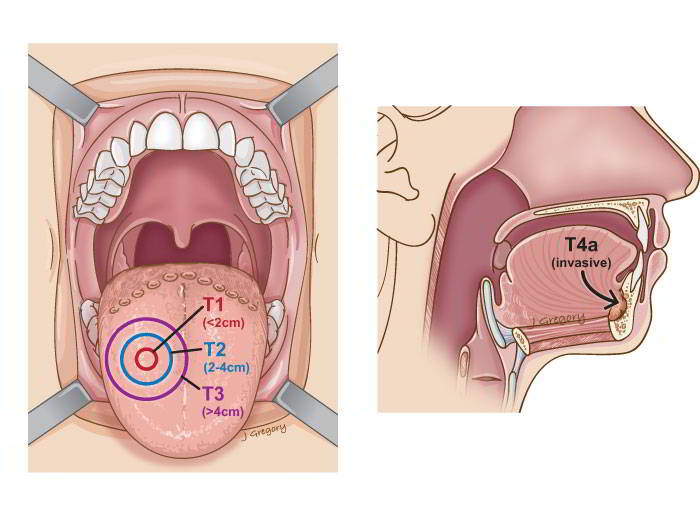
Горох, арахис, грецкий орех и лайм показывают размеры опухоли.
Стадия III
Стадия III рака гортани зависит от того, распространился ли рак из надгортанника, голосовой щели или надгортанника.
При раке надгортанника III стадии:
- Рак находится только в гортани, голосовые связки не могут двигаться, и / или рак находится в тканях рядом с гортани.Рак мог распространиться на один лимфатический узел на той же стороне шея как исходная опухоль и лимфатический узел 3 сантиметры или меньше; или
- рак находится в одной области надгортанника и в одном лимфатическом узле на той же стороне шея как исходная опухоль; лимфоузел 3 сантиметров или меньше, а голосовые связки могут двигаться как обычно; или
- рак находится в более чем одной области надгортанника или окружающих тканей и в одном лимфатическом узле на одной стороне шея как исходная опухоль; лимфоузел 3 сантиметры или меньше.
При раке голосовой щели III стадии:
- рак находится только в гортани, голосовые связки не могут двигаться, и / или рак находится в тканях рядом с гортани; рак мог распространиться на один лимфатический узел на той же стороне шея как исходная опухоль и лимфатический узел 3 сантиметры или меньше; или
- рака находится в одной или обеих голосовых связках и в одном лимфатическом узле с той же стороны шея как исходная опухоль; лимфоузел 3 сантиметры или меньше, и голосовые связки могут двигаться нормально; или
- рак распространился на надгортанник и / или подсвязка и / или голосовые связки не могут нормально двигаться.Рак также распространился на один лимфатический узел на той же стороне шея как исходная опухоль и лимфатический узел 3 сантиметры или меньше.
При раке под голосового канала III стадии:
- Рак находится в гортани, и голосовые связки не могут двигаться; рак мог распространиться на один лимфатический узел на той же стороне шея как исходная опухоль и лимфатический узел 3 сантиметры или меньше; или
- рак находится в подсвязке и в одном лимфатическом узле на одной стороне шея как исходная опухоль; лимфоузел 3 сантиметры или меньше; или
- рак распространился на одну или обе голосовые связки, что может нормально не двигаться.Рак также распространился на один лимфатический узел на той же стороне шея как исходная опухоль и лимфатический узел 3 сантиметры или меньше.
IV этап
IV этап разделен в стадию IVA, стадию IVB и стадию IVC. Каждая подстадия одинакова для рака надгортанника, голосовой щели или под голосовой щели.
- На стадии IVA:
- рак распространился через хрящ щитовидной железы и / или распространился на ткани за пределами гортани, такие как шея, трахея, щитовидная железа или пищевод.Рак мог распространиться на один лимфатический узел на той же стороне шея как исходная опухоль и лимфатический узел 3 сантиметры или меньше; или
- рак распространился на один лимфатический узел на той же стороне шеи, что и исходная опухоль, и лимфатический узел больше 3 сантиметров, но не больше 6 сантиметров, или распространился на более чем один лимфатический узел в любом месте шеи с размером не более 6 сантиметров. Рак мог распространиться на ткани за пределами гортани, такие как шея, трахея, щитовидная железа или пищевод.Голосовые связки могут не двигаться нормально.
- На стадии IVB:
- рак распространился на пространство перед позвоночником, окружает сонную артерию или распространился на части грудной клетки. Рак мог распространиться на один или несколько лимфатических узлов в любом месте шеи, и лимфатические узлы могут быть любого размера; или
- рак распространился на лимфатический узел размером более 6 сантиметров и, возможно, распространился на пространство перед позвоночником, вокруг сонной артерии или на части грудной клетки.Голосовые связки могут не двигаться нормально.
- На стадии IVC рак распространился на другие части тела, такие как легкие, печень или кости.
- рак распространился через хрящ щитовидной железы и / или распространился на ткани за пределами гортани, такие как шея, трахея, щитовидная железа или пищевод. Рак мог распространиться на один лимфатический узел на той же стороне шея как исходная опухоль и лимфатический узел 3 сантиметры или меньше; или
- рак распространился на один лимфатический узел на той же стороне шеи, что и исходная опухоль, и лимфатический узел больше 3 сантиметров, но не больше 6 сантиметров, или распространился на более чем один лимфатический узел в любом месте шеи с размером не более 6 сантиметров.Рак мог распространиться на ткани за пределами гортани, такие как шея, трахея, щитовидная железа или пищевод. Голосовые связки могут не двигаться нормально.
- рак распространился на пространство перед позвоночником, окружает сонную артерию или распространился на части грудной клетки. Рак мог распространиться на один или несколько лимфатических узлов в любом месте шеи, и лимфатические узлы могут быть любого размера; или
- рак распространился на лимфатический узел размером более 6 сантиметров и, возможно, распространился на пространство перед позвоночником, вокруг сонной артерии или на части грудной клетки.Голосовые связки могут не двигаться нормально.
Рецидивирующий рак гортани
Рецидивирующий рак гортани — это рак, который рецидивировал (вернулся) после это лечили. Рак, скорее всего, вернется в первые 2–3 года. Это может вернуться в гортань или в других частях тело.
Обзор вариантов лечения
Существуют различные виды лечения для пациентов с рак гортани.
Для пациентов с рак гортани.Некоторые методы лечения являются стандартными (в настоящее время использованное лечение), а некоторые проходят клинические испытания. Лечение клиническое испытание — это научное исследование, призванное помочь улучшить текущие методы лечения или получить информацию о новых методах лечения больных раком. Когда клинический испытания показывают, что новое лечение лучше, чем стандартное лечение, новое лечение может стать стандартным лечением. Пациенты могут захотеть принять участие в клиническом исследовании. Некоторые клинические испытания открыты только для пациентов, которые еще не начали лечение.
Используются три типа стандартного лечения:
Лучевая терапия
Лучевая терапия — это лечение рака, при котором используются высокоэнергетические рентгеновские лучи или другие виды излучения для уничтожения раковых клеток. Есть два типа лучевой терапии. Внешняя лучевая терапия использует устройство вне тела, чтобы направить излучение на рак. Внутренняя лучевая терапия использует радиоактивное вещество, запечатанное в иглах, семенах, проводах или катетерах, которые вводятся непосредственно в опухоль или рядом с ней.Способ проведения лучевой терапии зависит от типа и стадии лечения рака.
Лучевая терапия может лучше работать у пациентов с бросил курить до начала лечения. Наружная лучевая терапия щитовидная железа или гипофиз может изменить способ работает щитовидная железа. Врач может проверить щитовидную железу перед и после терапии, чтобы убедиться, что он работает должным образом.
Гиперфракционная лучевая терапия и новые виды лучевой терапии изучаются в лечении рака гортани.
Хирургия
Хирургия (удаление рака в ходе операции) — обычное дело лечение на всех стадиях рак гортани. Могут быть использованы следующие хирургические процедуры:
- Кордэктомия: операция по удалению только голосовые связки.
- Надгортанная ларингэктомия: операция по удалению только надгортанник.
- Гемиларингэктомия: операция по удалению половины гортань (голосовой ящик). А гемиларингэктомия сохраняет голос.
- Частичная ларингэктомия: операция по удалению части гортань (голосовой ящик).А частичная ларингэктомия помогает пациенту сохранить способность говорить.
- Тотальная ларингэктомия: операция по удалению всей гортани. Во время этой операции в передней части шеи делается отверстие, позволяющее пациенту дышать. Это называется трахеостомией.
- Тиреоидэктомия: удаление всей или части щитовидной железы. железа.
- Лазерная хирургия: хирургическая процедура, при которой лазерный луч (узкий луч интенсивного света) используется в качестве ножа для бескровных надрезов в ткани или для удаления поверхностного поражения, например опухоли.
Даже если врач удалит все опухоли, которые можно увидеть на во время операции некоторым пациентам может быть назначена химиотерапия или лучевая терапия терапия после операции, чтобы убить любые оставшиеся раковые клетки. Назначенное лечение после операции, чтобы снизить риск рецидива рака, называется адъювантная терапия.
Химиотерапия
Химиотерапия — это лечение рака, при котором используются лекарства, чтобы остановить рост раковых клеток, либо убивая клетки, либо останавливая их деление.Когда химиотерапия принимается внутрь или вводится в вену или мышцу, лекарства попадают в кровоток и могут достигать раковых клеток по всему телу (системная химиотерапия). Когда химиотерапия вводится непосредственно в спинномозговую жидкость, орган или полость тела, такую как брюшная полость, лекарства в основном воздействуют на раковые клетки в этих областях (региональная химиотерапия). Способ проведения химиотерапии зависит от типа и стадии лечения рака.
Дополнительную информацию см. В разделе «Лекарства, одобренные для лечения рака головы и шеи».(Рак гортани — это один из видов рака головы и шеи.)
Новые методы лечения проходят испытания в клинических условиях. испытания.
В этом сводном разделе описаны методы лечения, которые изучаются в ходе клинических испытаний. Он может не упоминать каждое новое изучаемое лечение. Информация о клинических испытаниях доступна на веб-сайте NCI.
Химиопрофилактика
Химиопрофилактика — это использование лекарств, витаминов или других веществ для снижения риска развития рака или снижения риска рецидива (возвращения) рака.Препарат изотретиноин изучается для предотвращения развития второго рака у пациентов, перенесших рак головы или шеи.
Радиосенсибилизаторы
Радиосенсибилизаторы — это препараты, повышающие чувствительность опухолевых клеток к лучевой терапии. Сочетание лучевой терапии с радиосенсибилизаторами может убить больше опухолевых клеток.
Пациенты могут захотеть принять участие в клиническом исследовании.
Для некоторых пациентов участие в клинических испытаниях может быть лучшим выбором лечения.Клинические испытания являются частью процесса исследования рака. Клинические испытания проводятся, чтобы выяснить, являются ли новые методы лечения рака безопасными и эффективными или лучше, чем стандартное лечение.
Многие современные стандартные методы лечения рака основаны на ранее проведенных клинических испытаниях. Пациенты, принимающие участие в клиническом исследовании, могут получать стандартное лечение или быть одними из первых, кто получит новое лечение.
Пациенты, принимающие участие в клинических испытаниях, также помогают улучшить методы лечения рака в будущем.Даже когда клинические испытания не приводят к созданию новых эффективных методов лечения, они часто дают ответы на важные вопросы и помогают продвигать исследования вперед.
Пациенты могут участвовать в клинических испытаниях до, во время или после начала лечения рака.
Некоторые клинические испытания включают только пациентов, которые еще не получали лечения. В других испытаниях проверяются методы лечения пациентов, у которых рак не вылечился. Существуют также клинические испытания, в которых проверяются новые способы предотвращения рецидива (возвращения) рака или уменьшения побочных эффектов лечения рака.
Клинические испытания проходят во многих частях страны. В следующем разделе «Варианты лечения» приведены ссылки на текущие клинические испытания лечения. Они были взяты из списка клинических испытаний NCI.
Могут потребоваться дополнительные тесты.
Некоторые тесты, которые были сделаны для диагностики рака или определения стадии рака, могут быть повторены. Некоторые тесты будут повторяться, чтобы увидеть, насколько эффективно лечение. Решения о продолжении, изменении или прекращении лечения могут быть основаны на результатах этих тестов.Иногда это называют повторной постановкой.
Некоторые тесты будут продолжаться время от времени после окончания лечения. Результаты этих тестов могут показать, изменилось ли ваше состояние или рак рецидивировал (вернулся). Эти тесты иногда называют контрольными или контрольными обследованиями.
Варианты лечения по стадиям
Рак гортани I стадии
Лечение I стадии гортани рак зависит от того, где находится рак в гортани.
Если рак находится в надгортаннике, лечение может включать следующие:
- Радиация терапия.
- Надгортанная ларингэктомия.
Если рак находится в голосовой щели, лечение может включать следующие:
- Лучевая терапия.
- Кордэктомия.
- Частичная ларингэктомия, гемиларингэктомия или полная ларингэктомия.
- Лазерная хирургия.
Если рак находится в подсвязке, лечение может включать следующее:
- Лучевая терапия с хирургическим вмешательством или без него.
- Только хирургия.
Проверить на U.S. клинические испытания из списка клинических испытаний рака NCI, в которые в настоящее время принимаются пациенты с раком гортани I стадии. Для получения более конкретных результатов уточните поиск, используя другие функции поиска, такие как место проведения испытания, тип лечения или название препарата. Поговорите со своим врачом о клинических испытаниях, которые могут вам подойти. Общая информация о клинических испытаниях доступна на веб-сайте NCI.
Рак гортани II стадии
Лечение гортани II стадии рак зависит от того, где находится рак в гортани.
Если рак находится в надгортаннике, лечение может включать следующие:
- Лучевая терапия.
- Надгортанная ларингэктомия или полная ларингэктомия с или без лучевой терапии.
- Клиническое испытание лучевой терапии.
- Клиническое испытание химиопрофилактики.
Если рак находится в голосовой щели, лечение может включать следующие:
- Лучевая терапия.
- Частичная ларингэктомия, гемиларингэктомия или полная ларингэктомия.
- Лазерная хирургия.
- Клинические испытания лучевой терапии.
- Клиническое испытание химиопрофилактики.
Если рак находится в подсвязке, лечение может включать следующие:
- Лучевая терапия с хирургическим вмешательством или без него.
- Только хирургия.
- Клинические испытания лучевой терапии.
- Клиническое испытание химиопрофилактики.
Проверьте клинические испытания США из списка клинических испытаний рака NCI, в которые в настоящее время принимаются пациенты с раком гортани II стадии.Для получения более конкретных результатов уточните поиск, используя другие функции поиска, такие как место проведения испытания, тип лечения или название препарата. Поговорите со своим врачом о клинических испытаниях, которые могут вам подойти. Общая информация о клинических испытаниях доступна на веб-сайте NCI.
Рак гортани III стадии
Лечение гортани III стадии рак зависит от того, где находится рак в гортани.
Если рак находится в надгортаннике или голосовой щели, лечение может включать следующие:
- Химиотерапия и лучевая терапия назначаются вместе.
- Химиотерапия с последующей химиотерапией и лучевой терапией терапия проводится вместе. Если рак остается, может быть сделана ларингэктомия.
- Лучевая терапия для пациентов, которым нельзя лечить химиотерапией и хирургическим вмешательством. При опухолях, не поддающихся облучению, может быть проведена тотальная ларингэктомия.
- Операция, после которой может последовать лучевая терапия.
- Клинические испытания лучевой терапии.
- Клиническое испытание химиотерапии, радиосенсибилизаторов или облучения терапия.
- Клиническое испытание химиопрофилактики.
Если рак находится в подсвязке, лечение может включать следующие:
- Ларингэктомия плюс тотальная тиреоидэктомия и удаление лимфатические узлы в горле, обычно следят лучевой терапией.
- Лучевая терапия с хирургическим вмешательством или без него.
- Клиническое исследование химиотерапии, радиосенсибилизаторов или лучевой терапии.
- Клиническое испытание химиопрофилактики.
Проверить на U.S. клинические испытания из списка клинических испытаний рака NCI, в которые в настоящее время принимаются пациенты с раком гортани III стадии. Для получения более конкретных результатов уточните поиск, используя другие функции поиска, такие как место проведения испытания, тип лечения или название препарата. Поговорите со своим врачом о клинических испытаниях, которые могут вам подойти. Общая информация о клинических испытаниях доступна на веб-сайте NCI.
Рак гортани IV стадии
Лечение гортани IV стадии рак зависит от того, где находится рак в гортани.
Если рак находится в надгортаннике или голосовой щели, лечение может включать следующие:
- Химиотерапия и лучевая терапия назначаются вместе.
- Химиотерапия с последующей химиотерапией и лучевой терапией терапия проводится вместе. Если рак остается, может быть сделана ларингэктомия.
- Лучевая терапия для пациентов, которым нельзя лечить химиотерапией и хирургическим вмешательством. При опухолях, не поддающихся облучению, может быть проведена тотальная ларингэктомия.
- Операция с последующей лучевой терапией.Химиотерапия может проводиться вместе с лучевой терапией.
- Клинические испытания лучевой терапии.
- Клиническое испытание химиотерапии, радиосенсибилизаторов или облучения терапия.
- Клиническое испытание химиопрофилактики.
Если рак находится в подсвязке, лечение может включать следующие:
- Ларингэктомия плюс тотальная тиреоидэктомия и удаление лимфы узлы в горле, обычно при лучевой терапии.
- Лучевая терапия.
- Клинические испытания лучевой терапии.
- Клиническое испытание химиотерапии, радиосенсибилизаторов или облучения терапия.
- Клиническое испытание химиопрофилактики.
Проверьте наличие клинических испытаний в США из списка клинических испытаний рака NCI, в которые в настоящее время принимаются пациенты с раком гортани IV стадии. Для получения более конкретных результатов уточните поиск, используя другие функции поиска, такие как место проведения испытания, тип лечения или название препарата.Поговорите со своим врачом о клинических испытаниях, которые могут вам подойти. Общая информация о клинических испытаниях доступна на веб-сайте NCI.
Варианты лечения рецидивирующего рака гортани
Лечение рецидивирующего рака гортани может включать следующее:
- Операция с лучевой терапией или без нее.
- Радиация терапия.
- Химиотерапия.
- Клиническое испытание химиотерапия как паллиативная терапия для облегчения симптомов, вызванных рака и улучшить качество жизнь.
Проверьте клинические испытания США из списка клинических испытаний рака NCI, в которые в настоящее время принимаются пациенты с рецидивирующим раком гортани. Для получения более конкретных результатов уточните поиск, используя другие функции поиска, такие как место проведения испытания, тип лечения или название препарата. Поговорите со своим врачом о клинических испытаниях, которые могут вам подойти. Общая информация о клинических испытаниях доступна на веб-сайте NCI.
Чтобы узнать больше о раке гортани
Для получения дополнительной информации о раке гортани от Национального института рака см .:
Для получения общей информации о раке и других ресурсов Национального института рака см .:
Было ли это полезно?
да НетПоследний вопрос: Насколько вы уверены в том, что самостоятельно заполняете медицинские формы?
Нисколько Маленький В некотором роде Немного Очень сильноСпасибо!
Начать поиск нового образования для пациентов>Рак гортани
Об этой программе
Врачи в рамках программы лечения рака гортани больницы общего профиля Массачусетса предоставляют широкий спектр услуг, включая диагностику и лечение рака гортани.
О состоянии
Рак гортани — это злокачественное новообразование, которое обычно начинается на поверхностных мембранах, выстилающих голосовой ящик. Обычно это плоскоклеточный рак. Если не лечить, рак может прорасти в более глубокие ткани, такие как мышцы и хрящи, а также некоторые типы рака гортани могут давать метастазы или распространяться на другие части тела. Гортань (голосовой ящик) делится на три части:
- Верхний (надгортанник)
- Средняя часть (голосовая щель или голосовые связки)
- Нижняя (подъязычная)
В то время как рак голосовой щели и надгортанник встречаются одинаково часто, рак подсвязочного канала встречается реже.Хотя большинство пациентов с раком гортани в какой-то момент своей жизни курили, в последние годы растет число некурящих пациентов.
Уход по последнему слову техники
Массовый общий центр хирургии гортани и голосовой реабилитации (Центр голоса) признан на национальном и международном уровнях за свои очень успешные новаторские хирургические методы, направленные на сохранение функции голоса, глотания и дыхания у пациентов с раком гортани. Мы широко публиковали эту работу в рецензируемой литературе и во многих учебниках и обучали этим методам в медицинских центрах США и за рубежом.По этой причине люди с раком гортани часто обращаются за помощью в Центр массового общения.
Лечение рака голосовых связок (рак глотки)
Двумя традиционными методами лечения рака голосовых связок являются хирургическое вмешательство и лучевая терапия. В большинстве случаев рак голосовых связок малых и средних размеров можно лечить через рот (трансоральным или эндоскопическим) с помощью лазера. Мы используем калий-титанил-фосфатный (KTP) лазер — революционную технологию, впервые примененную для лечения рака голосовых связок командой Mass General Voice Center.С 2005 года мы лечим этим инструментом пациентов с раком голосовых связок; Эта работа была основана на обширных фундаментальных научных исследованиях и клиническом опыте предраковых заболеваний голосовых связок (дисплазии). Использование лазера KTP привело к отличным голосовым результатам без ущерба для эффективности лечения рака.
Мы редко используем лучевую терапию при опухолях малых и средних размеров благодаря нашему многолетнему опыту и успехам в минимально инвазивном эндоскопическом лазерном лечении. Хотя показатели излечения при использовании лучевой терапии могут быть такими же эффективными, как и при хирургическом вмешательстве, радиация лечит здоровые части гортани, а также те, которые связаны с раком.Например, если рак поражает только одну голосовую связку, лазерная хирургия может полностью сохранить другую голосовую связку, в то время как нормальная ткань голосовой связки не может быть полностью защищена от воздействия лучевой терапии. Кроме того, лучевая терапия обычно может использоваться только один раз в одной и той же части тела, и может быть трудно отслеживать рецидив после того, как пациент получил лучевую терапию. Наконец, лучевая терапия может вызывать значительные и иногда изнурительные побочные эффекты, в том числе:
- Ограничение проходимости дыхательных путей
- Затруднения при глотании
- Сухость в горле
- Изменения голоса
Пациенты с рецидивирующим раком голосовых связок, несмотря на предшествующее лучевое лечение, также могут быть кандидатами на эндоскопическое лечение с помощью лазера KTP.
При необходимости, при более крупных раковых опухолях голосовых связок может потребоваться лучевая терапия и / или их необходимо удалить с помощью открытой хирургии через шею. В сотрудничестве с отделением торакальной хирургии Mass General’s недавно мы начали удалять только раковые части гортани у некоторых пациентов, реконструируя голосовой ящик и дыхательные пути, используя часть аорты от умершего донора (реконструкция гомотрансплантата аорты). Этот метод не требует специальных препаратов для подавления иммунитета. Хотя мы все еще находимся на ранних этапах изучения этого захватывающего нового метода лечения, он предлагает эффективную альтернативу пациентам, которым раньше требовалась полная ларингэктомия (полное удаление голосового аппарата).Мы также успешно использовали этот новаторский метод лечения стеноза (сужения) дыхательных путей.
Лечение рака надгортанника
По нашему опыту, супрагортальный рак оптимально лечится с помощью минимально инвазивного удаления через рот, сохраняя способность пациента глотать, дышать и говорить, используя послеоперационное облучение для более крупных опухолей. Mass General Voice Center использует и сообщает об этом успешном подходе к лазерному лечению более 20 лет.Совсем недавно хирурги общей практики представили новые волоконные лазеры, которые значительно облегчили эндоскопическую резекцию надгортанного рака.
При более поздних стадиях рака надгортанника или при неудачной лучевой терапии для излечения может потребоваться открытая операция через шею (в отличие от лазерной хирургии через рот). Мы также являемся экспертами в проведении более традиционных видов открытой консервативной хирургии гортани, удаляя только те части голосового аппарата, которые требуются раку, и реконструируем его, чтобы оптимизировать голос, глотание и дыхание после хирургического восстановления.Эта процедура может избежать необходимости полного удаления голосового аппарата (тотальная ларингэктомия).
Лечение рака подсвязочного канала
В зависимости от стадии, рак в этой части голосового аппарата часто можно лечить с помощью эндоскопической лазерной хирургии (с использованием KTP или тулиевого лазера) или открытой операции по удалению части голосового аппарата. На более поздних стадиях рака может потребоваться более обширное хирургическое вмешательство и / или лучевая терапия. Техника реконструкции гомотрансплантата аорты оказалась особенно полезной для сохранения голоса и глотательной функции при расширенном лечении подсвязочного рака.
Протоколы лечения рака гортани: протоколы лечения
Паздур Р., Вагман Л.Д., Кампхаузен К.А., Хоскинс В.Дж., ред. Лечение рака: мультидисциплинарный подход . Норуолк, Коннектикут: UBM Medica; 2010.
[Рекомендации] NCCN Клинические рекомендации по онкологии: рак головы и шеи. Национальная всеобъемлющая онкологическая сеть. Доступно на http://www.nccn.org/professionals/physician_gls/pdf/head-and-neck.pdf. Версия 3.2019 — 16 сентября 2019 г .; Дата обращения: 25 ноября 2019 г.
Тимме Д.В., Джонналагадда С., Патель Р., Рао К., Роббинс К.Т. Выбор лечения рака гортани T3 / T4a: химиолучевое лечение по сравнению с первичным хирургическим вмешательством. Энн Отол Ринол Ларингол . 2015 ноябрь 124 (11): 845-51. [Медлайн].
Forastiere AA, Goepfert H, Maor M, Pajak TF, Weber R, Morrison W. и др. Одновременная химиотерапия и лучевая терапия для сохранения органов при распространенном раке гортани. N Engl J Med . 2003 27 ноября. 349 (22): 2091-8.[Медлайн].
Adelstein DJ, Li Y, Adams GL, Wagner H Jr, Kish JA, Ensley JF и др. Межгрупповое сравнение фазы III стандартной лучевой терапии и двух схем одновременной химиолучевой терапии у пациентов с неоперабельным плоскоклеточным раком головы и шеи. Дж Клин Онкол . 2003 г., 1. 21 (1): 92-8. [Медлайн].
Нвизу Т., Адельштейн Д. Фармакотерапия рака головы и шеи. Экспертное мнение Pharmacother . 2015 Ноябрь.16 (16): 2409-22. [Медлайн].
Bachaud JM, Cohen-Jonathan E, Alzieu C, David JM, Serrano E, Daly-Schveitzer N. Комбинированная послеоперационная лучевая терапия и еженедельная инфузия цисплатина для местнораспространенного рака головы и шеи: окончательный отчет рандомизированного исследования. Int J Radiat Oncol Biol Phys . 1 декабря 1996 г., 36 (5): 999-1004. [Медлайн].
Bonner JA, Harari PM, Giralt J, Cohen RB, Jones CU, Sur RK, et al. Лучевая терапия плюс цетуксимаб при локорегионально распространенном раке головы и шеи: данные о 5-летней выживаемости из рандомизированного исследования фазы 3 и взаимосвязь между сыпью, вызванной цетуксимабом, и выживаемостью. Ланцет Онкол . 2010 января 11 (1): 21-8. [Медлайн].
Боннер Дж. А., Харари П. М., Гиралт Дж., Азарния Н., Шин Д. М., Коэн Р. Б. и др. Лучевая терапия плюс цетуксимаб при плоскоклеточном раке головы и шеи. N Engl J Med . 2006 9 февраля. 354 (6): 567-78. [Медлайн].
Garden AS, Harris J, Vokes EE, Forastiere AA, Ridge JA, Jones C и др. Предварительные результаты онкологической группы с лучевой терапией 97-03: рандомизированное исследование фазы II одновременного лучевого и химиотерапевтического лечения запущенных плоскоклеточных карцином головы и шеи. Дж Клин Онкол . 2004 15 июля. 22 (14): 2856-64. [Медлайн].
Soo KC, Tan EH, Wee J, Lim D, Tai BC, Khoo ML, et al. Хирургия и адъювантная лучевая терапия по сравнению с одновременной химиолучевой терапией при неметастатическом плоскоклеточном раке головы и шеи III / IV стадии: рандомизированное сравнение. Br J Рак . 2005 8 августа. 93 (3): 279-86. [Медлайн]. [Полный текст].
Adelstein DJ, Lavertu P, Saxton JP, Secic M, Wood BG, Wanamaker JR, et al.Зрелые результаты рандомизированного исследования фазы III, сравнивающего одновременную химиолучевую терапию с одной лучевой терапией у пациентов с плоскоклеточным раком головы и шеи III и IV стадии. Рак . 2000 15 февраля. 88 (4): 876-83. [Медлайн].
Рандомизированное испытание фазы III цисплатина, метотрекстата, цисплатина + метотрексата и цисплатина + 5-ФУ при плоскоклеточной карциноме в конечной стадии. Ливерпульская группа онкологии головы и шеи. Br J Рак .1990 Февраль 61 (2): 311-5. [Медлайн]. [Полный текст].
Calais G, Alfonsi M, Bardet E, Sire C, Germain T, Bergerot P и др. Рандомизированное испытание лучевой терапии в сравнении с сопутствующей химиотерапией и лучевой терапией при запущенной стадии карциномы ротоглотки. Национальный институт рака . 1999 15 декабря. 91 (24): 2081-6. [Медлайн].
Хаддад Р., Сонис С., Познер М., Вирт Л., Костелло Р., Брашайко П. и др. Рандомизированное исследование фазы 2 сопутствующей химиолучевой терапии с использованием карбоплатина / паклитаксела еженедельно с ежедневным подкожным введением амифостина или без него у пациентов с местнораспространенным раком головы и шеи. Рак . 2009 г., 1. 115 (19): 4514-23. [Медлайн].
Posner MR, Hershock DM, Blajman CR, Mickiewicz E, Winquist E, Gorbounova V, et al. Цисплатин и фторурацил отдельно или с доцетакселом при раке головы и шеи. N Engl J Med . 2007, 25 октября. 357 (17): 1705-15. [Медлайн].
Лорч Дж. Х., Голубева О., Хаддад Р. И., Каллен К., Сарлис Н., Тишлер Р. и др. Индукционная химиотерапия цисплатином и фторурацилом отдельно или в комбинации с доцетакселом при местнораспространенном плоскоклеточном раке головы и шеи: долгосрочные результаты рандомизированного исследования фазы 3 TAX 324. Ланцет Онкол . 2011 12 февраля (2): 153-9. [Медлайн].
Vermorken JB, Remenar E, van Herpen C и др. Цисплатин, фторурацил и доцетаксел при неоперабельном раке головы и шеи. N Engl J Med . 2007; 357: 1695-704:
Hitt R, López-Pousa A, Martínez-Trufero J, et al. Исследование фазы III, сравнивающее цисплатин плюс фторурацил с индукционной химиотерапией паклитакселом, цисплатином и фторурацилом с последующей химиолучевой терапией при местнораспространенном раке головы и шеи. Дж Клин Онкол . 2005 декабрь 1, 23 (34): 8636-45. [Медлайн].
Burtness B, et al; KEYNOTE-048 Следователи. Пембролизумаб отдельно или с химиотерапией по сравнению с цетуксимабом с химиотерапией при рецидивирующей или метастатической плоскоклеточной карциноме головы и шеи (KEYNOTE-048): рандомизированное открытое исследование фазы 3. Ланцет . 2019 31 октября. [Medline].
FDA одобряет пембролизумаб в качестве первой линии лечения плоскоклеточного рака головы и шеи.Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. Доступно по адресу https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-pembrolizumab-first-line-treatment-head-and-neck-squamous-cell-carcinoma. 11 июня 2019 г .; Дата обращения: 26 ноября 2019 г.
Vermorken JB, Mesia R, Rivera F, Remenar E, Kawecki A, Rottey S, et al. Химиотерапия на основе платины плюс цетуксимаб при раке головы и шеи. N Engl J Med . 2008 11 сентября. 359 (11): 1116-27. [Медлайн].
Глиссон Б.С., Мерфи Б.А., Френетт Г., Хури Ф.Р., Форастьер А.А.Фаза II Испытание комбинированной химиотерапии доцетакселом и цисплатином у пациентов с плоскоклеточным раком головы и шеи. Дж Клин Онкол . 2002 15 марта. 20 (6): 1593-9. [Медлайн].
Baur M, Kienzer HR, Schweiger J, DeSantis M, Gerber E, Pont J, et al. Доцетаксел / цисплатин в качестве химиотерапии первой линии у пациентов с карциномой головы и шеи: испытание фазы II. Рак . 1 июня 2002 г. 94 (11): 2953-8. [Медлайн].
Forastiere AA, Leong T, Rowinsky E, Murphy BA, Vlock DR, DeConti RC, et al.Сравнение фазы III высоких доз паклитаксела + цисплатина + гранулоцитарный колониестимулирующий фактор и низких доз паклитаксела + цисплатина при распространенном раке головы и шеи: исследование Восточной кооперативной онкологической группы E1393. Дж Клин Онкол . 2001 15 февраля. 19 (4): 1088-95. [Медлайн].
Гибсон М.К., Ли Ю., Мерфи Б., Хусейн М.Х., ДеКонти Р.К., Энсли Дж. И др. Рандомизированная фаза III оценки цисплатина плюс фторурацила по сравнению с цисплатином плюс паклитакселом при распространенном раке головы и шеи (E1395): межгрупповое исследование Восточной кооперативной онкологической группы. Дж Клин Онкол . 2005 20 мая. 23 (15): 3562-7. [Медлайн].
Samlowski WE, Moon J, Kuebler JP, Nichols CR, Gandara DR, Ozer H, et al. Оценка комбинации доцетаксел / карбоплатин у пациентов с метастатическим или рецидивирующим плоскоклеточным раком головы и шеи (SCCHN): исследование Southwest Oncology Group Phase II. Рак Инвест . 2007 апрель-май. 25 (3): 182-8. [Медлайн].
Кларк Дж. И., Хофмайстер С., Чоудхури А., Мац Дж., Коллинз С., Бастиан Р. и др.Оценка фазы II паклитаксела в комбинации с карбоплатином при запущенной карциноме головы и шеи. Рак . 2001 г., 1. 92 (9): 2334-40. [Медлайн].
Бертнесс Б., Гольдвассер М.А., Флуд У., Маттар Б., Форастьер А.А. Рандомизированное испытание фазы III цисплатина плюс плацебо по сравнению с цисплатином плюс цетуксимаб при метастатическом / рецидивирующем раке головы и шеи: исследование Восточной кооперативной онкологической группы. Дж Клин Онкол . 2005 декабрь 1, 23 (34): 8646-54. [Медлайн].
Baselga J, Trigo JM, Bourhis J, Tortochaux J, Cortés-Funes H, Hitt R, et al. Фаза II многоцентрового исследования моноклональных антител к рецепторам противоэпидермального фактора роста цетуксимаба в сочетании с химиотерапией на основе платины у пациентов с резистентным к платине метастатическим и / или рецидивирующим плоскоклеточным раком головы и шеи. Дж Клин Онкол . 2005 20 августа. 23 (24): 5568-77. [Медлайн].
Herbst RS, Arquette M, Shin DM, Dicke K, Vokes EE, Azarnia N, et al.Фаза II многоцентрового исследования антител к рецепторам эпидермального фактора роста цетуксимаба и цисплатина при рецидивирующей и рефрактерной плоскоклеточной карциноме головы и шеи. Дж Клин Онкол . 2005 20 августа. 23 (24): 5578-87. [Медлайн].
Forastiere AA, Metch B, Schuller DE, Ensley JF, Hutchins LF, Triozzi P, et al. Рандомизированное сравнение цисплатина плюс фторурацила и карбоплатина плюс фторурацила с метотрексатом при запущенной плоскоклеточной карциноме головы и шеи: исследование Southwest Oncology Group. Дж Клин Онкол . 1992 августа 10 (8): 1245-51. [Медлайн].
Джейкобс С., Лайман Г., Велес-Гарсия Э., Шридхар К.С., Найт В., Хохстер Х. и др. Рандомизированное исследование фазы III, сравнивающее цисплатин и фторурацил как отдельные препараты и в комбинации для лечения запущенной плоскоклеточной карциномы головы и шеи. Дж Клин Онкол . 1992 10 февраля (2): 257-63. [Медлайн].
Клавель М., Верморкен Дж. Б., Коннетти Ф, Каппеларе П., де Малдер П. Х., Шорнагель Дж. Х. и др.Рандомизированное сравнение цисплатина, метотрексата, блеомицина и винкристина (CABO) с цисплатином и 5-фторурацилом (CF) и цисплатином (C) при рецидивирующей или метастатической плоскоклеточной карциноме головы и шеи. Исследование фазы III совместной группы EORTC по лечению рака головы и шеи. Энн Онкол . 1994 июл.5 (6): 521-6. [Медлайн].
Guigay J, Fayette J, Dillies A-F и др. Цетуксимаб, доцетаксел и цисплатин (TPEx) в качестве терапии первой линии у пациентов с рецидивирующей или метастатической плоскоклеточной карциномой головы и шеи: окончательные результаты II фазы исследования GORTEC 2008-03 (аннотация). Журнал клинической онкологии . 2012. 30 (Приложение 15): Abstract 5505.
Lee AW, Sze WM, Au JS, Leung SF, Leung TW, Chua DT, et al. Результаты лечения рака носоглотки в современную эпоху: опыт Гонконга. Int J Radiat Oncol Biol Phys . 2005 15 марта. 61 (4): 1107-16. [Медлайн].
Forastiere AA, Shank D, Neuberg D, Taylor SG 4th, DeConti RC, Adams G. Окончательный отчет об оценке фазы II паклитаксела у пациентов с запущенной плоскоклеточной карциномой головы и шеи: исследование Восточной кооперативной онкологической группы ( PA390). Рак . 1 июня 1998 г. 82 (11): 2270-4. [Медлайн].
Catimel G, Verweij J, Mattijssen V, Hanauske A, Piccart M, Wanders J, et al. Доцетаксел (Таксотер): активный препарат для лечения пациентов с запущенной плоскоклеточной карциномой головы и шеи. Группа ранних клинических испытаний EORTC. Энн Онкол . 1994 июл.5 (6): 533-7. [Медлайн].
Дрейфус А.И., Кларк Дж. Р., Норрис С. М., Росси Р. М., Лукарини Дж. В., Буссе П. М. и др.Доцетаксел: активный препарат при плоскоклеточном раке головы и шеи. Дж Клин Онкол . 1996 май. 14 (5): 1672-8. [Медлайн].
Couteau C, Chouaki N, Leyvraz S, Oulid-Aissa D, Lebecq A, Domenge C и др. Исследование фазы II доцетаксела у пациентов с метастатическим плоскоклеточным раком головы и шеи. Br J Рак . 1999 Октябрь, 81 (3): 457-62. [Медлайн]. [Полный текст].
Vermorken JB, Trigo J, Hitt R, Koralewski P, Diaz-Rubio E, Rolland F, et al.Открытое, неконтролируемое, многоцентровое исследование фазы II для оценки эффективности и токсичности цетуксимаба в качестве единственного агента у пациентов с рецидивирующей и / или метастатической плоскоклеточной карциномой головы и шеи, которые не ответили на терапию на основе платины. Дж Клин Онкол . 2007, 1. 25 (16): 2171-7. [Медлайн].
Феррис Р.Л., Блюменшейн Дж. Младший, Фейет Дж., Гигей Дж., Колевас А.Д., Лиситра Л. и др. Ниволумаб при рецидивирующем плоскоклеточном раке головы и шеи. N Engl J Med . 2016 10 ноября. 375 (19): 1856-1867. [Медлайн]. [Полный текст].
Рак гортани | Мемориальный онкологический центр им. Слоуна Кеттеринга
Рак гортани возникает в гортани (голосовой ящик). Это второй по распространенности тип рака головы и шеи. По оценкам, ежегодно в Соединенных Штатах диагностируется 12 000 новых случаев рака гортани.
Гортань расположена в верхней части трахеи (дыхательного горла). Он состоит из двух мышц, называемых голосовыми связками, которые вибрируют, когда воздух проходит через них, чтобы произносить речь.Гортань также предотвращает попадание пищи в легкие.
Симптомы рака гортани
К наиболее частым симптомам рака гортани относятся:
- охриплость
- шишка на шее из-за увеличенного лимфатического узла
- боль в ухе
- Трудность глотания
Факторы риска рака гортани
Употребление табака и алкоголя, особенно их сочетание, являются наиболее частыми факторами риска рака гортани.
Дополнительные факторы риска включают:
- воздействие на рабочем месте древесной и металлической пыли, асбеста, паров краски и других химических ингаляторов
- диета с низким содержанием витаминов А и Е
- гастроэзофагеальная рефлюксная болезнь
- заражение вирусом папилломы человека (ВПЧ)
Люди с апластической анемией, заболеванием крови, связанным с определенными наследственными заболеваниями, также имеют более высокий риск развития рака гортани.
Лечение рака гортани
Цели лечения рака гортани:
- вылечить рак
- сохранить свою внешность и голос
- предотвратить возвращение рака
Степень и глубина рака определяют ваш план лечения.Лечение может включать хирургическое вмешательство, лучевую терапию, химиотерапию или комбинацию подходов.
Хирургия рака гортани
Врачи, хирурги и специалисты по онкологическим заболеваниям горла
Наша команда хирургов, онкологов-радиологов, медицинских онкологов и других специалистов обеспечивает индивидуальный уход за людьми с раком горла.
Узнать большеПри раке на ранней стадии хирург головы и шеи может удалить опухоль, используя эндоскопический подход, называемый трансоральной лазерной микрохирургией.Если рак гортани не может быть легко удален с помощью минимально инвазивной процедуры, вашему хирургу может потребоваться традиционная открытая операция.
В MSK наши хирурги предлагают беспрецедентные навыки и опыт в удалении рака гортани. Мы применяем новаторские подходы, чтобы сохранить ваш внешний вид и функции вашего горла.
Узнайте больше о нашем опыте в хирургии рака горла.
Лучевая терапия рака гортани
Лучевая терапия рака гортани заключается в нацеливании высокоэнергетических пучков частиц на опухоль.Когда частицы достигают опухоли, они могут разрушать раковые клетки, повреждая их ДНК.
Радиация часто является основным методом лечения людей с раком гортани на ранней стадии. Иногда химиотерапию проводят в сочетании с лучевой терапией. Этот подход называется химиолучевой . Это может повысить эффективность вашего ухода.
Команда лучевой терапии в Memorial Sloan Kettering имеет большой опыт в уходе за людьми со всеми стадиями рака гортани.Мы тесно сотрудничаем с другими членами вашей медицинской бригады и составим индивидуальный план лечения с точностью до миллиметра с учетом размера и формы опухоли. Наша цель — не только уничтожить раковые клетки, но и предотвратить побочные эффекты лечения.
Лекарственные средства для лечения запущенного рака гортани
Люди с запущенным заболеванием могут получать медикаментозное лечение, такое как химиотерапия, таргетная терапия или иммунотерапия.
В MSK наши врачи-онкологи (врачи, которые лечат рак с помощью лекарственных препаратов) работают с вами, чтобы составить индивидуальный план лечения, который соответствует вашим потребностям и приведет к наилучшему результату для вас.
Наши врачи-онкологи привносят исключительные навыки в уход за людьми с запущенным раком гортани. У нас есть глубокие знания о новейших клинических исследованиях рака гортани. Эти исследования могут дать вам доступ к передовым методам лечения за годы до того, как они станут доступны где-либо еще.
Найдите обзор лекарственных препаратов для лечения рака головы и шеи.
Современные методы лечения рака гортани
Реферат
В настоящее время клиники могут предложить пациентам различные варианты лечения при гистологической диагностике плоскоклеточного рака гортани.В зависимости от множества различных факторов, включая размер опухоли, возможные метастазы, состояние здоровья и возраст пациента, а также экономические факторы, устанавливается график лечения. Целью каждого лечебного решения должно быть сохранение органа гортани и сохранение функции гортани. Цель этого обзора — дать обзор методов лечения рака гортани, основанный не только на традиционных, но и на последних исследованиях, касающихся лечения этого заболевания. Обсуждаются хирургические подходы, а также варианты консервативного лечения, такие как химиолучевая терапия, индукционная терапия и таргетная терапия.Оптимальное сочетание хирургического лечения и консервативных методов лечения требует дальнейшего изучения. Кроме того, необходимо заново определить оптимальную функцию гортани, а также ее сохранение.
За последние десятилетия концепции лечения рака гортани сильно изменились. Решение о лечении зависит от стадии заболевания и предпочтительных местных подходов к лечению. Необходимо различать раннюю (I-II) и запущенную (III-IV) стадии заболевания. Заболевание на более ранней стадии, скорее всего, лечится хирургическим вмешательством или окончательным облучением с лечебной целью.В зависимости от состояния здоровья, работоспособности и соображений сохранения гортани на более поздних стадиях заболевания обычно лечат хирургическим путем, радиохимиотерапией или радиохимиотерапией / радиоиммунотерапией. Подходы к лечению изменились по мере увеличения внимания к качеству жизни. Стратегии лечения сегодня сосредоточены на хирургических и нехирургических процедурах, цель которых не только сохранить анатомический орган, но, что более важно, также его функцию. Сохранение как органов, так и их функций играет важную роль в качестве жизни пациента.Историческим золотым стандартом для далеко зашедших опухолей гортани была тотальная ларингэктомия. Эта процедура по-прежнему является вариантом лечения распространенного рака гортани, но сегодня для сохранения органов все чаще используются консервативные методы лечения, включая лучевую терапию, химиотерапию, таргетную молекулярную терапию и органосохраняющую хирургию. Прежде чем принимать решение о лечении, необходимо провести четкий анализ стадии опухоли и состояния каждого пациента, а целью должна быть высоко индивидуализированная терапия для каждого пациента.В настоящем обзоре описаны возможные методы лечения рака гортани от низкой до высокой стадии.
Хирургическое лечение
Тотальная ларингэктомия. Лечение злокачественных новообразований гортани остается сложной задачей для хирургов головы и шеи, поскольку выбранный метод лечения должен быть оптимальным с онкологической точки зрения, и в то же время функция гортани должна быть наилучшим образом сохранена. В последние десятилетия тотальная ларингэктомия потеряла свое значение. В течение многих лет это был единственный вариант лечения пациентов с запущенным раком гортани.Но нехирургические, мультимодальные подходы с целью сохранения гортани становятся все более и более важными, поэтому в настоящее время тотальная ларингэктомия является методом выбора лишь в нескольких отдельных случаях. Существуют различные хирургические методы лечения рака гортани на ранних и поздних стадиях. Тем не менее, в некоторых отдельных промежуточных и запущенных случаях сохранение функционального органа невозможно, и полная ларингэктомия становится обязательной. Тотальная ларингэктомия была впервые проведена Бильротом в 1873 году и оказалась эффективной операцией при запущенном раке гортани.Однако постоянная трахеостома и нарушение голосовой функции у этих пациентов оказывают значительное влияние на их жизнь (1). Серебро и др. пришел к выводу в большой обзорной статье от 2009 г., что тотальная ларингэктомия остается важным и эффективным инструментом в качестве начального лечения или спасения при раке гортани (2). Бывают ситуации, когда тотальная ларингэктомия является оптимальным начальным лечением запущенного рака гортани. Сюда входят ненадежные пациенты, пациенты в неразвитых или недостаточно обслуживаемых странах или в регионах, где сложное комплексное лечение и длительное наблюдение могут быть недоступны.Сюда также входят пациенты, которые не хотят или физически не могут подвергаться суровому воздействию химиолучевой терапии и последующего наблюдения. Они заявили, что затраты на альтернативные варианты лечения, такие как комбинированная терапия с одновременной химиолучевой терапией (CRT, включая ее токсичность) и спасательная хирургия (включая ее заболеваемость), могут быть слишком дорогими для развивающихся стран. CRT — дорогостоящий режим. Во многих слаборазвитых странах может быть трудно рассмотреть рутинное использование CRT.Даже в таких странах, как Индия или Бразилия, полная ларингэктомия часто используется из-за проблем, связанных с затратами (2). Тотальная ларингэктомия также является важным инструментом при лечении рецидивирующего рака гортани после начального нехирургического лечения, а также для пациентов, которые не реагируют на нехирургическое лечение или которым невозможна химиотерапия из-за сопутствующих заболеваний. Пациенты без отдаленных метастазов при рецидиве и с операбельным локорегиональным заболеванием являются кандидатами на операцию по спасению. Для таких пациентов единственным возможным лечением с лечебной целью часто является тотальная ларингэктомия (3-5).Стойкое заболевание или местный рецидив первичной опухоли встречается примерно у 30% пациентов с распространенным раком гортани, получавших нехирургическое органосохраняющее лечение (6, 7). Для таких пациентов лучшим лечением является тотальная ларингэктомия.
Частичная ларингэктомия, открытый доступ. Чрескожная открытая частичная ларингэктомия — ценный инструмент для лечения ранних и запущенных карцином гортани. Открытый чрескожный доступ является безопасным хирургическим методом, особенно когда обзор гортани с помощью ларингоскопа невозможен.Открытая частичная ларингэктомия часто обеспечивает превосходный обзор и онкологическую безопасность передней спайки, особенно при рецидиве (8). Многие типы хирургических вмешательств по сохранению открытой функции были рассмотрены, чтобы избежать тотальной ларингэктомии. Горизонтальную и вертикальную частичную ларингэктомию поддержали Piquet и Piquet (9) во Франции, Ogura и Dedo (10) в США и Hiroto et al. (11) в Японии и другие после 1960 года. В настоящее время, с развитием альтернативных нехирургических подходов, частичная ларингэктомия редко применяется при нелеченом раке на ранней стадии.Частичная ларингэктомия может использоваться для спасительной хирургии, когда лучевая терапия или химиотерапия не дали результата (12). Хирурги головы и шеи должны быть знакомы с хирургической техникой и периоперационным уходом.
Вертикальные частичные ларингэктомии. Вертикальная частичная ларингэктомия — прародитель органосохраняющих операций. Этот хирургический метод просуществовал более века и, несомненно, имеет реальную ценность. Это называется вертикальной частичной ларингэктомией, потому что эндоларинкс открывается вертикальным разрезом через щитовидный хрящ рядом с передней спайкой.В литературе описан ряд вариантов вертикальной частичной ларингэктомии. Наиболее распространены ларингофиссур и кордэктомия, вертикальная гемиларингэктомия (фронтолатеральная вертикальная гемиларингэктомия, заднебоковая гемиларингэктомия, расширенная вертикальная гемиларингэктомия) и надгортанная ларингопластика (13). Общей чертой всех этих процедур является вертикальное рассечение щитовидного хряща и резекция голосовой щели с продлением до параглоточного пространства. Эта процедура показана при опухолях Т1 и Т2.Однако у пациентов с фиксацией голосовых связок из-за инвазии перстневидного сустава не следует рассматривать возможность гемиларингэктомии (14). При использовании этого метода уровень местного контроля и сохранения гортани составляет от 82% до 95% для случаев T1-T2, а выживаемость через пять лет составляет более 90% (15-16). В другом исследовании, проведенном во Франции, уровень местного контроля в случаях T1 составил 91%, но снизился до 74% в случаях с вовлечением передней спайки и до 69% в случаях T2 (17).Уровень местного контроля и выживаемость через пять лет были значительно ниже для случаев Т3, с показателями местного контроля от 73% до 85% (18-19). Эти результаты показывают, что вертикальная частичная ларингэктомия является терапией выбора только в отдельных случаях. Для многих пациентов, которым можно вылечить вертикальную частичную ларингэктомию, трансоральная лазерная хирургия является лучшим вариантом лечения. Он имеет идентичные показатели местного контроля, лучшее качество голоса и функцию глотания, а также меньшую частоту осложнений (20).
Надгортанная ларингэктомия. Алонсо был пионером в разработке методов резекции надгортанных опухолей (21-22). Надгортанная ларингэктомия включает резекцию надгортанника, перевязок, надгортанника, подъязычной кости, верхушки щитовидного хряща и содержимого предгортанного пространства. Резекцию можно расширить, включив в нее один черпачок, основание языка или грушевидную пазуху. В зависимости от степени поражения может быть выполнена стандартная надгортанная ларингэктомия, щадя оба черпальца, оба спинных канатика, основание языка и подъязычную кость.В литературе описано множество расширений стандартной процедуры. Реабилитационный процесс после операции, в зависимости от объема резекции, часто бывает очень долгим и сложным. Почти всем пациентам необходим зонд для кормления и послеоперационная трахеостомия. Показания к надгортанной ларингэктомии шире, чем к вертикальной частичной ларингэктомии. С помощью надгортанной ларингэктомии можно лечить не только опухоли T1 и T2, но также опухоли T3 и T4. опухоли, поражающие предгортанное пространство или один из черпаловидных пазух, грушевидный синус или основание языка.С другой стороны, пациенты с этими большими поражениями все еще остаются кандидатами на тотальную ларингэктомию. Кроме того, пациенты, которым показана частичная надгортанная ларингэктомия, должны иметь адекватную легочную функцию. В целом, общая выживаемость через пять лет после надгортанной ларингэктомии сравнима с таковой, полученной при тотальной ларингэктомии, и составляет от 67% до 90%. Этот показатель составляет более 85% для пациентов на стадиях I и II, от 75% до 80% для стадии III и от 55% до 70% для пациентов с опухолями стадии IV (23-30).Показатели сохранения органов с помощью этой хирургической техники очень хорошие. Общий уровень сохранности гортани составляет более 85%. Кроме того, функциональные результаты после этой операции хорошие: более 90% пациентов могут быть деканюлированы и принимать оральную пищу перорально (23, 25, 26, 28). В заключение можно сказать, что надгортанная ларингэктомия является приемлемой хирургической техникой для отдельных случаев запущенного и промежуточного надгортанного рака. Тем не менее, обычная надгортанная ларингэктомия во многих случаях может быть заменена трансоральной лазерной хирургией.Функциональные и онкологические результаты этих двух хирургических методов можно сравнить, но эндоскопический подход трансоральной лазерной хирургии предлагает функциональные преимущества (31).
Таблица I.Сохранение гортани и выживаемость при различных хирургических и консервативных схемах лечения.
Супракрикоидная частичная ларингэктомия (ПКЛ). SCL был впервые описан Majer и Rieder (32) и популяризирован Laccoureye (33) после 1970-х годов. С помощью этой хирургической техники сохраняется четверть не пораженной гортани.Существует две формы супракрикоидной частичной ларингэктомии: перстневидноэпиглотопексия (CHEP) и перстневидопексия. SCL в целом является более радикальным хирургическим средством сохранения гортани при раке гортани. При супракрикоидной частичной ларингэктомии удаляются следующие структуры: голосовые складки, связки, надгортанные складки, надгортанник, часть подгортанника, соответствующая верхней поверхности перстневидного хряща, щитовидный хрящ, а также содержимое предглоточного и надгортанника. параглоточные пространства.Резекция может включать один чертополох, но при этом необходимо сохранить подъязычную кость. В зависимости от поражения надгортанника выполняется CHEP или криогиоидопексия. Сообщается, что SCL-CHEP эффективен при местном контроле над традиционной частичной ларингэктомией (34). SCL также может использоваться в качестве хирургической операции по спасению после неэффективности одновременной химиолучевой терапии. В своем обзоре 73 пациентов, получавших SCL-CHEP в течение 14 лет, Nakayama et al. сообщил о 5-летней сохранности гортани и общей выживаемости 92% и 85% соответственно.Онкологические и функциональные исходы были удовлетворительными и не различались между облученными и необлученными пациентами (35). В большой обзорной статье Silver et al. пришел к выводу, что в отдельных случаях SCL может быть альтернативой тотальной ларингэктомии (2). Hartl et al. поставили под сомнение лучшую органосохраняющую стратегию при раке голосовой щели Т3 и Т4. Опять же, SCL была упомянута как возможная альтернатива тотальной ларингэктомии в отдельных случаях T3 и T4a (36). В другом отчете SCL рассматривался у 41 пациента, но только 17 пациентов имели заболевание pT3.В этом отчете 5-летняя выживаемость без гортанной дисфункции для пациентов с опухолями T2-T3 составила 60,6% (37). После SCL необходима интенсивная реабилитация в течение нескольких недель, пока не восстановятся речь и глотание. Однако после операции качество голоса существенно изменилось. Ожидается, что от 80% до 90% пациентов восстановят глотательную функцию в течение первого года (38).
Эндоскопический доступ. В последнее десятилетие эндоскопическая частичная резекция гортани стала общепринятым подходом к лечению ранней карциномы гортани.Для сравнения, использование открытой хирургии заметно сократилось, а функциональные результаты эндоскопических процедур часто превосходят открытые доступы с меньшей болезненностью.
Трансоральная роботизированная хирургия. Роботизированная хирургия как хирургическая техника становится все более популярной. Он также приобрел значение в хирургии головы и шеи, так называемой трансоральной роботизированной хирургии (TORS). Основными преимуществами этой роботизированной хирургии являются ее трехмерная визуализация и возможность выполнения операции двумя или тремя руками при очень небольшом доступе.Одно из преимуществ по сравнению с трансоральной лазерной хирургией состоит в том, что имеется лучший обзор операционного поля благодаря более широкому углу обзора и широкоугольным линзам, а не прямой вид, как при использовании микроскопа во время лазерной хирургии. Еще одним преимуществом системы является то, что она позволяет хирургу выполнять очень точные движения без тремора. Операционное поле визуализируется в трехмерном виде на консоли, где хирург выполняет операцию. Роботизированная система позволяет работать в очень ограниченном и глубоком пространстве, что обычно не может быть достигнуто с использованием не роботизированных инструментов.О ТОРС при раке гортани опубликовано не так много исследований. Были проведены исследования, показывающие, что TORS является подходящим инструментом для доступа к ротовой полости, ротоглотке, гипофаринксе, надгортаннике и голосовой щели. Конечно, отдаленных онкологических результатов пока нет. Но предварительные результаты этой хирургической техники обнадеживают. Фактически, некоторые клиники показали, что трансоральная роботизированная хирургия может быть успешно применена, предлагая отличные клинические результаты. В многоцентровом исследовании Weinstein et al. в 2012 г. была определена безопасность, выполнимость и адекватность хирургических полей для ТОРС (39). В это исследование были включены 177 пациентов, большинство из которых имели опухоли ротоглотки (78%) и гортани (15%). Размеры опухолей варьировались от Т1 до Т4, а средний период наблюдения составил 345 дней. Результаты были удовлетворительными. Интраоперационной смерти во время операции или в промежуточном послеоперационном периоде не было. Кровопотеря во время операции была небольшая (83 мл), а показатель положительных полей составил всего 4.3%. Трахеостомия была выполнена у 12,4% всех пациентов, но только у 2,3% была выполнена трахеостомия при последнем наблюдении. 5,0% нуждались в чрескожной эндоскопической гастростомии, а средняя продолжительность госпитализации составила 4,2 дня. Было проведено всего несколько дополнительных исследований, показывающих возможность применения TORS при раке гортани. В небольшом исследовании с участием четырех пациентов с карциномой голосовой щели Парк показал, что применение TORS для частичной ларингэктомии технически осуществимо и безопасно (40). До этого, в 2007 году, Weinstein et al. были первыми, кто опубликовал результаты трансоральной надгортанной частичной ларингэктомии с использованием роботизированных инструментов у трех пациентов с надгортанной карциномой (41). В то время они уже пришли к выводу, что «TORS — это выполнимая и относительно безопасная хирургическая система для частичной надгортанной ларингэктомии. Он обеспечивает отличное хирургическое вмешательство, позволяющее полностью удалить опухоль. Кроме того, он представляет собой альтернативу открытым доступам и традиционной трансоральной надгортанной частичной ларингэктомии.Роль TORS в лечении рака гортани требует дальнейшего изучения. Функциональные и онкологические результаты после роботизированной хирургии рака гортани еще предстоит увидеть. Несомненно, TORS является подходящей альтернативой другим эндоскопическим доступам, таким как трансоральная лазерная хирургия, при раке гортани на ранней стадии.
Трансоральная лазерная хирургия. В последние годы хирургическое лечение рака гортани эволюционировало в сторону трансоральных резекций, особенно в сторону трансоральной лазерной микрохирургии (ТЛМ).TLM предлагает возможности точного рассечения и коагуляции, контролируемые микроскопическим обзором, и, кроме того, этот хирургический метод приводит к очень хорошим онкологическим и функциональным результатам. ТЛМ и супракрикоидная частичная ларингэктомия появились как подходы, сохраняющие функцию у пациентов с раком гортани. TLM выполняется с помощью лазера прямой видимости CO 2 -лазера и микроскопа. Штайнер и Амброш (42), Рудерт и др. (43) и другие хирурги (44-46) были пионерами трансоральной лазерной хирургии, и их работа превратилась в сегодняшние радикально более сложные резекции запущенных опухолей.С тех пор лазерная хирургическая техника получила большое развитие. Даже большие опухоли можно прооперировать с помощью трансоральной лазерной хирургии, поскольку за опухолью можно проследить через традиционные анатомические границы, чтобы оценить глубину инвазии и границы, а, разрезав ее на части, можно удалить. Лечение рака голосовой щели на ранних стадиях (Т1 и Т2) обсуждается неоднозначно. Есть центры, которые предпочитают лучевую терапию и считают лучевую терапию стандартной терапией при раннем раке голосовой щели. У такого способа лечения есть свои недостатки.Например, отек и гистологические последствия лучевой терапии ухудшают как визуальное, так и гистологическое исследование в период после лечения (47). Это может привести к задержке диагностики рецидива заболевания и может увеличить вероятность того, что хирургическое вмешательство потребует тотальной ларингэктомии. Преимущество лучевой терапии при ранних поражениях заключается в том, что она сохраняет высококачественный голос без ущерба для шансов на излечение. Тем не менее, многие центры лечат отдельных пациентов с опухолями T1 и T2 с помощью лазерного иссечения, несмотря на иногда более низкие результаты с точки зрения качества голоса.Многие исследования сообщают о хороших функциональных и онкологических результатах после лечения ранней стадии рака гортани с помощью лазерной хирургии. Перетти в своем исследовании 595 пациентов, перенесших трансоральную лазерную операцию по поводу рака голосовой щели Tis – T3, обнаружил, что общая выживаемость составила 87,5%, выживаемость по конкретным заболеваниям и без них составила 99% и 81,3%, а местный контроль — 92,7% (48). . Локорегиональные показатели, региональный контроль и сохранность органов составили 98,9%, 98,2% и 97,1% соответственно. Одномерный анализ показал значительное влияние категории pT на местный контроль с помощью лазера, сохранение органов, местно-региональный и региональный контроль.Голос после лазерной операции в большинстве случаев, особенно при ранних поражениях, не хуже, чем до операции. Основным преимуществом TLM является то, что удаление обычно выполняется за один сеанс.
Steiner (49) и Hinni (50) сообщили об отличных результатах даже при больших поражениях гортани, даже когда опухоли затрагивают черствый член, желудочек или переднюю комиссуру. Это определенно относится только к избранным случаям. Гистологическое подтверждение границы опухоли необходимо, чтобы гарантировать удаление болезни, и требуется тщательное наблюдение.Лечение надгортанного рака лазером CO 2 впервые было описано Воганом в 1978 г. (51). С тех пор было опубликовано много отчетов об этом хирургическом эндоскопическом подходе для лечения надгортанного рака гортани. Например, Амброш сообщил о 48 пациентах с надгортанным раком T1 и T2, получавших TLM. Частота 5-летнего местного контроля составила 100% для пациентов с T1-карциномой и 89% для пациентов с T2-карциномами (92). Совсем недавно Перетти опубликовал исследование 80 пациентов с надгортанной плоскоклеточной карциномой Tis-T3.Всем была проведена трансоральная лазерная операция. 5-летняя общая выживаемость, выживаемость при конкретном заболевании и без заболевания, а также местный контроль только с помощью лазера и показатели сохранения органов составили 84,4%, 97,4%, 88,3%, 96% и 97,2% соответственно. Одномерный анализ показал статистически значимое влияние на безрецидивную выживаемость и местный контроль только с помощью лазера. Результаты этого исследования показали хорошие общие онкологические исходы, полученные при трансоральной лазерной хирургии при Tis, T1, T2 и выбранном T3 надгортанном раке (52).Другое исследование, опубликованное Gonzalez-Marquez et al. в 2012 г. показали сопоставимые результаты при лазерной хирургии карциномы надгортанной гортани (53). Сорок девять пациентов с супрагортальным раком перенесли трансоральную лазерную операцию в качестве хирургического лечения. В это исследование были включены опухоли низкой и высокой стадии, и 13 пациентов получили послеоперационную лучевую терапию. Трех- и пятилетняя выживаемость при конкретном заболевании составила 93,2 и 82,2%. Наиболее частым осложнением после операции была аспирация (16.32%). В заключение, эти исследования показывают, что трансоральная лазерная хирургия является безопасным вариантом лечения надгортанного рака с низкой заболеваемостью и хорошими функциональными результатами. Чем меньше опухоль, тем лучше функциональный и онкологический исход.
Консервативное лечение
Радиотерапия . За последние десятилетия лечение рака гортани существенно изменилось, в основном из-за появления новых подходов, таких как комбинированная модальная терапия, а также улучшения радиотерапевтических методов.Лучевая терапия — это вариант лечения особенно небольших опухолей гортани. Высокие показатели местного контроля и сохранения функции гортани продемонстрированы у пациентов с ранними опухолями голосовой щели (T1a) при лучевой терапии. Сообщаемые показатели местного контроля при использовании только лучевой терапии колеблются от 84% до 95% (54-73). При более поздних стадиях карциномы голосовой щели (Т2) частота местного контроля в ретроспективных исследованиях колебалась от 50% до 85%. Если имеется нарушение подвижности голосовых складок в случаях с опухолями Т2, показатели местного контроля хуже, чем в случаях опухолей с нормальной подвижностью голосовых складок.Особые случаи среди карцином малой голосовой щели — опухоли, которые инфильтрируют переднюю комиссуру. Есть много исследований, посвященных этому виду опухолей. Например, Bron et al. (74) и Zohar et al. (75) обнаружили, что операция обеспечивает лучший исходный контроль, чем лучевая терапия. Напротив, Rucci et al. (76) ретроспективно сравнили свои хирургические и лучевые когорты опухолей с поражением передних комиссур и обнаружили, что хирургическое вмешательство в качестве лечения первой линии обеспечивает значительно лучший местный контроль (86% против 74%), но для чистого рака передней спайки лучевая терапия обеспечил лучший начальный местный контроль, хотя после лучевой терапии спасательная операция была менее эффективной.Опухоли более высокой классификации (T3 / T4) также можно лечить с помощью лучевой терапии. Пока нет исследований, которые бы напрямую сравнивали органосохраняющую хирургию с нехирургическими протоколами сохранения органов при опухолях гортани на поздних стадиях. Но есть исследования, показывающие преимущества комбинированных методов терапии (радиохимиотерапия, индукционная химиотерапия и лучевая терапия, лучевая терапия цетуксимабом) по сравнению с одной лучевой терапией при распространенном раке гортани.
Параллельная химиолучевая терапия и индукционная химиотерапия. Исследование группы радиационной терапии онкологии (RTOG) 91-11 (77, 78) сообщило в своем исследовании, проведенном в 2003 году, что одновременная химиотерапия и лучевая терапия превосходили последовательную терапию или только лучевую терапию для достижения местного и регионального контроля при применении к стадии III или рак гортани IV стадии. 547 пациентов с опухолями T2, T3 или T4 небольшого объема были случайным образом распределены в одну из трех исследуемых групп. По прошествии двух лет доля пациентов, у которых была сохранена гортань после лучевой терапии с сопутствующей химиотерапией (88%), была значительно выше, чем доля в группах, получавших последовательную терапию (75%, p = 0.005) или только лучевая терапия (70%, p <0,001). Частота локорегионального контроля также была значительно выше при лучевой терапии и одновременном приеме цисплатина (78 против 61% при индукционной химиотерапии с последующей лучевой терапией и 56% при только лучевой терапии). 5-летние результаты (78) отличаются от 2-летнего анализа значительным улучшением выживаемости без ларингэктомии, которое в настоящее время наблюдается как для последовательной терапии, так и для лучевой терапии с одновременным лечением химиотерапией по сравнению с одной лучевой терапией.10-летние результаты этого исследования, опубликованные в 2012 году, показывают, что индукционная терапия цисплатином / фторурацилом с последующей лучевой терапией и сопутствующей СРТ демонстрирует аналогичную эффективность для комбинированной конечной точки выживаемости без ларингэктомии. Локорегиональный контроль и сохранение гортани были значительно улучшены при одновременной терапии цисплатином / лучевой терапией по сравнению с индукционной терапией или только лучевой терапией (84). Что касается конечных точек сохранения гортани и локорегионального контроля, лучевая терапия с одновременной химиотерапией все еще является лучшим лечением без каких-либо преимуществ по сравнению с добавлением индукционной химиотерапии к одной только лучевой терапии, и, кроме того, не было улучшения скорости отдаленных метастазов.Однако в этом исследовании заболеваемость нехирургическим лечением рака гортани была значительной и ассоциировалась с 3% -ным риском смерти, связанной с лечением. Авторы исследования RTOG 91-11 после публикации своих долгосрочных результатов спустя 10 лет пришли к выводу, что необходимы новые стратегии для улучшения сохранения органов и их функции. В исследовании (EORTC) 24954 сравнивали чередование CRT и индукционной химиотерапии, но не было значительных различий между группами в отношении выживаемости и сохранности гортани.Использование неоадъювантной или индукционной химиотерапии с последующей сопутствующей CRT было исследовано с целью увеличения выживаемости и сохранения гортани. Первоначально цисплатин и 5-фторурацил были основными компонентами индукционной химиотерапии, в основном состоящими из трех цилиндров. Пациентам с остаточным заболеванием после индукции была проведена хирургическая операция. Так называемые респонденты начали сопутствующую химиолучевую терапию (79). Манц добавил в схему индукции лейковорин и интерферон-альфа 2b.Сопутствующая СРТ состояла из семи или восьми курсов 5-флуоурацила, гидроксимочевины и общей дозы лучевой терапии 70 Гр. Из 32 больных раком гортани с преимущественно IV стадией полная ремиссия наблюдалась у 59%. Через пять лет общая выживаемость составила 47%; локорегиональный контроль достигнут у 78% пациентов. Сохранность голоса с контролем болезни составила 75% через пять лет. Во время лечения и наблюдения были выполнены только две ларингэктомии, отдаленных метастазов не наблюдалось.Связанная с лечением токсичность стала причиной двух смертельных случаев (80). Однако эти результаты не имеют формального сравнения с рандомизированным или историческим контролем. Авторы пришли к выводу, что эта схема привела к высоким показателям излечения от болезни и сохранению голоса в группе пациентов, у которых традиционно плохие клинические и функциональные результаты. Исследование GORTEC 2000-01 — это недавно опубликованное во Франции исследование, в котором сравнивается более интенсивный режим индукционной химиотерапии: доцетаксел был добавлен к стандартному режиму цисплатин / 5-фторурацил.При среднем сроке наблюдения 36 месяцев 3-летняя сохранность гортани около 70% была значительно выше при триплетной индукционной химиотерапии (TPF), чем при дуплетной (PF) (81). Пациенты в группе TPF имели более тяжелую нейтропению, тогда как пациенты в группе PF имели более выраженный стоматит, тромбоцитопению и повышение креатинина. Общий ответ составил 80,0% в группе TPF по сравнению с 59,2% в группе PF. Авторы пришли к выводу, что у пациентов с запущенными карциномами гортани и гипофарингеала индукционная химиотерапия TPF превосходила режим PF с точки зрения общей скорости ответа.Эти результаты предполагают, что сохранение гортани может быть достигнуто у большей части пациентов. Тем не менее, существенной разницы в выживаемости не было. Познер также показал при местнораспространенном раке гортани и гортани, что последовательная терапия с индукцией TPF значительно улучшила выживаемость и выживаемость без прогрессирования по сравнению с PF. Среди оперированных пациентов TPF также значительно улучшил выживаемость без ларингэктомии и без прогрессирования заболевания. Они предложили использовать последовательный TPF с последующей CRT карбоплатином в качестве варианта лечения для сохранения органов или повышения выживаемости при местнораспространенном раке гортани и гортани (82).Европейская группа исследования TAX 323 (EORTC 24971) (83) также сравнивала TPF с PF в качестве индукционной химиотерапии у пациентов с местно-регионарно-распространенным неоперабельным заболеванием. Из-за неоперабельного статуса заболевания это не было исследованием сохранения органов, но средняя выживаемость без прогрессирования при медиане последующего наблюдения 32,5 месяца составила 11,0 месяцев в группе TPF по сравнению с 8,2 месяцами в группе PF. Лечение TPF привело к снижению риска смерти на 27% (p = 0,02) при средней общей выживаемости 18.8 месяцев по сравнению с 14,5 месяцами в группе ПФ. По сравнению со стандартной схемой приема цисплатина и фторурацила индукционная химиотерапия с добавлением доцетаксела значительно улучшила выживаемость без прогрессирования и общую выживаемость у этих пациентов. В случае неудачи этих упомянутых нехирургических методов лечения будет показана хирургическая тотальная ларингэктомия. Спасательная ларингэктомия связана с повышенным риском раневых осложнений по сравнению с операциями, выполняемыми до лучевой терапии.
Таргетная терапия. Ингибирование EGFR (рецептора эпидермального фактора роста) — это стратегия, ориентированная на молекулярные мишени. EGFR и его лиганды являются критическими белками в развитии и выживании эпителиальной ткани. Плоскоклеточный рак, в частности, головы и шеи, как правило, имеет высокий уровень EGFR. Ингибирование передачи сигналов EGFR небольшими молекулами, моноклональными антителами или антисмысловыми олигонуклеотидами продемонстрировало важные эффекты на различных моделях этих типов рака (85).Цетуксимаб, моноклональное антитело против EGFR и низкомолекулярный ингибитор тирозинкиназы, еще не доказал свою эффективность в клинических применениях. Публикация рандомизированного контролируемого исследования лучевой терапии с и без сопутствующего цетуксимаба, показывающего значительно улучшенную общую выживаемость (55% против 45% через три года, p = 0,03), привела к одобрению FDA цетуксимаба в сочетании с лучевой терапией для первичное лечение плоскоклеточного рака головы и шеи (86).Средняя продолжительность локорегионального контроля составила 24,4 месяца среди пациентов, получавших цетуксимаб в сочетании с лучевой терапией, и 14,9 месяца среди пациентов, получавших только лучевую терапию. Эти результаты были наиболее заметными у пациентов с первичными опухолями ротоглотки и с небольшой разницей в результатах для пациентов с раком гортани или гортани. В рандомизированном исследовании фазы II Tremplin, опубликованном в 2013 году, была проанализирована эффективность и безопасность индукционной химиотерапии с последующей CRT или биолучевой терапией для сохранения гортани, и в это исследование были включены 153 пациента.Результаты показали, что нет никаких доказательств того, что одно лечение лучше другого. Не было существенной разницы в сохранении гортани через три месяца и никакой разницы в общей выживаемости через 18 месяцев между двумя группами. В группе химиолучевой терапии было меньше неудач местного лечения, но спасательная операция была возможна только в группе биолучевой терапии (91). Это одно из ряда текущих клинических испытаний, в которых оценивают комбинации цетуксимаба и химиотерапии на основе цисплатина как индукционную или сопутствующую CRT.
Заключение
За последние десятилетия изменились парадигмы лечения рака гортани. Наблюдается тенденция к снижению использования открытых хирургических вмешательств (87). Пока нет рандомизированного исследования сохранения органов при распространенном раке гортани, которое показало бы улучшение выживаемости при нехирургическом лечении (77, 88). Новые стратегии CRT предлагаются в качестве альтернативных вариантов лечения для улучшения качества жизни пациентов с раком гортани в форме сохранения гортани. Обсуждение гортани сохранения остается спорным обсуждением, потому что его преимущество должно быть хорошо сбалансировано с контролем рака и возможными побочными эффектами.Терминология сохранения гортани еще четко не определена. Очень простое определение сохранения гортани — это, например, гортань без опухоли, трахеотомия или использование зонда для кормления (79). Сохранение анатомических органов у пациента, который останется зависимым от трахеотомической и гастростомической трубок, бессмысленно. Но некоторые исследования рассматривают сохранение гортани только как «гортань на месте», не принимая во внимание другие данные, такие как трахеотомия или необходимость использования зонда для кормления.Функцией гортани часто пренебрегают, и только несколько исследований включали выживаемость в качестве основной конечной точки.
В 2006 г. многопрофильная группа экспертов тщательно изучила литературу и разработала научно обоснованные клинические практические рекомендации по лечению рака гортани с целью сохранения гортани (самого органа или его функции) (89). Они указали на то, что использование подходов, сохраняющих гортань, для должным образом отобранных пациентов должно быть без какого-либо ущерба для выживаемости.
Однако ни один подход с сохранением гортани (хирургический или нехирургический) не дает преимущества в выживаемости по сравнению с тотальной ларингэктомией и адъювантной терапией с реабилитацией. Их рекомендация для пациентов с раком гортани T1 или T2, за редким исключением, — это начальное лечение с целью сохранения гортани. Для большинства пациентов с болезнью Т3 или Т4 без инвазии опухоли через хрящ в мягкие ткани подход с сохранением гортани является подходящим стандартным вариантом лечения, а одновременная СРТ является наиболее широко применимым подходом (89).Тем не менее, сравнение индукционной химиотерапии и сопутствующей CRT показывает, что локорегиональный контроль и сохранение гортани были значительно улучшены при одновременной терапии цисплатином / лучевой терапией по сравнению с индукционной терапией или только лучевой терапией (84). Для конечных точек сохранения гортани и локорегионального контроля лучевая терапия с одновременной химиотерапией по-прежнему является лучшим лечением, без каких-либо преимуществ по сравнению с добавлением индукционной химиотерапии к одной лучевой терапии, кроме того, нет улучшения скорости отдаленных метастазов (84 ).В исследовании Forastiere, где опубликованы долгосрочные результаты RTOG 91-11, не было продемонстрировано различий в поздней токсичности, речевой или глотательной функции, но наблюдалось увеличение смертности, не связанной с раком, у пациентов, которые одновременно получали цисплатин / лучевая терапия по сравнению с индукционной терапией или только лучевой терапией. Имея это в виду, индукционную химиотерапию следует по-прежнему считать экспериментальной и проводить только в рамках клинических испытаний (90). Не принято считать, что одновременная CRT является единственным стандартом лечения распространенного рака гортани, но является альтернативой тотальной ларингэктомии, поскольку одновременная CRT еще не сравнивалась напрямую с тотальной ларингэктомией в исследованиях.Чтобы обеспечить оптимальный результат для пациента, необходимы специальные знания и многопрофильная команда, и команда всегда должна обсуждать с пациентом преимущества и недостатки вариантов сохранения гортани по сравнению с методами лечения, включающими частичную и полную ларингэктомию. Лечащие врачи должны постоянно пересматривать свои рекомендации по лечению, поскольку предлагается множество новых переменных лечения, таких как химиотерапия, роботизированная хирургия и биомаркеры.
- Поступила 27.08.2013.
- Исправление получено 30 сентября 2013 г.
- Принято 1 октября 2013 г.
- Авторские права © 2013 Международный институт противораковых исследований (доктор Джон Г. Делинассиос), Все права защищены
Рак гортани | Онкологический центр им. Сильвестра
Ваша гортань — ваш голосовой ящик. Раковые образования, растущие в этой части тела, обычно являются плоскоклеточными карциномами. Они могут расти внутри и вокруг голосовых связок и других структур около голосового аппарата.
Почему выбирают комплексный онкологический центр им. Сильвестра?
Один из 71 онкологических центров США, назначенных NCI. Sylvester — один из двух онкологических центров во Флориде, признанных Национальным институтом рака. Команда заслужила это звание благодаря своей выдающейся работе по проведению исследований в своих лабораториях, лечению пациентов в своих клиниках и больницах и работе с сообществами, нуждающимися в медицинском обслуживании, с помощью инновационных стратегий профилактики.
По данным U.S. News & World Report, отделение отоларингологии занимает 9-е место в стране. У команды есть одна из крупнейших академических групп по борьбе с раком головы и шеи в стране в единственном онкологическом центре Южной Флориды, назначенном NCI, Комплексном онкологическом центре Сильвестра. Хирурги возглавляют хорошо зарекомендовавшую себя многопрофильную онкологическую команду, включающую инновационные методы, такие как скрининг рака полости рта, роботизированные технологии, микрососудистую реконструкцию, идентификацию сторожевых узлов и специализированное отделение послеоперационной помощи для этих сложных процедур.
Больше сертифицированных специалистов по хирургии головы и шеи, чем у любого другого поставщика медицинских услуг в Южной Флориде. У нас есть специалисты, которые работают вместе, чтобы позаботиться обо всех аспектах ухода за вашей головой и шеей. В большинстве случаев, требующих реконструкции, вам требуется всего одна операция по удалению рака и любая реконструктивная операция. Сильвестр — одно из лучших мест в стране для одновременной хирургии рака головы и шеи и реконструкции микрососудов.


