Посев на золотистый стафилококк и чувствительность к антибиотикам
Микробиологическое исследование, позволяющее выявить инфицированность золотистым стафилококком и определить количество возбудителя.
Золотистые стафилококки (Staphylococcus aureus) – грамположительные условно-патогенные бактерии рода Staphylococcus, являющиеся наиболее частой причиной стафилококковых, в частности внутрибольничных, инфекций. Золотистые стафилококки в норме могут располагаться на коже, слизистой оболочке носа и реже в гортани, влагалище, кишечнике. Они встречаются у 30 % здоровых людей.
Если у человека слабая иммунная система или нарушен нормальный состав микрофлоры, то при повреждении кожи (слизистых оболочек) золотистый стафилококк может приводить к разнообразным местным и системным инфекционно-воспалительным поражениям:
- кожи (карбункулам, импетиго, фолликулиту),
- молочных желез (маститу),
- дыхательных путей и ЛОР-органов (тонзиллиту, гаймориту, отиту, фарингиту, лариноготрахеиту, пневмонии),
- мочевыводящих путей (уретриту, циститу, пиелонефриту),
- пищеварительной системы (энтеритоколиту, аппендициту, перитониту, парапроктиту, холециститу),
- костно-суставной системы (остеомиелиту, артриту).
В отдельных случаях возможна генерализация инфекции с развитием септикопиемии. Производимый золотистым стафилококком энтеротоксин вызывает пищевые отравления и синдром токсического шока. Основные источники инфекции: здоровые (носители) и больные люди, домашние и сельскохозяйственные животные, а также пища, содержащая возбудителя инфекции (чаще всего это сахаросодержащие молочные продукты). Инфицирование может происходить контактным и воздушно-пылевым путем. Возможно аутоинфицирование.
Для идентификации золотистого стафилококка проводится посев клинического материала на питательные среды, где при наличии S. aureus через 18-24 часа наблюдается рост колоний золотистого цвета.
Определение количества бактерий может потребоваться, например, чтобы понять, нужно ли проводить лечение: в некоторых случаях, если количество небольшое, лечение не проводится. Решение о его необходимости зависит от клинических проявлений, а также от количества стафилококка. При небольшом содержании микробов и отсутствии симптоматики лечение может вообще не понадобиться, т. к. и в норме на слизистой могут находиться эти микробы. Стафилококк в кишечнике обнаруживается постоянно, это не повод для лечения, но если его количество превышено, тогда нужны меры (бактерия может вызывать колики и расстройства). Стафилококк в мазке без симптомов вагинита также является нормой, в то время как большие количества стафилококка в мазке, наряду с повышением лейкоцитов, требуют лечения.
Наличие стафилококка не обязательно означает инфекцию, это может быть бессимптомное носительство, например при посеве мазков из носа и зева носительством считается количество бактерий до 103. Однако более высокие показатели говорят нам о золотистом стафилококке как о причине заболевания, и это уже далеко не бессимптомное носительство.
Многое зависит от возраста пациента. Например, золотистый стафилококк в количестве 104 является вполне нормальным показателем для детей старше 1 года, но у грудных детей в таком количестве уже потребует лечения.
В любом случае наличие стафилококка при отсутствии симптомов болезни – еще не повод к назначению лекарств.
Количество стафилококка может определяться до и после лечения. Если выясняется, что рост возбудителя обильный, значит, инфекция набирает обороты, предыдущая терапия была неудачной и срочно требуется новый курс лечения; умеренный и скудный рост микроорганизмов по результатам последних анализов говорит об успешности терапии. Кроме того, в дальнейшем необходимо контролировать количество стафилококков в течение 1 или 2 месяцев после пройденного лечения.
Отмечено также, что после пребывания больных в хирургической клинике стафилококк обнаруживался у них вдвое чаще, чем при поступлении. У больных, поступающих в стационары, наблюдается замена антибиотикочувствительных стафилококков на антибиотикоустойчивые.
Лечение больных стафилококковой болезнью препаратами пенициллина или другими давно применяемыми антибиотиками часто остаётся безрезультатным, поскольку такие препараты нередко только усугубляют тяжесть течения инфекции. Поэтому так важно установить, какие антибиотики будут эффективны при лечении стафилококка.
Используется исследование:
- Для определения целесообразности лечения.
- Для дифференциации бактерионосительства и опасного инфицирования.
- Для контроля за состоянием пациента после проведенного лечения.
- Для того чтобы подтвердить, что стафилококк является причиной возникшего заболевания (об этом свидетельствуют высокие показатели посева).
Что означают результаты?
Референсные значения: нет роста.
Золотистый стафилококк в мазке в небольших количествах является частью нор¬мальной микрофлоры человека. Значительное повышение стафилококка в мазке может быть симптомом воспалительного процесса, кожных инфекций (угри и пр.) и смертельно опасных заболеваний (пневмония, остеомиелит, эндокардит и др.). Результат посева интерпретирует врач исходя из того, в каком количестве выделены микроорганизмы. Также прилагается заключение о чувствительности стафилококка к различным антибиотикам, в зависимости от которого назначается лечение теми или иными препаратами.
Исследование проводить до начала или через 2 недели после окончания антибактериальной, антимикотической терапии. Собирается утром натощак до чистки зубов или через 2-3 часа после еды и питья. Перед взятием не надо полоскать рот. Забирается специалистом.
Посев на золотистый стафилококк (S. aureus) без определения чувствительности к антибиотикам, количественно: исследования в лаборатории KDLmed
Микробиологическое исследование, позволяющее выявить инфицированность золотистым стафилококком и определить количество возбудителя.
Синонимы английские
Staphylococcus aureus culture, MRSA culture (Methicillin-resistant S. aureus culture), quantitative.
Метод исследования
Микроскопия.
Какой биоматериал можно использовать для исследования?
Грудное молоко, кал, мазок из зева, мазок с конъюнктивы, мазок из носа, мазок урогенитальный (с секретом предстательной железы), мокроту, отделяемое раны, отделяемое уха, ректальный мазок, среднюю порцию утренней мочи.
Как правильно подготовиться к исследованию?
- Рекомендуется употребить большой объем жидкости (воды) за 8-12 часов до сбора мокроты.
- Исследование рекомендуется проводить до начала приема антибиотиков и других антибактериальных химиотерапевтических препаратов.
- Исключить прием мочегонных препаратов в течение 48 часов до сбора мочи (по согласованию с врачом).
- Исключить прием слабительных препаратов, введение ректальных свечей, масел, ограничить прием медикаментов, влияющих на перистальтику кишечника (белладонна, пилокарпин и др.) и на окраску кала (железо, висмут, сернокислый барий), в течение 72 часов до сбора кала.
- Женщинам исследование (процедуру забора урогенитального мазка или сбор мочи) рекомендуется производить до менструации или через 2 дня после её окончания.
- Мужчинам не мочиться в течение 3 часов до забора урогенитального мазка или сбора мочи.
Общая информация об исследовании
Золотистые стафилококки (Staphylococcus aureus) – грамположительные условно-патогенные бактерии рода Staphylococcus, являющиеся наиболее частой причиной стафилококковых, в частности внутрибольничных, инфекций. Золотистые стафилококки в норме могут располагаться на коже, слизистой оболочке носа и реже в гортани, влагалище, кишечнике. Они встречаются у 30 % здоровых людей.
Если у человека слабая иммунная система или нарушен нормальный состав микрофлоры, то при повреждении кожи (слизистых оболочек) золотистый стафилококк может приводить к разнообразным местным и системным инфекционно-воспалительным поражениям:
- кожи (карбункулам, импетиго, фолликулиту),
- молочных желез (маститу),
- дыхательных путей и ЛОР-органов (тонзиллиту, гаймориту, отиту, фарингиту, лариноготрахеиту, пневмонии),
- мочевыводящих путей (уретриту, циститу, пиелонефриту),
- пищеварительной системы (энтеритоколиту, аппендициту, перитониту, парапроктиту, холециститу),
- костно-суставной системы (остеомиелиту, артриту).
В отдельных случаях возможна генерализация инфекции с развитием септикопиемии. Производимый золотистым стафилококком энтеротоксин вызывает пищевые отравления и синдром токсического шока. Основные источники инфекции: здоровые (носители) и больные люди, домашние и сельскохозяйственные животные, а также пища, содержащая возбудителя инфекции (чаще всего это сахаросодержащие молочные продукты). Инфицирование может происходить контактным и воздушно-пылевым путем. Возможно аутоинфицирование.
Для идентификации золотистого стафилококка проводится посев клинического материала на питательные среды, где при наличии S. aureus через 18-24 часа наблюдается рост колоний золотистого цвета.
Определение количества бактерий может потребоваться, например, чтобы понять, нужно ли проводить лечение: в некоторых случаях, если количество небольшое, лечение не проводится. Решение о его необходимости зависит от клинических проявлений, а также от количества стафилококка. При небольшом содержании микробов и отсутствии симптоматики лечение может вообще не понадобиться, т. к. и в норме на слизистой могут находиться эти микробы. Стафилококк в кишечнике обнаруживается постоянно, это не повод для лечения, но если его количество превышено, тогда нужны меры (бактерия может вызывать колики и расстройства). Стафилококк в мазке без симптомов вагинита также является нормой, в то время как большие количества стафилококка в мазке, наряду с повышением лейкоцитов, требуют лечения.
Наличие стафилококка не обязательно означает инфекцию, это может быть бессимптомное носительство, например при посеве мазков из носа и зева носительством считается количество бактерий до 103. Однако более высокие показатели говорят нам о золотистом стафилококке как о причине заболевания, и это уже далеко не бессимптомное носительство.
Многое зависит от возраста пациента. Например, золотистый стафилококк в количестве 104 является вполне нормальным показателем для детей старше 1 года, но у грудных детей в таком количестве уже потребует лечения.
В любом случае наличие стафилококка при отсутствии симптомов болезни – еще не повод к назначению лекарств.
Количество стафилококка может определяться до и после лечения. Если выясняется, что рост возбудителя обильный, значит, инфекция набирает обороты, предыдущая терапия была неудачной и срочно требуется новый курс лечения; умеренный и скудный рост микроорганизмов по результатам последних анализов говорит об успешности терапии. Кроме того, в дальнейшем необходимо контролировать количество стафилококков в течение 1 или 2 месяцев после пройденного лечения.
Для чего используется исследование?
- Для определения целесообразности лечения.
- Для дифференциации бактерионосительства и опасного инфицирования.
- Для контроля за состоянием пациента после проведенного лечения.
- Для того чтобы подтвердить, что стафилококк является причиной возникшего заболевания (об этом свидетельствуют высокие показатели посева).
Когда назначается исследование?
- При диагностике дисбактериоза.
Что означают результаты?
Референсные значения: нет роста.
Золотистый стафилококк в мазке в небольших количествах является частью нормальной микрофлоры человека. Значительное повышение стафилококка в мазке может быть симптомом воспалительного процесса, кожных инфекций (угри и пр.) и смертельно опасных заболеваний (пневмония, остеомиелит, эндокардит и др.). Результат посева интерпретирует врач исходя из того, в каком количестве выделены микроорганизмы.
Также рекомендуется
Кто назначает исследование?
Терапевт, врач общей практики, педиатр, ЛОР, инфекционист.
Литература
- Moreillon P., Que Y.-A., Glauser M.P. Staphylococcus aureus (Including Staphylococcal Toxic Shock). In: Principles and practice of infectious disease / G.L. Mandell, Bennett J.E., Dolin R (Eds) ; 6th ed. – Churchill Livingstone, Philadelphia, PA 2005. – 2701 p.
Посев на золотистый стафилококк и чувствительность к антибиотикам
Исследуемый материал Смотрите в описании
Существует три типа болезнетворных стафилококков: сапрофитный, эпидермальный, золотистый. Последний из них самый печально известный. Большинство медицинских проблем, связанных со стафилококком, подразумевают наличие именно золотистого стафилококка. Его воздействию подвержены все: взрослые, старики, дети. Он проникает в каждый орган человека, где вызывает воспаление. Не менее ста серьезных человеческих болезней напрямую связаны с золотистым стафилококком.
Микроб чрезвычайно устойчив во внешней среде. Многие бактерии обладают такой устойчивостью, но при неблагоприятных факторах они погибают, оставляя споры. При этом, золотистый стафилококк живет под прямыми солнечными лучами 12 часов, выдерживает температуру 150 С более 10 минут, не погибает в этиловом спирте, выживает в растворе натрия хлорида и перекись водорода ему не страшна.
Инкубационный период процесса в зависимости от нахождения очага инфекции может длиться несколько часов или несколько дней.
Противостоять такому «агрессору» может система местного и общего иммунитета человека. Выявление стафилококка при бак посеве без реальных симптомов болезни не является поводом для немедленного лечения.
Как выявить инфицированность стафилококком
Инфицированность стафилококком выявляется путем микробиологического исследования, которое также позволяет определять его чувствительность к антибиотикам.
Биоматериал для исследования
Чтобы сдать анализ на стафилококк, необходимо предоставить биоматериал, для исследования берут:
- разовую порцию мочи,
- мокроту,
- посев из носа,
- мазок с конъюнктивиты,
- мазок из зева,
- отделяемое уха,
- мазок урогенитальный,
- соскоб раны,
- вагинальный мазок.
Проводится также анализ грудного молока.
Симптомы стафилококка
Стафилококк проявляет себя разнообразно, от очагов на коже до болезни нервной системы. У детей он чаще проявляется высыпаниями, воспалением в кишечнике. Особую опасность представляет выявление микроба у новорожденных. Все чаще педиатры устанавливают дисбактериоз кишечника у грудничков. Назначив анализ на золотистый стафилококк, врач обнаруживает в кале у грудничка данный микроб.
- Стафилококк в горле является причиной ангин.
- Микроб в носу часто обнаруживается при беременности, однако, только при больших концентрациях назначают лечение.
- Если посев на стафилококк выявляет его присутствие в мазке без признаков вагинита, то это является нормой. Но его большое количество наряду с повышением лейкоцитов, требует лечения.
- Стафилококк в сперме — частое явление в урологии, это может означать, что он есть в соседних железах или в простате. Чтобы в этом убедиться делают посев на золотистый стафилококк.
Быстро и безопасно сдать анализ крови на стафилококк вы всегда можете в лаборатории ИНВИТРО, где проводят бактериологические исследования и других биоматериалов. Наши специалисты деликатно возьмут анализ, как у взрослых, так и у ребенка. При этом стоимость исследований вполне доступна.
Бактериологический посев на золотистый стафилококк (Staphylococcus aureus) с идентификацией микроорганизмов и определением чувствительности к антибиотикам
20.12.001 — Бактериологический посев на золотистый стафилококк (Staphylococcus aureus) с идентификацией микроорганизмов и определением чувствительности к антибиотикам
Описание: Прямой метод выявления золотистого стафилококка путем культивирования возбудителя на питательных средах, идентификации возбудителя и определения чувствительности к противомикробным препаратам (антибиотикам). Идентификация микроорганизмов выполняется методом времяпролетной МАСС-спектрометрии (MALDI-TOF). Метод времяпролетной МАСС-спектрометрии (MALDI-TOF) — это быстрая и точная идентификация микроорганизмов; обеспечивает почти 100% точность идентификации микроорганизмов и, соответственно, правильность диагноза и лечения.
Рекомендации по времени и условиям сдачи биоматериала: материал для исследования берется до начала антибактериальной терапии или не ранее двух-трех недель после ее окончания, а также не менее чем через 6-8 часов после отмены всех медикаментов и процедур; мазок из зева берется утром натощак до чистки зубов или через 2-4 часа после приема пищи; перед сбором кала необходимо предварительно помочиться
Биоматериал: мазок из носа, мазок из зева, кал
Контейнер для ПП, расходные материалы: для кала — стерильный контейнер с ложкой с завинчивающейся крышкой; для остальных биоматериалов — коллектор-туба с угольной средой Эймса
Инструкция по взятию ПП: Техника взятия соскобов описана в соответствующих разделах «Инструкции по получению и обработке первичной пробы» Лаборатории «Мобил Медикал Лаб». Кал отбирают из средней части фекальной массы специальной ложечкой, вмонтированной в крышку универсального стерильного пластикового контейнера в объеме мерной ложки. При заборе материала следует избегать попадания мочи и непереваренных кусочкой пищи.
Транспортировка, температура и время хранения: общее время хранения и транспортировки при температуре +2…+8°С: стерильный контейнер с угольной средой — не более 48 часов; стерильный контейнер с ложкой с завинчивающейся крышкой — не более 8 часов
Срок дозаказа (дни): нет
Посев на золотистый стафилококк МРЗС (S.aureus, MRSA) и определение чувствительности к антимикробным препаратам в Коломне. Диагностика и лечение
ФИО*:
Телефон*:
Необходимая услуга или врач: Комиссия для иностранных гражданМедицинская комиссия для трудоустройстваПриём аллергологаПриём врача УЗД (УЗИ)Приём гастроэнтерологаПриём гинекологаПриём дерматологаПриём детского аллергологаПриём детского гастроэнтерологаПриём детского гинекологаПриём детского кардиологаПриём детского психиатраПриём детского психологаПриём детского пульмонологаПрием детского стоматологаПриём детского урологаПриём детского хирургаПриём кардиологаПриём косметологаПриём логопедаПриём массажистаПриём неврологаПриём онкологаПриём ортодонтаПриём ортопедаПриём отоларингологаПриём офтальмологаПрием педиатраПриём проктологаПриём профпатологаПриём психиатра-наркологаПрием психотерапевтаПриём пульмонологаПриём ревматологаПриём сосудистого хирургаПриём стоматологаПриём терапевтаПриём трихологаПриём урологаПриём физиотерапевтаПриём хирургаПриём эндонкринологаСкрининг гинекологаЭКГ-ХолтерАбдулов Игорь АнатольевичАбдулова Валентина ИвановнаАкимова Нина ВикторовнаАксенов Кирилл СергеевичАлексеенко Мария НиколаевнаАннаев Максат ГеокчаевичБалашов Александр ВячеславовичБатова Елена ВикторовнаБелкина Анжелика СтаниславовнаБеляков Алексей СергеевичБойкова Мария ОлеговнаБондаренко Марина ВалерьевнаБосых Владимир ГеоргиевичБрага Раиса ИвановнаБулатов Дмитрий АлександровичБурбот Любовь ВикторовнаВдовина Елена ВитальевнаВиноградова Оксана НиколаевнаВласова Светлана АлександровнаГауст Анисья РадифовнаГвозденко Сергей ФедоровичГорбачев Илья СергеевичГригорьев Сергей АлексеевичГригорьева Анна БорисовнаДавыдова Надежда ВасильевнаДавыдова Елена ЮрьевнаДевяткина Варвара ПавловнаДеменкова Виктория ВладимировнаДинамарка Карина ФернандовнаДобко Зоя ГригорьевнаДустаметова Сабина ДустаметовнаЕгоренко Елена АнатольевнаЕжова Любовь ГеннадьевнаЖуков Семен АндреевичЗамостян Анна ДмитриевнаЗейналов Эльмар Кафар оглыЗинченко Светлана ИвановнаЗмановская Татьяна ЛеонидовнаИванов Александр АлександровичИвашкина Екатерина ДмитриевнаИкромов Сухробжон НасруллоевичИркова Ирина АнатольевнаКалашникова Елена ПетровнаКалинина Анна СергеевнаКандрашкина Екатерина ЕвгеньевнаКиселев Игорь ЕвгеньевичКиселева Наталия СтаниславовнаКозлова Инна ИвановнаКокорина Оксана ВалериевнаКолодина Юлия МихайловнаКольдин Алексей ВладимировичКорнев Алексей ВячеславовичКорчагина Антонина НиколаевнаКострюкова Лариса НиколаевнаКравцова Марина ЮрьевнаКрасулина Ольга АлександровнаКрюкова Оксана АндреевнаКудеева Оксана ВикторовнаКузьмина Елена НиколаевнаКулагина Татьяна СтаниславовнаКутлахметов Айрат АзгаровичЛихачев Никита ЕвгеньевичЛогинов Виталий АлександровичЛукьянова Екатерина ЮрьевнаМакаркин Владимир СергеевичМальцев Максим ЮрьевичМарченко Лилия ВладимировнаМатях Игорь ИгоревичМаханов Рустам ХамиджоновичМаханова Ольга БазаровнаМережко Вероника ИгоревнаМерзова Фируза РафиковнаМещеряков Михаил ВикторовичМиронова Марина АнатольевнаМихайлов Дмитрий ВладимировичМолчанова Надежда ПетровнаНазарчук Светлана НиколаевнаНайман Сергей ПавловичНикулин Павел НиколаевичНовиков Алексей НиколаевичНовиков Олег ЛеонидовичНовикова Ирина ВладимировнаНовикова Елена ВячеславовнаОдинец Лидия ФедоровнаОрлова Ольга АлександровнаОхотина Инна ИгоревнаПавлов Владимир СергеевичПанченко Ирина АнатольевнаПапин Александр ГеоргиевичПоздняков Евгений ГеннадьевичПопов Сергей ВикторовичПоспелова Рита АнатольевнаПучкова Наталья АлександровнаРепин Павел НиколаевичРешетникова Татьяна ПетровнаРогожин Павел СергеевичРогожина Екатерина ГеннадьевнаРостиков Олег ВячеславовичРудаева Любовь МихайловнаРыкова Марина ВладимировнаСкорнякова Ирина ИгоревнаСмирнова Людмила АлександровнаСоколова Татьяна ФедоровнаСорокина Елена КонстантиновнаСтепанова Виктория СергеевнаСтепашкина Анастасия СергеевнаСтроганова Тамара ИвановнаСычева Полина АлександровнаТарарышкин Дмитрий АлександровичТарахтиева Наталья ВасильевнаТерехина Наталья ВладимировнаТестовый Врач КлиникиТетерина Елена ВалерьевнаТихонов Алексей ВладимировичТутунина Елена ВладимировнаФедосеева Надежда ВикторовнаФокина Алена АлексеевнаХарламов Павел ВикторовичЧапчикова Ольга АлександровнаЧеремина Виктория ВикторовнаЧернецкая Инесса ИвановнаЧернова Любовь ВладимировнаЧижов Михаил СергеевичЧичерина Валентина ВикторовнаШаповалова Нина БорисовнаШкурлатов Сергей НиколаевичШтейн Юлия СергеевнаЩекочихина Тамара ВикторовнаЩекочихина Тамара ВикторовнаЩербак Валерия НиколаевнаЯгодина Екатерина Антоновна
Клиника Все клиникиДетская поликлиника «Живица+»Многопрофильная клиника «Живица+»Медицинский центр «Живица+» в ГолутвинеМедицинский центр «Живица+» на Окском
Предпочтительное время приема:
Детский врач Принимает детей
Отправляя заявку, вы даете согласие на обработкуперсональных данных в соответствии с политикой конфиденциальности
Бактериологические исследования
Адреса клиник г. Казань
Адрес: ул. Гаврилова, 1, ост. «Гаврилова» (пр. Ямашева)Пн-Пт: 7.00-20.00, Сб: 7.30-16.00, Вс: 8.00-14.00
Автобус: 10, 10а, 18, 33, 35, 35а, 36, 44, 45, 46, 49, 55, 60, 62, 76
Троллейбус: 2, 13
Трамвай: 5, 6
Адрес: ул. Т.Миннуллина, 8а, (Луковского) ост. «Театр кукол»Пн-Пт: 7.00-20.00, Сб: 7.30-16.00, Вс: 8.00-14.00
Автобус: 1, 2, 31, 37, 47, 74
Троллейбус: 6, 8, 12
Метро: Суконная слобода
Адрес: ул. Сыртлановой, 16, ст. метро Проспект Победы, ост. ул. Сыртлановой (проспект Победы)
Пн-Пт: 7.00-20.00, Сб: 7.30-16.00, Вс: 8.00-14.00
Автобус: 5, 34, 37, 62 77
Трамвай: 5
Метро: Проспект Победы
Адрес: ул. Назарбаева, 10, ст. метро «Суконная Слобода», ост. «Метро Суконная Слобода»Пн-Пт: 7.00-20.00, Сб: 7.30-16.00, Вс: выходной
Автобус: 1, 4, 25, 43, 71
Метро: Суконная слобода
Адрес: ул. Декабристов, 180, ст. метро «Северный вокзал», ост. «Гагарина»
Пн-Пт: 7.00-20.00, Сб: 7.30-16.00, Вс: выходной
Автобус: 6, 18, 29, 33, 37, 40, 43, 53, 62, 76, 78, 89
Троллейбус: 13
Трамвай: 1, 6
Метро: Северный вокзал
Адрес: пр. А.Камалеева, 28/9, (жилой комплекс «XXI век»), ост. «Новый ипподром»Пн-Пт: 7.00-20.00, Сб: 7.30-16.00, Вс: 8.00-14.00
Троллейбус: 3
Адрес: Дербышки, ул. Мира, 20, ост. «Магазин Комсомольский», «Гвоздика»
Пн-Пт: 7.00-20.00, Сб: 7.30-16.00, Вс: 8.00-14.00
Автобус: 1, 19, 25, 34, 44, 60, 84
Адрес: ул. Серова, 22/24, ост. «ул. Серова»Пн-Пт: 7.00-20.00, Сб: 7.30-16.00, Вс: 8.00-14.00
Автобус: 10, 10а
Адрес: ул. Беломорская, 6, ст. метро «Авиастроительная», ост. «ул. Ленинградская»
Пн-Пт: 7.00-20.00, Сб: 7.30-16.00, Вс: 8.00-14.00
Автобус: 6, 18, 33, 37, 40, 42, 43, 53, 60, 78, 89, 93
Троллейбус: 13
Трамвай: 1
Метро: Авиастроительная
Адрес: ул. Закиева, 41а, ост. «Кабельное телевидение»Пн-Пт: 7.00-20.00, Сб: 7.30-16.00, Вс: 8.00-14.00
Автобус: 5, 18, 30, 31, 34, 45, 46, 62, 63, 77, 89
Троллейбус: 3, 5, 9, 12
Адрес: ул. Кул Гали, 27, ост. «ул. Кул Гали» (ул. Габишева)
Пн-Пт: 7.00-20.00, Сб: 7.30-16.00, Вс: выходной
Автобус: 46, 90
Адрес: ул. Рихарда Зорге, 95, м. «Дубравная», ост. «ул. Юлиуса Фучика»Пн-Пт: 7.00-20.00, Сб: 7.30-16.00, Вс: 8.00-14.00
Автобусы: 5, 18, 30, 31, 33, 34, 45, 68, 74, 77
Троллейбусы: 5, 9, 12
Трамвай: 4
Метро: Дубравная
Адрес: ул. Фрунзе, 3а, ост. «Идель»Пн-Пт: 7.00-20.00, Сб: 7.30-16.00, Вс: 8:00-14:00
Автобусы: 10а, 36, 49, 53, 63, 72, 106
Троллейбус:1
Бактериологическая лаборатория Оренбург — бесплатно, цена.
Бактериологическая лаборатория — самостоятельная структурная единица в ГАУЗ «ООКБ№2»
В бактериологической лаборатории определяют вид инфекции, вызвавший то или иное заболевание организма. Для этого производят посевы крови, мочи, мокроты, отделяемого из раны, из зева, носа и других жидкостей организма на различные питательные среды, а затем определяют чувствительность выделенного микроорганизма к антимикробным препаратам. Для идентификации микроорганизма применяются методы
— бактериологический
— иммунохроматографический
— ПЦР
-Исследование генома возбудителя инфекций передающегося половым путем методом ПЦР.
Полимера́зная цепна́я реа́кция (ПЦР) — это метод молекулярной биологии, позволяющий добиться значительного увеличения малых концентраций определённых фрагментов нуклеиновой кислоты (ДНК) микроба в биологической пробе.
Этим методом в данной лаборатории определяются следующие микроорганизмы:
-хламидия трахоматис
-микоплазма гениталиум
-микоплазма гоминис
-уреаплазма уреалитикум ,sp.
-гарднерелла вагиналис
-нейссерия гонорея
-трихоионас вагиналис
-вирус простого герпеса 1-2
-цитомегаловирус
-вирус Эпштейна-Барра
-токсоплазма гонди
МЕТОД БАКТЕРИОЛОГИЧЕСКИХ ПОСЕВОВ НА ПИТАТЕЛЬНЫЕ СРЕДЫ.
-Дисбактериоз кишечника
Дисбактериоз — это состояние, при котором нарушается состав микроорганизмов, населяющих кишечник (полезных бактерий становится меньше либо они отсутствуют, а условно-патогенных, или патогенных соответственно, больше), что приводит к нарушению работы желудочно-кишечного тракта.
-Дисбиоз вагины
Дисбиоз вагины- это состояние при котором изменяется микробный состав влагалища (резкое снижение, вплоть до полного исчезновения молочнокислых бактерий у женщин репродуктивного возраста и замещением другой микрофлоры).
-Микоплазма,( Уреаплазма)
Микоплазмоз — это заболевание, характеризующееся воспалительным поражением различных слизистых оболочек, в том числе мочеполовой системы. Возбудителем является условно-патогенная бактерия – микоплазма, уреаплазма или одновременно два вида микоплазм.
-Определение хеликобактера из биоптата слизистой.
Хеликобактер — это микроорганизм который может вызвать воспалительные процессы в желудке.
-Исследования на дифтерию
Дифтерия — это инфекционное заболевание, вызываемое бактерией Corynebacterium diphtheriae.
-Половые инфекции (ГОНОРЕЯ)
Гоноре́я — это инфекционное заболевание, вызываемое микроорганизмом( лат. Neisseria gonorrhoeae), передаваемое половым путём и характеризующееся поражением слизистых оболочек половых органов и др.
-Половые инфекции (ТРИХОМОНАДЫ)
Трихомониаз воспалительное заболевание мочеполовой сферы, которое вызывается трихомонадой — простейшим одноклеточным микроорганизмом из класса жгутиковых.
-Кишечные инфекции (САЛЬМОНЕЛЛЕЗ)
Сальмонеллёз — острая кишечная инфекция пищеварительного тракта вызываемая сальмонеллами, с клиническими проявлениями дегидратации и интоксикации всего организма.
Инфекция распространена повсеместно.
-Кишечные инфекции (ДИЗЕНТЕРИЯ)
Дизентери́я — инфекционное заболевание, вызываемое бактерией шигеллой и характеризующееся общей инфекционной интоксикацией и поражения желудочно-кишечного тракта отдела толстой кишки, с фекально-оральным механизмом передачи.
-Биологический контроль работы паровых и воздушных стерилизаторов
Биологический контроль предназначен для контроля эффективности работы стерилизаторов и на основании гибели спор тест-культур. Осуществляют его с помощью биотестов. Биотест – это определенное количество тест-культуры в пробирке или другом носителе. В качестве тест-культуры для контроля работы парового стерилизатора используются споры Bacillus stearothermophilus ВКМ В-718, а воздушного стерилизатора – споры Bacillus licheniformis. После стерилизации тесты помещают на питательную среду. Отсутствие роста на питательной среде свидетельствует о гибели спор во время стерилизации.
-Смывы на кишечную палочку
-Смывы на патогенный стафилококк
Смывы на кишечную палочку и патогенный стафилококк являются санитарно-бактериологическим контролем при санитарном обследовании различных объектов, дающим возможность объективно оценивать уровень санитарного содержания обследуемых предприятий общественного питания и дезинфекцию ЛПУ.
-Стерильность хирургического материала
-Стерильность шовного материала
В основе качественной контактной хирургии лежит асептический метод, принцип которого уничтожение микробной флоры на всех предметах, соприкасающихся с раной. Все должно быть стерильным, а контроль стерильности проводится бактериологическим методом.
-Дистиллированная вода на пирогенность
— Воздух в закрытых помещениях аспирационным методом на омч, золотистый стафилококк, плесневые грибы
Аспирационные методы основаны на протягивании определенного объема воздуха пробоотборным устройством . В воздухе находится группа патогенных и условно-патогенных микроорганизмов, но в нем они не размножаются. Человек, болеющий инфекциями верхних дыхательных путей, выделяет микроорганизмы при разговоре, чихании, кашле и т.д. Через воздух передается группа заболеваний, которая так и называется — инфекции дыхательных путей с воздушно-капельным и воздушно-пылевым механизмами передачи.
Задачами санитарно-микробиологического исследования воздуха являются гигиеническая и эпидемиологическая оценка воздушной среды.
-Флора и чувствительность к антимикробным препаратам из биопроб
У человека находится большое количество сбалансированных между собой микроорганизмов. Но если человек заболел или его иммунная система не справляется, то микроорганизмы попавшие или собственные ,начинают размножатся и вызывать заболевание. Это закон природы. Определить возбудителя, его количество, вид и то, как он реагирует на медикаментозные средства, можно, сделав бакпосев на микрофлору .(н-р моча, мокрота ,цервикальный канал, уретра,нос, зев, и т.д.
-НОСИТЕЛЬ СТАФИЛОКОККА ЗОЛОТИСТОГО (ОТРИЦАТЕЛЬНЫЙ)
Стафилококк в носу. Стафилококки – род грамм положительных бактерий, являющихся одними из наиболее распространенных микроорганизмов на земле. Люди сталкиваются ежедневно с ними в быту, некоторые могут быть их носителями .Из всех стафилококков самым опасным является золотистый стафилококк. Стафилококк золотистый опасен тем, что признаки и симптомы заболевания могут по-разному, либо вообще не проявляться. Многие больные даже не знают, что они являются их носителями, пока бактериальный посев это не покажет.
-КРОВЬ НА СТЕРИЛЬНОСТЬ
Кровь на стерильность – это анализ, который проводится в бактериологической лаборатории методом посева венозной крови на специальные среды, что позволяет определить наличие бактерий в крови. В норме кровь стерильная.
-КРОВЬ НА САЛЬМОНЕЛЛЕЗ (ШИГЕЛЛЕЗ)
Исследование крови на сальмонеллез и шигеллез проводят из венозной крови при симптомах, характерных для кишечных инфекций, включая случаи с отрицательными результатами бактериологического посева на диз.группу и сальмонеллез из прямой кишки, а также при обследовании контактных лиц.
Staphylococcus aureus Колонизация горла происходит чаще, чем колонизация передних носовых ходов
J Clin Microbiol. 2006 сен; 44 (9): 3334–3339.
Петер Нильссон
Отделение клинической микробиологии и инфекционного контроля, Окружная больница Хальмстада, Хальмстад, Швеция
Торвальд Рипа
Отделение клинической микробиологии и инфекционного контроля, Окружная больница Хальмстада, Хальмстад, Швеция
Отделение Клиническая микробиология и инфекционный контроль, Окружная больница Хальмстада, Хальмстад, Швеция
* Автор, ответственный за переписку.Почтовый адрес: Отдел клинической микробиологии и инфекционного контроля, окружная больница Хальмстада, S-30185 Хальмстад, Швеция. Телефон: 46 35 136549. Факс: 46 35 131869. Электронная почта: [email protected].Поступило 26 апреля 2006 г .; Пересмотрено 10 июня 2006 г .; Принято 24 июня 2006 г.
Copyright © 2006, Американское общество микробиологов. Эта статья цитируется в других статьях в PMC.Abstract
Целью данного исследования было определение частоты и устойчивости носительства Staphylococcus aureus в глотке по отношению к носительству переднего носа.При использовании чувствительного обогащающего бульона S. aureus было культивировано из двух участков от 259 пациентов при поступлении в ортопедическое отделение и от 87 сотрудников одного отделения. Горло было наиболее частым местом носительства в обеих группах. Сорок процентов пациентов и 54% медперсонала были положительными на S. aureus в горле, по сравнению с 31% и 36%, соответственно, в передних ноздрях. Чтобы определить стойкость носительства, у 67 человек были повторно взяты пробы из передних носовых ходов и горла в течение 2 лет (от 5 до 10 раз; в среднем 7.8). Большинство, 58% (39/67), были определены как постоянные носители S. aureus с учетом результатов посева на обоих участках. Из 39 постоянных носителей 15 человек имели положительный результат посева только из глотки более чем в половине случаев отбора проб (они называются предпочтительными носителями из глотки), в то время как только 5% (два человека) были предпочтительными носителями передних нервных окончаний согласно тому же определению . Типирование собранных изолятов S. aureus с помощью гель-электрофореза в импульсном поле показало, что тот же штамм S.aureus с течением времени присутствовал в глотке человека, по крайней мере, в той же степени, что и в передних ноздрях. Горло-носительство было по крайней мере таким же устойчивым, как и носительство в передних ноздрях.
Помимо того, что это основной патоген для человека (14), Staphylococcus aureus колонизирует значительную часть популяций человека (27). Передние ноздри считаются первичным местом колонизации (11, 14), и примерно 30% здоровых людей переносят бактерии в передних ноздрях.Уровень носительства, близкий к 60%, был описан ранее для определенных популяций (11). Человеческое горло менее изучено как место носительства, и ранее сообщалось о различных уровнях изоляции. Boe et al. сообщили о частоте изоляции 31% пациентов, помещенных в медицинское отделение (4), а Uemura et al. сообщили, что уровень изоляции в группе здоровых взрослых добровольцев составил 29% (22). Беркович и др. обнаружили бактерии в горле у 10% здоровых детей в возрасте до 2 лет (3). Также были отмечены более высокие, чем ожидалось, показатели устойчивости к метициллину S.aureus (MRSA) в горле младенцев (9). Область промежности, по-видимому, является обычным местом носительства, но редко является единственным местом колонизации (4). Также ранее было описано носительство на различных участках кожи. Однако это, по-видимому, вторично по отношению к носительству или инфекции в других местах, поскольку удаление носовых колоний с помощью местного лечения в большинстве случаев устраняет носительство через кожу (16, 20).
Были описаны три основных типа носительства, когда у людей неоднократно брали пробы в передних ноздрях на S.aureus в течение более длительного периода. Сообщалось, что от 6 до 60% никогда не были переносчиками микроорганизмов (не носители), а от 14 до 33% были повторно положительными по культуре (постоянные носители). Остальные особи время от времени дают положительные культуры и характеризуются как случайные или периодические носители (6, 10, 27). Различия между исследованиями могут быть связаны с различными методами выборки и / или вариациями в определениях различных состояний носителей. Постоянные носители, как правило, с течением времени несут один и тот же тип или генотип фага чаще, чем прерывистые и случайные носители (6, 27).Насколько нам известно, структура носительства с течением времени не исследовалась ни в одном месте отбора проб, кроме передних ноздрей.
Целью этого исследования было определение частоты и устойчивости носительства в глотке по сравнению с носительством переднего нареза S. aureus . Мы использовали метод чувствительной культуры, чтобы свести к минимуму ошибки, возникающие из-за низкой скорости восстановления. Все изоляты были генотипированы с помощью гель-электрофореза в импульсном поле SmaI (PFGE).
МАТЕРИАЛЫ И МЕТОДЫ
Пациенты и
S.aureus отбор проб.Все образцы были собраны в рамках плановой схемы эпиднадзора за инфекциями в окружной больнице Хальмстада, Швеция.
Образцы были собраны с помощью тампона с вискозным наконечником и угольной транспортной среды Amies (114C.US) (Копан, Италия). Образцы из передних ноздрей брали путем вращения кончика тампона в обеих ноздрях, а из горла — путем вращения кончика тампона на обеих миндалинах.
Пациенты, поступившие в ортопедическое отделение окружной больницы Хальмстада, Швеция, с марта по сентябрь 2003 г., по прибытии были исследованы на предмет наличия S.aureus . Среди 259 отобранных пациентов 62% составляли женщины, средний возраст 74,4 года, и 38% — мужчины, средний возраст 64,3 года. В марте было взято 20 пациентов, 72 — в апреле, 57 — в мае, 20 — в июне, 17 — в июле, 38 — в августе и 35 — в сентябре.
Персонал ортопедического отделения был проинструктирован самостоятельно взять мазок, вращая тампон в обоих передних носовых ходах и отдельный тампон на обеих миндалинах. Пробы брались у всех дежурных сотрудников в течение 1 недели каждый месяц с марта по сентябрь 2003 г. (за исключением июня и июля, когда палата была закрыта большую часть времени), а затем в течение 1 недели в ноябре 2003 г., марте 2004 г. и апреле. 2005 г., всего девять раз.Не все сотрудники были доступны постоянно, и в течение периода исследования были включены новые сотрудники. Всего в ортопедическом отделении было отобрано 87 отдельных сотрудников (70 женщин, средний возраст 40 лет, и 17 мужчин, средний возраст 34 года).
У группы из 67 человек повторно брали пробы из передних носовых ходов и глотки в течение 24 месяцев. Группа состояла из 34 сотрудников ортопедического отделения и 33 сотрудников отделения клинической микробиологии и инфекционного контроля окружной больницы Хальмстада, Швеция.Из этих 67 человек 63 были женщинами и 4 мужчинами, их средний возраст на момент первого отбора проб составлял 44 года. В период с марта 2003 г. по март 2005 г. они отбирались как минимум пять раз (в среднем 7,8 раз; диапазон от 5 до 10). Всего было собрано 384 изолята S. aureus , и их клональные отношения были определены с помощью анализа PFGE.
S. aureus , изоляция.Все образцы мазков инкубировали в течение 16–18 ч при 37 ° C в шейкере (100 об / мин) в аэробных условиях в 3 мл обогащающего бульона со следующим составом: 15.0 г протеозопептона (Oxoid, Бейзингсток, Англия), 2,5 г печеночного переваривающего вещества (Oxoid), 5,0 г дрожжевого экстракта (Oxoid), 25,0 г NaCl, 10,0 г маннита, 16 мг / л фенилового красного и 8 мг азтреонама в финальной стадии. объем 1 литр (конечный pH 7,0 ± 0,1). Затем порцию (10 мкл) бульона высевали на чашку с кровяным агаром и инкубировали при 37 ° C в течение ночи. Подозреваемые колонии были выделены на чашке с кровяным агаром и идентифицированы как S. aureus с использованием теста ДНКазы и латексного теста Staphaurex (Remel Europe Ltd., Дартфорд, Англия). Когда эти методы не совпадали, присутствие гена термостабильной нуклеазы анализировали с помощью ПЦР, как описано Nilsson et al. (15). Один единственный изолят S. aureus был выделен из каждого образца. Возможное присутствие более одного штамма в каждом образце не учитывалось. Все изолированные штаммы S. aureus собирали и хранили при -70 ° C для дальнейшего анализа.
ПФГЭ.
Штаммы, собранные в ходе исследования, были проанализированы с помощью PFGE, как описано Bannerman et al.(2). Структуры полос изолятов анализировали с использованием программного обеспечения Molecular Analyst, версия 1.6 (Bio-Rad Laboratories, Геркулес, Калифорния), методом групповой кластеризации невзвешенных пар с использованием средних связей и коэффициента Дайса. Штаммы с более чем 80% сходством были сгруппированы в клональные группы и названы с заглавной буквы от A до X. Изоляты от одного и того же человека, но собранные в разных случаях, также сравнивали друг с другом. Во всех случаях, когда они принадлежали к одной и той же клональной группе, они находились в пределах трех разностей полос (21).Это означает, что изоляты от разных индивидуумов, но названные одной и той же буквой, имели не менее 80% сходства при компьютерном кластерном анализе, в то время как изоляты от одного индивидуума с тем же именем имели различия <4 полос.
Расчеты и определения.
Индекс носителя (ДИ) был определен как количество положительных мазков, деленное на общее количество мазков для каждого человека, как описано Eriksen et al. (6). Однако определения состояний носителей отличаются от определений, используемых Eriksen et al.В нашей работе постоянный носитель определяется как человек с CI> 0,5; для случайного носителя 0
РЕЗУЛЬТАТЫ
Носительство S. aureus у пациентов и персонала.В течение периода исследования с марта 2003 г. по сентябрь 2003 г. у 259 пациентов, поступивших в ортопедическое отделение, были взяты образцы при поступлении как в передние ноздри, так и в глотку. Скорость выделения S. aureus из разных участков представлена в таблице.В общей сложности S. aureus было выделено у 125 из 259 пациентов (48%) на любом из участков. Наиболее частым местом изоляции было горло (40% пациентов), за которым следовали передние ноздри (31% пациентов). Разница в частоте изоляции между передними ноздрями и глоткой была статистически значимой ( P = 0,037). Если бы передние ноздри были единственным местом скрининга, было бы идентифицировано 64% (80/125) из носителей S. aureus , тогда как взятие пробы только из глотки позволило бы идентифицировать 83% (104/125).Не было обнаружено значительных различий между мужчинами и женщинами в отношении показателей изоляции из разных участков (данные не показаны).
ТАБЛИЦА 1.
Степень изоляции S. aureus в передних ноздрях и горле среди пациентов и персонала ортопедического отделения
| Результат для ноздрей a | Результат для горла a | Количество (%) лиц с результатом | ||
|---|---|---|---|---|
| Пациенты | Персонал | Пациенты и персонал | ||
| Поз. | Поз. | 59 (23) | 24 (28) | 83 (24) Поз. | 21 (8) | 7 (8) | 28 (8) |
| Отрицательный | Поз. | 45 (17) | 23 (26) | 68 (20) |
| Отрицательный | Отр. | 134 (52) | 33 (38) | 167 (48) |
| Итого | 259 | 87 | 346 | |
За период исследования Персоналу отделения предлагалось ежемесячно проводить забор образцов из носа и горла.В таблице мы суммировали частоту выделения S. aureus при первом взятии проб у 87 сотрудников. Шестьдесят два процента (54/87) были положительными на любом из сайтов. Как и в группе пациентов, наиболее частым местом изоляции было горло (54% положительных результатов по сравнению с 36% в передних ноздрях; P = 0,023).
Всего обследовано 346 пациентов и сотрудников; 32% были положительными в передней части носа (доверительный интервал 95%, от 27 до 37%) и 44% были положительными в области горла (доверительный интервал 95%, от 38 до 49%).Разница в частоте изоляции между передними ноздрями и глоткой была статистически значимой, со значением P , равным 0,003.
На рисунке показаны уровни изоляции персонала и пациентов за каждый месяц. Общее количество отобранных особей составило 67 человек в марте, 114 в апреле, 99 в мае, 82 в августе и 76 в сентябре. Данные за июнь и июль не представлены, поскольку большую часть этого времени отделение было закрыто. Общий уровень перевозок был самым высоким в марте (66%) и самым низким в августе (48%).Кроме того, горло носительство имело тенденцию к снижению с 58% до 38% за тот же период. При каждом взятии проб горло носительство было более частым, чем носовое.
Уровень изоляции S. aureus среди персонала и пациентов ортопедического отделения с марта по сентябрь 2003 г.
Носительство во времени.
Для изучения характера носительства S. aureus с течением времени у группы из 67 человек были повторно взяты пробы из передних ноздрей и глотки в течение до 24 месяцев.Всего был взят 521 мазок из передних отделов носа и глотки; 152 (29%) оказались положительными на S. aureus в передних ноздрях и 232 (45%) в горле.
67 человек были сгруппированы в постоянных носителей, случайных носителей и не носителей на основе ДИ, рассчитанных на основе результатов посева только из передних носовых ходов, результатов только из горла и комбинированных результатов из обоих участков (таблица). Основываясь только на результатах анализа передних носовых ходов, 25% (17/67) пациентов были классифицированы как стойкие носители, по сравнению с 58% (39/67), когда были добавлены результаты мазков из зева.Результаты культивирования в каждом случае отбора проб для 39 человек, классифицированных как стойкие носители, представлены на рис.
Носительство S. aureus в передних ноздрях и глотке среди 39 постоянных носителей. Красный прямоугольник представляет положительные результаты только для передних ноздрей в этом случае отбора проб, оранжевый прямоугольник означает положительный результат для передних ноздрей и горла, желтый прямоугольник дает положительный результат только для горла, синий прямоугольник отрицательный в обоих местах, а серый прямоугольник означает образец не был взят.Буква (ы) в каждом поле обозначает клональный тип (ы) выделенного штамма S. aureus , как определено с помощью PFGE. В оранжевых квадратах (положительный результат в передних ноздрях и глотке) первая буква дает клональный тип в передних ноздрях, а вторая — в глотке. «$» Представляет клональный тип, уникальный для данного человека. Время отбора проб указано вверху со следующими сокращениями: M3, март 2003 г .; A, апрель 2003 г .; Mj, май-июнь 2003 г .; Jn, июнь 2003 г .; J, июль 2003 г .; Au, август 2003 г .; S, сентябрь 2003 г .; О, октябрь 2003 г .; N, ноябрь 2003 г .; D, декабрь 2003 г .; J, январь 2004 г .; F, февраль 2004 г .; M4, март 2004 г .; A5, апрель 2005 г.
ТАБЛИЦА 2.
Результаты от 67 человек, повторно взятых из передних носовых ходов и горла не менее пяти раз в течение 25 месяцев a
| Группа | Количество (%) лиц в группе, классифицирован по культуре из: | |||
|---|---|---|---|---|
| Ноздри | Горло | Ноздри или горло | ||
| Постоянные носители | 17 (25) | 31 (46) | 39 (58) | 9014 | 18 (27) | 14 (21) |
| Несущих | 29 (43) | 18 (27) | 14 (21) | |
На основе наиболее часто встречающихся мест перевозки Со временем 39 постоянных носителей можно сгруппировать в следующие группы: предпочтительные носители передних нервов, т.е.д., особи с положительным результатом только в передних ноздрях более чем в половине случаев отбора проб; предпочтительные носители горла, т. е. люди с положительным результатом только в горле более чем в половине случаев; преимущественно носители переднего носа / глотки, т. е. люди с положительным результатом в переднем отделе ноздрей и глотки более чем в половине случаев; и неопределимые носители, постоянные носители со смешанной схемой перевозки на основе места отбора проб. Согласно этим определениям, 5% постоянных носителей были предпочтительными носителями передних нервов (индивиды 1 и 2 [Рис.]), 38% были предпочтительными носителями горла (люди от 3 до 17 [Рис.]), 28% были предпочтительными носителями передней части носа / горла (люди от 18 до 28 [Рис.]), И еще 28% имели смешанный характер носительства. по месту отбора (особи от 29 до 39 [рис.]) (таблица).
ТАБЛИЦА 3.
Результаты 39 стойких носителей S. aureus , сгруппированных по наиболее частым местам носительства
| Группа a | Количество (%) лиц в группе | Средн. №выборок | Ср. ДИ | Ср. период исследования (мес.) | Ср. время носителя (мес) | Ср. одного и того же штамма, содержащегося в: | |
|---|---|---|---|---|---|---|---|
| Ноздри | Горло | ||||||
| Прив. Перевозчики нарис | 2 (5) | 7,0 | 0,8 | 25 | 25 | 15 | 0 |
| Прив. горловины | 15 (38) | 7,8 | 0,8 | 21 | 17 | 0 | 13 |
| Прив.нарис / горловые держатели | 11 (28) | 7,8 | 1,0 | 25 | 25 | 21 | 19 |
| Несъемные держатели | 11 (28) | 7,1 | 18 | 6 | 7 | ||
| Все | 39 | 7,6 | 0,8 | 23 | 20 | 8 | 12 |
Образцы полос SmaI PFGE для штаммов S. aureus , выделенных от четырех человек, определенных как предпочтительные носители через горло (индивидуумы 5, 9, 12 и 13 [рис.]). Время отбора проб указано над пробами со следующими сокращениями: м3, март 2003 г .; A, апрель 2003 г .; М, май 2003 г .; J, июнь 2003 г .; Au, август 2003 г .; S, сентябрь 2003 г .; N, ноябрь 2003 г .; m4, март 2004 г .; a5, апрель 2005 г.У пациента 5 в двух случаях были положительные результаты в передних ноздрях и глотке. Подчеркнуты образцы из передних ноздрей.
ОБСУЖДЕНИЕ
S. aureus чаще выделяли из глотки, чем из передних носовых ходов, в двух неродственных популяциях. Поскольку 259 пациентов были отобраны при поступлении в ортопедическое отделение, их статус колонизации, вероятно, не связан с группой или с 87 членами персонала того же отделения, которые также были отобраны.Средний возраст группы пациентов был намного выше, чем средний возраст группы персонала. Женщины были перепредставлены в обеих группах, но не наблюдалось значительной разницы в показателях изоляции между мужчинами и женщинами в группе пациентов (данные не показаны). Поэтому мы не думаем, что наши результаты связаны с полом или возрастом, и мы не думаем, что результаты представляют собой явление в одной популяции.
Наши результаты показывают, что S. aureus редко переносился только в передние ноздри.Если были колонизированы передние носовые ходы, бактерии, за редким исключением, также присутствовали в глотке. Это может иметь важные последствия. Поскольку носительство S. aureus передним носиком является хорошо задокументированным фактором риска инфицирования S. aureus (11), профилактическая деколонизация носителей была опробована с различными группами пациентов (12). Распространение MRSA среди пациентов и персонала медицинских учреждений также требует эффективных схем деколонизации.Обычно используемый протокол включает местную обработку передних носов мупироцином, иногда в сочетании с применением дезинфицирующих средств для кожи. Для большинства групп пациентов исследования не показали значительного снижения инфицирования (12, 26). Некоторым исключением являются пациенты, находящиеся на гемодиализе (5), пациенты на перитонеальном диализе (1) и пациенты общей хирургии (18). Наблюдалась реколонизация тем же штаммом S. aureus после периода лечения (17, 27).Источником бактерий в этих случаях могут быть другие места носительства на пациенте (например, горло), люди или предметы в окружающей среде пациента. Было показано, что повторное лечение приводит к развитию устойчивости к мупироцину (13, 23). Во время лечения передних носовых ходов наблюдались низкие концентрации мупироцина в горле (24). Кроме того, было поставлено под сомнение влияние назального лечения мупироцином на колонизацию горла (8, 25). В совокупности это может означать, что стандартный протокол деколонизации S.aureus может создать ситуацию, благоприятствующую развитию резистентности к мупироцину в горле у пролеченных людей. Остаточные бактерии в горле также могут быть одной из причин (из нескольких) повторной колонизации после лечения. Kluytmans и Wertheim предположили, что одним из способов повышения эффективности будущих схем лечения могло бы быть устранение S. aureus также из экстраназальных участков (12). Принимая во внимание наши результаты, лечение, также нацеленное на горло, может уменьшить проблемы с резистентностью к мупироцину и повторной колонизацией и, возможно, привести к большей эффективности с точки зрения снижения инфекции.
Большая группа преимущественно колонизировалась только в горле, в большинстве случаев одним и тем же штаммом в течение нескольких месяцев и даже лет. Очевидно, что эти люди не были бы обнаружены как носители, если бы были взяты образцы только из передних носовых ходов. Назальное носительство, по-видимому, играет центральную роль в эпидемиологии и патогенезе инфекции S. aureus (11, 12), а риски, связанные с носительством через горло, в значительной степени неизвестны. Половина предпочтительных носителей из глотки давала положительный результат на культуру передних носовых ходов хотя бы один раз за период исследования.Необходимы дальнейшие исследования, чтобы определить, какой риск представляет эта группа носителей S. aureus с точки зрения распространения микроорганизма и инфекции. Между тем, при попытке идентифицировать носителей MRSA и S. aureus в различных ситуациях представляется разумным использовать обогащенный бульон (15) и включать горло. Если нужно взять образец только с одного участка, вероятно, лучше выбрать горло, чем передние ноздри.
В этом исследовании 39 из 67 человек, или около 60%, были охарактеризованы как стойкие носители.Это примерно в два или даже три раза больше, чем указано ранее (27). Это несоответствие, вероятно, связано с сочетанием чувствительной техники скрининга, включения горла в качестве места носительства и другого определения стойкого носительства (ДИ> 0,5). Изменение определения в основном связано с группой предпочтительных носителей горла. Промежуточные отрицательные образцы, снижающие доверительный интервал для этой группы, вероятно, были связаны с ложноотрицательными результатами, а не с тем фактом, что человек стал не носителем.Этот вывод кажется разумным, поскольку в большинстве случаев один и тот же штамм был извлечен до и после отрицательных случаев отбора проб. Наблюдаемый более низкий ДИ для предпочтительных носителей глотки означает, что взятие пробы из глотки дает меньше организмов, чем отбор проб из передних носовых ходов, либо потому, что метод отбора проб неоптимален, либо, что более вероятно, потому, что в месте отбора пробы присутствует небольшое количество организмов. Вероятная причина более высокого, чем ожидалось, уровня S. aureus в горле (по сравнению с уровнем в передних ноздрях) заключается в том, что мы увеличили чувствительность, используя обогащенный бульон.Использование того же бульона с метициллином увеличивало скорость выделения MRSA на 35% в предыдущем исследовании (15).
Мы наблюдали почти на 20% более высокий уровень носительства S. aureus в весенние месяцы марта и апреля, чем в летний август. Более высокая частота была более выражена для горла. Поскольку колонизация и прикрепление S. aureus (и других бактерий) к глотке увеличивается во время вирусной инфекции (7, 19), объяснение может заключаться в том, что пик инфекций верхних дыхательных путей весной в Швеции приводит к большему количеству инфекций. колонизированы особи.Кроме того, вирусные инфекции вызывают увеличение количества бактерий в горле, тем самым повышая вероятность получения положительной культуры. Эти сезонные колебания, вероятно, также являются объяснением наблюдаемого более чем на 10% более высокого процента носителей среди персонала, чем среди пациентов. Первые пробы у большинства сотрудников были взяты в марте, но пациенты отбирались с марта по сентябрь. Насколько нам известно, сезонная вариация носительства S. aureus ранее не описывалась, но заслуживает дальнейшего внимания.
В заключение, глотку следует рассматривать как важное место носительства S. aureus , и его следует учитывать при скрининге на S. aureus , включая MRSA. Наши результаты также показывают, что носительство S. aureus в передних носовых ходах в большинстве случаев указывает на присутствие микроорганизма в горле, хотя и в меньших количествах. Это необходимо учитывать при разработке протоколов деколонизации.
Благодарности
Этот проект частично финансировался за счет исследовательского гранта Совета графства Халланд, Швеция.
Мы благодарны персоналу ортопедического отделения и отделения клинической микробиологии окружной больницы Хальмстада, Швеция, за помощь со сбором образцов. Эксперименты по гель-электрофорезу в импульсном поле были выполнены с большим мастерством микробиологом Усамой Назаром.
СПИСОК ЛИТЕРАТУРЫ
1. Американское общество нефрологов. 1996. Назальный мупироцин предотвращает инфекцию места выхода Staphylococcus aureus во время перитонеального диализа. Варенье. Soc. Нефрол.7 : 2403-2408. [PubMed] [Google Scholar] 2. Баннерман, Т. Л., Г. А. Хэнкок, Ф. К. Теновер и Дж. М. Миллер. 1995. Гель-электрофорез в импульсном поле вместо бактериофагового типирования Staphylococcus aureus . J. Clin. Microbiol. 33 : 551-555. [Бесплатная статья PMC] [PubMed] [Google Scholar] 3. Беркович М., М. Булковштейн, Д. Жовтис, Р. Гринберг, Ю. Ницан, Б. Барзилай и И. Болдур. 2002. Скорость колонизации бактерий в горле здоровых младенцев.Int. J. Pediatr. Оториноларингол. 63 : 19-24. [PubMed] [Google Scholar] 5. Boelaert, J. R., R. A. De Smedt, Y. A. De Baere, C. A. Godard, E. G. Matthys, M. L. Schurgers, R.F.Daneels, B.Z. Gordts и H. W. Van Landuyt. 1989. Влияние назальной мази с мупироцином кальция на заболеваемость Staphylococcus aureus инфекциями у пациентов, находящихся на гемодиализе. Нефрол. Набирать номер. Пересадка. 4 : 278-281. [PubMed] [Google Scholar] 6. Эриксен, Н. Х., Ф.Эсперсен, В. Т. Росдаль и К. Йенсен. 1995. Носительство Staphylococcus aureus среди 104 здоровых лиц в течение 19 месяцев. Эпидемиол. Заразить. 115 : 51-60. [Бесплатная статья PMC] [PubMed] [Google Scholar] 7. Файнштейн В., Д. М. Мушер и Т. Р. Кейт. 1980. Прилипание бактерий к клеткам глотки во время вирусной инфекции. J. Infect. Дис. 141 : 172-176. [PubMed] [Google Scholar] 8. Хаякава Т., Т. Хаясидера, С. Кацура, К. Йонеда и Т.Кусуноки. 2000. Назальное лечение мупироцином метициллин-резистентных, колонизированных глоткой. Staphylococcus aureus : предварительное исследование с участием 10 младенцев-носителей. Педиатр. Int. 42 : 67-70. [PubMed] [Google Scholar] 9. Хаякава Т., Т. Хаясидера, К. Йонеда, С. Кагава и Т. Кусуноки. 1999. Преимущественная колонизация глотки метициллин-резистентным Staphylococcus aureus у младенцев. J. Pediatr. 134 : 252. [PubMed] [Google Scholar] 10. Ху, Л., А. Умеда, С. Кондо, К. Амако. 1995. Типирование Staphylococcus aureus , колонизирующего носовые носители человека с помощью гель-электрофореза в импульсном поле. J. Med. Microbiol. 42 : 127-132. [PubMed] [Google Scholar] 11. Клюйтманс, Дж., А. ван Белкум и Х. Вербру. 1997. Носительство золотистого стафилококка : эпидемиология, основные механизмы и связанные риски. Clin. Microbiol. Ред. 10 : 505-520. [Бесплатная статья PMC] [PubMed] [Google Scholar] 12. Kluytmans, J. A., and H. F. Wertheim. 2005. Носительство Staphylococcus aureus и профилактика внутрибольничных инфекций. Инфекция 33 : 3-8. [PubMed] [Google Scholar] 13. М. Крескен, Д. Хафнер, Ф. Дж. Шмитц и Т. А. Вихельхаус. 2004. Распространенность устойчивости к мупироцину у клинических изолятов Staphylococcus aureus и Staphylococcus epidermidis : результаты исследования устойчивости к противомикробным препаратам Общества химиотерапии Поля-Эрлиха, 2001.Int. J. Antimicrob. Агенты 23 : 577-581. [PubMed] [Google Scholar] 14. Lowy, F. D. 1998. Staphylococcus aureus, инфекции. N. Engl. J. Med. 339 : 520-532. [PubMed] [Google Scholar] 15. Нильссон П., Х. Александерссон и Т. Рипа. 2005. Использование обогащения бульона и ПЦР в реальном времени для исключения присутствия метициллин-устойчивого Staphylococcus aureus в клинических образцах: чувствительный подход к скринингу. Clin. Microbiol. Заразить.11 : 1027-1034. [PubMed] [Google Scholar] 16. Паррас Ф., М. К. Герреро, Э. Боуза, М. Х. Бласкес, С. Морено, М. К. Менаргес и Э. Серценадо. 1995. Сравнительное исследование мупироцина и перорального ко-тримоксазола плюс местная фузидиевая кислота в искоренении носительства метициллин-резистентного Staphylococcus aureus . Противомикробный. Агенты Chemother. 39 : 175-179. [Бесплатная статья PMC] [PubMed] [Google Scholar] 17. Пена, К., Н. Фернандес-Сабе, М. А. Домингес, М.Pujol, A. Martinez-Castelao, J. Ayats, F. Gudiol и J. Ariza. 2004. Staphylococcus aureus носительство в носу у пациентов на гемодиализе: роль кожной колонизации. J. Hosp. Заразить. 58 : 20-27. [PubMed] [Google Scholar] 18. Перл, Т. М., Дж. Дж. Каллен, Р. П. Венцель, М. Б. Циммерман, М. А. Пфаллер, Д. Шеппард, Дж. Туомбли, П. П. Френч и Л. А. Хервальд. 2002. Мупироцин для интраназального введения для профилактики послеоперационных инфекций, вызванных Staphylococcus aureus. N. Engl.J. Med. 346 : 1871-1877. [PubMed] [Google Scholar] 19. Рамирес-Ронда, К. Х., З. Фуксенч-Лопес и М. Неварес. 1981. Повышенная бактериальная колонизация глотки при вирусном заболевании. Arch. Междунар. Med. 141 : 1599-1603. [PubMed] [Google Scholar] 20. Рейган Д. Р., Б. Н. Доббелинг, М. А. Пфаллер, К. Т. Шитц, А. К. Хьюстон, Р. Дж. Холлис и Р. П. Венцель. 1991. Ликвидация совпадающего носового и ручного стафилококка золотистого стафилококка с помощью интраназального применения кальциевой мази мупироцина.Аня. Междунар. Med. 114 : 101-106. [PubMed] [Google Scholar] 21. Теновер, Ф. К., Р. Д. Арбайт, Р. В. Геринг, П. А. Микельсен, Б. Э. Мюррей, Д. Х. Персинг и Б. Сваминатан. 1995. Интерпретация паттернов рестрикции хромосомной ДНК, полученных с помощью гель-электрофореза в импульсном поле: критерии типирования бактериальных штаммов. J. Clin. Microbiol. 33 : 2233-2239. [Бесплатная статья PMC] [PubMed] [Google Scholar] 22. Э. Уэмура, С. Какинохана, Н. Хига, К. Тома и Н. Накасоне. 2004. Сравнительная характеристика изолятов Staphylococcus aureus из глотки и носа здоровых добровольцев. Jpn. J. Infect. Дис. 57 : 21-24. [PubMed] [Google Scholar] 23. Уокер, Э. С., Ф. Леви, М. Шорман, Г. Дэвид, Дж. Абдалла и Ф. А. Сарубби. 2004. Снижение резистентности к мупироцину у метициллин-резистентных Staphylococcus aureus сопровождалось административным контролем за назначениями. J. Clin. Microbiol. 42 : 2792-2795. [Бесплатная статья PMC] [PubMed] [Google Scholar] 24. Ватанабэ Х., Х. Масаки, Н. Асо, К. Ватанабэ, К. Оиси, С. Кобаяси, А. Сато, Р. Сугита и Т. Нагатаке. 2001. Низкие концентрации мупироцина в глотке после интраназального введения могут способствовать устойчивости к мупироцину у метициллин-резистентных Staphylococcus aureus . J. Clin. Microbiol. 39 : 3775-3777. [Бесплатная статья PMC] [PubMed] [Google Scholar] 25. Wertheim, H.F., J. Verveer, H.A. Boelens, A. van Belkum, H.A. Verbrugh и M.C. Vos. 2005. Влияние лечения мупироцином на носительство в носу, глотке и промежности Staphylococcus aureus у здоровых взрослых. Противомикробный. Агенты Chemother. 49 : 1465-1467. [Бесплатная статья PMC] [PubMed] [Google Scholar] 26. Вертхайм, Х. Ф., М. К. Вос, А. Отт, А. Восс, Дж. А. Клюйтманс, К. М. Ванденбрук-Граулс, М. Х. Мистер, П. Х. ван Койлен и Х. А. Вербру. 2004. Профилактика мупироцином против нозокомиальных инфекций Staphylococcus aureus у нехирургических пациентов: рандомизированное исследование.Аня. Междунар. Med. 140 : 419-425. [PubMed] [Google Scholar]Staphylococcus aureus Колонизация горла происходит чаще, чем колонизация передних ноздрей
J Clin Microbiol. 2006 сен; 44 (9): 3334–3339.
Петер Нильссон
Отделение клинической микробиологии и инфекционного контроля, Окружная больница Хальмстада, Хальмстад, Швеция
Торвальд Рипа
Отделение клинической микробиологии и инфекционного контроля, Окружная больница Хальмстада, Хальмстад, Швеция
Отделение Клиническая микробиология и инфекционный контроль, Окружная больница Хальмстада, Хальмстад, Швеция
* Автор, ответственный за переписку.Почтовый адрес: Отдел клинической микробиологии и инфекционного контроля, окружная больница Хальмстада, S-30185 Хальмстад, Швеция. Телефон: 46 35 136549. Факс: 46 35 131869. Электронная почта: [email protected].Поступило 26 апреля 2006 г .; Пересмотрено 10 июня 2006 г .; Принято 24 июня 2006 г.
Copyright © 2006, Американское общество микробиологов. Эта статья цитируется в других статьях в PMC.Abstract
Целью данного исследования было определение частоты и устойчивости носительства Staphylococcus aureus в глотке по отношению к носительству переднего носа.При использовании чувствительного обогащающего бульона S. aureus было культивировано из двух участков от 259 пациентов при поступлении в ортопедическое отделение и от 87 сотрудников одного отделения. Горло было наиболее частым местом носительства в обеих группах. Сорок процентов пациентов и 54% медперсонала были положительными на S. aureus в горле, по сравнению с 31% и 36%, соответственно, в передних ноздрях. Чтобы определить стойкость носительства, у 67 человек были повторно взяты пробы из передних носовых ходов и горла в течение 2 лет (от 5 до 10 раз; в среднем 7.8). Большинство, 58% (39/67), были определены как постоянные носители S. aureus с учетом результатов посева на обоих участках. Из 39 постоянных носителей 15 человек имели положительный результат посева только из глотки более чем в половине случаев отбора проб (они называются предпочтительными носителями из глотки), в то время как только 5% (два человека) были предпочтительными носителями передних нервных окончаний согласно тому же определению . Типирование собранных изолятов S. aureus с помощью гель-электрофореза в импульсном поле показало, что тот же штамм S.aureus с течением времени присутствовал в глотке человека, по крайней мере, в той же степени, что и в передних ноздрях. Горло-носительство было по крайней мере таким же устойчивым, как и носительство в передних ноздрях.
Помимо того, что это основной патоген для человека (14), Staphylococcus aureus колонизирует значительную часть популяций человека (27). Передние ноздри считаются первичным местом колонизации (11, 14), и примерно 30% здоровых людей переносят бактерии в передних ноздрях.Уровень носительства, близкий к 60%, был описан ранее для определенных популяций (11). Человеческое горло менее изучено как место носительства, и ранее сообщалось о различных уровнях изоляции. Boe et al. сообщили о частоте изоляции 31% пациентов, помещенных в медицинское отделение (4), а Uemura et al. сообщили, что уровень изоляции в группе здоровых взрослых добровольцев составил 29% (22). Беркович и др. обнаружили бактерии в горле у 10% здоровых детей в возрасте до 2 лет (3). Также были отмечены более высокие, чем ожидалось, показатели устойчивости к метициллину S.aureus (MRSA) в горле младенцев (9). Область промежности, по-видимому, является обычным местом носительства, но редко является единственным местом колонизации (4). Также ранее было описано носительство на различных участках кожи. Однако это, по-видимому, вторично по отношению к носительству или инфекции в других местах, поскольку удаление носовых колоний с помощью местного лечения в большинстве случаев устраняет носительство через кожу (16, 20).
Были описаны три основных типа носительства, когда у людей неоднократно брали пробы в передних ноздрях на S.aureus в течение более длительного периода. Сообщалось, что от 6 до 60% никогда не были переносчиками микроорганизмов (не носители), а от 14 до 33% были повторно положительными по культуре (постоянные носители). Остальные особи время от времени дают положительные культуры и характеризуются как случайные или периодические носители (6, 10, 27). Различия между исследованиями могут быть связаны с различными методами выборки и / или вариациями в определениях различных состояний носителей. Постоянные носители, как правило, с течением времени несут один и тот же тип или генотип фага чаще, чем прерывистые и случайные носители (6, 27).Насколько нам известно, структура носительства с течением времени не исследовалась ни в одном месте отбора проб, кроме передних ноздрей.
Целью этого исследования было определение частоты и устойчивости носительства в глотке по сравнению с носительством переднего нареза S. aureus . Мы использовали метод чувствительной культуры, чтобы свести к минимуму ошибки, возникающие из-за низкой скорости восстановления. Все изоляты были генотипированы с помощью гель-электрофореза в импульсном поле SmaI (PFGE).
МАТЕРИАЛЫ И МЕТОДЫ
Пациенты и
S.aureus отбор проб.Все образцы были собраны в рамках плановой схемы эпиднадзора за инфекциями в окружной больнице Хальмстада, Швеция.
Образцы были собраны с помощью тампона с вискозным наконечником и угольной транспортной среды Amies (114C.US) (Копан, Италия). Образцы из передних ноздрей брали путем вращения кончика тампона в обеих ноздрях, а из горла — путем вращения кончика тампона на обеих миндалинах.
Пациенты, поступившие в ортопедическое отделение окружной больницы Хальмстада, Швеция, с марта по сентябрь 2003 г., по прибытии были исследованы на предмет наличия S.aureus . Среди 259 отобранных пациентов 62% составляли женщины, средний возраст 74,4 года, и 38% — мужчины, средний возраст 64,3 года. В марте было взято 20 пациентов, 72 — в апреле, 57 — в мае, 20 — в июне, 17 — в июле, 38 — в августе и 35 — в сентябре.
Персонал ортопедического отделения был проинструктирован самостоятельно взять мазок, вращая тампон в обоих передних носовых ходах и отдельный тампон на обеих миндалинах. Пробы брались у всех дежурных сотрудников в течение 1 недели каждый месяц с марта по сентябрь 2003 г. (за исключением июня и июля, когда палата была закрыта большую часть времени), а затем в течение 1 недели в ноябре 2003 г., марте 2004 г. и апреле. 2005 г., всего девять раз.Не все сотрудники были доступны постоянно, и в течение периода исследования были включены новые сотрудники. Всего в ортопедическом отделении было отобрано 87 отдельных сотрудников (70 женщин, средний возраст 40 лет, и 17 мужчин, средний возраст 34 года).
У группы из 67 человек повторно брали пробы из передних носовых ходов и глотки в течение 24 месяцев. Группа состояла из 34 сотрудников ортопедического отделения и 33 сотрудников отделения клинической микробиологии и инфекционного контроля окружной больницы Хальмстада, Швеция.Из этих 67 человек 63 были женщинами и 4 мужчинами, их средний возраст на момент первого отбора проб составлял 44 года. В период с марта 2003 г. по март 2005 г. они отбирались как минимум пять раз (в среднем 7,8 раз; диапазон от 5 до 10). Всего было собрано 384 изолята S. aureus , и их клональные отношения были определены с помощью анализа PFGE.
S. aureus , изоляция.Все образцы мазков инкубировали в течение 16–18 ч при 37 ° C в шейкере (100 об / мин) в аэробных условиях в 3 мл обогащающего бульона со следующим составом: 15.0 г протеозопептона (Oxoid, Бейзингсток, Англия), 2,5 г печеночного переваривающего вещества (Oxoid), 5,0 г дрожжевого экстракта (Oxoid), 25,0 г NaCl, 10,0 г маннита, 16 мг / л фенилового красного и 8 мг азтреонама в финальной стадии. объем 1 литр (конечный pH 7,0 ± 0,1). Затем порцию (10 мкл) бульона высевали на чашку с кровяным агаром и инкубировали при 37 ° C в течение ночи. Подозреваемые колонии были выделены на чашке с кровяным агаром и идентифицированы как S. aureus с использованием теста ДНКазы и латексного теста Staphaurex (Remel Europe Ltd., Дартфорд, Англия). Когда эти методы не совпадали, присутствие гена термостабильной нуклеазы анализировали с помощью ПЦР, как описано Nilsson et al. (15). Один единственный изолят S. aureus был выделен из каждого образца. Возможное присутствие более одного штамма в каждом образце не учитывалось. Все изолированные штаммы S. aureus собирали и хранили при -70 ° C для дальнейшего анализа.
ПФГЭ.
Штаммы, собранные в ходе исследования, были проанализированы с помощью PFGE, как описано Bannerman et al.(2). Структуры полос изолятов анализировали с использованием программного обеспечения Molecular Analyst, версия 1.6 (Bio-Rad Laboratories, Геркулес, Калифорния), методом групповой кластеризации невзвешенных пар с использованием средних связей и коэффициента Дайса. Штаммы с более чем 80% сходством были сгруппированы в клональные группы и названы с заглавной буквы от A до X. Изоляты от одного и того же человека, но собранные в разных случаях, также сравнивали друг с другом. Во всех случаях, когда они принадлежали к одной и той же клональной группе, они находились в пределах трех разностей полос (21).Это означает, что изоляты от разных индивидуумов, но названные одной и той же буквой, имели не менее 80% сходства при компьютерном кластерном анализе, в то время как изоляты от одного индивидуума с тем же именем имели различия <4 полос.
Расчеты и определения.
Индекс носителя (ДИ) был определен как количество положительных мазков, деленное на общее количество мазков для каждого человека, как описано Eriksen et al. (6). Однако определения состояний носителей отличаются от определений, используемых Eriksen et al.В нашей работе постоянный носитель определяется как человек с CI> 0,5; для случайного носителя 0
РЕЗУЛЬТАТЫ
Носительство S. aureus у пациентов и персонала.В течение периода исследования с марта 2003 г. по сентябрь 2003 г. у 259 пациентов, поступивших в ортопедическое отделение, были взяты образцы при поступлении как в передние ноздри, так и в глотку. Скорость выделения S. aureus из разных участков представлена в таблице.В общей сложности S. aureus было выделено у 125 из 259 пациентов (48%) на любом из участков. Наиболее частым местом изоляции было горло (40% пациентов), за которым следовали передние ноздри (31% пациентов). Разница в частоте изоляции между передними ноздрями и глоткой была статистически значимой ( P = 0,037). Если бы передние ноздри были единственным местом скрининга, было бы идентифицировано 64% (80/125) из носителей S. aureus , тогда как взятие пробы только из глотки позволило бы идентифицировать 83% (104/125).Не было обнаружено значительных различий между мужчинами и женщинами в отношении показателей изоляции из разных участков (данные не показаны).
ТАБЛИЦА 1.
Степень изоляции S. aureus в передних ноздрях и горле среди пациентов и персонала ортопедического отделения
| Результат для ноздрей a | Результат для горла a | Количество (%) лиц с результатом | ||
|---|---|---|---|---|
| Пациенты | Персонал | Пациенты и персонал | ||
| Поз. | Поз. | 59 (23) | 24 (28) | 83 (24) Поз. | 21 (8) | 7 (8) | 28 (8) |
| Отрицательный | Поз. | 45 (17) | 23 (26) | 68 (20) |
| Отрицательный | Отр. | 134 (52) | 33 (38) | 167 (48) |
| Итого | 259 | 87 | 346 | |
За период исследования Персоналу отделения предлагалось ежемесячно проводить забор образцов из носа и горла.В таблице мы суммировали частоту выделения S. aureus при первом взятии проб у 87 сотрудников. Шестьдесят два процента (54/87) были положительными на любом из сайтов. Как и в группе пациентов, наиболее частым местом изоляции было горло (54% положительных результатов по сравнению с 36% в передних ноздрях; P = 0,023).
Всего обследовано 346 пациентов и сотрудников; 32% были положительными в передней части носа (доверительный интервал 95%, от 27 до 37%) и 44% были положительными в области горла (доверительный интервал 95%, от 38 до 49%).Разница в частоте изоляции между передними ноздрями и глоткой была статистически значимой, со значением P , равным 0,003.
На рисунке показаны уровни изоляции персонала и пациентов за каждый месяц. Общее количество отобранных особей составило 67 человек в марте, 114 в апреле, 99 в мае, 82 в августе и 76 в сентябре. Данные за июнь и июль не представлены, поскольку большую часть этого времени отделение было закрыто. Общий уровень перевозок был самым высоким в марте (66%) и самым низким в августе (48%).Кроме того, горло носительство имело тенденцию к снижению с 58% до 38% за тот же период. При каждом взятии проб горло носительство было более частым, чем носовое.
Уровень изоляции S. aureus среди персонала и пациентов ортопедического отделения с марта по сентябрь 2003 г.
Носительство во времени.
Для изучения характера носительства S. aureus с течением времени у группы из 67 человек были повторно взяты пробы из передних ноздрей и глотки в течение до 24 месяцев.Всего был взят 521 мазок из передних отделов носа и глотки; 152 (29%) оказались положительными на S. aureus в передних ноздрях и 232 (45%) в горле.
67 человек были сгруппированы в постоянных носителей, случайных носителей и не носителей на основе ДИ, рассчитанных на основе результатов посева только из передних носовых ходов, результатов только из горла и комбинированных результатов из обоих участков (таблица). Основываясь только на результатах анализа передних носовых ходов, 25% (17/67) пациентов были классифицированы как стойкие носители, по сравнению с 58% (39/67), когда были добавлены результаты мазков из зева.Результаты культивирования в каждом случае отбора проб для 39 человек, классифицированных как стойкие носители, представлены на рис.
Носительство S. aureus в передних ноздрях и глотке среди 39 постоянных носителей. Красный прямоугольник представляет положительные результаты только для передних ноздрей в этом случае отбора проб, оранжевый прямоугольник означает положительный результат для передних ноздрей и горла, желтый прямоугольник дает положительный результат только для горла, синий прямоугольник отрицательный в обоих местах, а серый прямоугольник означает образец не был взят.Буква (ы) в каждом поле обозначает клональный тип (ы) выделенного штамма S. aureus , как определено с помощью PFGE. В оранжевых квадратах (положительный результат в передних ноздрях и глотке) первая буква дает клональный тип в передних ноздрях, а вторая — в глотке. «$» Представляет клональный тип, уникальный для данного человека. Время отбора проб указано вверху со следующими сокращениями: M3, март 2003 г .; A, апрель 2003 г .; Mj, май-июнь 2003 г .; Jn, июнь 2003 г .; J, июль 2003 г .; Au, август 2003 г .; S, сентябрь 2003 г .; О, октябрь 2003 г .; N, ноябрь 2003 г .; D, декабрь 2003 г .; J, январь 2004 г .; F, февраль 2004 г .; M4, март 2004 г .; A5, апрель 2005 г.
ТАБЛИЦА 2.
Результаты от 67 человек, повторно взятых из передних носовых ходов и горла не менее пяти раз в течение 25 месяцев a
| Группа | Количество (%) лиц в группе, классифицирован по культуре из: | |||
|---|---|---|---|---|
| Ноздри | Горло | Ноздри или горло | ||
| Постоянные носители | 17 (25) | 31 (46) | 39 (58) | 9014 | 18 (27) | 14 (21) |
| Несущих | 29 (43) | 18 (27) | 14 (21) | |
На основе наиболее часто встречающихся мест перевозки Со временем 39 постоянных носителей можно сгруппировать в следующие группы: предпочтительные носители передних нервов, т.е.д., особи с положительным результатом только в передних ноздрях более чем в половине случаев отбора проб; предпочтительные носители горла, т. е. люди с положительным результатом только в горле более чем в половине случаев; преимущественно носители переднего носа / глотки, т. е. люди с положительным результатом в переднем отделе ноздрей и глотки более чем в половине случаев; и неопределимые носители, постоянные носители со смешанной схемой перевозки на основе места отбора проб. Согласно этим определениям, 5% постоянных носителей были предпочтительными носителями передних нервов (индивиды 1 и 2 [Рис.]), 38% были предпочтительными носителями горла (люди от 3 до 17 [Рис.]), 28% были предпочтительными носителями передней части носа / горла (люди от 18 до 28 [Рис.]), И еще 28% имели смешанный характер носительства. по месту отбора (особи от 29 до 39 [рис.]) (таблица).
ТАБЛИЦА 3.
Результаты 39 стойких носителей S. aureus , сгруппированных по наиболее частым местам носительства
| Группа a | Количество (%) лиц в группе | Средн. №выборок | Ср. ДИ | Ср. период исследования (мес.) | Ср. время носителя (мес) | Ср. одного и того же штамма, содержащегося в: | |
|---|---|---|---|---|---|---|---|
| Ноздри | Горло | ||||||
| Прив. Перевозчики нарис | 2 (5) | 7,0 | 0,8 | 25 | 25 | 15 | 0 |
| Прив. горловины | 15 (38) | 7,8 | 0,8 | 21 | 17 | 0 | 13 |
| Прив.нарис / горловые держатели | 11 (28) | 7,8 | 1,0 | 25 | 25 | 21 | 19 |
| Несъемные держатели | 11 (28) | 7,1 | 18 | 6 | 7 | ||
| Все | 39 | 7,6 | 0,8 | 23 | 20 | 8 | 12 |
Образцы полос SmaI PFGE для штаммов S. aureus , выделенных от четырех человек, определенных как предпочтительные носители через горло (индивидуумы 5, 9, 12 и 13 [рис.]). Время отбора проб указано над пробами со следующими сокращениями: м3, март 2003 г .; A, апрель 2003 г .; М, май 2003 г .; J, июнь 2003 г .; Au, август 2003 г .; S, сентябрь 2003 г .; N, ноябрь 2003 г .; m4, март 2004 г .; a5, апрель 2005 г.У пациента 5 в двух случаях были положительные результаты в передних ноздрях и глотке. Подчеркнуты образцы из передних ноздрей.
ОБСУЖДЕНИЕ
S. aureus чаще выделяли из глотки, чем из передних носовых ходов, в двух неродственных популяциях. Поскольку 259 пациентов были отобраны при поступлении в ортопедическое отделение, их статус колонизации, вероятно, не связан с группой или с 87 членами персонала того же отделения, которые также были отобраны.Средний возраст группы пациентов был намного выше, чем средний возраст группы персонала. Женщины были перепредставлены в обеих группах, но не наблюдалось значительной разницы в показателях изоляции между мужчинами и женщинами в группе пациентов (данные не показаны). Поэтому мы не думаем, что наши результаты связаны с полом или возрастом, и мы не думаем, что результаты представляют собой явление в одной популяции.
Наши результаты показывают, что S. aureus редко переносился только в передние ноздри.Если были колонизированы передние носовые ходы, бактерии, за редким исключением, также присутствовали в глотке. Это может иметь важные последствия. Поскольку носительство S. aureus передним носиком является хорошо задокументированным фактором риска инфицирования S. aureus (11), профилактическая деколонизация носителей была опробована с различными группами пациентов (12). Распространение MRSA среди пациентов и персонала медицинских учреждений также требует эффективных схем деколонизации.Обычно используемый протокол включает местную обработку передних носов мупироцином, иногда в сочетании с применением дезинфицирующих средств для кожи. Для большинства групп пациентов исследования не показали значительного снижения инфицирования (12, 26). Некоторым исключением являются пациенты, находящиеся на гемодиализе (5), пациенты на перитонеальном диализе (1) и пациенты общей хирургии (18). Наблюдалась реколонизация тем же штаммом S. aureus после периода лечения (17, 27).Источником бактерий в этих случаях могут быть другие места носительства на пациенте (например, горло), люди или предметы в окружающей среде пациента. Было показано, что повторное лечение приводит к развитию устойчивости к мупироцину (13, 23). Во время лечения передних носовых ходов наблюдались низкие концентрации мупироцина в горле (24). Кроме того, было поставлено под сомнение влияние назального лечения мупироцином на колонизацию горла (8, 25). В совокупности это может означать, что стандартный протокол деколонизации S.aureus может создать ситуацию, благоприятствующую развитию резистентности к мупироцину в горле у пролеченных людей. Остаточные бактерии в горле также могут быть одной из причин (из нескольких) повторной колонизации после лечения. Kluytmans и Wertheim предположили, что одним из способов повышения эффективности будущих схем лечения могло бы быть устранение S. aureus также из экстраназальных участков (12). Принимая во внимание наши результаты, лечение, также нацеленное на горло, может уменьшить проблемы с резистентностью к мупироцину и повторной колонизацией и, возможно, привести к большей эффективности с точки зрения снижения инфекции.
Большая группа преимущественно колонизировалась только в горле, в большинстве случаев одним и тем же штаммом в течение нескольких месяцев и даже лет. Очевидно, что эти люди не были бы обнаружены как носители, если бы были взяты образцы только из передних носовых ходов. Назальное носительство, по-видимому, играет центральную роль в эпидемиологии и патогенезе инфекции S. aureus (11, 12), а риски, связанные с носительством через горло, в значительной степени неизвестны. Половина предпочтительных носителей из глотки давала положительный результат на культуру передних носовых ходов хотя бы один раз за период исследования.Необходимы дальнейшие исследования, чтобы определить, какой риск представляет эта группа носителей S. aureus с точки зрения распространения микроорганизма и инфекции. Между тем, при попытке идентифицировать носителей MRSA и S. aureus в различных ситуациях представляется разумным использовать обогащенный бульон (15) и включать горло. Если нужно взять образец только с одного участка, вероятно, лучше выбрать горло, чем передние ноздри.
В этом исследовании 39 из 67 человек, или около 60%, были охарактеризованы как стойкие носители.Это примерно в два или даже три раза больше, чем указано ранее (27). Это несоответствие, вероятно, связано с сочетанием чувствительной техники скрининга, включения горла в качестве места носительства и другого определения стойкого носительства (ДИ> 0,5). Изменение определения в основном связано с группой предпочтительных носителей горла. Промежуточные отрицательные образцы, снижающие доверительный интервал для этой группы, вероятно, были связаны с ложноотрицательными результатами, а не с тем фактом, что человек стал не носителем.Этот вывод кажется разумным, поскольку в большинстве случаев один и тот же штамм был извлечен до и после отрицательных случаев отбора проб. Наблюдаемый более низкий ДИ для предпочтительных носителей глотки означает, что взятие пробы из глотки дает меньше организмов, чем отбор проб из передних носовых ходов, либо потому, что метод отбора проб неоптимален, либо, что более вероятно, потому, что в месте отбора пробы присутствует небольшое количество организмов. Вероятная причина более высокого, чем ожидалось, уровня S. aureus в горле (по сравнению с уровнем в передних ноздрях) заключается в том, что мы увеличили чувствительность, используя обогащенный бульон.Использование того же бульона с метициллином увеличивало скорость выделения MRSA на 35% в предыдущем исследовании (15).
Мы наблюдали почти на 20% более высокий уровень носительства S. aureus в весенние месяцы марта и апреля, чем в летний август. Более высокая частота была более выражена для горла. Поскольку колонизация и прикрепление S. aureus (и других бактерий) к глотке увеличивается во время вирусной инфекции (7, 19), объяснение может заключаться в том, что пик инфекций верхних дыхательных путей весной в Швеции приводит к большему количеству инфекций. колонизированы особи.Кроме того, вирусные инфекции вызывают увеличение количества бактерий в горле, тем самым повышая вероятность получения положительной культуры. Эти сезонные колебания, вероятно, также являются объяснением наблюдаемого более чем на 10% более высокого процента носителей среди персонала, чем среди пациентов. Первые пробы у большинства сотрудников были взяты в марте, но пациенты отбирались с марта по сентябрь. Насколько нам известно, сезонная вариация носительства S. aureus ранее не описывалась, но заслуживает дальнейшего внимания.
В заключение, глотку следует рассматривать как важное место носительства S. aureus , и его следует учитывать при скрининге на S. aureus , включая MRSA. Наши результаты также показывают, что носительство S. aureus в передних носовых ходах в большинстве случаев указывает на присутствие микроорганизма в горле, хотя и в меньших количествах. Это необходимо учитывать при разработке протоколов деколонизации.
Благодарности
Этот проект частично финансировался за счет исследовательского гранта Совета графства Халланд, Швеция.
Мы благодарны персоналу ортопедического отделения и отделения клинической микробиологии окружной больницы Хальмстада, Швеция, за помощь со сбором образцов. Эксперименты по гель-электрофорезу в импульсном поле были выполнены с большим мастерством микробиологом Усамой Назаром.
СПИСОК ЛИТЕРАТУРЫ
1. Американское общество нефрологов. 1996. Назальный мупироцин предотвращает инфекцию места выхода Staphylococcus aureus во время перитонеального диализа. Варенье. Soc. Нефрол.7 : 2403-2408. [PubMed] [Google Scholar] 2. Баннерман, Т. Л., Г. А. Хэнкок, Ф. К. Теновер и Дж. М. Миллер. 1995. Гель-электрофорез в импульсном поле вместо бактериофагового типирования Staphylococcus aureus . J. Clin. Microbiol. 33 : 551-555. [Бесплатная статья PMC] [PubMed] [Google Scholar] 3. Беркович М., М. Булковштейн, Д. Жовтис, Р. Гринберг, Ю. Ницан, Б. Барзилай и И. Болдур. 2002. Скорость колонизации бактерий в горле здоровых младенцев.Int. J. Pediatr. Оториноларингол. 63 : 19-24. [PubMed] [Google Scholar] 5. Boelaert, J. R., R. A. De Smedt, Y. A. De Baere, C. A. Godard, E. G. Matthys, M. L. Schurgers, R.F.Daneels, B.Z. Gordts и H. W. Van Landuyt. 1989. Влияние назальной мази с мупироцином кальция на заболеваемость Staphylococcus aureus инфекциями у пациентов, находящихся на гемодиализе. Нефрол. Набирать номер. Пересадка. 4 : 278-281. [PubMed] [Google Scholar] 6. Эриксен, Н. Х., Ф.Эсперсен, В. Т. Росдаль и К. Йенсен. 1995. Носительство Staphylococcus aureus среди 104 здоровых лиц в течение 19 месяцев. Эпидемиол. Заразить. 115 : 51-60. [Бесплатная статья PMC] [PubMed] [Google Scholar] 7. Файнштейн В., Д. М. Мушер и Т. Р. Кейт. 1980. Прилипание бактерий к клеткам глотки во время вирусной инфекции. J. Infect. Дис. 141 : 172-176. [PubMed] [Google Scholar] 8. Хаякава Т., Т. Хаясидера, С. Кацура, К. Йонеда и Т.Кусуноки. 2000. Назальное лечение мупироцином метициллин-резистентных, колонизированных глоткой. Staphylococcus aureus : предварительное исследование с участием 10 младенцев-носителей. Педиатр. Int. 42 : 67-70. [PubMed] [Google Scholar] 9. Хаякава Т., Т. Хаясидера, К. Йонеда, С. Кагава и Т. Кусуноки. 1999. Преимущественная колонизация глотки метициллин-резистентным Staphylococcus aureus у младенцев. J. Pediatr. 134 : 252. [PubMed] [Google Scholar] 10. Ху, Л., А. Умеда, С. Кондо, К. Амако. 1995. Типирование Staphylococcus aureus , колонизирующего носовые носители человека с помощью гель-электрофореза в импульсном поле. J. Med. Microbiol. 42 : 127-132. [PubMed] [Google Scholar] 11. Клюйтманс, Дж., А. ван Белкум и Х. Вербру. 1997. Носительство золотистого стафилококка : эпидемиология, основные механизмы и связанные риски. Clin. Microbiol. Ред. 10 : 505-520. [Бесплатная статья PMC] [PubMed] [Google Scholar] 12. Kluytmans, J. A., and H. F. Wertheim. 2005. Носительство Staphylococcus aureus и профилактика внутрибольничных инфекций. Инфекция 33 : 3-8. [PubMed] [Google Scholar] 13. М. Крескен, Д. Хафнер, Ф. Дж. Шмитц и Т. А. Вихельхаус. 2004. Распространенность устойчивости к мупироцину у клинических изолятов Staphylococcus aureus и Staphylococcus epidermidis : результаты исследования устойчивости к противомикробным препаратам Общества химиотерапии Поля-Эрлиха, 2001.Int. J. Antimicrob. Агенты 23 : 577-581. [PubMed] [Google Scholar] 14. Lowy, F. D. 1998. Staphylococcus aureus, инфекции. N. Engl. J. Med. 339 : 520-532. [PubMed] [Google Scholar] 15. Нильссон П., Х. Александерссон и Т. Рипа. 2005. Использование обогащения бульона и ПЦР в реальном времени для исключения присутствия метициллин-устойчивого Staphylococcus aureus в клинических образцах: чувствительный подход к скринингу. Clin. Microbiol. Заразить.11 : 1027-1034. [PubMed] [Google Scholar] 16. Паррас Ф., М. К. Герреро, Э. Боуза, М. Х. Бласкес, С. Морено, М. К. Менаргес и Э. Серценадо. 1995. Сравнительное исследование мупироцина и перорального ко-тримоксазола плюс местная фузидиевая кислота в искоренении носительства метициллин-резистентного Staphylococcus aureus . Противомикробный. Агенты Chemother. 39 : 175-179. [Бесплатная статья PMC] [PubMed] [Google Scholar] 17. Пена, К., Н. Фернандес-Сабе, М. А. Домингес, М.Pujol, A. Martinez-Castelao, J. Ayats, F. Gudiol и J. Ariza. 2004. Staphylococcus aureus носительство в носу у пациентов на гемодиализе: роль кожной колонизации. J. Hosp. Заразить. 58 : 20-27. [PubMed] [Google Scholar] 18. Перл, Т. М., Дж. Дж. Каллен, Р. П. Венцель, М. Б. Циммерман, М. А. Пфаллер, Д. Шеппард, Дж. Туомбли, П. П. Френч и Л. А. Хервальд. 2002. Мупироцин для интраназального введения для профилактики послеоперационных инфекций, вызванных Staphylococcus aureus. N. Engl.J. Med. 346 : 1871-1877. [PubMed] [Google Scholar] 19. Рамирес-Ронда, К. Х., З. Фуксенч-Лопес и М. Неварес. 1981. Повышенная бактериальная колонизация глотки при вирусном заболевании. Arch. Междунар. Med. 141 : 1599-1603. [PubMed] [Google Scholar] 20. Рейган Д. Р., Б. Н. Доббелинг, М. А. Пфаллер, К. Т. Шитц, А. К. Хьюстон, Р. Дж. Холлис и Р. П. Венцель. 1991. Ликвидация совпадающего носового и ручного стафилококка золотистого стафилококка с помощью интраназального применения кальциевой мази мупироцина.Аня. Междунар. Med. 114 : 101-106. [PubMed] [Google Scholar] 21. Теновер, Ф. К., Р. Д. Арбайт, Р. В. Геринг, П. А. Микельсен, Б. Э. Мюррей, Д. Х. Персинг и Б. Сваминатан. 1995. Интерпретация паттернов рестрикции хромосомной ДНК, полученных с помощью гель-электрофореза в импульсном поле: критерии типирования бактериальных штаммов. J. Clin. Microbiol. 33 : 2233-2239. [Бесплатная статья PMC] [PubMed] [Google Scholar] 22. Э. Уэмура, С. Какинохана, Н. Хига, К. Тома и Н. Накасоне. 2004. Сравнительная характеристика изолятов Staphylococcus aureus из глотки и носа здоровых добровольцев. Jpn. J. Infect. Дис. 57 : 21-24. [PubMed] [Google Scholar] 23. Уокер, Э. С., Ф. Леви, М. Шорман, Г. Дэвид, Дж. Абдалла и Ф. А. Сарубби. 2004. Снижение резистентности к мупироцину у метициллин-резистентных Staphylococcus aureus сопровождалось административным контролем за назначениями. J. Clin. Microbiol. 42 : 2792-2795. [Бесплатная статья PMC] [PubMed] [Google Scholar] 24. Ватанабэ Х., Х. Масаки, Н. Асо, К. Ватанабэ, К. Оиси, С. Кобаяси, А. Сато, Р. Сугита и Т. Нагатаке. 2001. Низкие концентрации мупироцина в глотке после интраназального введения могут способствовать устойчивости к мупироцину у метициллин-резистентных Staphylococcus aureus . J. Clin. Microbiol. 39 : 3775-3777. [Бесплатная статья PMC] [PubMed] [Google Scholar] 25. Wertheim, H.F., J. Verveer, H.A. Boelens, A. van Belkum, H.A. Verbrugh и M.C. Vos. 2005. Влияние лечения мупироцином на носительство в носу, глотке и промежности Staphylococcus aureus у здоровых взрослых. Противомикробный. Агенты Chemother. 49 : 1465-1467. [Бесплатная статья PMC] [PubMed] [Google Scholar] 26. Вертхайм, Х. Ф., М. К. Вос, А. Отт, А. Восс, Дж. А. Клюйтманс, К. М. Ванденбрук-Граулс, М. Х. Мистер, П. Х. ван Койлен и Х. А. Вербру. 2004. Профилактика мупироцином против нозокомиальных инфекций Staphylococcus aureus у нехирургических пациентов: рандомизированное исследование.Аня. Междунар. Med. 140 : 419-425. [PubMed] [Google Scholar]Staphylococcus aureus Колонизация горла происходит чаще, чем колонизация передних ноздрей
J Clin Microbiol. 2006 сен; 44 (9): 3334–3339.
Петер Нильссон
Отделение клинической микробиологии и инфекционного контроля, Окружная больница Хальмстада, Хальмстад, Швеция
Торвальд Рипа
Отделение клинической микробиологии и инфекционного контроля, Окружная больница Хальмстада, Хальмстад, Швеция
Отделение Клиническая микробиология и инфекционный контроль, Окружная больница Хальмстада, Хальмстад, Швеция
* Автор, ответственный за переписку.Почтовый адрес: Отдел клинической микробиологии и инфекционного контроля, окружная больница Хальмстада, S-30185 Хальмстад, Швеция. Телефон: 46 35 136549. Факс: 46 35 131869. Электронная почта: [email protected].Поступило 26 апреля 2006 г .; Пересмотрено 10 июня 2006 г .; Принято 24 июня 2006 г.
Copyright © 2006, Американское общество микробиологов. Эта статья цитируется в других статьях в PMC.Abstract
Целью данного исследования было определение частоты и устойчивости носительства Staphylococcus aureus в глотке по отношению к носительству переднего носа.При использовании чувствительного обогащающего бульона S. aureus было культивировано из двух участков от 259 пациентов при поступлении в ортопедическое отделение и от 87 сотрудников одного отделения. Горло было наиболее частым местом носительства в обеих группах. Сорок процентов пациентов и 54% медперсонала были положительными на S. aureus в горле, по сравнению с 31% и 36%, соответственно, в передних ноздрях. Чтобы определить стойкость носительства, у 67 человек были повторно взяты пробы из передних носовых ходов и горла в течение 2 лет (от 5 до 10 раз; в среднем 7.8). Большинство, 58% (39/67), были определены как постоянные носители S. aureus с учетом результатов посева на обоих участках. Из 39 постоянных носителей 15 человек имели положительный результат посева только из глотки более чем в половине случаев отбора проб (они называются предпочтительными носителями из глотки), в то время как только 5% (два человека) были предпочтительными носителями передних нервных окончаний согласно тому же определению . Типирование собранных изолятов S. aureus с помощью гель-электрофореза в импульсном поле показало, что тот же штамм S.aureus с течением времени присутствовал в глотке человека, по крайней мере, в той же степени, что и в передних ноздрях. Горло-носительство было по крайней мере таким же устойчивым, как и носительство в передних ноздрях.
Помимо того, что это основной патоген для человека (14), Staphylococcus aureus колонизирует значительную часть популяций человека (27). Передние ноздри считаются первичным местом колонизации (11, 14), и примерно 30% здоровых людей переносят бактерии в передних ноздрях.Уровень носительства, близкий к 60%, был описан ранее для определенных популяций (11). Человеческое горло менее изучено как место носительства, и ранее сообщалось о различных уровнях изоляции. Boe et al. сообщили о частоте изоляции 31% пациентов, помещенных в медицинское отделение (4), а Uemura et al. сообщили, что уровень изоляции в группе здоровых взрослых добровольцев составил 29% (22). Беркович и др. обнаружили бактерии в горле у 10% здоровых детей в возрасте до 2 лет (3). Также были отмечены более высокие, чем ожидалось, показатели устойчивости к метициллину S.aureus (MRSA) в горле младенцев (9). Область промежности, по-видимому, является обычным местом носительства, но редко является единственным местом колонизации (4). Также ранее было описано носительство на различных участках кожи. Однако это, по-видимому, вторично по отношению к носительству или инфекции в других местах, поскольку удаление носовых колоний с помощью местного лечения в большинстве случаев устраняет носительство через кожу (16, 20).
Были описаны три основных типа носительства, когда у людей неоднократно брали пробы в передних ноздрях на S.aureus в течение более длительного периода. Сообщалось, что от 6 до 60% никогда не были переносчиками микроорганизмов (не носители), а от 14 до 33% были повторно положительными по культуре (постоянные носители). Остальные особи время от времени дают положительные культуры и характеризуются как случайные или периодические носители (6, 10, 27). Различия между исследованиями могут быть связаны с различными методами выборки и / или вариациями в определениях различных состояний носителей. Постоянные носители, как правило, с течением времени несут один и тот же тип или генотип фага чаще, чем прерывистые и случайные носители (6, 27).Насколько нам известно, структура носительства с течением времени не исследовалась ни в одном месте отбора проб, кроме передних ноздрей.
Целью этого исследования было определение частоты и устойчивости носительства в глотке по сравнению с носительством переднего нареза S. aureus . Мы использовали метод чувствительной культуры, чтобы свести к минимуму ошибки, возникающие из-за низкой скорости восстановления. Все изоляты были генотипированы с помощью гель-электрофореза в импульсном поле SmaI (PFGE).
МАТЕРИАЛЫ И МЕТОДЫ
Пациенты и
S.aureus отбор проб.Все образцы были собраны в рамках плановой схемы эпиднадзора за инфекциями в окружной больнице Хальмстада, Швеция.
Образцы были собраны с помощью тампона с вискозным наконечником и угольной транспортной среды Amies (114C.US) (Копан, Италия). Образцы из передних ноздрей брали путем вращения кончика тампона в обеих ноздрях, а из горла — путем вращения кончика тампона на обеих миндалинах.
Пациенты, поступившие в ортопедическое отделение окружной больницы Хальмстада, Швеция, с марта по сентябрь 2003 г., по прибытии были исследованы на предмет наличия S.aureus . Среди 259 отобранных пациентов 62% составляли женщины, средний возраст 74,4 года, и 38% — мужчины, средний возраст 64,3 года. В марте было взято 20 пациентов, 72 — в апреле, 57 — в мае, 20 — в июне, 17 — в июле, 38 — в августе и 35 — в сентябре.
Персонал ортопедического отделения был проинструктирован самостоятельно взять мазок, вращая тампон в обоих передних носовых ходах и отдельный тампон на обеих миндалинах. Пробы брались у всех дежурных сотрудников в течение 1 недели каждый месяц с марта по сентябрь 2003 г. (за исключением июня и июля, когда палата была закрыта большую часть времени), а затем в течение 1 недели в ноябре 2003 г., марте 2004 г. и апреле. 2005 г., всего девять раз.Не все сотрудники были доступны постоянно, и в течение периода исследования были включены новые сотрудники. Всего в ортопедическом отделении было отобрано 87 отдельных сотрудников (70 женщин, средний возраст 40 лет, и 17 мужчин, средний возраст 34 года).
У группы из 67 человек повторно брали пробы из передних носовых ходов и глотки в течение 24 месяцев. Группа состояла из 34 сотрудников ортопедического отделения и 33 сотрудников отделения клинической микробиологии и инфекционного контроля окружной больницы Хальмстада, Швеция.Из этих 67 человек 63 были женщинами и 4 мужчинами, их средний возраст на момент первого отбора проб составлял 44 года. В период с марта 2003 г. по март 2005 г. они отбирались как минимум пять раз (в среднем 7,8 раз; диапазон от 5 до 10). Всего было собрано 384 изолята S. aureus , и их клональные отношения были определены с помощью анализа PFGE.
S. aureus , изоляция.Все образцы мазков инкубировали в течение 16–18 ч при 37 ° C в шейкере (100 об / мин) в аэробных условиях в 3 мл обогащающего бульона со следующим составом: 15.0 г протеозопептона (Oxoid, Бейзингсток, Англия), 2,5 г печеночного переваривающего вещества (Oxoid), 5,0 г дрожжевого экстракта (Oxoid), 25,0 г NaCl, 10,0 г маннита, 16 мг / л фенилового красного и 8 мг азтреонама в финальной стадии. объем 1 литр (конечный pH 7,0 ± 0,1). Затем порцию (10 мкл) бульона высевали на чашку с кровяным агаром и инкубировали при 37 ° C в течение ночи. Подозреваемые колонии были выделены на чашке с кровяным агаром и идентифицированы как S. aureus с использованием теста ДНКазы и латексного теста Staphaurex (Remel Europe Ltd., Дартфорд, Англия). Когда эти методы не совпадали, присутствие гена термостабильной нуклеазы анализировали с помощью ПЦР, как описано Nilsson et al. (15). Один единственный изолят S. aureus был выделен из каждого образца. Возможное присутствие более одного штамма в каждом образце не учитывалось. Все изолированные штаммы S. aureus собирали и хранили при -70 ° C для дальнейшего анализа.
ПФГЭ.
Штаммы, собранные в ходе исследования, были проанализированы с помощью PFGE, как описано Bannerman et al.(2). Структуры полос изолятов анализировали с использованием программного обеспечения Molecular Analyst, версия 1.6 (Bio-Rad Laboratories, Геркулес, Калифорния), методом групповой кластеризации невзвешенных пар с использованием средних связей и коэффициента Дайса. Штаммы с более чем 80% сходством были сгруппированы в клональные группы и названы с заглавной буквы от A до X. Изоляты от одного и того же человека, но собранные в разных случаях, также сравнивали друг с другом. Во всех случаях, когда они принадлежали к одной и той же клональной группе, они находились в пределах трех разностей полос (21).Это означает, что изоляты от разных индивидуумов, но названные одной и той же буквой, имели не менее 80% сходства при компьютерном кластерном анализе, в то время как изоляты от одного индивидуума с тем же именем имели различия <4 полос.
Расчеты и определения.
Индекс носителя (ДИ) был определен как количество положительных мазков, деленное на общее количество мазков для каждого человека, как описано Eriksen et al. (6). Однако определения состояний носителей отличаются от определений, используемых Eriksen et al.В нашей работе постоянный носитель определяется как человек с CI> 0,5; для случайного носителя 0
РЕЗУЛЬТАТЫ
Носительство S. aureus у пациентов и персонала.В течение периода исследования с марта 2003 г. по сентябрь 2003 г. у 259 пациентов, поступивших в ортопедическое отделение, были взяты образцы при поступлении как в передние ноздри, так и в глотку. Скорость выделения S. aureus из разных участков представлена в таблице.В общей сложности S. aureus было выделено у 125 из 259 пациентов (48%) на любом из участков. Наиболее частым местом изоляции было горло (40% пациентов), за которым следовали передние ноздри (31% пациентов). Разница в частоте изоляции между передними ноздрями и глоткой была статистически значимой ( P = 0,037). Если бы передние ноздри были единственным местом скрининга, было бы идентифицировано 64% (80/125) из носителей S. aureus , тогда как взятие пробы только из глотки позволило бы идентифицировать 83% (104/125).Не было обнаружено значительных различий между мужчинами и женщинами в отношении показателей изоляции из разных участков (данные не показаны).
ТАБЛИЦА 1.
Степень изоляции S. aureus в передних ноздрях и горле среди пациентов и персонала ортопедического отделения
| Результат для ноздрей a | Результат для горла a | Количество (%) лиц с результатом | ||
|---|---|---|---|---|
| Пациенты | Персонал | Пациенты и персонал | ||
| Поз. | Поз. | 59 (23) | 24 (28) | 83 (24) Поз. | 21 (8) | 7 (8) | 28 (8) |
| Отрицательный | Поз. | 45 (17) | 23 (26) | 68 (20) |
| Отрицательный | Отр. | 134 (52) | 33 (38) | 167 (48) |
| Итого | 259 | 87 | 346 | |
За период исследования Персоналу отделения предлагалось ежемесячно проводить забор образцов из носа и горла.В таблице мы суммировали частоту выделения S. aureus при первом взятии проб у 87 сотрудников. Шестьдесят два процента (54/87) были положительными на любом из сайтов. Как и в группе пациентов, наиболее частым местом изоляции было горло (54% положительных результатов по сравнению с 36% в передних ноздрях; P = 0,023).
Всего обследовано 346 пациентов и сотрудников; 32% были положительными в передней части носа (доверительный интервал 95%, от 27 до 37%) и 44% были положительными в области горла (доверительный интервал 95%, от 38 до 49%).Разница в частоте изоляции между передними ноздрями и глоткой была статистически значимой, со значением P , равным 0,003.
На рисунке показаны уровни изоляции персонала и пациентов за каждый месяц. Общее количество отобранных особей составило 67 человек в марте, 114 в апреле, 99 в мае, 82 в августе и 76 в сентябре. Данные за июнь и июль не представлены, поскольку большую часть этого времени отделение было закрыто. Общий уровень перевозок был самым высоким в марте (66%) и самым низким в августе (48%).Кроме того, горло носительство имело тенденцию к снижению с 58% до 38% за тот же период. При каждом взятии проб горло носительство было более частым, чем носовое.
Уровень изоляции S. aureus среди персонала и пациентов ортопедического отделения с марта по сентябрь 2003 г.
Носительство во времени.
Для изучения характера носительства S. aureus с течением времени у группы из 67 человек были повторно взяты пробы из передних ноздрей и глотки в течение до 24 месяцев.Всего был взят 521 мазок из передних отделов носа и глотки; 152 (29%) оказались положительными на S. aureus в передних ноздрях и 232 (45%) в горле.
67 человек были сгруппированы в постоянных носителей, случайных носителей и не носителей на основе ДИ, рассчитанных на основе результатов посева только из передних носовых ходов, результатов только из горла и комбинированных результатов из обоих участков (таблица). Основываясь только на результатах анализа передних носовых ходов, 25% (17/67) пациентов были классифицированы как стойкие носители, по сравнению с 58% (39/67), когда были добавлены результаты мазков из зева.Результаты культивирования в каждом случае отбора проб для 39 человек, классифицированных как стойкие носители, представлены на рис.
Носительство S. aureus в передних ноздрях и глотке среди 39 постоянных носителей. Красный прямоугольник представляет положительные результаты только для передних ноздрей в этом случае отбора проб, оранжевый прямоугольник означает положительный результат для передних ноздрей и горла, желтый прямоугольник дает положительный результат только для горла, синий прямоугольник отрицательный в обоих местах, а серый прямоугольник означает образец не был взят.Буква (ы) в каждом поле обозначает клональный тип (ы) выделенного штамма S. aureus , как определено с помощью PFGE. В оранжевых квадратах (положительный результат в передних ноздрях и глотке) первая буква дает клональный тип в передних ноздрях, а вторая — в глотке. «$» Представляет клональный тип, уникальный для данного человека. Время отбора проб указано вверху со следующими сокращениями: M3, март 2003 г .; A, апрель 2003 г .; Mj, май-июнь 2003 г .; Jn, июнь 2003 г .; J, июль 2003 г .; Au, август 2003 г .; S, сентябрь 2003 г .; О, октябрь 2003 г .; N, ноябрь 2003 г .; D, декабрь 2003 г .; J, январь 2004 г .; F, февраль 2004 г .; M4, март 2004 г .; A5, апрель 2005 г.
ТАБЛИЦА 2.
Результаты от 67 человек, повторно взятых из передних носовых ходов и горла не менее пяти раз в течение 25 месяцев a
| Группа | Количество (%) лиц в группе, классифицирован по культуре из: | |||
|---|---|---|---|---|
| Ноздри | Горло | Ноздри или горло | ||
| Постоянные носители | 17 (25) | 31 (46) | 39 (58) | 9014 | 18 (27) | 14 (21) |
| Несущих | 29 (43) | 18 (27) | 14 (21) | |
На основе наиболее часто встречающихся мест перевозки Со временем 39 постоянных носителей можно сгруппировать в следующие группы: предпочтительные носители передних нервов, т.е.д., особи с положительным результатом только в передних ноздрях более чем в половине случаев отбора проб; предпочтительные носители горла, т. е. люди с положительным результатом только в горле более чем в половине случаев; преимущественно носители переднего носа / глотки, т. е. люди с положительным результатом в переднем отделе ноздрей и глотки более чем в половине случаев; и неопределимые носители, постоянные носители со смешанной схемой перевозки на основе места отбора проб. Согласно этим определениям, 5% постоянных носителей были предпочтительными носителями передних нервов (индивиды 1 и 2 [Рис.]), 38% были предпочтительными носителями горла (люди от 3 до 17 [Рис.]), 28% были предпочтительными носителями передней части носа / горла (люди от 18 до 28 [Рис.]), И еще 28% имели смешанный характер носительства. по месту отбора (особи от 29 до 39 [рис.]) (таблица).
ТАБЛИЦА 3.
Результаты 39 стойких носителей S. aureus , сгруппированных по наиболее частым местам носительства
| Группа a | Количество (%) лиц в группе | Средн. №выборок | Ср. ДИ | Ср. период исследования (мес.) | Ср. время носителя (мес) | Ср. одного и того же штамма, содержащегося в: | |
|---|---|---|---|---|---|---|---|
| Ноздри | Горло | ||||||
| Прив. Перевозчики нарис | 2 (5) | 7,0 | 0,8 | 25 | 25 | 15 | 0 |
| Прив. горловины | 15 (38) | 7,8 | 0,8 | 21 | 17 | 0 | 13 |
| Прив.нарис / горловые держатели | 11 (28) | 7,8 | 1,0 | 25 | 25 | 21 | 19 |
| Несъемные держатели | 11 (28) | 7,1 | 18 | 6 | 7 | ||
| Все | 39 | 7,6 | 0,8 | 23 | 20 | 8 | 12 |
Образцы полос SmaI PFGE для штаммов S. aureus , выделенных от четырех человек, определенных как предпочтительные носители через горло (индивидуумы 5, 9, 12 и 13 [рис.]). Время отбора проб указано над пробами со следующими сокращениями: м3, март 2003 г .; A, апрель 2003 г .; М, май 2003 г .; J, июнь 2003 г .; Au, август 2003 г .; S, сентябрь 2003 г .; N, ноябрь 2003 г .; m4, март 2004 г .; a5, апрель 2005 г.У пациента 5 в двух случаях были положительные результаты в передних ноздрях и глотке. Подчеркнуты образцы из передних ноздрей.
ОБСУЖДЕНИЕ
S. aureus чаще выделяли из глотки, чем из передних носовых ходов, в двух неродственных популяциях. Поскольку 259 пациентов были отобраны при поступлении в ортопедическое отделение, их статус колонизации, вероятно, не связан с группой или с 87 членами персонала того же отделения, которые также были отобраны.Средний возраст группы пациентов был намного выше, чем средний возраст группы персонала. Женщины были перепредставлены в обеих группах, но не наблюдалось значительной разницы в показателях изоляции между мужчинами и женщинами в группе пациентов (данные не показаны). Поэтому мы не думаем, что наши результаты связаны с полом или возрастом, и мы не думаем, что результаты представляют собой явление в одной популяции.
Наши результаты показывают, что S. aureus редко переносился только в передние ноздри.Если были колонизированы передние носовые ходы, бактерии, за редким исключением, также присутствовали в глотке. Это может иметь важные последствия. Поскольку носительство S. aureus передним носиком является хорошо задокументированным фактором риска инфицирования S. aureus (11), профилактическая деколонизация носителей была опробована с различными группами пациентов (12). Распространение MRSA среди пациентов и персонала медицинских учреждений также требует эффективных схем деколонизации.Обычно используемый протокол включает местную обработку передних носов мупироцином, иногда в сочетании с применением дезинфицирующих средств для кожи. Для большинства групп пациентов исследования не показали значительного снижения инфицирования (12, 26). Некоторым исключением являются пациенты, находящиеся на гемодиализе (5), пациенты на перитонеальном диализе (1) и пациенты общей хирургии (18). Наблюдалась реколонизация тем же штаммом S. aureus после периода лечения (17, 27).Источником бактерий в этих случаях могут быть другие места носительства на пациенте (например, горло), люди или предметы в окружающей среде пациента. Было показано, что повторное лечение приводит к развитию устойчивости к мупироцину (13, 23). Во время лечения передних носовых ходов наблюдались низкие концентрации мупироцина в горле (24). Кроме того, было поставлено под сомнение влияние назального лечения мупироцином на колонизацию горла (8, 25). В совокупности это может означать, что стандартный протокол деколонизации S.aureus может создать ситуацию, благоприятствующую развитию резистентности к мупироцину в горле у пролеченных людей. Остаточные бактерии в горле также могут быть одной из причин (из нескольких) повторной колонизации после лечения. Kluytmans и Wertheim предположили, что одним из способов повышения эффективности будущих схем лечения могло бы быть устранение S. aureus также из экстраназальных участков (12). Принимая во внимание наши результаты, лечение, также нацеленное на горло, может уменьшить проблемы с резистентностью к мупироцину и повторной колонизацией и, возможно, привести к большей эффективности с точки зрения снижения инфекции.
Большая группа преимущественно колонизировалась только в горле, в большинстве случаев одним и тем же штаммом в течение нескольких месяцев и даже лет. Очевидно, что эти люди не были бы обнаружены как носители, если бы были взяты образцы только из передних носовых ходов. Назальное носительство, по-видимому, играет центральную роль в эпидемиологии и патогенезе инфекции S. aureus (11, 12), а риски, связанные с носительством через горло, в значительной степени неизвестны. Половина предпочтительных носителей из глотки давала положительный результат на культуру передних носовых ходов хотя бы один раз за период исследования.Необходимы дальнейшие исследования, чтобы определить, какой риск представляет эта группа носителей S. aureus с точки зрения распространения микроорганизма и инфекции. Между тем, при попытке идентифицировать носителей MRSA и S. aureus в различных ситуациях представляется разумным использовать обогащенный бульон (15) и включать горло. Если нужно взять образец только с одного участка, вероятно, лучше выбрать горло, чем передние ноздри.
В этом исследовании 39 из 67 человек, или около 60%, были охарактеризованы как стойкие носители.Это примерно в два или даже три раза больше, чем указано ранее (27). Это несоответствие, вероятно, связано с сочетанием чувствительной техники скрининга, включения горла в качестве места носительства и другого определения стойкого носительства (ДИ> 0,5). Изменение определения в основном связано с группой предпочтительных носителей горла. Промежуточные отрицательные образцы, снижающие доверительный интервал для этой группы, вероятно, были связаны с ложноотрицательными результатами, а не с тем фактом, что человек стал не носителем.Этот вывод кажется разумным, поскольку в большинстве случаев один и тот же штамм был извлечен до и после отрицательных случаев отбора проб. Наблюдаемый более низкий ДИ для предпочтительных носителей глотки означает, что взятие пробы из глотки дает меньше организмов, чем отбор проб из передних носовых ходов, либо потому, что метод отбора проб неоптимален, либо, что более вероятно, потому, что в месте отбора пробы присутствует небольшое количество организмов. Вероятная причина более высокого, чем ожидалось, уровня S. aureus в горле (по сравнению с уровнем в передних ноздрях) заключается в том, что мы увеличили чувствительность, используя обогащенный бульон.Использование того же бульона с метициллином увеличивало скорость выделения MRSA на 35% в предыдущем исследовании (15).
Мы наблюдали почти на 20% более высокий уровень носительства S. aureus в весенние месяцы марта и апреля, чем в летний август. Более высокая частота была более выражена для горла. Поскольку колонизация и прикрепление S. aureus (и других бактерий) к глотке увеличивается во время вирусной инфекции (7, 19), объяснение может заключаться в том, что пик инфекций верхних дыхательных путей весной в Швеции приводит к большему количеству инфекций. колонизированы особи.Кроме того, вирусные инфекции вызывают увеличение количества бактерий в горле, тем самым повышая вероятность получения положительной культуры. Эти сезонные колебания, вероятно, также являются объяснением наблюдаемого более чем на 10% более высокого процента носителей среди персонала, чем среди пациентов. Первые пробы у большинства сотрудников были взяты в марте, но пациенты отбирались с марта по сентябрь. Насколько нам известно, сезонная вариация носительства S. aureus ранее не описывалась, но заслуживает дальнейшего внимания.
В заключение, глотку следует рассматривать как важное место носительства S. aureus , и его следует учитывать при скрининге на S. aureus , включая MRSA. Наши результаты также показывают, что носительство S. aureus в передних носовых ходах в большинстве случаев указывает на присутствие микроорганизма в горле, хотя и в меньших количествах. Это необходимо учитывать при разработке протоколов деколонизации.
Благодарности
Этот проект частично финансировался за счет исследовательского гранта Совета графства Халланд, Швеция.
Мы благодарны персоналу ортопедического отделения и отделения клинической микробиологии окружной больницы Хальмстада, Швеция, за помощь со сбором образцов. Эксперименты по гель-электрофорезу в импульсном поле были выполнены с большим мастерством микробиологом Усамой Назаром.
СПИСОК ЛИТЕРАТУРЫ
1. Американское общество нефрологов. 1996. Назальный мупироцин предотвращает инфекцию места выхода Staphylococcus aureus во время перитонеального диализа. Варенье. Soc. Нефрол.7 : 2403-2408. [PubMed] [Google Scholar] 2. Баннерман, Т. Л., Г. А. Хэнкок, Ф. К. Теновер и Дж. М. Миллер. 1995. Гель-электрофорез в импульсном поле вместо бактериофагового типирования Staphylococcus aureus . J. Clin. Microbiol. 33 : 551-555. [Бесплатная статья PMC] [PubMed] [Google Scholar] 3. Беркович М., М. Булковштейн, Д. Жовтис, Р. Гринберг, Ю. Ницан, Б. Барзилай и И. Болдур. 2002. Скорость колонизации бактерий в горле здоровых младенцев.Int. J. Pediatr. Оториноларингол. 63 : 19-24. [PubMed] [Google Scholar] 5. Boelaert, J. R., R. A. De Smedt, Y. A. De Baere, C. A. Godard, E. G. Matthys, M. L. Schurgers, R.F.Daneels, B.Z. Gordts и H. W. Van Landuyt. 1989. Влияние назальной мази с мупироцином кальция на заболеваемость Staphylococcus aureus инфекциями у пациентов, находящихся на гемодиализе. Нефрол. Набирать номер. Пересадка. 4 : 278-281. [PubMed] [Google Scholar] 6. Эриксен, Н. Х., Ф.Эсперсен, В. Т. Росдаль и К. Йенсен. 1995. Носительство Staphylococcus aureus среди 104 здоровых лиц в течение 19 месяцев. Эпидемиол. Заразить. 115 : 51-60. [Бесплатная статья PMC] [PubMed] [Google Scholar] 7. Файнштейн В., Д. М. Мушер и Т. Р. Кейт. 1980. Прилипание бактерий к клеткам глотки во время вирусной инфекции. J. Infect. Дис. 141 : 172-176. [PubMed] [Google Scholar] 8. Хаякава Т., Т. Хаясидера, С. Кацура, К. Йонеда и Т.Кусуноки. 2000. Назальное лечение мупироцином метициллин-резистентных, колонизированных глоткой. Staphylococcus aureus : предварительное исследование с участием 10 младенцев-носителей. Педиатр. Int. 42 : 67-70. [PubMed] [Google Scholar] 9. Хаякава Т., Т. Хаясидера, К. Йонеда, С. Кагава и Т. Кусуноки. 1999. Преимущественная колонизация глотки метициллин-резистентным Staphylococcus aureus у младенцев. J. Pediatr. 134 : 252. [PubMed] [Google Scholar] 10. Ху, Л., А. Умеда, С. Кондо, К. Амако. 1995. Типирование Staphylococcus aureus , колонизирующего носовые носители человека с помощью гель-электрофореза в импульсном поле. J. Med. Microbiol. 42 : 127-132. [PubMed] [Google Scholar] 11. Клюйтманс, Дж., А. ван Белкум и Х. Вербру. 1997. Носительство золотистого стафилококка : эпидемиология, основные механизмы и связанные риски. Clin. Microbiol. Ред. 10 : 505-520. [Бесплатная статья PMC] [PubMed] [Google Scholar] 12. Kluytmans, J. A., and H. F. Wertheim. 2005. Носительство Staphylococcus aureus и профилактика внутрибольничных инфекций. Инфекция 33 : 3-8. [PubMed] [Google Scholar] 13. М. Крескен, Д. Хафнер, Ф. Дж. Шмитц и Т. А. Вихельхаус. 2004. Распространенность устойчивости к мупироцину у клинических изолятов Staphylococcus aureus и Staphylococcus epidermidis : результаты исследования устойчивости к противомикробным препаратам Общества химиотерапии Поля-Эрлиха, 2001.Int. J. Antimicrob. Агенты 23 : 577-581. [PubMed] [Google Scholar] 14. Lowy, F. D. 1998. Staphylococcus aureus, инфекции. N. Engl. J. Med. 339 : 520-532. [PubMed] [Google Scholar] 15. Нильссон П., Х. Александерссон и Т. Рипа. 2005. Использование обогащения бульона и ПЦР в реальном времени для исключения присутствия метициллин-устойчивого Staphylococcus aureus в клинических образцах: чувствительный подход к скринингу. Clin. Microbiol. Заразить.11 : 1027-1034. [PubMed] [Google Scholar] 16. Паррас Ф., М. К. Герреро, Э. Боуза, М. Х. Бласкес, С. Морено, М. К. Менаргес и Э. Серценадо. 1995. Сравнительное исследование мупироцина и перорального ко-тримоксазола плюс местная фузидиевая кислота в искоренении носительства метициллин-резистентного Staphylococcus aureus . Противомикробный. Агенты Chemother. 39 : 175-179. [Бесплатная статья PMC] [PubMed] [Google Scholar] 17. Пена, К., Н. Фернандес-Сабе, М. А. Домингес, М.Pujol, A. Martinez-Castelao, J. Ayats, F. Gudiol и J. Ariza. 2004. Staphylococcus aureus носительство в носу у пациентов на гемодиализе: роль кожной колонизации. J. Hosp. Заразить. 58 : 20-27. [PubMed] [Google Scholar] 18. Перл, Т. М., Дж. Дж. Каллен, Р. П. Венцель, М. Б. Циммерман, М. А. Пфаллер, Д. Шеппард, Дж. Туомбли, П. П. Френч и Л. А. Хервальд. 2002. Мупироцин для интраназального введения для профилактики послеоперационных инфекций, вызванных Staphylococcus aureus. N. Engl.J. Med. 346 : 1871-1877. [PubMed] [Google Scholar] 19. Рамирес-Ронда, К. Х., З. Фуксенч-Лопес и М. Неварес. 1981. Повышенная бактериальная колонизация глотки при вирусном заболевании. Arch. Междунар. Med. 141 : 1599-1603. [PubMed] [Google Scholar] 20. Рейган Д. Р., Б. Н. Доббелинг, М. А. Пфаллер, К. Т. Шитц, А. К. Хьюстон, Р. Дж. Холлис и Р. П. Венцель. 1991. Ликвидация совпадающего носового и ручного стафилококка золотистого стафилококка с помощью интраназального применения кальциевой мази мупироцина.Аня. Междунар. Med. 114 : 101-106. [PubMed] [Google Scholar] 21. Теновер, Ф. К., Р. Д. Арбайт, Р. В. Геринг, П. А. Микельсен, Б. Э. Мюррей, Д. Х. Персинг и Б. Сваминатан. 1995. Интерпретация паттернов рестрикции хромосомной ДНК, полученных с помощью гель-электрофореза в импульсном поле: критерии типирования бактериальных штаммов. J. Clin. Microbiol. 33 : 2233-2239. [Бесплатная статья PMC] [PubMed] [Google Scholar] 22. Э. Уэмура, С. Какинохана, Н. Хига, К. Тома и Н. Накасоне. 2004. Сравнительная характеристика изолятов Staphylococcus aureus из глотки и носа здоровых добровольцев. Jpn. J. Infect. Дис. 57 : 21-24. [PubMed] [Google Scholar] 23. Уокер, Э. С., Ф. Леви, М. Шорман, Г. Дэвид, Дж. Абдалла и Ф. А. Сарубби. 2004. Снижение резистентности к мупироцину у метициллин-резистентных Staphylococcus aureus сопровождалось административным контролем за назначениями. J. Clin. Microbiol. 42 : 2792-2795. [Бесплатная статья PMC] [PubMed] [Google Scholar] 24. Ватанабэ Х., Х. Масаки, Н. Асо, К. Ватанабэ, К. Оиси, С. Кобаяси, А. Сато, Р. Сугита и Т. Нагатаке. 2001. Низкие концентрации мупироцина в глотке после интраназального введения могут способствовать устойчивости к мупироцину у метициллин-резистентных Staphylococcus aureus . J. Clin. Microbiol. 39 : 3775-3777. [Бесплатная статья PMC] [PubMed] [Google Scholar] 25. Wertheim, H.F., J. Verveer, H.A. Boelens, A. van Belkum, H.A. Verbrugh и M.C. Vos. 2005. Влияние лечения мупироцином на носительство в носу, глотке и промежности Staphylococcus aureus у здоровых взрослых. Противомикробный. Агенты Chemother. 49 : 1465-1467. [Бесплатная статья PMC] [PubMed] [Google Scholar] 26. Вертхайм, Х. Ф., М. К. Вос, А. Отт, А. Восс, Дж. А. Клюйтманс, К. М. Ванденбрук-Граулс, М. Х. Мистер, П. Х. ван Койлен и Х. А. Вербру. 2004. Профилактика мупироцином против нозокомиальных инфекций Staphylococcus aureus у нехирургических пациентов: рандомизированное исследование.Аня. Междунар. Med. 140 : 419-425. [PubMed] [Google Scholar]Staphylococcus aureus Колонизация горла происходит чаще, чем колонизация передних ноздрей
J Clin Microbiol. 2006 сен; 44 (9): 3334–3339.
Петер Нильссон
Отделение клинической микробиологии и инфекционного контроля, Окружная больница Хальмстада, Хальмстад, Швеция
Торвальд Рипа
Отделение клинической микробиологии и инфекционного контроля, Окружная больница Хальмстада, Хальмстад, Швеция
Отделение Клиническая микробиология и инфекционный контроль, Окружная больница Хальмстада, Хальмстад, Швеция
* Автор, ответственный за переписку.Почтовый адрес: Отдел клинической микробиологии и инфекционного контроля, окружная больница Хальмстада, S-30185 Хальмстад, Швеция. Телефон: 46 35 136549. Факс: 46 35 131869. Электронная почта: [email protected].Поступило 26 апреля 2006 г .; Пересмотрено 10 июня 2006 г .; Принято 24 июня 2006 г.
Copyright © 2006, Американское общество микробиологов. Эта статья цитируется в других статьях в PMC.Abstract
Целью данного исследования было определение частоты и устойчивости носительства Staphylococcus aureus в глотке по отношению к носительству переднего носа.При использовании чувствительного обогащающего бульона S. aureus было культивировано из двух участков от 259 пациентов при поступлении в ортопедическое отделение и от 87 сотрудников одного отделения. Горло было наиболее частым местом носительства в обеих группах. Сорок процентов пациентов и 54% медперсонала были положительными на S. aureus в горле, по сравнению с 31% и 36%, соответственно, в передних ноздрях. Чтобы определить стойкость носительства, у 67 человек были повторно взяты пробы из передних носовых ходов и горла в течение 2 лет (от 5 до 10 раз; в среднем 7.8). Большинство, 58% (39/67), были определены как постоянные носители S. aureus с учетом результатов посева на обоих участках. Из 39 постоянных носителей 15 человек имели положительный результат посева только из глотки более чем в половине случаев отбора проб (они называются предпочтительными носителями из глотки), в то время как только 5% (два человека) были предпочтительными носителями передних нервных окончаний согласно тому же определению . Типирование собранных изолятов S. aureus с помощью гель-электрофореза в импульсном поле показало, что тот же штамм S.aureus с течением времени присутствовал в глотке человека, по крайней мере, в той же степени, что и в передних ноздрях. Горло-носительство было по крайней мере таким же устойчивым, как и носительство в передних ноздрях.
Помимо того, что это основной патоген для человека (14), Staphylococcus aureus колонизирует значительную часть популяций человека (27). Передние ноздри считаются первичным местом колонизации (11, 14), и примерно 30% здоровых людей переносят бактерии в передних ноздрях.Уровень носительства, близкий к 60%, был описан ранее для определенных популяций (11). Человеческое горло менее изучено как место носительства, и ранее сообщалось о различных уровнях изоляции. Boe et al. сообщили о частоте изоляции 31% пациентов, помещенных в медицинское отделение (4), а Uemura et al. сообщили, что уровень изоляции в группе здоровых взрослых добровольцев составил 29% (22). Беркович и др. обнаружили бактерии в горле у 10% здоровых детей в возрасте до 2 лет (3). Также были отмечены более высокие, чем ожидалось, показатели устойчивости к метициллину S.aureus (MRSA) в горле младенцев (9). Область промежности, по-видимому, является обычным местом носительства, но редко является единственным местом колонизации (4). Также ранее было описано носительство на различных участках кожи. Однако это, по-видимому, вторично по отношению к носительству или инфекции в других местах, поскольку удаление носовых колоний с помощью местного лечения в большинстве случаев устраняет носительство через кожу (16, 20).
Были описаны три основных типа носительства, когда у людей неоднократно брали пробы в передних ноздрях на S.aureus в течение более длительного периода. Сообщалось, что от 6 до 60% никогда не были переносчиками микроорганизмов (не носители), а от 14 до 33% были повторно положительными по культуре (постоянные носители). Остальные особи время от времени дают положительные культуры и характеризуются как случайные или периодические носители (6, 10, 27). Различия между исследованиями могут быть связаны с различными методами выборки и / или вариациями в определениях различных состояний носителей. Постоянные носители, как правило, с течением времени несут один и тот же тип или генотип фага чаще, чем прерывистые и случайные носители (6, 27).Насколько нам известно, структура носительства с течением времени не исследовалась ни в одном месте отбора проб, кроме передних ноздрей.
Целью этого исследования было определение частоты и устойчивости носительства в глотке по сравнению с носительством переднего нареза S. aureus . Мы использовали метод чувствительной культуры, чтобы свести к минимуму ошибки, возникающие из-за низкой скорости восстановления. Все изоляты были генотипированы с помощью гель-электрофореза в импульсном поле SmaI (PFGE).
МАТЕРИАЛЫ И МЕТОДЫ
Пациенты и
S.aureus отбор проб.Все образцы были собраны в рамках плановой схемы эпиднадзора за инфекциями в окружной больнице Хальмстада, Швеция.
Образцы были собраны с помощью тампона с вискозным наконечником и угольной транспортной среды Amies (114C.US) (Копан, Италия). Образцы из передних ноздрей брали путем вращения кончика тампона в обеих ноздрях, а из горла — путем вращения кончика тампона на обеих миндалинах.
Пациенты, поступившие в ортопедическое отделение окружной больницы Хальмстада, Швеция, с марта по сентябрь 2003 г., по прибытии были исследованы на предмет наличия S.aureus . Среди 259 отобранных пациентов 62% составляли женщины, средний возраст 74,4 года, и 38% — мужчины, средний возраст 64,3 года. В марте было взято 20 пациентов, 72 — в апреле, 57 — в мае, 20 — в июне, 17 — в июле, 38 — в августе и 35 — в сентябре.
Персонал ортопедического отделения был проинструктирован самостоятельно взять мазок, вращая тампон в обоих передних носовых ходах и отдельный тампон на обеих миндалинах. Пробы брались у всех дежурных сотрудников в течение 1 недели каждый месяц с марта по сентябрь 2003 г. (за исключением июня и июля, когда палата была закрыта большую часть времени), а затем в течение 1 недели в ноябре 2003 г., марте 2004 г. и апреле. 2005 г., всего девять раз.Не все сотрудники были доступны постоянно, и в течение периода исследования были включены новые сотрудники. Всего в ортопедическом отделении было отобрано 87 отдельных сотрудников (70 женщин, средний возраст 40 лет, и 17 мужчин, средний возраст 34 года).
У группы из 67 человек повторно брали пробы из передних носовых ходов и глотки в течение 24 месяцев. Группа состояла из 34 сотрудников ортопедического отделения и 33 сотрудников отделения клинической микробиологии и инфекционного контроля окружной больницы Хальмстада, Швеция.Из этих 67 человек 63 были женщинами и 4 мужчинами, их средний возраст на момент первого отбора проб составлял 44 года. В период с марта 2003 г. по март 2005 г. они отбирались как минимум пять раз (в среднем 7,8 раз; диапазон от 5 до 10). Всего было собрано 384 изолята S. aureus , и их клональные отношения были определены с помощью анализа PFGE.
S. aureus , изоляция.Все образцы мазков инкубировали в течение 16–18 ч при 37 ° C в шейкере (100 об / мин) в аэробных условиях в 3 мл обогащающего бульона со следующим составом: 15.0 г протеозопептона (Oxoid, Бейзингсток, Англия), 2,5 г печеночного переваривающего вещества (Oxoid), 5,0 г дрожжевого экстракта (Oxoid), 25,0 г NaCl, 10,0 г маннита, 16 мг / л фенилового красного и 8 мг азтреонама в финальной стадии. объем 1 литр (конечный pH 7,0 ± 0,1). Затем порцию (10 мкл) бульона высевали на чашку с кровяным агаром и инкубировали при 37 ° C в течение ночи. Подозреваемые колонии были выделены на чашке с кровяным агаром и идентифицированы как S. aureus с использованием теста ДНКазы и латексного теста Staphaurex (Remel Europe Ltd., Дартфорд, Англия). Когда эти методы не совпадали, присутствие гена термостабильной нуклеазы анализировали с помощью ПЦР, как описано Nilsson et al. (15). Один единственный изолят S. aureus был выделен из каждого образца. Возможное присутствие более одного штамма в каждом образце не учитывалось. Все изолированные штаммы S. aureus собирали и хранили при -70 ° C для дальнейшего анализа.
ПФГЭ.
Штаммы, собранные в ходе исследования, были проанализированы с помощью PFGE, как описано Bannerman et al.(2). Структуры полос изолятов анализировали с использованием программного обеспечения Molecular Analyst, версия 1.6 (Bio-Rad Laboratories, Геркулес, Калифорния), методом групповой кластеризации невзвешенных пар с использованием средних связей и коэффициента Дайса. Штаммы с более чем 80% сходством были сгруппированы в клональные группы и названы с заглавной буквы от A до X. Изоляты от одного и того же человека, но собранные в разных случаях, также сравнивали друг с другом. Во всех случаях, когда они принадлежали к одной и той же клональной группе, они находились в пределах трех разностей полос (21).Это означает, что изоляты от разных индивидуумов, но названные одной и той же буквой, имели не менее 80% сходства при компьютерном кластерном анализе, в то время как изоляты от одного индивидуума с тем же именем имели различия <4 полос.
Расчеты и определения.
Индекс носителя (ДИ) был определен как количество положительных мазков, деленное на общее количество мазков для каждого человека, как описано Eriksen et al. (6). Однако определения состояний носителей отличаются от определений, используемых Eriksen et al.В нашей работе постоянный носитель определяется как человек с CI> 0,5; для случайного носителя 0
РЕЗУЛЬТАТЫ
Носительство S. aureus у пациентов и персонала.В течение периода исследования с марта 2003 г. по сентябрь 2003 г. у 259 пациентов, поступивших в ортопедическое отделение, были взяты образцы при поступлении как в передние ноздри, так и в глотку. Скорость выделения S. aureus из разных участков представлена в таблице.В общей сложности S. aureus было выделено у 125 из 259 пациентов (48%) на любом из участков. Наиболее частым местом изоляции было горло (40% пациентов), за которым следовали передние ноздри (31% пациентов). Разница в частоте изоляции между передними ноздрями и глоткой была статистически значимой ( P = 0,037). Если бы передние ноздри были единственным местом скрининга, было бы идентифицировано 64% (80/125) из носителей S. aureus , тогда как взятие пробы только из глотки позволило бы идентифицировать 83% (104/125).Не было обнаружено значительных различий между мужчинами и женщинами в отношении показателей изоляции из разных участков (данные не показаны).
ТАБЛИЦА 1.
Степень изоляции S. aureus в передних ноздрях и горле среди пациентов и персонала ортопедического отделения
| Результат для ноздрей a | Результат для горла a | Количество (%) лиц с результатом | ||
|---|---|---|---|---|
| Пациенты | Персонал | Пациенты и персонал | ||
| Поз. | Поз. | 59 (23) | 24 (28) | 83 (24) Поз. | 21 (8) | 7 (8) | 28 (8) |
| Отрицательный | Поз. | 45 (17) | 23 (26) | 68 (20) |
| Отрицательный | Отр. | 134 (52) | 33 (38) | 167 (48) |
| Итого | 259 | 87 | 346 | |
За период исследования Персоналу отделения предлагалось ежемесячно проводить забор образцов из носа и горла.В таблице мы суммировали частоту выделения S. aureus при первом взятии проб у 87 сотрудников. Шестьдесят два процента (54/87) были положительными на любом из сайтов. Как и в группе пациентов, наиболее частым местом изоляции было горло (54% положительных результатов по сравнению с 36% в передних ноздрях; P = 0,023).
Всего обследовано 346 пациентов и сотрудников; 32% были положительными в передней части носа (доверительный интервал 95%, от 27 до 37%) и 44% были положительными в области горла (доверительный интервал 95%, от 38 до 49%).Разница в частоте изоляции между передними ноздрями и глоткой была статистически значимой, со значением P , равным 0,003.
На рисунке показаны уровни изоляции персонала и пациентов за каждый месяц. Общее количество отобранных особей составило 67 человек в марте, 114 в апреле, 99 в мае, 82 в августе и 76 в сентябре. Данные за июнь и июль не представлены, поскольку большую часть этого времени отделение было закрыто. Общий уровень перевозок был самым высоким в марте (66%) и самым низким в августе (48%).Кроме того, горло носительство имело тенденцию к снижению с 58% до 38% за тот же период. При каждом взятии проб горло носительство было более частым, чем носовое.
Уровень изоляции S. aureus среди персонала и пациентов ортопедического отделения с марта по сентябрь 2003 г.
Носительство во времени.
Для изучения характера носительства S. aureus с течением времени у группы из 67 человек были повторно взяты пробы из передних ноздрей и глотки в течение до 24 месяцев.Всего был взят 521 мазок из передних отделов носа и глотки; 152 (29%) оказались положительными на S. aureus в передних ноздрях и 232 (45%) в горле.
67 человек были сгруппированы в постоянных носителей, случайных носителей и не носителей на основе ДИ, рассчитанных на основе результатов посева только из передних носовых ходов, результатов только из горла и комбинированных результатов из обоих участков (таблица). Основываясь только на результатах анализа передних носовых ходов, 25% (17/67) пациентов были классифицированы как стойкие носители, по сравнению с 58% (39/67), когда были добавлены результаты мазков из зева.Результаты культивирования в каждом случае отбора проб для 39 человек, классифицированных как стойкие носители, представлены на рис.
Носительство S. aureus в передних ноздрях и глотке среди 39 постоянных носителей. Красный прямоугольник представляет положительные результаты только для передних ноздрей в этом случае отбора проб, оранжевый прямоугольник означает положительный результат для передних ноздрей и горла, желтый прямоугольник дает положительный результат только для горла, синий прямоугольник отрицательный в обоих местах, а серый прямоугольник означает образец не был взят.Буква (ы) в каждом поле обозначает клональный тип (ы) выделенного штамма S. aureus , как определено с помощью PFGE. В оранжевых квадратах (положительный результат в передних ноздрях и глотке) первая буква дает клональный тип в передних ноздрях, а вторая — в глотке. «$» Представляет клональный тип, уникальный для данного человека. Время отбора проб указано вверху со следующими сокращениями: M3, март 2003 г .; A, апрель 2003 г .; Mj, май-июнь 2003 г .; Jn, июнь 2003 г .; J, июль 2003 г .; Au, август 2003 г .; S, сентябрь 2003 г .; О, октябрь 2003 г .; N, ноябрь 2003 г .; D, декабрь 2003 г .; J, январь 2004 г .; F, февраль 2004 г .; M4, март 2004 г .; A5, апрель 2005 г.
ТАБЛИЦА 2.
Результаты от 67 человек, повторно взятых из передних носовых ходов и горла не менее пяти раз в течение 25 месяцев a
| Группа | Количество (%) лиц в группе, классифицирован по культуре из: | |||
|---|---|---|---|---|
| Ноздри | Горло | Ноздри или горло | ||
| Постоянные носители | 17 (25) | 31 (46) | 39 (58) | 9014 | 18 (27) | 14 (21) |
| Несущих | 29 (43) | 18 (27) | 14 (21) | |
На основе наиболее часто встречающихся мест перевозки Со временем 39 постоянных носителей можно сгруппировать в следующие группы: предпочтительные носители передних нервов, т.е.д., особи с положительным результатом только в передних ноздрях более чем в половине случаев отбора проб; предпочтительные носители горла, т. е. люди с положительным результатом только в горле более чем в половине случаев; преимущественно носители переднего носа / глотки, т. е. люди с положительным результатом в переднем отделе ноздрей и глотки более чем в половине случаев; и неопределимые носители, постоянные носители со смешанной схемой перевозки на основе места отбора проб. Согласно этим определениям, 5% постоянных носителей были предпочтительными носителями передних нервов (индивиды 1 и 2 [Рис.]), 38% были предпочтительными носителями горла (люди от 3 до 17 [Рис.]), 28% были предпочтительными носителями передней части носа / горла (люди от 18 до 28 [Рис.]), И еще 28% имели смешанный характер носительства. по месту отбора (особи от 29 до 39 [рис.]) (таблица).
ТАБЛИЦА 3.
Результаты 39 стойких носителей S. aureus , сгруппированных по наиболее частым местам носительства
| Группа a | Количество (%) лиц в группе | Средн. №выборок | Ср. ДИ | Ср. период исследования (мес.) | Ср. время носителя (мес) | Ср. одного и того же штамма, содержащегося в: | |
|---|---|---|---|---|---|---|---|
| Ноздри | Горло | ||||||
| Прив. Перевозчики нарис | 2 (5) | 7,0 | 0,8 | 25 | 25 | 15 | 0 |
| Прив. горловины | 15 (38) | 7,8 | 0,8 | 21 | 17 | 0 | 13 |
| Прив.нарис / горловые держатели | 11 (28) | 7,8 | 1,0 | 25 | 25 | 21 | 19 |
| Несъемные держатели | 11 (28) | 7,1 | 18 | 6 | 7 | ||
| Все | 39 | 7,6 | 0,8 | 23 | 20 | 8 | 12 |
Образцы полос SmaI PFGE для штаммов S. aureus , выделенных от четырех человек, определенных как предпочтительные носители через горло (индивидуумы 5, 9, 12 и 13 [рис.]). Время отбора проб указано над пробами со следующими сокращениями: м3, март 2003 г .; A, апрель 2003 г .; М, май 2003 г .; J, июнь 2003 г .; Au, август 2003 г .; S, сентябрь 2003 г .; N, ноябрь 2003 г .; m4, март 2004 г .; a5, апрель 2005 г.У пациента 5 в двух случаях были положительные результаты в передних ноздрях и глотке. Подчеркнуты образцы из передних ноздрей.
ОБСУЖДЕНИЕ
S. aureus чаще выделяли из глотки, чем из передних носовых ходов, в двух неродственных популяциях. Поскольку 259 пациентов были отобраны при поступлении в ортопедическое отделение, их статус колонизации, вероятно, не связан с группой или с 87 членами персонала того же отделения, которые также были отобраны.Средний возраст группы пациентов был намного выше, чем средний возраст группы персонала. Женщины были перепредставлены в обеих группах, но не наблюдалось значительной разницы в показателях изоляции между мужчинами и женщинами в группе пациентов (данные не показаны). Поэтому мы не думаем, что наши результаты связаны с полом или возрастом, и мы не думаем, что результаты представляют собой явление в одной популяции.
Наши результаты показывают, что S. aureus редко переносился только в передние ноздри.Если были колонизированы передние носовые ходы, бактерии, за редким исключением, также присутствовали в глотке. Это может иметь важные последствия. Поскольку носительство S. aureus передним носиком является хорошо задокументированным фактором риска инфицирования S. aureus (11), профилактическая деколонизация носителей была опробована с различными группами пациентов (12). Распространение MRSA среди пациентов и персонала медицинских учреждений также требует эффективных схем деколонизации.Обычно используемый протокол включает местную обработку передних носов мупироцином, иногда в сочетании с применением дезинфицирующих средств для кожи. Для большинства групп пациентов исследования не показали значительного снижения инфицирования (12, 26). Некоторым исключением являются пациенты, находящиеся на гемодиализе (5), пациенты на перитонеальном диализе (1) и пациенты общей хирургии (18). Наблюдалась реколонизация тем же штаммом S. aureus после периода лечения (17, 27).Источником бактерий в этих случаях могут быть другие места носительства на пациенте (например, горло), люди или предметы в окружающей среде пациента. Было показано, что повторное лечение приводит к развитию устойчивости к мупироцину (13, 23). Во время лечения передних носовых ходов наблюдались низкие концентрации мупироцина в горле (24). Кроме того, было поставлено под сомнение влияние назального лечения мупироцином на колонизацию горла (8, 25). В совокупности это может означать, что стандартный протокол деколонизации S.aureus может создать ситуацию, благоприятствующую развитию резистентности к мупироцину в горле у пролеченных людей. Остаточные бактерии в горле также могут быть одной из причин (из нескольких) повторной колонизации после лечения. Kluytmans и Wertheim предположили, что одним из способов повышения эффективности будущих схем лечения могло бы быть устранение S. aureus также из экстраназальных участков (12). Принимая во внимание наши результаты, лечение, также нацеленное на горло, может уменьшить проблемы с резистентностью к мупироцину и повторной колонизацией и, возможно, привести к большей эффективности с точки зрения снижения инфекции.
Большая группа преимущественно колонизировалась только в горле, в большинстве случаев одним и тем же штаммом в течение нескольких месяцев и даже лет. Очевидно, что эти люди не были бы обнаружены как носители, если бы были взяты образцы только из передних носовых ходов. Назальное носительство, по-видимому, играет центральную роль в эпидемиологии и патогенезе инфекции S. aureus (11, 12), а риски, связанные с носительством через горло, в значительной степени неизвестны. Половина предпочтительных носителей из глотки давала положительный результат на культуру передних носовых ходов хотя бы один раз за период исследования.Необходимы дальнейшие исследования, чтобы определить, какой риск представляет эта группа носителей S. aureus с точки зрения распространения микроорганизма и инфекции. Между тем, при попытке идентифицировать носителей MRSA и S. aureus в различных ситуациях представляется разумным использовать обогащенный бульон (15) и включать горло. Если нужно взять образец только с одного участка, вероятно, лучше выбрать горло, чем передние ноздри.
В этом исследовании 39 из 67 человек, или около 60%, были охарактеризованы как стойкие носители.Это примерно в два или даже три раза больше, чем указано ранее (27). Это несоответствие, вероятно, связано с сочетанием чувствительной техники скрининга, включения горла в качестве места носительства и другого определения стойкого носительства (ДИ> 0,5). Изменение определения в основном связано с группой предпочтительных носителей горла. Промежуточные отрицательные образцы, снижающие доверительный интервал для этой группы, вероятно, были связаны с ложноотрицательными результатами, а не с тем фактом, что человек стал не носителем.Этот вывод кажется разумным, поскольку в большинстве случаев один и тот же штамм был извлечен до и после отрицательных случаев отбора проб. Наблюдаемый более низкий ДИ для предпочтительных носителей глотки означает, что взятие пробы из глотки дает меньше организмов, чем отбор проб из передних носовых ходов, либо потому, что метод отбора проб неоптимален, либо, что более вероятно, потому, что в месте отбора пробы присутствует небольшое количество организмов. Вероятная причина более высокого, чем ожидалось, уровня S. aureus в горле (по сравнению с уровнем в передних ноздрях) заключается в том, что мы увеличили чувствительность, используя обогащенный бульон.Использование того же бульона с метициллином увеличивало скорость выделения MRSA на 35% в предыдущем исследовании (15).
Мы наблюдали почти на 20% более высокий уровень носительства S. aureus в весенние месяцы марта и апреля, чем в летний август. Более высокая частота была более выражена для горла. Поскольку колонизация и прикрепление S. aureus (и других бактерий) к глотке увеличивается во время вирусной инфекции (7, 19), объяснение может заключаться в том, что пик инфекций верхних дыхательных путей весной в Швеции приводит к большему количеству инфекций. колонизированы особи.Кроме того, вирусные инфекции вызывают увеличение количества бактерий в горле, тем самым повышая вероятность получения положительной культуры. Эти сезонные колебания, вероятно, также являются объяснением наблюдаемого более чем на 10% более высокого процента носителей среди персонала, чем среди пациентов. Первые пробы у большинства сотрудников были взяты в марте, но пациенты отбирались с марта по сентябрь. Насколько нам известно, сезонная вариация носительства S. aureus ранее не описывалась, но заслуживает дальнейшего внимания.
В заключение, глотку следует рассматривать как важное место носительства S. aureus , и его следует учитывать при скрининге на S. aureus , включая MRSA. Наши результаты также показывают, что носительство S. aureus в передних носовых ходах в большинстве случаев указывает на присутствие микроорганизма в горле, хотя и в меньших количествах. Это необходимо учитывать при разработке протоколов деколонизации.
Благодарности
Этот проект частично финансировался за счет исследовательского гранта Совета графства Халланд, Швеция.
Мы благодарны персоналу ортопедического отделения и отделения клинической микробиологии окружной больницы Хальмстада, Швеция, за помощь со сбором образцов. Эксперименты по гель-электрофорезу в импульсном поле были выполнены с большим мастерством микробиологом Усамой Назаром.
СПИСОК ЛИТЕРАТУРЫ
1. Американское общество нефрологов. 1996. Назальный мупироцин предотвращает инфекцию места выхода Staphylococcus aureus во время перитонеального диализа. Варенье. Soc. Нефрол.7 : 2403-2408. [PubMed] [Google Scholar] 2. Баннерман, Т. Л., Г. А. Хэнкок, Ф. К. Теновер и Дж. М. Миллер. 1995. Гель-электрофорез в импульсном поле вместо бактериофагового типирования Staphylococcus aureus . J. Clin. Microbiol. 33 : 551-555. [Бесплатная статья PMC] [PubMed] [Google Scholar] 3. Беркович М., М. Булковштейн, Д. Жовтис, Р. Гринберг, Ю. Ницан, Б. Барзилай и И. Болдур. 2002. Скорость колонизации бактерий в горле здоровых младенцев.Int. J. Pediatr. Оториноларингол. 63 : 19-24. [PubMed] [Google Scholar] 5. Boelaert, J. R., R. A. De Smedt, Y. A. De Baere, C. A. Godard, E. G. Matthys, M. L. Schurgers, R.F.Daneels, B.Z. Gordts и H. W. Van Landuyt. 1989. Влияние назальной мази с мупироцином кальция на заболеваемость Staphylococcus aureus инфекциями у пациентов, находящихся на гемодиализе. Нефрол. Набирать номер. Пересадка. 4 : 278-281. [PubMed] [Google Scholar] 6. Эриксен, Н. Х., Ф.Эсперсен, В. Т. Росдаль и К. Йенсен. 1995. Носительство Staphylococcus aureus среди 104 здоровых лиц в течение 19 месяцев. Эпидемиол. Заразить. 115 : 51-60. [Бесплатная статья PMC] [PubMed] [Google Scholar] 7. Файнштейн В., Д. М. Мушер и Т. Р. Кейт. 1980. Прилипание бактерий к клеткам глотки во время вирусной инфекции. J. Infect. Дис. 141 : 172-176. [PubMed] [Google Scholar] 8. Хаякава Т., Т. Хаясидера, С. Кацура, К. Йонеда и Т.Кусуноки. 2000. Назальное лечение мупироцином метициллин-резистентных, колонизированных глоткой. Staphylococcus aureus : предварительное исследование с участием 10 младенцев-носителей. Педиатр. Int. 42 : 67-70. [PubMed] [Google Scholar] 9. Хаякава Т., Т. Хаясидера, К. Йонеда, С. Кагава и Т. Кусуноки. 1999. Преимущественная колонизация глотки метициллин-резистентным Staphylococcus aureus у младенцев. J. Pediatr. 134 : 252. [PubMed] [Google Scholar] 10. Ху, Л., А. Умеда, С. Кондо, К. Амако. 1995. Типирование Staphylococcus aureus , колонизирующего носовые носители человека с помощью гель-электрофореза в импульсном поле. J. Med. Microbiol. 42 : 127-132. [PubMed] [Google Scholar] 11. Клюйтманс, Дж., А. ван Белкум и Х. Вербру. 1997. Носительство золотистого стафилококка : эпидемиология, основные механизмы и связанные риски. Clin. Microbiol. Ред. 10 : 505-520. [Бесплатная статья PMC] [PubMed] [Google Scholar] 12. Kluytmans, J. A., and H. F. Wertheim. 2005. Носительство Staphylococcus aureus и профилактика внутрибольничных инфекций. Инфекция 33 : 3-8. [PubMed] [Google Scholar] 13. М. Крескен, Д. Хафнер, Ф. Дж. Шмитц и Т. А. Вихельхаус. 2004. Распространенность устойчивости к мупироцину у клинических изолятов Staphylococcus aureus и Staphylococcus epidermidis : результаты исследования устойчивости к противомикробным препаратам Общества химиотерапии Поля-Эрлиха, 2001.Int. J. Antimicrob. Агенты 23 : 577-581. [PubMed] [Google Scholar] 14. Lowy, F. D. 1998. Staphylococcus aureus, инфекции. N. Engl. J. Med. 339 : 520-532. [PubMed] [Google Scholar] 15. Нильссон П., Х. Александерссон и Т. Рипа. 2005. Использование обогащения бульона и ПЦР в реальном времени для исключения присутствия метициллин-устойчивого Staphylococcus aureus в клинических образцах: чувствительный подход к скринингу. Clin. Microbiol. Заразить.11 : 1027-1034. [PubMed] [Google Scholar] 16. Паррас Ф., М. К. Герреро, Э. Боуза, М. Х. Бласкес, С. Морено, М. К. Менаргес и Э. Серценадо. 1995. Сравнительное исследование мупироцина и перорального ко-тримоксазола плюс местная фузидиевая кислота в искоренении носительства метициллин-резистентного Staphylococcus aureus . Противомикробный. Агенты Chemother. 39 : 175-179. [Бесплатная статья PMC] [PubMed] [Google Scholar] 17. Пена, К., Н. Фернандес-Сабе, М. А. Домингес, М.Pujol, A. Martinez-Castelao, J. Ayats, F. Gudiol и J. Ariza. 2004. Staphylococcus aureus носительство в носу у пациентов на гемодиализе: роль кожной колонизации. J. Hosp. Заразить. 58 : 20-27. [PubMed] [Google Scholar] 18. Перл, Т. М., Дж. Дж. Каллен, Р. П. Венцель, М. Б. Циммерман, М. А. Пфаллер, Д. Шеппард, Дж. Туомбли, П. П. Френч и Л. А. Хервальд. 2002. Мупироцин для интраназального введения для профилактики послеоперационных инфекций, вызванных Staphylococcus aureus. N. Engl.J. Med. 346 : 1871-1877. [PubMed] [Google Scholar] 19. Рамирес-Ронда, К. Х., З. Фуксенч-Лопес и М. Неварес. 1981. Повышенная бактериальная колонизация глотки при вирусном заболевании. Arch. Междунар. Med. 141 : 1599-1603. [PubMed] [Google Scholar] 20. Рейган Д. Р., Б. Н. Доббелинг, М. А. Пфаллер, К. Т. Шитц, А. К. Хьюстон, Р. Дж. Холлис и Р. П. Венцель. 1991. Ликвидация совпадающего носового и ручного стафилококка золотистого стафилококка с помощью интраназального применения кальциевой мази мупироцина.Аня. Междунар. Med. 114 : 101-106. [PubMed] [Google Scholar] 21. Теновер, Ф. К., Р. Д. Арбайт, Р. В. Геринг, П. А. Микельсен, Б. Э. Мюррей, Д. Х. Персинг и Б. Сваминатан. 1995. Интерпретация паттернов рестрикции хромосомной ДНК, полученных с помощью гель-электрофореза в импульсном поле: критерии типирования бактериальных штаммов. J. Clin. Microbiol. 33 : 2233-2239. [Бесплатная статья PMC] [PubMed] [Google Scholar] 22. Э. Уэмура, С. Какинохана, Н. Хига, К. Тома и Н. Накасоне. 2004. Сравнительная характеристика изолятов Staphylococcus aureus из глотки и носа здоровых добровольцев. Jpn. J. Infect. Дис. 57 : 21-24. [PubMed] [Google Scholar] 23. Уокер, Э. С., Ф. Леви, М. Шорман, Г. Дэвид, Дж. Абдалла и Ф. А. Сарубби. 2004. Снижение резистентности к мупироцину у метициллин-резистентных Staphylococcus aureus сопровождалось административным контролем за назначениями. J. Clin. Microbiol. 42 : 2792-2795. [Бесплатная статья PMC] [PubMed] [Google Scholar] 24. Ватанабэ Х., Х. Масаки, Н. Асо, К. Ватанабэ, К. Оиси, С. Кобаяси, А. Сато, Р. Сугита и Т. Нагатаке. 2001. Низкие концентрации мупироцина в глотке после интраназального введения могут способствовать устойчивости к мупироцину у метициллин-резистентных Staphylococcus aureus . J. Clin. Microbiol. 39 : 3775-3777. [Бесплатная статья PMC] [PubMed] [Google Scholar] 25. Wertheim, H.F., J. Verveer, H.A. Boelens, A. van Belkum, H.A. Verbrugh и M.C. Vos. 2005. Влияние лечения мупироцином на носительство в носу, глотке и промежности Staphylococcus aureus у здоровых взрослых. Противомикробный. Агенты Chemother. 49 : 1465-1467. [Бесплатная статья PMC] [PubMed] [Google Scholar] 26. Вертхайм, Х. Ф., М. К. Вос, А. Отт, А. Восс, Дж. А. Клюйтманс, К. М. Ванденбрук-Граулс, М. Х. Мистер, П. Х. ван Койлен и Х. А. Вербру. 2004. Профилактика мупироцином против нозокомиальных инфекций Staphylococcus aureus у нехирургических пациентов: рандомизированное исследование.Аня. Междунар. Med. 140 : 419-425. [PubMed] [Google Scholar]Staphylococcus aureus Колонизация горла происходит чаще, чем колонизация передних ноздрей
J Clin Microbiol. 2006 сен; 44 (9): 3334–3339.
Петер Нильссон
Отделение клинической микробиологии и инфекционного контроля, Окружная больница Хальмстада, Хальмстад, Швеция
Торвальд Рипа
Отделение клинической микробиологии и инфекционного контроля, Окружная больница Хальмстада, Хальмстад, Швеция
Отделение Клиническая микробиология и инфекционный контроль, Окружная больница Хальмстада, Хальмстад, Швеция
* Автор, ответственный за переписку.Почтовый адрес: Отдел клинической микробиологии и инфекционного контроля, окружная больница Хальмстада, S-30185 Хальмстад, Швеция. Телефон: 46 35 136549. Факс: 46 35 131869. Электронная почта: [email protected].Поступило 26 апреля 2006 г .; Пересмотрено 10 июня 2006 г .; Принято 24 июня 2006 г.
Copyright © 2006, Американское общество микробиологов. Эта статья цитируется в других статьях в PMC.Abstract
Целью данного исследования было определение частоты и устойчивости носительства Staphylococcus aureus в глотке по отношению к носительству переднего носа.При использовании чувствительного обогащающего бульона S. aureus было культивировано из двух участков от 259 пациентов при поступлении в ортопедическое отделение и от 87 сотрудников одного отделения. Горло было наиболее частым местом носительства в обеих группах. Сорок процентов пациентов и 54% медперсонала были положительными на S. aureus в горле, по сравнению с 31% и 36%, соответственно, в передних ноздрях. Чтобы определить стойкость носительства, у 67 человек были повторно взяты пробы из передних носовых ходов и горла в течение 2 лет (от 5 до 10 раз; в среднем 7.8). Большинство, 58% (39/67), были определены как постоянные носители S. aureus с учетом результатов посева на обоих участках. Из 39 постоянных носителей 15 человек имели положительный результат посева только из глотки более чем в половине случаев отбора проб (они называются предпочтительными носителями из глотки), в то время как только 5% (два человека) были предпочтительными носителями передних нервных окончаний согласно тому же определению . Типирование собранных изолятов S. aureus с помощью гель-электрофореза в импульсном поле показало, что тот же штамм S.aureus с течением времени присутствовал в глотке человека, по крайней мере, в той же степени, что и в передних ноздрях. Горло-носительство было по крайней мере таким же устойчивым, как и носительство в передних ноздрях.
Помимо того, что это основной патоген для человека (14), Staphylococcus aureus колонизирует значительную часть популяций человека (27). Передние ноздри считаются первичным местом колонизации (11, 14), и примерно 30% здоровых людей переносят бактерии в передних ноздрях.Уровень носительства, близкий к 60%, был описан ранее для определенных популяций (11). Человеческое горло менее изучено как место носительства, и ранее сообщалось о различных уровнях изоляции. Boe et al. сообщили о частоте изоляции 31% пациентов, помещенных в медицинское отделение (4), а Uemura et al. сообщили, что уровень изоляции в группе здоровых взрослых добровольцев составил 29% (22). Беркович и др. обнаружили бактерии в горле у 10% здоровых детей в возрасте до 2 лет (3). Также были отмечены более высокие, чем ожидалось, показатели устойчивости к метициллину S.aureus (MRSA) в горле младенцев (9). Область промежности, по-видимому, является обычным местом носительства, но редко является единственным местом колонизации (4). Также ранее было описано носительство на различных участках кожи. Однако это, по-видимому, вторично по отношению к носительству или инфекции в других местах, поскольку удаление носовых колоний с помощью местного лечения в большинстве случаев устраняет носительство через кожу (16, 20).
Были описаны три основных типа носительства, когда у людей неоднократно брали пробы в передних ноздрях на S.aureus в течение более длительного периода. Сообщалось, что от 6 до 60% никогда не были переносчиками микроорганизмов (не носители), а от 14 до 33% были повторно положительными по культуре (постоянные носители). Остальные особи время от времени дают положительные культуры и характеризуются как случайные или периодические носители (6, 10, 27). Различия между исследованиями могут быть связаны с различными методами выборки и / или вариациями в определениях различных состояний носителей. Постоянные носители, как правило, с течением времени несут один и тот же тип или генотип фага чаще, чем прерывистые и случайные носители (6, 27).Насколько нам известно, структура носительства с течением времени не исследовалась ни в одном месте отбора проб, кроме передних ноздрей.
Целью этого исследования было определение частоты и устойчивости носительства в глотке по сравнению с носительством переднего нареза S. aureus . Мы использовали метод чувствительной культуры, чтобы свести к минимуму ошибки, возникающие из-за низкой скорости восстановления. Все изоляты были генотипированы с помощью гель-электрофореза в импульсном поле SmaI (PFGE).
МАТЕРИАЛЫ И МЕТОДЫ
Пациенты и
S.aureus отбор проб.Все образцы были собраны в рамках плановой схемы эпиднадзора за инфекциями в окружной больнице Хальмстада, Швеция.
Образцы были собраны с помощью тампона с вискозным наконечником и угольной транспортной среды Amies (114C.US) (Копан, Италия). Образцы из передних ноздрей брали путем вращения кончика тампона в обеих ноздрях, а из горла — путем вращения кончика тампона на обеих миндалинах.
Пациенты, поступившие в ортопедическое отделение окружной больницы Хальмстада, Швеция, с марта по сентябрь 2003 г., по прибытии были исследованы на предмет наличия S.aureus . Среди 259 отобранных пациентов 62% составляли женщины, средний возраст 74,4 года, и 38% — мужчины, средний возраст 64,3 года. В марте было взято 20 пациентов, 72 — в апреле, 57 — в мае, 20 — в июне, 17 — в июле, 38 — в августе и 35 — в сентябре.
Персонал ортопедического отделения был проинструктирован самостоятельно взять мазок, вращая тампон в обоих передних носовых ходах и отдельный тампон на обеих миндалинах. Пробы брались у всех дежурных сотрудников в течение 1 недели каждый месяц с марта по сентябрь 2003 г. (за исключением июня и июля, когда палата была закрыта большую часть времени), а затем в течение 1 недели в ноябре 2003 г., марте 2004 г. и апреле. 2005 г., всего девять раз.Не все сотрудники были доступны постоянно, и в течение периода исследования были включены новые сотрудники. Всего в ортопедическом отделении было отобрано 87 отдельных сотрудников (70 женщин, средний возраст 40 лет, и 17 мужчин, средний возраст 34 года).
У группы из 67 человек повторно брали пробы из передних носовых ходов и глотки в течение 24 месяцев. Группа состояла из 34 сотрудников ортопедического отделения и 33 сотрудников отделения клинической микробиологии и инфекционного контроля окружной больницы Хальмстада, Швеция.Из этих 67 человек 63 были женщинами и 4 мужчинами, их средний возраст на момент первого отбора проб составлял 44 года. В период с марта 2003 г. по март 2005 г. они отбирались как минимум пять раз (в среднем 7,8 раз; диапазон от 5 до 10). Всего было собрано 384 изолята S. aureus , и их клональные отношения были определены с помощью анализа PFGE.
S. aureus , изоляция.Все образцы мазков инкубировали в течение 16–18 ч при 37 ° C в шейкере (100 об / мин) в аэробных условиях в 3 мл обогащающего бульона со следующим составом: 15.0 г протеозопептона (Oxoid, Бейзингсток, Англия), 2,5 г печеночного переваривающего вещества (Oxoid), 5,0 г дрожжевого экстракта (Oxoid), 25,0 г NaCl, 10,0 г маннита, 16 мг / л фенилового красного и 8 мг азтреонама в финальной стадии. объем 1 литр (конечный pH 7,0 ± 0,1). Затем порцию (10 мкл) бульона высевали на чашку с кровяным агаром и инкубировали при 37 ° C в течение ночи. Подозреваемые колонии были выделены на чашке с кровяным агаром и идентифицированы как S. aureus с использованием теста ДНКазы и латексного теста Staphaurex (Remel Europe Ltd., Дартфорд, Англия). Когда эти методы не совпадали, присутствие гена термостабильной нуклеазы анализировали с помощью ПЦР, как описано Nilsson et al. (15). Один единственный изолят S. aureus был выделен из каждого образца. Возможное присутствие более одного штамма в каждом образце не учитывалось. Все изолированные штаммы S. aureus собирали и хранили при -70 ° C для дальнейшего анализа.
ПФГЭ.
Штаммы, собранные в ходе исследования, были проанализированы с помощью PFGE, как описано Bannerman et al.(2). Структуры полос изолятов анализировали с использованием программного обеспечения Molecular Analyst, версия 1.6 (Bio-Rad Laboratories, Геркулес, Калифорния), методом групповой кластеризации невзвешенных пар с использованием средних связей и коэффициента Дайса. Штаммы с более чем 80% сходством были сгруппированы в клональные группы и названы с заглавной буквы от A до X. Изоляты от одного и того же человека, но собранные в разных случаях, также сравнивали друг с другом. Во всех случаях, когда они принадлежали к одной и той же клональной группе, они находились в пределах трех разностей полос (21).Это означает, что изоляты от разных индивидуумов, но названные одной и той же буквой, имели не менее 80% сходства при компьютерном кластерном анализе, в то время как изоляты от одного индивидуума с тем же именем имели различия <4 полос.
Расчеты и определения.
Индекс носителя (ДИ) был определен как количество положительных мазков, деленное на общее количество мазков для каждого человека, как описано Eriksen et al. (6). Однако определения состояний носителей отличаются от определений, используемых Eriksen et al.В нашей работе постоянный носитель определяется как человек с CI> 0,5; для случайного носителя 0
РЕЗУЛЬТАТЫ
Носительство S. aureus у пациентов и персонала.В течение периода исследования с марта 2003 г. по сентябрь 2003 г. у 259 пациентов, поступивших в ортопедическое отделение, были взяты образцы при поступлении как в передние ноздри, так и в глотку. Скорость выделения S. aureus из разных участков представлена в таблице.В общей сложности S. aureus было выделено у 125 из 259 пациентов (48%) на любом из участков. Наиболее частым местом изоляции было горло (40% пациентов), за которым следовали передние ноздри (31% пациентов). Разница в частоте изоляции между передними ноздрями и глоткой была статистически значимой ( P = 0,037). Если бы передние ноздри были единственным местом скрининга, было бы идентифицировано 64% (80/125) из носителей S. aureus , тогда как взятие пробы только из глотки позволило бы идентифицировать 83% (104/125).Не было обнаружено значительных различий между мужчинами и женщинами в отношении показателей изоляции из разных участков (данные не показаны).
ТАБЛИЦА 1.
Степень изоляции S. aureus в передних ноздрях и горле среди пациентов и персонала ортопедического отделения
| Результат для ноздрей a | Результат для горла a | Количество (%) лиц с результатом | ||
|---|---|---|---|---|
| Пациенты | Персонал | Пациенты и персонал | ||
| Поз. | Поз. | 59 (23) | 24 (28) | 83 (24) Поз. | 21 (8) | 7 (8) | 28 (8) |
| Отрицательный | Поз. | 45 (17) | 23 (26) | 68 (20) |
| Отрицательный | Отр. | 134 (52) | 33 (38) | 167 (48) |
| Итого | 259 | 87 | 346 | |
За период исследования Персоналу отделения предлагалось ежемесячно проводить забор образцов из носа и горла.В таблице мы суммировали частоту выделения S. aureus при первом взятии проб у 87 сотрудников. Шестьдесят два процента (54/87) были положительными на любом из сайтов. Как и в группе пациентов, наиболее частым местом изоляции было горло (54% положительных результатов по сравнению с 36% в передних ноздрях; P = 0,023).
Всего обследовано 346 пациентов и сотрудников; 32% были положительными в передней части носа (доверительный интервал 95%, от 27 до 37%) и 44% были положительными в области горла (доверительный интервал 95%, от 38 до 49%).Разница в частоте изоляции между передними ноздрями и глоткой была статистически значимой, со значением P , равным 0,003.
На рисунке показаны уровни изоляции персонала и пациентов за каждый месяц. Общее количество отобранных особей составило 67 человек в марте, 114 в апреле, 99 в мае, 82 в августе и 76 в сентябре. Данные за июнь и июль не представлены, поскольку большую часть этого времени отделение было закрыто. Общий уровень перевозок был самым высоким в марте (66%) и самым низким в августе (48%).Кроме того, горло носительство имело тенденцию к снижению с 58% до 38% за тот же период. При каждом взятии проб горло носительство было более частым, чем носовое.
Уровень изоляции S. aureus среди персонала и пациентов ортопедического отделения с марта по сентябрь 2003 г.
Носительство во времени.
Для изучения характера носительства S. aureus с течением времени у группы из 67 человек были повторно взяты пробы из передних ноздрей и глотки в течение до 24 месяцев.Всего был взят 521 мазок из передних отделов носа и глотки; 152 (29%) оказались положительными на S. aureus в передних ноздрях и 232 (45%) в горле.
67 человек были сгруппированы в постоянных носителей, случайных носителей и не носителей на основе ДИ, рассчитанных на основе результатов посева только из передних носовых ходов, результатов только из горла и комбинированных результатов из обоих участков (таблица). Основываясь только на результатах анализа передних носовых ходов, 25% (17/67) пациентов были классифицированы как стойкие носители, по сравнению с 58% (39/67), когда были добавлены результаты мазков из зева.Результаты культивирования в каждом случае отбора проб для 39 человек, классифицированных как стойкие носители, представлены на рис.
Носительство S. aureus в передних ноздрях и глотке среди 39 постоянных носителей. Красный прямоугольник представляет положительные результаты только для передних ноздрей в этом случае отбора проб, оранжевый прямоугольник означает положительный результат для передних ноздрей и горла, желтый прямоугольник дает положительный результат только для горла, синий прямоугольник отрицательный в обоих местах, а серый прямоугольник означает образец не был взят.Буква (ы) в каждом поле обозначает клональный тип (ы) выделенного штамма S. aureus , как определено с помощью PFGE. В оранжевых квадратах (положительный результат в передних ноздрях и глотке) первая буква дает клональный тип в передних ноздрях, а вторая — в глотке. «$» Представляет клональный тип, уникальный для данного человека. Время отбора проб указано вверху со следующими сокращениями: M3, март 2003 г .; A, апрель 2003 г .; Mj, май-июнь 2003 г .; Jn, июнь 2003 г .; J, июль 2003 г .; Au, август 2003 г .; S, сентябрь 2003 г .; О, октябрь 2003 г .; N, ноябрь 2003 г .; D, декабрь 2003 г .; J, январь 2004 г .; F, февраль 2004 г .; M4, март 2004 г .; A5, апрель 2005 г.
ТАБЛИЦА 2.
Результаты от 67 человек, повторно взятых из передних носовых ходов и горла не менее пяти раз в течение 25 месяцев a
| Группа | Количество (%) лиц в группе, классифицирован по культуре из: | |||
|---|---|---|---|---|
| Ноздри | Горло | Ноздри или горло | ||
| Постоянные носители | 17 (25) | 31 (46) | 39 (58) | 9014 | 18 (27) | 14 (21) |
| Несущих | 29 (43) | 18 (27) | 14 (21) | |
На основе наиболее часто встречающихся мест перевозки Со временем 39 постоянных носителей можно сгруппировать в следующие группы: предпочтительные носители передних нервов, т.е.д., особи с положительным результатом только в передних ноздрях более чем в половине случаев отбора проб; предпочтительные носители горла, т. е. люди с положительным результатом только в горле более чем в половине случаев; преимущественно носители переднего носа / глотки, т. е. люди с положительным результатом в переднем отделе ноздрей и глотки более чем в половине случаев; и неопределимые носители, постоянные носители со смешанной схемой перевозки на основе места отбора проб. Согласно этим определениям, 5% постоянных носителей были предпочтительными носителями передних нервов (индивиды 1 и 2 [Рис.]), 38% были предпочтительными носителями горла (люди от 3 до 17 [Рис.]), 28% были предпочтительными носителями передней части носа / горла (люди от 18 до 28 [Рис.]), И еще 28% имели смешанный характер носительства. по месту отбора (особи от 29 до 39 [рис.]) (таблица).
ТАБЛИЦА 3.
Результаты 39 стойких носителей S. aureus , сгруппированных по наиболее частым местам носительства
| Группа a | Количество (%) лиц в группе | Средн. №выборок | Ср. ДИ | Ср. период исследования (мес.) | Ср. время носителя (мес) | Ср. одного и того же штамма, содержащегося в: | |
|---|---|---|---|---|---|---|---|
| Ноздри | Горло | ||||||
| Прив. Перевозчики нарис | 2 (5) | 7,0 | 0,8 | 25 | 25 | 15 | 0 |
| Прив. горловины | 15 (38) | 7,8 | 0,8 | 21 | 17 | 0 | 13 |
| Прив.нарис / горловые держатели | 11 (28) | 7,8 | 1,0 | 25 | 25 | 21 | 19 |
| Несъемные держатели | 11 (28) | 7,1 | 18 | 6 | 7 | ||
| Все | 39 | 7,6 | 0,8 | 23 | 20 | 8 | 12 |
Образцы полос SmaI PFGE для штаммов S. aureus , выделенных от четырех человек, определенных как предпочтительные носители через горло (индивидуумы 5, 9, 12 и 13 [рис.]). Время отбора проб указано над пробами со следующими сокращениями: м3, март 2003 г .; A, апрель 2003 г .; М, май 2003 г .; J, июнь 2003 г .; Au, август 2003 г .; S, сентябрь 2003 г .; N, ноябрь 2003 г .; m4, март 2004 г .; a5, апрель 2005 г.У пациента 5 в двух случаях были положительные результаты в передних ноздрях и глотке. Подчеркнуты образцы из передних ноздрей.
ОБСУЖДЕНИЕ
S. aureus чаще выделяли из глотки, чем из передних носовых ходов, в двух неродственных популяциях. Поскольку 259 пациентов были отобраны при поступлении в ортопедическое отделение, их статус колонизации, вероятно, не связан с группой или с 87 членами персонала того же отделения, которые также были отобраны.Средний возраст группы пациентов был намного выше, чем средний возраст группы персонала. Женщины были перепредставлены в обеих группах, но не наблюдалось значительной разницы в показателях изоляции между мужчинами и женщинами в группе пациентов (данные не показаны). Поэтому мы не думаем, что наши результаты связаны с полом или возрастом, и мы не думаем, что результаты представляют собой явление в одной популяции.
Наши результаты показывают, что S. aureus редко переносился только в передние ноздри.Если были колонизированы передние носовые ходы, бактерии, за редким исключением, также присутствовали в глотке. Это может иметь важные последствия. Поскольку носительство S. aureus передним носиком является хорошо задокументированным фактором риска инфицирования S. aureus (11), профилактическая деколонизация носителей была опробована с различными группами пациентов (12). Распространение MRSA среди пациентов и персонала медицинских учреждений также требует эффективных схем деколонизации.Обычно используемый протокол включает местную обработку передних носов мупироцином, иногда в сочетании с применением дезинфицирующих средств для кожи. Для большинства групп пациентов исследования не показали значительного снижения инфицирования (12, 26). Некоторым исключением являются пациенты, находящиеся на гемодиализе (5), пациенты на перитонеальном диализе (1) и пациенты общей хирургии (18). Наблюдалась реколонизация тем же штаммом S. aureus после периода лечения (17, 27).Источником бактерий в этих случаях могут быть другие места носительства на пациенте (например, горло), люди или предметы в окружающей среде пациента. Было показано, что повторное лечение приводит к развитию устойчивости к мупироцину (13, 23). Во время лечения передних носовых ходов наблюдались низкие концентрации мупироцина в горле (24). Кроме того, было поставлено под сомнение влияние назального лечения мупироцином на колонизацию горла (8, 25). В совокупности это может означать, что стандартный протокол деколонизации S.aureus может создать ситуацию, благоприятствующую развитию резистентности к мупироцину в горле у пролеченных людей. Остаточные бактерии в горле также могут быть одной из причин (из нескольких) повторной колонизации после лечения. Kluytmans и Wertheim предположили, что одним из способов повышения эффективности будущих схем лечения могло бы быть устранение S. aureus также из экстраназальных участков (12). Принимая во внимание наши результаты, лечение, также нацеленное на горло, может уменьшить проблемы с резистентностью к мупироцину и повторной колонизацией и, возможно, привести к большей эффективности с точки зрения снижения инфекции.
Большая группа преимущественно колонизировалась только в горле, в большинстве случаев одним и тем же штаммом в течение нескольких месяцев и даже лет. Очевидно, что эти люди не были бы обнаружены как носители, если бы были взяты образцы только из передних носовых ходов. Назальное носительство, по-видимому, играет центральную роль в эпидемиологии и патогенезе инфекции S. aureus (11, 12), а риски, связанные с носительством через горло, в значительной степени неизвестны. Половина предпочтительных носителей из глотки давала положительный результат на культуру передних носовых ходов хотя бы один раз за период исследования.Необходимы дальнейшие исследования, чтобы определить, какой риск представляет эта группа носителей S. aureus с точки зрения распространения микроорганизма и инфекции. Между тем, при попытке идентифицировать носителей MRSA и S. aureus в различных ситуациях представляется разумным использовать обогащенный бульон (15) и включать горло. Если нужно взять образец только с одного участка, вероятно, лучше выбрать горло, чем передние ноздри.
В этом исследовании 39 из 67 человек, или около 60%, были охарактеризованы как стойкие носители.Это примерно в два или даже три раза больше, чем указано ранее (27). Это несоответствие, вероятно, связано с сочетанием чувствительной техники скрининга, включения горла в качестве места носительства и другого определения стойкого носительства (ДИ> 0,5). Изменение определения в основном связано с группой предпочтительных носителей горла. Промежуточные отрицательные образцы, снижающие доверительный интервал для этой группы, вероятно, были связаны с ложноотрицательными результатами, а не с тем фактом, что человек стал не носителем.Этот вывод кажется разумным, поскольку в большинстве случаев один и тот же штамм был извлечен до и после отрицательных случаев отбора проб. Наблюдаемый более низкий ДИ для предпочтительных носителей глотки означает, что взятие пробы из глотки дает меньше организмов, чем отбор проб из передних носовых ходов, либо потому, что метод отбора проб неоптимален, либо, что более вероятно, потому, что в месте отбора пробы присутствует небольшое количество организмов. Вероятная причина более высокого, чем ожидалось, уровня S. aureus в горле (по сравнению с уровнем в передних ноздрях) заключается в том, что мы увеличили чувствительность, используя обогащенный бульон.Использование того же бульона с метициллином увеличивало скорость выделения MRSA на 35% в предыдущем исследовании (15).
Мы наблюдали почти на 20% более высокий уровень носительства S. aureus в весенние месяцы марта и апреля, чем в летний август. Более высокая частота была более выражена для горла. Поскольку колонизация и прикрепление S. aureus (и других бактерий) к глотке увеличивается во время вирусной инфекции (7, 19), объяснение может заключаться в том, что пик инфекций верхних дыхательных путей весной в Швеции приводит к большему количеству инфекций. колонизированы особи.Кроме того, вирусные инфекции вызывают увеличение количества бактерий в горле, тем самым повышая вероятность получения положительной культуры. Эти сезонные колебания, вероятно, также являются объяснением наблюдаемого более чем на 10% более высокого процента носителей среди персонала, чем среди пациентов. Первые пробы у большинства сотрудников были взяты в марте, но пациенты отбирались с марта по сентябрь. Насколько нам известно, сезонная вариация носительства S. aureus ранее не описывалась, но заслуживает дальнейшего внимания.
В заключение, глотку следует рассматривать как важное место носительства S. aureus , и его следует учитывать при скрининге на S. aureus , включая MRSA. Наши результаты также показывают, что носительство S. aureus в передних носовых ходах в большинстве случаев указывает на присутствие микроорганизма в горле, хотя и в меньших количествах. Это необходимо учитывать при разработке протоколов деколонизации.
Благодарности
Этот проект частично финансировался за счет исследовательского гранта Совета графства Халланд, Швеция.
Мы благодарны персоналу ортопедического отделения и отделения клинической микробиологии окружной больницы Хальмстада, Швеция, за помощь со сбором образцов. Эксперименты по гель-электрофорезу в импульсном поле были выполнены с большим мастерством микробиологом Усамой Назаром.
СПИСОК ЛИТЕРАТУРЫ
1. Американское общество нефрологов. 1996. Назальный мупироцин предотвращает инфекцию места выхода Staphylococcus aureus во время перитонеального диализа. Варенье. Soc. Нефрол.7 : 2403-2408. [PubMed] [Google Scholar] 2. Баннерман, Т. Л., Г. А. Хэнкок, Ф. К. Теновер и Дж. М. Миллер. 1995. Гель-электрофорез в импульсном поле вместо бактериофагового типирования Staphylococcus aureus . J. Clin. Microbiol. 33 : 551-555. [Бесплатная статья PMC] [PubMed] [Google Scholar] 3. Беркович М., М. Булковштейн, Д. Жовтис, Р. Гринберг, Ю. Ницан, Б. Барзилай и И. Болдур. 2002. Скорость колонизации бактерий в горле здоровых младенцев.Int. J. Pediatr. Оториноларингол. 63 : 19-24. [PubMed] [Google Scholar] 5. Boelaert, J. R., R. A. De Smedt, Y. A. De Baere, C. A. Godard, E. G. Matthys, M. L. Schurgers, R.F.Daneels, B.Z. Gordts и H. W. Van Landuyt. 1989. Влияние назальной мази с мупироцином кальция на заболеваемость Staphylococcus aureus инфекциями у пациентов, находящихся на гемодиализе. Нефрол. Набирать номер. Пересадка. 4 : 278-281. [PubMed] [Google Scholar] 6. Эриксен, Н. Х., Ф.Эсперсен, В. Т. Росдаль и К. Йенсен. 1995. Носительство Staphylococcus aureus среди 104 здоровых лиц в течение 19 месяцев. Эпидемиол. Заразить. 115 : 51-60. [Бесплатная статья PMC] [PubMed] [Google Scholar] 7. Файнштейн В., Д. М. Мушер и Т. Р. Кейт. 1980. Прилипание бактерий к клеткам глотки во время вирусной инфекции. J. Infect. Дис. 141 : 172-176. [PubMed] [Google Scholar] 8. Хаякава Т., Т. Хаясидера, С. Кацура, К. Йонеда и Т.Кусуноки. 2000. Назальное лечение мупироцином метициллин-резистентных, колонизированных глоткой. Staphylococcus aureus : предварительное исследование с участием 10 младенцев-носителей. Педиатр. Int. 42 : 67-70. [PubMed] [Google Scholar] 9. Хаякава Т., Т. Хаясидера, К. Йонеда, С. Кагава и Т. Кусуноки. 1999. Преимущественная колонизация глотки метициллин-резистентным Staphylococcus aureus у младенцев. J. Pediatr. 134 : 252. [PubMed] [Google Scholar] 10. Ху, Л., А. Умеда, С. Кондо, К. Амако. 1995. Типирование Staphylococcus aureus , колонизирующего носовые носители человека с помощью гель-электрофореза в импульсном поле. J. Med. Microbiol. 42 : 127-132. [PubMed] [Google Scholar] 11. Клюйтманс, Дж., А. ван Белкум и Х. Вербру. 1997. Носительство золотистого стафилококка : эпидемиология, основные механизмы и связанные риски. Clin. Microbiol. Ред. 10 : 505-520. [Бесплатная статья PMC] [PubMed] [Google Scholar] 12. Kluytmans, J. A., and H. F. Wertheim. 2005. Носительство Staphylococcus aureus и профилактика внутрибольничных инфекций. Инфекция 33 : 3-8. [PubMed] [Google Scholar] 13. М. Крескен, Д. Хафнер, Ф. Дж. Шмитц и Т. А. Вихельхаус. 2004. Распространенность устойчивости к мупироцину у клинических изолятов Staphylococcus aureus и Staphylococcus epidermidis : результаты исследования устойчивости к противомикробным препаратам Общества химиотерапии Поля-Эрлиха, 2001.Int. J. Antimicrob. Агенты 23 : 577-581. [PubMed] [Google Scholar] 14. Lowy, F. D. 1998. Staphylococcus aureus, инфекции. N. Engl. J. Med. 339 : 520-532. [PubMed] [Google Scholar] 15. Нильссон П., Х. Александерссон и Т. Рипа. 2005. Использование обогащения бульона и ПЦР в реальном времени для исключения присутствия метициллин-устойчивого Staphylococcus aureus в клинических образцах: чувствительный подход к скринингу. Clin. Microbiol. Заразить.11 : 1027-1034. [PubMed] [Google Scholar] 16. Паррас Ф., М. К. Герреро, Э. Боуза, М. Х. Бласкес, С. Морено, М. К. Менаргес и Э. Серценадо. 1995. Сравнительное исследование мупироцина и перорального ко-тримоксазола плюс местная фузидиевая кислота в искоренении носительства метициллин-резистентного Staphylococcus aureus . Противомикробный. Агенты Chemother. 39 : 175-179. [Бесплатная статья PMC] [PubMed] [Google Scholar] 17. Пена, К., Н. Фернандес-Сабе, М. А. Домингес, М.Pujol, A. Martinez-Castelao, J. Ayats, F. Gudiol и J. Ariza. 2004. Staphylococcus aureus носительство в носу у пациентов на гемодиализе: роль кожной колонизации. J. Hosp. Заразить. 58 : 20-27. [PubMed] [Google Scholar] 18. Перл, Т. М., Дж. Дж. Каллен, Р. П. Венцель, М. Б. Циммерман, М. А. Пфаллер, Д. Шеппард, Дж. Туомбли, П. П. Френч и Л. А. Хервальд. 2002. Мупироцин для интраназального введения для профилактики послеоперационных инфекций, вызванных Staphylococcus aureus. N. Engl.J. Med. 346 : 1871-1877. [PubMed] [Google Scholar] 19. Рамирес-Ронда, К. Х., З. Фуксенч-Лопес и М. Неварес. 1981. Повышенная бактериальная колонизация глотки при вирусном заболевании. Arch. Междунар. Med. 141 : 1599-1603. [PubMed] [Google Scholar] 20. Рейган Д. Р., Б. Н. Доббелинг, М. А. Пфаллер, К. Т. Шитц, А. К. Хьюстон, Р. Дж. Холлис и Р. П. Венцель. 1991. Ликвидация совпадающего носового и ручного стафилококка золотистого стафилококка с помощью интраназального применения кальциевой мази мупироцина.Аня. Междунар. Med. 114 : 101-106. [PubMed] [Google Scholar] 21. Теновер, Ф. К., Р. Д. Арбайт, Р. В. Геринг, П. А. Микельсен, Б. Э. Мюррей, Д. Х. Персинг и Б. Сваминатан. 1995. Интерпретация паттернов рестрикции хромосомной ДНК, полученных с помощью гель-электрофореза в импульсном поле: критерии типирования бактериальных штаммов. J. Clin. Microbiol. 33 : 2233-2239. [Бесплатная статья PMC] [PubMed] [Google Scholar] 22. Э. Уэмура, С. Какинохана, Н. Хига, К. Тома и Н. Накасоне. 2004. Сравнительная характеристика изолятов Staphylococcus aureus из глотки и носа здоровых добровольцев. Jpn. J. Infect. Дис. 57 : 21-24. [PubMed] [Google Scholar] 23. Уокер, Э. С., Ф. Леви, М. Шорман, Г. Дэвид, Дж. Абдалла и Ф. А. Сарубби. 2004. Снижение резистентности к мупироцину у метициллин-резистентных Staphylococcus aureus сопровождалось административным контролем за назначениями. J. Clin. Microbiol. 42 : 2792-2795. [Бесплатная статья PMC] [PubMed] [Google Scholar] 24. Ватанабэ Х., Х. Масаки, Н. Асо, К. Ватанабэ, К. Оиси, С. Кобаяси, А. Сато, Р. Сугита и Т. Нагатаке. 2001. Низкие концентрации мупироцина в глотке после интраназального введения могут способствовать устойчивости к мупироцину у метициллин-резистентных Staphylococcus aureus . J. Clin. Microbiol. 39 : 3775-3777. [Бесплатная статья PMC] [PubMed] [Google Scholar] 25. Wertheim, H.F., J. Verveer, H.A. Boelens, A. van Belkum, H.A. Verbrugh и M.C. Vos. 2005. Влияние лечения мупироцином на носительство в носу, глотке и промежности Staphylococcus aureus у здоровых взрослых. Противомикробный. Агенты Chemother. 49 : 1465-1467. [Бесплатная статья PMC] [PubMed] [Google Scholar] 26. Вертхайм, Х. Ф., М. К. Вос, А. Отт, А. Восс, Дж. А. Клюйтманс, К. М. Ванденбрук-Граулс, М. Х. Мистер, П. Х. ван Койлен и Х. А. Вербру. 2004. Профилактика мупироцином против нозокомиальных инфекций Staphylococcus aureus у нехирургических пациентов: рандомизированное исследование.Аня. Междунар. Med. 140 : 419-425. [PubMed] [Google Scholar]Страница не найдена — CAP TODAY
Not Found
Приносим извинения, но запрошенная страница не найдена. Возможно, поиск поможет.
Страницы
- # 62214 (без названия)
- Компьютерные системы анатомической патологии (2020)
- Компьютерные системы анатомической патологии, 2021
- Прикроватные системы тестирования глюкозы (2020)
- Руководство по прикроватным системам тестирования глюкозы, 2021
- Биллинг / счета к получению / системы RCM (2020)
- Биллинг / счета к получению / системы RCM, 2020
- Биллинг / счета к получению / системы RCM, 2021
- Покрытие CAP TODAY covid теперь включает информацию о продукте
- CAP TODAY Руководства по продуктам
- Химические анализаторы для лабораторий среднего и большого объема, 2020
- Анализаторы химии и иммуноанализа POC / лаборатории малого объема (2020)
- Анализаторы химии и иммуноанализа, лаборатории среднего и большого объема (2020)
- Анализаторы коагуляции (2020 )
- Анализаторы коагуляции, 2021
- Гематологические анализаторы (2020)
- Гематологические анализаторы, 2020
- Информация о лаборатории Системы рмации (2019)
- Инструменты для секвенирования нового поколения (2020)
- Инструменты для секвенирования нового поколения, 2021
- Справочник по продукту Индекс с возможностью поиска
- Карта сайта
- Теги
- Инструменты для анализа мочи (2019)
- Видео и аудио
- VimeoTEST
- z_Curation статей
Категории
- Рекламодатели
- Реклама
- ВСЕ ПРОБЛЕМЫ
- Выпуски 2013
- Апрель 2013
- Август 2013
- Декабрь 2013
- 17 Февраль 2013
- Июнь 2013
- март 2013
- май 2013
- ноябрь 2013
- октябрь 2013
- сентябрь 2013
- выпуски 2014
- апрель 2014
- август 2014
- декабрь 2014
- февраль 2014
- 17
- 17 Июль 2014
- Ju ne 2014
- март 2014
- май 2014
- ноябрь 2014
- октябрь 2014
- сентябрь 2014
- 2015 выпусков
- апрель 2015
- август 2015
- декабрь 2015
- февраль 2015
- 17 Июль 2015
- июнь 2015
- март 2015
- май 2015
- ноябрь 2015
- октябрь 2015
- сентябрь 2015
- выпуски 2016
- апрель 2016
- август 2016
- декабрь 2016
- 17 февраль 2016 Январь 2016
- июль 2016
- июнь 2016
- март 2016
- май 2016
- ноябрь 2016
- октябрь 2016
- сентябрь 2016
- 2017 выпуски
- апрель 2017
- август 2017
- 17 Февраль 2017
- Январь 2017
- Июнь ly 2017
- июнь 2017
- март 2017
- май 2017
- ноябрь 2017
- октябрь 2017
- сентябрь 2017
- выпуски 2018
- апрель 2018
- август 2018
- декабрь 2018
- 17 февраль 2018 Январь 2018
- Июль 2018
- Июнь 2018
- Март 2018
- Май 2018
- Ноябрь 2018
- Октябрь 2018
- Сентябрь 2018
- 2019 Выпуски
- Апрель 2019
- Август 2019
- 17 Декабрь 2019 Февраль 2019
- Январь 2019
- Июль 2019
- Июнь 2019
- Март 2019
- Май 2019
- Ноябрь 2019
- Октябрь 2019
- Сентябрь 2019
- 2020 Выпуски
- Апрель 2020
- 17 Август Декабрь 2020
- Февраль 2020
- Январь ry 2020
- июль 2020
- июнь 2020
- март 2020
- май 2020
- ноябрь 2020
- октябрь 2020
- сентябрь 2020
- 2021 выпуски
- апрель 2021
- февраль 202117
Март 2021 г.
- Выпуски 2013
- Май 2021 г.
Теги 9 0019
- 2020 The Westin Snowmass Resort
- 23andMe
- AABB
- Встречи / конференции AACC
- Aalto Bio Reagents
- AB Sciex
- Abacus Diagnostica
- Abbott417 ABBOTT417 Abbottstra175
- Подотчетная медицинская организация (ACOs)
- Accucore Group
- Accumen
- Adaptive Biotechnologies
- Дополнительные лабораторные услуги
- Advanced Biological Laboratories
- Advanced Cell Diagnostics
- Advanced Instruments AdvanD AdvanD Affymetrix
- Agena Bioscience
- Agendia
- AgileBio
- Agilent Technologies
- Agios Pharmaceuticals
- AIDS / HIV
- Aim Lab
- Aimmune Therapeutics Air Science
- U5 AION SA
- Akonni Biosystems
- Alcor Scientific
- Alere
- Тестирование на аллергию
- ALPCO
- Alpha-Tec Systems
- Болезнь Альцгеймера
- Ambry Genetics
- 175 Американская лаборатория патологии Американский совет по патологии
- Рак (AJCC)
- American Medical Technologies
- Американское общество микробиологов
- Amgen
- Отчеты о молекулярных клинических случаях AMP
- Амилоид / амилоидоз
- Аналитика
- Анатомическая патология
- Анатомическая патология анатомическая патология Selected Abstracts
- Anpac Bio
- Ansh Labs
- Anteo Diagnostics
- Антимюллеров гормон
- Устойчивость к антибиотикам / антибиотикам (см. Также микроорганизмы с множественной лекарственной устойчивостью)
- Антикоагулянты
- Антимикробные программы управления противомикробными препаратами Тест на чувствительность / резистентность
- Тестирование на антинуклеарные антитела
- Противовирусная терапия / тестирование на устойчивость к противовирусным препаратам
- Системы отслеживания AP
- AP-Visions
- Апериомика
- Приложение
- APPIA- Прикладной биокод
- 17 Прикладной биокод
- 17 Aquaro Biosystems
- Aquaro Histology
- ArcherDx
- Индекс Arcis Biotechnology
- Argent Global Services
- Ariosadx
- Arkray
- Arlington Scientific
- Arquer Art Diagnostics Arquer Art Diagnostics
- Искусственный интеллект
- Лаборатории ARUP
- Анализы (см. Диагностические тесты / маркеры / тесты / тест-наборы)
- Association for Molecular Patology (см. Также отчеты о молекулярных случаях AMP)
- Astellas —
- AstraZeneca
- Ast ute Medical
- Asuragen
- Athena Diagnostics
- Ativa Medical
- Atomo Diagnostics
- Audit MicroControls
- Aurora Biomed
- Aurora Diagnostics
- Aushon BioSystems 9317 9317 AutoGenMicroSystems 9317
- Автоверификация
- AvanSci Bio
- Aviir
- Azure Biotech
- Натрийуретический пептид B-типа
- Младенцы
- Babson Diagnostics
- BacterioScan
- Baebies417 Banyon 9317 Banyon Baebies417 Banyon 9317 5
- BBPL
- BD
- BD Biosciences
- BD Diagnostics
- Beckman Coulter
- Beckman Coulter Diagnostics
- Beckman Coulter Life Sciences
- Becton Dickinson 93 Gen175
- 175 Berry tices
- BG Medicine
- BGI
- Профилирование Bh4
- Bibby Scientific
- Управление циклом выставления счетов / доходов
- Сайт привязки
- Bio SB
- Bio-Rad
- Bio-Rad Laboratories Bio-Rad Laboratories Bio-Rad Laboratories 9317 / Data Corp.
- Biocare Медицинские
- Biocartis
- Biocept
- BioCision
- Biodesix
- BioDiscovery
- BioDot
- BioFire обороны
- BioFire Диагностика
- Biofortuna
- BioGX
- BioHelix
- Biohit Oyj
- Биоинформатика
- биопрепаратов
- биомаркеров
- Biomatrica
- Biomedical Полимеры
- Биомедицинские системы
- BioMedomics
- Biomerieux
- BioNano Genomics
- Bioo Scientific
- Biorepositories / биобанки
- биобезопасность
- Биосерч Технологии
- Biospecimens
- BioTek Instruments
- BioTheranostics
- Биотин
- Biotix
- BioView
- Рак мочевого пузыря
- Компьютерные системы банка крови
- Банк крови / переливание
- Институт исследования систем крови
- B кровь / коагуляция / гематология (см. также Флеботомия)
- BloodCenter of Wisconsin
- BloodPAC
- Blueprint Medicines
- Boehringer Ingelheim
- Boekel Scientific
- Boreal Genomics
- 17 Bosch
- BrandTech Scientific —
- Контрольные точки
- Рак груди / здоровье груди
- Bristol-Myers Squibb —
- Bruker —
- Buhlmann Laboratories
- Burnout
- Business analytics
- Cancer (см. Также
- Рак (см. Также Лейкемия, Рак груди / здоровье груди, Рак легких, Рак яичников)
- Cancer Genetics Inc.
- Атлас генома рака
- Стадии рака
- Руководство по стадированию рака
- Candida
- Каннабис / марихуана
- Встреча CAP ’12
- Встреча CAP ’13
- Встреча CAP ’15 174
- Встреча CAP 14 заседание
- Совет управляющих CAP
- Аккредитация лабораторий CAP / контрольные списки / протоколы / руководства
- Программы / продукты / услуги CAP (см. Также Q-Probes и проверки квалификации)
- CAP Publications / CAP Press
- Круглые столы CAP TODAY
- Вебинары CAP TODAY
- Вебинары CAP
- Встреча CAP17
- Встреча CAP18
- Встреча CAP19
- Встреча CAP20
- CARB-X
- Карбапенемная резистентность
- Карбаперневые заболевания / работа
- Caris Life Sciences
- Carl Zeiss Microscopy 9317 4 Картахения
- CD Диагностика
- Celgene Corp.
- CellaVision
- Cellex Inc.
- CellMax Life
- Celltrion
- Технологии сотовой инженерии
- Celsee Diagnostics
- Centauri Therapeutics
- Образовательный центр по флеботомии
- Центр услуг по флеботомии
- Центры медицинских услуг и услуг Medica
- Cepheid
- Cerilliant
- Cerner
- Рак шейки матки
- Скрининг рака шейки матки
- Change Healthcare
- Chatbots
- Check Point
- Chembio Diagnostics
- Chemohis Chemohis
- Холестерин
- ChromaCode
- Циркулирующие опухолевые клетки
- Clarient Diagnostics
- Claritas Genomics
- ClearLight Diagnostics
- Clever Culture Systems
- CLIA
- Консультации с пациентами (см. Также nsults, консультации токсиколога)
- Поддержка принятия клинических решений
- Клиническая лаборатория 2.0
- Клиническая патология Избранные тезисы
- Клиническая справочная лаборатория
- Clostridium difficile
- Облачные вычисления
- CLSI (ранее NCCLS)
- Смешение радиологии и патологии (см. Также Радиология)
- Анализаторы
- коагуляции
- Кофактор Genomics
- Колледж американских патологов
- Толстая кишка —
- Колоректальный рак
- Комментарий
- Сопутствующая диагностика
- Профили компаний / новости
- Compass Group
- Оценка компетентности Медицинская
- 174175 CompuGroup
- Тесты генов соединительной ткани
- Консенсусные рекомендации
- Тестирование, ориентированное на потребителя
- Загрязнение
- Copan Diagnostics
- Corgenix
- Corista
- Cornerstone Medical and Technology Finance
- Corning
- Corning Cova
- ris
- Cove Laboratory Software
- COVID-19 / SARS-CoV-2
- Системы CPOE
- Crescendo Bioscience
- Критические значения / критические результаты
- Cue Health
- Curbside консультирует
- 175 Craturet / ransomware
- Cynvenio Biosystems
- Cyrex Laboratories
- Цистатин C
- Cytocell
- Cytomegalovirus
- Цитопатология в фокусе
- Цитопатология / гистология (см. также Цитопатология / гистология Dichtology
- DI
- DX
- DI
- DI
- D
- D
- D
- D
- D
- D
- D
- D
- Dako
- Danaher
- Dark Report
- Аналитика данных
- Data Innovations
- Интеграция данных / управление данными
- Разработка Dataworks
- Debiopharm
- Определения
- Debiopharm Проверки DeltaN 174 Denville Scientific
- Dexcom
- Диабет
- Diaceutics
- Diadexus
- Диагностические тесты / маркеры / тесты / тестовые наборы (см. Также Скрининговые тесты)
- Диагностические тесты / маркеры / тесты / тестовые наборы)
- Группа управления диагностикой
- Группы управления диагностикой
- Diagnostica Stago
- Diagnovus
- Готовность к Diasaster
- DiaSorin
- Diasorin Molecular
- Diatron
- Diazyme Laboratories Digital assisted imaging pathology
- Dignity Health
- Прямые пероральные антикоагулянты
- Секвенирование ДНК
- Тестирование ДНК-РНК
- Dragonfly Therapeutics
- DRG International
- DriBank Labs
- Лекарственная устойчивость
- Лекарственные препараты (см. Также
- Фармацевтические препараты) 175
- Наркотики, злоупотребляющие наркотиками / передозировка наркотиков
- Dualsystems Biotech
- Dx-Sys
- Dysis Medical
- Easy Billing
- eBioscience
- Ebola
- EDP Biotech Обучение в лаборатории электронной диагностики (см. медицинские записи / системы электронных медицинских карт
- Электронный ввод заказа
- ELGA Process Water
- Eli Lilly
- ELITechGroup
- Ellume
- EMD Millipore
- Emicizumab
- Empirical Bioscience
- Enterprise Data Warehouse
- Enzo Biochem
- Enzo Life Sciences
- Epic Sciences
- Эпигеномика
- Eppendorf North America
- Epredia —
- Ergonomics
- Esker
- Расчетная скорость клубочковой фильтрации4 (см. Также eGPtoR) рецепторы rs / прогестерона
- ET Healthcare
- Eurofins
- EUROIMMUN
- Evalumetrics
- Exact Diagnostics
- Exact Sciences
- Executive War College
- Exosome Diagnostics Exosome Diagnostics Fast Exosome Diagnostics Track Exosome Diagnostics
- 9–14 февраля
- Festo
- Фето-материнское кровотечение
- Fimmic Oy
- Тонкоигольная аспирация
- Fio Corp.
- Flagship Biosciences
- Проточная цитометрия
- Fluidigm
- Устойчивые к фторхинолонам Escherichia coli
- Fluxion Biosciences
- Диагностика фокусировки
- Патология судебной медицины
- Фокус Диагностика
- Патология судебной медицины
- Из офиса президента
- Fujirebio
- Fujirebio Diagnostics
- Будущие тенденции
- G2 Intelligence Lab Institute
- Гастроэнтерология
- Гастроинтестинальная панель
- GE Healthcare Genalyte
- GE Healthcare Genalyte GE Healthcare Genalyte 9417
- Общие данные
- Genetech
- Генетика
- Генетика / генетическое тестирование / геномика (см. Также Секвенирование следующего поколения
- Генетика / генетическое тестирование / геномика (см. Также Следующее поколение s equencing, Pharmacogenetics)
- GenMark Diagnostics
- GenoLogics
- GenomeDx Biosciences
- Genomenon
- Genomic Health
- Genomic Testing Cooperative
- Genomics 93S
- 174174 Генотипирование
- Гештальт-диагностика
- Gilead Sciences
- GlaxoSmithKline
- Glencoe Software
- Глюкоза / инсулин / сахар в крови
- Glycomark
- Gold Standard Government Diagnostics
- 173 Bio-One
- Grifols
- Group K Diagnostics
- Guardant Health
- Haemonetics
- Haemtech Biopharma Services
- Halosys Technologies
- Halozyme
- Hamamatsu 9317 4 Hamilton Robotics
- Hamilton Scientific
- Hamilton Storage
- Hardy Diagnostics
- Согласование результатов лабораторных тестов
- HbA1c
- Hc1.com
- Реформа здравоохранения
- Возмещение расходов на здравоохранение
- Health Catalyst
- Health Network Laboratories
- Healthtech Publishing
- Heartland virus
- Heathrow Scientific
- Helmer Scientific
- Heathrow Scientific Heathmatology Heathmatology
- Hemo Bioscience
- Гемолиз
- Гемофилия
- HemoSonics
- Гепатит
- HER2
- гистосовместимости
- оседлый макрофаг Laboratories
- гистологии
- Hoefer
- Hologi
- Гомологичные рекомбинация дефицит
- Horiba
- Horizon Диагностика
- Horizon Discovery
- Horizon Discovery Group
- Внутрибольничные инфекции
- Методистская больница Хьюстона
- HTG Молекулярная диагностика
- Хорионический гонадотропин человека
- Человек p апилломавирус
- Hycor Biomedical
- iBio
- ICD-10
- iCubate
- IDT
- Illumina
- Immucor
- Immunalysis Corp.
- Immunetics
- Immunexpress
- Immuno Concepts
- Иммунодиагностические системы
- Иммуногистохимия
- Иммунотерапия
- Imprivata
- In memoriam
- Imprivata
- In memoriam
- Гибридизация in situ
- Гибридизация in situ
- InBios
- IncellDx
- Indica Labs
- Инфекционный контроль / инфекционные заболевания
- Грипп
- информатика
- Информатика / информационные технологии (см. Также Автоматизация; Цифровая патология; Информационные системы)
- 174 Inova Диагностика
- Inova Genetics
- InSphero
- Inspirata
- Instrumentation Laboratory
- Instrumentation / Product Guides
- Integra
- IntegraGen
- Integrated Diagnostics
- Integrated DNA Technologies 931 75
- IntelligentMDx
- Интерферирующие вещества
- Интерстициальное заболевание легких
- Intrinsic LifeSciences
- Invitae
- IPMN (внутрипротоковое папиллярное муцинозное новообразование)
- Irvine Scientific
- Connectivity ISO ISS
- Connectivity Irvine Scientific Constellation Janssen Biotech
- Janssen Pharmaceutica
- Janssen Pharmaceuticals
- Johns Hopkins Medicine
- Karius
- KD Scientific
- Заболевание почек / повреждение почек (см. Также расчетную скорость клубочковой фильтрации) Kite Pharma
- аккредитация (см. также аккредитацию лабораторий CAP / контрольные списки / протоколы)
- Новости аккредитации лабораторий: запросы и комментарии
- Информационные системы лабораторий
- Решения для лабораторных датчиков
- Управление использованием лабораторных тестов
- Тесты, разработанные лабораториями / ho mebrews
- LabCorp
- Labnet International
- Администрирование / управление лабораториями
- Консолидация / слияния / продажи лабораторий (см. также Совместные предприятия)
- Меры по повышению эффективности / экономии затрат
- Лабораторное оборудование / устройства (см. также Информационные системы и приборы) )
- Лабораторные ошибки
- Лабораторный охват
- Лабораторные профили
- Лабораторные закупки / бюджет
- Лабораторные справочные материалы
- Персонал лаборатории (см. Персонал)
- Проблемы / подводные камни лабораторных тестов
- Лабораторное обучение
- LabStyle174 Innovations Диагностика
- LabVine
- Leavitt Medical
- Правовые вопросы / действия (см. Также Медицинские ошибки
- Правовые вопросы / действия (см. Также Медицинские ошибки, Лабораторные ошибки)
- Законодательство
- Leica Biosystems
- Leica Microsyst ems
- Letters
- Leukemia
- LGC
- Стандарты LGC Maine
- Life Technologies
- Информационные системы LigoLab
- Липемия
- LipoScience
- Жидкая биопсия
- 17 Loop
- 17 Loop
- 17 Loop Loxo Oncology
- Lucid Diagnostics
- Lucira Health
- Luminex
- Lunaphore Technologies
- Рак легких (см. Также Интерстициальное заболевание легких)
- Повреждение ткани легкого
- Болезнь Лайма
- 174 Lymphis
- Узлы
- Lymphis
- Lymphis
- Maccura Biotechnology
- Машинное обучение
- MagBio Genomics
- Magellan Diagnosticsm
- Magnolia Medical
- Magnolia Medical Technologies
- Управление молекулярным качеством штата Мэн
- Проблемы управления
- MarketLab
- Массачусетс планы sualty
- Масс-спектрометрия
- Болезнь тучных клеток / мастоцитоз
- Секвенирование парных пар
- Mauna Kea Technologies
- Mawi DNA Technologies
- Mayo Clinic
- MDNA Life Sciences
- MD5175 Medica
- Medical Chemical Corp.
- Медицинская база данных
- Медицинские электронные системы
- Медицинские ошибки (см. Также Правовые вопросы / действия и Лабораторные ошибки)
- Medicare (см. Также записи Medicare в Capitol Scan)
- Medicare / Medicaid (см. Также график оплаты услуг врача)
- Meditech
- MedTest Dx
- Medtronic
- MeMed
- Онкологический центр Мемориала Слоуна Кеттеринга
- Menarini Silicon Biosystems
- Менингит / энцефалит
- Merck
- Результаты Meridian Life
- 175
- Mesa Biotech
- Metabolon
- Метагеномное глубокое секвенирование
- Metis Genetics
- Mettler Toledo
- Microbiologics
- Microbiology
- Microbiome
- Microbix
- Microbix
- Microbix Biosystems
- s
- MicroMedicine
- Маркеры MicroRNA
- Промежуточное ПО
- MidSci
- MikroScan Technologies
- Milestone Medical
- MilliporeSigma
- Mindray
- Приложение Miraca Life Sciences
Mobile Abbot - Молекулярная патология / диагностика (см. Также технологию полимеразной цепной реакции и отчеты о молекулярных клинических случаях AMP)
- Совет по молекулярным опухолям
- MolecularMD
- Mologic
- Моноцитоз
- Mopec
- Morphotek
- 17 MOSPHOTEK MOS
- MR Solutions
- Скрининг / инфицирование MRSA
- Организмы с множественной лекарственной устойчивостью
- Мультиплексное тестирование
- Multisorb Technologies
- MyCartis
- Mycology
- Справочное руководство по микологии
- Myocardit is
- Myriad Genetics
- Myriad RBM
- NanoComposix
- Nanomix —
- NanoPin Technologies
- Nanosphere
- NanoString Technologies
- Nanotechnology Национальное здравоохранение Еврейское координированное тестирование
- Natera
- Национальное координированное тестирование
- Natera Health Advanced Diagnostic Laboratories
- Натрийуретические пептиды
- Nautilus
- Биопсия иглы
- NeoGenomics
- Neoteryx
- NeuMoDx
- Тесты Neutrophilia
- 17 New England New England
- NextCode Health
- Nikon Instruments
- NMDX
- North West London Pathology
- Nova Biomedical
- Novartis
- Novo Nordisk
- Novodiax
- Novodiax
- ene
- NovoPath
- nRichDX
- Тестирование слияния NTRK
- Nuance Communications
- Nuclea Biotechnologies
- NxGen MDx
- Oasis Diagnostics
- Obituary
- 175 Olympus Life Расходы на офисные ресурсы
- OmniSeq
- Omnyx
- Oncimmune
- Oncolab
- OncoLens
- Oncomatrix
- OpGen
- Опиаты
- OptraScan
- Oracle
- OralDNA Labs
- OraSure Technologies
- Orchard Software
- Орто Клиническая диагностика
- Ортопедия
- Аутрич-лаборатории
- OvaGene Oncology
- Рак яичников
- Ovation
- Oxford Gene Technology
- Oxford Immunotec
- Pacific Biosciences
- Pacific Knowledge Systems
- Управление болью 9 3175
- Pall Life Sciences
- PAML
- Пап-тесты (см. Цитопатология / гистология и цитопатология и многое другое)
- Paragon Genomics
- Паразиты / паразитарные инфекции
- Parker Isaac Instruments
- PathCentral174 PathCentral175 Патолог Патолог профили / мемуары
- Подготовка / обучение патологов
- Стимулы для патологов
- Патологическая информатика Избранные тезисы
- Саммит патологической информатики 2014
- Патологические отчеты
- Патологическая диагностика
- PathXL
- Консультации с пациентами 9317 системы / безопасность пациента (см. также Безопасность)
- Проблемы с оплатой
- Биосистемы ПЦР
- Тестирование / экспрессия PD-L1
- PeaceHealth
- Педиатрия
- PerkinElmer
- Персональная диагностика генома
- Pfizer лекарственные препараты / рецепты / аптека
- Фармакогенетика)
- Фармакогенетика / фармакогеномика
- PHC Holdings Corp.
- Phenomenex
- Philips
- Флеботомия (см. Также Кровь / коагуляция / гематология)
- Диагностика фтизиса
- График оплаты врачей (см. Также Medicaid / Medicare)
- Показатели эффективности врача
- Platinum ScientificCode
- Platinum ScientificCode
- Пневмония
- Тестирование в местах оказания медицинской помощи / руководства / стандарты
- Истинная полицитемия
- Polymedco
- Технология полимеразной цепной реакции (ПЦР)
- PolyScience
- Объединенное тестирование
- Диагностика населения Управление здоровьем
- Население
- Синдром Прадера-Вилли
- Precipio
- Точная медицина
- Прогностические маркеры
- Prefix Public Relations
- Тестирование на беременность
- PreludeDx
- Premier
- Пренатальный скрининг
- Primary
- Primary 175
- Procalcitonin
- ProciseDx
- Проверка квалификации (см. Также программы / продукты / услуги CAP)
- Progenika Biopharma
- Project Santa Fe
- Promega
- Prometheus Laboratories
- 175
- ProsciaF
- Proscia
- Protagen
- Psyche Systems
- Информация об общественном здравоохранении / лаборатории общественного здравоохранения
- Лаборатории общественного здравоохранения
- Puma Biotechnology
- Puritan Medical Products
- Положите его на совет
- Q-Probes
- Q&A
- обеспечение / контроль качества / повышение качества
- Контроль качества
- Качественные лабораторные решения
- QualityStar
- QuanDx
- Quansys Biosciences
- QuantiBact
- Quantimetrix
- Количественный анализ изображений
- 174 Group Quest Diagnostics
- Quidel
- R-Biopharm
- Радиочастотная идентификация
- Radiometer America
- Rainbow Scientific
- Rainin Instrument
- RainTree Oncology Services
- Randox Reference Laboratories
- 17Randox интервалы
- Услуги референс-лаборатории по тестированию / отправка тестов
- Направления
- Алгоритмы тестирования рефлексов
- Rehrig Pacific
- Relaymed
- Remote Medical Technologies
- Патология почек / почечная недостаточность
- Резиденция / резиденты
- 175 Разрешение Bios Респираторные вирусы / лечение / тесты
- Rheonix
- Роботы
- Roche
- Roche Diagnostics
- Roche Molecular Systems
- Roche Tissue Diagnostics
- Rockland Immunochemicals —
- Rosetta Genomic s
- Круглый стол
- Royal Philips
- Безопасность (См. системы идентификации пациентов / безопасность пациентов)
- Safety-Spec
- Sakura Finetek
- Saladax Biomedical
- Тестирование слюны
- Sampleminded
- Sangon
- Samsung
- Sarepta Therapeutics
- Sarstedt
- Schuyler House
- Sciex
- SciGene
- ScopeLED
- Скрининговые тесты (см. Также Пренатальный скрининг /
- Скрининговые тесты)
- ScyTek Laboratories
- Seacoast Laboratory Data Systems
- Seattle Genetics
- Sebia
- Вторичные обзоры
- Seegene
- Sekisui Diagnostics
- Самоинспекции
- Selventa
- 175
- Sekisui Senseon
- Sequ enom
- SeraCare Life Sciences
- Половые гормоны
- Заболевания / инфекции, передающиеся половым путем
- Шорты по стандартам
- Серповидно-клеточная анемия
- Siemens Healthineers
- Сигма-анализ / сигма-показатели
- Сингулярность.ai
- Singulex
- Sirion Biotech
- SISCAPA Assay Technologies
- Skuldtech
- Smart Imaging Technologies
- Электронная отчетность SNOMED
- Социальные сети
- Society for Laboratory Automation and Screening
- См. также Программное обеспечение для автоматизации лабораторий
- )
- Sonic
- Sonora Quest
- Sophia Genetics
- South Bend Medical Foundation
- Spark Therapeutics
- Специфическая диагностика
- Сбор образцов / маркировка / обработка / отклонение
- Решения для распознавания речи / транскрипции
- Spring Bioscience
- SRL
- Персонал
- Стандарт лечения
- Стволовые клетки
- Stone Medical
- Streck
- Summit Cancer Centers
- Summit Healthcare
- Sunquest Information Systems 931 75
- Хирургическая патология
- Swift Biosciences
- Swisslog Healthcare Solutions
- Syapse
- Symbiodx
- Сифилис
- Sysmex
- Sysmex America
- Sysmex
- Sysmex America
- Table Software T2175
- Sysmex Inostics173175 T2175
- Techcyte
- Techlab
- Technidata
- Technopath Clinical Diagnostics
- Telcor
- Telecytology
- Terumo BCT
- Разработка / управление тестами
- Формулы тестов
- Тестовые пробирки Стандарты тестирования
- Испытательные пробирки Стандарты тестирования Испытания Стандарты испытаний Использование теста (см. Также Скрининговые тесты)
- Подтверждение и проверка теста
- Расходные материалы для тестирования
- Tetracore
- Терапевтический мониторинг лекарственных средств / анализы TDM
- Thermo Fisher
- Thermo Fisher Scientific
- Заболевание щитовидной железы / тестирование
- ThyroSeq
- клещевое заболевание (см. Также болезнь Лайма)
- Работа с тканями
- Title21 Health Solutions
- Toma BioScience
- Torrey Pines Scientific
- Tosoh Bioscology тестирование / консультации
- TRALI
- Медицинская помощь трансгендерам
- Трансгеномная
- Трансляционное программное обеспечение
- Услуги по трансплантации
- Transworld Systems
- Triangle Biomedical Sciences
- TriCore
- 17 TriCore
- 174
- Тровагене
- Туберкулез
- Онкологический совет
- Опухолевые отложения
- Мутационная нагрузка опухоли
- Ultivue
- UniConnect
- UnitedHealth Group
- Инфекции мочевыводящих путей
- Необязательные исследования
- Мочевыводящие пути Цитирование / цитология мочи
- UTAK Laboratories —
- Увеит
- Vacava
- Ванкомицин
- Васкулит
- Vector Laboratories
- Венозная тромбоэмболия
- Ventana5 Vera Vera
- Verichem Laboratories
- Verinata Health
- Vermillion
- Vidan Diagnostics
- Viewics
- Viracor Eurofins
- Тестирование вирусологии
- ViroStat
- Виртуальное образование
- Visio175 вирусов / вирусов
- Visio
- Visiun
- Vital Diagnostics
- Voicebrook
- vRad
- WaferGen Bio-systems
- Wako Diagnostics
- Walgreens —
- Warfarin
- Waters Corp.
- WaveSense
- веб-семинар
- Wellcome Sanger Institute
- Wheaton
- Секвенирование всего экзома
- Секвенирование всего генома
- Визуализация всего слайда
- Ограничения рабочей нагрузки
- Всемирная организация здравоохранения /9317 Веб-сайты Всемирной организации здравоохранения/9317
- X-Lab
- X-ray
- Xifin
- Йельская школа общественного здравоохранения
- Yaskawa Motoman
- Zenalux Biomedical
- Zeus Scientific
- Вирус Зика
- КЕПКА СЕГОДНЯ (402)
- Карин Олсон (1)
- Секвенирование поколений / секвенирование по Сэнгеру
Авторы
9- ODAY (Авторы 9
- ODAY) СЕГОДНЯ (420)
мазки из горла необходимы для надежного определения носителей золотистого стафилококка | Клинические инфекционные болезни
Абстрактные
Передние ноздри являются наиболее важным местом для скрининга колонизации Staphylococcus aureus. Мы проверили 2966 человек на наличие носительства S. aureus с мазками из носа и горла. В общей сложности 37,1% лиц были носителями носа, а 12,8% — носителями только горла. Скрининг мазков из зева значительно увеличивает чувствительность выявления среди носителей на 25,7%.
Передние ноздри считаются первичным местом колонизации Staphylococcus aureus [1,2–3]. Примерно 30% здорового населения носят S. aureus в передних ноздрях [4, 5].Носительство S. aureus в носу играет ключевую роль в эпидемиологии и патогенезе инфекции и связано с повышенным риском инфекционных осложнений после операции у пациентов с терминальной почечной недостаточностью и у пациентов с внутрисосудистыми устройствами [ 1, 6]. Примерно 80% инвазивных внутрибольничных инфекций имеют эндогенное происхождение у носителей носа [7, 8].
Появление метициллин-устойчивого S. aureus (MRSA) в больницах и в обществе привело к появлению множества программ скрининга для выявления носителей S.aureus , в частности MRSA. Раннее выявление носителей — важный шаг в программах профилактики MRSA; это особенно верно для стратегий «поиск и уничтожение», которые рекомендуются в Нидерландах [9]. В настоящее время в Соединенных Штатах обсуждается вопрос об обследовании всех поступающих в больницу.
Большинство программ скрининга S. aureus , которые включают MRSA, требуют получения мазка только из передних носовых ходов; мазок из горла еще не считается стандартом.Дополнительный результат культивирования горла считается незначительным, поскольку он добавляет дискомфорта для пациента и увеличивает стоимость системы здравоохранения без значительного увеличения чувствительности. Это мнение основано на наблюдении, что горловые носители S. aureus , вероятно, несут S. aureus и в ноздрях. Однако колонизация глотки, но не ноздрей, может быть более распространенной, чем это считается в настоящее время.
В публикациях 1940-х годов сообщалось о степени колонизации горла от 4 до 63% [3].Недавнее исследование подтвердило наблюдение, что горло может быть селективно колонизировано и избежать текущих рутинных программ скрининга [10].
Нераспознанные носители могут распространять MRSA и делать программы борьбы с инфекциями бесполезными. Поэтому мы поставили под сомнение практику скрининга только передних носовых ходов и оценили дополнительные преимущества скрининга как ноздрей, так и глотки в 4 различных исследуемых популяциях.
Пациенты и методы. Мы собрали данные от 4 разных групп людей.В первую группу вошли пациенты и медицинские работники, которые были обследованы после контакта с носителем MRSA в течение 2000–2005 годов. С 1997 года эта процедура является частью политики больницы по предотвращению распространения MRSA. Вторая группа состояла из медицинских работников, которые участвовали в торговой ярмарке медицинского и больничного оборудования (конференция Internationale Fachmesse für Arzt- und Spitalbedorf в выставочном центре в Цюрихе, Швейцария) 26–29 октября 2004 г. и которые вызвались участвовать в ней. исследование распространенности S.aureus среди населения Швейцарии. В третью группу вошли здоровые доноры крови, которые в 2005 году прошли скрининг на S. aureus . Группа 4 состоит из большой выборки культур из носа и горла, которые были объединены в лаборатории; отдельные результаты недоступны. Эта группа состоит из пациентов и медицинских работников, как и в группе 1.
носителей MRSA были проанализированы отдельно, чтобы избежать какой-либо потенциальной систематической ошибки, поскольку неизвестно, имеет ли MRSA тот же образец колонизации, что и чувствительный к метициллину S.aureus (MSSA). Скрининг проводился медсестрами инфекционного контроля или врачами после соответствующей подготовки. Исследование было одобрено комитетом по человеческим предметам Базельского университета (Швейцария).
Образцы были получены с помощью стерильного тампона с наконечником из полиэфирного волокна, смоченного стерильным физиологическим раствором; образцы были взяты из передних носовых ходов (5 оборотов в каждой передней ноздре) и из задней стенки глотки с помощью второго тампона. Мазки отправляли в лабораторию в транспортной пробирке (M40 Transystem; Copan) и обрабатывали в течение 24 часов.Для культивирования инокулировали селективный обогащающий бульон (бульон для инфузии сердца мозга с 6% NaCl). После инкубации при 35 ° C в течение ночи бульон пересевали как на хромогенный агар для S. aureus (Chromagar Staph. Aureus; Hy Laboratories), так и на колумбийский агар с 5% овечьей крови (Becton Dickinson). Планшеты считывали через 24 и 48 часов, и далее анализировали колонии, предположительно принадлежащие S. aureus
. S. aureus был идентифицирован на основе различных признаков, таких как типичный рост на хромогенной среде и / или кровяном агаре и обнаружение фактора слипания, протеина А и капсульных антигенов (Pastorex Staph-Plus; Bio-Rad). Изоляты S. aureus были протестированы на устойчивость к оксациллину с использованием оксациллинового диска, агаровой чашки для скрининга оксациллина или, совсем недавно, диска цефокситина, в соответствии с рекомендациями, выпущенными Институтом клинических и лабораторных стандартов (ранее NCCLS). Если результаты были неоднозначными или предполагалось наличие MRSA, проводили дополнительные тесты, а именно: наличие ауреазы определяли с помощью Rapidec staph (bioMérieux), MRSA-Screen (Denka Seiken) использовали для обнаружения пенициллин-связывающего белка 2a и ПЦР использовали для обнаружения генов mecA и femA ; Кроме того, была проведена комплексная антибиотикограмма в соответствии с рекомендациями Института клинических и лабораторных стандартов.Результаты. Всего в наше исследование был включен 5041 человек. Три группы (группы 1–3), которые включали в общей сложности 2966 человек, были проверены на носительство S. aureus с отдельными результатами носительства в носу и глотке. Четвертая группа (группа 4) состояла из 2075 человек, для которых данные мазков из носа и горла были объединены в лаборатории. Средний возраст составлял 50 × 21 год, и 50,4% испытуемых составляли женщины. В группах 1–3 всего 1480 особей (49.9%) дали положительный результат на S. aureus (таблица 1). В общей сложности 37,1% исследуемой популяции (в группах 1-3) имели носительство в носу S. aureus с положительными результатами посева из горла или без них. В общей сложности 380 человек (12,8% исследуемой популяции и 25,7% из носителей S. aureus ) были колонизированы только в горле. Таким образом, скрининг горла значительно повысил чувствительность на 25,7%. Передние ноздри были местом, наиболее часто заселенным S.aureus , за исключением группы доноров крови; Среди доноров крови мазки из горла выявляли S. aureus чаще, чем культуры мазков из ноздрей. Частота носительства S. aureus в группе 4 (т. Е. Группе объединенных результатов) составила 52,1%, что аналогично наблюдаемому с объединенными результатами для посева мазков из носа и глотки в группах 1-3.
Таблица 1
Скорость выделения Staphylococcus aureus из передних ноздрей и глотки.
Таблица 1
Скорость выделения Staphylococcus aureus из передних ноздрей и глотки.
Анализ подгруппы был проведен для 37 субъектов с носительством MRSA (0,74% от всех обследованных лиц). У 23 носителей MRSA были доступны отдельные результаты для посева образцов мазков из горла и носа. Дополнительный выход культур из горла был сопоставим с результатами, описанными для MSSA: 5 из 23 (22% всех носителей MRSA против 25,7% всех носителей MSSA).
Обсуждение. Насколько нам известно, это крупнейшее исследование, в котором оценивалась важность горла в носительстве S. aureus . Дополнительные посевы мазков из зева повысили результативность с 37% (посев только мазков из носа) до почти 50% (культуры из мазков из носа и горла вместе), что повысило чувствительность на 25,7%. Результаты для группы 4 (объединенная группа образцов) — отдельные культуры образцов мазков из ноздрей и горла не проводились — подтвердили результаты для групп 1–3 с преобладанием S.aureus — 49,9% и 52,1% соответственно. Таким образом, объединение результатов посева мазков из ноздрей и глотки может быть подходящим методом для оптимизации урожая S. aureus
— положительный результат при сохранении затрат на дополнительные посевы.Сегодня скрининг S. aureus в основном проводится для выявления носителей MRSA. Неизвестные носители горла могут распространять MRSA, что частично объясняет, почему многие схемы деколонизации подвержены неудачам. Горловое носительство даже спровоцировало крупную вспышку инфекции MRSA, которая была прослежена до медицинского работника, у которого была колония исключительно в горле.Обычный назальный скрининг не смог выявить этого носителя [11]. Скрининг избранных пациентов или всех пациентов, направленный на борьбу с инфекцией MRSA, проводится во многих больницах, но в большинстве учреждений скрининг сосредоточен на ноздрях [9]. Тем не менее, образцы мазка из зева регулярно собирались в Нидерландах на протяжении десятилетий в рамках успешной политики поиска и уничтожения, которая изложена в их национальных рекомендациях (http://www.wip.nl).
Наши данные подтверждают результаты предыдущих исследований о том, что передние ноздри являются единственным наиболее колонизированным участком с S.aureus. Только у доноров крови частота носительства была выше в горле, чем в ноздрях (группа 3). Это открытие может быть связано с тем, что только 1 обученный и высокомотивированный исследователь получил все эти образцы мазков. Нетренированным исследователям может быть сложно провести скрининг задней стенки глотки, избегая при этом дискомфорта пациента. С другой стороны, носительство через горло действительно может быть более распространенным среди здоровых людей, чем среди людей, которые находятся в контакте с системой здравоохранения, но такая гипотеза требует подтверждения другими исследователями в различных группах населения, не связанных с медицинским обслуживанием.
В целом распространенность носительства составляла ~ 50%, что выше, чем показатель, сообщаемый в большинстве других исследований (25–35%) [5]. Это несоответствие можно объяснить несколькими факторами. Во-первых, в других исследованиях горловое носительство не принималось во внимание. Фактически, частота носительства через нос (за исключением данных посевов из горла) была сопоставимой и составила 37,1%. Во-вторых, обогащающий бульон мог дополнительно повысить чувствительность культуры [12]. В-третьих, только специально обученные медицинские работники получали образцы мазков, поэтому образцы были взяты из задней стенки глотки, а не изо рта.
Добавление посевов из зева к посеву мазков из передних носовых ходов значительно повысило чувствительность скрининга на 25,7%. В целом, 37,1% субъектов имели носительство S. aureus в носу, но 12,8% пациентов носили только горло, и эти субъекты избежали традиционных методов скрининга. Следовательно, любой скрининг на S. aureus — в частности, скрининг на MRSA — должен включать как посев образцов мазков из передних носовых ходов, так и из глотки.Объединение образцов может снизить дополнительные расходы, связанные со скринингом горла, при сохранении чувствительности.
Благодарности
Финансовая поддержка. Швейцарский национальный научный фонд (3200BO-104179).
Возможный конфликт интересов. Через год после завершения исследования A.T. принял должность в F. Hoffmann – La Roche. Все остальные авторы: конфликтов нет.
Список литературы
1,,.Назальное носительство Staphylococcus aureus : эпидемиология, основные механизмы, сопутствующие риски
,Clin Microbiol Rev
,1997
, vol.10
(стр.505
—20
) 2.Staphylococcus aureus инфекции
,N Engl J Med
,1998
, vol.339
(стр.520
—32
) 3.Здоровое носительство Staphylococcus aureus : значение его распространенности
,Bacteriol Rev
,1963
, vol.27
(стр.56
—71
) 4« и др.Носительство Staphylococcus aureus среди потребителей инъекционных наркотиков: более низкая распространенность в программе поддерживающей терапии героином путем инъекций, чем в программе приема перорального метадона
,Инфекционный контроль Hosp Epidemiol
,2004
, vol.25
(стр.133
—7
) 5,,, et al.Роль носительства через нос при заражении Staphylococcus aureus
,Lancet Infect Dis
,2005
, vol.5
(стр.751
—62
) 6,.Значение носительства Staphylococcus aureus Частота инфицирования послеоперационной раны
,J Hosp Infect
,1995
, vol.31
(стр.13
—24
) 7,,,,.Назальное носительство как источник бактериемии Staphylococcus aureus . Study Group
,N Engl J Med
,2001
, vol.344
(стр.11
—6
) 8« и др.Риск исхода внутрибольничной бактериемии Staphylococcus aureus у носителей через нос по сравнению с не носителями
,Lancet
,2004
, vol.364
(стр.703
—5
) 9« и др.Низкая распространенность метициллин-устойчивого Staphylococcus aureus (MRSA) при поступлении в больницу в Нидерландах: ценность поиска разрушает ограничительное использование антибиотиков
,J Hosp Infect
,2004
, vol.56
(стр.321
—5
) 10,.Staphylococcus aureus Колонизация глотки встречается чаще, чем колонизация в передних ноздрях
,J Clin Microbiol
,2006
, vol.44
(стр.3334
—9
) 11« и др.Вспышка метициллин-устойчивого Staphylococcus aureus , инициированная пищевыми продуктами, проанализирована методом феногенотипирования
,J Clin Microbiol
,1995
, vol.33
(стр.1121
—8
) 12,,,.Сравнение методов скрининга культур для выявления носительства метициллин-устойчивого Staphylococcus aureus : проспективное исследование, сравнивающее 32 метода
,J Clin Microbiol
,2003
, vol.41
(стр.3163
—6
)© 2007 Американского общества инфекционистов
.
 Кроме того, было глубоко изучено и применение амброксола во втором и третьем триместрах беременности (после 28 недель). Результаты исследований подтвердили, что амбраксол не оказывает негативное влияние на плод.3
Кроме того, было глубоко изучено и применение амброксола во втором и третьем триместрах беременности (после 28 недель). Результаты исследований подтвердили, что амбраксол не оказывает негативное влияние на плод.3 Концентрация действующего вещества в крови малыша зависит от различных факторов, в том числе длительности кормления, объема молока, который получил ребенок, способности детского организма выводить лекарственный препарат. Поскольку пищеварительная система грудного ребенка незрелая, период полувыведения лекарств из его организма может быть намного выше, чем из организма матери.5
Концентрация действующего вещества в крови малыша зависит от различных факторов, в том числе длительности кормления, объема молока, который получил ребенок, способности детского организма выводить лекарственный препарат. Поскольку пищеварительная система грудного ребенка незрелая, период полувыведения лекарств из его организма может быть намного выше, чем из организма матери.5 Специалист здравоохранения, прежде чем рекомендовать лекарство, учитывает возможные изменения скорости выведения, принимая во внимание комплекс факторов, в том числе, какое лекарство назначается, насколько выражено нарушение работы почек в конкретном случае и так далее. Только после тщательной оценки специалист здравоохранения принимает решение о назначении лекарства и индивидуально подбирает его дозу.6
Специалист здравоохранения, прежде чем рекомендовать лекарство, учитывает возможные изменения скорости выведения, принимая во внимание комплекс факторов, в том числе, какое лекарство назначается, насколько выражено нарушение работы почек в конкретном случае и так далее. Только после тщательной оценки специалист здравоохранения принимает решение о назначении лекарства и индивидуально подбирает его дозу.6 Поэтому при нарушении ее работы принимать лекарство необходимо с осторожностью, что указано в инструкции к применению, и по назначению специалиста здравоохранения.3
Поэтому при нарушении ее работы принимать лекарство необходимо с осторожностью, что указано в инструкции к применению, и по назначению специалиста здравоохранения.3
 Принимать таблетки необходимо трижды в день, запивая водой. При необходимости дозу можно увеличить до 6 таблеток в день;
Принимать таблетки необходимо трижды в день, запивая водой. При необходимости дозу можно увеличить до 6 таблеток в день;







 К флакону прилагается мерный стаканчик из пластмассы с нанесенными метками объема и логотипом фирмы.
К флакону прилагается мерный стаканчик из пластмассы с нанесенными метками объема и логотипом фирмы. Алматы, 050010, ул. Каирбекова 38
Алматы, 050010, ул. Каирбекова 38 Это обусловлено его приятным вкусом и ароматом, которые имеют
несколько вариантов:
Это обусловлено его приятным вкусом и ароматом, которые имеют
несколько вариантов: Инструкция сиропа от кашля
Лазолван для детей имеет информацию о необходимости консультации с лечащим
врачом, особенно если вопрос касается детей до года.
Инструкция сиропа от кашля
Лазолван для детей имеет информацию о необходимости консультации с лечащим
врачом, особенно если вопрос касается детей до года.

 5 г сорбитола в пересчете на максимальную рекомендуемую суточную дозу (30 мл). Пациентам с редкой наследственной непереносимостью фруктозы не следует принимать этот препарат.
5 г сорбитола в пересчете на максимальную рекомендуемую суточную дозу (30 мл). Пациентам с редкой наследственной непереносимостью фруктозы не следует принимать этот препарат.

 В терапевтическом интервале концентраций связывание с белками плазмы составляет примерно 90%.
В терапевтическом интервале концентраций связывание с белками плазмы составляет примерно 90%.
 Флакон помещали в картонную коробку с инструкцией по применению и мерный стакан.
Флакон помещали в картонную коробку с инструкцией по применению и мерный стакан. 
 Произошло значительное уменьшение продолжительности обострений и количества дней антибактериальной терапии.
Произошло значительное уменьшение продолжительности обострений и количества дней антибактериальной терапии.  Конечный период полувыведения амброксола составляет 10 часов. Общий клиренс находится в диапазоне 660 мл / мин, почечный клиренс составляет около 8% от общего клиренса. Методом радиоактивной метки было установлено, что после приема разовой дозы препарата в течение следующих 5 дней с мочой выделяется около 83% дозы. Не обнаружено клинически значимого влияния возраста и пола на фармакокинетику амброксола, нет оснований для выбора дозировки по этим признакам.
Конечный период полувыведения амброксола составляет 10 часов. Общий клиренс находится в диапазоне 660 мл / мин, почечный клиренс составляет около 8% от общего клиренса. Методом радиоактивной метки было установлено, что после приема разовой дозы препарата в течение следующих 5 дней с мочой выделяется около 83% дозы. Не обнаружено клинически значимого влияния возраста и пола на фармакокинетику амброксола, нет оснований для выбора дозировки по этим признакам.  Во II и III триместре беременности применение препарата возможно только в том случае, если потенциальная польза для матери превышает потенциальный риск для плода.Амброксол выделяется с грудным молоком. Несмотря на то, что нежелательных явлений у детей, находящихся на грудном вскармливании, не наблюдается, в период лактации не рекомендуется использовать сироп Лазолван. Доклинические исследования амброксола не показали отрицательного влияния на фертильность.
Во II и III триместре беременности применение препарата возможно только в том случае, если потенциальная польза для матери превышает потенциальный риск для плода.Амброксол выделяется с грудным молоком. Несмотря на то, что нежелательных явлений у детей, находящихся на грудном вскармливании, не наблюдается, в период лактации не рекомендуется использовать сироп Лазолван. Доклинические исследования амброксола не показали отрицательного влияния на фертильность. 
 При появлении новых образований кожи и слизистых оболочек рекомендуется прекратить лечение амброксолом и немедленно обратиться за медицинской помощью. При нарушении функции почек Лазолван следует применять только по рекомендации врача.
При появлении новых образований кожи и слизистых оболочек рекомендуется прекратить лечение амброксолом и немедленно обратиться за медицинской помощью. При нарушении функции почек Лазолван следует применять только по рекомендации врача. 
 Некоторые авторы считают, что возникновение РБ связанно с ухудшением сопутствующего АР. Некоторые исследования показывают, что гормональное воздействие приводит к расслаблению гладкой мускулатуры, которая составляет стенку сосудов слизистой носа, в результате чего появляется заложенность носа. Такие выводы подтверждаются другими исследованиями, которые показывают, что оральные контрацептивы вызывают схожие эффекты в полости носа (но не у всех). Другие работы показывают, что повышенный индекс массы тела, избыточный вес, множественные беременности провоцируют или отягощают РБ.
Некоторые авторы считают, что возникновение РБ связанно с ухудшением сопутствующего АР. Некоторые исследования показывают, что гормональное воздействие приводит к расслаблению гладкой мускулатуры, которая составляет стенку сосудов слизистой носа, в результате чего появляется заложенность носа. Такие выводы подтверждаются другими исследованиями, которые показывают, что оральные контрацептивы вызывают схожие эффекты в полости носа (но не у всех). Другие работы показывают, что повышенный индекс массы тела, избыточный вес, множественные беременности провоцируют или отягощают РБ.
 Очень часто слышу на приеме: «Доктор я беременна и мучаюсь со своим носом все это время, но врачи мне говорят — ничего не поделаешь нужно терпеть». С другой стороны, часто наблюдается обратная ситуация «Доктор, я беременная и я без сосудосуживающих капель жить не могу». Эти ситуации, конечно же, не правильны, так как с одной стороны есть выход и оптимальное лечение, а с другой стороны постоянное воздействие сосудосуживающими препаратами — это совсем не выход из ситуации.
Очень часто слышу на приеме: «Доктор я беременна и мучаюсь со своим носом все это время, но врачи мне говорят — ничего не поделаешь нужно терпеть». С другой стороны, часто наблюдается обратная ситуация «Доктор, я беременная и я без сосудосуживающих капель жить не могу». Эти ситуации, конечно же, не правильны, так как с одной стороны есть выход и оптимальное лечение, а с другой стороны постоянное воздействие сосудосуживающими препаратами — это совсем не выход из ситуации.
 Такие спреи продаются во всех аптеках, но сразу вам их не продадут (нужно попросить). Несколько исследований отмечают достоверную эффективность в снижении заложенности при использовании их при АР, хроническом риносинусите. Также сравнительные исследования показывают их большую эффективность по сравнению с обычными изотоническими растворами. Примеры: Физиомер — гипертонический раствор (мой любимый), Аквалор-заложенность, или Аквалор-сильный насморк, Аквамарис Стронг.
Такие спреи продаются во всех аптеках, но сразу вам их не продадут (нужно попросить). Несколько исследований отмечают достоверную эффективность в снижении заложенности при использовании их при АР, хроническом риносинусите. Также сравнительные исследования показывают их большую эффективность по сравнению с обычными изотоническими растворами. Примеры: Физиомер — гипертонический раствор (мой любимый), Аквалор-заложенность, или Аквалор-сильный насморк, Аквамарис Стронг.
/GettyImages-177259687-56f0cacf5f9b5867a1c63cf4.jpg) Современные ИГКС — мометазон (назонекс, дезринит) и флутиказон (авамис, фликсоназе) обладает очень низкой системной биодоступностью, меньше 1% и доказанной эффективностью, тем самым могут рассматриваться как начальная терапия РБ. В исследованиях не было выявлено статистически значимой взаимосвязи между развитием пороков плода и применением данных средств.
Современные ИГКС — мометазон (назонекс, дезринит) и флутиказон (авамис, фликсоназе) обладает очень низкой системной биодоступностью, меньше 1% и доказанной эффективностью, тем самым могут рассматриваться как начальная терапия РБ. В исследованиях не было выявлено статистически значимой взаимосвязи между развитием пороков плода и применением данных средств.
 При этом биодоступность будесонида составляет 33%. Этот препарат переместился из группы С в группу В, благодаря нескольким качественно проведенным исследованиям в Швеции с начала XXI века, доказавшим его безопасность.
При этом биодоступность будесонида составляет 33%. Этот препарат переместился из группы С в группу В, благодаря нескольким качественно проведенным исследованиям в Швеции с начала XXI века, доказавшим его безопасность.
 Надеюсь, данный обзор позволил прояснить некоторые аспекты в особенностях РБ и дать понять, что РБ не приговор и можно его адекватно контролировать.
Надеюсь, данный обзор позволил прояснить некоторые аспекты в особенностях РБ и дать понять, что РБ не приговор и можно его адекватно контролировать.
 Слизистая носа тому не исключение – она становится полнокровной, отекшей, и ширина носового хода сужается. А еще эстроген усиливает выработку слизи.
Слизистая носа тому не исключение – она становится полнокровной, отекшей, и ширина носового хода сужается. А еще эстроген усиливает выработку слизи.


 Чаще всего, до того как наступила беременность, у женщины не было негативной реакции на вещества, которые при вынашивании ребенка становятся раздражителями. Дебютирует заболевание, как правило, резко и неожиданно. Так как состояние женщины при таком явлении ухудшается, то в обязательном порядке при появлении ринита надо обратиться за врачебной помощью. Лечить заболевание своими силами категорически запрещается из-за того, что при ошибках терапии может быть нанесен серьезный вред плоду. Любое лечение должно согласовываться с гинекологом, который ведет беременность.
Чаще всего, до того как наступила беременность, у женщины не было негативной реакции на вещества, которые при вынашивании ребенка становятся раздражителями. Дебютирует заболевание, как правило, резко и неожиданно. Так как состояние женщины при таком явлении ухудшается, то в обязательном порядке при появлении ринита надо обратиться за врачебной помощью. Лечить заболевание своими силами категорически запрещается из-за того, что при ошибках терапии может быть нанесен серьезный вред плоду. Любое лечение должно согласовываться с гинекологом, который ведет беременность.
 Если развился аллергический ринит во время беременности, лечение должно проводиться обязательно.
Если развился аллергический ринит во время беременности, лечение должно проводиться обязательно.
 Из-за его присутствия происходит воспаление слизистой и, как следствие, ее отек. Организм, чтобы избавиться от аллергена, начинает выделять большое количество особенно жидкой слизи, которая должна его вымыть наружу. Из-за того же что аллерген поступает с воздухом постоянно, удалить его естественным образом не получается. В результате этого без лекарственных препаратов решить проблему аллергического насморка оказывается невозможно.
Из-за его присутствия происходит воспаление слизистой и, как следствие, ее отек. Организм, чтобы избавиться от аллергена, начинает выделять большое количество особенно жидкой слизи, которая должна его вымыть наружу. Из-за того же что аллерген поступает с воздухом постоянно, удалить его естественным образом не получается. В результате этого без лекарственных препаратов решить проблему аллергического насморка оказывается невозможно.
 Из-за этого негативная реакция организма возникает и при пользовании пуховыми подушками и одеялами, в которых для жизни пылевых клещей идеальные условия;
Из-за этого негативная реакция организма возникает и при пользовании пуховыми подушками и одеялами, в которых для жизни пылевых клещей идеальные условия;
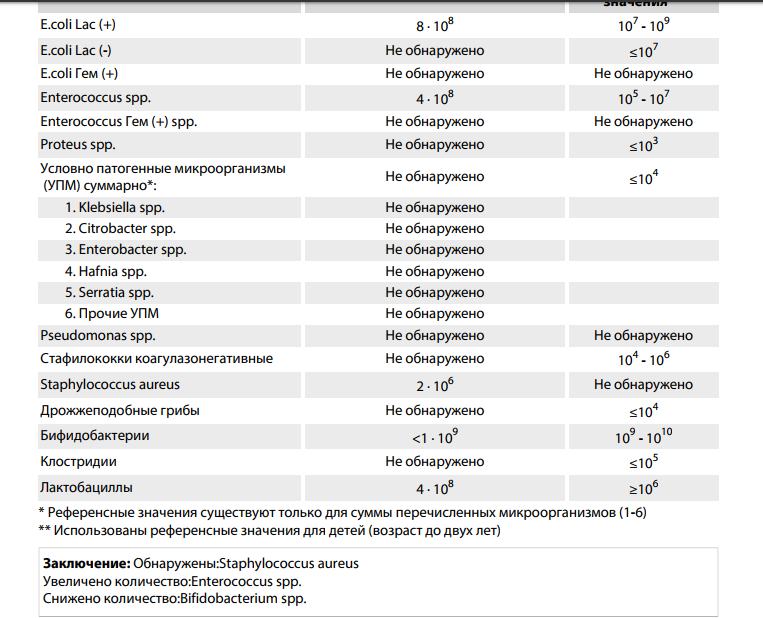
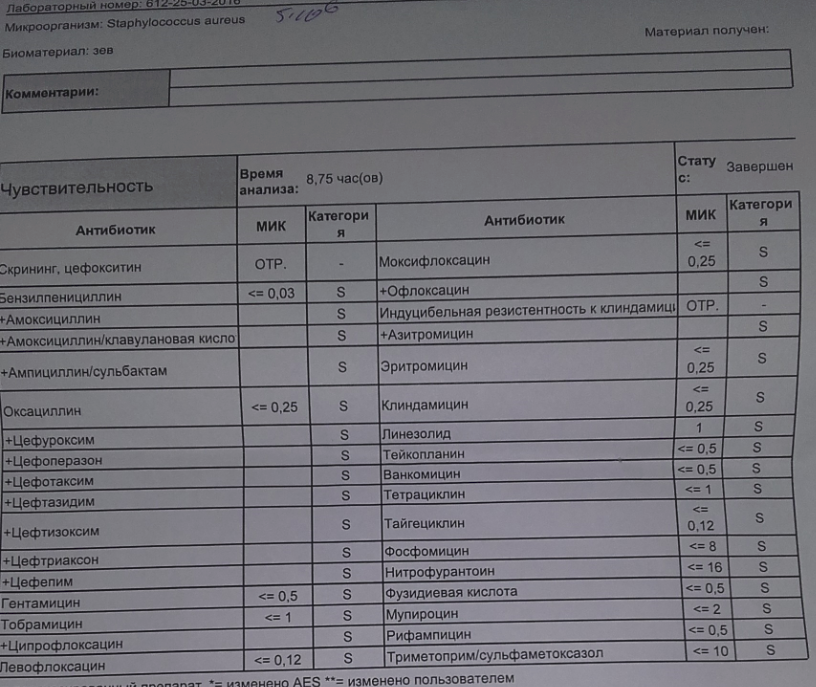 Симптомы золотистого стафилококка в кишечнике у взрослых
Симптомы золотистого стафилококка в кишечнике у взрослых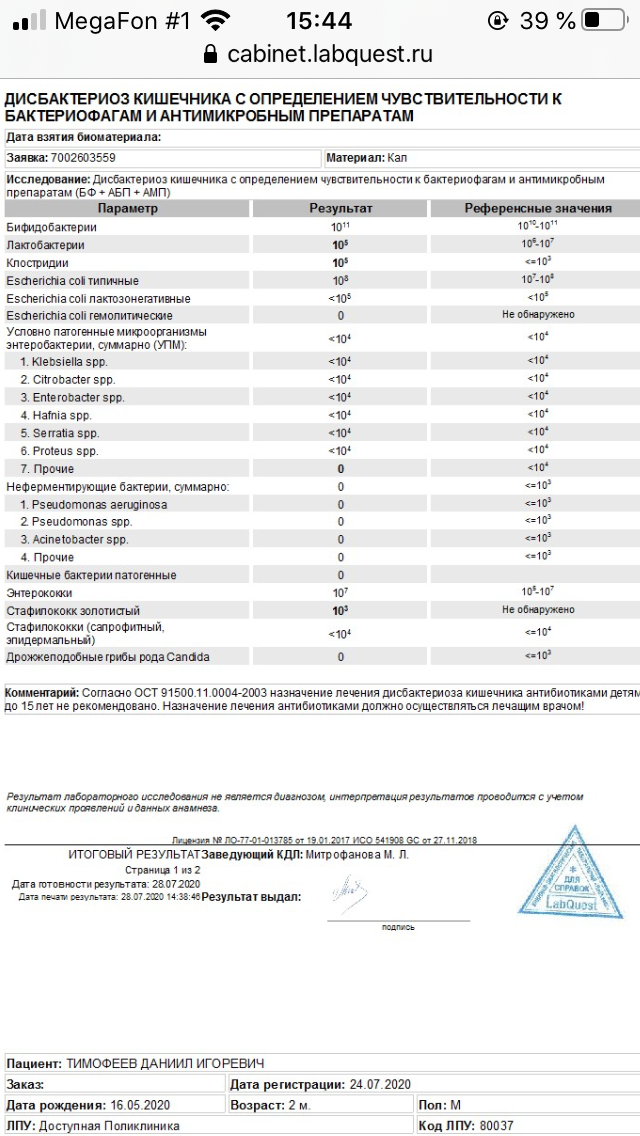
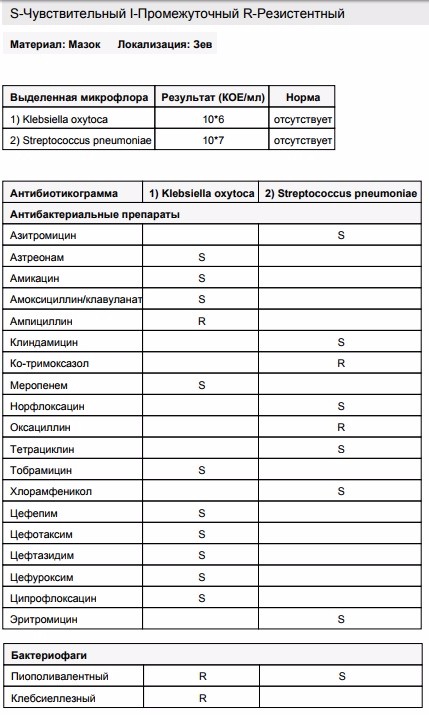
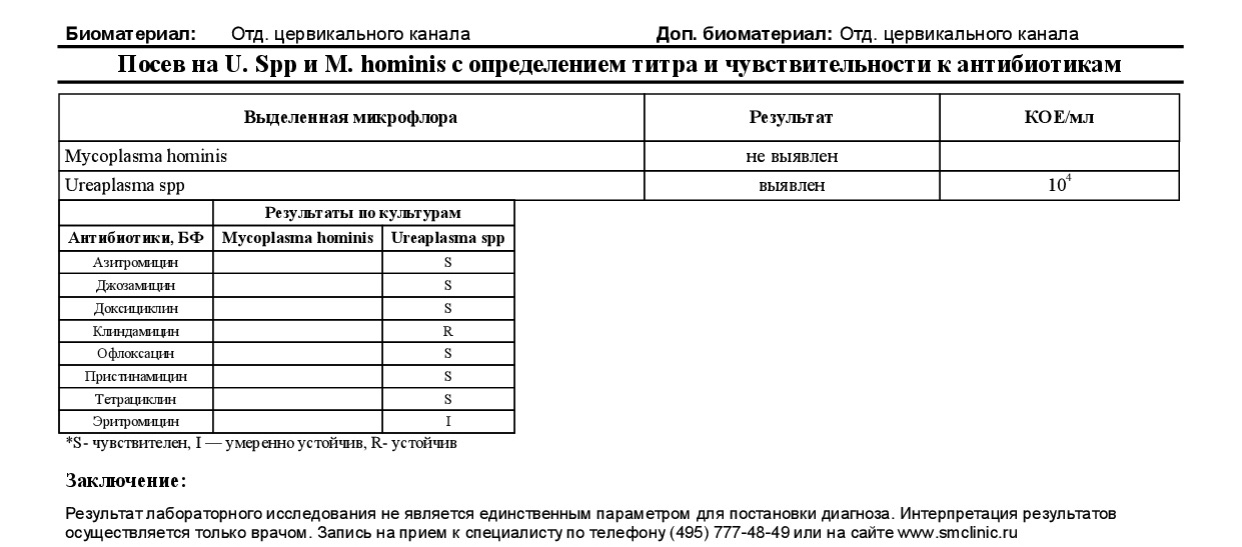


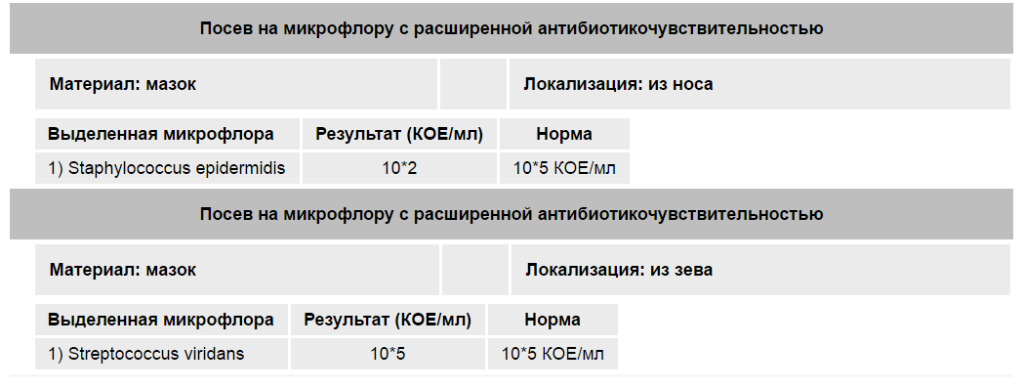
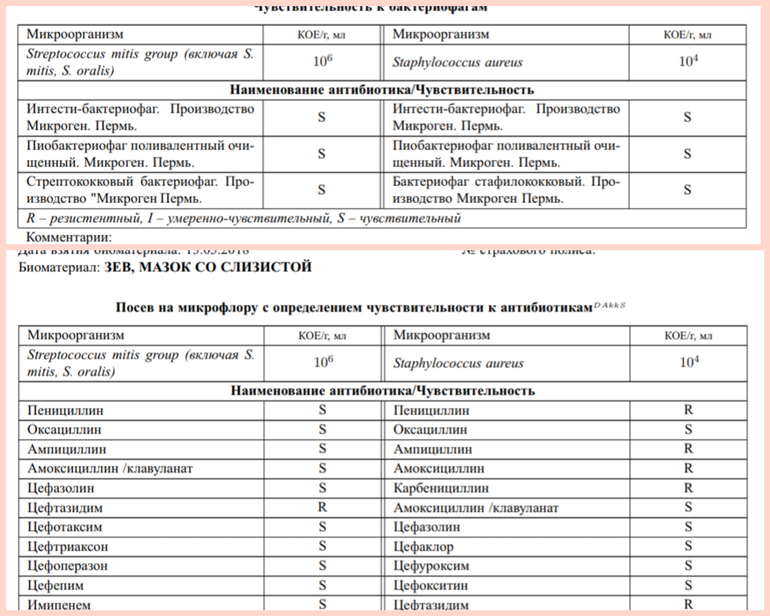
 Но, если эта бактерия попадает в кровь человека с ослабленным иммунитетом, что чаще всего происходит при хирургических операциях, использовании неправильно обработанных инструментов, катетеров, происходит заражение крови, что ведет к воспалению внутренней оболочки сердца.
Но, если эта бактерия попадает в кровь человека с ослабленным иммунитетом, что чаще всего происходит при хирургических операциях, использовании неправильно обработанных инструментов, катетеров, происходит заражение крови, что ведет к воспалению внутренней оболочки сердца.
 Но можно выделить ряд наиболее характерных признаков:
Но можно выделить ряд наиболее характерных признаков:
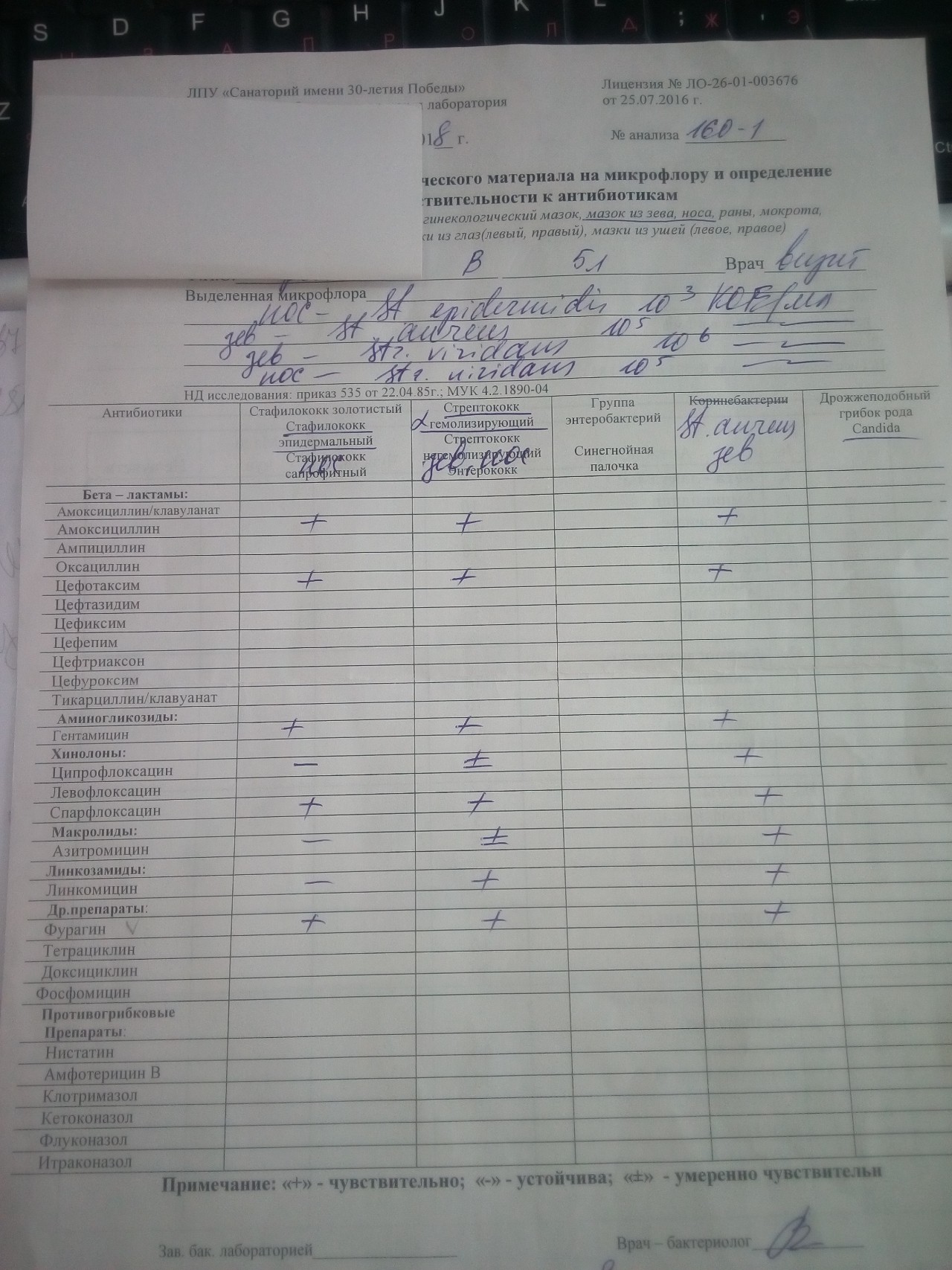

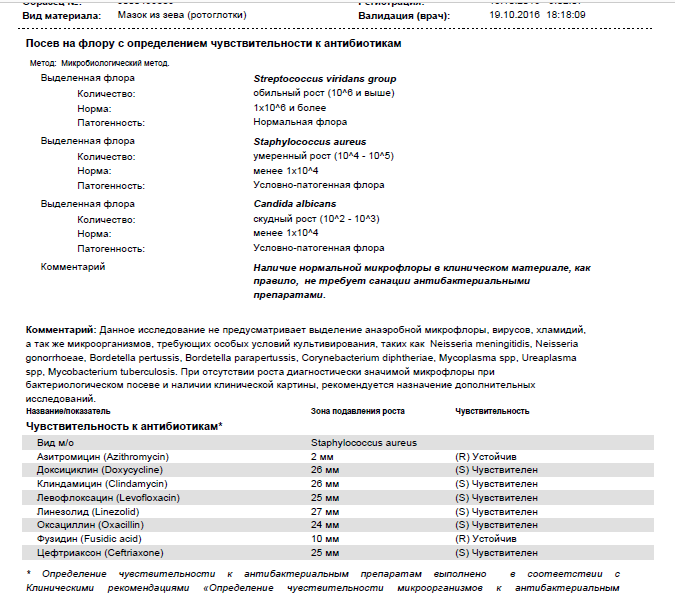


/109/109.jpg) При появлении гнойников может потребоваться и хирургическое вмешательство. Лечение золотистого стафилококка в носу у взрослых должно полностью контролироваться врачом. Это поможет избежать страшных последствий.
При появлении гнойников может потребоваться и хирургическое вмешательство. Лечение золотистого стафилококка в носу у взрослых должно полностью контролироваться врачом. Это поможет избежать страшных последствий.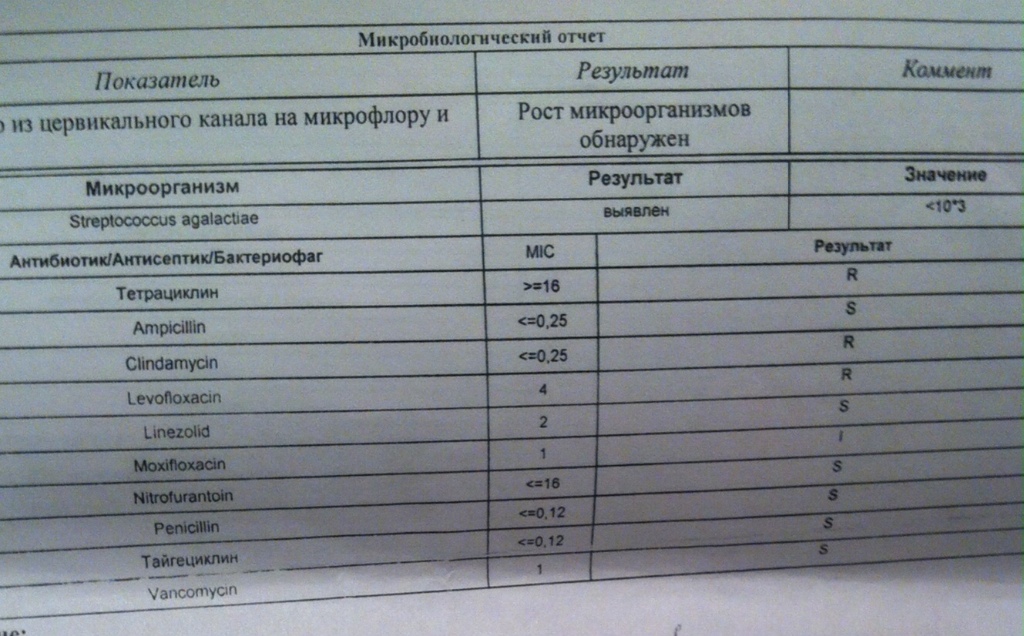
 Термин «условно-патогенный» означает, что стафилококк вызывает заболевание лишь при определенных обстоятельствах. Он может находиться в организме долгое время (хоть всю жизнь), не причиняя человеку вреда и должны создаться определенные условия, чтобы он вызвал болезнь. А именно – ослабление иммунитета. Если иммунная защита человека работает нормально, стафилококк существует в организме, не причиняя «хозяину» никакого беспокойства. Если иммунитет дает сбой, стафилококк может атаковать организм человека, что ведет к появлению самых различных болезней (более ста наименований): от относительно легких кожных гнойничковых инфекций до таких тяжелых процессов как пневмония (воспаление легких), менингит (воспаление оболочек мозга), остеомиелит (поражение костей), сепсис (воспалительный процесс во всех органах человека или «заражение крови»), токсический шок и другие.Самая распространенная токсическая стафилококковая болезнь – пищевая токсикоинфекция.
Термин «условно-патогенный» означает, что стафилококк вызывает заболевание лишь при определенных обстоятельствах. Он может находиться в организме долгое время (хоть всю жизнь), не причиняя человеку вреда и должны создаться определенные условия, чтобы он вызвал болезнь. А именно – ослабление иммунитета. Если иммунная защита человека работает нормально, стафилококк существует в организме, не причиняя «хозяину» никакого беспокойства. Если иммунитет дает сбой, стафилококк может атаковать организм человека, что ведет к появлению самых различных болезней (более ста наименований): от относительно легких кожных гнойничковых инфекций до таких тяжелых процессов как пневмония (воспаление легких), менингит (воспаление оболочек мозга), остеомиелит (поражение костей), сепсис (воспалительный процесс во всех органах человека или «заражение крови»), токсический шок и другие.Самая распространенная токсическая стафилококковая болезнь – пищевая токсикоинфекция.2008/21/3.png) Этим занимаются врачи различных специальностей. Лечение стафилококковых болезней — удивительно сложная задача, ибо нет микроба, способного сравниться со стафилококком по способности вырабатывать устойчивость к антибиотикам и другим антибактериальным средствам. Поэтому лечение необходимо назначать только после определения чувствительности к антибактериальным средствам. С этим согласны все специалисты.
Этим занимаются врачи различных специальностей. Лечение стафилококковых болезней — удивительно сложная задача, ибо нет микроба, способного сравниться со стафилококком по способности вырабатывать устойчивость к антибиотикам и другим антибактериальным средствам. Поэтому лечение необходимо назначать только после определения чувствительности к антибактериальным средствам. С этим согласны все специалисты. Например, вирус парагриппа — к слизистой оболочке носовых ходов и гортани, риновирусы — преимущественно к слизистой оболочке носовых ходов.
Например, вирус парагриппа — к слизистой оболочке носовых ходов и гортани, риновирусы — преимущественно к слизистой оболочке носовых ходов. Поэтому нельзя пренебрегать лечением при возникновении ОРЗ, даже если болезнь переносится легко.
Поэтому нельзя пренебрегать лечением при возникновении ОРЗ, даже если болезнь переносится легко. Да и при использовании ИММУНАЛА, комплексного гомеопатического препарата АФЛУБИНА возможны аллергические реакции у крохи.
Да и при использовании ИММУНАЛА, комплексного гомеопатического препарата АФЛУБИНА возможны аллергические реакции у крохи.

 При насморке могут быть полезны сосудосуживающие капли, облегчающие носовое дыхание НАФАЗОЛИН (НАФТИЗИН), КСИЛОМЕТАЗОЛИН (ГАЛАЗОЛИН), ТЕТРИЗОЛИН (ТИЗИН), ОКСИМЕТАЗОЛИН (НАЗИВИН). Использовать их можно не дольше 3-5 дней.
При насморке могут быть полезны сосудосуживающие капли, облегчающие носовое дыхание НАФАЗОЛИН (НАФТИЗИН), КСИЛОМЕТАЗОЛИН (ГАЛАЗОЛИН), ТЕТРИЗОЛИН (ТИЗИН), ОКСИМЕТАЗОЛИН (НАЗИВИН). Использовать их можно не дольше 3-5 дней. Для смазывания слизистой оболочки глотки применяют РАСТВОР ЛЮГОЛЯ (водный раствор калия йода).
Для смазывания слизистой оболочки глотки применяют РАСТВОР ЛЮГОЛЯ (водный раствор калия йода). В основном насморк проявляется при ОРЗ, ОРВИ, гриппе, тонзиллите, фарингите. Он развивается и при влиянии на организм аллергенов – например, шерсти или перьев, пыльцы растений, плесени, химикатов. Ринит часто сопровождает синуситы – гайморит, фронтит, сфеноидит.
Проявление и активное прогрессирование ринита вызывают следующие факторы:
В основном насморк проявляется при ОРЗ, ОРВИ, гриппе, тонзиллите, фарингите. Он развивается и при влиянии на организм аллергенов – например, шерсти или перьев, пыльцы растений, плесени, химикатов. Ринит часто сопровождает синуситы – гайморит, фронтит, сфеноидит.
Проявление и активное прогрессирование ринита вызывают следующие факторы: Капли во время кормления грудью помогают уменьшить отек и объем продуцируемой слизи, но полное излечение наступит только при выздоровлении от первичной болезни.
Ринит развивается в несколько стадий:
Капли во время кормления грудью помогают уменьшить отек и объем продуцируемой слизи, но полное излечение наступит только при выздоровлении от первичной болезни.
Ринит развивается в несколько стадий:
 Лечение насморка при грудном вскармливании проводится комплексно. С целью ускорения выздоровления кормящая мама должна соблюдать несложные правила:
Лечение насморка при грудном вскармливании проводится комплексно. С целью ускорения выздоровления кормящая мама должна соблюдать несложные правила: Зеленый оттенок выделений у кормящей женщины – плохой признак, при котором требуется срочно обратиться к доктору. Для купирования развития инфекции требуются антисептики, антибактериальные препараты. Во время курса последними кормление грудью приостанавливают.
Зеленый оттенок выделений у кормящей женщины – плохой признак, при котором требуется срочно обратиться к доктору. Для купирования развития инфекции требуются антисептики, антибактериальные препараты. Во время курса последними кормление грудью приостанавливают. д.
д.

 п. Они эффективно увлажняют слизистую носа, очищают носовые ходы от пыли, слизи, разжижают вязкие выделения.
п. Они эффективно увлажняют слизистую носа, очищают носовые ходы от пыли, слизи, разжижают вязкие выделения.
 Лечение орви во время лактации: боремся с насморком
Лечение орви во время лактации: боремся с насморком 

 Это происходит при онкологическом процессе, туберкулезе. Кровь может быть алого или малинового цвета, в зависимости от вида и давности кровотечения.
Это происходит при онкологическом процессе, туберкулезе. Кровь может быть алого или малинового цвета, в зависимости от вида и давности кровотечения.
 После откашливания материала, контейнер закупоривается и отправляется в лабораторию. Важно, чтобы мокрота была свежей, иначе происходит изменение кислотности, а часть жидкости высыхает. Предусмотрены индивидуальные плевательницы с плотно прилегающей крышкой. До передачи в лабораторию, контейнер с собранным материалом хранится в холодильнике.
После откашливания материала, контейнер закупоривается и отправляется в лабораторию. Важно, чтобы мокрота была свежей, иначе происходит изменение кислотности, а часть жидкости высыхает. Предусмотрены индивидуальные плевательницы с плотно прилегающей крышкой. До передачи в лабораторию, контейнер с собранным материалом хранится в холодильнике. 
 Как правило, заболевание не ограничивается только местными симптомами (покраснение задней стенки глотки, небных дужек, увеличение и набухание миндалин с налетами на них чаще бело-желтого цвета) и теми же неприятными ощущениями, что и при фарингите (боль, першение, трудности при глотании), но и характеризуется развитием общей симптоматики (повышение температуры, ухудшение самочувствия, слабость, вялость, головная боль, головокружение и т.д.). При ангине боли в горле могут быть настолько сильными, что ребенок отказывается от еды. Стоит заметить, что при часто переносимых острых фарингитах и/или ангинах может сформироваться хронический очаг инфекции в области глотки, так называемый хронический тонзиллит (хроническое воспаление миндалин), когда воспалительный процесс приобретает рецидивирующий (повторяющийся характер) характер. При этом появляются и новые симптомы, например, неприятный запах изо рта, начинают периодически воспаляться десны, болеть зубы, проявляется стоматит. Каждое новое обострение хронического тонзиллита рискует осложниться паратонзиллярным абсцессом, когда с одной стороны — в области миндалины, местно возникает гнойный очаг.
Как правило, заболевание не ограничивается только местными симптомами (покраснение задней стенки глотки, небных дужек, увеличение и набухание миндалин с налетами на них чаще бело-желтого цвета) и теми же неприятными ощущениями, что и при фарингите (боль, першение, трудности при глотании), но и характеризуется развитием общей симптоматики (повышение температуры, ухудшение самочувствия, слабость, вялость, головная боль, головокружение и т.д.). При ангине боли в горле могут быть настолько сильными, что ребенок отказывается от еды. Стоит заметить, что при часто переносимых острых фарингитах и/или ангинах может сформироваться хронический очаг инфекции в области глотки, так называемый хронический тонзиллит (хроническое воспаление миндалин), когда воспалительный процесс приобретает рецидивирующий (повторяющийся характер) характер. При этом появляются и новые симптомы, например, неприятный запах изо рта, начинают периодически воспаляться десны, болеть зубы, проявляется стоматит. Каждое новое обострение хронического тонзиллита рискует осложниться паратонзиллярным абсцессом, когда с одной стороны — в области миндалины, местно возникает гнойный очаг.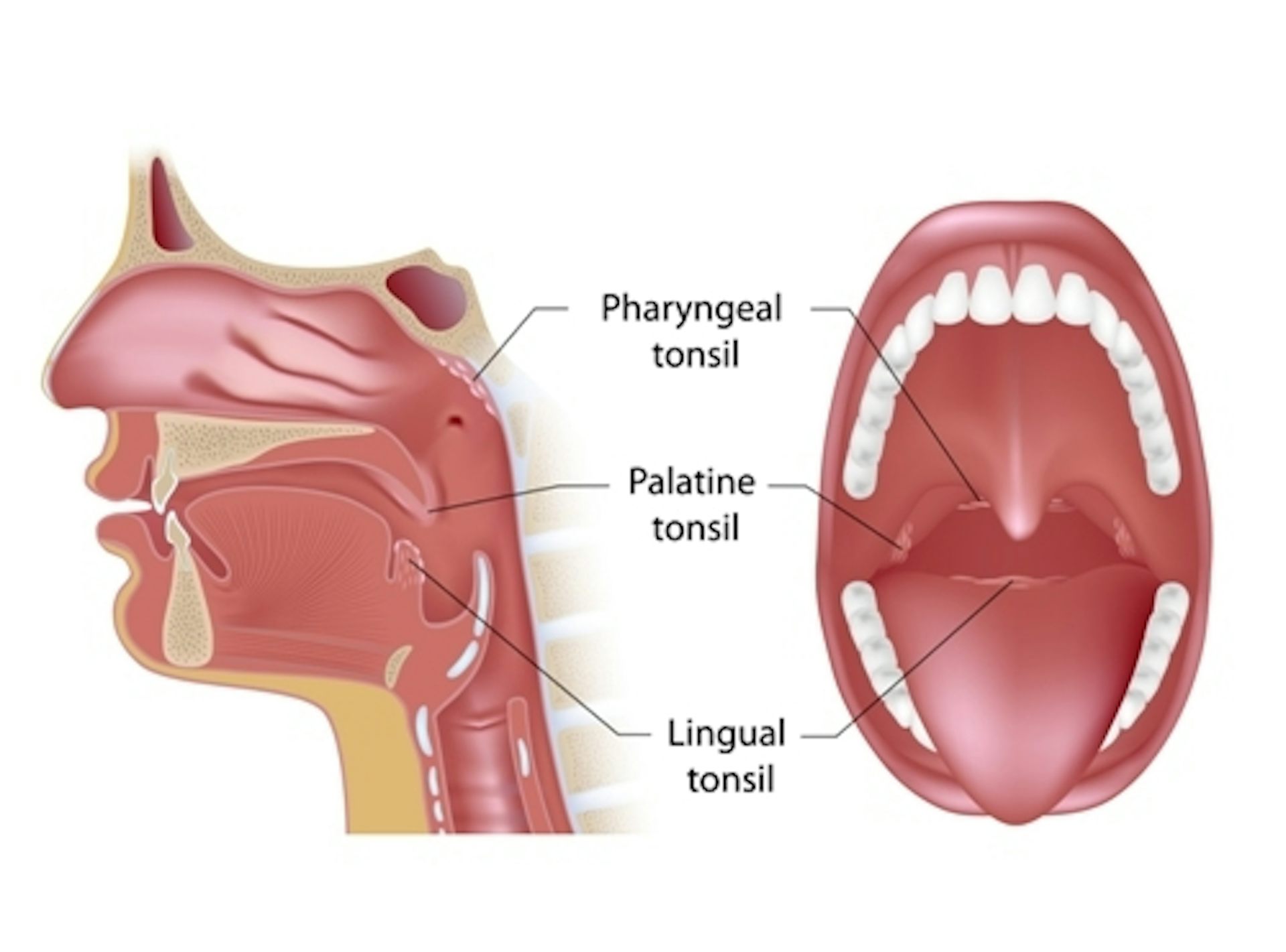 Во многих случаях такое осложнение требует оперативного лечения.
Во многих случаях такое осложнение требует оперативного лечения. Кроме того, частое применение антибиотиков способствует распространению грибковых инфекций, развитию аллергических реакций, дисбактериоза, нарушению функции клеток печени и т.д. Поэтому стоит очень взвешенно относиться к антибиотикотерапии. Самостоятельное «назначение» антибиотиков ребенку недопустимо!
Кроме того, частое применение антибиотиков способствует распространению грибковых инфекций, развитию аллергических реакций, дисбактериоза, нарушению функции клеток печени и т.д. Поэтому стоит очень взвешенно относиться к антибиотикотерапии. Самостоятельное «назначение» антибиотиков ребенку недопустимо! Хлоргексидин, входящий в его состав, является мощным антисептиком и воздействует на большинство возбудителей инфекций. Обезболивающее действие препарата обеспечивается анестетиком — тетракаином. Удобны и формы выпуска Анти-Ангина: пастилки, таблетки для рассасывания без сахара (рекомендуются взрослым и детям с 5 лет), спрей (рекомендуется взрослым и подросткам с 10 лет). В состав пастилок и таблеток входит еще и витамин С (аскорбиновая кислота), что способствует быстрому восстановлению слизистой оболочки полости рта и горла.
Хлоргексидин, входящий в его состав, является мощным антисептиком и воздействует на большинство возбудителей инфекций. Обезболивающее действие препарата обеспечивается анестетиком — тетракаином. Удобны и формы выпуска Анти-Ангина: пастилки, таблетки для рассасывания без сахара (рекомендуются взрослым и детям с 5 лет), спрей (рекомендуется взрослым и подросткам с 10 лет). В состав пастилок и таблеток входит еще и витамин С (аскорбиновая кислота), что способствует быстрому восстановлению слизистой оболочки полости рта и горла. Так, для лечения заболеваний горла успешно применяется препарат «Шалфей», разрешенный детям с 5-летнего возраста в виде пастилок и таблеток для рассасывания. «Шалфей» содержит вяжущие вещества и благодаря этому оказывает противовоспалительное действие. Это средство эффективно не только при заболеваниях глотки, но и при воспалительных заболеваниях полости рта (стоматит, парадонтит и др.). Кроме того, в отличие от многих лекарственных растений, «Шалфей Зеленый Доктор» обладает приятным вкусом, что немаловажно применительно к детскому возрасту.
Так, для лечения заболеваний горла успешно применяется препарат «Шалфей», разрешенный детям с 5-летнего возраста в виде пастилок и таблеток для рассасывания. «Шалфей» содержит вяжущие вещества и благодаря этому оказывает противовоспалительное действие. Это средство эффективно не только при заболеваниях глотки, но и при воспалительных заболеваниях полости рта (стоматит, парадонтит и др.). Кроме того, в отличие от многих лекарственных растений, «Шалфей Зеленый Доктор» обладает приятным вкусом, что немаловажно применительно к детскому возрасту. «Эвкалипт-М» разрешен к применению у детей с 8 лет в виде пастилок и таблеток для рассасывания.
«Эвкалипт-М» разрешен к применению у детей с 8 лет в виде пастилок и таблеток для рассасывания. Более чем у половины из них выявляются хронические очаги инфекции в области носоглотки. Санация хронических очагов инфекции у такой категории детей приобретает первостепенное значение. И вышеперечисленные препараты могут занять свое достойное место в ряду как лечебных, так и профилактических средств в комплексной работе с ЧБД.
Более чем у половины из них выявляются хронические очаги инфекции в области носоглотки. Санация хронических очагов инфекции у такой категории детей приобретает первостепенное значение. И вышеперечисленные препараты могут занять свое достойное место в ряду как лечебных, так и профилактических средств в комплексной работе с ЧБД.
 Провоцирует болезнь бактерия типа стрептококка, так что без лечения антибиотиками в этом случае не обойтись.
Провоцирует болезнь бактерия типа стрептококка, так что без лечения антибиотиками в этом случае не обойтись. Все мы с детства при посещении врача помним, что при этом желательно произнести протяжный звук «А». Заменить подобные горловые манипуляции можно просто глубоким вздохом. На протяжении всей процедуры осмотра больному нужно интенсивно дышать ртом для самопроизвольного опущения языка.
Все мы с детства при посещении врача помним, что при этом желательно произнести протяжный звук «А». Заменить подобные горловые манипуляции можно просто глубоким вздохом. На протяжении всей процедуры осмотра больному нужно интенсивно дышать ртом для самопроизвольного опущения языка. При этом необходимо узнать, нет ли гнойных очагов на небных миндалинах. Симптомы такого явления будут выражаться в патологических узелках на двух или одной гланде.
При этом необходимо узнать, нет ли гнойных очагов на небных миндалинах. Симптомы такого явления будут выражаться в патологических узелках на двух или одной гланде. Если воспаление гланд и глотки было обнаружено, необходимо срочно обратиться к врачу за консультацией.
Если воспаление гланд и глотки было обнаружено, необходимо срочно обратиться к врачу за консультацией.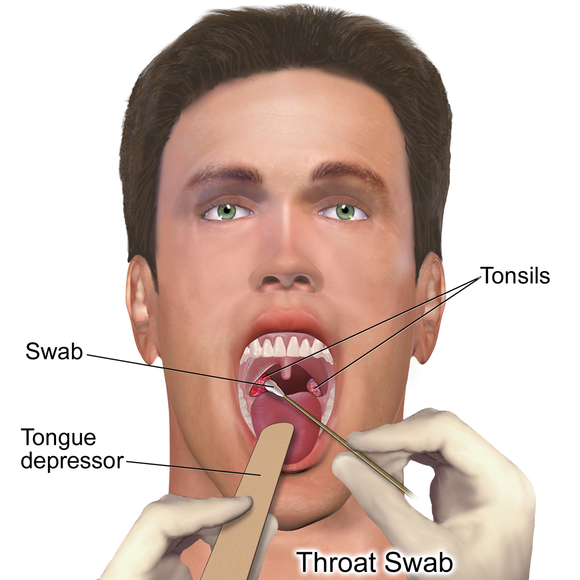 Чтобы понять, можно ли лечиться дома натуральными препаратами или все же следует посетить врача, важно понять, вызвана ли боль вирусной инфекцией, как это бывает в 80 % случаев, или бактериями, потому что тогда без посещения врача не обойтись. Это человек обычно может оценить сам.
Чтобы понять, можно ли лечиться дома натуральными препаратами или все же следует посетить врача, важно понять, вызвана ли боль вирусной инфекцией, как это бывает в 80 % случаев, или бактериями, потому что тогда без посещения врача не обойтись. Это человек обычно может оценить сам.

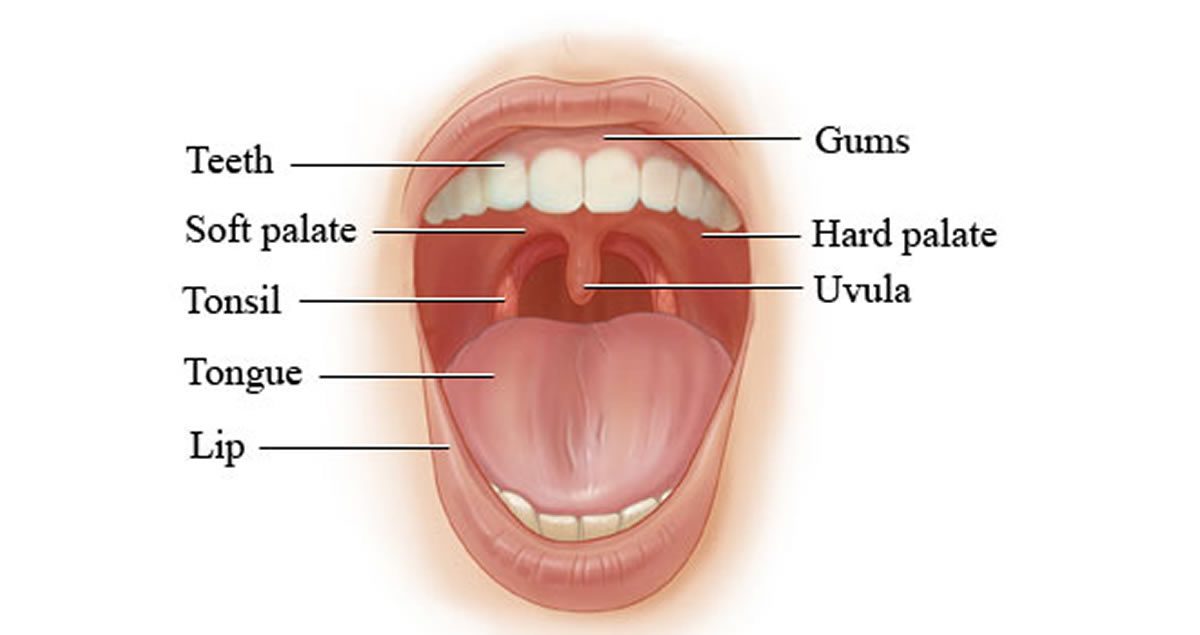 Концентрированный соляной раствор может вызвать еще более сильное раздражение или даже обжечь слизистую горла. Важно соблюдать умеренность при полоскании горла – это можно делать не чаще двух раз в день.
Концентрированный соляной раствор может вызвать еще более сильное раздражение или даже обжечь слизистую горла. Важно соблюдать умеренность при полоскании горла – это можно делать не чаще двух раз в день.

 При этих болезнях воспалительный процесс появляется в горле: человек чувствует першение, боль. Помимо боли в горле при вирусном поражении в процесс вовлечен и нос – сильный насморк, а так же снижение жизненной активности, общая слабость, головная боль, боли в мышцах и повышение температуры тела. А при оспе и кори на коже появляется и сыпь. При мононуклеозе увеличиваются лимфоузлы и есть опасность распространения воспалительного процесса на печень и селезенку.
При этих болезнях воспалительный процесс появляется в горле: человек чувствует першение, боль. Помимо боли в горле при вирусном поражении в процесс вовлечен и нос – сильный насморк, а так же снижение жизненной активности, общая слабость, головная боль, боли в мышцах и повышение температуры тела. А при оспе и кори на коже появляется и сыпь. При мононуклеозе увеличиваются лимфоузлы и есть опасность распространения воспалительного процесса на печень и селезенку. Имеет широкий спектр действия – от противовоспалительного до иммуностимулирующего. В том числе женьшень широко применяют для усиления мозговой активности.
Имеет широкий спектр действия – от противовоспалительного до иммуностимулирующего. В том числе женьшень широко применяют для усиления мозговой активности. А сотрудники Лёвенского католического университета в Бельгии выяснили 2, что здоровым людям экстракт родиолы помогает работать продуктивнее.
А сотрудники Лёвенского католического университета в Бельгии выяснили 2, что здоровым людям экстракт родиолы помогает работать продуктивнее. Поражающее воображение долгожительство сделало гинкго одной из самых популярных растительных добавок в мире. Считается, что его экстракт способен оказывать благотворное влияние на мозг и даже замедлять развитие старческой деменции.
Поражающее воображение долгожительство сделало гинкго одной из самых популярных растительных добавок в мире. Считается, что его экстракт способен оказывать благотворное влияние на мозг и даже замедлять развитие старческой деменции. Препарат NUTRILITE™ Память плюс в форме таблеток на основе корня цистанхе рекомендован всем, кто хочет развить свою память и умственную работоспособность.
Препарат NUTRILITE™ Память плюс в форме таблеток на основе корня цистанхе рекомендован всем, кто хочет развить свою память и умственную работоспособность.
 // Phytomedicine. 2015. №22 (3). С. 394-9.
// Phytomedicine. 2015. №22 (3). С. 394-9. Но, конечно, это не совсем так, когда речь идет о населяющих наш мир бактериях, вирусах и микробах. Они страшны именно тем, что могут проникнуть всюду, нанося вред здоровью и самочувствию человека.
Но, конечно, это не совсем так, когда речь идет о населяющих наш мир бактериях, вирусах и микробах. Они страшны именно тем, что могут проникнуть всюду, нанося вред здоровью и самочувствию человека. Также при возможности следует использовать ультрафиолетовую лампу в помещениях для очистки воздуха (следите, чтобы в это время в комнате никого не было). А чтобы борьба с вирусами и бактериями была наиболее эффективной, необходимо выбирать для обработки поверхностей проверенные дезинфицирующие средства для дома.
Также при возможности следует использовать ультрафиолетовую лампу в помещениях для очистки воздуха (следите, чтобы в это время в комнате никого не было). А чтобы борьба с вирусами и бактериями была наиболее эффективной, необходимо выбирать для обработки поверхностей проверенные дезинфицирующие средства для дома. Многие из этих возбудителей, вызывающих серьезные заболевания, резистентны к традиционным обеззараживающим и противомикробным средствам.
Многие из этих возбудителей, вызывающих серьезные заболевания, резистентны к традиционным обеззараживающим и противомикробным средствам. Их легко приобрести в свободной продаже, и существует множество народных способов и методов по их применению для проведения антибактериальной обработки помещения. Но сегодня мы все чаще и чаще задумываемся о том, насколько безопасны для экологии дома средства, которые мы используем во время уборки. Состав концентрата Pursue от Амвэй абсолютно натурален – в нем вы не найдете хлора, фосфатов или отбеливателей. Это универсальное концентрированное экосредство для уборки всего дома. С помощью данного препарата можно мыть санитарные зоны – кухню, туалет с ванной, полы и стены, а также обрабатывать кухонные принадлежности, например разделочные доски, игрушки и предметы личного пользования.
Их легко приобрести в свободной продаже, и существует множество народных способов и методов по их применению для проведения антибактериальной обработки помещения. Но сегодня мы все чаще и чаще задумываемся о том, насколько безопасны для экологии дома средства, которые мы используем во время уборки. Состав концентрата Pursue от Амвэй абсолютно натурален – в нем вы не найдете хлора, фосфатов или отбеливателей. Это универсальное концентрированное экосредство для уборки всего дома. С помощью данного препарата можно мыть санитарные зоны – кухню, туалет с ванной, полы и стены, а также обрабатывать кухонные принадлежности, например разделочные доски, игрушки и предметы личного пользования. Симптомы ротавируса у детей могут быть очень тяжелыми (рвота и диарея) и привести к обезвоживанию и другим неприятным последствиям интоксикации, вплоть до летального исхода. Особенно опасен он для младенцев. Бактерии сальмонеллы также весьма агрессивны для организма человека, они выделяют токсины и поражают желудочно-кишечный тракт. При этом они очень живучи, а сальмонеллез тяжело поддается лечению.
Симптомы ротавируса у детей могут быть очень тяжелыми (рвота и диарея) и привести к обезвоживанию и другим неприятным последствиям интоксикации, вплоть до летального исхода. Особенно опасен он для младенцев. Бактерии сальмонеллы также весьма агрессивны для организма человека, они выделяют токсины и поражают желудочно-кишечный тракт. При этом они очень живучи, а сальмонеллез тяжело поддается лечению.



 После перенесения серьезной травмы. Злокачественная опухоль как онкологическое заболевание. Первичный иммунодефицит. ВИЧ. Заболевания также являются факторами пониженного иммунитета. — Также к причинам понижения иммунной системы относится долгое принятие антибиотиков, тяжелые операции и кишечные инвазии, иначе – паразиты.
После перенесения серьезной травмы. Злокачественная опухоль как онкологическое заболевание. Первичный иммунодефицит. ВИЧ. Заболевания также являются факторами пониженного иммунитета. — Также к причинам понижения иммунной системы относится долгое принятие антибиотиков, тяжелые операции и кишечные инвазии, иначе – паразиты. 

 Затем кипятят примерно полчаса, и столько же настаивают. Принимают ежедневно по 200 мл. Отвар из хвои. Пользуется популярностью ароматный хвойный отвар.
Затем кипятят примерно полчаса, и столько же настаивают. Принимают ежедневно по 200 мл. Отвар из хвои. Пользуется популярностью ароматный хвойный отвар. л.) заливают горячей водой (250 мл) и охлаждают. Употребляют несколько раз в день, теплым, по 80 мл. Отвар из чистотела. Чистотел также обладает многими полезными качествами для иммунитета.
л.) заливают горячей водой (250 мл) и охлаждают. Употребляют несколько раз в день, теплым, по 80 мл. Отвар из чистотела. Чистотел также обладает многими полезными качествами для иммунитета.

 Общепринятая норма сна для взрослого человека составляет 7-8 часов в день. Стоит прислушиваться к своему организму – и он даст понять, частыми простудными заболеваниями или усталостью и слабостью, когда пора отдохнуть и хорошенько выспаться. У некоторых людей иногда нет возможности хорошо выспаться, но это не страшно, организм, недосыпая, имеет способность быстро восстанавливаться. Для этого просто нужно поспать подольше после бессонной ночи. Нельзя экономить на сне, потом, возможно, придется затратить больше времени, сил и денег на восстановление организма и иммунитета.
Общепринятая норма сна для взрослого человека составляет 7-8 часов в день. Стоит прислушиваться к своему организму – и он даст понять, частыми простудными заболеваниями или усталостью и слабостью, когда пора отдохнуть и хорошенько выспаться. У некоторых людей иногда нет возможности хорошо выспаться, но это не страшно, организм, недосыпая, имеет способность быстро восстанавливаться. Для этого просто нужно поспать подольше после бессонной ночи. Нельзя экономить на сне, потом, возможно, придется затратить больше времени, сил и денег на восстановление организма и иммунитета. Полезные травяные чаи помогут вам держаться в тонусе. Избавление от вредных привычек, активный образ жизни, меньше стрессов и переживаний, здоровый сон и правильное питание – залог крепкого иммунитета и здорового организма.
Полезные травяные чаи помогут вам держаться в тонусе. Избавление от вредных привычек, активный образ жизни, меньше стрессов и переживаний, здоровый сон и правильное питание – залог крепкого иммунитета и здорового организма.
 п.). Это могут быть не только инородные вещества, но и всевозможные вирусы и бактерии, способные стать причиной множества болезней.
п.). Это могут быть не только инородные вещества, но и всевозможные вирусы и бактерии, способные стать причиной множества болезней. Поэтому медики призывают тщательно следить за своим самочувствием, и не игнорировать тревожные сигналы, посылаемые нашим организмом.
Поэтому медики призывают тщательно следить за своим самочувствием, и не игнорировать тревожные сигналы, посылаемые нашим организмом. Только специалисты знают, как правильно оценить состояние здоровья пациента, и какие следует провести исследований (лабораторный анализ крови, первичный скрининг для тестирования иммунных функций, аллергопробы и т.п.).
Только специалисты знают, как правильно оценить состояние здоровья пациента, и какие следует провести исследований (лабораторный анализ крови, первичный скрининг для тестирования иммунных функций, аллергопробы и т.п.). п.).
п.).
 Бактерии, попавшие на сухую слизистую носа или горла, быстрее проникают в кровь. Поэтому в холодное время года люди чаще болеют простудными заболеваниями.
Бактерии, попавшие на сухую слизистую носа или горла, быстрее проникают в кровь. Поэтому в холодное время года люди чаще болеют простудными заболеваниями. п.
п. Не забывайте про орехи и сухофрукты, а также про цельнозерновой хлеб и каши. Попробуйте есть небольшими порциями, 4-5 раз в течение дня. Тогда организм перестанет испытывать стресс в ожидании очередной порции пищи, и начнет работать более стабильно.
Не забывайте про орехи и сухофрукты, а также про цельнозерновой хлеб и каши. Попробуйте есть небольшими порциями, 4-5 раз в течение дня. Тогда организм перестанет испытывать стресс в ожидании очередной порции пищи, и начнет работать более стабильно. Отключайте телефон, на время откажитесь от интернета, попросите близки не беспокоить вас по пустякам. Лучше всего провести день в тишине и спокойствии, либо отправиться на прогулку за город.
Отключайте телефон, на время откажитесь от интернета, попросите близки не беспокоить вас по пустякам. Лучше всего провести день в тишине и спокойствии, либо отправиться на прогулку за город. Ведь организм истощен борьбой с недугом, и нуждается в хорошей поддержке.
Ведь организм истощен борьбой с недугом, и нуждается в хорошей поддержке. Может выступать следствием перенесенной болезни или особенным состоянием пациента (например, при регулярных физических нагрузках необходимы белки и аминокислоты).
Может выступать следствием перенесенной болезни или особенным состоянием пациента (например, при регулярных физических нагрузках необходимы белки и аминокислоты). Среди них:
Среди них:
 Однако если иммунитет ослаблен, то он просто не справляется с вирусами, и человек заболевает.
Однако если иммунитет ослаблен, то он просто не справляется с вирусами, и человек заболевает.