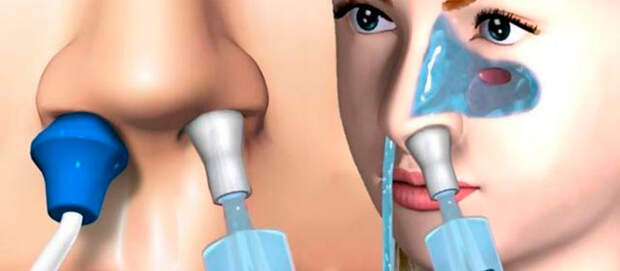
Слизь в горле, причины и лечение слизи в горле, почему постоянно скапливается мокрота
Скопление слизи в глотке — состояние неприятное, но излечимое. Главное — точно определить причину этого симптома, и устранить её. То есть состояние, при котором в глотке собирается слизь — это не самостоятельный диагноз, а одно из проявлений основного заболевания. Мокрота в горле может скапливаться не только из-за воспалительных процессов в носоглотке. Есть и другие причины, не связанные с лор-органами. Какие? Читайте в нашей новой статье.
Скопление слизи в горле — состояние весьма неприятное, особенно в тех случаях, когда она накапливается постоянно, и человека не покидает чувство, что в горле что-то мешает.
В медицине даже существует специальный термин, который употребляется при постоянно стекающей слизи в глотку из носовой полости — постназальный синдром. По сути, это тот же насморк, но наоборот.
Когда слизистые выделения из носа выходят не наружу, а внутрь, они раздражают стенки глотки и вызывают у человека непреодолимое желание часто откашливаться и сглатывать мокроту.
Так почему скапливается слизь в горле? Причины и лечение этого состояния — тема нашей новой статьи.
Зачем образуется слизь
Выработка носоглоткой слизистых масс — явление естественное. Они выполняют увлажняющую и защитную функцию. Слизистые массы задерживают попадающие с воздухом инородные частицы, пыльцу, бактерии и не дают им спуститься ниже в трахею и лёгкие. Как только эти чужеродные агенты попадают на слизистые оболочки, количество вырабатываемого секрета увеличивается, у человека возникает желание прочистить нос или откашляться. Когда раздражитель выведен из организма, выработка секрета возвращается к прежнему уровню.
Когда раздражитель выведен из организма, выработка секрета возвращается к прежнему уровню.
В норме процесс образования слизистых масс человек не замечает — они сглатываются вместе со слюной.
Скопление слизи в горле становится заметным, когда она вырабатывается постоянно и загустевает. Больной непосредственно ощущает, как слизистые массы текут по задней стенке глотки и скапливаются в ней. В дневное время скопление мокроты не так беспокоит — она проглатывается и не сильно раздражает кашлевые рецепторы. Но стоит принять горизонтальное положение, например, ночью во время сна, слизистые массы не могут свободно пройти внутрь и застаиваются в глотке. Это вызывает сильнейшие приступы кашля, которые даже могут спровоцировать рвоту.
Когда человек приходит к оториноларингологу и говорит: «Я постоянно сглатываю слизь в горле», первым делом лор-врач выяснит, почему в горле скапливается слизь.
Только после установления истинной причины слизи в горле, можно будет назначить корректное лечение.
Причины постназального синдрома
Причины постоянно скапливающейся слизи в глотке могут быть инфекционной и неинфекционной природы. К ним относят:
- Воспалительные заболевания носоглотки и гортани (синуситы, фарингит, ларингит). Усиленная выработка слизистого секрета в этот период связана с попыткой организма прочистить дыхательные пути от бактерий и вирусов, тем самым ускорив выздоровление. То, что слизь в этом случае выделяется обильно, наоборот, является вариантом нормы. Такие слизистые массы не мешают, а помогают избавиться от болезнетворных микроорганизмов.
- Хронические заболевания верхних дыхательных путей. Эти заболевания вызывают воспалительные процессы в носоглотке, в результате чего здесь формируется постоянный источник инфекции.
- Заболевания нижних дыхательных путей (бронхит, воспаление лёгких, туберкулёз).
- Аллергические реакции на внешний раздражитель. Аллергия может сопровождаться обильным скоплением мокроты, которая мешает и её хочется постоянно сглатывать.

- Нарушения в работе желудочно-кишечного тракта, при которых содержимое желудка забрасывается обратно в пищевод и далее в глотку (гастроэзофагеальная рефлюксная болезнь, гастрит, язва).
- Особенности строения носовой полости (искривлённая носовая перегородка, увеличенные носовые раковины).
- Аденоиды.
- Неправильное питание — употребление слишком жирной или острой пищи раздражает органы ЖКТ и может спровоцировать усиленную выработку секрета.
- Вредные привычки. Табакокурение и злоупотребление алкогольными напитками приводит к ожогам слизистой оболочки глотки. Организм пытается избавиться от пагубного воздействия вредных веществ, усиленно вырабатывая слизистые массы.
- Попадание в носовую полость посторонних предметов — частая причина скопления слизистых масс в глотке у детей, поскольку малыши в процессе игры могут засунуть в носовые ходы бусинки, мелкие детали игрушек и т.п.
- Плохая экологическая обстановка в месте проживания — загрязнённый воздух и пыль.
 Таким способом организм пытается избавиться от вредных частиц, попавших с воздухом.
Таким способом организм пытается избавиться от вредных частиц, попавших с воздухом.
Чем быстрее будет определена причина этого состояния, тем быстрее будет назначено и проведено эффективное лечение горла.
Симптоматика
Когда слизистые массы постоянно «стоят» в горле, больному хочется их сглатывать. Подобные действия (если секрет слишком густой) могут вызывать рвотные позывы и тошноту. Это состояние обычно протекает параллельно с другими характерными признаками, на которые жалуются больные на приёме у лор-врача:
- першение в гортани;
- ощущение кома в горле, от которого невозможно избавиться;
- постоянное желание откашляться, хотя и кашель не приносит облегчения; приступы кашля особенно сильны ночью;
- неприятные ощущения в процессе проглатывания пищи;
- неприятный запах изо рта, вызываемый размножающимися в глотке болезнетворными микроорганизмами;
- увеличение лимфатических узлов;
- громкий храп.

Чтобы понять, как лечить горло, нужно обратиться к лор-врачу для определения причины постназального синдрома.
Как лечить слизь в горле
Определением причины скопления слизистых масс занимается врач — оториноларинголог. Иногда приходится дополнительно обращаться к смежным специалистам: аллергологу, гастроэнтерологу и т.п. После установления причины неприятного состояния, пациенту будет назначена эффективная схема лечения, направленная не только на избавление от мокроты, но и на терапию основного заболевания.
Ведь стекание слизистых масс по носоглотке — это всего лишь симптом, который был спровоцирован основным диагнозом. Если качественно лечить заболевание, уйдёт и проблема скапливающейся слизи.
Пациенту лор-врач обязательно порекомендует скорректировать количество употребляемой жидкости: необходимо пить больше тёплой жидкости, чтобы разжижить слизь (разумеется, если у больного нет проблем с почками).
Дальнейшая тактика лечения зависит от характера основного заболевания. Если мокрота образуется из-за инфекционного заболевания, врач назначает антибактериальную либо противовирусную терапию (препарат, его дозировку и курс приёма также определяет оториноларинголог).
Если причина в аллергии, назначаются антигистаминные препараты. Дальнейшим лечением занимается врач — аллерголог.
При диагностировании проблем с ЖКТ необходимо пройти курс лечения у гастроэнтеролога.
Местная терапия также включает использование антисептических спреев (например, «Мирамистин»), приём иммуностимуляторов («Имудон», «Лизобакт»). Отлично дополнят основное лечение и ускорят процесс выздоровления физиотерапевтические процедуры в лор-клинике.
Если проблема скопления слизистых масс вас беспокоит, не затягивайте с лечением и приходите в «Лор Клинику Доктора Зайцева», ведь это профиль нашей клиники.
Для записи на консультацию звоните, пожалуйста, по телефонам: +7 (495) 642-45-25 и +7 (926) 384-40-04.
Будем рады вам помочь!
Всегда ваш, Доктор Зайцев.
Об авторе: ЛОР врач высшей категории, кандидат мед. наук.
Слизь в организме. Откуда берётся, чем опасна и как выводить.
Простые способы избавления от слизи в организме.
Впервые слизь в нашем организме образуется еще в раннем детстве тогда, когда мы съедаем что-то вареное.
По мере того как мы растем, слизь накапливается и заполняет все полости нашего тела.
Самым «любимым» местом скопления для слизи являются:
- легкие
- бронхи
- желудок
Когда ее собирается слишком много, она начинает подниматься выше и выходит через нос.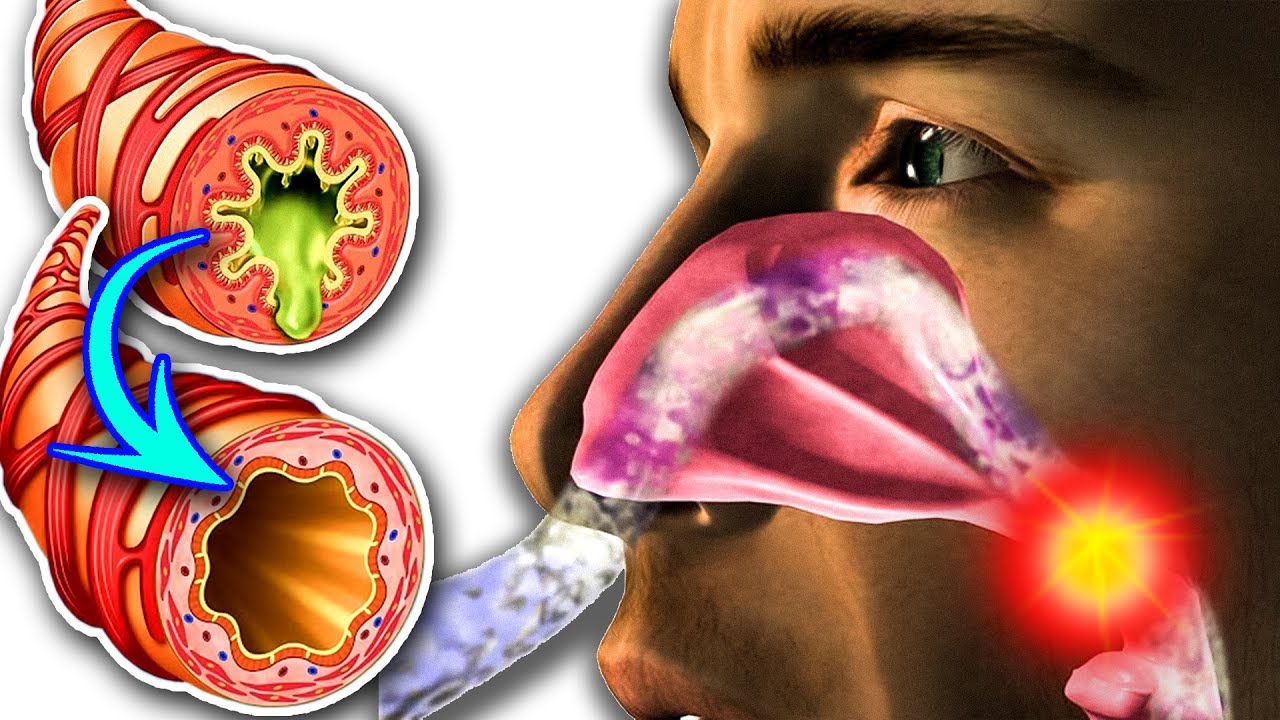
Как правило, очень часто мамы маленьких детей думают, что их чадо простудилось, но на самом деле эта простуда не что иное, как попытка нашего организма избавиться от излишков скопившегося налета.
СКОПЛЕНИЕ СЛИЗИ В ОРГАНИЗМЕ
Когда организм пытается вывести такой секрет, начинается кашель, температура, насморк, появляются мешки под глазами. При возникновении таких симптомов мы сразу начинаем реагировать на них по привычному сценарию:
насморк — капаем капли в нос, температура — сбиваем аспирином, а если нас атакует еще и кашель, то принимаем антибиотики.
То есть своими же руками мы мешаем здоровому телу освободиться от слизи. В результате мы переключаемся на процесс детоксикации от лекарств, в то время как слой секрета становится еще толще.
До определенного момента слизь остается прозрачной, но если ее образовалось слишком много, то она становится более плотной и может иметь желтый, коричневый и даже зеленоватый оттенок.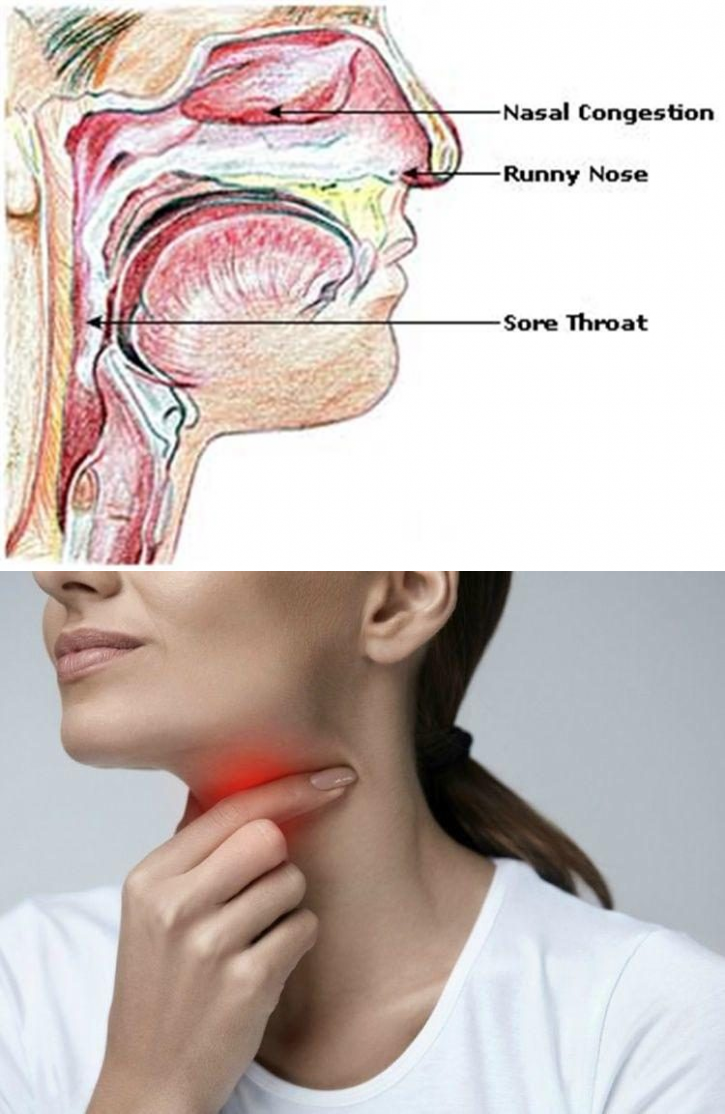
Она обволакивает стенки кишечника и становится «посредником» между употребляемой нами пищей и кровеносными сосудами.
В таком состоянии наше тело становится пристанищем для всевозможных микроорганизмов, которые питаются вареной пищей.
Если мы меняем свой рацион и начинаем отдавать предпочтение сырой пище, все эти «падальщики» тут же гибнут и начинается детоксикация организма.
Возникает головная боль, рвота, тошнота и понос, которые являются следствием очищения.
ВЫВОДИМ СЛИЗЬ
Самым эффективным методом, который помогает вывести данный секрет, является употребление свежего имбиря.
Для этого нужно очистить небольшой кусочек корня имбиря, нарезать его тонкими колечками, так чтобы получилась
примерно чайная ложка, и залить кипятком. После того как напиток настоится и немного остынет, можно добавить 1 ч. ложку меда и выдавить немного сока лимона. Пить напиток нужно теплым в течение всего дня, желательно за пол часа до еды.
Чтобы вывести скопления данного налета в желудке и кишечнике, можно выполнить очищающую процедуру.
Вам понадобится чайная ложка черного перца горошком, его нужно, не разжевывая, проглотить и запить стаканом чистой воды. Для лучшего очищения организма эту процедуру нужно выполнять вечером, до 18 часов, и только между приемами пищи. Общий курс процедур составляет семь дней, с
периодичностью выполнения через два дня на третий.
Не менее действенным средством, позволяющим очистится от ненужной слизи, является лимон и хрен.
Нужно выдавить сок из пяти лимонов и добавить к нему 150 грамм предварительно растертого хрена, после чего хорошо перемешать.
Полученную смесь необходимо принимать по чайной ложке натощак и перед сном. Основным преимуществом такой лекарственной смеси является то, что она, не повреждая оболочки, способствует полному растворению секрета и
при этом совсем не раздражает ни пищеварительный тракт, ни желчный пузырь.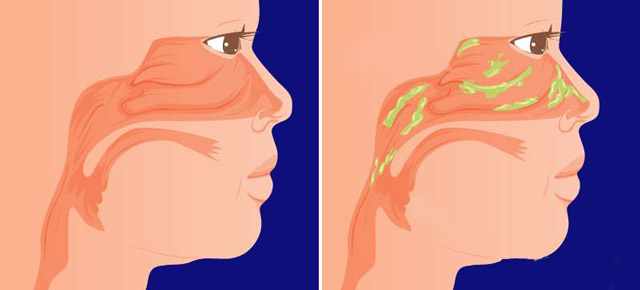
Среди лекарственных растений, которые позволяют очистить организм от слизи, стоит выделить следующие:
- цветки ромашки
- сосновые и кедровые почки
- листья эвкалипта черной смородины и мяты
- шишки хмеля
Из них делают настойки и чаи. Можно попробовать такой сбор: столовая ложка липового цвета и две чайной ложки корня солодки заварить крутым кипятком, оставить на полчаса настояться, процедить и пить в горячем виде по 150 мл перед завтраком, обедом и ужином. Курс полного лечения — 30 дней.
ИЗ-ЗА ЧЕГО В ГОРЛЕ СКАПЛИВАЕТСЯ СЛИЗЬ И КАК ОТ НЕЕ ИЗБАВИТЬСЯ
Из-за различных факторов внешней среды и заболеваний внутренних систем и органов в горле скапливается слизь. Повышенное количество этого вязкого вещества вырабатывается при бронхиальной астме. Бокаловидные клетки, производящие слизь, таким образом защищают организм человека и помогают удалять из него аллергены. Самой частой причиной скопления продуктов клеточной секреции являются болезни ЛОР-органов бактериального, грибкового, аллергического, постинфекционного происхождения. Также постоянная слизь в горле может возникать вследствие аномального развития области носоглотки (анатомических особенностей строения). Хроническое постоянное возникновение вязкого вещества может возникать в период разных заболеваний носа и его пазух, а также в случае искривления его перегородки или наличия полипов.
Самой частой причиной скопления продуктов клеточной секреции являются болезни ЛОР-органов бактериального, грибкового, аллергического, постинфекционного происхождения. Также постоянная слизь в горле может возникать вследствие аномального развития области носоглотки (анатомических особенностей строения). Хроническое постоянное возникновение вязкого вещества может возникать в период разных заболеваний носа и его пазух, а также в случае искривления его перегородки или наличия полипов.
ПРОЯВЛЕНИЕ БОЛЕЗНИ
Густая слизь в горле скапливается обычно в утреннее время. Налипание вязкого вещества вызывает покашливание, не сопровождающееся изменениями структуры легких. Иногда желудочная жидкость обратным путем попадает в глотку и своим агрессивным действием раздражает его. Из-за этого иногда в горле скапливается слизь, вызывает кашель и мышечные спазмы, в результате которых расширяется и сужается глотка, появляется ощущение наличия кома в горле. Если содержимое желудка кислое, налипание вязкого вещества будет сопровождаться изжогой.
ВЫЯВЛЕНИЕ ЗАБОЛЕВАНИЯ
Когда присутствует постоянная слизь в горле, диагноз устанавливается доктором на основании жалоб пациента, исследования гортани, глотки, желудка и пищевода специальной оптикой (эндоскопом). Дополнительно рентгенологически исследуется кислотность в пищеводе.
ЛЕЧЕНИЕ
Не так давно, когда возникала густая слизь в горле, использовалось только промывание с применением слабого гипертонического или изотонического раствора. Так как подобные мероприятия имели не долгосрочный эффект, в лечебных целях стали применять кортикостероидные гормоны в виде спрея или капель. Эта методика имеет более длительный эффект, но при прекращении введения препаратов в горле скапливается слизь снова. Главным методом избавления от нее является лечение базового заболевания. Если имеет место патология ЛОР-органов, применяются антибиотики, в тяжелом случае может применить оперативное вмешательство.
НЕМЕДИКАМЕНТОЗНЫЕ СПОСОБЫ ИЗБАВЛЕНИЯ ОТ СЛИЗИ В ГОРЛЕ
Чтобы снизить секрецию, нужно изменить свой пищевой рацион. Количество в меню продуктов с большим содержанием витамина Е и С должно быть увеличено, а жирных и острых — ограничено. Уменьшить слизистые налипания можно при помощи дыхательной гимнастики. Рекомендовано выпивать в течение одного дня не менее полутора литров воды. Избавляет от слизи и полоскание содовым раствором и ингаляции с применением масла эвкалипта. Важно ограничить контакты с дымом от табака и бытовыми химическими средствами. Если в горле скапливается слизь, не следует употреблять пищу перед сном, необходимо ограничить употребления напитков, содержащих алкоголь и кофеин.
Количество в меню продуктов с большим содержанием витамина Е и С должно быть увеличено, а жирных и острых — ограничено. Уменьшить слизистые налипания можно при помощи дыхательной гимнастики. Рекомендовано выпивать в течение одного дня не менее полутора литров воды. Избавляет от слизи и полоскание содовым раствором и ингаляции с применением масла эвкалипта. Важно ограничить контакты с дымом от табака и бытовыми химическими средствами. Если в горле скапливается слизь, не следует употреблять пищу перед сном, необходимо ограничить употребления напитков, содержащих алкоголь и кофеин.
КАК ИЗБАВИТЬСЯ ОТ СОПЛЕЙ В ГОРЛЕ
Слизь может скапливаться не только в носу, но и в горле, что вызывает более неприятные последствия. Если появились сопли в горле, лечение должно проводиться сразу после обнаружения возникшей проблемы, поскольку они оказывают на организм такое воздействие:
- вызывают ощущение комка в горле;
- провоцируют кашель;
- затрудняют процесс приема пищи;
- вызывают дискомфорт при разговоре;
- становятся причиной образования неприятного запаха изо рта.

ПРИЧИНЫ СЛИЗИ В ГОРЛЕ И МЕТОДЫ БОРЬБЫ С НИМИ
Процесс образования слизи связан с гиперактивностью слизистой оболочки, которая возникает в результате нарушения вывода жидкости из организма. Главной причиной образования слизи в горле являются заболевания носоглотки. Кроме того, по словам специалистов, повлиять на деятельность слизистой может также злоупотребление некоторыми медикаментами.
Сопли в горле образуются при развитии таких заболеваний:
- риносинусит;
- фарингит;
- аденоидит.
 Это обусловлено тем, что слизистая набухает, образуя места для скапливания соплей. Как результат такого явления – сопли начинают стекать по задней стенке горла, вызывая кашель или першение в глотке. Обнаружив, что сопли скапливаются в горле, следует незамедлительно провести лечение, ведь кроме неприятных ощущений, они приводят к накоплению в организме человека погибших микробов, что может вызвать интоксикацию.
Это обусловлено тем, что слизистая набухает, образуя места для скапливания соплей. Как результат такого явления – сопли начинают стекать по задней стенке горла, вызывая кашель или першение в глотке. Обнаружив, что сопли скапливаются в горле, следует незамедлительно провести лечение, ведь кроме неприятных ощущений, они приводят к накоплению в организме человека погибших микробов, что может вызвать интоксикацию.Кроме того, из горла сопли попадают в дыхательные пути, где еще не погибшие микроорганизмы найдут питательную среду для своего стремительного размножения, нанося этим большой вред организму. Нередко пациенты жалуются на проблемы, связанные с нарушением деятельности пищеварительной системы, что произошло после проглатывания соплей.
КАК УДАЛИТЬ СЛИЗЬ
Иногда, чтобы удалить слизь из горла достаточно провести несколько процедур полоскания, другие люди не смогут обойтись без применения медикаментов, также не стоит пренебрегать эффективными и безопасными методами народной медицины. Чаще всего врачи назначают полоскание горла и тщательное промывание гортани, направленное на очищение дыхательных путей. Обычно пациенты жалуются на скапливание слизи преимущественно по утрам, именно за ночь в горле образуется очень большое количество соплей, ухудшая состояние человека.
Чаще всего врачи назначают полоскание горла и тщательное промывание гортани, направленное на очищение дыхательных путей. Обычно пациенты жалуются на скапливание слизи преимущественно по утрам, именно за ночь в горле образуется очень большое количество соплей, ухудшая состояние человека.
- фурацилин;
- марганцовку;
- пищевую соду;
- отвар ромашки, шалфея или дуба.
Если образование слизи связано с проникновением инфекции, не обойтись без применения антибактериальных препаратов. Отоларингологи в большинстве случаев назначают такие средства как Амоксиклав и Аугментин. При желании исключить поступления в организм антибиотика можно заменить его Протарголом с серебром, который можно применять даже при лечении детей.
Отоларингологи в большинстве случаев назначают такие средства как Амоксиклав и Аугментин. При желании исключить поступления в организм антибиотика можно заменить его Протарголом с серебром, который можно применять даже при лечении детей.
Важно знать, что на количество выработки слизи влияют некоторые продукты питания, поэтому стоит пересмотреть свой рацион питания людям, столкнувшимся с данной проблемой. Чтобы сократить количество слизи, необходимо есть пищу с высоким содержанием витаминов Е и С.
Также желательно увеличить количество воды, выпиваемой в сутки, до 8 стаканов. Помогает справиться с проблемой и дыхательная гимнастика, которую можно провести самостоятельно в домашних условиях.
Среди средств народной медицины можно провести ингаляцию с эвкалиптовым маслом. Такая процедура направлена на разжижение слизи и устранение воспалительного процесса, который неизбежно возникает в результате стекания соплей по стенкам гортани.
Справиться с возникшей проблемой поможет сок алоэ.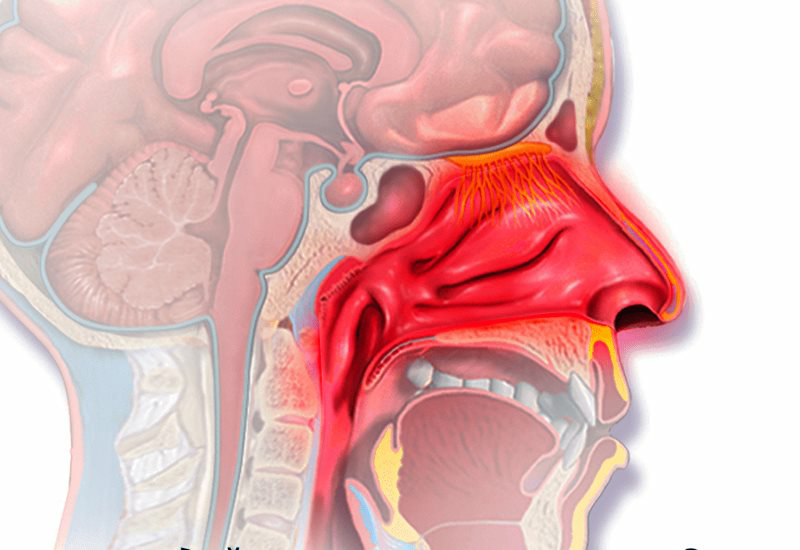 Для приготовления лекарства нужно взять лист алоэ, удалить кожицу, измельчить, перемешать с медом и съесть за два приема – утром и вечером. Облегчение наступит уже на 2 день, проводить лечение до полного устранения слизи из горла.
Для приготовления лекарства нужно взять лист алоэ, удалить кожицу, измельчить, перемешать с медом и съесть за два приема – утром и вечером. Облегчение наступит уже на 2 день, проводить лечение до полного устранения слизи из горла.
Эффективным и безопасным средством также является прополис, его нужно измельчить до порошкового состояния, залить стаканом холодной воды. Нужно дать ему постоять, чтобы воск и остальные примеси поднялись на поверхность воды, а сам прополис сел на дно. Полученный осадок нужно залить спиртом – на 30 г прополиса взять 100 г спирта. Настоять в течение недели и смазывать больное горло.
Свежие лепестки календулы хорошо промыть и перемешать с медом 1: 1. Есть по ложке после каждого приема пищи, пока не наступит выздоровление.
Своевременно проведенное лечение такого неприятного процесса как образование слизи в горле, устранит дискомфортные, и даже болезненные ощущения, предупредив, таким образом, развитие серьезных патологий.
golbis.com
Слизь в носоглотке: проблема решаема!
У абсолютно здорового пациента ежедневно в организме вырабатывается приблизительно два литра слизи. У этой жидкости очень важные задачи — она сохраняет дыхательные пути влажными и чистыми, что помогает нормально дышать. В нездоровом состоянии она скапливается в носоглотке, и, конечно, сразу же хочется избавиться от неприятного ощущения.
Неприятное явление
Как известно, нос нам необходим для того, чтобы очищать воздух, поступающий в организм извне, а также увлажнять его и подогревать. Также нос помогает человеку чувствовать вкус и запах.
Миниатюрные волосинки, которые покрывают внутренние стенки носовой полости, помогают устранять из нее все лишнее. В том числе и слизь, которая медленно уходит в самый конец носоглотки и в результате сглатывается человеком. Все это происходит незаметно и неосознанно, так как этот процесс регулируют соответствующие системы.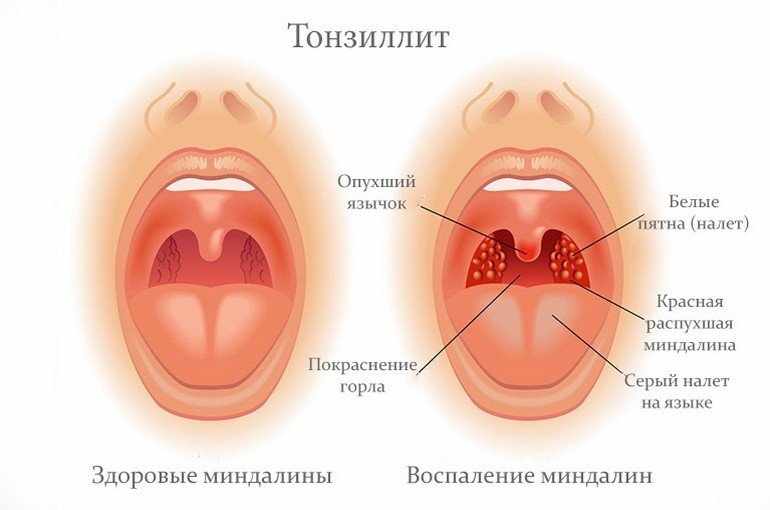
Нередко случается, что в результате некоторых заболеваний количество вырабатываемой организмом слизи может резко увеличиться, что опасно, поскольку чем больше слизи появляется, тем сложнее становится нормально дышать, говорить, есть. Излишнее количество этого вещества в носоглотке становится идеальным местом для размножения и жизнедеятельности всевозможных микроорганизмов. Ведь основа состава слизи — белки, которые представляют собой отличную пищу, например, для анаэробных бактерий.
Как правило, в нездоровом организме слизь скапливается в большом количестве на задней стенке полости носа и горла, в результате чего и создается ощущение стекания. При этом появляются следующие симптомы: неприятные ощущения в носоглотке; неприятный запах изо рта; насморк; кашель; заложенность носа; сильный зуд в носовой полости; частое чихание.
Причины болезни
Согласно данным медицинской статистики, чаще всего скопление слизи в носоглотке происходит по причине аллергии на различные внешние раздражители. В этом случае, помимо основных симптомов, добавляется также зуд в ушах, чувство усталости, бессилие, красные, постоянно слезящиеся глаза, першение в горле, головная боль.
В этом случае, помимо основных симптомов, добавляется также зуд в ушах, чувство усталости, бессилие, красные, постоянно слезящиеся глаза, першение в горле, головная боль.
Часто такое состояние у пациента наблюдается при сезонной аллергии в определенные времена года. Например, когда в воздухе появляется пыльца цветущих растений. Поэтому указанные симптомы человек будет переживать ежегодно. Иногда аллергенами становятся объекты, с которыми каждый из нас сталкивается регулярно: шерсть животных, пыль, запах строительных материалов или моющих средств и т.п.
Также причинами может стать сильное загрязнение воздуха в месте, где проживает больной. Выхлопные газы автомобилей, табачный дым, резкие запахи различных косметических средств.
Появление и скопление слизи в носоглотке может вызвать также употребление слишком холодной или слишком горячей пищи, прием определенных медицинских препаратов, недолеченный насморк, гайморит, фарингит, фронтит и другие подобные заболевания, особенно в том случае, если они перешли в хроническую форму.
Важно отметить, что если не начать лечение, то воспаление может с кровью распространиться и на другие органы, постепенно поражая весь организм.
Неприятный симптом преследует также беременных женщин и тех, у кого носоглотка имеет особенности в строении. Например, если у человека от рождения носовые пазухи (раковины) слишком большого размера или искривлена носовая перегородка.
Нормальный процесс очищения носоглотки от секреции могут нарушить различные проблемы с проглатыванием. К ним приводят стресс и переживания, когда появляется так называемый комок в горле; почтенный возраст, когда снижается сила проглатывания; инсульт и различные мышечные заболевания; сужение горла в результате опухолей и некоторых других болезней.
Иногда количество слизи увеличивается при изменении температуры тела, особенно если она резко понижается.
Если слизь слишком густая, это значит, что в ней не хватает жидкости. К таким последствиям приводит низкая влажность воздуха, инородные тела, попавшие в носовую полость, побочные эффекты некоторых медицинских препаратов.
Способы лечения
Прежде чем начать бороться с проблемой, необходимо установить точную причину ее возникновения. Сделать это под силу только грамотному специалисту. А вот пытаться самостоятельно поставить диагноз и начать лечение не рекомендуется. Это может привести к еще более негативным последствиям.
Основная терапия заключается в устранении заболевания или явления, по причине которого появилась слизь в носоглотке. Если, например, врач установил, что проблема возникла в результате патологии ЛОР-органов, то в некоторых случаях пациенту назначают хирургическую операцию, хотя чаще всего бывает достаточно лечения соответствующими препаратами.
Помогает уменьшить количество слизи и специальная диета, состоящая из большого количества свежих овощей и фруктов; продуктов, богатых витаминами Е и С. В течение дня необходимо выпивать минимум два литра воды.
Рекомендуется держать лицо над паром, чтобы произошло разжижение слизи. Для такой ванночки подойдет, например, горячая вода, оставшаяся после варки картофеля, отвар мяты или крапивы. Продолжительность составляет 20 минут, в течение которых пар аккуратно вдыхается то ртом, то носом. Затем необходимо тщательно высмаркиваться.
Продолжительность составляет 20 минут, в течение которых пар аккуратно вдыхается то ртом, то носом. Затем необходимо тщательно высмаркиваться.
Полезно полоскать рот самой обычной водой. Набрав чуть теплую жидкость в рот, следует перегонять ее в течение 20 секунд, после чего выплюнуть. Повторить 20-25 раз. Такую процедуру следует повторять утром и вечером.
В качестве профилактики специалисты советуют вести здоровый образ жизни и заниматься спортом, чаще бывать на свежем воздухе, сбалансировано питаться и, конечно же, чаще улыбаться и радоваться жизни. Помните, что все болезни от нервов и угрюмости!
Будьте здоровы!
Источник: http://medvoice.ru
Когда ощущение слизи в горле представляет опасность здоровью — Новости здоровья
Без слизи в носу нормальное дыхание невозможно. Слизь выполняет множество функций для сохранения нашего носа и подготовки воздуха к дальнейшему использованию. Впрочем, иногда неприятные ощущения в горле настораживают.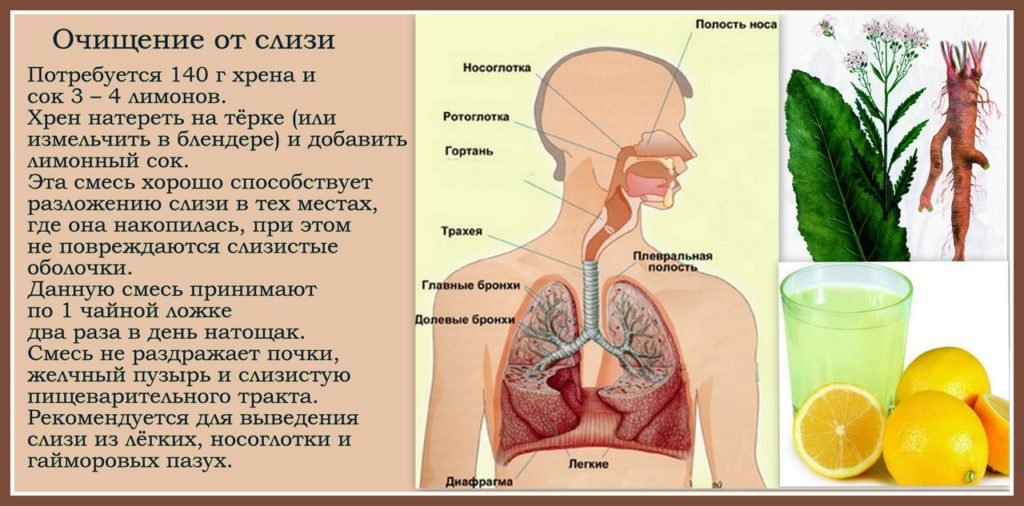
Лор Анатолий Власенко рассказал, почему люди часто жалуются на неприятное ощущение слизи в горле и когда симптом может свидетельствовать про определенные заболевания.
Читайте также: Насморк или аллергия: как отличить
Стоит понимать, что по «задней стенке» слизь течет всегда, другой вопрос, что мы этого не чувствуем.
А вот чувствовать начинаем в одном из четырех случаев:
- Слизи очень много, как например, при аллергическом рините.
- Слизистая задней стенки глотки пересушена, если вместо носа дышим ртом.
- Слизистая глотки повреждена химическими веществами табачным дымом, смогом.
- Слизистая глотки повреждена забросом желудочного сока, при проблемах с желудком / пищеводом.
Следовательно, искать нужно сопутствующие симптомы, а тогда выяснять причину.
Аллергический ринит. Он сопровождается массой других симптомов, по которым может быть диагностирован. В частности, отек слизистой оболочки носа, аллергические спазмы, частое чихание и другие неприятные ощущения. Поэтому врач сразу поймет, что причина избыточной выработки слизи в наличии заболевания и определит нужное лечение.
Поэтому врач сразу поймет, что причина избыточной выработки слизи в наличии заболевания и определит нужное лечение.
Аллергический ринит следует лечить / Фото: Unsplash
Три другие причины, которые объединяют повреждения слизистой, при котором появляется дискомфорт даже при нормальном количестве слизи:
При нарушенном носовом дыхании проблема иногда явная, а иногда – нет. Если днем дыхание абсолютно нормальное, то человек спешит исключать из вероятных причин проблемы с дыханием. Впрочем часто впоследствии оказывается, что пациент страдает от храпа, или случается такое, что человек просыпается ночью, во рту пересохло, горло «печет» и о, чудо, нос заложен. Это может свидетельствовать о проблемах с дыханием.
При рефлюксе, забросе желудочного содержимого, характерными моментами могут быть: «першение в горле» в течение дня, кашель, особенно после еды или в горизонтальном положении, боль в горле, на утро после позднего приема пищи.
Влияние таких факторов, как табачный дым, старый неочищенный кондиционер, выхлопы соседнего завода, только усиливают неприятные ощущения.
Больше новостей, касающихся лечения, медицины, питания, здорового образа жизни и многое другое – читайте в разделе Здоровье.
Трудности дыхания и скопление слизи в носоглотке: как избавиться от истинной причины?
Трудности носового дыхания испытывает практически каждый человек. Это наиболее часто диагностируемая жалоба среди пациентов, ведь симптом связан с искривлением носовой перегородки. Такой диагноз в разной степени встречается у 80% населения земного шара. Однако выраженный дискомфорт беспокоит далеко не каждого пациента, поэтому и методы лечения интересуют не всех.
Кроме затрудненного дыхания, пациенты могут встречаться и с другими симптомами, интенсивность которых напрямую зависит от степени кривизны носовой перегородки.
Почему носовая перегородка искривляется?
Хрящевая ткань, которой представлена перегородка, имеет не такую плотную структуру как кость, поэтому она склонна к деформации в результате травм, падения, а также на фоне длительных воспалительных процессов. Перегородка состоит из четырехугольного хряща и трех костей – это перпендикулярная пластинка, сошниковая и премаксиллярная кость от верхней челюсти. Искривляется из-за того, что идет расхождение в росте хрящевой части и костной – что-то растет быстрее и, так как некуда расти, уходит в бок, или была травма, а уже из-за этого перегородка искривляется. Поэтому есть искривленные перегородки и без травмы.
Перегородка состоит из четырехугольного хряща и трех костей – это перпендикулярная пластинка, сошниковая и премаксиллярная кость от верхней челюсти. Искривляется из-за того, что идет расхождение в росте хрящевой части и костной – что-то растет быстрее и, так как некуда расти, уходит в бок, или была травма, а уже из-за этого перегородка искривляется. Поэтому есть искривленные перегородки и без травмы.
До 21 года у человека хрящевая ткань еще продолжает расти, поэтому оперативное вмешательство считается неприемлемым. Во многих случаях в процессе роста возможно естественное самоисправление. Перегородку сейчас оперируют в любом возрасте, несмотря на то, что она растет. Но если перегородка выражено искривлена, оперируют в любом возрасте, в том числе и детском.
Несмотря на обнадеживающие прогнозы, возможно повреждение не только самой перегородки, но и внутренних структур. В результате подобной деформации внутренней полости развиваются серьезные хронические процессы, характеризующиеся скоплением слизи внутри. Таким образом формируются показания для оперативного вмешательства.
Таким образом формируются показания для оперативного вмешательства.
Как исправить деформацию носовой перегородки?
В тех случаях, когда искривление носовой перегородки требует оперативного вмешательства, проводят эндоскопическую септопластику. Эта операция выполняется по показаниям и не относится к числу эстетических. Но зачастую ринопластика выполняется вместе с септопластикой, так как искривленная носовая перегородка может иметь ярко выраженные признаки, в результате чего изменяется и форма носа.
Показаниями к проведению эндоскопической септопластики являются следующие.
- Нарушение носового дыхания. Это главный симптом, требующий проведения септопластики.
- Постоянный отек слизистых тканей в носоглотке.
- Частые синуситы.
- Храп, дыхание с хрипами.
- Постоянное ощущение комка слизи в носоглотке из-за неправильного ее оттока.
При хроническом воспалительном процессе могут формироваться доброкачественные новообразования – полипы.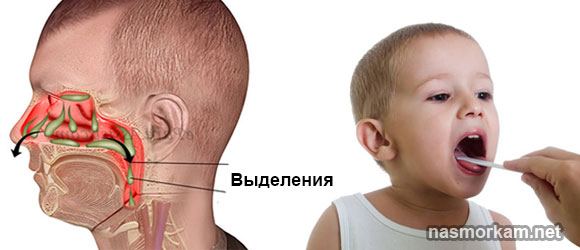 Именно поэтому рекомендуется не затягивать с лечением, и если у вас имеются проблемы с носовым дыханием, частыми простудами, вы постоянно ощущаете ком слизи в горле, то стоит обратиться к специалистам, которые смогут диагностировать степень искривления носовой перегородки и выполнить при необходимости оперативное вмешательство.
Именно поэтому рекомендуется не затягивать с лечением, и если у вас имеются проблемы с носовым дыханием, частыми простудами, вы постоянно ощущаете ком слизи в горле, то стоит обратиться к специалистам, которые смогут диагностировать степень искривления носовой перегородки и выполнить при необходимости оперативное вмешательство.
Как проводится эндоскопическая септопластика?
Суть операции заключается в иссечении тех участков костей и хрящиков, которые были деформированы. Слизистую оболочку не подвергают иссечению, так как она предварительно отслаивается, что позволяет сохранить ее целостность и значительно сократить период реабилитации.
Современная медицина позволяет выполнять оперативное вмешательство предельно щадящим способом, поэтому в большинстве случаев иссекается только та часть перегородки, которая деформирована и доставляет дискомфортные ощущения.
Операция производится с применением эндоскопа. В ходе вмешательства выполняется тщательный осмотр деформированной области.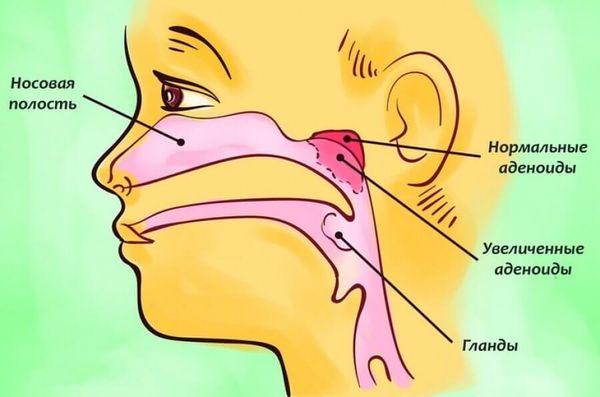 Необходимые участки удаляются с применением малотравматичных микроинструментов. Контроль операции осуществляется с помощью эндоскопа.
Необходимые участки удаляются с применением малотравматичных микроинструментов. Контроль операции осуществляется с помощью эндоскопа.
Почему выбирают Медицинский центр Елены Малышевой?
При выборе врача и клиники для проведения септопластики необходимо установить доверительный контакт между специалистом и пациентом. В клинике Елены Малышевой работают врачи мирового уровня. Дмитрий Семенович Горин – сертифицированный ЛОР-врач, проходивший практику в знаменитых учреждениях США (Институт уха, горла, носа в Нью-Йорке) и Германии (Университет ЛОР-болезней).
Дмитрий Семенович работает как со взрослыми пациентами, так и с детьми. Имея за плечами большой практический опыт, доктор Горин проводит ЛОР-операции на самом высоком уровне. Благодаря слаженной работе всего медицинского центра предварительная диагностика и основное лечение производятся с высокой степенью эффективности. Применяемое современное оборудование позволяет выполнить эндоскопическую септопластику щадящим образом, снизив длительность и интенсивность реабилитации.
Отечность после операции сохраняется в течение недели, а приступить к работе можно будет уже через 10-14 дней.
Эндоскопическая септопластика – это щадящий хирургический метод, который решит вашу проблему с дыханием. Клиника Елены Малышевой освободит вас от проблем и позволит свободно сделать глубокий вдох носом!
Более подробная информация и запись по телефону: 8 (495) 268-12-12.
В горле скапливается слизь, как сопли
Организм взрослого и совершенно здорового человека вырабатывает около 2-х литров мокроты в сутки. Она необходима для защиты и естественного очищения дыхательных путей от вирусов, бактерий и пылевых частиц. В норме этот секрет незаметно удаляется, поэтому если в горле скапливается слизь как сопли и ее невозможно откашлять, вероятно, развивается какой-то патологический процесс. Слишком густая мокрота обычно свидетельствует о воспалении.
По каким причинам в горле скапливается слизь?
Рассматриваемое явление – типичный «спутник» курильщиков.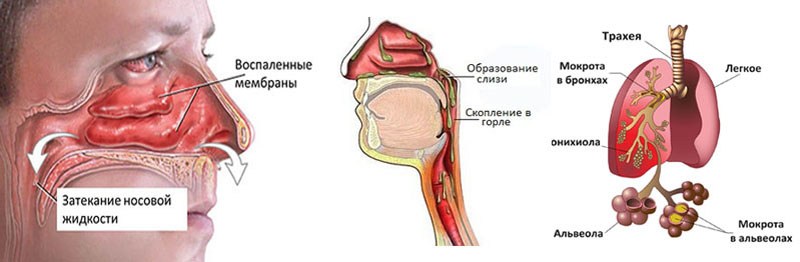 Табачный дым сильно раздражает внутренние оболочки носа и глотки, и они реагируют усиленной выработкой вязкой мокроты, чтобы защититься от повреждений.
Табачный дым сильно раздражает внутренние оболочки носа и глотки, и они реагируют усиленной выработкой вязкой мокроты, чтобы защититься от повреждений.
Другие возможные варианты, почему в горле постоянно скапливается слизь:
- Аллергия. Гиперчувствительность иммунитета к различным веществам нередко проявляется как ощущение комка в глотке и ее отечность.
- Синуситы. Вследствие воспалительных процессов в носовых пазухах образуется большое количество насморка, который может стекать вниз.
- Болезни легких и бронхов. Особенно часто описываемый симптом возникает при хронических формах бронхита. Слизь скапливается в горле ночью, провоцируя приступы мучительного кашля.
- Патологии пищеварения. Заболевания желудка и пищевода сопровождаются различными неспецифическими признаками, включая ощущение инородного тела в глотке.
- Ангина. При тонзиллитах пораженные миндалины покрываются гноем или вязкой мокротой.
- Некоторые медикаменты.
 Диуретики, антибиотики, гормональные и другие препараты часто вызывают побочные эффекты, среди которых – увеличение густоты секрета, выделяемого бронхами.
Диуретики, антибиотики, гормональные и другие препараты часто вызывают побочные эффекты, среди которых – увеличение густоты секрета, выделяемого бронхами.
Самостоятельно выявить причину данной патологии удается редко, так как диагностировать хронические вялотекущие болезни дыхательной системы может только квалифицированный и опытный врач после результатов обследования и получения результатов анализов.
Какое нужно лечение, если в горле постоянно скапливается слизь?
Правильная терапия предполагает точный диагноз и выявление всех факторов, провоцирующих избыточное выделение вязкой мокроты. Поэтому важно посетить отоларинголога и узнать, почему в горле скапливается слизь как сопли – лечение будет зависеть от причин проблемы.
Общие принципы:
- Питьевой режим. Чтобы сделать бронхиальный секрет менее густым, необходимо потреблять обильное количество теплой жидкости. Желательно пить компоты, морсы и травяные чаи, на время исключить из рациона молоко, которое способствует продуцирование слизи в организме.

- Промывание и полоскание. Удалять мокроту нужно и из носа, и из глотки. Поэтому сначала проводится тщательное промывание синусов посредством шприца, специального чайника или спринцовки, а затем полоскание горла. Подойдут любые антисептические растворы – с морской солью, содой, Фурацилином, отваром ромашки, шалфея или коры дуба. Также используются готовые жидкости, например, Мирамистин, Хлоргексидин, Йодинол.
- Ингаляции. Смягчить слизистые оболочки и убрать раздражение поможет вдыхание паров с эфирным маслом эвкалипта или отваром его листьев. Предварительно надо убедиться в отсутствии аллергии на данное растение.
Более серьезные мероприятия, прием антибиотиков, противовоспалительных, антигистаминных или противовирусных лекарств, физиотерапия назначается только специалистом в соответствии с установленным диагнозом. Самостоятельный прием любых препаратов может ухудшить состояние и спровоцировать увеличение выработки слизи с носовых пазухах и бронхах.
Слизь в горле
При различных заболеваниях и даже при отличном здоровье человека может беспокоить слизь в горле. Даже если носоглотка не воспалена, человек ощущает скопление в горле слизи, которую надо выплюнуть. Но для начала нужно знать, что провоцирует образование слизи, какие симптомы говорят о том, что надо лечиться.
Из-за чего в горле появляется слизь
Изнутри глотка выстлана эпителиальными клетками, которые способны вырабатывать бесцветную жидкость — мокроту. Она выполняет полезные функции. Постоянно вырабатываясь в носу, глотке, трахее и бронхах, мокрота обволакивает слизистую, предотвращает ее пересыхание, содержит клетки иммунной системы, является средой обитания микрофлоры дыхательных путей. Когда органам дыхания нужна защита от инфекций, инородных тел и аллергенов, мокроты становится больше. Причем чем больше раздражитель, тем больше образуется слизи в горле.
Неинфекционные причины
* Пища. Поскольку она раздражает слизистую, организм выделяет мокроту, защищаясь таким образом. Не мешайте ему. Употребление острых, соленых, пряных блюд, раздражающих слизистую ротовой полости и глотки, может вызвать увеличение ее секреции. Мокрота может усиленно выделяться и стоять в горле как раз после еды, например, молоко провоцирует скопление густой слизи. Лечение в такой ситуации не требуется. Избавиться от этого поможет правильное питание.
Поскольку она раздражает слизистую, организм выделяет мокроту, защищаясь таким образом. Не мешайте ему. Употребление острых, соленых, пряных блюд, раздражающих слизистую ротовой полости и глотки, может вызвать увеличение ее секреции. Мокрота может усиленно выделяться и стоять в горле как раз после еды, например, молоко провоцирует скопление густой слизи. Лечение в такой ситуации не требуется. Избавиться от этого поможет правильное питание.
* Курение. Сигаретный дым при курении вызывает скопление слизи в горле, и любителям сигарет приходится периодически ее сплевывать. Так организм пытается обезвредить и вывести токсические для него вещества. Но рано или поздно он перестает справляться с этим. Постепенно у курящего слизистая атрофируется, бронхи не могут самоочищаться, мокрота перестает выделяться, начинает беспокоить мучительный спастический кашель. Дальше — хуже. Поскольку слизистая не справляется с защитой от токсических веществ, воспаляются нижние дыхательные пути. Так же действуют на органы дыхания вредная производственная пыль, грязный воздух. Чтобы справиться с таким состоянием, в первую очередь надо бросить курить, надевать на нос и рот защитные маски, поменять место работы.
Чтобы справиться с таким состоянием, в первую очередь надо бросить курить, надевать на нос и рот защитные маски, поменять место работы.
* Аллергены. При их воздействии на организм слизистая раздражается, в носу появляются сопли, в глотке — слизь, из глаз текут слезы. Организм любым путем пытается закрыться от чужеродного вещества: сопли могут стекать в горло, могут появиться чиханье, кашель, отекать нос и глотка. В этом случае помогают антигистаминные препараты. Если аллергия сопровождается затруднением дыхания или сильным отеком, надо срочно лечиться гормональными, противовоспалительными и спазмолитическими препаратами.
* Постоянное ощущение густой слизи в горле. Оно может появиться, если человек часто дышит через рот, мало пьет жидкости (ее не хватает организму для выработки достаточного количества мокроты). В результате слизистая горла пересыхает. Такое состояние бывает при искривлении носовой перегородки. В остальных случаях симптомы снимают при помощи промывания носа, полоскания горла, ингаляций с физраствором. Доктор рекомендует пить больше жидкости, увлажнять воздух в доме, особенно, когда работают батареи.
Доктор рекомендует пить больше жидкости, увлажнять воздух в доме, особенно, когда работают батареи.
* Болезни пищевода и желудка. В глотке происходит перекрест дыхательной системы с пищеварительной. Поэтому некоторые патологические состояния пищевода и желудка могут спровоцировать повышенное образование слизи. При забрасывании желудочного содержимого в глотку ее стенки раздражаются агрессивными ферментами и соляной кислотой. Возникает небольшое воспаление, в ответ на которое в горле появляется слизь. После приема пищи и пробуждения от сна человека могут беспокоить изжога и отрыжка. Лечить, в первую очередь, нужно органы пищеварения. Также между едой необходимо делать меньше перерывов, уменьшив порции. Есть надо только пресную, теплую пищу. Можно полоскать горло отваром ромашки, или слабым раствором морской соли, или раствором соды, соли и пары капель йода — это облегчит неприятные ощущения в горле и предотвратит скопление слизи.
* Некоторые новообразования в носу и глотке. Они могут вызывать ощущение, будто в горле все время сопли. Полипы носоглотки — разрастания слизистой оболочки — часто становятся причиной затрудненного носового дыхания, ринита и того, что по задней стенке глотки стекают сопли. Лечение требует оперативного удаления полипов, назначения стероидов. После операции спустя время полипы могут образоваться снова, и тогда придется делать повторную операцию.
Они могут вызывать ощущение, будто в горле все время сопли. Полипы носоглотки — разрастания слизистой оболочки — часто становятся причиной затрудненного носового дыхания, ринита и того, что по задней стенке глотки стекают сопли. Лечение требует оперативного удаления полипов, назначения стероидов. После операции спустя время полипы могут образоваться снова, и тогда придется делать повторную операцию.
Инфекция в носу и глотке
Различные вирусы, бактерии, грибки могут вызывать воспалительный процесс в носу и его пазухах, глотке и зеве, что сопровождается повышенным образованием мокроты. Во время болезни в слизи содержится большое количество иммунных клеток, способных убивать и поглощать микробы, поэтому ее так много вырабатывается. Чаще всего ощущение соплей в горле вызывают вирусный и бактериальный риниты, синусит, гайморит, фарингит, тонзиллит, если он сопровождается воспалением зева и глотки. Особенно вреден задний ринит — им часто болеют и взрослые, и дети. Очаг воспаления находится в дальней части полости носа и в верхней части глотки. Именно из-за заднего ринита после сна сопли затекают в горло, раздражая слизистую и вызывая сильный кашель. Сопли, попавшие в горло, обычно человек или проглатывает, или сплевывает. При осмотре можно увидеть признаки воспаления, а также то, как по задней стенке горла стекают сопли. Они могут быть прозрачными при вирусном рините, желтоватыми или зеленоватыми при бактериальной инфекции. Стекая по задней стенке глотки, сопли раздражают ее, вызывая, кроме кашля, еще и першение и постоянное желание отхаркиваться. Лечиться нужно, промывая нос и используя сосудосуживающие средства. Помогают полоскания антисептическими растворами и травяными настоями.
Очаг воспаления находится в дальней части полости носа и в верхней части глотки. Именно из-за заднего ринита после сна сопли затекают в горло, раздражая слизистую и вызывая сильный кашель. Сопли, попавшие в горло, обычно человек или проглатывает, или сплевывает. При осмотре можно увидеть признаки воспаления, а также то, как по задней стенке горла стекают сопли. Они могут быть прозрачными при вирусном рините, желтоватыми или зеленоватыми при бактериальной инфекции. Стекая по задней стенке глотки, сопли раздражают ее, вызывая, кроме кашля, еще и першение и постоянное желание отхаркиваться. Лечиться нужно, промывая нос и используя сосудосуживающие средства. Помогают полоскания антисептическими растворами и травяными настоями.
При болезнях бронхо-легочной системы излишки мокроты продвигаются вверх по дыхательным путям, скапливаются в гортани, на задней стенке глотки, заставляя человека откашливаться. Такое происходит при пневмонии, обструктивном бронхите, бронхиальной астме. Лечение сложное, часто проводится в стационаре. Перед тем как начать лечить больного, врач направляет его на рентгенологическое обследование, бронхоскопию. Также требуется исследование мокроты.
Перед тем как начать лечить больного, врач направляет его на рентгенологическое обследование, бронхоскопию. Также требуется исследование мокроты.
Физиология выделения слизи и мокроты в дыхательной системе
Основная функция дыхательной системы заключается в том, чтобы втягивать воздух в легкие, чтобы обеспечить обмен газов с кровью, циркулирующей в легких.
Абстракция
ТОМ: 99, ВЫПУСК: 23, НОМЕР СТРАНИЦЫ: 63
Мэрион Ричардсон, BD, CertEd, DipN, RGN, RNT, старший преподаватель и руководитель программы в отделении неотложной медицинской помощи, Университет Хартфордшира
Эта кровь снабжает клетки тела кислородом и удаляет продукты обмена веществ.Ткани дыхательных путей тонкие и нежные, наиболее тонкими становятся на поверхности авеолов, где происходит газообмен. В организме есть ряд механизмов, которые защищают эти ткани и гарантируют, что мусор и бактерии не достигнут их.
Крошечные волоски, называемые ресничками, улавливают крупные частицы мусора и вылетают из дыхательных путей; Рефлексы чихания и кашля помогают изгнать частицы из дыхательной системы, а образование слизи сохраняет ткани влажными и помогает задерживать мелкие частицы посторонних предметов.
Производство слизи в дыхательных путях в норме. Без него дыхательные пути становятся сухими и нарушают работу. Но иногда слизь выделяется в избытке и меняет характер. Это приводит к позыву кашлять и откашливанию этой слизи в виде мокроты. Отхождение мокроты — это ненормально, и всегда есть основная патологическая причина.
Слизь
Слизь выделяется из двух отдельных участков легочной ткани. В поверхностном эпителии, который является частью тканевой выстилки дыхательных путей, есть продуцирующие слизь клетки, называемые бокаловидными клетками.Слой соединительной ткани под эпителием слизистой оболочки содержит серомукозные железы, которые также производят слизь.
Дыхательные пути вырабатывают из этих желез около двух литров слизи в день (Martini, 2003), которая состоит из воды, углеводов, белков и липидов. Высокое содержание воды помогает увлажнять проходящий вдыхаемый воздух. Слизь содержит гликопротеины (или муцины), а также белки, полученные из плазмы, и продукты гибели клеток, такие как ДНК.
Слизь липкая и помогает удерживать частицы пыли, бактерии и другой вдыхаемый мусор.Слизь также содержит природные антибиотики, которые помогают уничтожать бактерии — эпителиальные клетки выделяют вещество, называемое дефенсисом. Слизь также содержит лизоцим — антибактериальный фермент.
Движение слизи
Реснички в носу перемещают образовавшуюся слизь в глотку, где она проглатывается и переваривается в желудке. В холодную погоду этот процесс замедляется, слизь иногда собирается в носу и капает или вытекает наружу — зимний насморк.
Частицы диаметром более 4 мм обычно попадают в слизь в носу и редко попадают дальше по дыхательным путям.Слизистая оболочка носа имеет множество сенсорных нервных окончаний, и крупные частицы раздражают эти нервы, вызывая чихание — сильный поток воздуха, который изгоняет частицы вместе со слизью.
Далее по дыхательным путям реснички трахеи и бронхов также разносят слизь по направлению к глотке, чтобы ее проглотить. Это движение против силы тяжести иногда называют эскалатором слизи. Обычно это движение вверх незаметно, кроме случаев, когда мы откашливаемся. Однако, если накапливается большее количество слизи, рецепторы кашля могут быть стимулированы, и воздух и слизь будут принудительно вытеснены из трахеи.
Это движение против силы тяжести иногда называют эскалатором слизи. Обычно это движение вверх незаметно, кроме случаев, когда мы откашливаемся. Однако, если накапливается большее количество слизи, рецепторы кашля могут быть стимулированы, и воздух и слизь будут принудительно вытеснены из трахеи.
При движении по дыхательным путям эпителий слизистой оболочки истончается и меняет свой характер. В бронхиолах всего несколько ресничек и нет клеток, продуцирующих слизь, поэтому любой мусор, переносимый по воздуху, удаляется макрофагами в альвеолах или откашливается.
Производство мокроты
Раздражение дыхательной системы вызывает воспаление дыхательных путей и заметное увеличение секреции слизи. Человек может осознавать, что проглатывает слизь, или воспаление может вызвать кашлевой рефлекс, так что он откашливает эти выделения в виде мокроты.
Похоже, что воспаление слизистой оболочки отвечает за образование мокроты, а не какие-либо другие изменения, происходящие в пораженной легочной ткани (Jeffrey Maestrelli et al, 2001).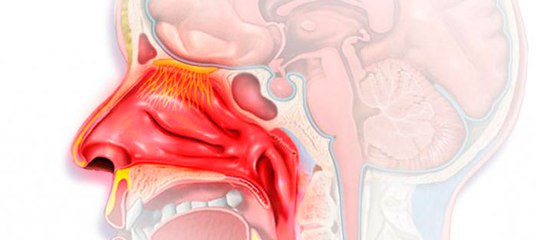
Отхаркиваемая мокрота содержит секреты нижних дыхательных путей, а также выделения из носа, рта и глотки, а также клеточный мусор и микроорганизмы (Rubin, 2002). При некоторых болезненных процессах мокрота меняет свой характер и цвет.
Заболевание дыхательных путей и мокрота
Производство мокроты связано со многими заболеваниями легких, и мокрота может инфицироваться, окрашиваться кровью или содержать аномальные клетки.
Курение — Курение оказывает большое влияние на дыхательные пути. Вдыхаемый дым разрушает реснички, которые играют важную роль в перемещении слизи в горло для проглатывания. В результате слизь накапливается в бронхиолах и раздражает там чувствительные ткани, вызывая кашель. Кашель жизненно важен, поскольку это единственный способ курильщика удалить слизь из легких и сохранить чистоту дыхательных путей (Рубин, 2002). Для этого характерен «кашель курильщика».
Постоянный кашель для удаления мокроты влияет на гладкую мускулатуру бронхиол, которая становится гипертрофированной (увеличенной или разрастающейся). Это, в свою очередь, приводит к развитию большего количества слизистых желез.
Это, в свою очередь, приводит к развитию большего количества слизистых желез.
Курение также вызывает гиперплазию (чрезмерное деление и рост клеток) бокаловидных клеток, продуцирующих слизь (Maestrelli et al, 2001). Из-за постоянного раздражения в альвеолах образуется больше слизи, которая может перегружаться и разрушаться.
Еще одним следствием курения является развитие эмфиземы, когда альвеолы расширяются, капиллярное кровоснабжение ухудшается и снижается газообмен. Курение усугубляет другие заболевания легких и является основной причиной рака легких и многих других.
Отказ от курения улучшает здоровье легких — бронхи расслабляются, и работа дыхания становится легче, а реснички начинают отрастать в течение нескольких месяцев, поэтому слизь и мусор могут выводиться без постоянного кашля. Кроме того, со временем снижается риск рака.
Бронхит — Бронхит — это воспаление слизистой оболочки бронхов. Обычно это связано с курением сигарет, но также может быть вызвано раздражителями окружающей среды, такими как пары химических веществ, выхлопные газы или пестициды. В ответ на воспаление образуется избыток слизи. Это может заблокировать небольшие дыхательные пути и снизить эффективность дыхания, например, при хронической обструкции дыхательных путей. Чрезмерное выделение слизи приводит к частому кашлю, который еще больше раздражает ткани и вызывает еще большее выделение слизи.
В ответ на воспаление образуется избыток слизи. Это может заблокировать небольшие дыхательные пути и снизить эффективность дыхания, например, при хронической обструкции дыхательных путей. Чрезмерное выделение слизи приводит к частому кашлю, который еще больше раздражает ткани и вызывает еще большее выделение слизи.
Хроническая обструктивная болезнь легких. Характер стойких респираторных симптомов (хронический бронхит, хроническая обструкция дыхательных путей и эмфизема) называется хронической обструктивной болезнью легких (ХОБЛ).У большинства пациентов с ХОБЛ гиперсекреция слизи в дыхательных путях проявляется следующим образом:
— Производство мокроты;
— Увеличение слизи в просвете дыхательных путей;
— Гипертрофия слизистых подслизистых желез;
— Гиперплазия бокаловидных клеток.
Гиперсекреция слизи приводит к нарушению газообмена и уменьшению мукоцилиарного клиренса, что способствует бактериальной колонизации и обострению заболевания (Rogers, 2001). Гиперсекреция слизи может способствовать развитию заболеваний у этих пациентов.
Гиперсекреция слизи может способствовать развитию заболеваний у этих пациентов.
Астма (острая обструктивная болезнь дыхательных путей) — Дыхательные пути некоторых людей чувствительны к аллергенам, таким как лекарства, загрязнение окружающей среды или бактерии, и это заставляет тучные клетки в их тканях взрываться и выделять гистамин и простагландин.
В ответ слизистая оболочка дыхательных путей становится опухшей и отечной, и увеличивается выработка слизи в попытке избавить организм от аллергена. Сжимаются гладкие мышцы, особенно вокруг конечных бронхиол, и затрудняется дыхание.Транспортировка слизи замедляется, а в дыхательных путях скапливается жидкость.
Эта гиперсекреция слизи является важной причиной болезней и смерти пациентов с астмой. Специальных методов лечения не существует (Fahy, 2002). Количество бокаловидных клеток увеличивается, и пациент накапливает и выделяет больше муцина, что делает мокроту густой и липкой. Астма может быть смертельной, и смерть обычно наступает из-за закупорки узких дыхательных путей пробкой мокроты.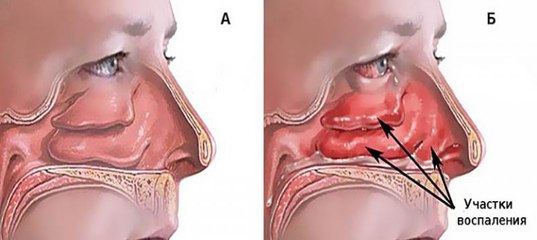
Муковисцидоз — Муковисцидоз является смертельным заболеванием, передаваемым по наследству и поражающим кавказцев североевропейского происхождения.Дефектный ген, расположенный на хромосоме 7, означает, что белок, называемый трансмембранным регулятором кистозного фиброза, отвечающий за активный транспорт ионов хлора внутри клеток, не функционирует нормально.
Этого белка много в клетках, производящих водянистые выделения, такие как слизь. Аномалия означает, что секреторные клетки не могут эффективно переносить соли и воду, и секреты становятся густыми. Это влияет на слизистые железы дыхательных путей и секреторные железы желудочно-кишечного тракта.
В дыхательных путях гипервязкая, липкая слизь прилипает к дыхательным путям и не может транспортироваться должным образом — эскалатор слизи перестает работать, и слизистые пробки блокируют более мелкие дыхательные пути. Дыхание становится затрудненным, и проблемы с транспортировкой слизи могут привести к бактериальной колонизации.
Средняя продолжительность жизни людей с муковисцидозом в Великобритании составляет 31 год (National Services Division, 2002). Люди с муковисцидозом умирают от хронических рецидивирующих бактериальных инфекций легких и связанной с ними сердечной недостаточности.
Оценка мокроты
Мокрота может дать несколько подсказок о здоровье пациента. Трудно оценить количество мокроты, выделяемой за день (Law, 2000), но есть много терминов для ее описания — слизистая, гнойная, слизисто-гнойная, пенистая, вязкая или с кровью.
Цвет слизи также значительно варьируется от белого или непрозрачного до серого, оранжевого, зеленого, коричневого или, иногда, черного. Желтая, оранжевая или зеленая мокрота обычно связана с бактериальной инфекцией.Чем больше нейтрофилов присутствует в мокроте, тем она зеленее, и пациентам может потребоваться лечение антибиотиками.
Однако у людей, страдающих астмой, в мокроте часто есть нейтрофилы — мокрота может быть окрашена, но не инфицирована. Красная мокрота указывает на наличие крови и может указывать на туберкулез или рак.
Красная мокрота указывает на наличие крови и может указывать на туберкулез или рак.
Заключение
Мокрота выделяется при повреждении или заболевании легких и может дать медсестрам важную информацию о пациенте и его заболевании.
Слизь в дыхательных путях ограничивает Neisseria meningitidis от эпителиальных клеток носоглотки и защищает слизистую оболочку от воспаления
РЕФЕРАТ
Neisseria meningitidis — обитатель носоглотки, от которого она передается от человека к человеку или становится вредным возбудителем в крови. В этой работе мы рассмотрели колонизацию носоглоточной ниши, сосредоточив внимание на взаимодействии между менингококками и слизью дыхательных путей, выстилающей слизистую оболочку хозяина.Используя клетки Calu-3, выращенные в культуре с воздушным интерфейсом (клетки, выращенные с апикальным доменом, обращенным к воздуху), мы изучили менингококковую колонизацию слизи и реакцию хозяина. Наши результаты показали, что N. meningitidis ведет себя как комменсальные бактерии в слизи, не взаимодействуя с человеческими клетками и не мигрируя активно через клеточный слой. В результате пили типа IV не играют роли в этой модели, и менингококки не вызывают сильного врожденного иммунного ответа со стороны клеток Calu-3. Наконец, мы показали, что эта модель подходит для изучения взаимодействия N.meningitidis с другими бактериями, живущими в носоглотке, и Streptococcus mitis, но не Moraxella catarrhalis, могут способствовать росту менингококков в этой модели.
meningitidis ведет себя как комменсальные бактерии в слизи, не взаимодействуя с человеческими клетками и не мигрируя активно через клеточный слой. В результате пили типа IV не играют роли в этой модели, и менингококки не вызывают сильного врожденного иммунного ответа со стороны клеток Calu-3. Наконец, мы показали, что эта модель подходит для изучения взаимодействия N.meningitidis с другими бактериями, живущими в носоглотке, и Streptococcus mitis, но не Moraxella catarrhalis, могут способствовать росту менингококков в этой модели.
ВАЖНО N. meningitidis передается от человека к человеку в виде капель аэрозоля, образующихся при дыхании, разговоре, кашле или при прямом контакте с зараженной жидкостью. Естественным резервуаром N. meningitidis является слизистая оболочка носоглотки человека, расположенная в задней части носа и над ротоглоткой.Способы, с помощью которых менингококки проникают через стенку носоглотки, все еще обсуждаются из-за отсутствия удобной и актуальной модели, имитирующей носоглоточную нишу. Здесь мы использовали клетки Calu-3, выращенные в культуре с воздушным интерфейсом, чтобы изучить, как менингококки колонизируют носоглоточную нишу. Мы сообщаем, что слизь в дыхательных путях является одновременно нишей для роста менингококков, а также защитным барьером против инфекции N. meningitidis. Таким образом, N. meningitidis ведет себя как комменсальные бактерии и вряд ли вызовет инфекцию без внешнего триггера.
Здесь мы использовали клетки Calu-3, выращенные в культуре с воздушным интерфейсом, чтобы изучить, как менингококки колонизируют носоглоточную нишу. Мы сообщаем, что слизь в дыхательных путях является одновременно нишей для роста менингококков, а также защитным барьером против инфекции N. meningitidis. Таким образом, N. meningitidis ведет себя как комменсальные бактерии и вряд ли вызовет инфекцию без внешнего триггера.
ВВЕДЕНИЕ
Neisseria meningitidis (менингококк) — грамотрицательная бактерия, которая обычно бессимптомно обитает в носоглотке человека. По неизвестным причинам он может пересекать эпителиальный барьер и размножаться в кровотоке, где становится одним из самых вредных патогенов. N. meningitidis эффективно прикрепляется к эндотелиальным клеткам, выстилающим просвет кровеносных сосудов (1). Отсюда бактерии размножаются и вызывают дисфункцию кровеносных сосудов (2–6), ответственную за быстрое прогрессирование септического шока, что в худшем случае приводит к молниеносной пурпуре, острой системной воспалительной реакции, связанной с внутрисосудистой коагуляцией и некрозом тканей. N. meningitidis также может преодолевать гематоэнцефалический барьер и вызывать цереброспинальный менингит (7, 8).
N. meningitidis также может преодолевать гематоэнцефалический барьер и вызывать цереброспинальный менингит (7, 8).
N. meningitidis передается от человека к человеку в виде капель аэрозоля, образующихся при дыхании, разговоре, кашле или при прямом контакте с зараженной жидкостью. Естественным резервуаром N. meningitidis является слизистая оболочка носоглотки человека, расположенная в задней части носа и над ротоглоткой. Там бактерии встречаются с богатой микробиотой (9–11), которая постоянно претерпевает изменения с возрастом и при инфекциях верхних дыхательных путей (12, 13).Носоглотка выстлана двумя основными типами эпителия: плюристратифицированным плоским эпителием, покрывающим 60% носоглотки, и цилиндрическим респираторным эпителием (14, 15). В дыхательных путях клетки защищены двухслойной поверхностной жидкостью толщиной от 10 до 12 мкм, образованной перицилиарной жидкостью с низкой вязкостью (PCL), контактирующей с клетками, и высоковязкой слизью, обращенной к просвету, которая удерживает бактерии, вдыхаемые частицы и клеточный мусор (внешняя слизь) (16, 17). PCL способствует биению ресничек, что обеспечивает эффективный мукоцилиарный клиренс в 6.9 ± 0,7 мм / мин (18). Благодаря постоянной транспортировке слизи из нижних дыхательных путей в глотку, откуда она проглатывается, этот механизм считается основной защитой от микроорганизмов и частиц. Слой слизи, в которой ограничены комменсальные бактерии, представляет собой плотный гель, образованный муцинами, и содержит множество антимикробных белков и пептидов, таких как IgA, лизоцим, лактоферрин и человеческие дефенсины (19–21). Муцины представляют собой семейство по меньшей мере 22 высокомолекулярных гликопротеинов, разделенных на два класса: связанные с мембраной муцины, которые продуцируются любыми эпителиальными клетками, и гелеобразующие муцины, продуцируемые бокаловидными клетками и подслизистыми железами.В дыхательных путях слой слизи в основном состоит из MUC5AC и MUC5B. Их экспрессия строго регулируется и реагирует на бактериальные инфекции и различные заболевания дыхательных путей (17).
PCL способствует биению ресничек, что обеспечивает эффективный мукоцилиарный клиренс в 6.9 ± 0,7 мм / мин (18). Благодаря постоянной транспортировке слизи из нижних дыхательных путей в глотку, откуда она проглатывается, этот механизм считается основной защитой от микроорганизмов и частиц. Слой слизи, в которой ограничены комменсальные бактерии, представляет собой плотный гель, образованный муцинами, и содержит множество антимикробных белков и пептидов, таких как IgA, лизоцим, лактоферрин и человеческие дефенсины (19–21). Муцины представляют собой семейство по меньшей мере 22 высокомолекулярных гликопротеинов, разделенных на два класса: связанные с мембраной муцины, которые продуцируются любыми эпителиальными клетками, и гелеобразующие муцины, продуцируемые бокаловидными клетками и подслизистыми железами.В дыхательных путях слой слизи в основном состоит из MUC5AC и MUC5B. Их экспрессия строго регулируется и реагирует на бактериальные инфекции и различные заболевания дыхательных путей (17).
Взаимодействие N. meningitidis с эпителиальными клетками было предметом многочисленных исследований за последние 4 десятилетия. Однако способы, которыми менингококки проникают через стенку носоглотки, все еще обсуждаются. Это может быть связано с отсутствием удобной и актуальной модели, имитирующей носоглоточную нишу.Большинство предыдущих исследований, посвященных зависимому от адгезии взаимодействию N. meningitidis с эпителиальными клетками кишечника и дыхательных путей, проводилось на клетках, культивируемых в жидких средах, таких как RPMI и среда Игла, модифицированная Дульбекко (DMEM). Эти первые исследования привели к появлению концепции колонизации клеток, опосредованной ворсинками IV типа и / или Opa / Opc. В такой модели менингококки взаимодействуют с эпителиальными клетками через свои пили типа IV и образуют высокопролиферативные микроколонии, которые в конечном итоге пересекают эпителиальный барьер (22–28), в то время как белки Opa и Opc участвуют в активном процессе интернализации, который, как предполагается, способствует развитию транслокация бактерий через монослой клеток (29–31). Каждая из этих работ продемонстрировала тесное взаимодействие N. meningitidis с эпителиальными клетками человека. За последнее десятилетие мало исследований было сосредоточено на транслокации N. meningitidis через эпителиальный слой. Работа T. C. Sutherland et al. в 2010 (32) обращается к этому вопросу, используя Calu-3 человеческие бронхиальные эпителиальные клетки, клеточную модель дыхательных путей, которая может быть полностью дифференцирована в поляризованный эпителий. Хотя авторы работали с клетками, инфицированными в культуре, покрытой жидкостью (LCC), они предложили использовать клетки Calu-3 в культуре с воздушным интерфейсом (AIC), модель, в которой клетки выращиваются так, что апикальный домен обращен к воздуху.В конце концов они пришли к выводу, что N. meningitidis может пересекать эпителиальный слой трансцеллюлярным путем с использованием пилей IV типа. Между тем, Barrile et al. показали, используя клетки Calu-3, выращенные в LCC, что менингококки могут интернализоваться и транспортироваться в базальный домен, нарушая внутриклеточный трафик клеток-хозяев (33).
Каждая из этих работ продемонстрировала тесное взаимодействие N. meningitidis с эпителиальными клетками человека. За последнее десятилетие мало исследований было сосредоточено на транслокации N. meningitidis через эпителиальный слой. Работа T. C. Sutherland et al. в 2010 (32) обращается к этому вопросу, используя Calu-3 человеческие бронхиальные эпителиальные клетки, клеточную модель дыхательных путей, которая может быть полностью дифференцирована в поляризованный эпителий. Хотя авторы работали с клетками, инфицированными в культуре, покрытой жидкостью (LCC), они предложили использовать клетки Calu-3 в культуре с воздушным интерфейсом (AIC), модель, в которой клетки выращиваются так, что апикальный домен обращен к воздуху.В конце концов они пришли к выводу, что N. meningitidis может пересекать эпителиальный слой трансцеллюлярным путем с использованием пилей IV типа. Между тем, Barrile et al. показали, используя клетки Calu-3, выращенные в LCC, что менингококки могут интернализоваться и транспортироваться в базальный домен, нарушая внутриклеточный трафик клеток-хозяев (33). Однако они также показали, что транслокация бактерий полностью ингибируется в высокополяризованных клетках, культивируемых в течение 18 дней.
Однако они также показали, что транслокация бактерий полностью ингибируется в высокополяризованных клетках, культивируемых в течение 18 дней.
В дополнение к этим работам в период с 1980 по 1995 год была проведена серия из экспериментов ex vivo с использованием культур органов вместо иммортализованных клеток (34–37).Авторы наблюдали прямое взаимодействие между менингококками и эпителиальными клетками эксплантата. Это было связано с потерей ресничек и, для некоторых эксплантов, с интернализацией бактерий в эпителиальных клетках. Однако в каждом из этих экспериментов эксплантаты погружали в жидкую среду, протокол, который мог изменить морфологию клеток и нарушить слизистый барьер.
Изучение менингококковой колонизации верхних дыхательных путей человека затруднено из-за отсутствия соответствующих моделей.В этой работе мы использовали клетки Calu-3, выращенные в AIC (38), чтобы изучить, как менингококки колонизируют носоглоточную нишу. Заражение клеток Calu-3 показало зависимость N. meningitidis от слизи на этой модели. Наши результаты показывают, что слизь защищает менингококки от смерти, связанной с высыханием, и поддерживает рост бактерий. Мы показали, что слой слизи изолировал бактерии и что прямое взаимодействие бактерий с эпителиальными клетками наблюдалось редко.Бактерии росли, не вызывая сильного врожденного иммунного ответа клеток Calu-3. Включенные в слизь, менингококки были защищены и питались, и экспрессировали более низкие уровни адгезинов, но высокий уровень переносчиков железа, в то время как пили типа IV не были необходимы для колонизации. Наконец, мы оценили влияние колонизации Streptococcus mitis и Moraxella catarrhalis, двух бактерий, классически присутствующих в слизистой оболочке носоглотки, на рост N. meningitidis (39–41) и показали, что совместная колонизация N.meningitidis с S. mitis может способствовать росту менингококков.
meningitidis от слизи на этой модели. Наши результаты показывают, что слизь защищает менингококки от смерти, связанной с высыханием, и поддерживает рост бактерий. Мы показали, что слой слизи изолировал бактерии и что прямое взаимодействие бактерий с эпителиальными клетками наблюдалось редко.Бактерии росли, не вызывая сильного врожденного иммунного ответа клеток Calu-3. Включенные в слизь, менингококки были защищены и питались, и экспрессировали более низкие уровни адгезинов, но высокий уровень переносчиков железа, в то время как пили типа IV не были необходимы для колонизации. Наконец, мы оценили влияние колонизации Streptococcus mitis и Moraxella catarrhalis, двух бактерий, классически присутствующих в слизистой оболочке носоглотки, на рост N. meningitidis (39–41) и показали, что совместная колонизация N.meningitidis с S. mitis может способствовать росту менингококков.
РЕЗУЛЬТАТЫ
Менингококки требуют продуцирования слизи для колонизации клеток, культивируемых на границе раздела воздух-жидкость. Для изучения колонизации верхних дыхательных путей человека Neisseria meningitidis мы использовали клетки Calu-3, выращенные на мембране с размером пор 0,4 мкм в условиях AIC. . Клетки, выдерживаемые в течение нескольких дней в AIC (неделя 0), образовывали моностратифицированный эпителий с лишь несколькими пятнами слизи на поверхности клетки (см. Рис. S1A в дополнительном материале).Мы наблюдали псевдостратифицированные клетки Calu-3, покрытые слоем слизи после 2 недель AIC. После 3 недель AIC эпителий оказался плюристратифицированным с толстым слоем слизи над клетками (рис. S1A). Клетки, выращенные в течение 2 недель в AIC, также выявили наличие плотных контактов, микроворсинок и клеток, продуцирующих слизь (рис. S1B). Через две недели после AIC толщина слизи составила 30,6 ± 5,6 мкм (рис. S1C). Сначала мы рассмотрели, может ли слизь влиять на рост менингококков на клетках Calu-3, выращенных в AIC в течение 2 дней или 2 недель (AIC W 0 и AIC W 2 , соответственно).
Для изучения колонизации верхних дыхательных путей человека Neisseria meningitidis мы использовали клетки Calu-3, выращенные на мембране с размером пор 0,4 мкм в условиях AIC. . Клетки, выдерживаемые в течение нескольких дней в AIC (неделя 0), образовывали моностратифицированный эпителий с лишь несколькими пятнами слизи на поверхности клетки (см. Рис. S1A в дополнительном материале).Мы наблюдали псевдостратифицированные клетки Calu-3, покрытые слоем слизи после 2 недель AIC. После 3 недель AIC эпителий оказался плюристратифицированным с толстым слоем слизи над клетками (рис. S1A). Клетки, выращенные в течение 2 недель в AIC, также выявили наличие плотных контактов, микроворсинок и клеток, продуцирующих слизь (рис. S1B). Через две недели после AIC толщина слизи составила 30,6 ± 5,6 мкм (рис. S1C). Сначала мы рассмотрели, может ли слизь влиять на рост менингококков на клетках Calu-3, выращенных в AIC в течение 2 дней или 2 недель (AIC W 0 и AIC W 2 , соответственно).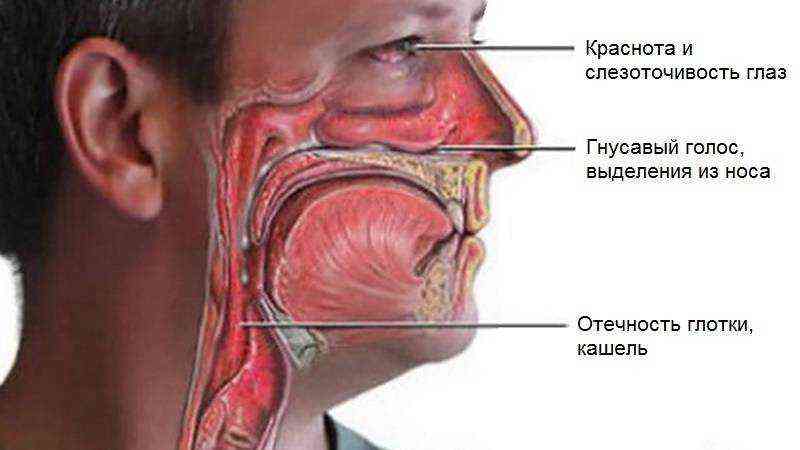 Мы добавили 1 × 10 6 менингококков (штамм 2C4.3) к клеткам и оценили колонизацию эпителия с помощью конфокальной визуализации и количественной культуры (подсчет КОЕ) через 24 часа после заражения. Эти результаты сравнивали с результатами, полученными после инфицирования клеток Calu-3, культивированных в культуре, покрытой жидкостью (LCC). Мы наблюдали резкое снижение бактериальной пролиферации через 24 часа после заражения культивированных клеток AIC W 0 по сравнению с культивированными клетками LCC (1,35 × 10 8 ± 0,35 × 10 8 бактерий на лунку в LCC; 0.75 × 10 6 ± 0,25 × 10 6 бактерий на лунку в AIC W 0 ). Это ингибирование менее выражено в культивируемых клетках AIC W 2 , которые продуцировали слизь (2 × 10 7 ± 0,64 × 10 7 бактерий в AIC W 2 ). Кроме того, при LCC бактерии равномерно распределяются по поверхности слизи (рис. 1A и B). Эти результаты предполагают, что LCC более благоприятен для роста бактерий, чем AIC.
Мы добавили 1 × 10 6 менингококков (штамм 2C4.3) к клеткам и оценили колонизацию эпителия с помощью конфокальной визуализации и количественной культуры (подсчет КОЕ) через 24 часа после заражения. Эти результаты сравнивали с результатами, полученными после инфицирования клеток Calu-3, культивированных в культуре, покрытой жидкостью (LCC). Мы наблюдали резкое снижение бактериальной пролиферации через 24 часа после заражения культивированных клеток AIC W 0 по сравнению с культивированными клетками LCC (1,35 × 10 8 ± 0,35 × 10 8 бактерий на лунку в LCC; 0.75 × 10 6 ± 0,25 × 10 6 бактерий на лунку в AIC W 0 ). Это ингибирование менее выражено в культивируемых клетках AIC W 2 , которые продуцировали слизь (2 × 10 7 ± 0,64 × 10 7 бактерий в AIC W 2 ). Кроме того, при LCC бактерии равномерно распределяются по поверхности слизи (рис. 1A и B). Эти результаты предполагают, что LCC более благоприятен для роста бактерий, чем AIC.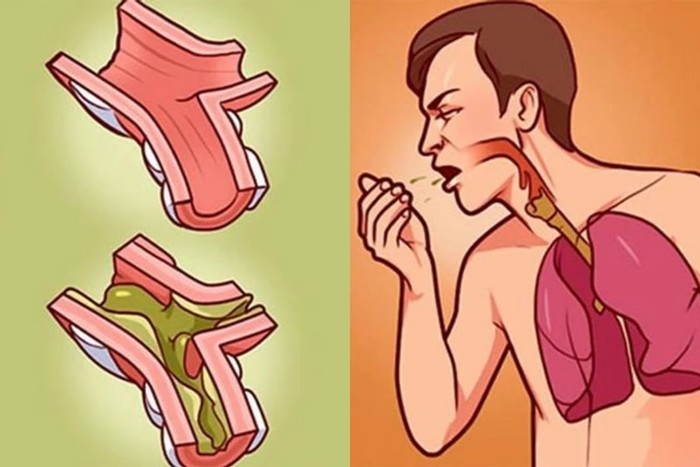
Пролиферация N. meningitidis в модели культуры с воздушным интерфейсом.(A) Конфокальные 3D-реконструкции, показывающие пролиферацию N. meningitidis через 24 часа после инфицирования клеток Calu-3. Менингококки были помечены антителом против 2С43 (зеленый). Клетки окрашивали фаллоидином, конъюгированным с Alexa Fluor (красный). Ядра окрашивали DAPI (синий). Прутки, 20 мкм. (B) Количество КОЕ N. meningitidis на лунку через 24 часа после заражения (10 6 бактерий). Данные были выражены как средние значения КОЕ на фильтр ± стандартная ошибка средних значений (SEM) (планки ошибок). Статистический анализ проводился с помощью однофакторного дисперсионного анализа не менее пяти фильтров из трех независимых экспериментов.Значения, которые статистически значимо различаются, обозначены столбцами и звездочками следующим образом: *, P <0,05; **, P <0,01. (C) Анализ осушения. Планшеты покрывали слизью, полученной из клеток Calu-3, или культуральной средой в качестве контроля. Затем бактерии выращивали в течение ночи в этих лунках, содержащих культуральную среду. Затем среду осторожно удалили. Бактерии сушили 0, 30, 60 или 120 мин. Затем оценивали количество КОЕ. Данные были выражены как средние значения КОЕ на миллилитр ± стандартная ошибка среднего.Статистический анализ проводили с помощью теста Стьюдента t по меньшей мере на четырех лунках из двух независимых экспериментов. Значения, которые статистически значимо различаются, обозначены столбцами и звездочками следующим образом: **, P <0,01.
Затем бактерии выращивали в течение ночи в этих лунках, содержащих культуральную среду. Затем среду осторожно удалили. Бактерии сушили 0, 30, 60 или 120 мин. Затем оценивали количество КОЕ. Данные были выражены как средние значения КОЕ на миллилитр ± стандартная ошибка среднего.Статистический анализ проводили с помощью теста Стьюдента t по меньшей мере на четырех лунках из двух независимых экспериментов. Значения, которые статистически значимо различаются, обозначены столбцами и звездочками следующим образом: **, P <0,01.
FIG S1
Клетки Calu-3, выращенные с использованием AIC. (A) Конфокальные 3D-реконструкции живых клеток Calu-3, показывающие накопление слизи после 2 недель культивирования в AIC. Слизь была помечена декстраном, конъюгированным с Alexa Fluor (голубой), и клетки были окрашены с помощью Cell Trace Calcein Red Orange, AM (красный).Пруток, 20 мкм. (B) Изображения просвечивающей электронной микроскопии (поперечный разрез). Обозначены плотное соединение (звездочка), муцин-содержащие везикулы (стрелка), микроворсинки (мкВ) и слизь (M). Прутки, 2 мкм. (C) Измерение толщины слизи через 2 или 3 недели культивирования в AIC. Измерения были получены в результате анализа конфокальных изображений с использованием ImageJ. Толщина слизи выражалась в микронах (среднее значение ± стандартная ошибка среднего). Статистический анализ проводился с помощью U-критерия Манна-Уитни (20 измерений были выполнены на двух репрезентативных изображениях x-z и x-y ).Значения толщины слизи на 2-й и 3-й неделе статистически значимо различались ( P < 0,0001). Скачать FIG S1, файл TIF, 1,8 МБ.
Прутки, 2 мкм. (C) Измерение толщины слизи через 2 или 3 недели культивирования в AIC. Измерения были получены в результате анализа конфокальных изображений с использованием ImageJ. Толщина слизи выражалась в микронах (среднее значение ± стандартная ошибка среднего). Статистический анализ проводился с помощью U-критерия Манна-Уитни (20 измерений были выполнены на двух репрезентативных изображениях x-z и x-y ).Значения толщины слизи на 2-й и 3-й неделе статистически значимо различались ( P < 0,0001). Скачать FIG S1, файл TIF, 1,8 МБ. Авторские права © 2019 Audry et al.Этот контент распространяется согласно условиям международной лицензии Creative Commons Attribution 4.0.
Слизистый слой, как известно, является плохой питательной средой, которая ограничивает рост многих комменсальных и патогенных бактерий. Это сильно гидратированный гель, который также защищает клеточную поверхность от высыхания.Поэтому мы стремились определить, может ли слой слизи защитить N.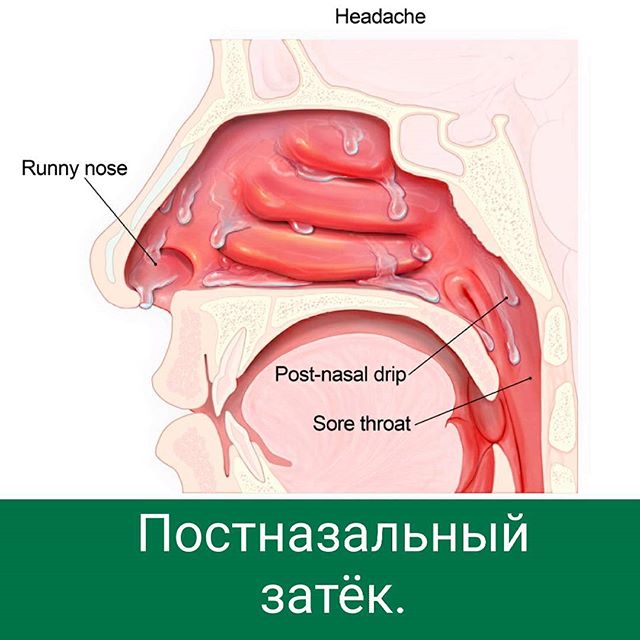 meningitidis от высыхания в модели колонизации абиотической поверхности (рис. 1C). Мы инфицировали пластиковые лунки, покрытые очищенной и высушенной слизью, в течение 24 часов, чтобы позволить бактериям прилипнуть и образоваться биопленке на дне лунок (см. Материалы и методы). Важно отметить, что слизь не способствовала росту бактерий. Мы подсчитали одинаковое количество КОЕ перед сушкой как в контрольных лунках, так и в лунках, покрытых слизью (1.7 × 10 7 и 1,4 × 10 7 КОЕ соответственно). В день эксперимента мы удалили питательную среду и инкубировали прилипшие бактерии под ламинарным вытяжным шкафом в течение 30, 60 и 120 мин. В этом состоянии менингококки были особенно чувствительны к высыханию. В контрольных лунках количество живых бактерий уменьшилось в 5,6 × 10 3 раз за 30 мин и в 7,9 × 10 5 раз через 120 мин после начала эксперимента. И наоборот, в лунках, покрытых слизью, количество живых бактерий снижалось в 110 раз через 30 минут и 1.
meningitidis от высыхания в модели колонизации абиотической поверхности (рис. 1C). Мы инфицировали пластиковые лунки, покрытые очищенной и высушенной слизью, в течение 24 часов, чтобы позволить бактериям прилипнуть и образоваться биопленке на дне лунок (см. Материалы и методы). Важно отметить, что слизь не способствовала росту бактерий. Мы подсчитали одинаковое количество КОЕ перед сушкой как в контрольных лунках, так и в лунках, покрытых слизью (1.7 × 10 7 и 1,4 × 10 7 КОЕ соответственно). В день эксперимента мы удалили питательную среду и инкубировали прилипшие бактерии под ламинарным вытяжным шкафом в течение 30, 60 и 120 мин. В этом состоянии менингококки были особенно чувствительны к высыханию. В контрольных лунках количество живых бактерий уменьшилось в 5,6 × 10 3 раз за 30 мин и в 7,9 × 10 5 раз через 120 мин после начала эксперимента. И наоборот, в лунках, покрытых слизью, количество живых бактерий снижалось в 110 раз через 30 минут и 1. 46 × 10 3 -кратно через 120 мин после начала эксперимента. В целом, наши результаты показывают, что слизистый слой клеток Calu-3, культивируемых в AIC, вероятно, защищает бактерии от высыхания.
46 × 10 3 -кратно через 120 мин после начала эксперимента. В целом, наши результаты показывают, что слизистый слой клеток Calu-3, культивируемых в AIC, вероятно, защищает бактерии от высыхания.
Менингококки ограничены слоем слизи и не проникают через эпителий. Во время LCC-инфекции бактерии легко прикрепляются к клеткам человека и индуцируют передачу сигналов клетки-хозяина, что приводит к привлечению эзрина и актина и образованию выступов на мембране (42, 43 ). И наоборот, во время инфекции AIC, как и в случае колонизации носоглоточной слизи, бактерии откладываются на слое слизи, которое защищает клетки.Поэтому мы изучили, как N. meningitidis взаимодействует с эпителием, выращенным в AIC. Сначала мы сравнили количество КОЕ, выделенных из внешней слизи, с фракцией, содержащей как клетки, так и прикрепленную к клеткам слизь. Клетки были инфицированы 1 × 10 6 менингококков дикого типа или его непилированным производным (мутант pilE ; Δ pilE ), который не может прикрепляться к клеткам человека (24). До 80% менингококков дикого типа или менингококков Δ pilE было обнаружено во внешнем слое слизи, что означает, что N.meningitidis лишь незначительно проникает в этот слой (рис. 2А). Интересно, что такое же количество менингококков дикого типа и Δ pilE было собрано во фракции, содержащей клетки и прикрепленную к клеткам слизь. Чтобы лучше охарактеризовать инфекцию клеток Calu-3, выращенных с использованием AIC, и определить, взаимодействовали ли бактерии с клетками, мы визуализировали инфицированные клетки с помощью трансмиссионной и сканирующей электронной микроскопии (TEM и SEM). Мы обнаружили, что большинство бактерий попало в слизь (рис.2B и C) и организованы в небольшие скопления живых и умирающих менингококков в соответствии с морфологией клеток. Несколько бактерий были обнаружены в прямом контакте с плазматическими мембранами клеток Calu-3, и мы редко обнаруживали выступы мембран рядом с бактериями, в отличие от того, что наблюдалось ранее, когда клетки были инфицированы в LCC (43).
До 80% менингококков дикого типа или менингококков Δ pilE было обнаружено во внешнем слое слизи, что означает, что N.meningitidis лишь незначительно проникает в этот слой (рис. 2А). Интересно, что такое же количество менингококков дикого типа и Δ pilE было собрано во фракции, содержащей клетки и прикрепленную к клеткам слизь. Чтобы лучше охарактеризовать инфекцию клеток Calu-3, выращенных с использованием AIC, и определить, взаимодействовали ли бактерии с клетками, мы визуализировали инфицированные клетки с помощью трансмиссионной и сканирующей электронной микроскопии (TEM и SEM). Мы обнаружили, что большинство бактерий попало в слизь (рис.2B и C) и организованы в небольшие скопления живых и умирающих менингококков в соответствии с морфологией клеток. Несколько бактерий были обнаружены в прямом контакте с плазматическими мембранами клеток Calu-3, и мы редко обнаруживали выступы мембран рядом с бактериями, в отличие от того, что наблюдалось ранее, когда клетки были инфицированы в LCC (43). Мы обнаружили несколько интернализованных бактерий, несмотря на анализ четырех разных продольно разрезанных слоев клеток. Эти бактерии находились вблизи апикальной плазматической мембраны (рис.2D) или уже переварены в вакуоли (рис. S2). Затем мы изучили инфицированные клетки Calu-3 с помощью конфокальной микроскопии. Опять же, большинство бактерий было обнаружено в слизи, окрашенной антителом против MUC5AC. Мы также наблюдали с помощью конфокальной микроскопии и ПЭМ микроколонии бактерий, заключенных между эпителиальными клетками в полостях в верхней части клеточного слоя (рис. 3А и В). Однако в базальной части эпителия бактерий не наблюдалось, как можно было бы ожидать, если бы бактерии прошли через него.Кроме того, непилированный мутант Δ pilE показал такое же пространственное расположение, что и штамм дикого типа, что позволяет предположить, что пили типа IV не играют никакой роли в локализации бактерий в слизи (фиг. 3A).
Мы обнаружили несколько интернализованных бактерий, несмотря на анализ четырех разных продольно разрезанных слоев клеток. Эти бактерии находились вблизи апикальной плазматической мембраны (рис.2D) или уже переварены в вакуоли (рис. S2). Затем мы изучили инфицированные клетки Calu-3 с помощью конфокальной микроскопии. Опять же, большинство бактерий было обнаружено в слизи, окрашенной антителом против MUC5AC. Мы также наблюдали с помощью конфокальной микроскопии и ПЭМ микроколонии бактерий, заключенных между эпителиальными клетками в полостях в верхней части клеточного слоя (рис. 3А и В). Однако в базальной части эпителия бактерий не наблюдалось, как можно было бы ожидать, если бы бактерии прошли через него.Кроме того, непилированный мутант Δ pilE показал такое же пространственное расположение, что и штамм дикого типа, что позволяет предположить, что пили типа IV не играют никакой роли в локализации бактерий в слизи (фиг. 3A).
N. meningitidis колонизирует наружную слизь. Клетки Calu-3, выращенные в AIC, инфицировали в течение 24 ч 10 6 бактериями. (A) После того, как клетки Calu-3 были инфицированы диким типом (WT) или мутантом Δ pilE штамма 2C4.3 N. meningitidis, внешний слой слизи (наружная слизь) отделился от прикрепленной к клетке слизи. с использованием N -ацетилцистеина.Определяли бактериальную нагрузку во фракции N -ацетилцистеина или во фракции присоединенных клеток. Данные были выражены в виде среднего процента КОЕ ± SEM для по крайней мере пяти фильтров из трех независимых экспериментов. (B) Изображения, полученные с помощью сканирующей электронной микроскопии, демонстрируют бактерии, попавшие в слизь. Показаны бактерии, застрявшие в слизи (красная звездочка), и бактерии, которые напрямую взаимодействуют с клетками Calu-3 (красная стрелка). Прутки, 10 мкм. (C) Изображения просвечивающей электронной микроскопии, показывающие бактерии в слизи (слева) или в контакте с клетками (справа).Показаны умирающие бактерии (красная звездочка) и бактерии, прикрепленные к клеткам Calu-3 (красные стрелки).
Клетки Calu-3, выращенные в AIC, инфицировали в течение 24 ч 10 6 бактериями. (A) После того, как клетки Calu-3 были инфицированы диким типом (WT) или мутантом Δ pilE штамма 2C4.3 N. meningitidis, внешний слой слизи (наружная слизь) отделился от прикрепленной к клетке слизи. с использованием N -ацетилцистеина.Определяли бактериальную нагрузку во фракции N -ацетилцистеина или во фракции присоединенных клеток. Данные были выражены в виде среднего процента КОЕ ± SEM для по крайней мере пяти фильтров из трех независимых экспериментов. (B) Изображения, полученные с помощью сканирующей электронной микроскопии, демонстрируют бактерии, попавшие в слизь. Показаны бактерии, застрявшие в слизи (красная звездочка), и бактерии, которые напрямую взаимодействуют с клетками Calu-3 (красная стрелка). Прутки, 10 мкм. (C) Изображения просвечивающей электронной микроскопии, показывающие бактерии в слизи (слева) или в контакте с клетками (справа).Показаны умирающие бактерии (красная звездочка) и бактерии, прикрепленные к клеткам Calu-3 (красные стрелки). (D) Z-стек из конфокальной трехмерной реконструкции двух различных слоев клеток Calu-3, инфицированных N. meningitidis. Слои клеток Calu-3 фиксировали и иммуноокрашивали антителом против 2C4.3 (зеленый) и антителом против MUC5AC (фиолетовый). Клетки окрашивали A546-фаллоидином (красный), а ядра окрашивали DAPI (синий). Пруток, 20 мкм.
(D) Z-стек из конфокальной трехмерной реконструкции двух различных слоев клеток Calu-3, инфицированных N. meningitidis. Слои клеток Calu-3 фиксировали и иммуноокрашивали антителом против 2C4.3 (зеленый) и антителом против MUC5AC (фиолетовый). Клетки окрашивали A546-фаллоидином (красный), а ядра окрашивали DAPI (синий). Пруток, 20 мкм.
N. meningitidis не пересекает эпителиальный слой. (A) Z-стек из конфокальной трехмерной реконструкции клеточного слоя Calu-3, инфицированного за 24 часа 10 6 бактериями штамма дикого типа (2C4.3 WT) или штамм с дефектом пилей IV типа (2C4.3 Δ pilE ). Слой клеток Calu-3 фиксировали и иммуноокрашивали антителом против 2C4.3 (зеленый). Клетки окрашивали фаллоидином, конъюгированным с Alexa Fluor (красный), а ядра окрашивали DAPI (синий). Пруток, 20 мкм. (B) Изображения просвечивающей электронной микроскопии (продольные срезы) клеточного слоя Calu-3, инфицированного в течение 24 часов 10 6 менингококками дикого типа. (C) Графики Каплана-Мейера, показывающие прохождение N. meningitidis дикого типа через слой клеток Calu-3.Данные были выражены как процент проникновения в базальную камеру. Для необработанных клеток восемь фильтров были инфицированы 10 4 или 10 2 бактериями, и были выполнены три независимых эксперимента. Для клеток, обработанных IL-4 или IL-13, четыре фильтра были инфицированы 10 4 или 10 2 бактериями, и были выполнены два независимых эксперимента.
(C) Графики Каплана-Мейера, показывающие прохождение N. meningitidis дикого типа через слой клеток Calu-3.Данные были выражены как процент проникновения в базальную камеру. Для необработанных клеток восемь фильтров были инфицированы 10 4 или 10 2 бактериями, и были выполнены три независимых эксперимента. Для клеток, обработанных IL-4 или IL-13, четыре фильтра были инфицированы 10 4 или 10 2 бактериями, и были выполнены два независимых эксперимента.
FIG S2
Умирающий и живой N. meningitidis. Изображения просвечивающей электронной микроскопии (продольный разрез), показывающие умирающие и живые бактерии внутри слизи (A) и умирающие бактерии внутри клетки (B).Показаны мертвые бактерии (DB) и живые бактерии (LB). Прутки, 1 мкм. Скачать FIG S2, файл TIF, 1,6 МБ.Авторские права © 2019 Audry et al.Этот контент распространяется согласно условиям международной лицензии Creative Commons Attribution 4.0.
На основании этого наблюдения мы изучили транслокацию менингококков через слой эпителиальных клеток. Сначала мы выращивали клетки Calu-3 в AIC с использованием мембран с порами 3 мкм вместо мембран с порами 0,4 мкм. Мы решили заразить клетки Calu-3 10 2 или 10 4 бактериями и сначала подтвердили пролиферацию N.meningitidis в этих условиях (рис. S3A и B). Независимо от инокулята количество колонизирующих бактерий через 24 ч, 10 7 КОЕ, было одинаковым. Затем мы изучали транслокацию N. meningitidis из слизи в базальную камеру, помещая базальную среду на чашки с агаром через 4 и 24 часа после заражения. Мы считали транслокацию положительной, когда хотя бы одна КОЕ была извлечена из базальной камеры. Интересно, что через 24 часа после заражения мы обнаружили всего 2 из 16 колонизированных базальных камер, а бактерии в базальных камерах не были обнаружены через 4 часа после заражения (рис.3С). Используя эту модель, мы затем оценили влияние интерлейкина-4 (IL-4) или IL-13, двух цитокинов, которые, как известно, участвуют в воспалении глотки (44), на транслокацию N.
Сначала мы выращивали клетки Calu-3 в AIC с использованием мембран с порами 3 мкм вместо мембран с порами 0,4 мкм. Мы решили заразить клетки Calu-3 10 2 или 10 4 бактериями и сначала подтвердили пролиферацию N.meningitidis в этих условиях (рис. S3A и B). Независимо от инокулята количество колонизирующих бактерий через 24 ч, 10 7 КОЕ, было одинаковым. Затем мы изучали транслокацию N. meningitidis из слизи в базальную камеру, помещая базальную среду на чашки с агаром через 4 и 24 часа после заражения. Мы считали транслокацию положительной, когда хотя бы одна КОЕ была извлечена из базальной камеры. Интересно, что через 24 часа после заражения мы обнаружили всего 2 из 16 колонизированных базальных камер, а бактерии в базальных камерах не были обнаружены через 4 часа после заражения (рис.3С). Используя эту модель, мы затем оценили влияние интерлейкина-4 (IL-4) или IL-13, двух цитокинов, которые, как известно, участвуют в воспалении глотки (44), на транслокацию N. meningitidis. Клетки обрабатывали 24 ч 5 нг / мл IL-4 или IL-13, как описано ранее (44) (фиг. 3C). Как и ожидалось, обработка клеток Calu-3 IL-4 или IL-13 привела к двукратному снижению трансэпителиального электрического сопротивления (TEER) (165,9 ± 20,02 Ом · см 2 и 155,3 ± 11,58 Ом · см 2 соответственно; рис.S3C). Однако это не было связано с повышенным прохождением клеточного слоя N. meningitidis (Fig. 3C). Наши результаты показывают, что менингококки, вероятно, колонизируют внешний слой слизи, из которого бактерии могут достигать прикрепленной к клеткам слизи, но редко вступают в контакт с клетками или пересекают эпителиальный слой, культивируемый в AIC.
meningitidis. Клетки обрабатывали 24 ч 5 нг / мл IL-4 или IL-13, как описано ранее (44) (фиг. 3C). Как и ожидалось, обработка клеток Calu-3 IL-4 или IL-13 привела к двукратному снижению трансэпителиального электрического сопротивления (TEER) (165,9 ± 20,02 Ом · см 2 и 155,3 ± 11,58 Ом · см 2 соответственно; рис.S3C). Однако это не было связано с повышенным прохождением клеточного слоя N. meningitidis (Fig. 3C). Наши результаты показывают, что менингококки, вероятно, колонизируют внешний слой слизи, из которого бактерии могут достигать прикрепленной к клеткам слизи, но редко вступают в контакт с клетками или пересекают эпителиальный слой, культивируемый в AIC.
ФИГ. S3
Культура клеток Calu-3 в присутствии IL-4 и IL-13 и инфицирование клеток Calu-3. (A) Количество менингококков через 24 часа после инфицирования клеток Calu-3, выращенных в AIC, с 10 2 , 10 4 или 10 6 бактериями.Данные были выражены как среднее значение КОЕ на фильтр ± SEM для шести фильтров из двух независимых экспериментов. (B) Конфокальные 3D-реконструкции, показывающие пролиферацию N. meningitidis. Через 24 часа после инфицирования клеток Calu-3 бактериями 10 2 , 10 4 или 10 6 клетки фиксировали и иммуноокрашивали антителом против 2C4.3 (зеленый). Клетки окрашивали с использованием фаллоидина, конъюгированного с Alexa Fluor (красный). Ядра окрашивали DAPI (синий). Пруток, 20 мкм. (C) Измерение TEER слоя клеток Calu-3, культивируемых в AIC, с использованием 0.Мембрана с порами 4 мкм или мембрана с порами 3 мкм, с добавлением или без добавления 5 нг / мл IL-4 или IL-13 в течение 24 часов. TEER выражали как среднее значение Ом · см 2 ± SEM. Статистический анализ выполняли с помощью однофакторного дисперсионного анализа (для мембраны с размером пор 0,4 и 3 мкм, три фильтра; для контроля по сравнению с обработанными IL-4 или IL-13, четыре фильтра из двух независимых экспериментов). Значения, которые статистически значимо различаются, обозначены звездочками следующим образом: ***, P P FIG S3, файл TIF, 1.
(B) Конфокальные 3D-реконструкции, показывающие пролиферацию N. meningitidis. Через 24 часа после инфицирования клеток Calu-3 бактериями 10 2 , 10 4 или 10 6 клетки фиксировали и иммуноокрашивали антителом против 2C4.3 (зеленый). Клетки окрашивали с использованием фаллоидина, конъюгированного с Alexa Fluor (красный). Ядра окрашивали DAPI (синий). Пруток, 20 мкм. (C) Измерение TEER слоя клеток Calu-3, культивируемых в AIC, с использованием 0.Мембрана с порами 4 мкм или мембрана с порами 3 мкм, с добавлением или без добавления 5 нг / мл IL-4 или IL-13 в течение 24 часов. TEER выражали как среднее значение Ом · см 2 ± SEM. Статистический анализ выполняли с помощью однофакторного дисперсионного анализа (для мембраны с размером пор 0,4 и 3 мкм, три фильтра; для контроля по сравнению с обработанными IL-4 или IL-13, четыре фильтра из двух независимых экспериментов). Значения, которые статистически значимо различаются, обозначены звездочками следующим образом: ***, P P FIG S3, файл TIF, 1. 1 МБ.
1 МБ. Авторские права © 2019 Audry et al.Этот контент распространяется согласно условиям международной лицензии Creative Commons Attribution 4.0.
Экспрессия факторов вирулентности менингококков во время инфекции AIC. Наши результаты показывают, что на слизистой оболочке менингококки могут жить в ловушке слизи. В этих условиях вполне вероятно, что менингококки регулируют экспрессию своих генов иначе, чем в бульоне. Поэтому мы охарактеризовали относительную экспрессию генов, которые, как известно, участвуют в колонизации слизистой оболочки.Мы сосредоточили свое внимание на экспрессии генов, кодирующих факторы адгезии: pilE , opaB , opaC и nhbA ; гены, кодирующие белки, участвующие в приобретении железа: tbpA , lbpA , fetA и tonB ; mtrC , кодирующий первый ген оперона mtrCDE , который участвует в оттоке лекарственного средства; ctrA , который кодирует капсульный транспортный белок А; и четыре гена, кодирующие мишени вакцины meningitidis B (MenB), porA , fhbp , nadA и nhbA .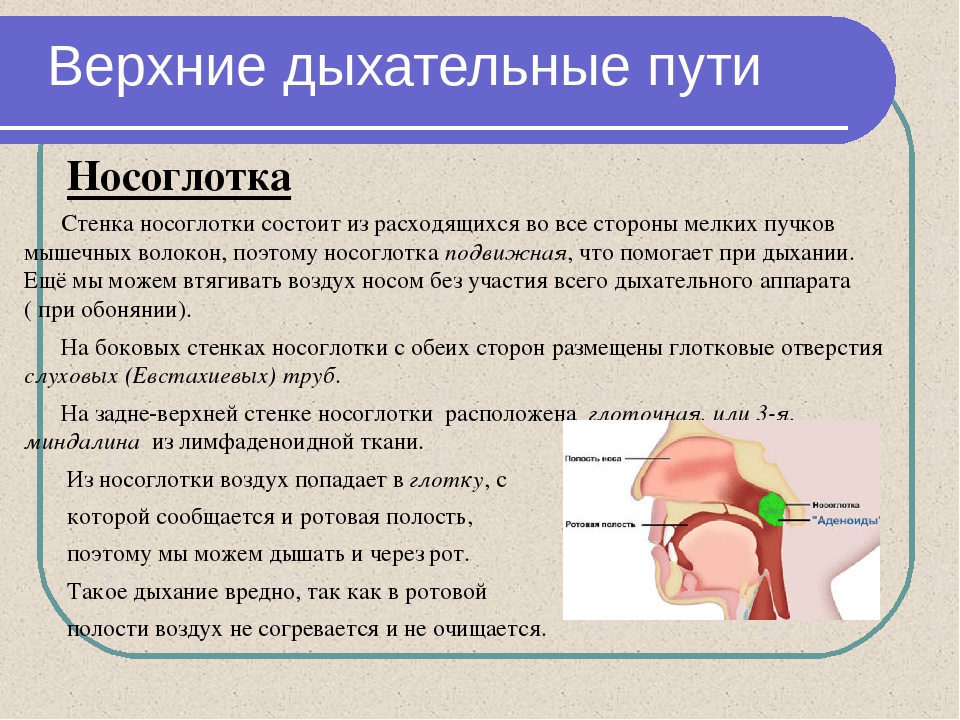 Мы сравнили экспрессию этих генов во время инфекции AIC с их экспрессией во время экспоненциальной и стационарной фазы роста в бульоне (рис. 4).
Мы сравнили экспрессию этих генов во время инфекции AIC с их экспрессией во время экспоненциальной и стационарной фазы роста в бульоне (рис. 4).
Экспрессия факторов вирулентности. Была приготовлена общая РНК, полученная из 3-часовой или 24-часовой бульонной культуры или собранная после 24 часов инфицирования клеток Calu-3 с использованием AIC или LCC. Выражение pilE , opaB , opaC , tbpA , lbpA , fetA , tonB , mtrC , porA12 nad6, nad6, и генов ctrA анализировали с помощью количественной ОТ-ПЦР.Экспрессия гена была нормализована до мкг и выражена как относительная экспрессия ± SEM. Статистический анализ был выполнен с помощью однофакторного дисперсионного анализа двух независимых экспериментов в трех повторностях. Значения, которые статистически значимо различаются, обозначены звездочками следующим образом: ****, P <0,0001; ***, Р <0,001; **, P <0,01; *, P <0,05.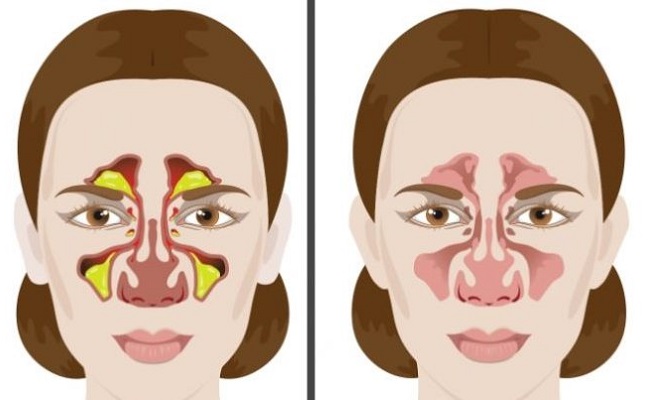 Указаны значения, которые существенно не отличаются (нс).
Указаны значения, которые существенно не отличаются (нс).
Эти гены следовали разным профилям экспрессии.Экспрессия факторов адгезии ( pilE , opaB , opaC и nhbA ) сопоставима между стационарной фазой роста в бульоне и инфицированием клеток Calu-3 в течение 24 часов. Напротив, экспрессия pilE , opaB , opaC и nhbA в AIC была снижена по сравнению с экспоненциальной фазой роста (AIC / экспоненциальная фаза, 0,28, 0,34, 0,33 и 0,47, соответственно) . Три протестированных транспортера железа ( tbpA , lbpA и fetA ) были сильно экспрессированы в AIC по сравнению с экспоненциальной фазой роста (AIC / экспоненциальная фаза, 6.25, 10 и 27 соответственно).
Примечательно, что экспрессия fhbp , tonB и mtrC была слабой во время инфекции AIC. Их экспрессия в слизи клеток Calu-3 была в 6,3, 6,7 и 3,5 раза меньше, чем в стационарной фазе роста. Экспрессия porA снижена в AIC по сравнению как с стационарной фазой, так и с экспоненциальной фазой роста (AIC / стационарная фаза, 0,67; AIC / экспоненциальная фаза, 0,51). Никаких серьезных различий в экспрессии nadA и ctrA между тестируемыми условиями не наблюдалось.В целом, 9 из 13 протестированных генов, по-видимому, следовали той же схеме экспрессии в AIC, что и в стационарной фазе роста. Затем мы рассмотрели влияние на экспрессию генов взаимодействия слизи и бактерий по сравнению с взаимодействием клеток и бактерий. Клетки, выращенные в LCC, инфицировали в течение 24 часов и экспрессию гена определяли количественно, как описано выше. Интересно, что 9 из 13 генов следовали одному и тому же профилю экспрессии в AIC и LCC. Только экспрессия opaB , opaC , nadA и fhbp была значительно увеличена во время инфекции LCC по сравнению с инфекцией AIC.Эти результаты предполагают, что через 24 часа после заражения менингококк не распознает слизь или клетки как триггер для экспрессии генов.
Никаких серьезных различий в экспрессии nadA и ctrA между тестируемыми условиями не наблюдалось.В целом, 9 из 13 протестированных генов, по-видимому, следовали той же схеме экспрессии в AIC, что и в стационарной фазе роста. Затем мы рассмотрели влияние на экспрессию генов взаимодействия слизи и бактерий по сравнению с взаимодействием клеток и бактерий. Клетки, выращенные в LCC, инфицировали в течение 24 часов и экспрессию гена определяли количественно, как описано выше. Интересно, что 9 из 13 генов следовали одному и тому же профилю экспрессии в AIC и LCC. Только экспрессия opaB , opaC , nadA и fhbp была значительно увеличена во время инфекции LCC по сравнению с инфекцией AIC.Эти результаты предполагают, что через 24 часа после заражения менингококк не распознает слизь или клетки как триггер для экспрессии генов.
Менингококки вызывают меньшее воспаление при состоянии AIC. Затем мы рассмотрели влияние колонизации менингококков на врожденный иммунный ответ клеток Calu-3, выращенных в AIC или LCC.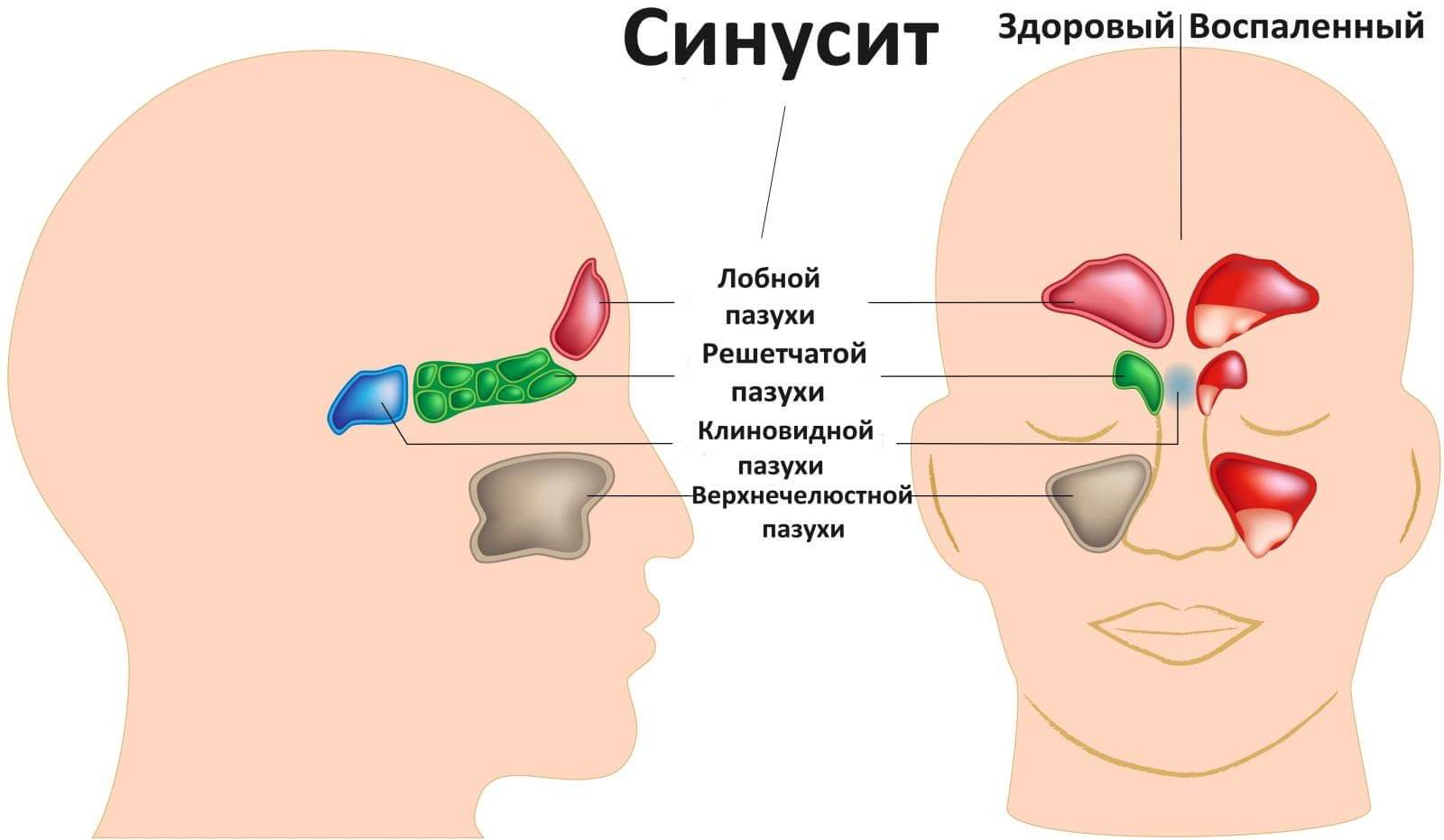 Поэтому мы измерили высвобождение 10 про- или противовоспалительных цитокинов через 24 часа после заражения по сравнению с базальным высвобождением этих цитокинов клетками Calu-3 через 24 часа культивирования без бактерий (рис.5). Мы наблюдали, что после инфицирования три цитокина продуцировались в больших количествах при LCC-инфекции, чем при AIC-инфекции: IL-1β показал 2,9-кратное увеличение при AIC по сравнению с 15,6-кратным увеличением при LCC; фактор некроза опухоли альфа (TNF-α) показал 66,4-кратное увеличение при AIC по сравнению с 200,4-кратным увеличением при LCC; IL-4 показал 6-кратное увеличение при AIC по сравнению с 31,8-кратным увеличением при LCC. Умеренное высвобождение четырех других цитокинов было обнаружено только при LCC: IL-10, IL-13, IL-2 и IL-6 (1,4-кратное увеличение, 1.5-кратное увеличение, 1,6-кратное увеличение и 2,33-кратное увеличение соответственно). Наконец, секреция гамма-интерферона (IFN-γ) увеличивалась в 2 раза при AIC по сравнению с 3-кратным при LCC, а секреция IL-12 увеличивалась в 3,1 раза при AIC по сравнению с 5,1 раза при LCC.
Поэтому мы измерили высвобождение 10 про- или противовоспалительных цитокинов через 24 часа после заражения по сравнению с базальным высвобождением этих цитокинов клетками Calu-3 через 24 часа культивирования без бактерий (рис.5). Мы наблюдали, что после инфицирования три цитокина продуцировались в больших количествах при LCC-инфекции, чем при AIC-инфекции: IL-1β показал 2,9-кратное увеличение при AIC по сравнению с 15,6-кратным увеличением при LCC; фактор некроза опухоли альфа (TNF-α) показал 66,4-кратное увеличение при AIC по сравнению с 200,4-кратным увеличением при LCC; IL-4 показал 6-кратное увеличение при AIC по сравнению с 31,8-кратным увеличением при LCC. Умеренное высвобождение четырех других цитокинов было обнаружено только при LCC: IL-10, IL-13, IL-2 и IL-6 (1,4-кратное увеличение, 1.5-кратное увеличение, 1,6-кратное увеличение и 2,33-кратное увеличение соответственно). Наконец, секреция гамма-интерферона (IFN-γ) увеличивалась в 2 раза при AIC по сравнению с 3-кратным при LCC, а секреция IL-12 увеличивалась в 3,1 раза при AIC по сравнению с 5,1 раза при LCC.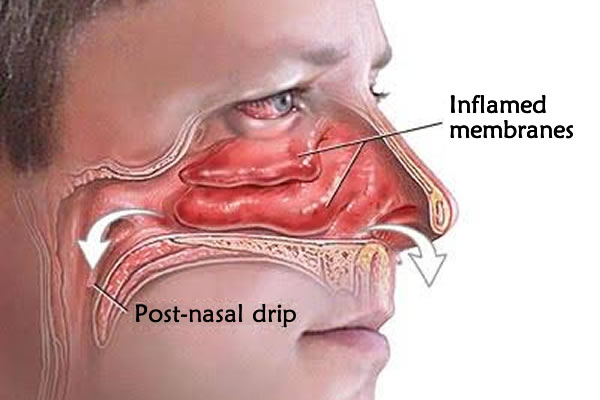 В целом провоспалительный ответ, оцениваемый по продукции цитокинов, оказался выше в модели LCC по сравнению с моделью AIC. Кроме того, мы не наблюдали секреции IL-2, IL-10, IL-13 и IL-6 во время инфекции AIC.
В целом провоспалительный ответ, оцениваемый по продукции цитокинов, оказался выше в модели LCC по сравнению с моделью AIC. Кроме того, мы не наблюдали секреции IL-2, IL-10, IL-13 и IL-6 во время инфекции AIC.
Экспрессия цитокинов инфицированными клетками Calu-3, выращенными в AIC и LCC. Секрецию цитокинов исследовали в слизи неинфицированных и инфицированных клеток Calu-3 в AIC в течение 24 часов или в супернатанте неинфицированных и инфицированных клеток Calu-3 в LCC в течение 24 часов. Данные были выражены как среднее значение ± SEM кратного увеличения между инфицированными и неинфицированными условиями. Статистический анализ проводился с помощью однофакторного дисперсионного анализа по крайней мере двух фильтров, считанных в двух экземплярах. Значения, которые статистически значимо различаются, обозначены звездочками следующим образом: ****, P <0.0001; ***, Р <0,001; **, P <0,01; *, P <0,05.
Колонизация Streptococcus mitis клетками Calu-3 способствует росту N. meningitidis. Далее мы стремились изучить взаимодействие между N. meningitidis и другими видами бактерий в этой модели. Среди видов, которые, как известно, колонизируют носоглотку человека, мы выбрали Streptococcus mitis и Moraxella catarrhalis, которые классически выделяются из нормальной слизистой оболочки носоглотки у взрослых и детей, соответственно (39–41).Сначала мы инфицировали клетки Calu-3, культивированные в AIC на мембране с размером пор 0,4 мкм, 1 × 10 5 S. mitis или инактивированными нагреванием S. mitis или M. catarrhalis. Обе живые бактерии были способны выжить в слизи клеток Calu-3, но мы не обнаружили пролиферации через 48 часов после заражения (S. mitis, инокулят, 3,08 × 10 5 ± 0,8 × 10 5 , 48 ч, 2,7 × 10 5 ± 1,01 × 10 5 ; M. catarrhalis, инокулят, 4,12 × 10 5 ± 1,9 × 10 5 , 48 ч, 6.07 × 10 5 ± 2,38 × 10 5 ). Затем мы инфицировали клетки Calu-3, колонизированные инактивированными нагреванием S. mitis или живыми S. mitis и M. catarrhalis, менингококками 1 × 10 6 (штамм 2C4.3 дикого типа) в течение 24 часов (рис. 6). В качестве контроля наивные неинфицированные клетки Calu-3 были инфицированы N. meningitidis. Наши результаты показали, что коинфекция S. mitis значительно улучшила колонизацию менингококков в 6,7 раза, в то время как инактивированный нагреванием S. mitis или живые M. catarrhalis не оказали никакого эффекта (рис.6). Интересно отметить положительный эффект S. mitis-N. meningitidis при росте менингококков оказалась специфичной для модели AIC. Совместное культивирование в 24-часовом бульоне 1 × 10 5 S. mitis и 1 × 10 6 N. meningitidis выявило небольшое снижение роста менингококков (рис. S4A). В целом, эти результаты подтверждают гипотезу о том, что рост N. meningitidis при AIC может быть облегчен другими бактериями носоглоточной ниши.
FIG 6Коинфекция S.mitis и M. catarrhalis. (A) Схематическое изображение протокола, применяемого для коинфекции. (B) В день 1 клетки инфицировали 10 5 S. mitis ( Sm ), инактивированным нагреванием S. mitis (HI Sm ) или M. catarrhalis ( Mc ). На 2 день клетки инфицировали 10 6 менингококками (N. meningitidis [ Nm ]). На 3 день собирали бактерии и определяли количество КОЕ. КОЕ менингококков после 24 ч совместного культивирования выражали как средний процент контрольного эксперимента ± SEM (КОЕ менингококков в монокультуре).Статистический анализ был выполнен с помощью теста Стьюдента t по меньшей мере на пяти фильтрах из трех независимых экспериментов. Значения, которые статистически значимо различаются, обозначены звездочками следующим образом: **, P <0,01; * P <0,05.
FIG S4
Совместное культивирование N. meningitidis с S. mitis в бульоне. Бульонные культуры BHI с N. meningitidis ( Nm ) и S. mitis ( Sm ) или только N. meningitidis выращивали в течение 24 часов, а N.meningitidis были определены КОЕ. Количество менингококков через 24 часа роста выражали как средний процент от значения для контрольного эксперимента ± SEM. Контролем служили менингококки, выращенные в монокультуре. Статистический анализ выполняли с помощью теста Стьюдента t на четырех лунках из двух независимых экспериментов. Значения, которые статистически значимо различаются, обозначены звездочками следующим образом: ****, P P FIG S4, файл TIF, 0,2 МБ.Авторские права © 2019 Audry et al.Этот контент распространяется согласно условиям международной лицензии Creative Commons Attribution 4.0.
В отличие от M. catarrhalis, S. mitis способен модифицировать слизь, например, путем гидролиза гликанов, которых очень много в белках муцина (45). Таким образом, гидролиз углеводов муцинов может стать дополнительным источником углерода и питательных веществ для менингококков. В качестве маркера модификации слизи живым S. mitis мы исследовали профили гликозилирования муцинов с помощью масс-спектрометрии после инфицирования или коинфекции клеток Calu-3 S.mitis, N. meningitidis или M. catarrhalis (таблица 1; см. также таблицу S1 в дополнительном материале). Мы наблюдали умеренное сверхсиалилирование муцинов после колонизации N. meningitidis или M. catarrhalis, поскольку 59% или 62,5% обнаруженных олигосахаридов, соответственно, были сиалированы по сравнению с 36,2% в неинфицированных клетках. Профиль гликозилирования муцинов резко изменился после добавления S. mitis (таблица 1 и таблица S1). Мы заметили глобальное упрощение O-гликанов из-за резкого десиалилирования муцинов, которое, вероятно, приводит к высвобождению сиаловой кислоты.Инфекция стрептококками, инактивированными нагреванием, не изменила профиль гликозилирования муцинов (Таблица S1). Это подтверждает, что S. mitis способен модифицировать слизь Calu-3 и, по крайней мере, гидролизовать O-гликаны муцинов, процесс, который коррелирует с усилением роста N. meningitidis.
ТАБЛИЦА 1Предлагаемые структуры или последовательности олигосахаридов и профили гликозилирования муцинов на сиалилированных олигосахаридах и их несиалилированных формах, идентифицированных на муцинах Calu-3 a
ОБСУЖДЕНИЕ
В этой работе мы адаптировали экспериментальную модель Клетки Calu-3, культивируемые в AIC, для изучения поведения N.meningitidis в слизи дыхательных путей. Мы показали, что менингококки задерживаются в слое слизи, где бактерии, вероятно, были защищены от высыхания и, безусловно, получили доступ к питательным веществам. Мы не обнаружили доказательств активного прохождения N. meningitidis через эпителиальный слой, и мы заметили, что пили типа IV не важны для роста или подвижности / подвижности в этой модели. Точно так же мы показали, что факторы вирулентности были плохо выражены в этой модели по сравнению с культурой в бульоне.Поразительно, это предполагает комменсальное поведение N. meningitidis, а это означает, что бактерии извлекают выгоду из клеточного слоя / слоя слизи, не повреждая его. Эта гипотеза подтверждается слабым цитокиновым ответом, наблюдаемым через 24 часа после заражения. Мы воспользовались этой моделью, чтобы исследовать влияние других бактерий на рост N. meningitidis. Мы показали, что S. mitis, который способен гидролизовать гликаны, способствует росту менингококков в протоколе коинфекции.
Большинство исследований, направленных на определение поведения менингококков на эпителиальных клетках, проводилось с клетками, которые были культивированы и инфицированы в LCC.Хотя эти исследования предоставили исчерпывающее описание взаимодействия между N. meningitidis и эпителиальными клетками человека, научное сообщество не смогло прийти к согласию по вопросу о том, как и когда менингококки проникают через эпителий носоглотки. Во время инфекций LCC бактерии легко размножаются в среде для культивирования клеток, содержащей аминокислоты, источник углерода и белковые экстракты. Это позволяет N. meningitidis расти и в конечном итоге почти полностью покрывать клеточный слой Calu-3.Когда мы инфицировали клетки Calu-3, культивируемые в AIC в течение 2 недель, мы наблюдали шестикратное уменьшение общего количества КОЕ на фильтр через 24 часа после заражения. Бактерии в основном были обнаружены в слизи, где они организовывались в небольшие группы живых и умирающих менингококков. Как следствие, бактерии редко взаимодействуют с человеческими клетками, и мы почти не обнаружили N. meningitidis в прямом контакте с плазматической мембраной этих клеток. Ввиду этого результата мы спросили, может ли N. meningitidis пересекать эпителиальный слой, выращенный в AIC.После инфицирования клеток, культивируемых на мембранах с размером пор 3 мкм, мы обнаружили бактерии в базальной камере только в двух лунках из восьми для самого высокого посевного материала (10 4 КОЕ) и отсутствия загрязненных камер для самого низкого уровня (10 2 КОЕ). Затем мы обрабатывали клетки Calu-3 IL-4 или IL-13, двумя цитокинами, которые вызывают снижение TEER и индуцируют выработку слизи, в течение 24 часов (44). Как и ожидалось, эти два цитокина привели к снижению TEER. Однако это не сопровождалось увеличением транслокации бактерий через эпителиальный слой.Все эти результаты свидетельствуют о том, что наблюдаемый в этом эксперименте обход был только стохастическим и, вероятно, из-за неоднородности слоя слизи на поверхности лунок. Чтобы поддержать эту гипотезу, мы никогда не наблюдали менингококки штамма 2C4.3, внутри или вне клеток, а также вблизи пористой мембраны. Тем не менее, будет интересно оценить поведение других изолятов N. meningitidis, особенно штаммов других серотипов, таких как MC58 или Z5463.
Эти результаты позволяют предположить, что N.meningitidis, растущий в слизи эпителиальных клеток, не изменял эпителиальный слой в ходе эксперимента. Поэтому мы изучили продукцию цитокинов эпителиальными клетками, выращенными в AIC или LLC. Примечательно, что мы наблюдали, что три основных воспалительных цитокина (IL-6, TNF-α и IL-1β) вырабатывались меньше во время инфекции при AIC, чем при LCC. Два противовоспалительных цитокина, ИЛ-10 и ИЛ-4, также вырабатывались меньше после инфицирования, что свидетельствует об общем снижении цитокинового ответа во время инфекции при АИК.Однако после инфицирования клетки Calu-3 секретировали IL-12 и IFN-γ в одинаковой степени независимо от того, были ли они инфицированы в AIC или LCC. Известно, что IFN-γ и IL-12 связаны с ответами макрофагов и дендритных клеток, хотя есть доказательства того, что эпителиальные клетки продуцируют эти цитокины после заражения микробами (46, 47). IFN-γ оказывает плейотропное действие на эпителиальные клетки дыхательных путей. Было показано, что этот цитокин снижает экспрессию MUC5AC, что может привести к снижению барьерных свойств дыхательной слизи (48).Между тем, IFN-γ индуцирует экспрессию рецепторов CEACAM (49), которые являются рецепторами менингококкового адгезина Opa, который, как известно, участвует в интернализации бактерий. И наоборот, IFN-γ может способствовать барьерной функции эпителиальных клеток легких (44). Наконец, мы не обнаружили секрецию IL-8 после инфицирования клеток Calu-3. В нашем цитокиновом анализе клетки, культивируемые AIC, обычно были менее реактивными, чем клетки, культивированные в LCC, что указывает на то, что слой слизи, вероятно, защищает клетки и сохраняет связанные с патогенами молекулярные структуры, что приводит к снижению врожденного иммунного ответа.Однако наша модель, которая не включала иммунные клетки, дает лишь частичный обзор врожденного иммунного ответа в носоглотке.
Мы наблюдали, что экспрессия факторов вирулентности N. meningitidis варьировалась в зависимости от статуса роста и что три гена вирулентности pilE , mtrC и fhbp значительно подавлялись во время инфекции при AIC. Экспрессия pilE во время инфекции в модели AIC оказалась аналогичной экспрессии, наблюдаемой во время стационарной фазы роста в жидкой культуре.Это коррелировало с отсутствием роли пилей типа IV во время колонизации клеток Calu-3. Хотя большинство штаммов менингококков, обнаруженных in vivo , были пилитированными, роль пилей типа IV во время роста в слизи, вероятно, не была связана с подвижностью и / или взаимодействием с эпителиальными клетками. Однако мы не могли исключить взаимодействие пилей IV типа с муцинами. Напротив, экспрессия fhbp во время заражения в AIC была резко снижена по сравнению с экспоненциальной и стационарной фазой роста в бульоне.Интересно, что fHBP (белок, связывающий фактор H) является ключевым фактором вирулентности N. meningitidis (50), необходимым для связывания с человеческим фактором H, и который ингибирует альтернативный путь комплемента хозяина. Роль fHBP в дыхательных путях не ясна. Хотя дыхательная слизь содержит компоненты комплемента (51, 52), бактерицидная активность комплемента четко не определена против N. meningitidis. Например, акапсулированные штаммы регулярно выделяют мазками, тогда как активная система комплемента должна устранить эти штаммы.Поэтому неудивительно наблюдать отсутствие регуляции экспрессии гена ctrA между различными тестируемыми условиями. Основываясь на наших результатах и в контексте вакцины MenB, может быть важным дальнейшее исследование экспрессии fhbp в контексте респираторной слизи. Наконец, мы показали, что lbpA , tbpA и особенно fetA были высоко экспрессированы в AIC, подтверждая низкую концентрацию свободного железа в этой модели.
Носоглотка колонизирована шестью основными родами: Haemophilus , Streptococcus , Moraxella , Staphylococcus , Alloiococcus и Corynebacterium 41126. Влияние микробиоты на рост, выживаемость и экспрессию фактора вирулентности N. meningitidis пока не известно. Здесь мы использовали модель AIC, чтобы рассмотреть влияние колонизации на рост N. meningitidis двух из этих бактерий, Streptococcus mitis или Moraxella catarrhalis, которые являются типичными колонизаторами носоглотки человека (39–41).Мы коинфицировали клетки Calu-3 с S. mitis или M. catarrhalis и менингококками. Интересно, что мы наблюдали, что S. mitis способствовал росту менингококков через 24 часа после заражения. Такой результат не ожидался, поскольку известно, что пируватоксидаза (SpxB) из Streptococcaceae продуцирует большое количество перекиси водорода и подавляет рост N. meningitidis в бульоне (53). Okahashi et al. показали, что S. mitis также экспрессирует SpxB, который может быть вредным для клеток Calu-3 (54). Поэтому мы изучили рост менингококков, выращенных совместно с S.mitis в бульоне (см. рис. S4 в дополнительном материале). Как описано, высокое соотношение S. mitis убило менингококки, тогда как соотношение 1 S. mitis на 10 N. meningitidis достаточно, чтобы вдвое уменьшить общее количество менингококков после 1 дня совместного культивирования. Напротив, при AIC S. mitis способствует росту N. meningitidis, что позволяет предположить, что S. mitis менее активен против менингококков в условиях AIC. Кроме того, наш гликомический анализ показал, что S. mitis способен гидролизовать O-гликаны муцина, тогда как N.meningitidis — нет. Это было ожидаемо, поскольку известно, что S. mitis экспрессирует многие гликозилгидролазы (45). Поскольку сиаловые кислоты высвобождались из O-гликанов, мы оценили, может ли это обеспечить преимущество роста N. meningitidis. Как и ожидалось, менингококки не могли расти в присутствии сиаловой кислоты в качестве единственного источника углерода в бульоне, и добавления сиаловой кислоты в слизь клеток Calu-3 было недостаточно для усиления роста менингококков (данные не показаны). . Однако можно предположить, что S.mitis может увеличивать концентрацию других питательных веществ, которые могут метаболизироваться N. meningitidis, ингибировать антимикробный пептид или поглощать питательные вещества, которые затем могут метаболизировать N. meningitidis.
В целом, наши результаты показали, что инфицирование продуцирующих слизь клеток в AIC отличается от таковых в обычных экспериментах, проводимых в LCC. В то время как в последних экспериментах изучается взаимодействие N. meningitidis с эпителиальными клетками, которое, вероятно, происходит после значительного воспаления или механического повреждения слизистого слоя, в нашем настоящем исследовании подчеркивается, что N.meningitidis определенно задерживается в слое слизи и редко взаимодействует с клетками человека, в то время как реакция хозяина менее выражена. Потребуется дальнейшая работа, чтобы лучше понять, как N. meningitidis регулирует свои факторы вирулентности и сожительствует с другими видами бактерий в слизи.
МАТЕРИАЛЫ И МЕТОДЫ
Бактериальные штаммы и условия роста. В этом исследовании использовались Neisseria meningitidis NEM 8013 (2C4.3), капсулированный штамм серогруппы C с пилилированной капсулой и его изогенный неадгезивный мутант с дефектом PilE (Δ pilE ) (27). ).
Штамм Streptococcus mitis B26E10 (обозначенный как 0902 230473 в коллекции Necker Hospital) и штамм Moraxella catarrhalis B18F4 (обозначенный как B18F4 в коллекции Necker Hospital) были изолированы от пациента в больнице Necker (Париж). За исключением штамма S. mitis, выращенного на чашках поливитекса с шоколадным агаром, все штаммы выращивали на чашках с агаром для инфузии мозга (BHI) с добавлением 5% лошадиной сыворотки при 37 ° C в инкубаторе с 5% CO 2 . Были использованы следующие антибиотики и концентрации: канамицин 100 мкг / мл, ванкомицин 20 мкг / мл и полимиксин 15 мкг / мл.
Клеточная культура. Эпителиальные клетки Calu-3 (ATCC HTB-55) поддерживали в среде optiMEM (Life Technologies) с добавлением 5% фетальной бычьей сыворотки, HEPES, минимального раствора аминокислот и антибиотиков пенициллин-стрептомицин. Клетки выращивали в инкубаторе с 5% CO 2 при 37 ° C. Клетки выращивали на полиэфирном мембранном фильтре для культивирования клеток с порами 0,4 мкм (Transwell; Corning). Для анализов прохождения использовали мембраны с порами 3 мкм. Перед посевом клеток мембраны фильтра были покрыты коллагеном плаценты человека IV типа (Sigma) в течение 24 часов.Клетки (3 × 10 5 ) высевали на апикальную сторону мембран и поддерживали в 200 мкл культуральной среды в апикальной камере и 1,2 мл в базальной камере. В условиях культивирования с воздушным интерфейсом (AIC) апикальную культуральную среду удаляли через 5 дней, и клеткам позволяли расти на воздушной границе в течение 3-6 дней (неделя 0) или в течение 14-17 дней (неделя 2), когда слизь был равномерно распределен по поверхности слоев клеток. Толщину слизи оценивали на репрезентативных конфокальных изображениях и анализировали с помощью ImageJ.Покрытые жидкостью слои засевали и культивировали от 14 до 17 дней, как описано выше, за исключением того, что апикальная среда сохранялась все время. Трансэпителиальное электрическое сопротивление (TEER) в культуре с воздушным интерфейсом измеряли с помощью вольтметра Millicell (Millipore). Примечательно, что барьерная функция клеточного слоя Calu-3, который был выращен на мембране с размером пор 3 мкм, была снижена, на что указывает измерение трансэпителиального электрического сопротивления (TEER 357 ± 19,83 Ом / см 2 с использованием 0 .Мембрана с размером пор 4 мкм; 258 ± 14,63 Ом / см 2 с использованием мембраны с порами 3 мкм) (см. Рис. S3C в дополнительном материале). Мы подсчитали, что клетки Calu-3 точно представляют клетки носоглотки, сравнивая профили гликозилирования слизи клеток Calu-3 и носовой слизи от человека-донора. Мы сравнили репертуар гликозилирования муцинов, секретируемых либо клетками Calu-3, либо слизистой оболочкой носа человека ( n = 5 доноров), чтобы продемонстрировать, что основные O-гликаны, переносимые обоими наборами муцинов, аналогичны (см. Таблицу S2 в дополнительном документе). материал).
Инфекция. (i) Инфекция N. meningitidis. За два дня до заражения антибиотики были удалены из питательной среды. В день инфицирования суспензию бактерий из ночной культуры на чашке с агаром разбавляли до бактериальной концентрации 5 × 10 7 КОЕ / мл и культивировали в течение 2 ч при 37 ° C в среде optiMEM. Культуральные клетки с воздушным интерфейсом инфицировали на апикальной стороне 10 мкл бактериальной суспензии, содержащей 10 6 КОЕ на 10 мкл, если не указано иное.На следующий день клетки собирали соскабливанием и тщательно встряхивали, а затем подсчитывали КОЕ, высевая серийные разведения на чашки с агаром. Тот же протокол применялся для инфекций на границе раздела жидкостей, за исключением того, что использовался объем 200 мкл бактериальной суспензии (10 6 КОЕ на 200 мкл). Чтобы отделить бактерии, присутствующие во фракции внешней слизи или во фракции прикрепленной к клеткам слизи, раствор optiMEM-0,1% N-ацетилцистеина инкубировали в течение 15 минут над клетками и собирали.Этот процесс повторяли три раза, и подсчитывали КОЕ во фракции внешней слизи путем посева на чашки серийных разведений. Затем для фракции прикрепленной к клеткам слизи клетки соскабливали, собранные клетки встряхивали и бактериальную нагрузку оценивали путем высева на чашки КОЕ.
(ii) Анализ трансмиграции. За день до инфицирования бактериями интерлейкин-4 (IL-4) и интерлейкин-13 (IL-13) человека были добавлены в базальную камеру клеток Calu-3, культивированных в AIC, при концентрации 5 нг / мл каждый.Среду заменяли непосредственно перед инфицированием и добавляли IL-4 или IL-13. Через 4 и 24 часа после инфицирования среду из базальных камер, содержащую необработанные или обработанные клетки, собирали и центрифугировали. Осадки ресуспендировали в 200 мкл и серийные разведения культивировали на чашках с агаром.
(iii) Коинфекция и сокультура. В день 0 штаммы S. mitis или M. catarrhalis, выращенные на чашках с агаром в течение ночи, ресуспендировали в среде optiMEM и культивировали в среде optiMEM в течение 2–3 часов при 37 ° C.После достижения фазы экспоненциального роста клетки Calu-3, выращенные в течение 2 недель в AIC, инфицировали 10 мкл бактериальной суспензии, содержащей 1 × 10 5 КОЕ. Для контрольных фильтров поверх клеток добавляли 10 мкл стерильной среды. Мы также инфицировали клетки инактивированными нагреванием S. mitis, кипяченными в течение 5 мин при 95 ° C. В день 1 контрольный и инфицированный фильтры инфицировали 1 × 10 6 штамма N. meningitidis 2C4.3, как описано ранее. На 2 день бактерии собирали соскабливанием и культивировали на чашках с селективной средой с агаром.Штамм 2C4.3 был выбран на ванкомицине (20 мкг / мл) при совместном культивировании с S. mitis и на полимиксине (15 мкг / мл) при совместном культивировании с M. catarrhalis. Во время анализа клетки инкубировали при 37 ° C в инкубаторе с 5% CO 2 .
Иммунофлуоресцентный анализ. (i) Фиксированные ячейки. Для иммунофлуоресцентных анализов клетки Calu-3 выращивали в AIC и инфицировали в течение 24 часов. Фильтры фиксировали 4% параформальдегидом в течение 1 ч при комнатной температуре, дважды промывали фосфатно-солевым буфером (PBS) и в течение 10 мин повышали проницаемость с помощью PBS-0.1% Triton X-100 и 10 мин в PBS − 0,1% бычьего сывороточного альбумина (BSA) −0,1% X-100 Triton (окрашивающий буфер). Затем клетки инкубировали с анти-N. meningitidis штамм 2C4.3 (анти-2C4.3) (и моноклональное антитело против MUC5AC (клон 45M1; Life Technologies) в буфере для окрашивания в течение 2 ч. После трех промывок в PBS фильтры инкубировали с вторичным конъюгированным с Alexa Fluor вторичным антитела в течение 2 ч. Ядерную ДНК и актин окрашивали 4 ‘, 6’-диамидино-2-фенилиндолом (DAPI) в концентрации 1 мкг / мл и фаллоидином, конъюгированным с Alexa Fluor (Invitrogen), соответственно.После нескольких промывок мембраны были вырезаны из пластиковой основы, и покровные стекла были помещены в Mowiol для наблюдения.
(ii) Живые клетки. Поскольку слизь не может быть легко сохранена посредством фиксации, ее образование с течением времени контролировалось путем визуализации живых клеток, меченных декстраном, конъюгированным с Alexa Fluor, в концентрации 1 мг / мл (молекулярная масса [MW] 10 000; Life Technologies) и клеточных следов. Кальцеин Red Orange AM в концентрации 2,5 мкМ (Life Technologies) использовали для окрашивания эпителия.Клеточный индикатор добавляли в базальную камеру на 1 ч, а раствор декстрана добавляли поверх клеток. Оба раствора были удалены и промыты перед конфокальной съемкой. Во время сбора клетки поддерживались при 37 ° C и 5% CO 2 .
Анализ изображения. Для трехмерной (3D) реконструкции получение изображения выполняли на лазерном сканирующем конфокальном микроскопе (Leica TCS SP5). Изображения флуоресцентной микроскопии были собраны и обработаны с использованием программного обеспечения Leica Application Suite AF Lite.Каждый канал был настроен для лучшей визуализации. Трехмерная реконструкция, изображения z-стека и анализ после лечения были выполнены с использованием программного обеспечения Imaris. Анализ толщины слизи проводился с помощью ImageJ.
Электронная микроскопия. (i) Химические вещества. Кристаллический четырехокись осмия (OsO 4 ), какодилат натрия, 25% глутаральдегид и Epon были от Euromedex (Суффельвейерсхайм, Франция). Гексаметилдисилазан (HMDS) был от Sigma-Aldrich (Лион, Франция). Перфторсодержащее соединение FC-72 было от Fisher Scientific (Illkirch, Франция).
(ii) Процедуры. Все инкубации проводили при комнатной температуре. Целые вставки фиксировали в 1% OsO 4 , разведенном в FC-72 в течение 90 минут, промывали в FC-72 в течение 30 минут и фиксировали в 2,5% глутаральдегиде, разведенном в 0,1 М буфере какодилата натрия (pH 7,4), в течение 90 минут. Затем вставки промывали в какодилатном буфере (дважды по 30 мин каждый раз) и погружали в растворы этанола с возрастающей концентрацией (30%, 50%, 70%, 95%, 100%, 100% и 100% на 10 минут. каждый раз) на обезвоживание.Для сканирующей электронной микроскопии (SEM) обезвоживание завершали погружением в HMDS-этанол (1/1, об. / Об.) На 10 мин и в HMDS на 10 мин. После сушки на воздухе в течение ночи каждый фильтр извлекали из вставки с помощью небольшого лезвия скальпеля, помещали на кусок двусторонней липкой ленты на алюминиевом штыре и распылением покрывали Au / Pd. Изображения были получены с использованием JEOL LV6510 (JEOL, Круасси-сюр-Сен, Франция). Для просвечивающей электронной микроскопии (ПЭМ) вставки погружали в смесь Epon-этанол с возрастающей концентрацией Epon (1/3 в течение 60 минут, 1/1 в течение 60 минут, 3/1 в течение ночи) и, наконец, в чистый Epon (меняли дважды. через 48 ч).Каждый фильтр вынимали из вставки и помещали в капсулу для заливки ячейками вниз. После полимеризации смолы (2 часа при 37 ° C, а затем 72 часа при 60 ° C) блок разделяли на секции, чтобы получить секции клеточного слоя. Ультратонкие срезы (80 нм) окрашивали цитратом свинца и исследовали в JEOL 100S (JEOL, Croissy-sur-Seine, Франция) при ускоряющем напряжении 80 кВ. Живые бактерии были определены как круглые и электронно-плотные клетки.
Анализ осушения. Слизь была извлечена из клеток Calu-3, культивированных в AIC в течение 2 недель с использованием 0.2% β-меркаптоэтанол, разбавленный optiMEM (среда для сбора). Среду для сбора добавляли поверх клеток Calu-3 на 20 мин и собирали в чистую пробирку. Этот шаг повторяли трижды. Затем слизь или свежую среду для сбора (в качестве контроля) наносили в лунки для чистых культур клеток и сушили в течение ночи под вытяжным шкафом с ламинарным потоком. На следующий день высушенную слизь или контрольную среду инфицировали в течение 24 часов 5 × 10 6 бактерий в 100 мкл среды для культивирования клеток. Это позволяет бактериям оседать и образовывать биопленку на дне колодца.На следующий день культуральные супернатанты осторожно удаляли и осажденные бактерии подвергали сушке в течение 0, 30, 60 и 120 минут в вытяжном шкафу с ламинарным потоком. Бактерии собирали и подсчитывали количественным культивированием на чашках с агаром.
Количественная ПЦР с обратной транскрипцией (ОТ-ПЦР). (i) Выделение РНК. Тотальную РНК выделяли из N. meningitidis, культивированного при 37 ° C в среде optiMEM в течение 3 часов (экспоненциальная фаза роста) или в течение ночи (стационарная фаза), или из инфицированных клеток (AIC или LCC [культура, покрытая жидкостью]) через 24 часа.В этих четырех условиях бактерии осаждали центрифугированием на максимальной скорости в микроцентрифуге в течение 2 минут и быстро ресуспендировали в холодном растворе TRIzol.
Образцы замораживали и хранили при –80 ° C. Затем образцы обрабатывали хлороформом, собирали водную фазу и использовали ее в протоколе очистки RNeasy (Qiagen). Образцы РНК инкубировали с турбо-ДНКазой (Invitrogen) в течение 1 ч при 37 ° C перед очисткой на мини-колонке RNeasy. Элюцию РНК проводили в воде, свободной от нуклеаз, и перед хранением добавляли 1 мкл rRNasin (Promega).
(ii) Ретранскрипция. реакций синтеза кДНК проводили с использованием набора Lunascript RT Supermix (NEB), и для каждой реакции использовали 500 нг РНК.
(iii) Метод количественной ОТ-ПЦР. Реакционная смесь объемом 20 мкл состояла из 10 мкл Luna Universal qPCR Master Mix, 0,5 мкл 10 мкМ каждого праймера, 1 мкл кДНК и 8 мкл воды, свободной от нуклеаз. Пары праймеров были созданы с помощью программы Primer3Plus. Уровни экспрессии гена были нормализованы по уровню экспрессии гена домашнего хозяйства мкг / г (NMV_1606).Соответствующие контроли без RT были проведены для обеспечения точности результатов.
Количественный анализ цитокинов. (i) Подготовка проб. клеток Calu-3 выращивали на Transwells либо в AIC, либо в LCC в течение 2 недель. Для AIC клетки инкубировали при 37 ° C в течение 20 мин со 100 мкл раствора Рингера и собирали апикальные супернатанты. Этот этап повторяли один раз, и образцы хранили на льду. Для культуры, покрытой жидкостью, в апикальной камере собирали 100 мкл среды, а клетки промывали еще одним объемом 100 мкл среды optiMEM.Все образцы встряхивали и центрифугировали при 4 ° C в течение 5 минут на максимальной скорости для удаления бактерий и мусора. Супернатанты собирали, мгновенно замораживали в жидком азоте и хранили при –80 ° C перед обработкой.
(ii) Измерение цитокинов. Цитокинов в клеточных супернатантах определяли количественно с помощью наборов для электрохемилюминесцентного мультиплексного анализа от Meso Scale Discovery (Rockville, MD, USA). Вкратце, 25 мкл супернатанта добавляли в каждую лунку 96-луночных многоточечных планшетов, и анализы выполняли в соответствии с инструкциями производителя.Планшеты считывали на мультиплексоре Sector S600 (Meso Scale Discovery). Все образцы были измерены в двух экземплярах.
Анализ гликозилирования муцина. (i) Выделение и очистка муцинов, секретируемых клетками Calu-3. Клетки солюбилизировали в 4 М буфере восстановления гуанидинхлорида, содержащем 10 мМ дитиотреитола (DTT), 5 мМ ЭДТА, 10 мМ бензамидин, 5 мМ N -этилмалеимид, 0,1 мг / мл ингибитора трипсина сои и 1 мМ фенилметансульфонилфторид. В каждую апикальную камеру добавляли два миллилитра восстанавливающего буфера и инкубировали в течение ночи при комнатной температуре.Затем клеточные суспензии осторожно перемешивали пипеткой, и каждую из пяти суспензий фильтра для каждого условия объединяли в одну аликвоту. CsCl добавляли до начальной плотности 1,4 г / мл, и муцины очищали центрифугированием в изопикническом градиенте плотности (ультрацентрифуга Beckman Coulter LE80 K; ротор 70,1 Ti, 417600 × г при 15 ° C в течение 72 часов). Фракции объемом 1 мл собирали со дна пробирки и анализировали на реакционную способность и плотность по периодической кислоте Шиффа (PAS). Фракции, содержащие муцин, объединяли, диализовали против воды и лиофилизировали.
(ii) Высвобождение олигосахаридов из муцина путем обработки щелочным борогидридом. муцинов подвергали β-элиминированию в восстановительных условиях (0,1 М КОН и 1 М KBH 4 в течение 24 часов при 45 ° C), и смесь олигосахаридных альдитов сушили на роторном испарителе (Buchi) при 45 ° C. Соли бората удаляли несколькими совместными испарениями с метанолом перед очисткой с помощью катионообменной хроматографии (Dowex 50 × 2, 200-400 меш, Н + форма).
(iii) Анализ перметилирования и гликозилирования муцина с помощью MALDI-TOF MS. Перметилирование смеси олигосахаридных альдитов проводили методом гидроксида натрия Чукану и Керека (55). После дериватизации продукты реакции растворяли в 200 мкл метанола и дополнительно очищали на колонке C 18 Sep-Pak (Waters, Milford, MA). Перметилированные олигосахариды анализировали с помощью матричной лазерной десорбции-ионизации-времяпролетной масс-спектрометрии (MALDI-TOF MS) в режиме отражения положительных ионов как [M + Na] + .Количественную оценку через относительный процент каждого олигосахарида рассчитывали на основе интегрирования пиков на спектрах МС.
Статистика. Статистический анализ проводился с использованием программного обеспечения GraphPad Prism 8. В этом исследовании использовался односторонний дисперсионный анализ (ANOVA), тест Стьюдента t или U-критерий Манна-Уитни. В случаях неравной дисперсии вместо одностороннего дисперсионного анализа применяли дисперсионный анализ Уэлча. P Значения <0,05 считались показывающими статистическую значимость.Все изображения, представленные в этой работе, были репрезентативными.
БЛАГОДАРНОСТИ
Мы благодарим Николя Гудена из центра визуализации Института Неккера за его техническую поддержку. Мы благодарим Эммануэль Билле за внимательное чтение рукописи. Мы благодарим Карин Байли из Центра цитометрии и иммунобиологии Института Кочина (CYBIO) за отличную техническую помощь.
Эта работа была поддержана грантами ANR-15-CE15-0002-01. X.N. и M.C. также поддерживаются INSERM, CNRS, Université de Paris и Fondation pour la Recherche Médicale.C.R.-M. был поддержан исследовательской федерацией FRABio (Université de Lille, CNRS, FR 3688, FRABio, Biochimie Structurale et Fonctionnelle des Assemblages Biomoléculaires), CNRS (Unité Mixte de Recherche CNRS / ULille 8576) и Ministère de l’Enseignement de Supériement la Recherche.
- Авторские права © 2019 Audry et al.
Адаптация Pseudomonas aeruginosa в носоглоточном резервуаре приводит к миграции и сохранению в легких
King, P.Т., Холдсворт, С. Р., Фризер, Н. Дж., Вильянуева, Э. и Холмс, П. В. Последующее микробиологическое исследование бронхоэктазов у взрослых. Респир. Med. 101 , 1633–1638 (2007).
Артикул PubMed Google ученый
Либерман Д. и Либерман Д. Псевдомонадные инфекции у пациентов с ХОБЛ: эпидемиология и лечение. Am. J. Respir. Med. 2 , 459–468 (2003).
Артикул PubMed Google ученый
Lyczak, J.Б., Кэннон, С. Л. и Пьер, Г. Б. Инфекции легких, связанные с кистозным фиброзом. Clin. Microbiol. Ред. 15 , 194–222 (2002).
CAS Статья PubMed PubMed Central Google ученый
Харт, К. А. и Уинстенли, К. Стойкие и агрессивные бактерии в легких у детей с муковисцидозом. Br. Med. Бык. 61 , 81–96 (2002).
Артикул PubMed Google ученый
Ян, Л.и другие. Эволюционная динамика бактерий в среде хозяина человека. Proc. Natl Acad. Sci. США 108 , 7481–7486 (2011).
ADS CAS Статья PubMed Google ученый
Mowat, E. et al. Популяционное разнообразие и круговорот Pseudomonas aeruginosa при хронических инфекциях кистозного фиброза. Am. J Respir. Med. 183 , 1674–1679 (2011).
Артикул Google ученый
Фотергилл, Дж.Л., Моват, Э., Ледсон, М. Дж., Уолшоу, М. Дж. И Уинстенли, С. Колебания фенотипов и генотипов в популяциях синегнойной палочки в легких при муковисцидозе во время обострений легких. J. Med. Microbiol. 59 , (Pt 4): 472–481 (2010).
CAS Статья PubMed Google ученый
Li, Z. et al. Продольное развитие инфекции слизистой оболочки Pseudomonas aeruginosa и прогрессирование заболевания легких у детей с муковисцидозом. JAMA 293 , 581–588 (2005).
CAS Статья PubMed Google ученый
Lillquist, Y. P., Cho, E. & Davidson, A. G. Экономические эффекты протокола ликвидации первого появления Pseudomonas aeruginosa у пациентов с муковисцидозом: 1995 по сравнению с. 2009. J. Cyst. Фиброз 10 , 175–180 (2011).
Артикул Google ученый
Годой, Дж.М., Годой, А. Н., Рибалта, Г. и Ларго, И. Бактериальный образец при хроническом синусите и муковисцидозе. Отоларингология 145 , 673–676 (2011).
Артикул Google ученый
Шапиро, Э. Д., Милмо, Г. Дж., Уолд, Э. Р., Роднан, Дж. Б. и Боуэн, А. Д. Бактериология верхнечелюстных пазух у пациентов с муковисцидозом. J. Infect. Dis. 146 , 589–593 (1982).
CAS Статья PubMed Google ученый
Хансен, С.K. et al. Эволюция и диверсификация Pseudomonas aeruginosa в придаточных пазухах носа у детей с муковисцидозом имеет последствия для хронической легочной инфекции. ISME J 6 , 31–45 (2012).
Артикул PubMed Google ученый
Muhlebach, M. S. et al. Являются ли посевы из нижних дыхательных путей или глотки предикторами бактериологии пазух при муковисцидозе? Pediatr. Пульмонол. 41 , 445–451 (2006).
Артикул PubMed Google ученый
Aanaes, K. et al. Снижение давления кислорода в слизистой оболочке верхнечелюстных пазух у пациентов с муковисцидозом. J. Cyst. Фиброз 10 , 114–120 (2011).
Артикул Google ученый
Bragonzi, A. Мышиные модели острой и хронической легочной инфекции возбудителями муковисцидоза. Внутр. J. Med. Microbiol. 300 , 584–593 (2010).
Артикул PubMed Google ученый
Fothergill, J. L., Walshaw, M. J. и Winstanley, C. Трансмиссивные штаммы Pseudomonas aeruginosa при муковисцидозе легких. Eur. Респир. J. 40 , 227–238 (2012).
Артикул PubMed Google ученый
Аль-Алул, М.и другие. Повышенная заболеваемость, связанная с хронической инфекцией, вызванной эпидемическим штаммом Pseudomonas aeruginosa у пациентов с МВ. Грудь 59 , 334–336 (2004).
CAS Статья PubMed PubMed Central Google ученый
Carter, M. E. et al. Подтип эпидемического штамма муковисцидоза Pseudomonas aeruginosa демонстрирует повышенную вирулентность на мышиной модели острой респираторной инфекции. J. Infect. Dis. 202 , 935–942 (2010).
Артикул PubMed Google ученый
Эндрюс, Дж. М. Стандартизированный метод тестирования дисковой чувствительности BSAC (версия 8). J. Antimicrob. Chemother. 64 , 454–489 (2009).
CAS Статья PubMed Google ученый
Jeukens, J. et al. Сравнительная геномика изолятов эпидемического штамма Pseudomonas aeruginosa , ассоциированного с хроническими инфекциями легких у пациентов с муковисцидозом. PLoS ONE 9 , e87611 (2014).
ADS Статья PubMed PubMed Central Google ученый
Кукавица-Ибрулдж, И. и Левеск, Р.С. Животные модели хронической легочной инфекции, вызванной Pseudomonas aeruginosa : полезные инструменты для исследований кистозного фиброза. Lab. Anim. 42 , 389–412 (2008).
CAS Статья PubMed Google ученый
Hoffmann, N.и другие. Новая мышиная модель хронической инфекции легких Pseudomonas aeruginosa , имитирующей кистозный фиброз. Заражение. Иммун. 73 , 2504–2514 (2005).
CAS Статья PubMed PubMed Central Google ученый
Wu, H. et al. Обнаружение N-ацилгомосериновых лактонов в тканях легких мышей, инфицированных Pseudomonas aeruginosa . Microbiology 146 , (Pt 10): 2481–2493 (2000).
CAS Статья PubMed Google ученый
Holzmann, D. et al. Эффекты хирургии носовых пазух у пациентов с муковисцидозом после трансплантации легких: 10-летний опыт. Трансплантация 77 , 134–136 (2004).
Артикул PubMed Google ученый
Дигой, Г. П., Данн, Дж. Д., Стоунер, Дж. А., Кристи, А. и Джонс, Д.Т. Бактериология придаточных пазух носа у детей с муковисцидозом. Внутр. J. Pediatr. Оториноларингол. 76 , 934–938 (2012).
Артикул PubMed Google ученый
Johansen, H. K. et al. Колонизация и инфицирование придаточных пазух носа у пациентов с муковисцидозом сопровождается снижением ответа PMN. J. Cyst. Фиброз 11 , 525–531 (2012).
CAS Статья Google ученый
Аанаес, К.и другие. Секреторный IgA как инструмент диагностики Pseudomonas aeruginosa респираторной колонизации. J. Cyst. Фиброс. 12 , 81–87 (2013).
CAS Статья PubMed Google ученый
Zhao, K. Q. et al. Присущие различия в функции ресничек носа и трахеи в ответ на заражение Pseudomonas aeruginosa . Am. J. Rhinol. Аллергия 25 , 209–213 (2011).
Артикул PubMed Google ученый
Ciofu, O. et al. P. aeruginosa в придаточных пазухах носа и трансплантированных легких имеет аналогичные адаптивные мутации, как и изоляты из хронически инфицированных легких CF. J. Cyst. Фиброс. 12 , 729–736 (2013).
Артикул PubMed Google ученый
Кадиоглу А., Вайзер Дж.Н., Патон, Дж. С. и Эндрю, П. В. Роль факторов вирулентности Streptococcus pneumoniae в респираторной колонизации и болезни хозяина. Nat. Rev. Microbiol. 6 , 288–301 (2008).
CAS Статья Google ученый
Хаксли, Э. Дж., Вирослав, Дж., Грей, У. Р. и Пирс, А. К. Глоточная аспирация у здоровых взрослых и пациентов с подавленным сознанием. Am. J. Med. 64 , 564–568 (1978).
CAS Статья PubMed Google ученый
Mainz, J. G. et al. Синоназальная персистенция Pseudomonas aeruginosa после трансплантации легкого. J. Cyst. Фиброс. 11 , 158–161 (2012).
CAS Статья PubMed Google ученый
Hogardt, M. & Heesemann, J. Адаптация Pseudomonas aeruginosa во время персистирования при муковисцидозе легких. Внутр. J. Med. Microbiol. 300 , 557–562 (2010).
CAS Статья PubMed Google ученый
Hoiby, N. et al. Клиническое влияние бактериальных биопленок. Внутр. J. Oral. Sci. 3 , 55–65 (2011).
Артикул PubMed PubMed Central Google ученый
Де Киевит, Т. Р., Гиллис, Р., Маркс, С., Brown, C. & Iglewski, B.H. Гены, воспринимающие кворум, в биопленках Pseudomonas aeruginosa : их роль и паттерны экспрессии. Заявл. Environ. Microbiol. 67 , 1865–1873 (2001).
CAS Статья PubMed PubMed Central Google ученый
Bragonzi, A. et al. Безмукоидная Pseudomonas aeruginosa экспрессирует альгинат в легких пациентов с муковисцидозом и на мышиной модели. J. Infect. Dis. 192 , 410–419 (2005).
Артикул PubMed PubMed Central Google ученый
Worlitzsch, D. et al. Эффекты снижения концентрации кислорода слизи в дыхательных путях. Pseudomonas Инфекции пациентов с муковисцидозом. J. Clin. Вкладывать деньги. 109 , 317–325 (2002).
CAS Статья PubMed PubMed Central Google ученый
Потвин, Э.и другие. Функциональная геномика in vivo Pseudomonas aeruginosa для высокопроизводительного скрининга новых факторов вирулентности и антибактериальных мишеней. Environ. Microbiol. 5 , 1294–1308 (2003).
CAS Статья PubMed Google ученый
Хаусслер, С. и Парсек, М. Р. Биопленки 2009: новые перспективы в основе микробных сообществ, связанных с поверхностью. J. Bacteriol. 192 , 2941–2949 (2010).
Артикул PubMed PubMed Central Google ученый
Colvin, K. M. et al. Полисахариды Pel и Psl обеспечивают структурную избыточность Pseudomonas aeruginosa в матрице биопленки. Environ. Microbiol. 14 , 1913–1928 (2012).
CAS Статья PubMed Google ученый
Head, N. E. & Yu, H. Поперечный анализ клинических и экологических изолятов Pseudomonas aeruginosa : образование биопленок, вирулентность и разнообразие генома. Заражение. Иммун. 72 , 133–144 (2004).
CAS Статья PubMed PubMed Central Google ученый
Hoffman, L.R. et al. Доступность питательных веществ как механизм отбора устойчивых к антибиотикам Pseudomonas aeruginosa в дыхательных путях при МВ. PLoS Pathog. 6 , e1000712 (2010).
Артикул PubMed PubMed Central Google ученый
Снайдер Л.A. et al. Эпидемиологическое расследование изолятов Pseudomonas aeruginosa в результате шестилетней больничной вспышки с использованием высокопроизводительного полногеномного секвенирования. евро Surveill. 18 , pii: 20611 (2013).
Артикул Google ученый
Марвиг, Р. Л., Йохансен, Х. К., Молин, С. и Джелсбак, Л. Анализ генома трансмиссивной линии передачи Pseudomonas aeruginosa выявляет патоадаптивные мутации и различные пути эволюции гипермутаторов. PLoS Genet. 9 , e1003741 (2013).
CAS Статья PubMed PubMed Central Google ученый
Ким Д. и Форст С. Геномный анализ семейства гистидинкиназ у бактерий и архей. Microbiology 147 , (Pt 5): 1197–1212 (2001).
CAS Статья PubMed Google ученый
Чен, Х.Д. и Гройсман, Э. А. Биология двухкомпонентной системы PmrA / PmrB: главный регулятор модификаций липополисахаридов. Ann. Rev. Microbiol. 67 , 83–112 (2013).
CAS Статья Google ученый
Moskowitz, S.M. et al. Мутации PmrB способствуют устойчивости к полимиксину у Pseudomonas aeruginosa , выделенных от пациентов с кистозным фиброзом, леченных колистином. Антимикробный.Агенты Chemother. 56 , 1019–1030 (2012).
CAS Статья PubMed PubMed Central Google ученый
Mulcahy, H., Charron-Mazenod, L. & Lewenza, S. Внеклеточная ДНК хелатирует катионы и индуцирует устойчивость к антибиотикам в биопленках Pseudomonas aeruginosa . PLoS Pathog. 4 , e1000213 (2008).
Артикул PubMed PubMed Central Google ученый
Бернс, Дж.L. et al. Продольная оценка Pseudomonas aeruginosa у маленьких детей с муковисцидозом. J. Infect. Dis. 183 , 444–452 (2001).
CAS Статья PubMed Google ученый
Fothergill, J. L., Upton, A. L., Pitt, T. L., Hart, C. A. и Winstanley, C. Диагностический мультиплексный ПЦР-анализ для идентификации эпидемических штаммов Pseudomonas aeruginosa из Ливерпуля, Мидлендса 1 и Манчестера. J. Cyst. Фиброс. 7 , 258–261 (2008).
CAS Статья PubMed Google ученый
Шах, Х. Как рассчитать размер выборки при исследованиях на животных? Natl J. Physiol. Pharm. Pharmacol. 1 , 35–39 (2011).
Google ученый
Брокхерст М.А., Баклинг А. и Рейни П.Б. Влияние бактериофага на диверсификацию условно-патогенного бактериального патогена, Pseudomonas aeruginosa . Proc. Биол. Sci. 272 , 1385–1391 (2005).
Артикул PubMed PubMed Central Google ученый
Kirchner, S. et al. Использование искусственной среды для мокроты для проверки эффективности антибиотиков против Pseudomonas aeruginosa в условиях, более характерных для муковисцидоза легких. J. Vis. Exp. 64 , e3857 (2012).
Google ученый
Хуанг Дж.и другие. Температурно-зависимая экспрессия phzM и его регуляторных генов lasI и ptsP в ризосферном изоляте Pseudomonas sp. штамм M18. Заявл. Environ. Microbiol. 75 , 6568–6580 (2009).
CAS Статья PubMed PubMed Central Google ученый
Savli, H. et al. Стабильность экспрессии шести генов домашнего хозяйства: предложение для количественных исследований генов устойчивости Pseudomonas aeruginosa с помощью количественной ОТ-ПЦР в реальном времени. J. Med. Microbiol. 52 , (Pt 5): 403–408 (2003).
CAS Статья PubMed Google ученый
Олсон, А. Дж. Перестраиваемые переходы Ландау-Зинера в спин-орбитальном связанном конденсате Бозе-Эйнштейна. Препринт на http: // arXivorg / abs / 13101818 (2013).
Koboldt, D.C. et al. VarScan 2: открытие соматических мутаций и изменений числа копий при раке путем секвенирования экзома. Genome Res. 22 , 568–576 (2012).
CAS Статья PubMed PubMed Central Google ученый
Winsor, G. L. et al. База данных генома Pseudomonas: улучшенные возможности сравнительного анализа и популяционной геномики для геномов Pseudomonas . Nucleic Acids Res. 39 , (выпуск базы данных): D596 – D600 (2011).
ADS CAS Статья Google ученый
Органы и структуры дыхательной системы
Цели обучения
К концу этого раздела вы сможете:
- Перечислите структуры, составляющие дыхательную систему
- Опишите, как дыхательная система обрабатывает кислород и CO 2
- Сравните и сопоставьте функции верхних дыхательных путей и нижних дыхательных путей
Основные органы дыхательной системы функционируют в первую очередь для обеспечения кислородом тканей тела для клеточного дыхания, удаления углекислого газа и поддержания кислотно-щелочного баланса.Части дыхательной системы также используются для выполнения не жизненно важных функций, таких как распознавание запахов, производство речи и напряжение, например, во время родов или кашля.
Рис. 1. Основные респираторные структуры простираются от носовой полости до диафрагмы.
Функционально дыхательную систему можно разделить на проводящую зону и респираторную зону. Проводящая зона дыхательной системы включает органы и структуры, непосредственно не участвующие в газообмене.Газообмен происходит в зоне дыхания .
Проводящая зона
Основными функциями проводящей зоны являются обеспечение маршрута для входящего и выходящего воздуха, удаление мусора и патогенов из входящего воздуха, а также нагрев и увлажнение входящего воздуха. Некоторые структуры в проводящей зоне выполняют и другие функции. Например, эпителий носовых ходов важен для восприятия запахов, а эпителий бронхов, выстилающий легкие, может метаболизировать некоторые переносимые по воздуху канцерогены.
Нос и прилегающие к нему структуры
Основной вход и выход из дыхательной системы — через нос. Говоря о носе, полезно разделить его на две основные части: внешний нос и носовую полость или внутренний нос.
Внешний нос состоит из поверхности и скелетных структур, которые создают внешний вид носа и вносят свой вклад в его многочисленные функции. Корень — это область носа, расположенная между бровями.Переносица — это часть носа, которая соединяет корень с остальной частью носа. Dorsum nasi — это длина носа. Вершина — кончик носа. По обе стороны от верхушки ноздри образованы крыльями (единственное число = ала). Ала — это хрящевая структура, которая образует боковую сторону каждого яруса (множественное число = ноздри) или отверстия ноздри. Желобок — это вогнутая поверхность, которая соединяет верхушку носа с верхней губой.
Рис. 2. На этом рисунке показаны особенности внешнего носа (вверху) и скелетные особенности носа (внизу).
Под тонкой кожей носа скрываются черты его скелета. В то время как корень и переносица состоят из кости, выступающая часть носа состоит из хряща. В результате при взгляде на череп отсутствует нос. Носовая кость — одна из пары костей, лежащих под корнем и переносицей. Носовая кость сочленяется сверху с лобной костью и латерально с верхнечелюстными костями. Септальный хрящ — это гибкий гиалиновый хрящ, соединенный с носовой костью, образующий спинную часть носа.Хрящ крыльев носа состоит из вершины носа; он окружает нарис.
Рисунок 3. Верхние дыхательные пути
Носовые ходы открываются в полость носа, которая разделена носовой перегородкой на левую и правую части. Носовая перегородка образована спереди частью перегородочного хряща (гибкая часть, которую можно коснуться пальцами), а сзади — перпендикулярной пластиной решетчатой кости (черепная кость, расположенная сразу после носовых костей) и тонким сошником. кости (название которых связано с формой плуга).Каждая боковая стенка полости носа имеет три костных выступа, называемых верхней, средней и нижней носовыми раковинами. Нижние раковины — это отдельные кости, тогда как верхняя и средняя раковины — части решетчатой кости. Раковины служат для увеличения площади поверхности носовой полости и нарушения потока воздуха, когда он попадает в нос, заставляя воздух подпрыгивать вдоль эпителия, где он очищается и нагревается. Раковины и проходы также сохраняют воду и предотвращают обезвоживание носового эпителия, задерживая воду во время выдоха.Дно носовой полости состоит из неба. Твердое небо в передней части носовой полости состоит из кости. Мягкое небо в задней части носовой полости состоит из мышечной ткани. Воздух выходит из носовых полостей через внутренние ноздри и попадает в глотку.
Несколько костей, которые помогают формировать стенки носовой полости, имеют воздухосодержащие пространства, называемые придаточными пазухами носа, которые служат для обогрева и увлажнения поступающего воздуха. Пазухи выстланы слизистой оболочкой.Каждая придаточная пазуха названа в честь связанной с ней кости: лобной пазухи, гайморовой пазухи, клиновидной пазухи и решетчатой пазухи. Пазухи выделяют слизь и облегчают вес черепа.
Носовые ходы и передняя часть носовых полостей выстлана слизистыми оболочками, содержащими сальные железы и волосяные фолликулы, которые служат для предотвращения прохождения крупных загрязнений, таких как грязь, через носовую полость. Обонятельный эпителий, используемый для обнаружения запахов, находится глубже в полости носа.
Раковины, носовые ходы и придаточные пазухи выстланы респираторным эпителием, состоящим из псевдостратифицированного мерцательного столбчатого эпителия. Эпителий содержит бокаловидные клетки, одни из специализированных столбчатых эпителиальных клеток, которые производят слизь для улавливания мусора. Реснички респираторного эпителия помогают удалять слизь и мусор из полости носа постоянными толчковыми движениями, перемещая материалы по направлению к горлу для проглатывания. Интересно, что холодный воздух замедляет движение ресничек, что приводит к накоплению слизи, которая в свою очередь может вызвать насморк в холодную погоду.Этот влажный эпителий нагревает и увлажняет поступающий воздух. Капилляры, расположенные непосредственно под эпителием носа, нагревают воздух конвекцией. Серозные клетки и клетки, продуцирующие слизь, также секретируют фермент лизоцим и белки, называемые дефенсинами, которые обладают антибактериальными свойствами. Иммунные клетки, патрулирующие соединительную ткань глубоко в респираторном эпителии, обеспечивают дополнительную защиту.
Рис. 4. Дыхательный эпителий представляет собой псевдостратифицированный мерцательный столбчатый эпителий. Серомукозные железы выделяют смазывающую слизь.LM × 680. (Микрофотография предоставлена Медицинской школой Риджентс Мичиганского университета © 2012)
Просмотрите WebScope Мичиганского университета, чтобы изучить образец ткани более подробно.Глотка
Глотка представляет собой трубку, образованную скелетными мышцами и выстланную слизистой оболочкой, которая проходит через слизистую оболочку носовых полостей. Глотка делится на три основных области: носоглотку, ротоглотку и гортань.
Рис. 5. Глотка делится на три области: носоглотку, ротоглотку и гортань.
Носоглотка примыкает к раковинам носовой полости и служит только дыхательным путем. В верхней части носоглотки находятся глоточные миндалины. Глоточная миндалина, также называемая аденоидом, представляет собой совокупность лимфоидной ретикулярной ткани, похожую на лимфатический узел, расположенный в верхней части носоглотки. Функция глоточной миндалины до конца не изучена, но она содержит богатый запас лимфоцитов и покрыта мерцательным эпителием, который улавливает и уничтожает вторгающиеся патогены, попадающие при вдыхании.Глоточные миндалины у детей большие, но что интересно, с возрастом они регрессируют и могут даже исчезнуть. Язычок представляет собой небольшую выпуклую каплевидную структуру, расположенную на вершине мягкого неба. И язычок, и мягкое небо во время глотания движутся подобно маятнику, качаясь вверх, чтобы закрыть носоглотку, чтобы предотвратить попадание проглоченных материалов в полость носа. Кроме того, слуховые (евстахиевы) трубы, которые соединяются с каждой полостью среднего уха, открываются в носоглотку. В связи с этим простуды часто приводят к ушным инфекциям.
Ротоглотка — это проход как воздуха, так и пищи. Ротоглотка окаймлена сверху носоглоткой, а спереди ротовой полостью. Зев — это отверстие на стыке ротовой полости и ротоглотки. Когда носоглотка становится ротоглоткой, эпителий изменяется с псевдостратифицированного мерцательного столбчатого эпителия на многослойный плоский эпителий. Ротоглотка состоит из двух различных групп миндалин: небных и язычных миндалин. Небная миндалина — одна из пары структур, расположенных латерально в ротоглотке в области зева.Язычная миндалина расположена у основания языка. Подобно глоточной миндалине, небные и язычные миндалины состоят из лимфоидной ткани и улавливают и уничтожают патогены, попадающие в организм через ротовую или носовую полости.
Гортань ниже ротоглотки и кзади от гортани. Он продолжает путь проглоченного материала и воздуха до его нижнего конца, где пищеварительная и дыхательная системы расходятся. Многослойный плоский эпителий ротоглотки переходит в гортань.Спереди гортань открывается в гортань, а сзади — в пищевод.
Гортань
Гортань — это хрящевая структура, расположенная ниже гортани, которая соединяет глотку с трахеей и помогает регулировать объем воздуха, входящего и выходящего из легких. Структура гортани образована несколькими кусочками хряща. Три больших хряща — щитовидный хрящ (передний), надгортанник (верхний) и перстневидный хрящ (нижний) — образуют основную структуру гортани.Щитовидный хрящ — самый большой кусок хряща, из которого состоит гортань. Щитовидный хрящ состоит из выступа гортани, или «адамова яблока», которое обычно более заметно у мужчин. Толстый перстневидный хрящ образует кольцо с широкой задней областью и более тонкой передней областью. Три парных хряща меньшего размера — черпаловидный, роговой и клиновидный — прикрепляются к надгортаннику, голосовым связкам и мышцам, которые помогают двигать голосовые связки для воспроизведения речи.
Рисунок 6.Гортань простирается от гортани и подъязычной кости до трахеи.
Рис. 7. Настоящие голосовые связки и вестибулярные складки гортани просматриваются снизу от гортани.
Надгортанник, прикрепленный к щитовидному хрящу, представляет собой очень гибкий кусок эластичного хряща, закрывающий отверстие трахеи. В «закрытом» положении незакрепленный конец надгортанника упирается в голосовую щель. Голосовая щель состоит из вестибулярных складок, настоящих голосовых связок и пространства между этими складками.Вестибулярная складка, или ложная голосовая связка, — это одна из пары складчатых участков слизистой оболочки. Настоящая голосовая связка — это одна из белых перепончатых складок, прикрепленных мышцами к щитовидной железе и черпаловидным хрящам гортани на их внешних краях. Внутренние края настоящих голосовых связок свободны, что позволяет вибрациям производить звук. Размер перепончатых складок настоящих голосовых связок различается у разных людей, что позволяет воспроизводить голоса с разным диапазоном высоты тона. Складки у самцов, как правило, больше, чем у самок, что создает более глубокий голос.Акт глотания заставляет глотку и гортань подниматься вверх, позволяя глотке расширяться, а надгортанник опускается вниз, закрывая отверстие для трахеи. Эти движения увеличивают площадь прохождения пищи, предотвращая попадание пищи и напитков в трахею.
Продолжая гортань, верхняя часть гортани выстлана многослойным плоским эпителием, переходящим в псевдостратифицированный мерцательный столбчатый эпителий, содержащий бокаловидные клетки.Подобно полости носа и носоглотке, этот специализированный эпителий вырабатывает слизь для улавливания мусора и патогенов, когда они попадают в трахею. Реснички отбивают слизь вверх по направлению к гортани, где ее можно проглотить по пищеводу.
Трахея
Трахея (дыхательное горло) простирается от гортани к легким. Трахея образована от 16 до 20 уложенных друг на друга С-образных кусочков гиалинового хряща, соединенных плотной соединительной тканью. Мышца трахеи и эластичная соединительная ткань вместе образуют фиброэластическую мембрану, гибкую мембрану, которая закрывает заднюю поверхность трахеи, соединяя С-образные хрящи.Фиброэластичная мембрана позволяет трахее немного растягиваться и расширяться во время вдоха и выдоха, тогда как хрящевые кольца обеспечивают структурную поддержку и предотвращают схлопывание трахеи. Кроме того, мышца трахеи может сокращаться, чтобы направлять воздух через трахею во время выдоха. Трахея выстлана псевдостратифицированным мерцательным столбчатым эпителием, который переходит в гортань. Пищевод сзади граничит с трахеей.
Рис. 8. (a) Трахеальная трубка образована сложенными друг на друга С-образными кусочками гиалинового хряща.(b) Слой, видимый на этом поперечном срезе ткани стенки трахеи между гиалиновым хрящом и просветом трахеи, представляет собой слизистую оболочку, которая состоит из псевдостратифицированного мерцательного столбчатого эпителия, содержащего бокаловидные клетки. LM × 1220. (Микрофотография предоставлена Медицинской школой Риджентс Мичиганского университета © 2012)
Бронхиальное дерево
Трахея разветвляется на правый и левый главные бронхи у киля. Эти бронхи также выстланы псевдостратифицированным мерцательным столбчатым эпителием, содержащим бокаловидные клетки, продуцирующие слизь.Киль — это приподнятая структура, которая содержит специализированную нервную ткань, которая вызывает сильный кашель, если присутствует инородное тело, например пища. Хрящевые кольца, похожие на кольца трахеи, поддерживают структуру бронхов и предотвращают их коллапс. Первичные бронхи входят в легкие в воротах, вогнутой области, где кровеносные сосуды, лимфатические сосуды и нервы также входят в легкие. Бронхи продолжают разветвляться в бронхиальное дерево. Бронхиальное дерево (или респираторное дерево) — собирательный термин, используемый для этих разветвленных бронхов.Основная функция бронхов, как и других структур проводящей зоны, заключается в обеспечении прохода воздуха для входа и выхода из каждого легкого. Кроме того, слизистая оболочка задерживает мусор и болезнетворные микроорганизмы.
Бронхиола отходит от третичных бронхов. Бронхиолы, которые имеют диаметр около 1 мм, продолжают ветвиться, пока не станут крошечными конечными бронхиолами, которые приводят к структурам газообмена. В каждом легком более 1000 терминальных бронхиол. Мышечные стенки бронхиол не содержат хрящей, как в бронхах.Эта мышечная стенка может изменять размер трубки, увеличивая или уменьшая поток воздуха через трубку.
Дыхательная зона
В отличие от проводящей зоны, респираторная зона включает структуры, непосредственно участвующие в газообмене. Дыхательная зона начинается там, где терминальные бронхиолы соединяются с респираторной бронхиолой, самым маленьким типом бронхиолы, которая затем ведет к альвеолярному протоку, открывающемуся в группу альвеол.
Рис. 9. Бронхиолы ведут к альвеолярным мешочкам в респираторной зоне, где происходит газообмен.
Альвеолы
Альвеолярный проток — это трубка, состоящая из гладких мышц и соединительной ткани, которая открывается в группу альвеол. Альвеола — это один из множества маленьких мешочков, похожих на виноград, которые прикрепляются к альвеолярным протокам.
Альвеолярный мешок — это скопление множества отдельных альвеол, которые отвечают за газообмен. Альвеола имеет диаметр примерно 200 мм с эластичными стенками, которые позволяют альвеолам растягиваться во время поступления воздуха, что значительно увеличивает площадь поверхности, доступную для газообмена.Альвеолы связаны со своими соседями альвеолярными порами, которые помогают поддерживать одинаковое давление воздуха в альвеолах и легких.
Рис. 10. (a) Альвеола отвечает за газообмен. (b) Микрофотография показывает альвеолярные структуры в легочной ткани. LM × 178. (Микрофотография предоставлена Медицинской школой Риджентс Мичиганского университета © 2012)
Стенка альвеол состоит из трех основных типов клеток: альвеолярных клеток I типа, альвеолярных клеток II типа и альвеолярных макрофагов.Альвеолярная клетка I типа представляет собой плоскоклеточную эпителиальную клетку альвеол, которые составляют до 97 процентов площади поверхности альвеол. Эти клетки имеют толщину около 25 нм и очень проницаемы для газов. Альвеолярные клетки типа II вкраплены среди клеток типа I и секретируют легочное сурфактант, вещество, состоящее из фосфолипидов и белков, которое снижает поверхностное натяжение альвеол. Вокруг альвеолярной стенки бродит альвеолярный макрофаг, фагоцитарная клетка иммунной системы, которая удаляет мусор и патогены, достигшие альвеол.
Простой плоский эпителий, образованный альвеолярными клетками I типа, прикреплен к тонкой эластичной базальной мембране. Этот эпителий чрезвычайно тонкий и граничит с эндотелиальной мембраной капилляров. Взятые вместе, альвеолы и капиллярные мембраны образуют дыхательную мембрану толщиной примерно 0,5 мм. Дыхательная мембрана позволяет газам проходить через простую диффузию, позволяя кислороду забираться кровью для транспортировки, а CO 2 выделяться в воздух альвеол.
Заболевания дыхательной системы: астма
Астма — распространенное заболевание, поражающее легкие как у взрослых, так и у детей. Приблизительно 8,2 процента взрослых (18,7 миллиона) и 9,4 процента детей (7 миллионов) в Соединенных Штатах страдают астмой. Кроме того, астма — самая частая причина госпитализации детей.
Астма — хроническое заболевание, характеризующееся воспалением и отеком дыхательных путей, а также бронхоспазмами (то есть сужением бронхиол), которые могут препятствовать проникновению воздуха в легкие.Кроме того, может происходить чрезмерное выделение слизи, что еще больше способствует закупорке дыхательных путей. Клетки иммунной системы, такие как эозинофилы и мононуклеарные клетки, также могут принимать участие в инфильтрации стенок бронхов и бронхиол.
Бронхоспазмы возникают периодически и приводят к «приступу астмы». Приступ может быть спровоцирован факторами окружающей среды, такими как пыль, пыльца, шерсть домашних животных или перхоть, перемены погоды, плесень, табачный дым и респираторные инфекции, или физическими упражнениями и стрессом.
Рис. 11. (a) Нормальная легочная ткань не имеет характеристик легочной ткани во время (b) приступа астмы, который включает утолщение слизистой оболочки, повышенное содержание слизистых бокаловидных клеток и инфильтраты эозинофилов.
Симптомы приступа астмы включают кашель, одышку, хрипы и стеснение в груди. Симптомы тяжелого приступа астмы, требующего немедленной медицинской помощи, включают затрудненное дыхание, которое приводит к посинению (синюшности) губ или лица, спутанности сознания, сонливости, учащенного пульса, потоотделения и сильного беспокойства.Тяжесть состояния, частота приступов и выявленные триггеры влияют на тип лекарства, которое может потребоваться человеку. Для людей с более тяжелой астмой используются более длительные методы лечения. Краткосрочные, быстродействующие препараты, которые используются для лечения приступа астмы, обычно вводятся через ингалятор. Маленьким детям или людям, которым трудно пользоваться ингалятором, лекарства от астмы можно вводить через небулайзер.
Во многих случаях основная причина состояния неизвестна.Однако недавние исследования показали, что определенные вирусы, такие как человеческий риновирус C (HRVC) и бактерии Mycoplasma pneumoniae и Chlamydia pneumoniae , зараженные в младенчестве или раннем детстве, могут способствовать развитию многих случаев астмы. .
Практический вопрос
Посмотрите это видео, чтобы узнать больше о том, что происходит во время приступа астмы. Какие три изменения происходят в дыхательных путях во время приступа астмы?
Покажи ответ
Воспаление с выделением густой слизи; сокращение мышц дыхательных путей или бронхоспазм; и повышенная чувствительность к аллергенам.
Обзор главы
Дыхательная система отвечает за получение кислорода и избавление от углекислого газа, а также за помощь в речи и распознавание запахов. С функциональной точки зрения дыхательную систему можно разделить на две основные области: проводящую зону и респираторную зону. Проводящая зона состоит из всех структур, обеспечивающих проходы воздуха в легкие и из легких: носовая полость, глотка, трахея, бронхи и большинство бронхиол.Носовые ходы содержат раковины и проходы, которые увеличивают площадь поверхности полости, что помогает согревать и увлажнять поступающий воздух, удаляя при этом мусор и болезнетворные микроорганизмы. Глотка состоит из трех основных отделов: носоглотки, которая продолжается с носовой полостью; ротоглотка, граничащая с носоглоткой и ротовой полостью; и гортань, граничащая с ротоглоткой, трахеей и пищеводом. Дыхательная зона включает структуры легкого, непосредственно участвующие в газообмене: концевые бронхиолы и альвеолы.
Выстилка проводящей зоны состоит в основном из псевдостратифицированного реснитчатого столбчатого эпителия с бокаловидными клетками. Слизь улавливает болезнетворные микроорганизмы и мусор, тогда как биение ресничек перемещает слизь вверх по направлению к горлу, где она проглатывается. По мере того, как бронхиолы становятся все меньше и меньше и ближе к альвеолам, эпителий истончается и представляет собой простой плоский эпителий в альвеолах. Эндотелий окружающих капилляров вместе с альвеолярным эпителием образует дыхательную мембрану.Это гемато-воздушный барьер, через который происходит обмен газа путем простой диффузии.
Самопроверка
Ответьте на вопрос (ы) ниже, чтобы увидеть, насколько хорошо вы понимаете темы, затронутые в предыдущем разделе.
Вопросы к критическому мышлению
- Опишите три области глотки и их функции.
- Если человек получит травму надгортанника, каков будет физиологический результат?
- Сравните и сопоставьте проводящую и дыхательную зоны.
- Глотка состоит из трех основных областей. Первая область — это носоглотка, которая связана с задней полостью носа и выполняет функцию дыхательных путей. Вторая область — ротоглотка, которая продолжается с носоглоткой и соединяется с полостью рта через зев. Гортань соединяется с ротоглоткой, пищеводом и трахеей. И ротоглотка, и гортань являются проходами для воздуха, еды и питья.
- Надгортанник — это область гортани, которая важна при глотании еды или питья.Когда человек глотает, глотка движется вверх, и надгортанник закрывается над трахеей, предотвращая попадание еды или питья в трахею. Если бы у человека было повреждено надгортанник, этот механизм был бы нарушен. В результате у человека могут возникнуть проблемы с попаданием еды или питья в трахею и, возможно, в легкие. Со временем это может вызвать инфекцию, например пневмонию.
- Проводящая зона дыхательной системы включает органы и структуры, которые не участвуют напрямую в газообмене, но выполняют другие функции, такие как обеспечение прохода для воздуха, улавливание и удаление мусора и патогенов, а также нагрев и увлажнение поступающего воздуха.К таким структурам относятся полость носа, глотка, гортань, трахея и большая часть бронхиального дерева. Дыхательная зона включает в себя все органы и структуры, которые непосредственно участвуют в газообмене, включая респираторные бронхиолы, альвеолярные протоки и альвеолы.
Глоссарий
ala: (множественное число = alae) маленькая расширяющаяся структура ноздри, которая образует боковую сторону ноздрей
хрящ крыльев носа: хрящ, поддерживающий верхушку носа и помогающий формировать ноздри; он соединен с перегородочным хрящом и соединительной тканью крыльев
альвеолярный проток: маленькая трубка, которая ведет от конечной бронхиолы к респираторной бронхиоле и является местом прикрепления альвеол
альвеолярный макрофаг: клетка иммунной системы альвеолы, которая удаляет мусор и патогены
Альвеолярная пора: отверстие, через которое воздух проходит между соседними альвеолами
альвеолярный мешок: кластер альвеол
альвеола: маленький виноградоподобный мешок, который осуществляет газообмен в легких
вершина: кончик наружного носа
бронхиальное дерево: собирательное название множественных ветвей бронхов и бронхиол дыхательной системы
переносица: часть внешнего носа, лежащая в области носовых костей
бронхиола: ветвь бронхов диаметром 1 мм или менее, оканчивающаяся у альвеолярных мешочков
бронх: трубка, соединенная с трахеей, которая разветвляется на многие дочерние органы и обеспечивает проход воздуха для входа и выхода из легких
проводящая зона: область дыхательной системы, которая включает органы и структуры, обеспечивающие проходы воздуха и не участвующие напрямую в газообмене
перстневидный хрящ: часть гортани, состоящая из хрящевого кольца с широкой задней областью и более тонкой передней областью; прикреплен к пищеводу
dorsum nasi: промежуточная часть внешнего носа, которая соединяет переносицу с верхушкой и поддерживается носовой костью
надгортанник: листообразный кусок эластичного хряща, который представляет собой часть гортани, которая поворачивается, чтобы закрыть трахею во время глотания.
внешний нос: область носа, хорошо видимая окружающим
зев: часть задней полости рта, которая соединяет ротовую полость с ротоглоткой
фиброэластичная мембрана: специализированная мембрана, соединяющая концы хряща С-образной формы в трахее; содержит гладкие мышечные волокна
голосовая щель: отверстие между голосовыми складками, через которое проходит воздух при произнесении речи
выступ гортани: область, где две пластинки щитовидного хряща соединяются, образуя выступ, известный как «кадык»
гортань: часть глотки, ограниченная ротоглоткой сверху и пищеводом и трахеей снизу; служит маршрутом как для воздуха, так и для еды
гортань: хрящевая структура, которая издает голос, предотвращает попадание пищи и напитков в трахею и регулирует объем воздуха, который входит и выходит из легких
язычная миндалина: лимфоидная ткань, расположенная у основания языка
проходной канал: одно из трех углублений (верхнее, среднее и нижнее) в полости носа, прикрепленное к раковинам, которые увеличивают площадь поверхности носовой полости
нарис: (множественное число = ноздри) открытие ноздрей
носовая кость: кость черепа, которая лежит под корнем и переносицей и соединяется с лобной и верхнечелюстной костями
носовая перегородка: стенка из кости и хряща, разделяющая левую и правую полости носа
носоглотка: часть глотки, окруженная раковинами и ротоглоткой, которая служит дыхательным путем
ротоглотка: часть глотки, окруженная носоглоткой, полостью рта и гортани, которая является проходом как для воздуха, так и для пищи
небная миндалина: одна из парных структур, состоящая из лимфоидной ткани, расположенная кпереди от язычка на крыше перешейка зева
околоносовые пазухи: одна из полостей черепа, которая соединяется с раковинами, которые служат для нагрева и увлажнения поступающего воздуха, выделения слизи и уменьшения веса черепа; состоит из лобных, верхнечелюстных, клиновидных и решетчатых пазух
глоточная миндалина: структура, состоящая из лимфоидной ткани, расположенная в носоглотке
глотка: область проводящей зоны, которая образует трубку скелетных мышц, выстланных респираторным эпителием; расположен между носовыми раковинами и пищеводом и трахеей
желобок: вогнутая поверхность лица, которая соединяет вершину носа с верхней губой
легочное сурфактант: вещество, состоящее из фосфолипидов и белков, которое снижает поверхностное натяжение альвеол; произведены альвеолярными клетками II типа
респираторная бронхиола: специфический тип бронхиолы, ведущей к альвеолярным мешочкам
респираторный эпителий: реснитчатая выстилка большей части проводящей зоны, которая специализируется на удалении мусора и патогенов и выработке слизи
дыхательная мембрана: альвеолярная стенка и стенка капилляра вместе, которые образуют воздушный барьер, способствующий простой диффузии газов
Дыхательная зона: включает структуры дыхательной системы, непосредственно участвующие в газообмене
корень: область внешнего носа между бровями
щитовидный хрящ: самый большой кусок хряща, который составляет гортань и состоит из двух пластинок
трахея: трубка, состоящая из хрящевых колец и поддерживающей ткани, которая соединяет легкие, бронхи и гортань; обеспечивает путь воздуха для входа и выхода из легких
мышца трахеи: гладкая мышца, расположенная в фиброэластической мембране трахеи
истинный голосовой связок: одна из пары складчатых белых мембран со свободным внутренним краем, который колеблется при прохождении воздуха и производит звук
альвеолярных клеток I типа: клеток плоского эпителия, которые являются основным типом клеток в альвеолярной стенке; высокая газопроницаемость
альвеолярных клеток типа II: кубовидных эпителиальных клеток, которые являются клетками минорного типа в альвеолярной стенке; секретирует легочный сурфактант
вестибулярная складка: часть складчатой области голосовой щели, состоящая из слизистой оболочки; поддерживает надгортанник при глотании
Ссылки
Bizzintino J, Lee WM, Laing IA, Vang F, Pappas T, Zhang G, Martin AC, Khoo SK, Cox DW, Geelhoed GC, et al.Связь между риновирусом С человека и тяжестью острой астмы у детей. Eur Respir J [Интернет]. 2010 [цитируется 22 марта 2013 года]; 37 (5): 1037–1042. Доступно по адресу: http://erj.ersjournals.com/gca?submit=Go&gca=erj%3B37%2F5%2F1037&allch=
Кумар В., Рамзи С., Роббинс С.Л. Базовая патология Роббинса. 7-е изд. Филадельфия (Пенсильвания): Elsevier Ltd; 2005 г.
Мартин Р.Дж., Крафт М., Чу Х.В., Бернс, Э.А., Касселл Г.Х. Связь между хронической астмой и хронической инфекцией. J Allergy Clin Immunol [Интернет].2001 [цитируется 22 марта 2013 г.]; 107 (4): 595-601. Доступно по адресу: http://erj.ersjournals.com/gca?submit=Go&gca=erj%3B37%2F5%2F1037&allch=
Мукоцилиарный транспорт — обзор
Кашель и принудительный выдох
При недостаточности основного мукоцилиарного транспорта слизь удаляется из дыхательных путей путем принудительного выдоха или кашля. В каждом из этих механизмов энергия, получаемая от воздушного потока, влияет на движение слизи. Взаимодействуя со слоем слизи, воздушный поток с достаточной кинетической энергией может вызвать силу сдвига на поверхности слизи; величина этой силы пропорциональна плотности воздуха и квадрату средней скорости воздушного потока. 122 Чтобы слизь перемещалась в направлении крупных дыхательных путей, сила сдвига, создаваемая воздушным потоком, должна преодолевать вязкость слизи и гравитационные силы. При очень высоких скоростях воздушного потока (> 2500 см / с) слизь отрывается от поверхности в виде капель, создавая поток тумана, характерный для отхождения мокроты из трахеи; такая скорость воздушного потока может быть достигнута в мелких дыхательных путях во время кашля или принудительного выдоха. 123 Для данной скорости воздушного потока требуется критическая глубина слизи, чтобы ее движение могло произойти.Эта критическая глубина увеличивается с увеличением вязкости слизи и уменьшается с увеличением скорости воздушного потока. 124 Поскольку критическая глубина вязкой слизи высока, слизь накапливается в виде толстого слоя в дыхательных путях, прежде чем подвергнуться перемещению под действием воздушного потока.
При кашлевом маневре происходит быстрый вдох сверхнормального дыхательного объема с последующим закрытием голосовой щели, повышением внутригрудного давления (от 50 до 100 мм рт. Ст.) И открытием голосовой щели с быстрым выдохом. При сверхмаксимальном потоке и сужении трахеи, описанном у взрослых, скорость воздушного потока может достигать 280 м / с, что приводит к эффективному движению слизи вверх. 122 Повышенная податливость грудной стенки и трахеи нормального новорожденного имеет тенденцию ограничивать достижимое внутригрудное давление и скорость воздушного потока, снижая эффективность кашля в этой популяции. 125 Кашель также менее эффективен при слабости дыхательных мышц или неспособности закрыть голосовую щель, как при эндотрахеальной интубации. Однако кашель, недостаточный для создания требуемых сил сдвига, указанных выше, может все же способствовать выведению слизи за счет изменения секреции перицилиарной жидкости или увеличения биения ресничек. 126
Скоординированный маневр кашля основан на местных хеморецепторах и механорецепторах, блуждающих афферентах, интеграции сигналов в мозговом веществе дорали и эфферентной иннервации соответствующих мышц вдоха и выдоха. Рецепторы, вызывающие кашель, плохо охарактеризованы, но могут активироваться местными медиаторами, включая гистамин, тахикинины и вещество P. 127,128 Кашель также может быть вызван стимуляцией других участков, иннервируемых блуждающим нервом, таких как наружный слуховой проход или пищевод.Афферентная конечность включает блуждающий нерв и структуры, иннервируемые блуждающим нервом, такие как гортань и проводящие дыхательные пути. Из них гортань и верхние дыхательные пути кажутся более чувствительными к механической стимуляции, тогда как нижние дыхательные пути более чувствительны к химиотерапии. 129 Афференты блуждающего нерва от этих участков синапса в солитарном ядре мозгового слоя дорали, предполагаемом «кашлевом центре». Эфферентные пути включают возвратный гортанный нерв, который стимулирует закрытие голосовой щели, и спинномозговые нервы от C3 до S2, которые иннервируют межреберные, брюшные и тазовые мышцы, необходимые для достижения достаточного дыхательного объема и давления на выдохе.Как отмечалось ранее, кашлевой рефлекс у недоношенных новорожденных обычно бывает «незрелым» или отсутствует, что объясняется неполной миелинизацией афферентов блуждающего нерва. 130
При отсутствии эффективного кашля существуют дополнительные защитные рефлексы дыхательных путей. 131 Механическое раздражение эпифаринкса через язычно-глоточный нерв вызывает аспирационный рефлекс, похожий на фырканье, с помощью которого инородные частицы могут быть удалены из задней части носа, проглочены или выведены через мукоцилиарный клиренс.Механическая стимуляция голосовых связок с помощью верхнего гортанного нерва вызывает кратковременное усилие выдоха без предварительного вдоха (рефлекс выдоха). Наконец, чихание — эффективный механизм очищения носа и носоглотки. Как и кашель, чихание можно описать как три отдельные фазы: инспираторную, компрессионную и выдохную. В фазе вдоха быстро вдыхается сверхнормальный дыхательный объем, за которым сразу же закрывается гортань и глотка.Затем следует мощное выдыхательное усилие с заметным повышением внутригрудного давления. В фазе выдоха глотка и голосовая щель открываются, и поток воздуха с высокой скоростью направляется в основном через нос. Чихание не может происходить добровольно и обычно бывает слабым или отсутствует в раннем неонатальном периоде.
Движущаяся слизь имеет значение для здоровья легких · Границы для молодых умов
Аннотация
Когда мы дышим, легкие обменивают кислород воздуха на углекислый газ из крови.Этот обмен жизненно необходим. Каждый вдох подвергает легкие воздействию внешней среды, содержащей загрязнения и микробы, представляющие угрозу нашему здоровью. Первая линия защиты называется мукоцилиарным эскалатором: слизь улавливает потенциально опасный материал, а реснички выталкивают этот материал вверх и из наших дыхательных путей. Когда мукоцилиарный эскалатор не работает должным образом, у нас может развиться заболевание легких. Например, у пациентов с генетическими заболеваниями, такими как муковисцидоз (CF) и первичная цилиарная дискинезия (PCD), или заболеваниями, связанными с курением, такими как хроническая обструктивная болезнь легких (ХОБЛ), слизь очень густая.Эта слизь накапливается, позволяя бактериям, грибам и вирусам процветать, вызывая повреждение легких и снижение оксигенации. Заболевания легких чрезвычайно затрудняют дыхание, и пациенты могут иметь опасные для жизни респираторные заболевания, когда мукоцилиарный эскалатор не может поддерживать здоровье легких.
Как работают легкие?
Основная функция легких — дыхание. Газообмен — это название процесса, посредством которого кислород попадает в кровоток (при вдыхании), а углекислый газ покидает тело (при выдохе).Структура легких эволюционировала, чтобы выполнять эту задачу очень эффективно. Основная структура легких — это серия полых трубок, называемых дыхательными путями. Дыхательные пути разветвляются и уменьшаются в размерах, заканчиваясь крошечными воздушными мешочками, называемыми альвеолами. Альвеолы покрыты небольшими кровеносными сосудами, называемыми капиллярами, которые служат для обмена газов в крови [1]. Легкие можно сравнить с деревом, у которого большой главный ствол, а ветви становятся меньше по мере удаления от ствола. Альвеолы похожи на листья.
В легком есть две основные области: проводящая зона и респираторная зона (рис. 1). Через проводящую зону воздух попадает в легкие и попадает в респираторную зону, содержащую альвеолы. Альвеолы одного человека имеют такую же площадь поверхности, как и теннисный корт, а это большая площадь для газообмена. Проводящая зона — это часть легких, через которую проходит воздух без газообмена, потому что трубки слишком толстые, чтобы газы могли проходить через них.Проводящая зона выстлана похожими на волосы структурами, называемыми ресничками, которые покрыты слизью, которая помогает задерживать потенциально опасные материалы. Реснички — это подвижные крошечные пальцеобразные выступы на поверхности клеток дыхательных путей. Реснички выстилают дыхательные пути и помогают выводить слизь вверх и из легких [5]. Реснички имеют высоту около 6–7 микрометров, что составляет примерно десятую часть ширины человеческого волоса [3, 5].
- Рисунок 1 — Мукоцилиарный эскалатор у здорового человека (слева) и у человека с больным мукоцилиарным эскалатором (справа).
- Мукоцилиарный эскалатор находится в трахее, бронхах и бронхиолах, которые являются частью проводящей зоны. Газообмен происходит в альвеолах дыхательной зоны (вставка).
Частицы и микробы в воздухе — зачем легким защита
Есть много типов частиц, которые могут попасть в легкие и вызвать повреждение. Некоторые из этих частиц являются загрязняющими веществами, такими как выбросы от газовых транспортных средств, окись углерода от каминов, токсины от вейпинга или курения, а также аэрозоли, такие как лак для волос.Частицы могут попадать в различные области легких. Короткие волосы, такие как волосы на макушке, выстилают ноздри изнутри и покрыты слизью. Эти покрытые слизью волосы помогают задерживать более крупные частицы, попадающие в нос. Частицы, попадающие в проводящую зону, могут повредить клетки дыхательных путей, что может уменьшить движение их ресничек и привести к накоплению слизи, которая не может быть удалена из дыхательных путей [2]. Забитые слизью дыхательные пути могут не позволять воздуху перемещаться так же эффективно, как листья в желобе, мешающие потоку воды.Иногда более мелкие частицы могут доходить до альвеол. Повреждение альвеол значительно затрудняет дыхание, потому что кислород не проникает в кровь. Эта пониженная эффективность газообмена может вызвать гипоксию остального тела, что означает недостаток кислорода. Только проводящая зона, от трахеи до бронхиол, обладает способностью перемещать слизь с помощью ресничек, поэтому альвеолы не могут полагаться на этот механизм, чтобы избавиться от этих мелких частиц [3]. Жизнь в загрязненном городе или годы курения / вейпинга могут вызвать воспаление легочной ткани и привести к таким заболеваниям, как хроническая обструктивная болезнь легких (ХОБЛ) [4].
Что такое мукоцилиарный эскалатор?
Мукоцилиарный эскалатор находится внутри проводящих дыхательных путей и состоит из слизи и ресничек, которые перемещают слизь вверх и из легких, откуда она может быть выведена при кашле или глотании (рис. 1, 2) [5]. В качестве первой линии защиты слизь в дыхательных путях состоит из различных компонентов, которые помогают ей задерживать частицы и микробы [2, 4]. Слизь представляет собой физический барьер, защищающий легкие, и обладает свойствами, помогающими избавиться от потенциально инфекционных бактерий, грибков и вирусов [4, 5].Некоторые из важных компонентов слизи дыхательных путей — это муцины (липкие белки с сахарным покрытием), защитные белки, соль и вода. Вместе эти компоненты образуют гель, который улавливает частицы, попадающие в дыхательные пути [2].
- Рис. 2. (Слева) Реснички здоровых дыхательных путей подвижны и способны эффективно перемещать слизь вверх по мукоцилиарному эскалатору.
- (посередине) При МВ слизь становится густой и трудно поддается перемещению, что снижает эффективность мукоцилиарного эскалатора; это позволяет задерживать микробы / частицы, что в конечном итоге приводит к повреждению легких.(Справа) При PCD реснички менее подвижны или даже неподвижны, что делает их неспособными перемещать слизь вверх по мукоцилиарному эскалатору.
Слизь в основном продуцируется клетками, выстилающими дыхательные пути изнутри. Они называются бокаловидными ячейками. Бокальные ячейки имеют форму средневековых чаш, отсюда и название кубок. В отличие от других клеток дыхательных путей, которые имеют ресничную форму и имеют форму столбиков, бокаловидные клетки не имеют наверху ресничек. Бокаловидные клетки отсутствуют за пределами проводящей зоны, чтобы слизь не мешала газообмену.Слизь также участвует в гидратации дыхательных путей, что необходимо для правильного функционирования ресничек [3, 5].
Движение ресничек подобно движению ваших рук при плавании брассом [3]. Отдельные реснички недостаточно сильны, чтобы самостоятельно перемещать слой слизи, но когда тысячи ресничек скоординированно бьются вместе, они могут коллективно вызывать движение слизи [2, 3]. Представьте себе толпу на концерте, когда исполнитель ныряет со сцены, чтобы заняться серфингом толпы: исполнитель подобен сгустку слизи, который удерживается руками толпы и движется согласованной волной.В некотором смысле реснички взаимодействуют друг с другом посредством движения, чтобы обеспечить скоординированное и эффективное движение слизи! Так работает мукоцилиарный эскалатор.
Какие заболевания могут возникнуть, если мукоцилиарный эскалатор работает неправильно?
Некоторые люди наследуют аномальные гены от своих родителей и рождаются с заболеванием, называемым первичной цилиарной дискинезией (ПЦД) (рис. 2). PCD — это заболевание легких, которое препятствует эффективному сокращению ресничек, а в тяжелых случаях вообще не дает им двигаться [3].У пациентов с PCD дыхательные пути инфицируются из-за неэффективного транспорта слизи, который повреждает клетки дыхательных путей. Когда со временем дыхательные пути повреждаются, они становятся вялыми, как сплющенная соломка, не позволяя воздуху проходить через них и затрудняя дыхание. Представьте, что вы пьете вкусный густой молочный коктейль; При использовании соломки нормальной ширины требуется меньше усилий по сравнению с соломинкой шириной с лапшу для спагетти.
Муковисцидоз (МВ) — еще одно наследственное заболевание, поражающее мукоцилиарный эскалатор [3] (рис. 2).У людей с МВ есть мутации в обеих копиях гена (одна от мамы и одна от папы), ответственных за выработку белка, называемого регулятором трансмембранной проводимости при муковисцидозе (CFTR). CFTR образует канал через мембраны клеток, который участвует в выработке пота, пищеварительной жидкости и слизи. CFTR регулирует, сколько воды попадает в эти выделения и, следовательно, насколько густой и липкой становится слизь. При неправильной работе канала слизи не хватает воды и она становится густой, как клей.Чрезвычайно густая слизь накапливается в легких, в отличие от нормальной водянистой слизи, которая легко выводится мукоцилиарным эскалатором, вызывая накопление густой слизи и в конечном итоге вызывая разрушение дыхательных путей и легочную недостаточность.
Хроническая обструктивная болезнь легких (ХОБЛ) — это заболевание, которое может возникнуть после курения сигарет или электронных сигарет. ХОБЛ может негативно влиять на мукоцилиарный эскалатор и вызывать заболевание легких, во многом похожее на МВ [3]. Повреждение мукоцилиарного эскалатора может способствовать развитию других распространенных заболеваний, таких как пневмония и астма, которые имеют схожие, но иногда менее серьезные проблемы со слизью.
Заключение: почему имеют значение слизь, реснички и мукоцилиарный эскалатор
Для здоровых легких требуется правильная работа мукоцилиарного эскалатора. Слизь и реснички являются основным механизмом защиты легких. Если есть проблема со слизью или ресничками, дыхательные пути могут быть заблокированы, и вредные микробы и частицы могут попасть в легкие, что приведет к повреждению. Генетические заболевания, такие как PCD и CF, и приобретенные заболевания, такие как COPD, негативно влияют на мукоцилиарный эскалатор.Эти заболевания легких могут привести к уменьшению газообмена и вызвать гипоксию всего тела. Так что помните — когда вы дома больны простудой, слизь, которую вы откашливаете, исходит из мукоцилиарного эскалатора, и она помогает поддерживать здоровье и здоровье ваших легких, удаляя потенциально опасные частицы и микробы!
Авторские взносы
MW, JP, JK, TB, SP, R-JS и SR внесли свой вклад в подготовку рукописи и окончательное редактирование. Все авторы одобрили окончательный вариант рукописи перед отправкой.
Глоссарий
Газообмен : ↑ Процесс, при котором отходы углекислого газа (CO 2 ) удаляются из кровотока и заменяются вдыхаемым кислородом (O 2 ).
Альвеолы : ↑ Воздушные мешочки, составляющие наименьшую часть респираторной зоны; альвеолы и капиллярные сосуды находятся в непосредственной близости; здесь происходит газообмен.
Проводящая зона : ↑ Часть дыхательных путей, не участвующая в газообмене; цель зоны проводимости состоит в том, чтобы перемещать воздух в зону дыхания и из нее; где находится мукоцилиарный эскалатор; обнаруживается в проксимальном отделе легкого от трахеи до бронхиол.
Дыхательная зона : ↑ Часть дыхательных путей, в которой происходит газообмен; находится в дистальном отделе легкого, где расположены альвеолы.
Реснички : ↑ Подвижные волосковидные выступы на верхней части клеток, выстилающих проводящую зону дыхательных путей; реснички перемещают слизь по мукоцилиарному эскалатору.
Слизь : ↑ Липкое гелеобразное вещество, которое находится на вершине ресничной щетки в проводящей зоне дыхательных путей; в легких слизь производится бокаловидными клетками и железами и защищает дыхательные пути от опасных материалов; слизь состоит из воды, гликопротеинов муцина, защитных белков и соли.
Мукоцилиарный эскалатор : ↑ Срок для аппарата слизи и ресничек; отвечает за движение слизи вверх и из дыхательных путей; слизь улавливает частицы, а реснички выталкивают слизь вверх и из легких.
Заявление о конфликте интересов
SR имеет нелицензированный патент на использование микрооптической когерентной томографии в качестве диагностического устройства, которое используется для характеристики функциональной микроанатомии мукоцилиарного эскалатора.
Остальные авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Благодарности
Авторы хотели бы поблагодарить Джорджа Д. Филлипса (13 лет), С. Коринн Филлипс (16 лет) и Эндрю Роу (14 лет) за чтение рукописи и их вдумчивые правки и отзывы. Джереми Левер и Бэзил Боно за неоценимую поддержку в завершении этого проекта.
Список литературы
[1] ↑ Вест, Дж. Б. 2012. Физиология дыхания Веста: основы . 9-е изд. Балтимор, Мэриленд: Липпинкотт Уильямс и Уилкинс.
[2] ↑ Ноулз М. Р. и Баучер Р. С. 2002. Очистка от слизи как основной врожденный механизм защиты дыхательных путей млекопитающих. J. Clin. Вкладывать деньги. 109: 571–7. DOI: 10.1172 / jci15217
[3] ↑ Пибоди, Дж. Э., Шей, Р. Дж., Бермингем, Б. М., Филлипс, С. Е., Тернер, Б., Роу, С. М. и др. 2018. Видение ресничек: методы визуализации движения ресничек и клинических связей. Am. J. Physiol. Легочная клетка. Мол. Physiol. 314: L909–21.DOI: 10.1152 / ajplung.00556.2017
[4] ↑ Чжан П., Саммер В. Р., Бэгби Г. Дж. И Нельсон С. 2000. Врожденный иммунитет и легочная защита хозяина. Immunol. Rev. 173: 39–51. DOI: 10.1034 / j.1600-065X.2000.
6.x
[5] ↑ Бустаманте-Марин, X. М., и Островски, Л. Е. 2017. Реснички и мукоцилиарный клиренс. Cold Spring Harbor Perspect. Биол. 9: a028241. DOI: 10.1101 / cshperspect.a028241
Насморк (хронический ринит): определение, симптомы и причины
Просмотреть видео
Несмотря на все ваши усилия, такие как сморкание или использование спрея для ноздрей, ваш нос не перестанет капать, и с каждой минутой он становится красным, грубым и нежным.Что ты можешь сделать? Первое, что вы можете сделать, это узнать больше о том, что такое насморк (капающий), каковы некоторые из его распространенных причин и его симптомы. Затем вы можете поговорить с одним из наших хьюстонских ЛОР-врачей и обсудить варианты лечения.
Определение хронического ринитаИтак, что такое насморк?
Насморк — это дополнительный дренаж носовых и соседних кровеносных сосудов и тканей носа. Дренаж может варьироваться от густой слизи до прозрачной жидкости.Он может вытекать из носа и попадать в горло в спину или и то, и другое.
Термины «ринит» и «ринорея» часто используются при обозначении насморка.
Ринорея — это относительно жидкие прозрачные выделения из носа.
Ринит — это воспаление тканей носа, вызванное различными причинами, которое приводит к насморку.
Заложенность носа может сочетаться, а может и не сочетаться с насморком.
Неаллергический ринит может поражать как взрослых, так и детей, но чаще встречается у взрослых старше 20 лет.Триггеры симптомов неаллергического ринита различаются и могут включать:
Врач ставит диагноз неаллергического ринита после того, как исключит аллергическую причину с помощью анализов крови, кожных аллергических тестов или других тестов.
Просмотр видео
Симптомы насморкаНеаллергический ринит — это мокрый, заложенный нос или хроническое чихание без видимой причины. Симптомы неаллергического ринита похожи на симптомы аллергического ринита (сенной лихорадки), но нет типичных признаков наличия аллергической реакции.
Если вы боретесь с неаллергическим ринитом, ваши симптомы, вероятно, появляются и исчезают в течение года. Вы можете испытывать кратковременные симптомы или постоянные симптомы. Некоторые симптомы неаллергического ринита могут включать:
Неаллергический ринит обычно не вызывает зуда в глазах, носа или горла, который является симптомом, связанным с сенной лихорадкой или другими аллергиями.
У некоторых людей существует существенная связь между астмой, ринитом (аллергическим) и хроническим синуситом (воспаление носовых пазух продолжительностью более 12 недель).По некоторым данным, до трех из пяти пациентов страдают более чем одним заболеванием.
Постназальное выделение жидкости — частая характеристика хронического ринита. Постназальное выделение — это скопление слизи в задней части горла и носа, в результате чего слизь капает с задней части носа или дает ощущение этого чувства. Это может привести к хроническому кашлю, хронической боли в горле или откашливанию. Это часто вызвано нарушением регулярного выведения слизи из горла и носа или густым или чрезмерным выделением слизи.
Запишитесь на прием к врачу, если:
У вас есть симптомы, которые не устраняются безрецептурными лекарствами или самолечением.
У вас серьезные симптомы.
Вы испытываете определенные побочные эффекты от безрецептурных или отпускаемых по рецепту лекарств от ринита.
В зависимости от того, что вызывает насморк, долгосрочные эффекты могут различаться. Закупорка носа и раздражение носа могут повлиять на качество жизни ребенка, если они продолжаются.Закупорка носа может повлиять на качество сна.
Возможность дышать носом необходима для развития лица в детстве. В редких случаях острые инфекции носовых пазух могут привести к более тяжелым инфекциям, если их не лечить. Ринорея и заложенность носа могут повлиять на здоровье уха и слух, поскольку дренажный путь в среднем ухе проходит через носоглотку (заднюю часть носа).
Причины насморкаВаши носовые пазухи и нос обычно выделяют слизь, чтобы поддерживать нос во влажном состоянии, и обычно ее проглатывают и возвращают обратно в горло.Насморк возникает по многим причинам, в том числе:
.Crying: Слезы текут через слезные протоки, когда вы плачете, в носовую полость, а затем в нос.
Простуда и грипп: Слизь, образующаяся в результате болезней, может вызвать временную заложенность носа, заполняя носовую полость.
Аденоидные инфекции и / или инфекции носовых пазух: Полости лица или носовые пазухи, которые стекают в нос, могут заполняться инфицированной слизью, что приводит к воспалению носовых пазух (синусит).У детей аденоиды (ткань носоглотки) также могут инфицироваться, что приводит к аналогичному образованию инфицированной слизи.
Cold Weather: Когда становится холодно, это иногда может вызвать реакцию с выделением слизи.
Аллергический ринит: Назальная реакция на аллергены, такие как перхоть домашних животных, пыльца или аллергия, может вызвать появление слизи. Он может быть круглогодичным или просто сезонным. Весенние нападения обычно происходят из-за пыльцы с деревьев, тогда как пыльца травы вызывает нападения летом, а пыльца сорняков вызывает нападения осенью.Многие люди с аллергическим ринитом имеют чувствительность к нескольким аллергенам.
Неаллергический ринит: Назальная реакция на раздражители, такие как загрязнение или дым, или реакция организма на другие раздражители, такие как горячая пища или холодная погода, могут вызывать появление слизи. Смог, пыль, сильные запахи духов, пассивное курение — все это может вызвать неаллергический ринит. Воздействие химических паров, как в некоторых профессиях, также может вызвать неаллергический ринит.Вы также можете развить неаллергический ринит от алкогольных напитков или острой горячей пищи.
Носовые полипы : Выращивание слизистой оболочки носа, напоминающее виноград.
Опухшие / большие носовые раковины: Ваши носовые раковины (кости внутри носа) могут опухнуть из-за инфекций или аллергии, что приведет к заложенности носа.
Большие аденоиды: Увеличенная ткань у детей в задней части носа.
Опухоли или кисты носа: В редких случаях может возникнуть обструкция из-за злокачественных или доброкачественных опухолей или кист; обычно наблюдается, когда симптомы затрагивают только одну сторону носа.
Вставка инородного тела: Закупорка носа у детей из-за попадания в нос таких предметов, как бусинка или арахис, что также вызывает отток слизи с неприятным запахом.
Искривленная перегородка носа: Левая и правая стороны носа разделены перегородкой из хряща и кости, которая называется носовой перегородкой.Иногда перегородка наклоняется больше в одну сторону и вызывает закупорку с этой стороны в состоянии, известном как искривление перегородки. Присутствие этой деформации может быть замечено при рождении или быть результатом травмы носа в более позднем возрасте.
Пириформ апертура стеноз или атрезия хоан: Стеноз грушевидной апертуры — это узкое костное отверстие носа, которое закрывает нос. Атрезия хоан — это когда носоглотка закрывается тканью и / или костью при рождении.Когда он двусторонний (присутствует с обеих сторон), он часто присутствует сразу после рождения. Однако, если он присутствует только с одной стороны, его часто не обнаруживают до более позднего периода жизни.
Часто ринорея проходит сама по себе. Но если он сохраняется или длится более 10 дней, это может быть признаком другого состояния, подобного любому из перечисленных выше. Проконсультируйтесь с врачом, особенно если это сопровождается высокой температурой.
Обследование на хронический ринит (насморк)Если у вас постоянный насморк, лечащий врач может направить вас к аллергологу или отоларингологу (врачу по лечению ушей, носа и горла).Специалист осмотрит внутреннюю и переднюю часть вашего носа и получит полную историю болезни. Как только они обнаружат источник вашего насморка, они сядут с вами и проведут лечение, которое может включать в себя эффективную и довольно новую процедуру, известную как Clarifix®, о которой мы подробно расскажем в следующем сообщении в блоге.
Чтобы пройти обследование на хронический ринит, свяжитесь с нами здесь, в Houston ENT & Allergy Services, по телефону 281-649-7000 или запишитесь на прием онлайн.
Тара Моррисон, доктор медицины
.

 Таким способом организм пытается избавиться от вредных частиц, попавших с воздухом.
Таким способом организм пытается избавиться от вредных частиц, попавших с воздухом.
 Диуретики, антибиотики, гормональные и другие препараты часто вызывают побочные эффекты, среди которых – увеличение густоты секрета, выделяемого бронхами.
Диуретики, антибиотики, гормональные и другие препараты часто вызывают побочные эффекты, среди которых – увеличение густоты секрета, выделяемого бронхами.