Интерфероны — противовирусное средство №1 » Фармвестник
Так началась «эра интерферона». Человечество обрело мощное естественное средство для борьбы с вирусными инфекциями. Сегодня интерфероны — это большой класс белковых веществ, объединенных общим названием и имеющих сходные свойства. Наиболее изученным свойством данной группы белков является их способность препятствовать размножению вирусов, а также активизировать иммунную систему. В настоящее время в качестве лекарственных средств широко применяются интерфероны первого типа — альфа и бета. Рекомбинантные ИФН сегодня по праву считаются наиболее перспективными. Полученные методами генной инженерии без использования крови человека, эти ИФН отличаются чистым и однородным составом, высоким профилем безопасности и относительно низкой себестоимостью.
В записную книжкуДля лечения и экстренной профилактики гриппа и ОРВИ врачи рекомендуют оригинальный отечественный препарат Гриппферон®.
Состав: активный компонент — интерферон альфа-2b человеческий рекомбинантный не менее 10 000 ME, полимерная основа.
Показания к применению: Профилактика и лечение гриппа и ОРВИ у детей с рождения и взрослых.
Гриппферон®:
- выпускается в двух удобных лекарственных формах — капли назальные и спрей назальный дозированный;
- препарат топического действия, т.е. оказывает прямое противовирусное воздействие непосредственно в месте проникновения вируса в организм человека — в слизистой оболочке носовой полости;
- блокирует механизм воспроизведения респираторных вирусов;
- вирусы не способны приобрести устойчивость к действию препарата;
- разрешен пациентам всех категорий, в т.ч. детям с рождения, беременным и кормящим женщинам;
- на 60—70% снижает количество осложнений у больных с острой респираторной инфекцией;
- совместим с другими противовирусными препаратами, а также с вакцинопрофилактикой;
- не требует совместного назначения сосудосуживающих средств, так как сам уменьшает отек слизистой оболочки носа.

При первых признаках заболевания Гриппферон® применяют в течение 5 дней в возрастной дозировке, по 1—3 капли/дозы в каждый носовой ход, от 3 до 5—6 раз в день (в соответствии с возрастом заболевшего). Так, у самых маленьких пациентов (в возрасте от 0 до 1 года) препарат применяют по схеме: 1 капля/доза Гриппферона в каждый носовой ход 5 раз в день (разовая доза — 1000 ME, суточная доза — 5000 ME). Взрослым (старше 14 лет) рекомендуется применять препарат по 3 капли/дозы 5—6 раз в день (разовая доза — 3000 ME, суточная доза — 15 000—18 000 ME).
Для профилактики Гриппферон® закапывают в разовой возрастной дозировке 2 раза в день на протяжении контакта с больным. При необходимости профилактические курсы повторяют.
Гриппферон® с лоратадином, мазь назальная — оригинальный безрецептурный комбинированный препарат, содержащий в своем составе рекомбинантный человеческий интерферон альфа-2b и антигистаминную субстанцию второго поколения — лоратадин. Препарат предназначен для лечения и профилактики гриппа и ОРВИ у взрослых, включая пациентов с аллергическим ринитом.
Препарат предназначен для лечения и профилактики гриппа и ОРВИ у взрослых, включая пациентов с аллергическим ринитом.
Как рекомендовать
Клиент: Здравствуйте! Похоже, я простудился. А у меня дочка маленькая и жена на четвертом месяце, болеть им совсем нельзя. Что лучше взять, чтобы и себе помочь, и близких защитить?
Первостольник: Возьмите Гриппферон® — он подходит и для лечения, и для профилактики гриппа и ОРВИ для всех членов семьи. Гриппферон® действует на причину заболевания — подавляет распространение вирусов в слизистой оболочке носа, помогает быстро снять основные симптомы болезни и снизить риск осложнений гриппа и ОРВИ¹.
Клиент: А беременным Гриппферон® можно?
Первостольник: Да, в течение всего срока. Препарат успешно прошел клинические испытания² и подтвердил свою безопасность, в т.ч. у беременных и у детей с рождения. А если болезнь протекает в легкой или средней форме, прием Гриппферона поможет избежать назначения антибиотиков — сами понимаете, как это важно для беременных.
Клиент: Хорошо, что безопасен для детей. А то у нас дочка часто болеет… Кстати, это таблетки? Мы ребенка никак не можем к таблеткам приучить.
Первостольник: Тогда точно Гриппферон® — то, что вам нужно! Это спрей или капли назальные. Такая форма помогает препарату сразу же начать работать на слизистой носа —именно там, где вирусы и проникают в организм.
Клиент: Хорошо, а как часто необходимо его закапывать?
Первостольник: Взрослому для лечения — по 3 капли/дозы спрея в каждую ноздрю 5—6 раз в сутки, 5 дней. Для профилактики Гриппферон® достаточно использовать всего дважды в сутки в возрастной дозе. Если же заболевание сопровождается аллергическими проявлениями, могу еще посоветовать мазь назальную Гриппферон® с лоратадином для взрослых. Препарат поможет избавиться от насморка, чиханья и других аллергических симптомов.
Клиент: Спасибо. Я возьму Гриппферон® для жены и дочки, а себе — Гриппферон® с лоратадином.
1Краснов В.В. Эффективность рекомбинантного интерферона альфа в лечении и профилактике ОРВИ. Вопросы практической педиатрии, 2016, т. 11, №4. — С. 44–52.
2Клинические и экспериментальные исследования Гриппферона проведены на 4450 испытуемых в 14 научно-исследовательских и клинических центрах России и Украины.
Генферон Лайт спрей с интерфероном и таурином для лечения и профилактики гриппа и ОРВИ
Генферон® Лайт спрей — единственный противовирусный назальный спрей для лечения и профилактики ОРВИ и гриппа с максимальной* дозой активного вещества для взрослых и детей с 14 лет. Разрешено к применению у беременных женщин.
Генферон® Лайт спрей — максимум* в 1 дозе. Комфортно, современно, удобно.
Преимущества препарата:
- Активно борется с вирусами и бактериями в месте их вторжения — полости носа
- Обладает универсальным противовирусным действием
- Активирует защитный местный иммунитет
- Содержит глицерол**, известный своими увлажняющими свойствами1,2
- Содержит масло мяты**
Награды и исследования:
- Генферон® Лайт — единственная в России комбинация интерферона и таурина*** для лечения и профилактики ОРВИ и гриппа
- Генферон® Лайт прошел испытания в 9 крупных клинических исследованиях на 1579 пациентах
Преимущества формы выпуска:
- Дозированная насадка-распылитель Генферон® Лайт в форме спрея обеспечивает комфортное использование и точность дозы: 1 нажатие — 1 доза 50 тыс.
 МЕ препарата
МЕ препарата - Генферон® Лайт в форме спрея обеспечивает мелкодисперсное («туманообразное») распыление препарата для создания равномерного распределения по всей поверхности носоглотки, помогая блокировать вирусное вторжение
- Специальная конструкция флакона с насосом обеспечивает полное использование противовирусного средства без остатка
- Экономичность спрея Генферон® Лайт: в одном флаконе противовирусного спрея содержится 100 доз. Можно использовать в течение нескольких эпизодов простудных заболеваний или для профилактики в течение всего простудного сезона
- Использовать вскрытый флакон Генферон® Лайт можно до конца срока годности препарата
- Можно сочетать с другими лекарственными средствами (симптоматическими, этиотропными)
- Для формы спрея не характерны побочные эффекты со стороны желудка, свойственные пероральным лекарственным средствам
Другие формы выпуска
Эксперт назвал необходимые во время пандемии COVID-19 препараты :: Общество :: РБК
 Об этом газете «Аргументы и факты» рассказал заведующий кафедрой общей и клинической фармакологии РУДН, профессор Сергей Зырянов.
Об этом газете «Аргументы и факты» рассказал заведующий кафедрой общей и клинической фармакологии РУДН, профессор Сергей Зырянов.При этом он подчеркнул, что среди жаропонижающих лекарств стоит выбирать те, в которых содержится парацетамол, а не ибупрофен.
«Ни в коем случае не стоит покупать антибиотики и лечиться ими без назначения врача, — добавил Зырянов. — Я не говорю уже о противовирусных препаратах, которые самостоятельно пить нельзя. Они обладают массой нежелательных реакций. И назначаться могут только под контролем врача».
По словам профессора, сейчас появилась информация о том, что при COVID-19 стоит употреблять витамин D, так как его дефицит ухудшает течение заболевания.
|
B02BA |
витамин K |
менадиона натрия бисульфит |
раствор для внутримышечного введения |
|
B02BC |
местные гемостатики |
фибриноген + тромбин |
губка |
|
B02BD |
факторы свертывания крови |
антиингибиторный коагулянтный комплекс |
лиофилизат для приготовления раствора для инфузий |
|
мороктоког альфа |
лиофилизат для приготовления раствора для внутривенного введения |
||
|
нонаког альфа |
лиофилизат для приготовления раствора для внутривенного введения |
||
|
октоког альфа |
лиофилизат для приготовления раствора для внутривенного введения |
||
|
фактор свертывания крови VII |
лиофилизат для приготовления раствора для внутривенного введения |
||
|
фактор свертывания крови VIII |
лиофилизат для приготовления раствора для внутривенного введения; лиофилизат для приготовления раствора для инфузий; раствор для инфузий (замороженный) |
||
|
фактор свертывания крови IX |
лиофилизат для приготовления раствора для внутривенного введения; лиофилизат для приготовления раствора для инфузий |
||
|
|
лиофилизат для приготовления раствора для внутривенного введения |
||
|
факторы свертывания крови II, IX и X в комбинации |
лиофилизат для приготовления раствора для инфузий |
||
|
фактор свертывания крови VIII + фактор Виллебранда |
лиофилизат для приготовления раствора для внутривенного введения |
||
|
эптаког альфа (активированный) |
лиофилизат для приготовления раствора для внутривенного введения |
||
|
B02BX |
другие системные гемостатики |
ромиплостим |
порошок для приготовления раствора для подкожного введения |
|
элтромбопаг |
таблетки, покрытые пленочной оболочкой |
||
|
этамзилат |
раствор для внутривенного и внутримышечного введения; раствор для инъекций; раствор для инъекций и наружного применения; |
||
|
B03 |
антианемические препараты |
||
|
B03A |
препараты железа |
||
|
B03AB |
пероральные препараты трехвалентного железа |
железа (III) гидроксид полимальтозат |
капли для приема внутрь раствор для приема внутрь; сироп; таблетки жевательные |
|
B03AC |
парентеральные препараты трехвалентного железа |
железа (III) гидроксида сахарозный комплекс |
раствор для внутривенного введения |
|
железа карбоксимальтозат |
раствор для внутривенного введения |
||
|
B03B |
витамин B12 и фолиевая кислота |
||
|
B03BA |
витамин B12 (цианокобаламин и его аналоги) |
цианокобаламин |
раствор для инъекций |
|
B03BB |
фолиевая кислота и ее производные |
фолиевая кислота |
таблетки; таблетки, покрытые пленочной оболочкой |
|
B03X |
другие антианемические препараты |
||
|
B03XA |
другие антианемические препараты |
дарбэпоэтин альфа |
раствор для инъекций |
|
метоксиполиэтиленгликоль-эпоэтин бета |
раствор для внутривенного и подкожного введения |
||
|
эпоэтин альфа |
раствор для внутривенного и подкожного введения |
||
|
эпоэтин бета |
лиофилизат для приготовления раствора для внутривенного и подкожного введения; лиофилизат для приготовления раствора для подкожного введения; раствор для внутривенного и подкожного введения |
||
|
B05 |
кровезаменители и перфузионные растворы |
||
|
B05A |
кровь и препараты крови |
||
|
B05AA |
кровезаменители и препараты плазмы крови |
альбумин человека |
раствор для инфузий |
|
гидрокси-этилкрахмал |
раствор для инфузий |
||
|
декстран |
раствор для инфузий |
||
|
желатин |
раствор для инфузий |
||
|
B05B |
растворы для внутривенного введения |
||
|
B05BA |
растворы для парентерального питания |
жировые эмульсии для парентерального питания |
эмульсия для инфузий |
|
B05BB |
растворы, влияющие на водно-электролитный баланс |
декстроза + калия хлорид + натрия хлорид + натрия цитрат |
порошок для приготовления раствора для приема внутрь; порошок для приготовления раствора для приема внутрь (для детей) |
|
калия хлорид + натрия ацетат + натрия хлорид |
раствор для инфузий |
||
|
меглюмина натрия сукцинат |
раствор для инфузий |
||
|
натрия лактата раствор сложный |
раствор для инфузий |
||
|
(калия хлорид + кальция хлорид + натрия хлорид + натрия лактат) |
|||
|
натрия хлорида раствор сложный (калия хлорид + кальция хлорид + натрия хлорид) |
раствор для инфузий |
||
|
натрия хлорид + калия хлорид + кальция хлорида дигидрат + магния хлорида гексагидрат + натрия ацетата тригидрат + яблочная кислота |
раствор для инфузий |
||
|
B05BC |
растворы с осмодиуретическим действием |
маннитол |
раствор для инфузий |
|
B05C |
ирригационные растворы |
||
|
B05CX |
другие ирригационные растворы |
декстроза |
раствор для внутривенного введения; раствор для инфузий |
|
B05D |
растворы для перитонеального диализа |
растворы для перитонеального диализа |
|
|
B05X |
добавки к растворам для внутривенного введения |
||
|
B05XA |
растворы электролитов |
калия хлорид |
концентрат для приготовления раствора для инфузий; концентрат для приготовления раствора для инфузий и приема внутрь; раствор для внутривенного введения |
|
магния сульфат |
раствор для внутривенного введения; раствор для внутривенного и внутримышечного введения |
||
|
натрия гидрокарбонат |
раствор для инфузий |
||
|
натрия хлорид |
раствор для инфузий; раствор для инъекций; растворитель для приготовления лекарственных форм для инъекций |
||
|
C |
сердечно-сосудистая система |
||
|
C01 |
препараты для лечения заболеваний сердца |
||
|
C01A |
сердечные гликозиды |
||
|
C01AA |
гликозиды наперстянки |
дигоксин |
раствор для внутривенного введения; таблетки; таблетки (для детей) |
|
C01B |
антиаритмические препараты, классы I и III |
||
|
C01BA |
антиаритмические препараты, класс IA |
прокаинамид |
раствор для внутривенного и внутримышечного введения; раствор для инъекций; таблетки |
|
C01BB |
антиаритмические препараты, класс IB |
лидокаин |
гель для местного применения; капли глазные; раствор для внутривенного введения; раствор для инъекций; спрей для местного и наружного применения; спрей для местного применения дозированный |
|
C01BC |
антиаритмические препараты, класс IC |
пропафенон |
раствор для внутривенного введения; таблетки, покрытые пленочной оболочкой |
|
C01BD |
антиаритмические препараты, класс III |
амиодарон |
раствор для внутривенного введения; таблетки |
|
C01BG |
другие антиаритмические препараты, классы I и III |
лаппаконитина гидробромид |
таблетки |
|
C01C |
кардиотонические средства, кроме сердечных гликозидов |
||
|
C01CA |
адренергические и дофаминергические средства |
добутамин |
концентрат для приготовления раствора для инфузий; лиофилизат для приготовления раствора для инфузий; раствор для инфузий |
|
допамин |
концентрат для приготовления раствора для инфузий; раствор для инъекций |
||
|
норэпинефрин |
концентрат для приготовления раствора для внутривенного введения |
||
|
фенилэфрин |
раствор для инъекций |
||
|
эпинефрин |
раствор для инъекций |
||
|
C01CX |
другие кардиотонические средства |
левосимендан |
концентрат для приготовления раствора для инфузий |
|
C01D |
вазодилататоры для лечения заболеваний сердца |
||
|
C01DA |
органические нитраты |
изосорбида динитрат |
концентрат для приготовления раствора для инфузий; спрей дозированный; спрей подъязычный дозированный; таблетки; таблетки пролонгированного действия |
|
изосорбида мононитрат |
капсулы; капсулы пролонгированного действия; капсулы ретард; капсулы с пролонгированным высвобождением; таблетки; таблетки пролонгированного действия |
||
|
нитроглицерин |
аэрозоль подъязычный дозированный; капсулы подъязычные; концентрат для приготовления раствора для инфузий; пленки для наклеивания на десну; |
||
|
раствор для внутривенного введения; спрей подъязычный дозированный; таблетки подъязычные; таблетки сублингвальные |
|||
|
C01E |
другие препараты для лечения заболеваний сердца |
||
|
C01EA |
простагландины |
алпростадил |
концентрат для приготовления раствора для инфузий; лиофилизат для приготовления раствора для инфузий |
|
C01EB |
другие препараты для лечения заболеваний сердца |
ивабрадин |
таблетки, покрытые пленочной оболочкой |
|
мельдоний |
капсулы; раствор для внутривенного и парабульбарного введения; раствор для внутривенного, внутримышечного и парабульбарного введения; раствор для инъекций |
||
|
C02 |
антигипертензивные средства |
||
|
C02A |
антиадренергические средства центрального действия |
||
|
C02AB |
метилдопа |
метилдопа |
таблетки |
|
C02AC |
агонисты имидазолиновых рецепторов |
клонидин |
раствор для внутривенного введения; таблетки |
|
моксонидин |
таблетки, покрытые оболочкой; таблетки, покрытые пленочной оболочкой |
||
|
C02C |
антиадренергические средства периферического действия |
||
|
C02CA |
альфа-адреноблокаторы |
урапидил |
капсулы пролонгированного действия; раствор для внутривенного введения |
|
C02K |
другие антигипертензивные средства |
||
|
C02KX |
антигипертензивные средства для лечения легочной артериальной гипертензии |
бозентан |
таблетки диспергируемые; таблетки, покрытые оболочкой; таблетки, покрытые пленочной оболочкой |
|
C03 |
диуретики |
||
|
C03A |
тиазидные диуретики |
||
|
C03AA |
тиазиды |
гидрохлоротиазид |
таблетки |
|
C03B |
тиазидоподобные диуретики |
||
|
C03BA |
сульфонамиды |
индапамид |
капсулы; таблетки, покрытые оболочкой; таблетки, покрытые пленочной оболочкой; таблетки пролонгированного действия, покрытые оболочкой; таблетки пролонгированного действия, покрытые пленочной оболочкой; таблетки с контролируемым высвобождением, покрытые пленочной оболочкой; таблетки с модифицированным высвобождением, покрытые оболочкой |
|
C03C |
«петлевые» диуретики |
||
|
C03CA |
сульфонамиды |
фуросемид |
раствор для внутривенного и внутримышечного введения; раствор для инъекций; таблетки |
|
C03D |
калийсберегающие диуретики |
||
|
C03DA |
антагонисты альдостерона |
спиронолактон |
капсулы; таблетки |
|
C04 |
периферические вазодилататоры |
||
|
C04A |
периферические вазодилататоры |
||
|
C04AD |
производные пурина |
пентоксифиллин |
концентрат для приготовления раствора для внутривенного и внутриартериального введения; концентрат для приготовления раствора для инфузий; концентрат для приготовления раствора для инъекций; раствор для внутривенного введения; раствор для внутривенного и внутриартериального введения; раствор для инфузий; раствор для инъекций |
|
C07 |
бета-адреноблокаторы |
||
|
C07A |
бета-адреноблокаторы |
||
|
C07AA |
неселективные бета-адреноблокаторы |
пропранолол |
таблетки |
|
соталол |
таблетки |
||
|
C07AB |
селективные бета-адреноблокаторы |
атенолол |
таблетки; таблетки, покрытые оболочкой; таблетки, покрытые пленочной оболочкой |
|
бисопролол |
таблетки; таблетки, покрытые пленочной оболочкой |
||
|
метопролол |
раствор для внутривенного введения; таблетки; таблетки, покрытые пленочной оболочкой; таблетки пролонгированного действия, покрытые пленочной оболочкой; таблетки с замедленным высвобождением, покрытые оболочкой |
||
|
C07AG |
альфа- и бета-адреноблокаторы |
карведилол |
таблетки; таблетки, покрытые пленочной оболочкой |
|
C08 |
блокаторы кальциевых каналов |
||
|
C08C |
селективные блокаторы кальциевых каналов с преимущественным действием на сосуды |
||
|
C08CA |
производные дигидропиридина |
амлодипин |
таблетки; таблетки, покрытые пленочной оболочкой |
|
нимодипин |
раствор для инфузий; таблетки, покрытые пленочной оболочкой |
||
|
нифедипин |
раствор для инфузий; таблетки; таблетки, покрытые оболочкой; таблетки, покрытые пленочной оболочкой; таблетки, покрытые пленочной оболочкой, с модифицированным высвобождением; таблетки пролонгированного действия, покрытые оболочкой; таблетки пролонгированного действия, покрытые пленочной оболочкой; таблетки с контролируемым высвобождением, покрытые оболочкой; таблетки с контролируемым высвобождением, покрытые пленочной оболочкой; таблетки с модифицированным высвобождением, покрытые оболочкой |
||
|
C08D |
селективные блокаторы кальциевых каналов с прямым действием на сердце |
||
|
C08DA |
производные фенилалкиламина |
верапамил |
раствор для внутривенного введения; таблетки, покрытые оболочкой; таблетки, покрытые пленочной оболочкой; таблетки, пролонгированного действия, покрытые оболочкой; таблетки пролонгированного действия, покрытые пленочной оболочкой |
|
C09 |
средства, действующие на ренин-ангиотензиновую систему |
||
|
C09A |
ингибиторы АПФ |
||
|
C09AA |
ингибиторы АПФ |
каптоприл |
таблетки; таблетки, покрытые оболочкой |
|
лизиноприл |
таблетки |
||
|
периндоприл |
таблетки; таблетки, диспергируемые в полости рта; таблетки, покрытые пленочной оболочкой |
||
|
эналаприл |
таблетки |
||
|
C09C |
антагонисты рецепторов ангиотензина II |
||
|
C09CA |
антагонисты рецепторов ангиотензина II |
лозартан |
таблетки, покрытые оболочкой; таблетки, покрытые пленочной оболочкой |
|
C09DX |
антагонисты рецепторов ангиотензина II в комбинации с другими средствами |
валсартан + сакубитрил |
таблетки, покрытые пленочной оболочкой |
|
C10 |
гиполипидемические средства |
||
|
C10A |
гиполипидемические средства |
||
|
C10AA |
ингибиторы ГМГ-КоА-редуктазы |
аторвастатин |
капсулы; таблетки, покрытые оболочкой; таблетки, покрытые пленочной оболочкой |
|
симвастатин |
таблетки, покрытые оболочкой; таблетки, покрытые пленочной оболочкой |
Виролиз 800 мг спрей назальный порошковый
УТВЕРЖДЕНА
приказом Председателя
Комитета Фармации
Министерства здравоохранения
Республики Казахстан
Инструкция
по медицинскому применению изделия медицинского назначения
Название изделия медицинского назначения
Виролиз®
Состав и описание изделия
Виролиз® — назальный порошковый спрей, состоит исключительно из натуральных компонентов.
Состав: порошок целлюлозы растительного происхождения и экстракт дикого чеснока, порошок перечной мяты.
Описание: мелкодисперсный порошок белого или близко к белому цвета, с легким ароматом. По 800 мг во флаконе из полиэтилена с патентованным дозатором и навинчивающимся колпачком. 1 флакон вместе с инструкцией помещен в пачку из картона.
Виролиз® действует как естественный барьер на слизистой носа и используется для защиты от проникновения вдыхаемых вирусов и бактерий. Является профилактическим и защитным средством от гриппа и простудных заболеваний.
Порошок из дозатора, попадая на влажную поверхность носовой полости, образует прочную гелеобразную пленку, которая создает надежный барьер, не позволяющий вдыхаемым инфекционным возбудителям проникнуть в кровоток через микрососуды слизистой носа в течение дня.
Такой эффект происходит за счет основного действующего компонента — мелкодисперсной целлюлозы. Она покрывает слизистую носа тонким гелеобразным слоем, который выступает в роли фильтра, тем самым устраняя причину развития острых респираторных вирусных инфекций.
Содержащийся в Виролиз® экстракт дикого чеснока, обладает противомикробным и противовирусным действием, подавляет рост и размножение патогенных микроорганизмов. Благодаря этому, бактерии и вирусы, задержанные целлюлозным барьером, не могут воздействовать на слизистую носа и быстро погибают.
Порошок перечной мяты придает средству приятный аромат.
Один флакон содержит до 200 доз и рассчитан до 30 дней применения.
Не содержит лекарств, консервантов, а также системно и местно действующих веществ, быстрого действия, с клинически доказанной эффективностью. Не вызывает привыкания и сонливости.
Область применения
— для профилактики и в составе комплексного лечения острых респираторных вирусных инфекций (ОРВИ) и гриппа
Применяется у детей с 1,5 лет, только под наблюдением взрослых, у взрослых, у женщин в период беременности и кормления грудью.
Способ применения
Впрыскивания в нос — по одному впрыску в каждый носовой ход.
Действие наступает через несколько минут после впрыскивания.
Рекомендуется использовать Виролиз® при первых симптомах гриппа и простуды, или профилактически — заранее, перед возможным контактом с воздушно-капельными инфекциями при посещении мест большого скопления людей (школы, офисы, торговые центры, самолеты, общественный транспорт и т.д.).
Применение по одному впрыску 3 раза в день — достаточно для защиты в течение всего дня.
Рекомендуется повторять впрыскивания после каждого очищения носа, для возобновления образования защитного слоя.
Инструкция по применению
Перед первым использованием нужно правильно настроить дозирующее устройство для рационального получения оптимальной дозы. Для этого расположите флакон-дозатор от себя, слегка нажмите на стенки флакона, сделайте 2 пробных впрыскивания в воздух – вы увидите струйку белого порошка и ощутите легкий аромат.
Перед каждым применением встряхните флакон!
1. Аккуратно прочистите нос.
2. Снимите колпачок.
3. Сделайте выдох.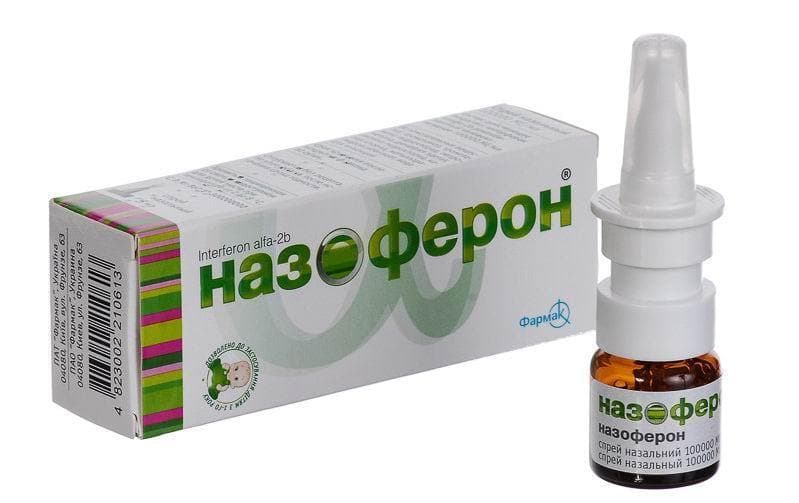
4. Зажмите пальцем одну ноздрю.
5. Поместите кончик флакона в другую ноздрю.
6. Медленно, но крепко сожмите стенки флакона для выделения одной «струи» порошка Виролиз®, одновременно осторожно вдыхая его.
7. Задержите дыхание на две секунды и сделайте глубокий спокойный вдох, чтобы препарат проник в носовые ходы.
8. Повторите аналогичную процедуру с противоположной стороны.
Для того, чтобы получить максимальный эффект необходимо поддерживать гелеобразную пленку, образующуюся при применении порошкового спрея на внутренней поверхности носа. Используйте Виролиз® как минимум 3 раза в день или по мере надобности.
ВНИМАНИЕ
При соприкосновении кончика флакона с влажной слизистой носовой полости возможно образование гелевой пробочки в дозаторе. В этом случае следует прочистить концевое отверстие дозатора –спрея.
Противопоказания
Не применять при повышенной чувствительности к целлюлозе, экстракту чеснока и мяты.
Побочные действия
В виду того, что активные компоненты медицинского изделия не поступают в системный кровоток и не оказывают местного действия, побочные эффекты не отмечаются.
Меры предосторожности
Только для интраназального применения.
Не использовать одновременно с другими назальными спреями, т.к. это может снизить эффективность Виролиз®.
При попадании порошка в глаза рекомендуется промыть их водой.
При возникновении аллергической реакции проконсультируйтесь с врачом.
Сохраняйте флакон и его наконечник сухими. Не мойте флакон водой или другими жидкостями, так как вода может в него попасть
Условия хранения
Хранить в сухом месте, при температуре не выше 25оС. Колпачок флакона должен быть плотно закрыт.
Не применять при повреждении флакона.
Хранить в недоступном для детей месте!
Срок годности
3 года.
Не использовать по истечении срока годности.
Организация-производитель
«Назализ Лтд».
Unit 3, Woodside House, Ballafletcher Business Park, Douglas, IM4 4QE, Isle of Man, Великобритания.
Держатель регистрационного удостоверения
«Сэлтфар Лтд».
Suite 12, 2-nd floor, Queens House, 180 Tottenham Court Road, London, W1T 7 PD, Великобритания.
Организация, принимающая на территории Республики Казахстан претензии по изделиям медицинского назначения от потребителей и ответственная за пострегистрационное наблюдение за безопасность:
Представительство «Сэлтфар СА». г. Алматы, пр. Аль-Фараби 5, Нурлы Тау 1А, офис 301. Тел\факс +7 (727) 311 16 28.
Виролиз® является изделием медицинского назначения, имеет маркировку СЕ и соответствует требованиям Директивы 93/42 Европейского Союза.
Бездействующие лекарственные препараты: найти и выбросить
Валерьянка известна многим людям как популярное
успокоительное средство. Настойка эхинацеи — в качестве
иммуностимулятора для борьбы с часто повторяющимися простудами. Глицин
рекомендуется принимать школьникам в период интенсивных умственных
нагрузок. Что объединяет эти препараты? Отсутствие доказанной
эффективности.
Правильно проводимый контроль лечебных характеристик лекарственных соединений — один из инструментов доказательной медицины. Он подразумевает исследование действия вещества на больших выборках людей (несколько тысяч), использование метода тройного ослепления, когда ни пациенты, ни исследователи, ни специалисты, обрабатывающие результаты, не знают, пустышку или лекарство получали представители контрольной и экспериментальной групп. Столь же важно провести метаанализ — клинические испытания препарата в разных странах, на разных национальностях и выборках (не менее 1,5 тысяч человек), для поиска и последующего изучения полученных различий. В идеале новое лекарство должно работать одинаково для всех групп. Чуть ниже уровень доверия к рандомизированным клиническим исследованиям — они проводятся для больших групп, без усреднения по популяции.
Какие же препараты проходят весь спектр этих проверок, а самое главное:
где посмотреть выводы? Существует несколько баз данных, в которых
опубликованы результаты независимых медицинских исследований, когда-либо
проводившихся по разным фармакологическим соединениям.
«Самое лучшее, что вы можете найти — это база данных глобального сообщества “Кокрейн” (Cochrane). Если препарат попал в нее, и в авторском заключении написано, что это лекарство работает, то его действительно можно рекомендовать к использованию», — рассказывает старший научный сотрудник ФИЦ «Институт цитологии и генетики СО РАН», научный сотрудник Новосибирского института органической химии им. Н.Н. Ворожцова СО РАН кандидат биологических наук Татьяна Сергеевна Фролова.
Cochrane — международная некоммерческая организация, исследующая эффективность медицинских препаратов и процедур. Кокрейновское содружество включает более 11 000 членов и 35 000 сторонников. Это ученые, врачи, пациенты из 130 стран.
Следующий по значимости источник информации для принятия решения об
эффективности лекарства — сайт управления по контролю качества пищевых и
лекарственных продуктов США (FDA). Также можно использовать самую
большую базу данных по медицинским и биологическим научным статьям —
NCBI или медицинскую предметную рубрику MeSH.
«Последнее — это что-то вроде облака тегов, когда вы не знаете, что конкретно хотите найти, но хотите узнать, как работает, например, физиотерапия или магнитотерапия», — поясняет Татьяна Фролова.
Собственно говоря, а зачем искать? Без валерьянки, эхинацеи и глицина вполне можно прожить. Однако проблема в том, что многие из бездействующих препаратов широко рекламируются, а некоторые входят в перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения (ЖНВЛП).
Перечень ЖНВЛП — ежегодно утверждаемый правительством Российской Федерации перечень лекарственных препаратов для медицинского применения, обеспечивающих приоритетные потребности здравоохранения в целях профилактики и лечения заболеваний, в том числе преобладающих в структуре заболеваемости в Российской Федерации (см. Федеральный закон «Об обращении лекарственных средств» от 12.04.2010 № 61-ФЗ).
Так называемые фуфломицины можно разделить на несколько групп:
гомеопатические вещества, иммуностимуляторы, противовирусные средства,
биологически активные добавки, ноотропы, хондропротекторы.
С первыми, казалось бы, всё ясно: согласно тем схемам разведения, что используются для приготовления этого типа «лекарств», в них нет ни одной молекулы действующего вещества.
«Основная опасность состоит в том, что при лечении гомеопатией пациенты
рискуют запустить действительно серьезное заболевание до такой стадии,
когда не поможет и доказательная медицина. В частности, не так давно
рекламировался гомеопатический препарат “Анаферон детский” для
профилактики клещевого энцефалита уже после укуса клеща. В этом случае
ребенку нужно вводить сывороточный иммуноглобулин, а не “лечить” его
“Анафероном”», — отмечает Татьяна Фролова.
Никакого эффекта, кроме плацебо, не оказывают иммуностимуляторы и большинство противовирусных средств. К первым относится популярная настойка эхинацеи и другие препараты, призванные «улучшить» иммунитет.
«Иммунитет бывает врожденный и приобретенный. Последний, в свою
очередь, тоже делится на два вида: естественный, который приобретается с
молоком матери или в результате перенесенной инфекции, и искусственный —
он возникает после введения вакцины с возбудителем болезни (прививки)
или сыворотки с уже готовыми антителами. Болеть простудой вы всё равно
будете, это нормально, нужно дать себе время восстановиться,
иммуностимуляторы никакой роли в выздоровлении не сыграют», — говорит
Татьяна Фролова.
Болеть простудой вы всё равно
будете, это нормально, нужно дать себе время восстановиться,
иммуностимуляторы никакой роли в выздоровлении не сыграют», — говорит
Татьяна Фролова.
Аналогичное бездействие у многих противовирусных препаратов: например, среди тех, что рекламируются как средство помощи при гриппе, почти нет лекарств с доказанной эффективностью. FDA рекомендует только три средства: «Тамифлю», «Реленза» и «Рапиваб» («Перамивир»). Однако, согласно данным Cochrane, первые два оказывают небольшое, неспецифическое действие, сокращая время, требуемое для облегчения симптомов гриппа у взрослых. К тому же действующее вещество «Тамифлю» (озелтамивир) усиливает риск возникновения побочных эффектов (тошнота, рвота, реакция со стороны почек). Данные по «Рапивабу» в базе Cochrane отсутствуют.
«Как правило, большинство простудных вирусных заболеваний проходит само
по себе через три — пять дней максимум неделю, поэтому фармацевтические
фирмы любят вкладываться в производство соответствующих препаратов. Самый популярный из них в России — “Арбидол”, разработанный как
отечественная альтернатива “Тамифлю”. В качестве доказательства
эффективности первого часто приводят информацию о том, что он
зарегистрирован в классификаторе Всемирной организации здравоохранения, в
разделе “Противовирусные, противомикробные препараты”. Это ничего не
говорит о действии или бездействии лекарства, а означает лишь только то,
что ВОЗ о нем знает, но не дает никаких рекомендаций по его применению.
Упоминаний об “Арбидоле” я не нашла ни в Cochrane, ни в базе данных
FDA. Есть лишь одна публикация в Pubmed, в которой авторы взяли очень
маленькую выборку пациентов, наблюдали за ними в течение трех дней на
фоне приема “Арбидола”, после чего, согласно данным статьи, почти всем
испытуемым стало лучше. А через девять дней они поправились», —
рассказывает Татьяна Фролова.
Самый популярный из них в России — “Арбидол”, разработанный как
отечественная альтернатива “Тамифлю”. В качестве доказательства
эффективности первого часто приводят информацию о том, что он
зарегистрирован в классификаторе Всемирной организации здравоохранения, в
разделе “Противовирусные, противомикробные препараты”. Это ничего не
говорит о действии или бездействии лекарства, а означает лишь только то,
что ВОЗ о нем знает, но не дает никаких рекомендаций по его применению.
Упоминаний об “Арбидоле” я не нашла ни в Cochrane, ни в базе данных
FDA. Есть лишь одна публикация в Pubmed, в которой авторы взяли очень
маленькую выборку пациентов, наблюдали за ними в течение трех дней на
фоне приема “Арбидола”, после чего, согласно данным статьи, почти всем
испытуемым стало лучше. А через девять дней они поправились», —
рассказывает Татьяна Фролова.
Как вы уже могли догадаться, ноотропы («Глицин»), нейропротекторы
(«Семакс»), гепато- и хондропротекторы, фитопрепараты тоже не облегчат
ваше состояние при болезни, зато в некоторых случаях солидно уменьшат
вес кошелька.
«Глицин — это аминокислота, которая действительно участвует в передаче импульсов между нервными клетками. Беда в том, что он никогда не попадет в центральную нервную систему из желудочно-кишечного тракта, потому что ЦНС защищена плотной оболочкой. Нейропротектор, или антиоксидант — “Семакс” — входит в перечень жизненно-важных лекарственных средств. Не так давно было исследование того, что препараты, которые всасываются в ЖКТ, подвергаются расщеплению в печени и не оказывают воздействия на головной мозг. Производители “Семакса” предложили использовать его в качестве назальных капель. Тем не менее вывести средство на международный рынок не удается, потому что о нем нет никаких упоминаний в базах FDA и Cochrane, а есть лишь только статья на Pubmed, в которой опубликованы результаты заказного рандомизированного клинического исследования», — объясняет Татьяна Фролова.
Кроме лекарственных препаратов — фуфломицинов, есть еще и
бездействующие методы лечения: физио- и цветотерапия, лечение
ультразвуком (за исключением ультразвуковой чистки зубов),
магнитотерапия.
«Физиотерапия в нашей стране — это подраздел реабилитации, который включает лечебную физкультуру и воздействие физическими методами на организм. Например, гальванизацией, электрофорезом, микрополяризацией. Нет ни одного исследования, которое бы доказывало их эффективность. В США и Европе физиотерапия подразумевает то, что человеку помогают восстановиться через двигательную активность с использованием специальных приспособлений, в том числе роботизированных. Магнитотерапия в этих странах признана лженаукой, лечить таким методом запрещено, у нас же до сих пор он прописывается медицинскими работниками», — замечает исследовательница.
Одним словом, если свидетельств эффективности препарата еще нет, то это, конечно, не значит, что он не работает. Но, скорее всего, так и есть, потому что любой производитель лекарственных средств заинтересован в том, чтобы их результативность была доказана, ведь это окупит многократные вложения в разработку.
«Какие есть преимущества у лекарств-пустышек? Если пациенты приходят к
врачу с вымышленными болями, им нужно, чтобы прописали хоть что-то. После этого их зачастую действительно отпускает, потому что средства,
работающие на эффекте плацебо, отлично с этой функцией справляются.
Поэтому все вышеназванные препараты — для здоровых. Как только вы
заболели, добро пожаловать на Cochrane!» — советует Татьяна Фролова.
После этого их зачастую действительно отпускает, потому что средства,
работающие на эффекте плацебо, отлично с этой функцией справляются.
Поэтому все вышеназванные препараты — для здоровых. Как только вы
заболели, добро пожаловать на Cochrane!» — советует Татьяна Фролова.
Надежда Дмитриева
Доказана эффективность назального спрея INNA-051 от коронавируса
30 Сентября 2020Доказана эффективность назального спрея INNA-051 от коронавируса
Компания Ena Respiratory заявила об эффективности назального спрея INNA-051 в снижении уровня репликации коронавируса в организме. Исследования препарата были проведены на хорьках.Австралийская биотехнологическая компания Ena Respiratory заявила об успешно проведенных исследованиях своей разработки, назального спрея для улучшения иммунной системы человека и борьбы с простудой и гриппом. Согласно результатам испытаний препарата на животных, спрей способствовал значительному снижению распространения коронавируса в теле.
Исследование на хорьках продемонстрировало, что препарат под названием INNA-051 способен снизить уровень репликации COVID-19 в теле. Исследование проводилось британским правительственным агентством Public Health England. Отмечается, что INNA-051 можно использовать как метод противовирусной профилактической терапии в дополнение к вакцинам от коронавируса.
В сообщении Ena Respiratory также говорится, что компания будет готова провести испытания INNA-051 на людях в течение ближайших четырех месяцев, при условии успешного изучения токсичности препарата и получения одобрения от регулирующих органов.
Компания привлекла 8,24 миллиона долларов США на разработку спрея. Среди инвесторов в производство препарата: венчурная фирма Brandon Capital, Правительство Австралии, местные пенсионные фонды и крупная австралийская биотехнологическая компания CSL Limited.
На данный момент в Австралии зарегистрировано 875 случаев смерти от коронавируса и чуть более 27 000 случаев заболевания.
INNA-051 — это синтетическая молекула, которая вводится в организм с помощью простого в использовании назального спрея, принимаемого один или два раза в неделю, причем эффект наступает практически незамедлительно.
Действие INNA-051 заключается в стимуляции врожденной иммунной системы, с противодействием которой прежде всего сталкиваются микроорганизмы и токсины, успешно преодолевшие физические защитные барьеры организма. Таким образом можно повышать иммунный ответ человека с помощью INNA-051 еще до заражения COVID-19.
Ранее «ФВ» писал, что в Великобритании планируется проведение исследований ингаляционных форм вакцин от коронавируса.
Источник:https://pharmvestnik.ru/content/news/Dokazana-effektivnost-nazalnogo-spreya-INNA-051-ot-koronavirusa.html
Взаимодействие между Flumist Quad 2019-2020 Назальный и вакцина-вирус гриппа-вакцина-живые-отобранные-противовирусные-агенты
Наркотики и лекарстваFlumist Quad 2019-2020 10Exp6,5-7,5 Единица FF / шприц для назального спрея 0,2 мл Вакцина от гриппаВзаимодействие живой вакцины против вируса гриппа / отдельных противовирусных агентов
Эта информация носит общий характер и не предназначена для использования в качестве конкретной медицинской рекомендации. Проконсультируйтесь со своим лечащим врачом перед приемом или прекращением приема любого лекарства или началом любого курса лечения.
Проконсультируйтесь со своим лечащим врачом перед приемом или прекращением приема любого лекарства или началом любого курса лечения.
Медицинское предупреждение:
Очень серьезно. Эти лекарства могут взаимодействовать друг с другом и вызывать очень вредные эффекты и обычно не принимаются вместе. Обратитесь к своему лечащему врачу (например, врачу или фармацевту) для получения дополнительной информации.
Как происходит взаимодействие:
Амантадин, балоксавир, осельтамивир, римантадин, занамивир могут инактивировать вакцину до того, как ваш организм сможет выработать иммунитет к вирусу гриппа.
Что может случиться:
У вас может не развиться иммунитет к вирусу гриппа, если он вводится вместе или в течение 48 часов после использования амантадина, балоксавира, осельтамивира, римантадина или занамивира, или если вы принимаете амантадин, римантадин или занамивир в течение 2 недель после введения интраназальной вакцины против гриппа. .
.
Что делать с этим взаимодействием:
Сообщите своим медицинским работникам (например, врачу или фармацевту) до введения интраназальной вакцины против гриппа, принимали ли вы амантадин, балоксавир, римантадин или занамивир в течение предыдущих 48 часов. Если вы получили интраназальную вакцину против гриппа в течение предыдущих двух недель, сообщите об этом своему лечащему врачу, прежде чем начинать прием амантадина, осельтамивира, римантадина или занамивира. Возможно, ваши медицинские работники уже знают об этом взаимодействии и могут следить за вами.Не начинайте, не останавливайте и не изменяйте дозировку каких-либо лекарств, пока не проконсультируетесь с ними.
- 1.Symmetrel (гидрохлорид амантадина) Информация по назначению в США. Endo Pharmaceuticals Inc., январь 2009 г.
- 2. Тамифлю (осельтамивир фосфат) Информация о назначении в США. Roche Laboratories, Inc., март 2018 г.
- 3.Флумадин (ремантадин гидрохлорид) Информация по назначению в США.
 Forest Pharmaceuticals, Inc. Апрель 2010 г.
Forest Pharmaceuticals, Inc. Апрель 2010 г. - 4.Реленза (занамивир) США информация о назначении. GlaxoSmithKline, июнь 2018 г.
- 5. Xofluza (балоксавир) Информация по назначению США. Genentech USA, Inc. Ноябрь 2020 г.
- 6.FluMist (вакцина против вируса гриппа живая, интраназальная) Информация о назначении в США. ООО «МедИммун» июль 2010 г.
Выбрано из данных, включенных с разрешения и защищенных авторским правом First Databank, Inc. Этот защищенный авторским правом материал был загружен у лицензированного поставщика данных и не предназначен для распространения, за исключением случаев, когда это разрешено применимыми условиями использования.
УСЛОВИЯ ИСПОЛЬЗОВАНИЯ: Информация в этой базе данных предназначена для дополнения, а не подмены опыта и суждений специалистов здравоохранения. Информация не предназначена для охвата всех возможных применений, указаний, мер предосторожности, лекарственных взаимодействий или побочных эффектов, а также не должна толковаться как указание на то, что использование конкретного лекарства безопасно, подходит или эффективно для вас или кого-либо еще.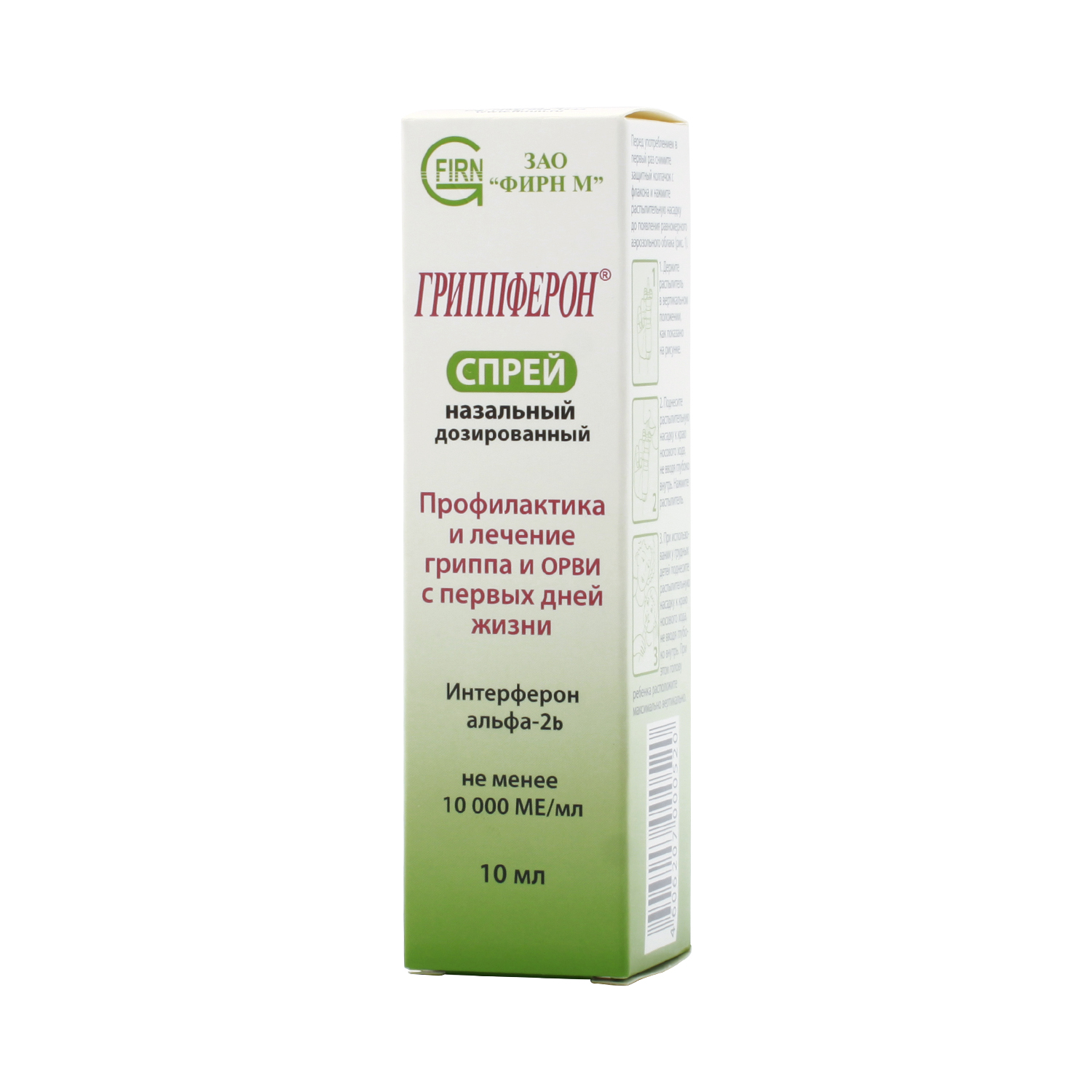 Перед приемом любого лекарства, изменением диеты или началом или прекращением любого курса лечения следует проконсультироваться с врачом.
Перед приемом любого лекарства, изменением диеты или началом или прекращением любого курса лечения следует проконсультироваться с врачом.
Каррагинан в спрее для носа при подтвержденном вирусе простуды: анализ данных двух рандомизированных контролируемых исследований отдельных пациентов Междисциплинарная респираторная медицина
Пациенты
В двух двойных слепых рандомизированных контролируемых исследованиях 254 вирус-положительных пациента были включены в группу лиц, которым назначено лечение (ITT). Из них 126 пациентов были рандомизированы для лечения каррагинаном, а 128 пациентов — для лечения плацебо. В популяции согласно протоколу (PP) оставался 191 пациент, разделенный на 97 пациентов в группе каррагинана и 94 пациента в группе плацебо (рисунок 1).
Рисунок 1Распределение пациентов, включенных в объединенный анализ.
Демографические данные представлены в таблице 2. Вирусная популяция ITT состояла из 136 женщин (59 каррагинан и 77 плацебо) и 118 мужчин (67 каррагинан и 51 плацебо) (таблица 2). Статистически значимая разница была выявлена в распределении мужчин и женщин в группах каррагинана и плацебо в ITT-популяции.Это различие получено в основном из исследования, проведенного на детях (средний возраст 5 лет) [14]. Тем не менее, анализ статистической корректировки был проведен, но не выявил разницы в результатах (данные не показаны). Никаких различий в распределении не наблюдалось ни в одной другой группе пациентов, например Популяция PP или одна из трех подгрупп, инфицированных вирусом (данные не показаны).
Вирусная популяция ITT состояла из 136 женщин (59 каррагинан и 77 плацебо) и 118 мужчин (67 каррагинан и 51 плацебо) (таблица 2). Статистически значимая разница была выявлена в распределении мужчин и женщин в группах каррагинана и плацебо в ITT-популяции.Это различие получено в основном из исследования, проведенного на детях (средний возраст 5 лет) [14]. Тем не менее, анализ статистической корректировки был проведен, но не выявил разницы в результатах (данные не показаны). Никаких различий в распределении не наблюдалось ни в одной другой группе пациентов, например Популяция PP или одна из трех подгрупп, инфицированных вирусом (данные не показаны).
Продолжительность симптомов и клиническая эффективность
На момент включения интенсивность симптомов простуды (оценка симптомов) была аналогичной для каррагинана (6.42 ± 0,18) и плацебо (6,59 ± 0,16) в популяции ITT (p = 0,485). Точно так же не было различий в популяции PP в соответствующих группах, каррагинан (6,47 ± 0,2) и плацебо (6,43 ± 0,18). Продолжительность симптомов простуды была значительно сокращена у пациентов, получавших каррагинан, по сравнению с пациентами, получавшими плацебо, как в ITT, так и в PP популяции. Средняя продолжительность заболевания уменьшилась на 1,9 дня в группе каррагинана ITT и на 1,7 дня в группе каррагинана PP по сравнению с соответствующими группами плацебо (ITT: p = 0.002; PP: p <0,016) (рисунок 2).
Точно так же не было различий в популяции PP в соответствующих группах, каррагинан (6,47 ± 0,2) и плацебо (6,43 ± 0,18). Продолжительность симптомов простуды была значительно сокращена у пациентов, получавших каррагинан, по сравнению с пациентами, получавшими плацебо, как в ITT, так и в PP популяции. Средняя продолжительность заболевания уменьшилась на 1,9 дня в группе каррагинана ITT и на 1,7 дня в группе каррагинана PP по сравнению с соответствующими группами плацебо (ITT: p = 0.002; PP: p <0,016) (рисунок 2).
Продолжительность симптомов простуды в группах ITT и PP. Продолжительность симптомов простуды у вирус-положительных пациентов, получавших каррагинан или плацебо, в популяции ITT или PP, соответственно (ITT: каррагинан против плацебо, p = 0,002; PP: каррагинан против плацебо, p = 0,016).
Рецидивы
В течение 21 дня наблюдения рецидивы наблюдались значительно чаще в группах плацебо, чем у пациентов, получавших каррагинан, независимо от ITT или PP популяции (ITT: p = 0. 003; PP: p = 0,01) (рисунок 3). Поскольку у некоторых пациентов было более одного рецидива в течение периода наблюдения, было рассчитано среднее количество рецидивов на пациента. Среднее количество рецидивов на одного пациента составляло 0,17 у пациентов, получавших каррагинан, по сравнению с 0,45 у пациентов, получавших плацебо, в популяции ITT (p = 0,002). Аналогичным образом, среднее количество рецидивов на пациента было значительно выше в группе плацебо, а именно 0,38 по сравнению с 0,15 в группе каррагинана в популяции PP в течение периода наблюдения (p = 0.01).
003; PP: p = 0,01) (рисунок 3). Поскольку у некоторых пациентов было более одного рецидива в течение периода наблюдения, было рассчитано среднее количество рецидивов на пациента. Среднее количество рецидивов на одного пациента составляло 0,17 у пациентов, получавших каррагинан, по сравнению с 0,45 у пациентов, получавших плацебо, в популяции ITT (p = 0,002). Аналогичным образом, среднее количество рецидивов на пациента было значительно выше в группе плацебо, а именно 0,38 по сравнению с 0,15 в группе каррагинана в популяции PP в течение периода наблюдения (p = 0.01).
Процент пациентов с рецидивами в течение 21-дневного периода наблюдения. Рецидивы в группах, получавших каррагинан и плацебо, представлены в популяции ITT и PP. (* р <0,05; ** р <0,01).
Анализ противовирусной эффективности
Для анализа противовирусной эффективности были включены пациенты с положительным результатом на вирус во время визита 1 (день 1), посещения 2 (дни 3-5) или во время обоих посещений. Пациенты, пропустившие визит 2, были исключены из анализа из-за неполных данных.Каждый обнаруженный вирус рассматривался как отдельное событие. При включении, независимо от популяции ITT или PP, средние титры вирусов (измеренные как log [x + 1]) полученных чисел копий ПЦР в реальном времени были аналогичными для каррагинана (ITT: 4,82 ± 0,2; PP: 4,42 ± 0,2) и плацебо ( ITT: 4,42 ± 0,2; PP: 4,66 ± 0,2) группы. На втором визите во всех группах наблюдалось значительное снижение титров вирусов. Однако в популяции ITT снижение вирусных титров было значительно более выраженным в группе каррагинана (-2.2 log [x + 1]), чем в группе плацебо (-1,1 log [x + 1]; p = 0,022). Данные показали, что лечение йота-каррагенаном привело к снижению вирусного титра при посещении 2, что было на порядок более чем на 90% сильнее по сравнению с лечением плацебо. Точно так же разница в титрах вирусов между визитом 1 и визитом 2 была значительно выше в группе каррагинана по сравнению с группой плацебо в популяции PP (каррагинан: -2,25, плацебо: -1,2; p = 0,044) (Таблица 3).
Пациенты, пропустившие визит 2, были исключены из анализа из-за неполных данных.Каждый обнаруженный вирус рассматривался как отдельное событие. При включении, независимо от популяции ITT или PP, средние титры вирусов (измеренные как log [x + 1]) полученных чисел копий ПЦР в реальном времени были аналогичными для каррагинана (ITT: 4,82 ± 0,2; PP: 4,42 ± 0,2) и плацебо ( ITT: 4,42 ± 0,2; PP: 4,66 ± 0,2) группы. На втором визите во всех группах наблюдалось значительное снижение титров вирусов. Однако в популяции ITT снижение вирусных титров было значительно более выраженным в группе каррагинана (-2.2 log [x + 1]), чем в группе плацебо (-1,1 log [x + 1]; p = 0,022). Данные показали, что лечение йота-каррагенаном привело к снижению вирусного титра при посещении 2, что было на порядок более чем на 90% сильнее по сравнению с лечением плацебо. Точно так же разница в титрах вирусов между визитом 1 и визитом 2 была значительно выше в группе каррагинана по сравнению с группой плацебо в популяции PP (каррагинан: -2,25, плацебо: -1,2; p = 0,044) (Таблица 3).
Поскольку у некоторых пациентов было обнаружено более одного вируса, группы лечения сравнивали по количеству вирусов на пациента при посещении 1 и 2.В то время как на исходном уровне группы существенно не различались, при посещении 2 количество вирусов на пациента было значительно ниже в группе каррагинана. Соответственно, изменение количества вирусов на пациента между визитом 2 и визитом 1 было более выраженным в группе каррагинана: в среднем пациент, получавший плацебо, удалил 0,15 ± 0,07 вируса, в то время как пациенты, получавшие каррагинан, потеряли 0,37 ± 0,07 вируса в популяции ITT ( р = 0,02). Точно так же в популяции PP клиренс вируса составлял 0,14 ± 0,7 в группе плацебо по сравнению с 0.38 ± 0,7 в группе каррагинана (p = 0,025). У пациентов, получавших каррагинан, наблюдалось значительное увеличение числа свободных от вирусов пациентов между визитом 1 и визитом 2 в ITT, а также в популяции PP. Напротив, у пациентов, получавших плацебо, не было никаких различий среди людей, свободных от вирусов, между посещением 1 и посещением 2 (таблица 4). На рисунке 4 показан процент пациентов с ухудшением (определяемым как более чем 50-кратное увеличение титра вируса при посещении 2 или обнаружением нового вируса, который не был выявлен при посещении 1) или улучшением (определяемым как более чем 50-кратное снижение титра вируса при посещении 2 или элиминация вируса, который присутствовал при посещении 1) или отсутствие изменений (определяемых как титр вируса от 1:50 до 50: 1 при посещении 2 по сравнению с посещением 1) в статусе вируса между посещением 1 и посетите 2.Значительно больше пациентов показали улучшение вирусного статуса между посещением 1 и посещением 2 у пациентов, получавших каррагинан, по сравнению с пациентами, получавшими плацебо, в ITT, а также в популяции PP. (ITT: p = 0,005; PP: p = 0,009, рисунок 4).
Напротив, у пациентов, получавших плацебо, не было никаких различий среди людей, свободных от вирусов, между посещением 1 и посещением 2 (таблица 4). На рисунке 4 показан процент пациентов с ухудшением (определяемым как более чем 50-кратное увеличение титра вируса при посещении 2 или обнаружением нового вируса, который не был выявлен при посещении 1) или улучшением (определяемым как более чем 50-кратное снижение титра вируса при посещении 2 или элиминация вируса, который присутствовал при посещении 1) или отсутствие изменений (определяемых как титр вируса от 1:50 до 50: 1 при посещении 2 по сравнению с посещением 1) в статусе вируса между посещением 1 и посетите 2.Значительно больше пациентов показали улучшение вирусного статуса между посещением 1 и посещением 2 у пациентов, получавших каррагинан, по сравнению с пациентами, получавшими плацебо, в ITT, а также в популяции PP. (ITT: p = 0,005; PP: p = 0,009, рисунок 4).
Процент пациентов с динамическими изменениями вирусного статуса между визитом 1 и визитом 2. «Ухудшение» определялось как более чем 50-кратное увеличение титра вируса при посещении 2 или обнаружение нового вируса, который не был обнаружен при посещении 1. «Улучшение» определялось как более чем 50-кратное снижение титра вируса при посещении 2 или уничтожение вируса, который присутствовал при посещении 1. «Без изменений» определяли как титр вируса от 1:50 до 50: 1 при посещении 2 по сравнению с посещением 1. A : ITT-популяция p = 0,005 B : PP население p = 0,009.
«Ухудшение» определялось как более чем 50-кратное увеличение титра вируса при посещении 2 или обнаружение нового вируса, который не был обнаружен при посещении 1. «Улучшение» определялось как более чем 50-кратное снижение титра вируса при посещении 2 или уничтожение вируса, который присутствовал при посещении 1. «Без изменений» определяли как титр вируса от 1:50 до 50: 1 при посещении 2 по сравнению с посещением 1. A : ITT-популяция p = 0,005 B : PP население p = 0,009.
В двух объединенных исследованиях наиболее часто выявлялись следующие вирусы: hRV (142 пациента), hCV (типы OC43 или 229E, 78 пациентов) и InfA (43 пациента).Пациенты с положительным результатом на разные типы вирусов были равномерно распределены между группами лечения каррагинаном и плацебо (таблица 5).
Таблица 5 Процент пациентов, положительных на разные типы вирусов в ITT-популяции Анализ подгрупп был проведен для трех наиболее распространенных типов вирусов в объединенной популяции, вируса hRV, hCV и InfA, соответственно. В популяции ITT продолжительность простуды была значительно сокращена во всех трех подгруппах вирусов, получавших каррагинан.Этот эффект был наиболее выражен у инфицированных вирусом гепатита C пациентов, получавших каррагинан, где сокращение продолжительности составляло почти 4 дня в популяции ITT (p <0,01) и 3 дня в популяции PP (p <0,01) (таблица 6 и рисунок 5).
В популяции ITT продолжительность простуды была значительно сокращена во всех трех подгруппах вирусов, получавших каррагинан.Этот эффект был наиболее выражен у инфицированных вирусом гепатита C пациентов, получавших каррагинан, где сокращение продолжительности составляло почти 4 дня в популяции ITT (p <0,01) и 3 дня в популяции PP (p <0,01) (таблица 6 и рисунок 5).
Продолжительность простуды у пациентов, получавших каррагинан или плацебо, в субпопуляции hRV, hCV и InfA.A : Продолжительность простуды в группе ITT (p = 0,019; p = 0,001; p = 0,02, соответственно). B : Продолжительность симптомов простуды у пациентов, получавших каррагинан или плацебо, в субпопуляции hRV, hCV и InfA в группе PP (p = 0,041; p = 0,009; p = 0,27; соответственно).
Во всех трех подгруппах вирусов значительное сокращение продолжительности простуды было зарегистрировано у пациентов, получавших каррагинан, по сравнению с пациентами, получавшими плацебо, в популяции ITT. Аналогичным образом, значительное сокращение наблюдалось в популяции PP между группами каррагинана и плацебо, за исключением пациентов с InfA.
Рецидивы в подгруппах
Рецидивы происходили значительно чаще в группах плацебо у пациентов, инфицированных ВЧС и ВГС, по сравнению с группой каррагинана в популяции ITT. Точно так же у пациентов, инфицированных InfA, наблюдалась тенденция к большему количеству рецидивов в группе плацебо (p = 0,055) (рисунок 6A). Также в популяции PP более высокий процент рецидивов был отмечен в подгруппах, инфицированных вирусом, получавших плацебо. Однако только у пациентов, инфицированных вирусом гепатита C, эта разница достигла статистической значимости (p = 0.005) (Рисунок 6B). В ITT-популяции среднее количество рецидивов на пациента было значительно ниже в подгруппах, инфицированных каррагинаном. Таким образом, у пациентов, инфицированных hRV, среднее количество рецидивов на одного пациента составило 0,13 у пациентов, получавших каррагинан, и 0,79 у пациентов, получавших плацебо (p = 0,04). У пациентов, инфицированных hCV, рецидивы на одного пациента возникали в 0,2 раза у пациентов, получавших каррагинан, по сравнению с 0,58 раза у пациентов, получавших плацебо (p = 0,007). Более того, у пациентов, инфицированных InfA, получавших плацебо, было 0.79 рецидивов на пациента по сравнению с 0,13 рецидивов на пациента в группе каррагинана (p = 0,04).
Таким образом, у пациентов, инфицированных hRV, среднее количество рецидивов на одного пациента составило 0,13 у пациентов, получавших каррагинан, и 0,79 у пациентов, получавших плацебо (p = 0,04). У пациентов, инфицированных hCV, рецидивы на одного пациента возникали в 0,2 раза у пациентов, получавших каррагинан, по сравнению с 0,58 раза у пациентов, получавших плацебо (p = 0,007). Более того, у пациентов, инфицированных InfA, получавших плацебо, было 0.79 рецидивов на пациента по сравнению с 0,13 рецидивов на пациента в группе каррагинана (p = 0,04).
Доля пациентов, перенесших рецидив за 21 день наблюдения. A : популяция ITT (hRV: каррагинан n = 70, плацебо n = 80; hCV: каррагинан n = 45, плацебо n = 43; InfA: каррагинан n = 45, плацебо n = 43) B : PP популяция (hRV : каррагинан n = 52, плацебо n = 60; hCV: каррагинан n = 38, плацебо n = 32; InfA: каррагинан n = 19, плацебо n = 15).
Аналогично, что касается общего числа рецидивов в популяции PP, более высокое среднее количество рецидивов на пациента было выявлено во всех инфицированных вирусом подгруппах, но только в инфицированной hCV субпопуляции эта разница достигла значимости (0,18 против 0,53, p = 0,006).
Безопасность
Общая переносимость исследуемых продуктов была очень хорошей, и не было различий между группами лечения по количеству пациентов с НЯ или тяжелыми нежелательными явлениями (СНЯ) (Таблица 7). Около 80% пациентов не сообщали о каких-либо НЯ до конца периода наблюдения.Интересно, что ринит (впервые выявленные случаи и ухудшение состояния во время исследования) чаще наблюдался в группе плацебо (ни одного случая в группе лечения каррагинаном по сравнению с 4 случаями в группе плацебо), со статистически значимой разницей между группами (р = 0,045). ). В двух исследованиях у шести пациентов наблюдались СНЯ, ни одно из них не было связано с исследованием, и все СНЯ разрешились до конца исследования. Все НЯ были оценены как не связанные с исследованием.
Таблица 7 Обзор наиболее часто регистрируемых НЯПротивовирусный назальный спрей Marinomed одобрен для использования в Канаде
Венская биотехнологическая компания Marinomed Biotechnologie GmbH объявила сегодня о разрешении своего противовирусного назального спрея для прибыльного канадского рынка. Одобрение спрея последовало за подтверждением убедительных доклинических и клинических данных о безопасности и эффективности препарата. Продукт на основе каррагелозы®, натурального вещества, извлекаемого из красных водорослей, в настоящее время одобрен для профилактики и лечения простуды в 38 странах мира. Благодаря хорошей переносимости, он также доступен без рецепта детям с одного года, а также беременным женщинам и кормящим матерям.
Одобрение спрея последовало за подтверждением убедительных доклинических и клинических данных о безопасности и эффективности препарата. Продукт на основе каррагелозы®, натурального вещества, извлекаемого из красных водорослей, в настоящее время одобрен для профилактики и лечения простуды в 38 странах мира. Благодаря хорошей переносимости, он также доступен без рецепта детям с одного года, а также беременным женщинам и кормящим матерям.
Комментируя последнее утверждение компании на рынке, д-р Андреас Грассауэр, генеральный директор Marinomed, говорит: «Тот факт, что наше первое лекарство уже пользуется большим успехом во всем мире, подтверждает эффективность нашей платформы противовирусных технологий и наша корпоративная стратегия. Сейчас она сосредоточена на разработке и утверждении других продуктов для профилактики и лечения гриппа и комбинированных продуктов для людей, страдающих аллергией ».
Основу нынешнего успеха компании составляет ее технологическая платформа MAVIREX®, которая использует эффективность полимеров из красных водорослей. Это позволяет разрабатывать методы лечения более 200 различных штаммов респираторных вирусов. Самый первый полимер, разработанный Marinomed для терапевтического использования — Carragelose® — уже показывает уникальный противовирусный эффект против множества респираторных вирусов. Полимер окружает вирусы и тем самым предотвращает их прикрепление к клеткам слизистой оболочки носа и проникновение в них. В то же время он образует полезный и защитный слой влаги в носу. Клинические исследования доказывают, что лечение назальным спреем сокращает продолжительность вирусной простуды примерно на два дня (по сравнению с пациентами, получавшими плацебо).Кроме того, снизилась вирусная нагрузка и рецидивы заболевания.
Это позволяет разрабатывать методы лечения более 200 различных штаммов респираторных вирусов. Самый первый полимер, разработанный Marinomed для терапевтического использования — Carragelose® — уже показывает уникальный противовирусный эффект против множества респираторных вирусов. Полимер окружает вирусы и тем самым предотвращает их прикрепление к клеткам слизистой оболочки носа и проникновение в них. В то же время он образует полезный и защитный слой влаги в носу. Клинические исследования доказывают, что лечение назальным спреем сокращает продолжительность вирусной простуды примерно на два дня (по сравнению с пациентами, получавшими плацебо).Кроме того, снизилась вирусная нагрузка и рецидивы заболевания.
Что касается эффективности противовирусного назального спрея, доктор Грассауэр объясняет: «Простуда, кашель и охриплость голоса могут быть вызваны множеством респираторных вирусов. Фактически невозможно точно диагностировать вирусный штамм, ответственный за каждый случай. Однако в этом нет необходимости для лечения назальным спреем Мариномед: он эффективен одновременно против множества штаммов вирусов.Это объясняет успех продаж спрея ».
Однако в этом нет необходимости для лечения назальным спреем Мариномед: он эффективен одновременно против множества штаммов вирусов.Это объясняет успех продаж спрея ».
На фоне этого успеха несколько лет назад Мариномед также расширил свою линейку разработок. В дополнение к активным веществам для лечения респираторных заболеваний компания в настоящее время занимается также разрабатывает продукты для лечения аллергии I типа и аутоиммунных заболеваний.
О компании Marinomed Biotechnologie GmbH (по состоянию на март 2013 г.) Компания Marinomed Biotechnologie GmbH была основана в 2006 г. и разрабатывает методы лечения респираторных заболеваний на основе инновационная платформа противовирусных респираторных технологий.Удобство использования этой безопасной и эффективной технологии было доказано ее первым продуктом на рынке: противовирусным назальным спреем. Огромный потенциал технологии отражается в дополнительных продуктах Marinomed, предназначенных для лечения гриппа, комбинированных продуктах для астматиков и других пациентов с высоким риском. Кроме того, компания разрабатывает новое лекарство от аллергии I типа и аутоиммунных заболеваний. Marinomed Biotechnologie GmbH является дочерней компанией Венского ветеринарного университета и находится в Вене, Австрия.
Кроме того, компания разрабатывает новое лекарство от аллергии I типа и аутоиммунных заболеваний. Marinomed Biotechnologie GmbH является дочерней компанией Венского ветеринарного университета и находится в Вене, Австрия.
Назальный спрей может снизить вирусное выделение и передачу риновирусов
, 18 сентября 2009 г. (Сан-Франциско, Калифорния) — Новое исследование показывает, что обычный назальный спрей может иметь противовирусный эффект против риновируса и, возможно, может снизить риск передачи заболевания, согласно исследованию, представленному здесь на 49-й Международной конференции по антимикробным препаратам. Агенты и химиотерапия.
Оксиметазолин, ингредиент отпускаемых без рецепта назальных противоотечных спреев, значительно снизил титры вируса в носовых секретах у субъектов, которым был привит риновирус.
«Это очень интересный эффект, и он заслуживает дополнительных исследований, чтобы проанализировать, как его можно использовать», — сказала ведущий автор Биргит Винтер, доктор медицины, ведущий автор и доцент отоларингологии в Университете Вирджинии в Шарлоттсвилле, Medscape Infectious Diseases .
Доктор Винтер сказал, что назальный спрей может помочь в лечении тяжелых простуд, предотвращая интраназальное распространение вируса или предотвращая его распространение в носовые пазухи или легкие. Доктор Винтер и ее коллеги-авторы также предположили, что спрей может уменьшить распространение вируса в окружающей среде.
В исследовании 33 инфицированных субъекта получали 3 интраназальных дозы 0,05% гидрохлорида оксиметазолина в день, разбавленного лимонной кислотой, а 37 других получали физиологический раствор. Добровольцы возвращались каждый день в течение 5 дней, чтобы исследователи могли промыть нос и оценить симптомы и побочные эффекты. На 6-й и 7-й дни промывания носа не проводились, но добровольцев оценивали на предмет симптомов и побочных эффектов.
Результаты показали, что выделение вируса произошло для 3.3 дня в группе оксиметазолина и 3,5 дня в группе физиологического раствора. Средний титр вируса в группе оксиметазолина на 2 день был также значительно ниже, чем в группе, получавшей физиологический раствор (1,49 против 2,24; P <0,05).
«Обычно между 2 и 3 днями вы видите пик вируса в смыве для носа. Это произошло в группе физиологического раствора, но в группе оксиметазолина мы не видели этого пика. Он оставался неизменным», — сказал д-р. Винтер .
Доктор Винтер и ее коллеги предполагают, что эффект оксиметазолина может быть связан с его влиянием на экспрессию рецептора ICAM-1.По ее словам, несколько исследований in vitro показали, что препарат снижает экспрессию ICAM-1.
Неопубликованное исследование 250 пациентов в Германии показало, что назальный спрей сокращает продолжительность простуды у людей с тяжелыми симптомами, сказала она. В исследовании доктора Винтера оксиметазолин также влиял на симптомы заболевания. Из тех, кто принимал оксиметазолин, 64% соответствовали критериям Джексона для симптоматического заболевания; из тех, кто принимал физиологический раствор, это сделали 76%.
Частота нежелательных явлений в обеих группах была одинаковой. — сказал Винтер. Побочные эффекты включали головную боль и носовое кровотечение.
— сказал Винтер. Побочные эффекты включали головную боль и носовое кровотечение.
Доктор Винтер отметил ограничения исследования. «Это не было профилактическим испытанием или испытанием лечения, а просто доказательством правильности того, что мы видели в пробирках», — сказала она.
Другие исследователи отметили небольшой размер исследования, что может ограничить обоснованность его выводов. «Вы также не можете сказать, был ли эффект просто случайным, вызван ли он деконгестантом или лекарство действительно подавляло рост вируса», — сказал Питер Катона, доктор медицинских наук, доцент кафедры инфекционных болезней Калифорнийского университета в Лос-Анджелесе. , рассказала Medscape Infectious Diseases .«Я бы хотел увидеть намного больше данных, прежде чем пришел к выводу, что это хорошая вещь для использования», — добавил он.
Хотя д-р Винтер с энтузиазмом относится к обещаниям оксиметазолина, д-р Катона остается скептически настроенным. «Мне не нравится этот препарат», — сказал он. «Причина в том, что люди используют его для лечения заложенности носа, а затем перестают его использовать, и это вызывает у них заложенность, которая намного хуже, чем первоначальные симптомы».
«Мне не нравится этот препарат», — сказал он. «Причина в том, что люди используют его для лечения заложенности носа, а затем перестают его использовать, и это вызывает у них заложенность, которая намного хуже, чем первоначальные симптомы».
Исследование финансировалось Merck Selbastmedikation GmbH.Доктор Винтер сообщает о получении исследовательской поддержки от Merck Selbastmedikation GmbH. Доктор Катона не раскрыл никаких финансовых отношений.
49-я Международная конференция по противомикробным препаратам и химиотерапии (ICAAC): Abstract V-536. Представлено 13 сентября 2009 г.
Спрей для носа от простуды
В настоящее время проходят клинические испытания спрея, который предназначен для прерывания цикла инфицирования вирусом простуды.
Поделиться в Pinterest Холодильники составляют до 40 процентов всех пропущенных рабочих дней в США.Getty Images Новый назальный спрей, который в настоящее время проходит клинические испытания, может стать революционным средством в лечении простуды.
Назальный спрей разрабатывается в Австралии. Он содержит противовирусный агент, который убивает вирусы в носовом проходе.
Пока что, по мнению исследователей, результаты выглядят многообещающими.
«Исследования показали, что активный агент в назальном спрее атакует вирусы и инактивирует большинство из них за 15–60 секунд, и, что важно, вирусы не могут стать к нему устойчивыми», — сказал Питер Моллой, председатель Firebrick Pharma, разработчики. спрея, сказал Healthline.
«Во время простуды в носовых ходах присутствуют миллионы вирусов, и таким образом инфекция распространяется в носу и другим людям. Часто используя спрей во время простуды, мы надеемся прервать цикл заражения, уменьшив симптомы и продолжительность простуды. Для оценки этого в настоящее время проводятся клинические испытания. Это также может защитить вас от простуды или передачи инфекции другим, что было бы здорово », — добавил он.
Ежегодно в Соединенных Штатах регистрируются миллионы случаев простуды. По данным Центров по контролю и профилактике заболеваний (CDC), взрослые простужаются от двух до трех раз в год. Дети получают даже больше.
По данным Центров по контролю и профилактике заболеваний (CDC), взрослые простужаются от двух до трех раз в год. Дети получают даже больше.
В результате простуды к врачу ежегодно обращаются не менее 75 миллионов человек. По оценкам, из-за простуды пропускается от 22 до 189 миллионов школьных дней.
Это приводит к пропуску примерно 126 миллионов рабочих дней из-за того, что родители должны заботиться о своих детях.
Простуда является причиной около 40 процентов пропусков работы в Соединенных Штатах, что влияет на около 150 миллионов рабочих дней.
«Простуда явно является серьезной проблемой. Это досадная проблема. Он не убивает людей, но на какое-то время делает их несчастными. Это мешает учебе среди маленьких детей. Родители остаются дома, потому что им приходится заботиться о детях. Взрослые тоже простужаются, и они либо пропускают работу, либо не успевают на работе, а также чувствуют себя вялыми в течение значительного периода времени », — сказал Healthline доктор Уильям Шаффнер, эксперт по инфекционным заболеваниям из Медицинского центра Университета Вандербильта в Теннесси.
Существует более 200 вирусов, вызывающих простуду. Найти эффективное лечение или лекарство непросто.
«Вирусы очень трудно лечить и еще труднее вылечить. Исследования простуды не финансируются хорошо, и, поскольку большинство простуд протекает в легкой форме, соотношение пользы и риска должно быть очень высоким. Кроме того, окупаемость инвестиций в исследования невысока. Люди не будут платить тысячи долларов за лекарство от простуды, поэтому цена лекарства должна быть низкой », — сказал доктор.Джеффри Клауснер, профессор медицины отделения инфекционных заболеваний Калифорнийского университета в Лос-Анджелесе (UCLA), рассказал Healthline.
Было предпринято несколько попыток вылечить простуду, но нет данных, подтверждающих успех любого из этих методов лечения.
«Например, некоторые люди употребляют таблетки цинка, которые, как утверждается, предотвращают прикрепление некоторых вирусов простуды к клеткам, или цинковый назальный спрей. Но данных о клинической эффективности, таких как хорошие клинические испытания, нет. Полоскание горла соленой водой, спреями для носа с солевым раствором (соленой водой), перекисью водорода и различными пастилками также были среди множества вещей, которые люди пробовали, но клинических испытаний обычно не проводилось, и поэтому мы полагаемся на анекдот », — Стивен Морс , Доктор философии, профессор эпидемиологии в Медицинском центре Колумбийского университета в Нью-Йорке, сообщил Healthline.
Полоскание горла соленой водой, спреями для носа с солевым раствором (соленой водой), перекисью водорода и различными пастилками также были среди множества вещей, которые люди пробовали, но клинических испытаний обычно не проводилось, и поэтому мы полагаемся на анекдот », — Стивен Морс , Доктор философии, профессор эпидемиологии в Медицинском центре Колумбийского университета в Нью-Йорке, сообщил Healthline.
Морс говорит, что если клинические испытания будут успешными, у назального спрея будет большой потенциал.
«Мы все можем представить, как сильно мы хотели бы иметь что-то, что было бы простым и безопасным в использовании, и что могло бы предотвратить заражение или распространение простуды или быстро уйти», — сказал он.«Также легко представить, сколько беспокойства и потери производительности можно было бы предотвратить. Продукт выглядит довольно дешевым (на рынке есть то же химическое вещество, что и дезинфицирующее средство для кожи), и, если оно сработает, будет большим подспорьем, возможно, даже при других респираторных инфекциях. Но мы и раньше видели обнадеживающие выводы, поэтому только хорошо проведенные клинические испытания покажут это ».
Но мы и раньше видели обнадеживающие выводы, поэтому только хорошо проведенные клинические испытания покажут это ».
Вирусы действуют, заражая чувствительные клетки-хозяева, например клетки верхних дыхательных путей.
Затем они используют собственный механизм инфицированной клетки для репликации и производства нескольких копий вируса.
Потомки переходят в другие клетки, чтобы повторить процесс.
Вирусы распространяются между людьми, когда инфицированный человек кашляет или чихает. Затем вирус переходит в новое тело, и цикл повторяется.
Моллой говорит, что назальный спрей, который в настоящее время проходит двойное слепое плацебо-контролируемое исследование, сможет нарушить этот цикл.
«Вирусы простуды, как правило, очень беспорядочные и могут легко мутировать, чтобы обойти любую вакцину или таргетный противовирусный препарат. Наш подход решает обе проблемы, уничтожая все вирусы без разбора », — сказал он.
Шаффнер настроен осторожно и оптимистично.
«Это похоже на настоящий антивирусный агент, который, если бы он мог остановить репликацию вируса, сократил бы продолжительность простуды. Так что будем надеяться, но пока еще рано », — сказал он.
Назальный спрей, разработанный австралийскими исследователями, может стать прорывом в лечении простуды.
Пока еще проходят клинические испытания, спрей убивает вирусы в носовом проходе.
Эксперты проявляют осторожный оптимизм в отношении того, что эффективность спрея будет доказана в ходе продолжающихся клинических испытаний.
Разработка назального спрея с противовирусным препаратом против вируса гриппа
Альберт Ф. Каборе и Джонатан П. Вонг
Аннотация
я Пандемии гриппа, включая испанский грипп 1917–1918 годов, исторически унесли жизни миллионов людей во всем мире. Несмотря на успехи В области вакцинологии и разработки противовирусных препаратов мир остается уязвимым перед будущими пандемиями. Текущий доступен противовирусные препараты против структур вируса гриппа и белков вирусов, и могут оказаться неэффективными из-за постоянного мутации в этих сайтах на генетическом уровне. Чтобы обойти проблему лекарственной устойчивости, используются новые подходы, которые
Стимулирование врожденного иммунитета хозяина для обеспечения широкого противовирусного ответа становится горячей областью в разработке противовирусных препаратов.
С этой целью Defense R&D Canada (DRDC) выступила пионером в доклинической разработке инкапсулированного в липосомы Poly ICLC.
(LE Poly ICLC), мощный противовирусный агент, который активирует сигнальный путь toll-подобного рецептора-3 (TLR-3), что, в свою очередь, приводит к
в индукции защитного противовирусного иммунитета у хозяина.DRDC направлена на продвижение развития носовой полости.
спрей на основе LE Poly ICLC, потенциально способный защитить канадские вооруженные силы, службы быстрого реагирования и гражданское население от гриппа
пандемии. В исследовании, проведенном на экспериментальной модели хорька, мы продемонстрировали, что назальный спрей является безопасным,
эффективное и безыгольное средство доставки LE Poly ICLC для защиты от вируса гриппа A / PR / 8/34 (h2N1).
Чтобы обойти проблему лекарственной устойчивости, используются новые подходы, которые
Стимулирование врожденного иммунитета хозяина для обеспечения широкого противовирусного ответа становится горячей областью в разработке противовирусных препаратов.
С этой целью Defense R&D Canada (DRDC) выступила пионером в доклинической разработке инкапсулированного в липосомы Poly ICLC.
(LE Poly ICLC), мощный противовирусный агент, который активирует сигнальный путь toll-подобного рецептора-3 (TLR-3), что, в свою очередь, приводит к
в индукции защитного противовирусного иммунитета у хозяина.DRDC направлена на продвижение развития носовой полости.
спрей на основе LE Poly ICLC, потенциально способный защитить канадские вооруженные силы, службы быстрого реагирования и гражданское население от гриппа
пандемии. В исследовании, проведенном на экспериментальной модели хорька, мы продемонстрировали, что назальный спрей является безопасным,
эффективное и безыгольное средство доставки LE Poly ICLC для защиты от вируса гриппа A / PR / 8/34 (h2N1). Когда полностью
разработаны, они улучшат нашу способность защищаться от смертельных случаев, независимо от того, являются ли они естественным по происхождению, биоинженерными или
устойчивы к обычным противовирусным препаратам.
Когда полностью
разработаны, они улучшат нашу способность защищаться от смертельных случаев, независимо от того, являются ли они естественным по происхождению, биоинженерными или
устойчивы к обычным противовирусным препаратам.Биография
Капитан Каборе — офицер по биологическим наукам в канадских вооруженных силах в 1 отряде полевой скорой помощи в Саффилде. В настоящее время он назначен на DRDC Military. Подразделение поддержки Суффилд, секция биотехнологии. В настоящее время капитан Каборе берет на себя обязанности руководителя программы антивирусной программы (AVP). PDF HTMLИнгибирование репликации риновирусов in vitro и in vivo с помощью физиологического раствора с кислотным буфером | Журнал инфекционных болезней
Абстрактные
Риновирусы человека (ВСР) весьма чувствительны к низкому pH.Чтобы определить, может ли эта характеристика быть терапевтической мишенью, мы оценили чувствительность ВСР к буферам с низким pH in vitro и in vivo.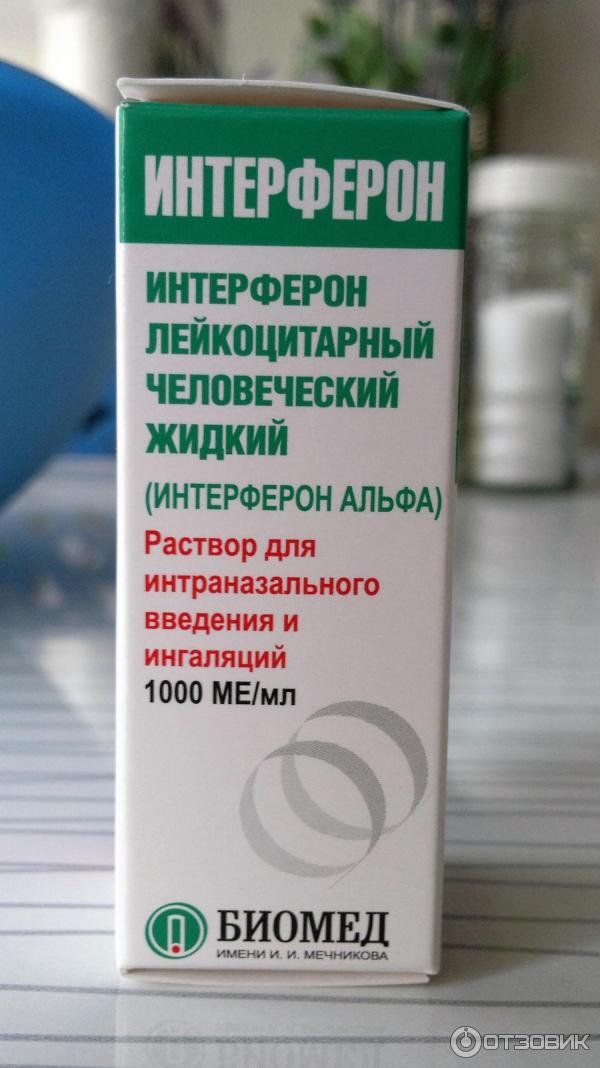 Наши результаты подтверждают, что низкий pH ингибирует репликацию большинства ВСР и снижает репликацию вируса гриппа. Предварительные эксперименты подтвердили, что поверхностный pH носоглотки человека можно временно снизить до pH ∼4,0 путем местного введения цитрат / фосфатных (CP) буферов, что хорошо переносится. В пилотном экспериментальном исследовании простуды интраназальное введение CP-буфера по сравнению с физиологическим раствором снизило выделение вируса на 1 логарифмическую единицу (10 3 vs.10 4 50% инфекционная доза культуры ткани / мл; P <0,01), хотя респираторные симптомы значительно не уменьшились. Эти данные демонстрируют, что буферы с низким pH обладают противовирусной активностью in vivo, и позволяют предположить, что необходимо более крупное клиническое испытание, чтобы определить, может ли этот подход снизить скорость передачи вируса.
Наши результаты подтверждают, что низкий pH ингибирует репликацию большинства ВСР и снижает репликацию вируса гриппа. Предварительные эксперименты подтвердили, что поверхностный pH носоглотки человека можно временно снизить до pH ∼4,0 путем местного введения цитрат / фосфатных (CP) буферов, что хорошо переносится. В пилотном экспериментальном исследовании простуды интраназальное введение CP-буфера по сравнению с физиологическим раствором снизило выделение вируса на 1 логарифмическую единицу (10 3 vs.10 4 50% инфекционная доза культуры ткани / мл; P <0,01), хотя респираторные симптомы значительно не уменьшились. Эти данные демонстрируют, что буферы с низким pH обладают противовирусной активностью in vivo, и позволяют предположить, что необходимо более крупное клиническое испытание, чтобы определить, может ли этот подход снизить скорость передачи вируса.
Риновирусы человека (ВСР), которые долгое время ассоциировались с простудой, в настоящее время признаны причиной серьезных заболеваний у пациентов с астмой, хронической обструктивной болезнью легких и другими хроническими респираторными заболеваниями [1].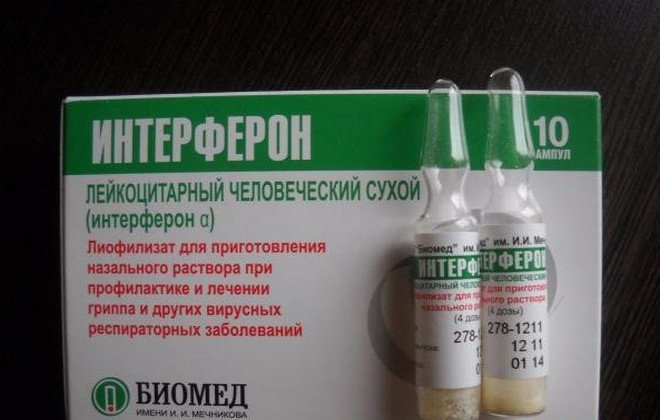 Кроме того, эти вирусные заболевания могут вызывать синусит, средний отит [2, 3] и бронхиолит у детей младшего возраста [4, 5] и пожилых людей [6], и они часто являются предвестниками бактериального отита и синусита [7]. Признание ВСР важной причиной заболеваемости как верхних, так и нижних дыхательных путей помогло активизировать поиск противовирусных средств для лечения или предотвращения инфицирования ВСР.
Кроме того, эти вирусные заболевания могут вызывать синусит, средний отит [2, 3] и бронхиолит у детей младшего возраста [4, 5] и пожилых людей [6], и они часто являются предвестниками бактериального отита и синусита [7]. Признание ВСР важной причиной заболеваемости как верхних, так и нижних дыхательных путей помогло активизировать поиск противовирусных средств для лечения или предотвращения инфицирования ВСР.
Несколько уникальных аспектов репликационного цикла ВСР были определены как терапевтические цели.Например, были разработаны соединения для блокирования связывания ВСР с ее основным рецептором, молекулой межклеточной адгезии (ICAM) -1, для предотвращения отслоения вирусной РНК или для ингибирования вирусной протеазы 3C [8-10]. Помимо этих уязвимостей, одной из определяющих характеристик ВСР является то, что они весьма чувствительны к низкому pH. Считается, что этот эффект связан с конформационными изменениями капсидных белков при pH <6,2, что приводит к потере субъединицы VP4, что делает вирус неинфекционным [11]. Хотя этот эффект был отмечен in vitro в течение многих лет, наш поиск в литературе не нашел никаких попыток введения кислых буферов интраназально для профилактики или лечения инфекции ВСР.
Хотя этот эффект был отмечен in vitro в течение многих лет, наш поиск в литературе не нашел никаких попыток введения кислых буферов интраназально для профилактики или лечения инфекции ВСР.
Мы провели серию экспериментов, чтобы более тщательно оценить чувствительность ВСР к буферам с низким pH in vitro и определить, являются ли буферы с низким pH безопасными, хорошо переносимыми и эффективными на людях-добровольцах. Наши результаты подтверждают, что многие серотипы ВСР чрезвычайно чувствительны к pH <6.0 активность in vitro. Эти результаты послужили основанием для проведения двойного слепого плацебо-контролируемого клинического исследования для определения того, обладают ли буферы с низким pH активностью против ВСР in vivo.
Материалы и методы
Клетки и вирусы. Клетки H-HeLa выращивали в Eagle’s MEM (EMEM; Life Technologies) с добавлением заменимых аминокислот, L-глутамина, антибиотиков и 10% телячьей сыворотки (Hyclone) [12]. Эпителиальные клетки бронхов человека (HBEC) выделяли из остаточной ткани, предназначенной для трансплантации легких, как описано в другом месте [13].Клетки MDCK и клетки Hep-2 выращивали в EMEM с добавлением 10% фетальной бычьей сыворотки (Hyclone). Репрезентативные серотипы ВСР (1A, 2, 14, 16, 49 и 85) и вируса парагриппа 3 типа (PIV-3; штамм 243 [HA1]; Лаборатория гигиены штата Висконсин) выращивали в клетках HeLa. Грипп (местный изолят, типизированный Центрами по контролю и профилактике заболеваний как грипп A / Beijing / 32/92-подобный [h4N2]), был выращен в клетках MDCK, а респираторно-синцитиальный вирус (RSV; предоставлен D. Tristram, East Carolina University, Greenville, NC) выращивали в клетках Hep-2.Количественные культуры HRV16 представлены в виде TCID 50 на миллилитр [14].
Эпителиальные клетки бронхов человека (HBEC) выделяли из остаточной ткани, предназначенной для трансплантации легких, как описано в другом месте [13].Клетки MDCK и клетки Hep-2 выращивали в EMEM с добавлением 10% фетальной бычьей сыворотки (Hyclone). Репрезентативные серотипы ВСР (1A, 2, 14, 16, 49 и 85) и вируса парагриппа 3 типа (PIV-3; штамм 243 [HA1]; Лаборатория гигиены штата Висконсин) выращивали в клетках HeLa. Грипп (местный изолят, типизированный Центрами по контролю и профилактике заболеваний как грипп A / Beijing / 32/92-подобный [h4N2]), был выращен в клетках MDCK, а респираторно-синцитиальный вирус (RSV; предоставлен D. Tristram, East Carolina University, Greenville, NC) выращивали в клетках Hep-2.Количественные культуры HRV16 представлены в виде TCID 50 на миллилитр [14].
Доклинические исследования
Тесты токсичности буферов с низким pH на монослоях клеток HeLa и BE. Монослои клеток (клетки HeLa и / или HBEC) инкубировали (в течение 10 мин при 34 ° C) с 0,5 мл тестового буфера вместе с 0,5 мл среды. Затем клетки один раз промывали PBS (pH 7,2) и среду заменяли. Это лечение повторяли еще дважды с 4-часовыми интервалами.Через 24 часа после первой обработки неокрашенные клетки исследовали под световым микроскопом на цитопатические эффекты. Затем клетки фиксировали (0,5 мл / лунку забуференного формалина в течение 1 ч) и окрашивали 0,1% кристаллическим фиолетовым в 20% этаноле. Целостность клеточного монослоя оценивали по шкале от 0 до 3 в зависимости от интенсивности окрашивания (0 — нет выживших клеток; 3 — интактный монослой клеток).
Затем клетки один раз промывали PBS (pH 7,2) и среду заменяли. Это лечение повторяли еще дважды с 4-часовыми интервалами.Через 24 часа после первой обработки неокрашенные клетки исследовали под световым микроскопом на цитопатические эффекты. Затем клетки фиксировали (0,5 мл / лунку забуференного формалина в течение 1 ч) и окрашивали 0,1% кристаллическим фиолетовым в 20% этаноле. Целостность клеточного монослоя оценивали по шкале от 0 до 3 в зависимости от интенсивности окрашивания (0 — нет выживших клеток; 3 — интактный монослой клеток).
Тесты инактивации вирусов in vitro. HRV16 (10 мкл ≈ 10 6 TCID 50 ) инкубировали (при 22 ° C и 35 ° C) с 1 мл либо 0.15 моль / л цитрат-фосфатного (CP) буфера (pH 5,0), 0,1 моль / л аскорбата (pH 5,0), 0,05 моль / л фталата (pH 5,0) или PBS (pH 7,2) в качестве отрицательного контроля. Во второй серии экспериментов был протестирован ряд респираторных вирусов, включая RSV, грипп (Beijing / 32/92-like), PIV-3 и несколько серотипов HRV. Для этих экспериментов вирусные суспензии разбавляли только в 2 раза, чтобы более точно имитировать условия, которые могут возникнуть в носоглотке после местного применения назального спрея. Титры вирусов определяли через 2 и 10 мин инкубации.
Для этих экспериментов вирусные суспензии разбавляли только в 2 раза, чтобы более точно имитировать условия, которые могут возникнуть в носоглотке после местного применения назального спрея. Титры вирусов определяли через 2 и 10 мин инкубации.
Влияние периодического воздействия буферов с низким pH на рост вирусов in vitro. Монослои клеток HeLa инокулировали HRV16 (10 TCID 50 / лунку в течение 4 часов), а затем обрабатывали буферами с низким pH или PBS (в течение 10 минут при 34 ° C). Эту процедуру повторяли через 8, 12, 24, 28, 32 и 36 часов после заражения, а титры вирусов определяли через 48 часов. Кроме того, неинфицированные монослои клеток также кратковременно (10 мин) подвергали воздействию буферов с низким pH (0,15 моль / л CP [pH 5.0] или 0,05 моль / л фталата [pH 5,0]) или PBS (pH 7,2) 3 раза в течение 24 часов. Обработка цитратом и ЦП не вызывала токсичности для клеток, но обработка фталатом приводила к значительному истончению и отслоению монослоя клеток (данные не показаны).
Клинические исследования
Три исследования были проведены для проверки переносимости и эффектов повторного введения буферов с низким pH, а также для проверки противовирусных эффектов in vivo. Каждый протокол был рассмотрен и одобрен комитетом испытуемых в исследовательском учреждении (больница Университета Висконсина или Комитет по этике местных исследований Халла и Ист-Райдинга).
Переносимость назальных спреев с низким pH у здоровых добровольцев. Чтобы определить, переносятся ли спреи для носа с низким pH при повторном использовании, было проведено двойное слепое плацебо-контролируемое рандомизированное перекрестное исследование. После получения информированного согласия 15 нормальных здоровых добровольцев в возрасте от 18 до 65 лет распыляли 300 мкл 0,15 моль / л CP (pH 4,5), 0,075 моль / л CP (pH 4,5) или физиологического раствора (pH 7,4). в каждую ноздрю 4 раза в день в течение 5 дней.Каждый из спреев также содержал стандартные консерванты и загустители. Испытуемые использовали все назальные спреи последовательно с периодами отдыха (без спреев) между ними. Каждый спрей вводили по 3 укола (~ 100 мкл / выстрел) в каждую ноздрю 4 раза в день с последующим 9-дневным периодом отдыха, в течение которого не использовали назальные спреи. Физикальное обследование слизистой оболочки носа проводилось в начале и в конце каждого 5-дневного периода лечения. Кроме того, велся дневник для записи симптомов (заложенность, головная боль и т. Д.).) по 4-балльной шкале (0 — нет; 1 — легкая; 2 — умеренная; 3 — тяжелая). Между введением назальных спреев был 10-дневный период вымывания.
Испытуемые использовали все назальные спреи последовательно с периодами отдыха (без спреев) между ними. Каждый спрей вводили по 3 укола (~ 100 мкл / выстрел) в каждую ноздрю 4 раза в день с последующим 9-дневным периодом отдыха, в течение которого не использовали назальные спреи. Физикальное обследование слизистой оболочки носа проводилось в начале и в конце каждого 5-дневного периода лечения. Кроме того, велся дневник для записи симптомов (заложенность, головная боль и т. Д.).) по 4-балльной шкале (0 — нет; 1 — легкая; 2 — умеренная; 3 — тяжелая). Между введением назальных спреев был 10-дневный период вымывания.
Влияние назального спрея на интраназальный pH. Для исследования были набраны двенадцать здоровых взрослых добровольцев в возрасте от 18 до 60 лет без текущих назальных симптомов. Никто не использовал тематические назальные спреи в течение предшествующих 3 месяцев. Три разных объема (15, 50 и 100 мкл) раствора лимонной кислоты / L-пироглутаминовой кислоты / фитиновой кислоты с pH 3,5 вводили через насосы для назального спрея (Valois VP7) только в 1 ноздрю. Чтобы получить дозу 100 мкл, насос на 50 мкл распыляли дважды. Измерения pH поверхности эпителия слизистой оболочки проводились с помощью многоразового педиатрического внешнего эталонного pH-катетера (Medtronic), введенного через преддверие в 3 точки носа: нижняя носовая раковина, перегородка и носоглотка [15, 16]. Измерения были получены на исходном уровне и через 1, 5, 10, 15 и 30 минут после введения дозы. Порядок проверки доз был выбран исследователем случайным образом.
Чтобы получить дозу 100 мкл, насос на 50 мкл распыляли дважды. Измерения pH поверхности эпителия слизистой оболочки проводились с помощью многоразового педиатрического внешнего эталонного pH-катетера (Medtronic), введенного через преддверие в 3 точки носа: нижняя носовая раковина, перегородка и носоглотка [15, 16]. Измерения были получены на исходном уровне и через 1, 5, 10, 15 и 30 минут после введения дозы. Порядок проверки доз был выбран исследователем случайным образом.
Влияние назальных спреев с низким pH на экспериментальную инфекцию ВСР. Чтобы определить, может ли интраназальное введение буферов с низким pH предотвратить или уменьшить тяжесть клинической простуды, было проведено пилотное проспективное рандомизированное плацебо-контролируемое исследование с использованием экспериментальной инокуляции HRV16. После предоставления информированного согласия здоровые добровольцы в возрасте от 18 до 60 лет без обнаруживаемых нейтрализующих антител к HRV16 были случайным образом распределены для получения либо активного лечения, либо плацебо. Раствор для обработки состоял из цитрата (pH 3.5), фитиновая кислота (хелатирующий агент), L-пироглутаминовая кислота, фенилэтиловый спирт (консервант), карбопол 980 (загуститель) и эвкалиптол. Раствор плацебо состоял из физиологического раствора (pH 7,2–7,4), а также таких же загустителей и консервантов.
Раствор для обработки состоял из цитрата (pH 3.5), фитиновая кислота (хелатирующий агент), L-пироглутаминовая кислота, фенилэтиловый спирт (консервант), карбопол 980 (загуститель) и эвкалиптол. Раствор плацебо состоял из физиологического раствора (pH 7,2–7,4), а также таких же загустителей и консервантов.
Через 5 минут после инокуляции (1000 TCID 50 ) тестовый раствор (либо буфер с низким pH, либо плацебо) вводили самостоятельно 4 раза в день (∼8: 00 утра, 13:00, 6:00 pm и 23:00 pm) в течение 5 дней в объеме 100 мкл (2 спрея по 50 мкл) в каждую ноздрю.Перед введением второй, третьей и четвертой доз исследуемого продукта в каждый из дней 0–4 субъекты записывали наличие и тяжесть своих симптомов в это время в своем дневнике симптомов. Симптомы простуды (чихание, ринорея, заложенность носа, боль в горле, кашель, головная боль, недомогание / усталость, чувство усталости и озноб) оценивались по 4-балльной шкале (0 — отсутствие; 1 — легкое; 2 — умеренное; 3, тяжелая). 3–4 балла для каждого типа симптома в каждый день были скорректированы относительно исходного уровня путем вычитания соответствующих баллов из дня -1, и были рассчитаны средние дневные баллы.
Промывание носа проводилось после оценки симптомов и перед первой утренней дозой в дни 0–4. Считалось, что субъекты простудились, если они соответствовали следующим модифицированным критериям Джексона: (1) подтвержденная инфекция, о чем свидетельствует присутствие HRV16 в их носовой жидкости или по крайней мере 4-кратное увеличение титра сывороточных нейтрализующих антител к HRV16. и (2) общий балл симптомов ≥6 и либо наличие ринореи в течение ≥3 дней, либо впечатление пациента о простуде.Продолжительность холода определялась как количество дней, в течение которых у субъектов ежедневная оценка симптомов превышала пороговое значение. Для бессимптомных инфекций была назначена продолжительность простуды 0.
Статистические методы
Продолжительность снижения pH, вызванного введением различных объемов назального спрея, сравнивали путем вычисления площади под кривой (AUC). Из-за исследовательского характера исследования не было сделано никаких корректировок для контроля уровня ошибок типа I. Сравнение назальных композиций с низким pH и плацебо-контроля проводилось с использованием точного теста Фишера (для процента инокулированных субъектов, инфицированных ВСР16, и процента инокулированных субъектов, которые заразились ВСР16 и показали наличие простуды) и Тест суммы рангов Вилкоксона (для общего, ежедневного и индивидуального баллов симптомов для субъектов, которые заразились ВСР16; количества дней простуды для субъектов, которые заразились ВСР16; количества дней, в течение которых ВСР16 сбрасывалась для инокулированных субъектов; и количество HRV16, выделенного на 2-й день для инокулированных субъектов).Для всех сравнений показаны односторонние значения P , если не указано иное. Коэффициент ошибок типа I 0,10 использовался для проверки всех статистических гипотез.
Сравнение назальных композиций с низким pH и плацебо-контроля проводилось с использованием точного теста Фишера (для процента инокулированных субъектов, инфицированных ВСР16, и процента инокулированных субъектов, которые заразились ВСР16 и показали наличие простуды) и Тест суммы рангов Вилкоксона (для общего, ежедневного и индивидуального баллов симптомов для субъектов, которые заразились ВСР16; количества дней простуды для субъектов, которые заразились ВСР16; количества дней, в течение которых ВСР16 сбрасывалась для инокулированных субъектов; и количество HRV16, выделенного на 2-й день для инокулированных субъектов).Для всех сравнений показаны односторонние значения P , если не указано иное. Коэффициент ошибок типа I 0,10 использовался для проверки всех статистических гипотез.
Результаты
Доклинические исследования
Чувствительность ВСР, RSV, PIV и вируса гриппа к низкому pH. Для исследования было выбрано несколько буферов с низким pH из-за их буферной способности в диапазоне pH 4–6, который, как сообщается, инактивирует ВСР.Каждый из выбранных буферов поддерживал pH <6,0 при разбавлении по крайней мере в 3 раза PBS (pH 7,4). Кроме того, поскольку целью этих экспериментов была разработка раствора для местного применения в носу, несколько буферов не были выбраны из-за плохой растворимости, раздражения слизистой оболочки или сильного вкуса. Фталатный, CP- и аскорбатный буферы вызывали заметную потерю титра инфекционного вируса, и этот эффект был более выражен при 35 ° C, чем при 22 ° C (рисунок 1).
Для исследования было выбрано несколько буферов с низким pH из-за их буферной способности в диапазоне pH 4–6, который, как сообщается, инактивирует ВСР.Каждый из выбранных буферов поддерживал pH <6,0 при разбавлении по крайней мере в 3 раза PBS (pH 7,4). Кроме того, поскольку целью этих экспериментов была разработка раствора для местного применения в носу, несколько буферов не были выбраны из-за плохой растворимости, раздражения слизистой оболочки или сильного вкуса. Фталатный, CP- и аскорбатный буферы вызывали заметную потерю титра инфекционного вируса, и этот эффект был более выражен при 35 ° C, чем при 22 ° C (рисунок 1).
Рисунок 1.
Кинетика потери инфекционности риновируса человека (ВСР) -16 в кислых растворах. Вирус разводили в предварительно нагретых кислых растворах при 22 ° C или 35 ° C. Через определенные промежутки времени отбирали образцы объемом 10 мл и разбавляли 1 мкл ледяного PBS для титрования.
Рисунок 1.
Кинетика потери инфекционности риновируса человека (ВСР) -16 в кислых растворах. Вирус разводили в предварительно нагретых кислых растворах при 22 ° C или 35 ° C. Через определенные промежутки времени отбирали образцы объемом 10 мл и разбавляли 1 мкл ледяного PBS для титрования.
Вирус разводили в предварительно нагретых кислых растворах при 22 ° C или 35 ° C. Через определенные промежутки времени отбирали образцы объемом 10 мл и разбавляли 1 мкл ледяного PBS для титрования.
После инкубации (в течение 2 минут при 35 ° C) вирусных суспензий с равным объемом 0,15 моль / л CP (pH 4,5), HRV1A, -2, -14, -16 и -49 потеряны от 2,6 до 3,6 log 10 в титрах. HRV85 не потерял заметного титра даже при инкубации в течение 10 мин в кислотном буфере. Инфекционность вируса гриппа A (аналогичный Пекину / 32/92) снизилась на 0,7 log 10 за 2 минуты и в среднем на 2,9 log 10 через 10 минут. Низкий pH не снижает титры ни RSV, ни PIV-3.
Влияние периодического воздействия буферов с низким pH на рост вирусов in vitro. Естественная инфекция ВСР инициируется небольшим инокулятом, и вирус должен распространяться внеклеточно, чтобы заразить дополнительные клетки. Были проведены эксперименты для моделирования этого процесса in vitro и определения того, могут ли спреи для носа с низким pH прервать внеклеточное распространение ВСР. Воздействие на инфицированные HRV16 клеток HeLa цитратных или CP-буферов с низким pH с 4-часовыми интервалами снижало выход вируса через 48 часов (рисунок 2).Напротив, отмывка клеток PBS (pH 7,2) вызвала лишь умеренное снижение вирусного титра по сравнению с необработанными клетками (10 4,1 против 10 5,5 TCID 50 / мл; рисунок 2).
Воздействие на инфицированные HRV16 клеток HeLa цитратных или CP-буферов с низким pH с 4-часовыми интервалами снижало выход вируса через 48 часов (рисунок 2).Напротив, отмывка клеток PBS (pH 7,2) вызвала лишь умеренное снижение вирусного титра по сравнению с необработанными клетками (10 4,1 против 10 5,5 TCID 50 / мл; рисунок 2).
Рисунок 2.
Выходы риновируса человека (HRV) —16 из клеток HeLa, обработанных кислотными растворами. Монослои клеток HeLa инфицировали 10 TCID 50 / лунку HRV16, а затем периодически обрабатывали буферами, как указано выше. С, цитратный буфер; ЦП, цитратно-фосфатный буфер.
Рисунок 2.
Выходы риновируса человека (HRV) —16 из клеток HeLa, обработанных кислыми растворами. Монослои клеток HeLa инфицировали 10 TCID 50 / лунку HRV16, а затем периодически обрабатывали буферами, как указано выше. С, цитратный буфер; ЦП, цитратно-фосфатный буфер.
Клинические исследования
Переносимость назальных спреев с низким pH у здоровых добровольцев. Спреи в целом хорошо переносились, и все субъекты прошли все фазы исследования.Никаких различий в общей оценке симптомов отмечено не было (таблица 1). Когда отдельные признаки и симптомы анализировались отдельно, боль в горле чаще сообщалась у лиц, получавших ХП 0,15 или 0,075 моль / л, по сравнению с физиологическим раствором, и это также отражалось в более высоком среднем балле для этого симптома (таблица 1). Эритема носа при физикальном осмотре чаще наблюдалась у лиц, получавших физиологический раствор. Других групповых различий в признаках или симптомах не было.
Спреи в целом хорошо переносились, и все субъекты прошли все фазы исследования.Никаких различий в общей оценке симптомов отмечено не было (таблица 1). Когда отдельные признаки и симптомы анализировались отдельно, боль в горле чаще сообщалась у лиц, получавших ХП 0,15 или 0,075 моль / л, по сравнению с физиологическим раствором, и это также отражалось в более высоком среднем балле для этого симптома (таблица 1). Эритема носа при физикальном осмотре чаще наблюдалась у лиц, получавших физиологический раствор. Других групповых различий в признаках или симптомах не было.
Таблица 1.
Признаки и симптомы, связанные с назальными спреями.
Таблица 1.
Признаки и симптомы, связанные с назальными спреями.
Спреи для носа с буфером могут снижать pH in vivo. Всего 12 здоровых добровольцев завершили интраназальное исследование pH. Интраназальное введение 15, 50 или 100 мкл раствора лимонной кислоты / L-пироглутаминовой кислоты / фитиновой кислоты с pH 3,5 вызвало временные изменения pH во всех 3 областях носа, и эффект зависел от дозы и времени (рисунок 3; таблица 2). Наибольшие эффекты (снижение на 2–2,5 единицы pH) наблюдались через 1 мин после введения 50–100 мкл, а pH оставался значительно ниже исходного уровня в течение 5–10 мин. Доза 100 мкл вызвала значительно большее снижение pH по сравнению с дозами 15 и 50 мкл (AUC, P = 0,02 и 0,04, соответственно) в носоглотке, и аналогичные тенденции были отмечены для других областей нос (данные не показаны).
Наибольшие эффекты (снижение на 2–2,5 единицы pH) наблюдались через 1 мин после введения 50–100 мкл, а pH оставался значительно ниже исходного уровня в течение 5–10 мин. Доза 100 мкл вызвала значительно большее снижение pH по сравнению с дозами 15 и 50 мкл (AUC, P = 0,02 и 0,04, соответственно) в носоглотке, и аналогичные тенденции были отмечены для других областей нос (данные не показаны).
Рис. 3.
Влияние назального спрея на pH нижней носовой раковины (см. Текст).Базовые значения pH ( t = 0 мин) были получены непосредственно перед дозированием с помощью назальных спреев.
Рис. 3.
Влияние назального спрея на pH нижней носовой раковины (см. Текст). Базовые значения pH ( t = 0 мин) были получены непосредственно перед дозированием с помощью назальных спреев.
Таблица 2.
Статистический анализ изменения интраназального pH после дозирования назального спрея по сравнению с исходным уровнем.
Таблица 2.
Статистический анализ изменения интраназального pH после дозирования назального спрея по сравнению сисходный уровень.
Влияние назальных спреев с низким pH на исход экспериментально индуцированной инфекции HRV16. Всего 43 субъекта завершили исследование (таблица 3), и 42 субъекта были инфицированы, на что указывало выделение вируса с выделениями из носа и / или 4-кратное увеличение титра антител. Среди инфицированных субъектов 20 (группа активной назальной композиции) и 21 (группа плацебо) имели полные наборы данных для анализа, основанного на предыдущих суточных оценках симптомов. В группе плацебо 86% субъектов, которым была привита ВСР16, испытали симптомы простуды.В группе активного лечения показатель заболеваемости простудными заболеваниями был ниже — 71%, но это различие, отражающее разницу в 3 субъекта между двумя группами лечения, не достигло статистической значимости. Активное лечение не приводило к снижению общей оценки симптомов или средней суточной оценки симптомов (рисунок 4) по сравнению с плацебо. Точно так же введение назального спрея с низким pH не уменьшало количество индивидуальных симптомов и не сокращало продолжительность заболевания (данные не показаны).
Точно так же введение назального спрея с низким pH не уменьшало количество индивидуальных симптомов и не сокращало продолжительность заболевания (данные не показаны).
Таблица 3.
Таблица 3.
Рисунок 4.
Средние суточные оценки симптомов во время экспериментальной простуды. Субъектам исследования прививали риновирус человека — 16 в день 0 и им вводили либо буфер с низким pH, либо плацебо 4 раза в день, начиная с 5 минут после инокуляции.
Рис. 4.
Средние суточные оценки симптомов во время экспериментальной простуды. Субъектам исследования прививали риновирус человека — 16 в день 0 и им вводили либо буфер с низким pH, либо плацебо 4 раза в день, начиная с 5 минут после инокуляции.
Почти все субъекты заразились контрольным вирусом (20 из 21 в группе лечения и 22 из 22 в группе плацебо). Когда количество вируса в образцах носового лаважа со 2 дня было определено количественно, средний уровень вируса был в 10 раз ниже в группе лечения по сравнению с группой плацебо (10 3 против 10 4 TCID 50 / мл; P <0,01). Корреляция между выделением вируса и оценкой симптомов в группе в целом была умеренной ( r s = 0.447; P <0,01), и это не было изменено статусом лечения.
Корреляция между выделением вируса и оценкой симптомов в группе в целом была умеренной ( r s = 0.447; P <0,01), и это не было изменено статусом лечения.
О серьезных побочных эффектах (НЯ) не сообщалось. Одна ранняя абстиненция была связана с дискомфортом в животе. Количество субъектов, сообщающих о НЯ в каждой группе лечения, независимо от причинной связи, составляло 6 субъектов (27%) в группе активной назальной композиции и 2 субъекта (9%) в группе плацебо. Среди НЯ, которые были расценены как возможно или вероятно связанные с лечением, 1 субъект (5%) в группе активной назальной композиции сообщил о лихорадке, а 1 субъект (5%) в группе плацебо сообщил о дискомфорте в животе.Один субъект сообщил о реакции места нанесения на активный спрей; об этом было сообщено в один день и разрешено в тот же день.
Обсуждение
Мы провели серию экспериментов in vitro и in vivo, чтобы определить, можно ли использовать чувствительность ВСР к низкому pH для разработки новых подходов к лечению респираторных вирусных инфекций. Обзор распространенных респираторных вирусов показал, что кислотные условия подавляют репликацию большинства серотипов ВСР и, в меньшей степени, вируса гриппа.Многие из протестированных буферов с низким pH не повреждали монослои клеток in vitro. Из различных растворов, которые были оценены в культуре ткани, цитрат был выбран для дальнейшего исследования, поскольку он нетоксичен, легко убивает вирус (2–4 log 10 снижение TCID 50 ) и имеет буферную способность, чтобы оставаться на низком уровне. pH даже после трехкратного разбавления. Модель периодического воздействия назального спрея in vitro предполагает, что, прерывая внеклеточное распространение вируса, буферы с низким pH могут предотвращать или уменьшать тяжесть клинических простуд.Поскольку буферы с низким pH снижали pH носа по крайней мере на 5 минут и вызывали лишь незначительное раздражение носа у здоровых добровольцев, было проведено небольшое пилотное клиническое испытание с использованием экспериментальной инокуляции с HRV16.
Обзор распространенных респираторных вирусов показал, что кислотные условия подавляют репликацию большинства серотипов ВСР и, в меньшей степени, вируса гриппа.Многие из протестированных буферов с низким pH не повреждали монослои клеток in vitro. Из различных растворов, которые были оценены в культуре ткани, цитрат был выбран для дальнейшего исследования, поскольку он нетоксичен, легко убивает вирус (2–4 log 10 снижение TCID 50 ) и имеет буферную способность, чтобы оставаться на низком уровне. pH даже после трехкратного разбавления. Модель периодического воздействия назального спрея in vitro предполагает, что, прерывая внеклеточное распространение вируса, буферы с низким pH могут предотвращать или уменьшать тяжесть клинических простуд.Поскольку буферы с низким pH снижали pH носа по крайней мере на 5 минут и вызывали лишь незначительное раздражение носа у здоровых добровольцев, было проведено небольшое пилотное клиническое испытание с использованием экспериментальной инокуляции с HRV16. Экспериментальная инокуляция ВСР представляет собой привлекательную модель для тестирования противовирусных соединений, поскольку она позволяет делать инокуляцию стандартизированным вирусом и проводить подробные кинетические наблюдения за развитием и разрешением простуды. Комбинация низкого pH и хелатирующего агента уменьшала количество вирусов во время острой простуды, но не уменьшала симптомы простуды.Хотя никаких клинических преимуществ продемонстрировано не было, настоящее исследование подтвердило возможность использования недорогих растворов с низким pH для подавления репликации вируса.
Экспериментальная инокуляция ВСР представляет собой привлекательную модель для тестирования противовирусных соединений, поскольку она позволяет делать инокуляцию стандартизированным вирусом и проводить подробные кинетические наблюдения за развитием и разрешением простуды. Комбинация низкого pH и хелатирующего агента уменьшала количество вирусов во время острой простуды, но не уменьшала симптомы простуды.Хотя никаких клинических преимуществ продемонстрировано не было, настоящее исследование подтвердило возможность использования недорогих растворов с низким pH для подавления репликации вируса.
Главный вопрос, поднятый этими результатами, заключается в том, почему лечение смогло уменьшить вирусное выделение, но не уменьшило клинические симптомы. Одним из факторов была статистическая мощность исследования. Еще одна возможность состоит в том, что, несмотря на противовирусный эффект, растворы вызывали ощущения в носу, которые принимали за симптомы простуды. Хотя профиль АЕ цитрата в носу у нормальных добровольцев был подобен профилю нормального физиологического раствора, возможно, что этот эффект мог усиливаться при наличии вирусной инфекции. Альтернативное объяснение отсутствия клинической пользы заключается в том, что для достижения эффективности необходимо большее снижение вирусной репликации. Снижение выделения вируса на 1 логарифм, наблюдаемое в настоящем исследовании, тем не менее, аналогично тому, о котором сообщалось в клиническом исследовании тремакамры (растворимого ICAM-1) [10], и несколько больше, чем у интерферона-α 2b или плеконарил [17, 18]. В предыдущих исследованиях каждый из этих препаратов давал небольшую, но значительную клиническую пользу. У местных лекарств есть дополнительная проблема, заключающаяся в доставке лекарства к месту инфекции.Инфекции, вызванные ВСР, могут поражать не только носоглотку, но и большие нижние дыхательные пути [19], и доставка в эти места может быть необходима для получения оптимальных клинических преимуществ. Наконец, возможно, что спрей усилил клеточное или нервное воспаление; оба этих механизма связаны с патогенезом симптомов простуды [1, 20]. Для будущих исследований гистологическая оценка образцов биопсии слизистой оболочки носа может предоставить дополнительную информацию в этом отношении.
Альтернативное объяснение отсутствия клинической пользы заключается в том, что для достижения эффективности необходимо большее снижение вирусной репликации. Снижение выделения вируса на 1 логарифм, наблюдаемое в настоящем исследовании, тем не менее, аналогично тому, о котором сообщалось в клиническом исследовании тремакамры (растворимого ICAM-1) [10], и несколько больше, чем у интерферона-α 2b или плеконарил [17, 18]. В предыдущих исследованиях каждый из этих препаратов давал небольшую, но значительную клиническую пользу. У местных лекарств есть дополнительная проблема, заключающаяся в доставке лекарства к месту инфекции.Инфекции, вызванные ВСР, могут поражать не только носоглотку, но и большие нижние дыхательные пути [19], и доставка в эти места может быть необходима для получения оптимальных клинических преимуществ. Наконец, возможно, что спрей усилил клеточное или нервное воспаление; оба этих механизма связаны с патогенезом симптомов простуды [1, 20]. Для будущих исследований гистологическая оценка образцов биопсии слизистой оболочки носа может предоставить дополнительную информацию в этом отношении.
В предварительных испытаниях, спреи для носа с низким pH хорошо переносились здоровыми добровольцами и вызывали значительное снижение pH в носу.В дополнение к цитрату к препарату, используемому в испытании по инокуляции, была добавлена фитиновая кислота, поскольку сочетание низкого pH и хелатирующей способности помогло повысить противовирусную активность препарата in vitro (данные не показаны). Предварительные эксперименты показали, что препарат с низким pH, содержащий фитиновую кислоту, также хорошо переносился добровольцами (данные не показаны). С технической точки зрения наши результаты демонстрируют, что можно снизить pH носа до <4,0 у здоровых людей путем дозирования всего лишь 50–100 мкл назального спрея.Обнадеживает то, что влияние на pH в полости носа распространялось от передней части нижней носовой раковины (где был отложен продукт) до носоглотки, что указывает на широкую картину отложения и / или распространения. В целом, разбавление носового секрета и буферизация носовых тканей привели к изменению всего лишь на 0,5 единицы pH по сравнению с доставленным продуктом. Это подтверждает, что использование спрея привело к достижению pH, враждебного по отношению к вариабельности сердечного ритма, которая обычно инактивируется 1-минутным воздействием pH 4,0.
Это подтверждает, что использование спрея привело к достижению pH, враждебного по отношению к вариабельности сердечного ритма, которая обычно инактивируется 1-минутным воздействием pH 4,0.
Хотя на этой модели не было продемонстрировано никаких клинических преимуществ, назальный спрей с низким pH действительно снизил распространение вируса.Поскольку передача простуды частично зависит от распространения большого количества вируса [21], вполне вероятно, что лечение с низким pH может быть использовано для подавления передачи от человека к человеку. Фактически, ткани, пропитанные органическими кислотами и детергентами, смогли уменьшить передачу простудных заболеваний в клинических испытаниях [22].
Таким образом, некоторые, но не все распространенные респираторные вирусы чувствительны к низкому pH, и мы продемонстрировали противовирусное действие низкого pH как in vitro, так и in vivo.Несмотря на противовирусный эффект, тестируемый нами назальный состав не привел к статистически значимому снижению тяжести или продолжительности простуды, и наша гипотеза состоит в том, что местное раздражение носа может иметь скрытые клинические преимущества. Если будут разработаны менее раздражающие кислые спреи, это может стать новым и недорогим противовирусным подходом для профилактики или лечения простуды, вызванной ВСР, и потребует проведения более масштабных исследований на людях.
Если будут разработаны менее раздражающие кислые спреи, это может стать новым и недорогим противовирусным подходом для профилактики или лечения простуды, вызванной ВСР, и потребует проведения более масштабных исследований на людях.
Список литературы
1.,.Связь вирусных инфекций с заболеваниями хрипов и астмой
,Nat Rev Immunol
,2002
, vol.2
(стр.132
—8
) 2.,,,.Обнаружение риновируса в чистках носовых пазух пациентов с острым внебольничным синуситом методом обратной транскрипции-ПЦР
,J Clin Microbiol
,1997
, vol.35
(стр.1791
—3
) 3.,,, Et al.Физиологические аномалии придаточных пазух носа при экспериментальной риновирусной простуде
,J Allergy Clin Immunol
,1992
, vol.90
(стр.474
—8
) 4.,,, Et al.Вирусные инфекции в зависимости от возраста, атопии и сезона госпитализации среди детей, госпитализированных из-за хрипов
,J Allergy Clin Immunol
,2004
, vol.
114
(стр.239
—47
) 5.,,, Et al.Риновирусные заболевания в младенчестве предсказывают последующее свистящее дыхание в детстве
,J Allergy Clin Immunol
,2005
, vol.116
(стр.571
—7
) 6.,,.Госпитализации пожилых людей, связанных с риновирусом и коронавирусной инфекцией
,J Infect Dis
,2002
, vol.185
(стр.1338
—41
) 7 ..Вирус гриппа и средний отит, связанный с риновирусом: потенциал для противовирусного вмешательства
,Vaccine
,2000
, vol.19
(стр.S66
—70
) 8.,,, Et al.Пероральное лечение плеконарилом пикорнавирусного респираторного респираторного заболевания у взрослых: эффективность и переносимость в клинических испытаниях фазы II
,Antivir Ther
,2002
, vol.7
(стр.53
—65
) 9.,,, Et al.Фаза II, рандомизированные, двойные слепые, плацебо-контролируемые исследования 2-процентной суспензии рупринвира назального спрея для профилактики и лечения экспериментально индуцированной риновирусной простуды у здоровых добровольцев
,Противомикробные агенты Chemother
,2003
, vol.
47
(стр.3907
—16
) 10.,,, Et al.Эффективность тремакамры, растворимой молекулы межклеточной адгезии 1, при экспериментальной риновирусной инфекции — рандомизированное клиническое исследование
,JAMA
,1999
, vol.281
(стр.1797
—804
) 11.,,, Et al.Структурные изменения риновируса-14 человека, вызванные кислотой — возможная роль в непокрытии
,Proc Natl Acad Sci USA
,1992
, vol.89
(стр.10213
—7
) 12.,,.Роль расщепления созревания в инфекционности пикорнавирусов: активация инфектосомы
,J Virol
,1993
, vol.67
(стр.2110
—22
) 13., , , и другие.Репликация риновируса вызывает продукцию RANTES в первичных эпителиальных клетках бронхов
,Am J Respir Cell Mol Biol
,1999
, vol.20
(стр.1220
—8
) 14.,,,,,.Риновирус-индуцированные реакции мононуклеарных клеток периферической крови и исход экспериментальной инфекции у субъектов с аллергией
,J Allergy Clin Immunol
,2000
, vol.
105
(стр.692
—8
) 15.,,,.pH носа и клиренс сахарина не связаны в физиологически нормальном носу
,Rhinology
,2000
, vol.38
(стр.66
—7
) 16.,,,.Измерение pH в носу: надежный и повторяемый параметр физиологического раствора с кислотным буфером и риновируса
,Clin Otolaryngol Allied Sci
,1999
, vol.24
(стр.67
—8
) 17.,.Интраназальное лечение экспериментальных риновирусных простуд интерфероном-альфа 2
,J Infect Dis
,1984
, vol.150
(стр.174
—80
) 18.,,, Et al.Эффективность и безопасность перорального плеконарила для лечения простуды, вызванной пикорнавирусами у взрослых: результаты 2 двойных слепых рандомизированных плацебо-контролируемых исследований
,Clin Infect Dis
,2003
, vol.36
(стр.1523
—32
) 19.,,, Et al.Количественный и качественный анализ риновирусной инфекции в тканях бронхов
,Am J Respir Crit Care Med
,2005
, vol.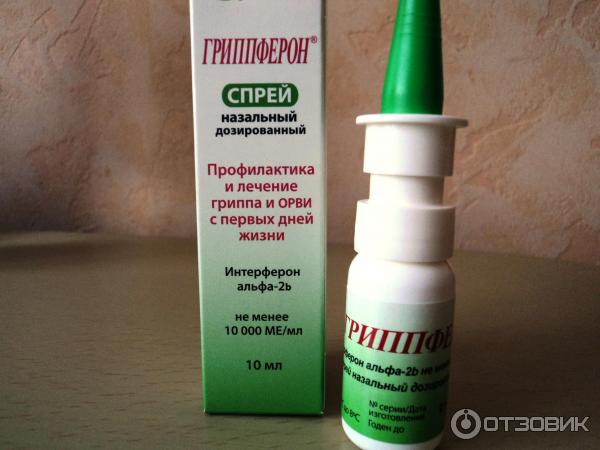
171
(стр.645
—51
) 20 ..Приступы астмы, вызванные вирусами
,JAMA
,2002
, т.287
(стр.755
—61
) 21.,,.Модель для получения предсказуемой естественной передачи риновирусов у людей-добровольцев
,J Infect Dis
,1984
, vol.150
(стр.195
—201
) 22.,,, Et al.Прерывание передачи риновирусной простуды среди людей-добровольцев с использованием вирулицидных бумажных носовых платков
,J Infect Dis
,1986
, vol.153
(стр.352
—6
)© 2007 Американское общество инфекционных болезней
.


 МЕ препарата
МЕ препарата Forest Pharmaceuticals, Inc. Апрель 2010 г.
Forest Pharmaceuticals, Inc. Апрель 2010 г.