Памятка: Профилактика гриппа и коронавирусной инфекции
Вирусы гриппа и коронавирусной инфекции вызывают у человека респираторные заболевания разной тяжести. Симптомы заболевания аналогичны симптомам обычного (сезонного) гриппа. Тяжесть заболевания зависит от целого ряда факторов, в том числе от общего состояния организма и возраста.
Предрасположены к заболеванию: пожилые люди, маленькие дети, беременные женщины и люди, страдающие хроническими заболеваниями (астмой, диабетом, сердечно-сосудистыми заболеваниями), и с ослабленным иммунитетом.
ПРАВИЛО 1. ЧАСТО МОЙТЕ РУКИ С МЫЛОМ
Чистите и дезинфицируйте поверхности, используя бытовые моющие средства.
Гигиена рук — это важная мера профилактики распространения гриппа и коронавирусной инфекции. Мытье с мылом удаляет вирусы. Если нет возможности помыть руки с мылом, пользуйтесь спиртсодержащими или дезинфицирующими салфетками.
Чистка и регулярная дезинфекция поверхностей (столов, дверных ручек, стульев, гаджетов и др.) удаляет вирусы.
ПРАВИЛО 2. СОБЛЮДАЙТЕ РАССТОЯНИЕ И ЭТИКЕТ
Вирусы передаются от больного человека к здоровому воздушно -капельным путем (при чихании, кашле), поэтому необходимо соблюдать расстояние не менее 1 метра от больных.
Избегайте трогать руками глаза, нос или рот. Вирус гриппа и коронавирус распространяются этими путями.
Надевайте маску или используйте другие подручные средства защиты, чтобы уменьшить риск заболевания.
При кашле, чихании следует прикрывать рот и нос одноразовыми салфетками, которые после использования нужно выбрасывать.
Избегая излишние поездки и посещения многолюдных мест, можно уменьшить риск заболевания.
ПРАВИЛО 3. ВЕДИТЕ ЗДОРОВЫЙ ОБРАЗ ЖИЗНИ
Здоровый образ жизни повышает сопротивляемость организма к инфекции. Соблюдайте здоровый режим, включая полноценный сон, потребление пищевых продуктов богатых белками, витаминами и минеральными веществами, физическую активность.
ПРАВИЛО 4. ЗАЩИЩАЙТЕ ОРГАНЫ ДЫХАНИЯ С ПОМОЩЬЮ МЕДИЦИНСКОЙ МАСКИ
Среди прочих средств профилактики особое место занимает ношение масок, благодаря которым ограничивается распространение вируса.
Медицинские маски для защиты органов дыхания используют:
— при посещении мест массового скопления людей, поездках в общественном транспорте в период роста заболеваемости острыми респираторными вирусными инфекциями;
— при уходе за больными острыми респираторными вирусными инфекциями;
— при общении с лицами с признаками острой респираторной вирусной инфекции;
— при рисках инфицирования другими инфекциями, передающимися воздушно-капельным путем.
КАК ПРАВИЛЬНО НОСИТЬ МАСКУ?
Маски могут иметь разную конструкцию. Они могут быть одноразовыми или могут применяться многократно. Есть маски, которые служат 2, 4, 6 часов. Стоимость этих масок различная, из-за различной пропитки. Но нельзя все время носить одну и ту же маску, тем самым вы можете инфицировать дважды сами себя. Какой стороной внутрь носить медицинскую маску — непринципиально.
Какой стороной внутрь носить медицинскую маску — непринципиально.
Чтобы обезопасить себя от заражения, крайне важно правильно ее носить:
— маска должна тщательно закрепляться, плотно закрывать рот и нос, не оставляя зазоров;
— старайтесь не касаться поверхностей маски при ее снятии, если вы ее коснулись, тщательно вымойте руки с мылом или спиртовым средством;
— влажную или отсыревшую маску следует сменить на новую, сухую;
— не используйте вторично одноразовую маску;
— использованную одноразовую маску следует немедленно выбросить в отходы.
При уходе за больным, после окончания контакта с заболевшим, маску следует немедленно снять. После снятия маски необходимо незамедлительно и тщательно вымыть руки.
Маска уместна, если вы находитесь в месте массового скопления людей, в общественном транспорте, а также при уходе за больным, но она нецелесообразна на открытом воздухе.
Во время пребывания на улице полезно дышать свежим воздухом и маску надевать не стоит.
Вместе с тем, медики напоминают, что эта одиночная мера не обеспечивает полной защиты от заболевания. Кроме ношения маски необходимо соблюдать другие профилактические меры.
ПРАВИЛО 5. ЧТО ДЕЛАТЬ В СЛУЧАЕ ЗАБОЛЕВАНИЯ ГРИППОМ, КОРОНАВИРУСНОЙ ИНФЕКЦИЕЙ?
Оставайтесь дома и срочно обращайтесь к врачу.
Следуйте предписаниям врача, соблюдайте постельный режим и пейте как можно больше жидкости.
КАКОВЫ СИМПТОМЫ ГРИППА/КОРОНАВИРУСНОЙ ИНФЕКЦИИ высокая температура тела, озноб, головная боль, слабость, заложенность носа, кашель, затрудненное дыхание, боли в мышцах, конъюнктивит.
В некоторых случаях могут быть симптомы желудочно-кишечных расстройств: тошнота, рвота, диарея.
КАКОВЫ ОСЛОЖНЕНИЯ
Среди осложнений лидирует вирусная пневмония. Ухудшение состояния при вирусной пневмонии идёт быстрыми темпами, и у многих пациентов уже в течение 24 часов развивается дыхательная недостаточность, требующая немедленной респираторной поддержки с механической вентиляцией лёгких.
Быстро начатое лечение способствует облегчению степени тяжести болезни.
ЧТО ДЕЛАТЬ ЕСЛИ В СЕМЬЕ КТО-ТО ЗАБОЛЕЛ ГРИППОМ/
КОРОНАВИРУСНОЙ ИНФЕКЦИЕЙ?
Вызовите врача.
Выделите больному отдельную комнату в доме. Если это невозможно, соблюдайте расстояние не менее 1 метра от больного.
Ограничьте до минимума контакт между больным и близкими, особенно детьми, пожилыми людьми и лицами, страдающими хроническими заболеваниями.
Часто проветривайте помещение.
Сохраняйте чистоту, как можно чаще мойте и дезинфицируйте поверхности бытовыми моющими средствами.
Часто мойте руки с мылом.
Ухаживая за больным, прикрывайте рот и нос маской или другими защитными средствами (платком, шарфом и др.).
Насколько COVID-19 может быть опаснее гриппа. Факты и цифры :: Общество :: РБК
Сколько людей умирали от пандемий гриппа и COVID-19
VideoЧитайте на РБК Pro
Если проанализировать данные по числу умерших от пандемий за последние 100 лет, рассчитав, сколько человек в среднем умирали за месяц при каждой из них, самой смертоносной окажется испанка — так называемый испанский грипп, — начавшаяся весной 1918-го и продлившаяся два года. По разным оценкам, от нее погибли от 17,4 млн до 100 млн человек, то есть до 6,3 млн человек умирали каждый месяц. Масштабы бедствия осложняли послевоенные годы и более низкий уровень медицины.
По разным оценкам, от нее погибли от 17,4 млн до 100 млн человек, то есть до 6,3 млн человек умирали каждый месяц. Масштабы бедствия осложняли послевоенные годы и более низкий уровень медицины.

Таким образом, по максимальной оценке, этот вирус в среднем уносил жизни 70 тыс. человек в месяц. В августе 2010 года ВОЗ заявила о переходе заболевания в постпандемическую стадию. Таким образом, пандемия продлилась 15 месяцев.
Пандемия COVID-19 длится уже восемь месяцев (с момента объявления ВОЗ), и никто не может дать прогноз, сколько еще она продлится. За это время уже умерло больше людей, чем во время волны свиного гриппа 2009–2010 годов.
Самыми пострадавшими странами от COVID-19 в плане суммарного числа умерших оказались США, Бразилия и Индия. Италия, Испания и Франция — европейские страны, встретившие пандемию одними из первых, также стабильно держатся в первой десятке.
Список государств, где больше всего умерших на 1 млн человек населения, выглядит похожим образом, но страны в нем распределяются по-другому.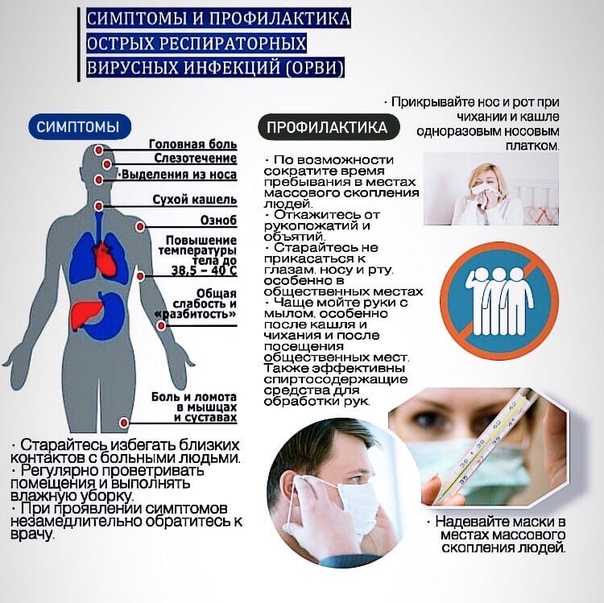
Россия, оказавшаяся в списке первых 15 стран по общему числу умерших, при расчете числа жертв COVID-19 на 1 млн человек находится на 54-м месте (32 тыс. умерших). При этом, судя по всему, ВОЗ ориентируется на данные оперативного штаба по борьбе с коронавирусом. В то же время Росстат показывает намного больше умерших, опираясь на свидетельства о смерти из реестра ЗАГС: по последним представленным данным, с апреля по сентябрь умерли более 55 тыс. россиян с COVID-19.
Какие шесть главных ограничений ввели в российских регионах. ГлавноеУ гриппа и COVID-19 разнятся возрастные группы риска. В первом случае, по данным ВОЗ, заболевание представляет опасность для детей, беременных женщин и пожилых. Что касается коронавируса, здесь к группе риска относятся прежде всего пожилые (и люди любого возраста с хроническими заболеваниями, то же касается и гриппа. — РБК).
В первом случае, по данным ВОЗ, заболевание представляет опасность для детей, беременных женщин и пожилых. Что касается коронавируса, здесь к группе риска относятся прежде всего пожилые (и люди любого возраста с хроническими заболеваниями, то же касается и гриппа. — РБК).
В статье Age-specific mortality and immunity patterns of SARS-CoV-2, опубликованной в журнале Nature в ноябре, исследователи собрали подтвержденные данные о возрастном распределении погибших в 45 странах. РБК отобрал из этого исследования 14 стран Европы и Латинской Америки с суммарным населением 627 млн человек и вычислил процент умерших в каждой возрастной категории (выборка основана на сопоставимости рассмотренных в исследовании возрастных диапазонов для этих стран). Оказалось, что опаснее всего COVID-19 для пожилых людей от 70 лет. На этот сегмент приходится почти две трети всех смертельных случаев.
Оказалось, что опаснее всего COVID-19 для пожилых людей от 70 лет. На этот сегмент приходится почти две трети всех смертельных случаев.
Легче всего болезнь переносят дети. На возрастную группу от 20 до 40 лет приходится 2% смертей. Но представители этих возрастных групп, переносящие инфекцию в легкой форме, могут вносить вклад в распространение болезни.
Несмотря на то что к группам риска при гриппе относят больше возрастных категорий, при COVID-19 случаев течения болезни в тяжелой форме больше, отмечают ученые. Это происходит потому, что в случае с гриппом контакт с прошлыми сезонными инфекциями и массовая вакцинация позволяют ограничить само число случаев заражения. А вот к вирусу, вызывающему COVID-19, потенциально восприимчивы все люди из-за его новизны.
Когда и как долго заразен больной
Другая коварная черта коронавируса заключается в инкубационном периоде. Время от момента заражения до возникновения симптомов при COVID-19 составляет в среднем пять-шесть дней, однако может доходить и до 14 дней. При гриппе инкубационный период длится в среднем два дня, но может быть и четыре. То есть при COVID-19 человек потенциально может дольше не ощущать недуг.
Время от момента заражения до возникновения симптомов при COVID-19 составляет в среднем пять-шесть дней, однако может доходить и до 14 дней. При гриппе инкубационный период длится в среднем два дня, но может быть и четыре. То есть при COVID-19 человек потенциально может дольше не ощущать недуг.
Последние исследования указывают и на то, что носители COVID-19 дольше остаются заразными. По данным Роспотребнадзора, при гриппе пациент становится таким за один день до начала клинических проявлений заболевания. Максимальный период, когда больной заразен, составляет три дня заболевания.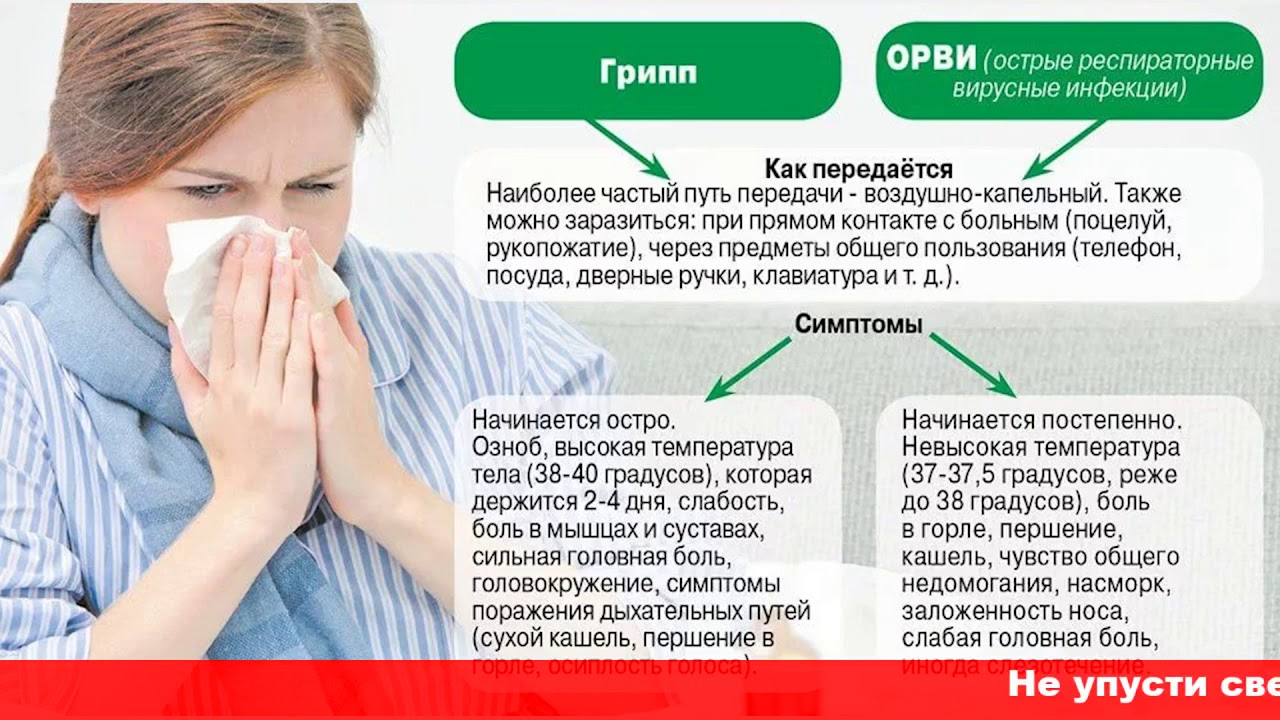
Согласно данным ВОЗ, инфицированные коронавирусом нового типа наиболее заразны за два дня до появления симптомов и на ранней стадии болезни. Те, у кого развивается тяжелая форма, могут распространять COVID-19 дольше.
Центр по контролю и профилактике заболеваний (CDC) США указывает, что пациенты с COVID-19 в легкой и умеренной форме заразны в течение десяти дней, а с ослабленным иммунитетом — до 20 дней после появления симптомов.
Меры сдерживания и применение масок
Для сдерживания распространения коронавируса ВОЗ рекомендует использовать комплекс мер: помимо ношения маски к ним относятся соблюдение дистанции, а также частое мытье и дезинфекция рук. Эффективность повсеместного использования масок не доказана, но специалисты указывают на необходимость их применения в местах скопления людей, например в общественном транспорте и магазинах (такие требования с 28 октября по всей России ввел Роспотребнадзор).
Мишустин раскритиковал регионы за несвоевременные действия по COVID-19В Европе проходили демонстрации против мер, которые принимают государства, включая требование использовать средства индивидуальной защиты. А в России появилась петиция против обязательного ношения масок (к 15 ноября ее подписали немногим более 13 тыс. человек). В обращении среди прочего указано на риски самозаражения из-за неправильного или слишком долгого использования маски (ВОЗ также указывает на то, что масками нужно пользоваться аккуратно). А также что от маски может быть польза именно в плане «снижения потенциального риска заражения при контакте с заболевшим в период заболевания, предшествующий появлению симптомов». Именно на это обращает внимание ВОЗ в своих рекомендациях: «Маска может сыграть роль барьера, сдерживающего распространение зараженных вирусом респираторных капель инфицированного человека».
А в России появилась петиция против обязательного ношения масок (к 15 ноября ее подписали немногим более 13 тыс. человек). В обращении среди прочего указано на риски самозаражения из-за неправильного или слишком долгого использования маски (ВОЗ также указывает на то, что масками нужно пользоваться аккуратно). А также что от маски может быть польза именно в плане «снижения потенциального риска заражения при контакте с заболевшим в период заболевания, предшествующий появлению симптомов». Именно на это обращает внимание ВОЗ в своих рекомендациях: «Маска может сыграть роль барьера, сдерживающего распространение зараженных вирусом респираторных капель инфицированного человека».
Согласно данным Роспотребнадзора, ношение масок снижает вероятность заражения разного рода респираторными инфекциями в 1,8 раза, использование перчаток — в 1,3 раза.
В одном из последних исследований японские ученые пришли к выводу, что матерчатая маска задерживает 17% частиц вируса, хирургическая трехслойная — 47%, а маска типа N95 защищает на 79%.
Грипп. Симптомы. Профилактика
Грипп— острое инфекционное заболевание дыхательных путей, вызываемое вирусом гриппа. Входит в группу острых респираторных вирусных инфекций (ОРВИ). Периодически распространяется в виде эпидемий и пандемий.
В настоящее время выявлено более 2000 вариантов вируса гриппа, различающихся между собой антигенным спектром. По оценкам ВОЗ, от всех вариантов вируса во время сезонных эпидемий в мире ежегодно умирают от 250 до 500 тыс. человек (большинство из них старше 65 лет), в некоторые годы число смертей может достигать миллиона.
Нередко словом «грипп» в обиходе также называют любое острое респираторное заболевание (ОРВИ), что ошибочно, так как кроме гриппа на сегодняшний день описано ещё более 200 видов других респираторных вирусов (аденовирусы, риновирусы, респираторно-синцитиальные вирусы и др. ), вызывающих гриппоподобные заболевания у человека.
), вызывающих гриппоподобные заболевания у человека.
Для профилактики гриппа Центры по контролю и профилактике заболеваний США рекомендуют вакцинировать всех лиц старше 6 месяцев (особенно входящих в группы риска), применять средства индивидуальной защиты, сократить контакты с заболевшими, применять противовирусные препараты по назначению врача.
Во многих европейских языках грипп называют «инфлюэнцей» (итал. influenza — «воздействие»), названием, в своё время возникшим в Риме в середине XVIII века благодаря потенциальной вирулентности заражения, как бы воздействующего на здоровое население.
Впервые вирус был выделен в 1930-е годы.
К гриппу восприимчивы все возрастные категории людей. Источником инфекции является больной человек с явной или стёртой формой болезни, выделяющий вирус с кашлем, чиханьем и т. д. Больной заразен с первых часов заболевания и до пятого—седьмого дня болезни. Характеризуется аэрозольным (вдыхание мельчайших капель слюны, слизи, которые содержат вирус гриппа) механизмом передачи и чрезвычайно быстрым распространением в виде эпидемий и пандемий..jpg) Эпидемии гриппа, вызванные серотипом А, возникают примерно каждые 2—3 года, а вызванные серотипом В — каждые 4—6 лет. Серотип С не вызывает эпидемий, только единичные вспышки у детей и ослабленных людей. В виде эпидемий встречается чаще в осенне-зимний период. Согласно исследованию финских специалистов, проведённому университетом Оулу совместно с исследовательским центром биомедицины и Ведомством здравоохранения и социального развития THL, риск эпидемий является наиболее высоким при температуре от +5 до −5, когда уменьшение влажности воздуха создаёт благоприятные условия для проникновения вирусов в человеческий организм, в силу охлаждения и сухости дыхательных путей. Периодичность эпидемий связана с частым изменением антигенной структуры вируса при пребывании его в естественных условиях.
Эпидемии гриппа, вызванные серотипом А, возникают примерно каждые 2—3 года, а вызванные серотипом В — каждые 4—6 лет. Серотип С не вызывает эпидемий, только единичные вспышки у детей и ослабленных людей. В виде эпидемий встречается чаще в осенне-зимний период. Согласно исследованию финских специалистов, проведённому университетом Оулу совместно с исследовательским центром биомедицины и Ведомством здравоохранения и социального развития THL, риск эпидемий является наиболее высоким при температуре от +5 до −5, когда уменьшение влажности воздуха создаёт благоприятные условия для проникновения вирусов в человеческий организм, в силу охлаждения и сухости дыхательных путей. Периодичность эпидемий связана с частым изменением антигенной структуры вируса при пребывании его в естественных условиях.
Группами высокого риска считаются дети, люди преклонного возраста, беременные женщины, люди с хроническими болезнями сердца, лёгких.
Входными воротами для вируса гриппа являются клетки мерцательного эпителия верхних дыхательных путей — носа, трахеи, бронхов. В этих клетках вирус размножается и приводит к их разрушению и гибели. Этим объясняется раздражение верхних дыхательных путей, кашель, чихание, заложенность носа. Проникая в кровь и вызывая виремию, вирус оказывает непосредственное, токсическое действие, проявляющееся в виде повышения температуры, озноба, миалгий, головной боли. Кроме того, вирус повышает сосудистую проницаемость, вызывает развитие стазов и плазмо-геморрагий. Может вызывать и угнетение защитных систем организма, что обусловливает присоединение вторичной инфекции и осложнения.
В этих клетках вирус размножается и приводит к их разрушению и гибели. Этим объясняется раздражение верхних дыхательных путей, кашель, чихание, заложенность носа. Проникая в кровь и вызывая виремию, вирус оказывает непосредственное, токсическое действие, проявляющееся в виде повышения температуры, озноба, миалгий, головной боли. Кроме того, вирус повышает сосудистую проницаемость, вызывает развитие стазов и плазмо-геморрагий. Может вызывать и угнетение защитных систем организма, что обусловливает присоединение вторичной инфекции и осложнения.
На протяжении всего трахео-бронхиального дерева наблюдается отслоение эпителия, образование аркадообразных структур эпителия трахеи и бронхов вследствие неравномерного отёка и вакуолизации цитоплазмы и признаки экссудативного воспаления. Частый характерный признак — это геморрагический трахеобронхит различной степени выраженности. В очагах гриппозной пневмонии альвеолы содержат серозный экссудат, эритроциты, лейкоциты, альвеолоциты. В очагах воспаления нередки тромбозы сосудов и некрозы.
Симптомы гриппа не являются специфическими, то есть без особых лабораторных исследований (выделение вируса из мазков горла, прямая и непрямая иммунофлуоресценция на мазках эпителия слизистой оболочки носа, серологический тест на наличие противогриппозных антител в крови и т. п.) невозможно наверняка отличить грипп от других ОРВИ. На практике диагноз «грипп» устанавливается на основании лишь эпидемических данных, когда наблюдается повышение заболеваемости ОРВИ среди населения данной местности. В отличие от других ОРВИ, для гриппа существует этиотропная терапия (озельтамивир, занамивир, римантадин), и специфическая профилактика — вакцинация.
Инкубационный период может колебаться от нескольких часов до 3 дней, обычно 1—2 дня. Тяжесть заболевания варьирует от лёгких до тяжёлых гипертоксических форм. Некоторые авторы указывают, что типичная гриппозная инфекция начинается обычно с резкого подъёма температуры тела (до 38 °C — 40 °C), которая сопровождается обычными симптомами интоксикации: ознобом, болями в мышцах, головной болью, чувством усталости и держится 3-4 дня. Выделений из носа, как правило, нет, напротив, есть выраженное чувство сухости в носу и глотке. Обычно появляется сухой, напряжённый кашель, сопровождающийся болью за грудиной. При гладком течении эти симптомы сохраняются 3—5 дней, и больной выздоравливает, но несколько дней сохраняется чувство выраженной усталости, особенно у пожилых больных. При тяжёлых формах гриппа развивается сосудистый коллапс, отёк мозга, геморрагический синдром, присоединяются вторичные бактериальные осложнения. Клинические находки при объективном исследовании не выражены — только гиперемия и отёк слизистой зева, бледность кожи, инъецированные склеры. Грипп представляет большую опасность из-за развития серьёзных осложнений, особенно у детей, пожилых и ослабленных больных.
Выделений из носа, как правило, нет, напротив, есть выраженное чувство сухости в носу и глотке. Обычно появляется сухой, напряжённый кашель, сопровождающийся болью за грудиной. При гладком течении эти симптомы сохраняются 3—5 дней, и больной выздоравливает, но несколько дней сохраняется чувство выраженной усталости, особенно у пожилых больных. При тяжёлых формах гриппа развивается сосудистый коллапс, отёк мозга, геморрагический синдром, присоединяются вторичные бактериальные осложнения. Клинические находки при объективном исследовании не выражены — только гиперемия и отёк слизистой зева, бледность кожи, инъецированные склеры. Грипп представляет большую опасность из-за развития серьёзных осложнений, особенно у детей, пожилых и ослабленных больных.
Частота возникновения осложнений заболевания относительно невелика, но в случае их развития они могут представлять значительную опасность для здоровья больного. Средне-тяжёлые, тяжёлые и токсические формы гриппа, могут являться причиной серьёзных осложнений. Причинами возникновения осложнений при гриппе могут быть следующие особенности инфекционного процесса: вирус гриппа оказывает выраженное капилляротоксическое действие, способен подавлять иммунитет, разрушает тканевые барьеры, облегчая тем самым агрессию тканей резидентной флорой.
Причинами возникновения осложнений при гриппе могут быть следующие особенности инфекционного процесса: вирус гриппа оказывает выраженное капилляротоксическое действие, способен подавлять иммунитет, разрушает тканевые барьеры, облегчая тем самым агрессию тканей резидентной флорой.
Впервые вакцинация против вируса была разработана в начале 1940-х и испытана на солдатах, воевавших во Второй мировой войне. До последнего времени лечение было обычно симптоматическое, в виде жаропонижающих, отхаркивающих, и противокашлевых средств. ЦКЗ рекомендует пациентам покой, достаточное количество жидкости, избегать курения и спиртных напитков. Неосложнённый грипп не лечат антибиотиками, поскольку антибиотиками лечат только бактериальные инфекции (к которым грипп не относится).
Диагностика гриппа является типичной для клинической картины: при резком повышении температуры необходимо сразу же обратиться к врачу. Визит к врачу позволит оперативно определить риск появления возможных бактериальных осложнений. При диагностике гриппа огромное внимание уделяется повторным повышениям температуры, в частности при резком, а также при усилении кашля, общего ухудшения самочувствия после начинающегося улучшения — как правило, при гриппе подобные явления появляются на 4-5-й день заболевания. В таком случае врач направляет на выполнение лабораторных и функциональных исследований, как общий анализ крови, рентген придаточных пазух носа, грудной клетки и др.
При диагностике гриппа огромное внимание уделяется повторным повышениям температуры, в частности при резком, а также при усилении кашля, общего ухудшения самочувствия после начинающегося улучшения — как правило, при гриппе подобные явления появляются на 4-5-й день заболевания. В таком случае врач направляет на выполнение лабораторных и функциональных исследований, как общий анализ крови, рентген придаточных пазух носа, грудной клетки и др.
Традиционным способом предупреждения заболевания гриппом, рекомендованным Центрами по контролю и профилактике заболеваний США и Всемирной организацией здравоохранения является вакцинация.
Исследования последовательно показывают высокую эффективность у детей раннего возраста (в возрасте от 6 месяцев до 7 лет).
Вакцинация осуществляется соответствующей ведущему штамму противогриппозной вакциной и содержит, как правило, антигены трёх штаммов вируса гриппа, которые отбираются на основе рекомендаций Всемирной организации здравоохранения. Предложена вакцина для профилактики гриппа в форме живой, убитой (инактивированной), субъединичной вакцины. Вакцинация особенно показана в группах риска — дети, пожилые люди, больные с хроническими заболеваниями сердца и лёгких, а также медицинские работники. Обычно осуществляется, когда эпидемиологический прогноз свидетельствует о целесообразности массовых мероприятий (обычно в середине осени). Возможна и вторая прививка в середине зимы.
Предложена вакцина для профилактики гриппа в форме живой, убитой (инактивированной), субъединичной вакцины. Вакцинация особенно показана в группах риска — дети, пожилые люди, больные с хроническими заболеваниями сердца и лёгких, а также медицинские работники. Обычно осуществляется, когда эпидемиологический прогноз свидетельствует о целесообразности массовых мероприятий (обычно в середине осени). Возможна и вторая прививка в середине зимы.
Профилактика ОРВИ и гриппа ⁄ Тегульдетская районная больница
Медицинская маска помогает защититься от гриппа. Главное соблюдать правила использования маски
Ежегодно в осенне-зимний период активизируется циркуляция вирусов гриппа и других респираторных вирусов, которые быстро передаются от человека к человеку воздушно-капельным путем, вызывая массовую заболеваемость населения вплоть до ее эпидемического уровня. Грипп и ОРВИ относятся к числу наиболее массовых инфекционных заболеваний, на их долю ежегодно приходится до 90-95% в структуре регистрируемой инфекционной заболеваемости.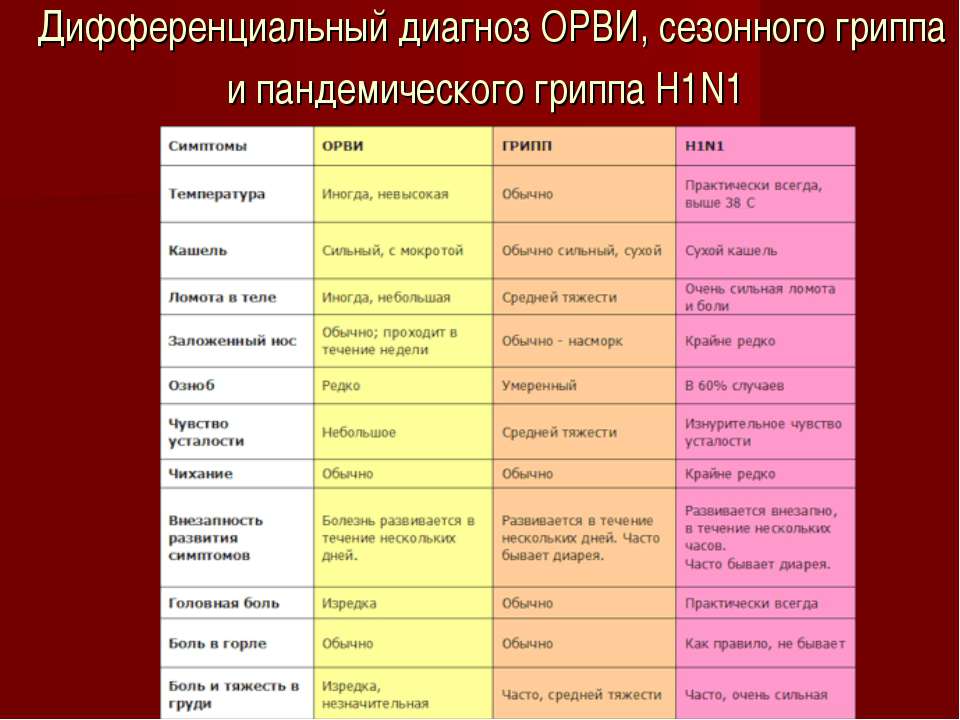 По данным статистических наблюдений каждый взрослый человек в среднем в год болеет в 2 раза респираторными инфекциями, школьник – 3 раза, ребенок дошкольного возраста – 6 раз.
По данным статистических наблюдений каждый взрослый человек в среднем в год болеет в 2 раза респираторными инфекциями, школьник – 3 раза, ребенок дошкольного возраста – 6 раз.
Что нужно знать о гриппе и ОРВИ: грипп и ОРВИ – это неравноценные понятия.
Грипп – это острое инфекционное заболевание, вызываемое вирусами типов А, В и С, которое, как правило отличается самыми выраженными симптомами и склонно к тяжёлому течению и развитию осложнений. Первым из этих симптомов является высокая температура тела, резкая слабость, головная боль. Как правило, на третий день присоединяются кашель и насморк. Заболевание склонно к быстрому и глобальному распространению, наиболее опасным осложнением гриппа является пневмония, которая может стать причиной неблагоприятного исхода заболевания. Особенно опасен грипп для лиц, страдающих хроническими заболеваниями сердечно-сосудистой, дыхательной систем, сахарным диабетом, ожирением и для беременных женщин. Заболевание гриппом у таких людей может привести к тяжелым осложнениям.
Заболевание гриппом у таких людей может привести к тяжелым осложнениям.
Грипп и другие острые респираторные вирусные инфекции (ОРВИ) являются наиболее распространенными инфекционными заболеваниями среди всех возрастных групп населения планеты.
Часто грипп и респираторные заболевания, вызванные другими возбудителями, начинаются похожими симптомами – температура, слабость, насморк, кашель. Однако, грипп гораздо чаще, чем другие ОРВИ, протекает в более тяжелой форме и вызывает осложнения – бронхит, пневмонию, отит, синуситы и т.д.
Особенно грипп опасен для лиц пожилого возраста, у которых с возрастом иммунитет ослабевает, а наличие хронических заболеваний увеличивает риск возникновения серьезных осложнений и обострений имеющихся заболеваний.
Для детей раннего возраста любой вирус гриппа – новый, поэтому они болеют особенно тяжело, для их полного излечения может потребоваться длительное время.
Наиболее эффективным методом профилактики гриппа является вакцинопрофилактика. Ежегодно перед началом сезонного подъема заболеваемости гриппом и ОРВИ проводится иммунизации против гриппа лиц, относящихся к группам риска. В рамках Национального календаря профилактических прививок в Чувашии в эпидемиологическом сезоне 2016-2017 годов планируется охватить прививками более 520 тыс. человек, из них 170 тыс. детей. Ожидается, что защиту от гриппа получат около 42% всего населения республики.
Противогриппозные вакцины безопасны и обладают высокой эффективностью с точки зрения профилактики гриппа и развития осложнений. Вакцинация снижает частоту заболеваемости гриппом в среднем в 2 раза, у привитых в случае их заболевания оно протекает легче и не приводит к развитию осложнений. Перед проведением прививки каждого прививаемого осматривает медицинский работник.
В период сезонного подъема заболеваемости гриппом и ОРВИ необходимо употреблять в пищу больше овощей и фруктов, богатых витамином С, чаще проводить влажные уборки и проветривание помещений, больше времени проводить на свежем воздухе, сократить число посещений мест большого скопления людей, пользоваться средствами индивидуальной защиты, соблюдать правила личной гигиены.
При появлении симптомов гриппа необходимо немедленно обратиться за медицинской помощью. Рекомендуется соблюдать домашний режим. При чихании и кашле следует прикрывать нос и рот одноразовым носовым платком, выбрасывать носовые платки сразу после использования.
Острые вирусные респираторные инфекции вызываются целой группой респираторных вирусов, чаще это аденовирусы, вирусы парагриппа, респираторно-синцитиальный вирус (РС-вирус), коронавирус, риновирус. Общим для этих вирусов является поражение верхних дыхательных путей человека, сопровождающееся насморком, болями в горле, явлениями интоксикации, но есть и особенности клинической картины, которые может отличить врач. ОРВИ протекают легче гриппа с менее выраженной интоксикацией организма, реже развиваются тяжелые осложнения.
Поэтому профилактика гриппа и ОРВИ, позволяющая избежать или смягчить такие последствия, более чем актуальна.
Какие существуют способы профилактики гриппа и ОРВИ?
Специфическая профилактика: В настоящее время одним из эффективных способов профилактики гриппа является вакцинация.
В борьбе с инфекционными заболеваниями все большее значение приобретают методы специфической профилактики. Защита от инфекции при помощи иммунизации известна уже многие сотни лет. Так, с древних времен китайцы с этой целью втягивали в нос высушенные и измельченные корочки оспенных больных. Однако такой метод, названный вариоляцией, был небезопасным мероприятием, чреватым большим риском для жизни и здоровья. В 18 веке ЭдвардДженнер был первым врачом, который проводил вакцинацию людей коровьей оспой, чтобы защитить их от натуральной. В 1777 году он основал в Лондоне первый вмире оспопрививальный пункт. Это было рождением научного подхода к применению активной иммунизации. Через 100 лет Луи Пастер произвел первую успешную вакцинацию человека против бешенства. В настоящее время вакцинация является одним из ведущих методов профилактики инфекционных заболеваний.
Цель вакцинации — создание специфической невосприимчивости к инфекционному заболеванию путем имитации естественного инфекционного процесса с благоприятным исходом. Активный поствакцинальный иммунитет сохраняется в течение 5—10 лет у привитых против кори, дифтерии, столбняка, полиомиелита, или в течение нескольких месяцев у привитых против гриппа, брюшного тифа. Однако при своевременной ревакцинации он может сохраняться всю жизнь.
Активный поствакцинальный иммунитет сохраняется в течение 5—10 лет у привитых против кори, дифтерии, столбняка, полиомиелита, или в течение нескольких месяцев у привитых против гриппа, брюшного тифа. Однако при своевременной ревакцинации он может сохраняться всю жизнь.
Иммунизация против гриппа проводится перед началом эпидемического сезона, оптимальные сроки сентябрь-ноябрь для того чтобы к началу эпидемического распространения инфекции у человека сформировался иммунный ответ на введенный препарат. После вакцинации антитела в организме привитого человека появляются через 12-15 дней, иммунитет сохраняется в течение года. Вакцины против гриппа производятся на каждый сезон, в их состав входят актуальный штаммы вирусов гриппа (не менее 3-х), циркуляция которых прогнозируется ежегодно Всемирной Организацией здравоохранения.
Современные вакцины против гриппа помимо формирования специфического иммунитета к определенным вирусам гриппа, повышают общую резистентность организма к другим респираторным вирусам. Так, отечественные инактивированные вакцины содержат в своем составе иммуномодулятор полиоксидоний, который еще до выработки специфического иммунитета способствует повышению защитных сил организма при встрече с респираторными вирусами. Прививка против гриппа вакцинами отечественного или зарубежного производства не дает 100% защиты от заболевания. По данным статистических наблюдений защитные титры антител к вирусу гриппа после вакцинации лиц разного возраста определятся у 75-92% вакцинированных. Поэтому некоторые привитые люди заболевают гриппом, однако, как правило, заболевание у привитых протекает в более легкой форме, без серьезных осложнений. Прививка против гриппа не исключает и заболевание другими респираторными вирусами, которых насчитывается более 200 видов, однако, в отличие от гриппа, клиника респираторных вирусных инфекций не тяжела, нет выраженной интоксикации организма, заболевание ограничивается поражением верхних дыхательных путей (насморк, боли в горле), иногда без температурной реакции со стороны организма.
Так, отечественные инактивированные вакцины содержат в своем составе иммуномодулятор полиоксидоний, который еще до выработки специфического иммунитета способствует повышению защитных сил организма при встрече с респираторными вирусами. Прививка против гриппа вакцинами отечественного или зарубежного производства не дает 100% защиты от заболевания. По данным статистических наблюдений защитные титры антител к вирусу гриппа после вакцинации лиц разного возраста определятся у 75-92% вакцинированных. Поэтому некоторые привитые люди заболевают гриппом, однако, как правило, заболевание у привитых протекает в более легкой форме, без серьезных осложнений. Прививка против гриппа не исключает и заболевание другими респираторными вирусами, которых насчитывается более 200 видов, однако, в отличие от гриппа, клиника респираторных вирусных инфекций не тяжела, нет выраженной интоксикации организма, заболевание ограничивается поражением верхних дыхательных путей (насморк, боли в горле), иногда без температурной реакции со стороны организма.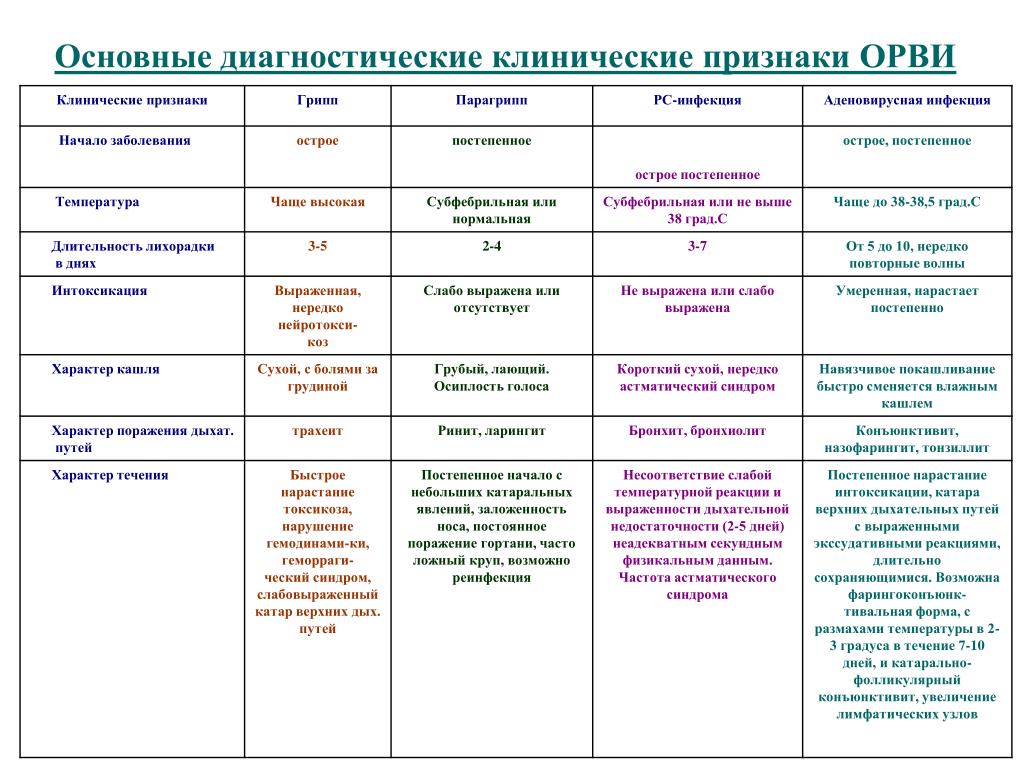
Неспецифическая профилактика – это методы профилактики, направленные на повышение защитных (реактивных) сил организма для противодействия проникающим в организм человека респираторным вирусам. Неспецифическая профилактика проводится как в предэпидемический период, так и непосредственно в период эпидемического подъема заболеваемости.
· Соблюдение личной гигиены играет немаловажную роль в предупреждении заболевания респираторными вирусными инфекциями. Важно – чаще мыть руки. Рукопожатие, поручни в общественном транспорте, ручки дверей в организациях, общественных зданиях и т.д. – все это источники повышенного риска в передаче вируса гриппа, после любого контакта с вышеуказанными местами общего пользования необходимо мыть руки. Необходимо избегать контакта немытых рук с лицом.
· Необходимо чаще проветривать помещения, проводить влажную уборку помещений с использованием дезинфицирующих средств. В организациях и учреждениях целесообразно использовать оборудование, снижающее циркуляцию в воздухе вирусных и бактериальных клеток (рециркуляторы, бактерицидные облучатели и др. )
)
· В период эпидемического распространения заболеваемости необходимо постараться не посещать массовые мероприятия, особенного в закрытых помещениях, места массового скопления населения.
· Использовать для защиты органов дыхания одноразовые медицинские маски (использование одной маски не должно превышать 6 часов, повторное использование маски недопустимо), чаще бывать на свежем воздухе.
· Если заболели вы или ваши близкие (появились насморк, першение в горле, поднялась температура, общее недомогание, головная боль и т.д.) не следует посещать работу, учебное заведение, направлять ребенка в детский организованный коллектив, необходимо вызвать врача на дом.
· В случае тяжелого течения заболевания не отказываться от предложенной госпитализации, своевременно начатое лечение в стационаре позволит избежать возникновения неблагоприятных последствий заболевания.
· При чихании, кашле, насморке используйте одноразовые бумажные салфетки-платки.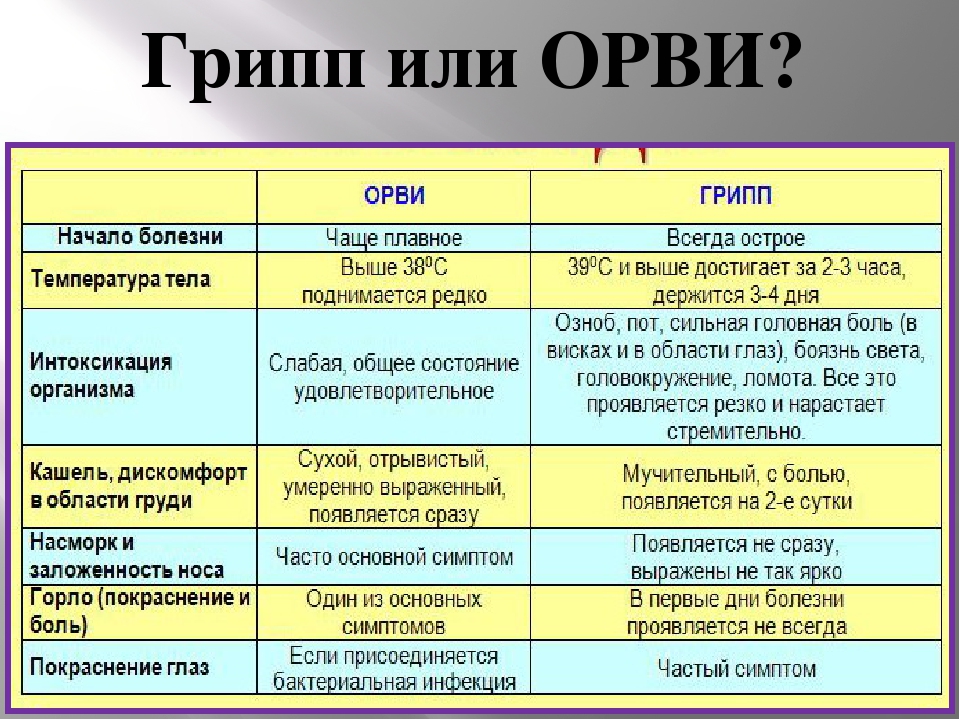 После использования их необходимо сразу выбросить, категорически нельзя их использовать повторно.
После использования их необходимо сразу выбросить, категорически нельзя их использовать повторно.
· Для больного необходимо выделить отдельную посуду, после использование тщательно ее мыть и дезинфицировать.
· Желательно изолировать больного в отдельную комнату, ограничить контакты здоровых членов семьи и проводить среди них неспецифическую профилактику. Чаще проветривать жилые помещения, проводить влажную уборку.
Именно эти простые меры, а отнюдь не рекламируемые дорогостоящие лекарственные средства с недоказанной эффективностью помогут Вам пережить опасный сезон.
Не стоит забывать о тепловом режиме: важно одеваться по погоде, не допускать переохлаждение организма, соблюдать температурный режим в жилых и общественных зданиях.
Важно – рациональное питание, также влияющее на сопротивляемость организма: употребление продуктов питания содержащих полноценные белки, витамины группы С (цитрусовые, квашеная капуста, отвар шиповника и др. ).
).
Забота о своем здоровье и здоровье своих близких, выполнение рекомендаций по профилактике заболевания гриппом и респираторными вирусными инфекциями позволит сохранить здоровье, улучшить качество жизни, а также сэкономить семейный бюджет.
Памятка для населения по профилактике гриппа, коронавирусной инфекции и других ОРВИ
ссылка: Памятка: Профилактика гриппа и коронавирусной инфекции
ссылка: Памятка: ИСПОЛЬЗОВАНИЕ ОДНОРАЗОВОЙ МАСКИ СНИЖАЕТ ВЕРОЯТНОСТЬ ЗАРАЖЕНИЯ ГРИППОМ, КОРОНАВИРУСОМ И ДРУГИМИ ОРВИ
Грипп, коронавирусная инфекция и другие острые респираторные вирусные инфекции (ОРВИ)
Грипп, коронавирусная инфекция и другие острые респираторные вирусные инфекции (ОРВИ) находятся на первом месте по числу ежегодно заболевающих людей.
Несмотря на постоянные усилия, направленные на борьбу с возбудителями гриппа, коронавирусной инфекции и других ОРВИ победить их до сих пор не удается..gif)
Ежегодно от осложнений гриппа погибают тысячи человек.
Это связано с тем, что вирусы, прежде всего вирусы гриппа и коронавирусы обладают способностью менять свою структуру и мутировавший вирус, способен поражать человека вновь. Так, переболевший гриппом человек имеет хороший иммунный барьер, но тем не менее новый измененный вирус, способен легко проникать через него, так как иммунитета против этого вида вируса организм пока не выработал.
Для кого наиболее опасна встреча с вирусом?
Особо тяжело переносят инфекцию дети и пожилые люди, для этих возрастных групп очень опасны осложнения, которые могут развиться во время заболевания. Дети болеют более тяжело в связи с тем, что их иммунная система еще не встречалась с данным вирусом, а для пожилых людей, также, как и для людей с хроническими заболеваниями, вирус опасен по причине ослабленной иммунной системы.
Группы риска
· Дети
· Люди старше 60 лет
· Люди с хроническими заболеваниями легких (бронхиальная астма, хроническая обструктивная болезнь легких)
· Люди с хроническими заболеваниями сердечно-сосудистой системы (врожденные пороки сердца, ишемическая болезнь сердца, сердечная недостаточность)
· Беременные женщины
· Медицинские работники
· Работники общественного транспорта, предприятий общественного питания
Каким образом происходит заражение?
Инфекция передается от больного человека здоровому через мельчайшие капельки слюны или слизи, которые выделяются во время чихания, кашля разговора. Возможна и контактная передача.
Возможна и контактная передача.
Симптомы
В зависимости от конкретного вида возбудителя симптомы могут значительно различаться, как по степени выраженности, так и по вариантам сочетания.
· Повышение температуры
· Озноб, общее недомогание, слабость головная боль, боли в мышцах
· Снижение аппетита, возможны тошнота и рвота
· Конъюнктивит (возможно)
· Понос (возможно)
В среднем, болезнь длится около 5 дней. Если температура держится дольше, возможно, возникли осложнения.
Осложнения
· Пневмония
· Энцефалит, менингит
· Осложнения беременности, развитие патологии плода
· Обострение хронических заболеваний
Лечение заболевания проводится под контролем врача, который только после осмотра пациента назначает схему лечения и дает другие рекомендации. Заболевший должен соблюдать постельный режим, полноценно питаться и пить больше жидкости.
Антибиотики
Принимать антибиотики в первые дни заболевания — большая ошибка. Антибиотики не способны справиться с вирусом, кроме того, они неблагоприятно влияют на нормальную микрофлору. Антибиотики назначает только врач, только в случае развития осложнений, вызванных присоединением бактериальной инфекции. Принимать антибактериальные препараты в качестве профилактики развития осложнений- опасно и бесполезно.
Заболевший человек должен оставаться дома и не создавать угрозу заражения окружающих.
Профилактика
Самым эффективным способом профилактики гриппа является ежегодная вакцинация. Состав вакцины против гриппа меняется ежегодно. Прежде всего, вакцинироваться рекомендуется тем, кто входит в группу риска. Оптимальное время для вакцинации октябрь-ноябрь. Вакцинация детей против гриппа возможна, начиная с 6-месячного возраста.
Вакцины против большинства возбудителей острых респираторных вирусных инфекций не разработаны.
Универсальные меры профилактики
· Часто и тщательно мойте руки
· Избегайте контактов с кашляющими людьми
· Придерживайтесь здорового образа жизни (сон, здоровая пища, физическая активность)
· Пейте больше жидкости
· Регулярно проветривайте и увлажняйте воздух в помещении, в котором находитесь
· Реже бывайте в людных местах
· Используйте маску, когда находитесь в транспорте или в людных местах
· Избегайте объятий, поцелуев и рукопожатий при встречах
· Не трогайте лицо, глаза, нос немытыми руками
При первых признаках вирусной инфекции – обратитесь к врачу!
Гигиена при гриппе, коронавирусной инфекции и других ОРВИ
Что нужно делать в период активной циркуляции возбудителей гриппа, коронавирусной инфекции и других возбудителей острых респираторных вирусных инфекций (ОРВИ) для того, чтобы предотвратить собственное заражение и обезопасить окружающих, если заболели вы?
Возбудители всех этих заболеваний высоко заразны и передаются преимущественно воздушно-капельным путем.
При чихании и кашле в воздухе вокруг больного человека распространяются микрокапли его слюны, мокроты и респираторных выделений, которые содержат вирусы. Более крупные капли оседают на окружающих предметах, и поверхностях, мелкие -долго находятся в воздухе и переносятся на расстояния до нескольких сот метров, при этом вирусы сохраняют способность к заражению от нескольких часов до нескольких дней. Основные меры гигиенической профилактики направлены на предотвращение контакта здоровых людей с содержащими вирусы частицами выделений больного человека.
Соблюдение следующих гигиенических правил позволит существенно снизить риск заражения или дальнейшего распространения гриппа, коронавирусной инфекции и других ОРВИ.
Как не заразиться
· Мыть руки после посещения любых общественных мест, транспорта, прикосновений к дверным ручкам, деньгам, оргтехнике общественного пользования на рабочем месте, перед едой и приготовлением пищи. Уделите особое внимание тщательному намыливанию (не менее 20 секунд), и последующему полному осушению рук.
Уделите особое внимание тщательному намыливанию (не менее 20 секунд), и последующему полному осушению рук.
· После возвращения с улицы домой — вымыть руки и лицо с мылом, промыть нос изотоническим раствором соли.
· Прикасаться к лицу, глазам-только недавно вымытыми руками. При отсутствии доступа к воде и мылу, для очистки рук использовать дезинфицирующие средства на спиртовой основе. Или воспользоваться одноразовой салфеткой, при необходимости прикосновения к глазам или носу
· Надевать одноразовую медицинскую маску в людных местах и транспорте. Менять маску на новую надо каждые 2-3 часа, повторно использовать маску нельзя.
· Отдавать предпочтение гладким прическам, когда вы находитесь в местах скопления людей, распущенные волосы, часто контактируя с лицом, увеличивают риск инфицирования.
· Избегать близких контактов и пребывания в одном помещении с людьми, имеющими видимые признаки ОРВИ (кашель, чихание, выделения из носа).
· Не прикасаться голыми руками к дверным ручкам, перилам, другим предметам и поверхностям в общественных пространствах.
· Ограничить приветственные рукопожатия, поцелуи и объятия.
· Чаще проветривать помещения.
· Не пользоваться общими полотенцами.
Как не заразить окружающих
· Минимизировать контакты со здоровыми людьми (приветственные рукопожатия, поцелуи).
· Если вы испытываете недомогание, но вынуждены общаться с другими людьми или пользоваться общественным транспортом — использовать одноразовую маску, обязательно меняя ее на новую каждый час.
· При кашле или чихании обязательно прикрывать рот, по возможности — одноразовым платком, если его нет — ладонями или локтевым сгибом.
· Пользоваться только личной или одноразовой посудой.
· Изолировать от домочадцев свои предметы личной гигиены: зубную щетку, мочалку, полотенца.
· Проводить влажную уборку дома ежедневно, включая обработку дверных ручек, выключателей, панелей управления оргтехникой.
Грипп, коронавирус, другие ОРВИ — поможет маска!
В период активной циркуляции возбудителей гриппа, коронавирусной инфекции, и других возбудителей острых респираторных вирусных инфекций напоминаем о целесообразности использования одноразовой медицинской маски в качестве эффективной меры профилактики заражения и ограничения распространения инфекции.
Эти вирусы передаются от человека к человеку преимущественно воздушно-капельным путём, через микрокапли респираторных выделений, которые образуются, когда инфицированные люди говорят, чихают или кашляют.
С воздухом эти капли могут попасть на поверхность слизистой оболочки верхних дыхательных путей здоровых людей, которые находятся рядом с заражённым человеком.
Заражение может происходить и в результате непосредственного или косвенного контакта здорового человека с респираторными выделениями инфицированного.
Использование одноразовой медицинской маски предотвращает попадание в организм здорового человека капель респираторных выделений, которые могут содержать вирусы, через нос и рот.
· Надевайте маску, когда ухаживаете за членом семьи с симптомами вирусного респираторного заболевания.
· Если вы больны, или у вас симптомы вирусного респираторного заболевания, наденьте маску перед тем, как приближаться к другим людям.
· Если у вас симптомы вирусного респираторного заболевания и вам необходимо обратиться к врачу, заблаговременно наденьте маску, чтобы защитить окружающих в зоне ожидания.
· Носите маску, когда находитесь в людных местах.
· Используйте маску однократно, повторное использование маски недопустимо.
· Меняйте маску каждые 2-3 часа или чаще.
· Если маска увлажнилась, её следует заменить на новую.
· После использования маски, выбросьте её и вымойте руки.
Одноразовая медицинская маска, при правильном использовании – надёжный и эффективный метод снижения риска заражения и предотвращения распространения гриппа, коронавируса и других возбудителей ОРВИ.
ГБПОУ АО «АФПК». Коронавирус, Профилактика гриппа
Каждый год в Россию приходит тот или иной тип вируса гриппа. Этой зимой вирусологи прогнозируют приход гриппа типа А(h2N1) 2009. В чем особенность этого вируса и как защитить себя от него, читайте далее.
Вирус гриппа A (h2N1) легко передается от человека к человеку и вызывает респираторные заболевания разной тяжести. Симптомы заболевания аналогичны симптомам обычного (сезонного) гриппа. Тяжесть заболевания зависит от целого ряда факторов, в том числе от общего состояния организма и возраста. Предрасположены к заболеванию: пожилые люди, маленькие дети, беременные женщины и люди, страдающие хроническими заболеваниями (астмой, диабетом, сердечно-сосудистыми заболеваниями), и с ослабленным иммунитетом. Как защититься от гриппа?
Как защититься от гриппа?
ПРАВИЛО 1. МОЙТЕ РУКИ
Гигиена рук — это важная мера профилактики распространения гриппа. Мыло удаляет и уничтожает микробы. Если нет возможности помыть руки с мылом, пользуйтесь спиртсодержащими или дезинфицирующими салфетками. Чистка и регулярная дезинфекция поверхностей (столов, дверных ручек, стульев и др.) удаляет и уничтожает вирус.
ПРАВИЛО 2. СОБЛЮДАЙТЕ РАССТОЯНИЕ И ЭТИКЕТ
Избегайте близкого контакта с больными людьми. Вирус легко передается от больного человека к здоровому воздушно-капельным путем (при чихании, кашле), поэтому необходимо соблюдать расстояние не менее 1 метра от больных.
Избегайте многолюдных мест. Надевайте маску или используйте другие подручные средства защиты, чтобы уменьшить риск заболевания. Не трогайте руками глаза, нос или рот: этими путями вирус легко проникает в организм.
При кашле, чихании следует прикрывать рот и нос одноразовыми салфетками, которые после использования нужно выбрасывать.
ПРАВИЛО 3. ВЕДИТЕ ЗДОРОВЫЙ ОБРАЗ ЖИЗНИ
Поддерживайте свой организм в хорошей форме, занимаясь физкультурой, соблюдая режим, высыпаясь, полноценно питаясь. В этот период особенно необходимы продукты, богатые белками, витаминами и минеральными веществами.
КАКОВЫ СИМПТОМЫ ГРИППА А (h2N1)2009?
Самые распространённые симптомы гриппа А (Н1N1)2009:
- высокая температура тела (97%),
- кашель (94%),
- насморк (59%),
- боль в горле (50%),
- головная боль (47%),
- учащенное дыхание (41%),
- боли в мышцах (35%),
- конъюнктивит (9%).
В некоторых случаях наблюдаются симптомы желудочно-кишечных расстройств (которые не характерны для сезонного гриппа): тошнота, рвота (18%), диарея (12%).
Осложнения гриппа А(Н1N1)2009:
Характерная особенность — раннее появление осложнений. Если при сезонном гриппе осложнения возникают, как правило, на 5-7 день и позже, то при гриппе А(Н1N1)2009 уже на 2-3-й день болезни.
Если при сезонном гриппе осложнения возникают, как правило, на 5-7 день и позже, то при гриппе А(Н1N1)2009 уже на 2-3-й день болезни.
Среди осложнений лидирует вирусная пневмония. Ухудшение состояния при вирусной пневмонии идёт быстрыми темпами, и у многих пациентов уже в течение 24 часов развивается дыхательная недостаточность, требующая немедленной респираторной поддержки с механической вентиляцией лёгких. Быстро начатое лечение способствует облегчению степени тяжести болезни.
ЧТО ДЕЛАТЬ, ЕСЛИ ЗАБОЛЕЛ?
Оставайтесь дома и срочно обращайтесь к врачу. Следуйте предписаниям врача, соблюдайте постельный режим и пейте как можно больше жидкости. Прикрывайте рот и нос платком, когда чихаете или кашляете. Как можно чаще мойте руки с мылом.
ЧТО ДЕЛАТЬ, ЕСЛИ В СЕМЬЕ КТО-ТО ЗАБОЛЕЛ ГРИППОМ?
Выделите больному отдельную комнату в доме. Если это невозможно, соблюдайте расстояние не менее 1 метра от больного.
Ограничьте до минимума контакт между больным и близкими, особенно детьми, пожилыми людьми и родственниками, страдающими хроническими заболеваниями.
Часто проветривайте помещение.
Сохраняйте чистоту, как можно чаще мойте и дезинфицируйте поверхности бытовыми моющими средствами.
Часто мойте руки с мылом.
Ухаживая за больным, прикрывайте рот и нос маской или другими защитными средствами (платком, шарфом и др.).
Ухаживать за больным должен только один член семьи.
(По материалам сайта http://29.rospotrebnadzor.ru/)
ГРИПП И ОРВИ: что делать, чтобы не заболеть?Что такое грипп?
Грипп — это тяжелая вирусная инфекция, которая поражает мужчин, женщин и детей всех возрастов и национальностей. Эпидемии гриппа случаются каждый год обычно в холодное время года. По количеству случаев в мире грипп и ОРВИ занимают первое место, удельный вес в структуре инфекционных заболеваний достигает 95%.
Грипп и ОРВИ, постепенно подрывая здоровье, сокращают на несколько лет среднюю продолжительность жизни человека. При тяжелом течении гриппа часто возникают необратимые поражения сердечно-сосудистой системы, дыхательных органов, центральной нервной системы, провоцирующие заболевания сердца и сосудов, пневмонии, трахеобронхиты, менингоэнцефалиты. Распространенными осложнениями после гриппа являются риниты, синуситы, бронхиты, отиты, обострение хронических заболеваний, бактериальная суперинфекция. В ослабленный гриппом организм часто внедряется бактериальная инфекция (пневмококковая, гемофильная, стафилококковая). Наибольшие жертвы грипп собирает среди пожилых групп населения, страдающих хроническими болезнями. Смерть при гриппе может наступить от интоксикации, кровоизлияний в головной мозг, легочных осложнений (пневмония), сердечной или сердечно-легочной недостаточности.
Распространенными осложнениями после гриппа являются риниты, синуситы, бронхиты, отиты, обострение хронических заболеваний, бактериальная суперинфекция. В ослабленный гриппом организм часто внедряется бактериальная инфекция (пневмококковая, гемофильная, стафилококковая). Наибольшие жертвы грипп собирает среди пожилых групп населения, страдающих хроническими болезнями. Смерть при гриппе может наступить от интоксикации, кровоизлияний в головной мозг, легочных осложнений (пневмония), сердечной или сердечно-легочной недостаточности.
Термин «острое респираторное заболевание» (ОРЗ) или «острая респираторная вирусная инфекция» (ОРВИ) охватывает большое количество заболеваний, во многом похожих друг на друга. Основное их сходство состоит в том, что все они вызываются вирусами, проникающими в организм вместе с вдыхаемым воздухом через рот и носоглотку, а также в том, что все они характеризуются одним и тем же набором симптомов. У больного несколько дней отмечается повышенная температура тела, воспаление в горле, кашель и головная боль. Самым распространенным симптомом респираторных заболеваний является насморк; он вызывается целым рядом родственных вирусов, известных как риновирусы. При выздоровлении все эти симптомы исчезают и не оставляют после себя никаких следов.
У больного несколько дней отмечается повышенная температура тела, воспаление в горле, кашель и головная боль. Самым распространенным симптомом респираторных заболеваний является насморк; он вызывается целым рядом родственных вирусов, известных как риновирусы. При выздоровлении все эти симптомы исчезают и не оставляют после себя никаких следов.
Вирус гриппа очень легко передается. Самый распространенный путь передачи инфекции — воздушно-капельный. Также возможен и бытовой путь передачи, например через предметы обихода. При кашле, чихании, разговоре из носоглотки больного или вирусоносителя выбрасываются частицы слюны, слизи, мокроты с болезнетворной микрофлорой, в том числе с вирусами гриппа. Вокруг больного образуется зараженная зона с максимальной концентрацией аэрозольных частиц. Дальность их рассеивания обычно не превышает 2 — 3 м.
Симптомы гриппа
Обычно грипп начинается остро. Инкубационный (скрытый) период, как правило, длится 2 — 5 дней.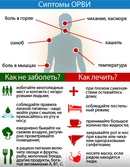 Затем начинается период острых клинических проявлений. Тяжесть болезни зависит от общего состояния здоровья, возраста, от того, контактировал ли больной с данным типом вируса ранее. В зависимости от этого у больного может развиться одна из четырех форм гриппа: легкая, среднетяжелая, тяжелая, гипертоксическая.
Затем начинается период острых клинических проявлений. Тяжесть болезни зависит от общего состояния здоровья, возраста, от того, контактировал ли больной с данным типом вируса ранее. В зависимости от этого у больного может развиться одна из четырех форм гриппа: легкая, среднетяжелая, тяжелая, гипертоксическая.
Способы профилактики:
1. Личная гигиена.
Иначе говоря, множество заболеваний связано с немытыми руками. Источник, как и прежде, больной человек. Избегать в этот период необходимо рукопожатий. После соприкосновений с ручками дверей, туалета, поручнями в общественных местах, обработать руки антисептиком или тщательно их вымыть. Не трогайте грязными, немытыми руками нос, глаза, рот.
2. Промываем нос.
Даже если вы не умеете этого делать, пришла пора учиться. Сейчас многие доктора советуют увлажнять или промывать в период эпидемий нос. Это можно сделать при помощи солевого раствора (на литр воды 1 ч. ложка соли) или специальными соляными спреями, коих в аптеках множество.
ложка соли) или специальными соляными спреями, коих в аптеках множество.
3. Одеваем маски.
Причем одевать как раз стоит ее на больного человека, чтобы исключить попадание в пространство крупных частиц слюны при кашле и чихании, мелкие же частицы она не задерживает.
4. Тщательная уборка помещений.
Вирус любит теплые и пыльные помещения, поэтому стоит уделить время влажной уборке и проветриванию.
5. Избегайте массовых скоплений людей.
В этот период лучше воздержаться от походов в театры, цирки, кафе и прочие места, где могут оказаться инфицированные люди и где шанс подцепить вирус высок.
6. Другие методы
К ним можно отнести сбалансированное питание и здоровый образ жизни, занятие физкультурой, прогулки.
Вакцинация – наше всё!
Всемирная организация здравоохранения считает вакцинацию единственной социально и экономически оправданной мерой борьбы с гриппом. Вакцинация на 90 % снижает заболеваемость, на 60 % снижает госпитализацию.
Вакцинация на 90 % снижает заболеваемость, на 60 % снижает госпитализацию.
Основным методом специфической профилактики против гриппа является активная иммунизация — вакцинация, когда в организм вводят частицу инфекционного агента. Вирусы (его части), содержащиеся в вакцине, стимулируют организм к выработке антител (они начинают вырабатываться в среднем через две недели), которые предотвращают размножение вирусов и инфицирование организма.
Вакцинацию лучше проводить осенью, поскольку эпидемии гриппа, как правило, бывают между ноябрем и мартом.
По материалам пресс-службы Управления Роспотребнадзора по Архангельской области
ГРИПП: меры профилактикиСделайте прививку против гриппа до начала эпидемического сезона.
Сократите время пребывания в местах массовых скоплений людей и общественном транспорте. Пользуйтесь маской в местах скопления людей.
Избегайте тесных контактов с людьми, которые имеют признаки заболевания, например: чихают или кашляют.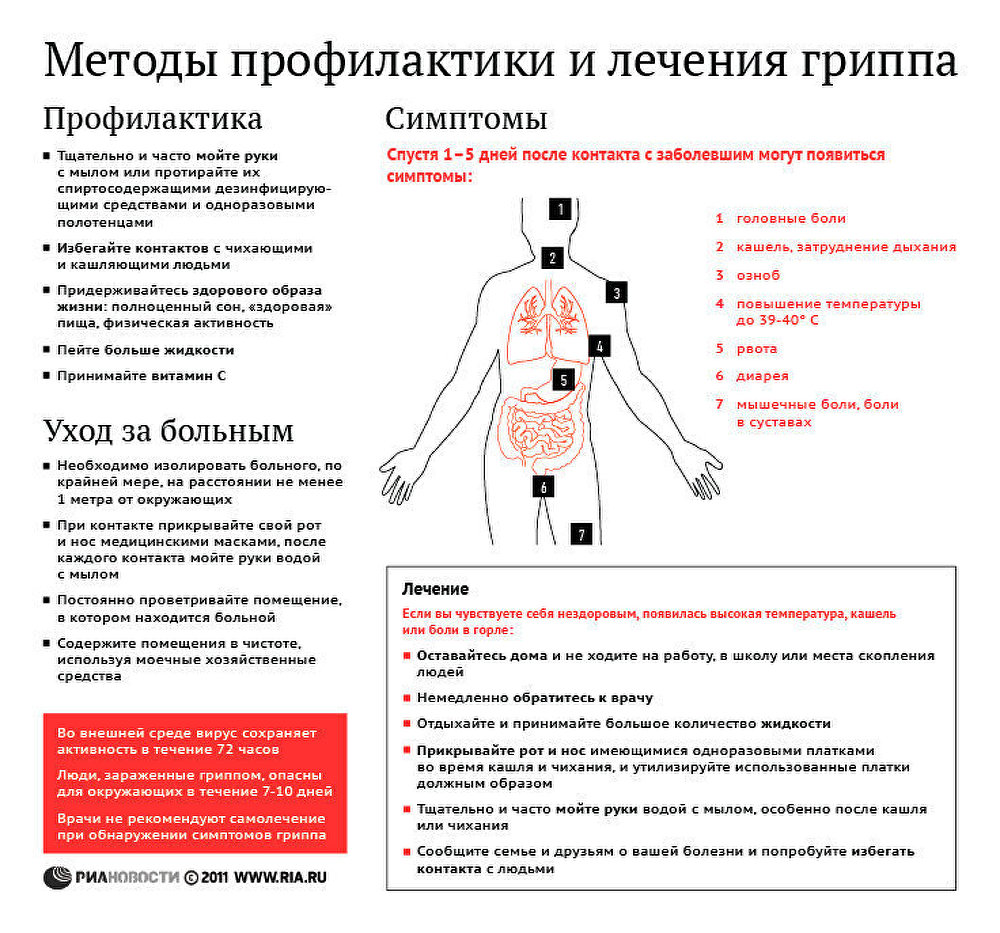 Находитесь от них на расстоянии не менее 1 метра.
Находитесь от них на расстоянии не менее 1 метра.
Регулярно тщательно мойте руки с мылом, особенно после улицы и общественного транспорта.
Промывайте полость носа, особенно после улицы и общественного транспорта.
Регулярно проветривайте помещение и делайте влажную уборку.
Увлажняйте воздух в помещении, где находитесь.
Ешьте больше продуктов, содержащих витамин С (клюква, брусника, лимон и др.).
Ешьте больше блюд с добавлением чеснока и лука
Ведите здоровый образ жизни, высыпайтесь, сбалансированно питайтесь и регулярно занимайтесь физкультурой.
Не занимайтесь самолечением.
При первых проявлениях заболевания (подъем температуры, общее недомогание, головная боль, кашель) нельзя посещать работу, учебное заведение, направлять ребенка в детский сад. Необходимо вызвать врача на дом.
Острые респираторные инфекции у детей — приоритеты борьбы с заболеваниями в развивающихся странах
Острые респираторные инфекции (ОРИ) классифицируются как инфекции верхних дыхательных путей (URI) или инфекции нижних дыхательных путей (LRIs). Верхние дыхательные пути состоят из дыхательных путей от ноздрей до голосовых связок в гортани, включая придаточные пазухи носа и среднее ухо. Нижние дыхательные пути покрывают продолжение дыхательных путей от трахеи и бронхов к бронхиолам и альвеолам.ОРИ не ограничиваются дыхательными путями и имеют системные эффекты из-за возможного распространения инфекции или микробных токсинов, воспаления и снижения функции легких. Дифтерия, коклюш (коклюш) и корь — это болезни, которые можно предотвратить с помощью вакцин, которые могут иметь компонент дыхательных путей, но также влияют на другие системы; они обсуждаются в главе 20.
Верхние дыхательные пути состоят из дыхательных путей от ноздрей до голосовых связок в гортани, включая придаточные пазухи носа и среднее ухо. Нижние дыхательные пути покрывают продолжение дыхательных путей от трахеи и бронхов к бронхиолам и альвеолам.ОРИ не ограничиваются дыхательными путями и имеют системные эффекты из-за возможного распространения инфекции или микробных токсинов, воспаления и снижения функции легких. Дифтерия, коклюш (коклюш) и корь — это болезни, которые можно предотвратить с помощью вакцин, которые могут иметь компонент дыхательных путей, но также влияют на другие системы; они обсуждаются в главе 20.
За исключением периода новорожденности, ОРИ являются наиболее частой причиной как болезней, так и смертности детей в возрасте до пяти лет, у которых в среднем от трех до шести эпизодов ОРИ ежегодно, независимо от того, где они живут или каково их экономическое положение есть (Камат и другие, 1969; Монто и Ульман, 1974).Однако соотношение легкой и тяжелой формы заболевания варьируется между странами с высоким и низким уровнем доходов, и из-за различий в конкретной этиологии и факторах риска тяжесть ИПП у детей в возрасте до пяти лет хуже в развивающихся странах, что приводит к более высокому уровню заболеваемости.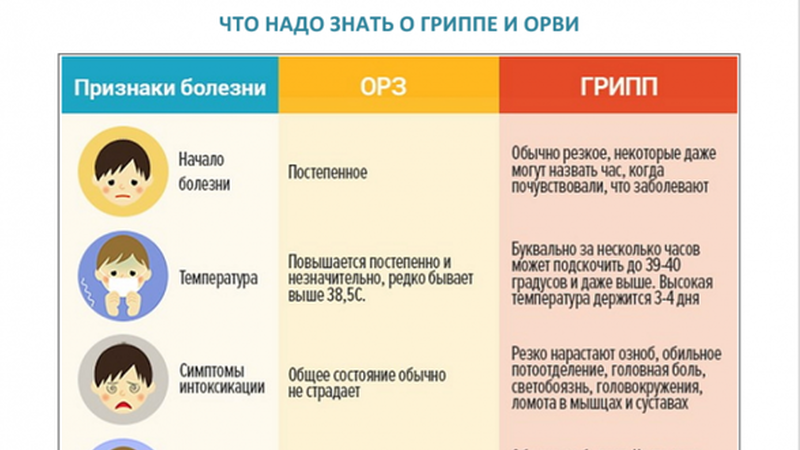 летальность. Хотя медицинская помощь может до некоторой степени снизить как тяжесть заболевания, так и летальный исход, многие тяжелые ИПП не поддаются лечению, в основном из-за отсутствия высокоэффективных противовирусных препаратов. Ежегодно умирает около 10,8 миллиона детей (Black, Morris, and Bryce, 2003).По оценкам, в 2000 году 1,9 миллиона из них умерли от ОРИ, 70 процентов из них — в Африке и Юго-Восточной Азии (Williams and others 2002). По оценкам Всемирной организации здравоохранения (ВОЗ), 2 миллиона детей в возрасте до пяти лет умирают от пневмонии ежегодно (Bryce and others 2005).
летальность. Хотя медицинская помощь может до некоторой степени снизить как тяжесть заболевания, так и летальный исход, многие тяжелые ИПП не поддаются лечению, в основном из-за отсутствия высокоэффективных противовирусных препаратов. Ежегодно умирает около 10,8 миллиона детей (Black, Morris, and Bryce, 2003).По оценкам, в 2000 году 1,9 миллиона из них умерли от ОРИ, 70 процентов из них — в Африке и Юго-Восточной Азии (Williams and others 2002). По оценкам Всемирной организации здравоохранения (ВОЗ), 2 миллиона детей в возрасте до пяти лет умирают от пневмонии ежегодно (Bryce and others 2005).
Причины ОРИ и бремя болезней
ОРИ у детей серьезно уносят жизни, особенно там, где медицинская помощь недоступна или к ней не обращаются.
Инфекции верхних дыхательных путей
URI являются наиболее распространенными инфекционными заболеваниями.К ним относятся ринит (простуда), синусит, инфекции уха, острый фарингит или тонзиллофарингит, эпиглоттит и ларингит, из которых инфекции уха и фарингит вызывают более серьезные осложнения (глухота и острая ревматическая лихорадка соответственно). Подавляющее большинство URI имеют вирусную этиологию. Риновирусы составляют от 25 до 30 процентов URI; респираторно-синцитиальные вирусы (РСВ), вирусы парагриппа и гриппа, метапневмовирус человека и аденовирусы — от 25 до 35 процентов; вирусы короны на 10 процентов; и неопознанные вирусы для остальных (Denny 1995).Поскольку большинство URI являются самоограничивающимися, их осложнения более важны, чем инфекции. Острые вирусные инфекции предрасполагают детей к бактериальным инфекциям носовых пазух и среднего уха (Berman 1995a), а аспирация инфицированных секретов и клеток может привести к LRIs.
Подавляющее большинство URI имеют вирусную этиологию. Риновирусы составляют от 25 до 30 процентов URI; респираторно-синцитиальные вирусы (РСВ), вирусы парагриппа и гриппа, метапневмовирус человека и аденовирусы — от 25 до 35 процентов; вирусы короны на 10 процентов; и неопознанные вирусы для остальных (Denny 1995).Поскольку большинство URI являются самоограничивающимися, их осложнения более важны, чем инфекции. Острые вирусные инфекции предрасполагают детей к бактериальным инфекциям носовых пазух и среднего уха (Berman 1995a), а аспирация инфицированных секретов и клеток может привести к LRIs.
Острый фарингит
Острый фарингит у детей младшего возраста более чем в 70% случаев вызывается вирусами. Типичны легкое покраснение глотки, отек и увеличение миндалин. Стрептококковая инфекция редко встречается у детей до пяти лет и более часто встречается у детей старшего возраста.В странах с многолюдными условиями жизни и группами населения, которые могут иметь генетическую предрасположенность, постстрептококковые последствия, такие как острый ревматизм и кардит, распространены у детей школьного возраста, но могут также возникать у детей младше пяти лет. Острый фарингит в сочетании с развитием перепонки в горле почти всегда вызывается в развивающихся странах Corynebacterium diphtheriae . Однако при почти повсеместной вакцинации младенцев вакциной АКДС (дифтерия-столбняк-коклюш) дифтерия встречается редко.
Острый фарингит в сочетании с развитием перепонки в горле почти всегда вызывается в развивающихся странах Corynebacterium diphtheriae . Однако при почти повсеместной вакцинации младенцев вакциной АКДС (дифтерия-столбняк-коклюш) дифтерия встречается редко.
Острая ушная инфекция
Острая ушная инфекция встречается у 30 процентов URI. В развивающихся странах с неадекватной медицинской помощью это может привести к перфорации барабанных перепонок и хроническим выделениям из уха в более позднем детстве и, в конечном итоге, к ухудшению слуха или глухоте (Berman 1995b). Хроническая ушная инфекция после повторных эпизодов острой ушной инфекции распространена в развивающихся странах, поражая от 2 до 6 процентов детей школьного возраста. Связанная с этим потеря слуха может приводить к инвалидности и влиять на обучение.Повторные ушные инфекции могут привести к мастоидиту, который, в свою очередь, может распространить инфекцию на мозговые оболочки. Мастоидит и другие осложнения, вызванные ОРВИ, являются причиной почти 5% всех смертей от ОРИ во всем мире (Williams и др. , 2002).
, 2002).
Инфекции нижних дыхательных путей
Распространенными инфекциями нижних дыхательных путей у детей являются пневмония и бронхиолит. Частота дыхания является ценным клиническим признаком для диагностики острой ЛРН у кашляющих и учащенно дышащих детей. Наличие втягивания нижней грудной стенки указывает на более тяжелое заболевание (Mulholland и др., 1992; Shann, Hart, and Thomas 1984).
В настоящее время наиболее частыми причинами вирусных LRIs являются RSV. Они имеют тенденцию быть очень сезонными, в отличие от вирусов парагриппа, следующей наиболее частой причины вирусных LRI. Эпидемиология вирусов гриппа у детей в развивающихся странах заслуживает срочного исследования, поскольку доступны безопасные и эффективные вакцины. До эффективного использования противокоревой вакцины вирус кори был наиболее важной вирусной причиной заболеваемости и смертности детей, связанных с респираторными путями, в развивающихся странах.
Пневмония
И бактерии, и вирусы могут вызывать пневмонию. Бактериальная пневмония часто вызывается Streptococcus pneumoniae (пневмококк) или Haemophilus influenzae, в основном типом b (Hib) и иногда Staphylococcus aureus или другими стрептококками. Всего от 8 до 12 из множества типов пневмококка вызывают большинство случаев бактериальной пневмонии, хотя конкретные типы могут различаться у взрослых и детей и в разных географических регионах.Другие патогены, такие как Mycoplasma pneumoniae и Chlamydia pneumoniae, , вызывают атипичные пневмонии. Их роль как причины тяжелых заболеваний у детей до пяти лет в развивающихся странах неясна.
Бактериальная пневмония часто вызывается Streptococcus pneumoniae (пневмококк) или Haemophilus influenzae, в основном типом b (Hib) и иногда Staphylococcus aureus или другими стрептококками. Всего от 8 до 12 из множества типов пневмококка вызывают большинство случаев бактериальной пневмонии, хотя конкретные типы могут различаться у взрослых и детей и в разных географических регионах.Другие патогены, такие как Mycoplasma pneumoniae и Chlamydia pneumoniae, , вызывают атипичные пневмонии. Их роль как причины тяжелых заболеваний у детей до пяти лет в развивающихся странах неясна.
Бремя LRIs, вызванных Hib или S. pneumoniae , трудно определить, поскольку современные методы установления бактериальной этиологии не обладают чувствительностью и специфичностью. Результаты посева из глотки не всегда позволяют выявить патоген, который является причиной LRI.Бактериальные культуры образцов аспирата легких часто считаются золотым стандартом, но они не подходят для применения в полевых условиях.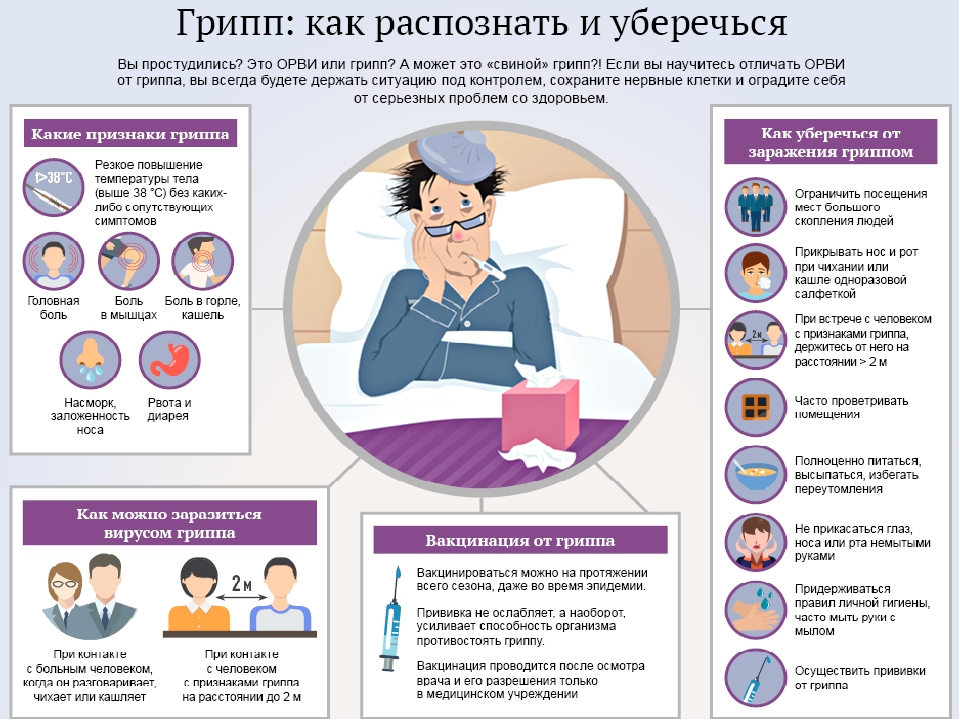 Обзор нескольких исследований Вуори-Холопайнен и Пелтола (2001) показывает, что на S. pneumoniae и Hib приходится от 13 до 34 процентов и от 1,4 до 42,0 процентов бактериальных пневмоний, соответственно, тогда как исследования Адегбола и др. (1994), Шэнн, Граттен и другие (1984) и Уолл и другие (1986) предполагают, что Hib составляет от 5 до 11 процентов случаев пневмонии.
Обзор нескольких исследований Вуори-Холопайнен и Пелтола (2001) показывает, что на S. pneumoniae и Hib приходится от 13 до 34 процентов и от 1,4 до 42,0 процентов бактериальных пневмоний, соответственно, тогда как исследования Адегбола и др. (1994), Шэнн, Граттен и другие (1984) и Уолл и другие (1986) предполагают, что Hib составляет от 5 до 11 процентов случаев пневмонии.
Пониженные уровни клинической или радиологической пневмонии при клинических испытаниях девятивалентной пневмококковой конъюгированной вакцины дают оценку бремени болезней, предупреждаемых с помощью вакцины ( валентность указывает количество серотипов, от которых вакцина обеспечивает защиту; конъюгат относится к конъюгации полисахаридов с белковым остовом). В исследовании, проведенном в Гамбии, было предотвращено 37 процентов радиологической пневмонии, что отражает количество заболеваний, вызванных S.pneumoniae, , а смертность снизилась на 16 процентов (Cutts and others 2005).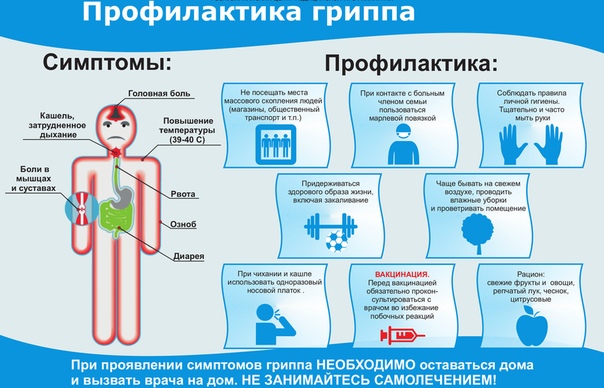
Колонизация верхних дыхательных путей потенциально патогенными организмами и аспирация зараженных секретов участвуют в патогенезе бактериальной пневмонии у детей младшего возраста. Было показано, что инфицирование верхних дыхательных путей вирусом гриппа или RSV увеличивает связывание как H. influenzae (Jiang и др., 1999), так и S. pneumoniae (Hament and others 2004; McCullers and Bartmess 2003) с подкладкой. клетки носоглотки.Это открытие может объяснить, почему рост пневмококковой пневмонии идет параллельно с эпидемиями гриппа и RSV. Исследование, проведенное в Южной Африке, показало, что вакцинация девятивалентной пневмококковой конъюгированной вакциной снижает заболеваемость вирус-ассоциированной пневмонией, вызывающей госпитализацию, на 31 процент, что позволяет предположить, что пневмококк играет важную роль в патогенезе вирус-ассоциированной пневмонии (Madhi, Petersen, Мадхи, Васас и др. 2000).
Попадание бактерий из кишечника с распространением через кровоток в легкие также было предложено для патогенеза грамотрицательных организмов (Fiddian-Green and Baker 1991), но такие бактерии являются необычными этиологическими агентами пневмонии у иммунокомпетентных дети. Однако у новорожденных и младенцев грамотрицательная пневмония не редкость (Quiambao готовится к печати).
Однако у новорожденных и младенцев грамотрицательная пневмония не редкость (Quiambao готовится к печати).
Вирусы ответственны за от 40 до 50 процентов инфекций у младенцев и детей, госпитализированных по поводу пневмонии в развивающихся странах (Hortal and others 1990; John and others 1991; Tupasi and others 1990). Вирус кори, RSV, вирусы парагриппа, вирус гриппа типа A и аденовирусы являются наиболее важными причинами вирусной пневмонии. Рентгенологически сложно отличить вирусную пневмонию от бактериальной, отчасти потому, что поражения выглядят одинаково, а отчасти потому, что бактериальная суперинфекция возникает при гриппе, кори и инфекциях RSV (Ghafoor и др., 1990).
В развивающихся странах уровень летальности среди детей с вирусной пневмонией колеблется от 1,0 до 7,3 процента (John и др., 1991; Stensballe, Devasundaram, and Simoes, 2003), с бактериальной пневмонией от 10 до 14 процентов и со смешанной вирусной и вирусной пневмонией. бактериальные инфекции от 16 до 18 процентов (Ghafoor и др. , 1990; Shann, 1986).
, 1990; Shann, 1986).
Бронхиолит
Бронхиолит возникает преимущественно в первый год жизни и с уменьшающейся частотой во второй и третий годы.Клинические признаки включают учащенное дыхание и втягивание нижней грудной стенки, лихорадку в одной трети случаев и хрипы (Cherian и др., 1990). Воспалительная обструкция мелких дыхательных путей, которая приводит к гиперинфляции легких и коллапсу сегментов легкого. Поскольку признаки и симптомы также характерны для пневмонии, работникам здравоохранения может быть сложно провести различие между бронхиолитом и пневмонией. Две особенности, которые могут помочь, — это определение сезонности RSV в данной местности и умение обнаруживать хрипы.RSV являются основной причиной бронхиолита во всем мире и могут вызывать до 70 или 80 процентов LRI в высокий сезон (Simoes 1999; Stensballe, Devasundaram и Simoes 2003). Недавно обнаруженный метапневмовирус человека также вызывает бронхиолит (Van den Hoogen и др., 2001), который неотличим от болезни RSV.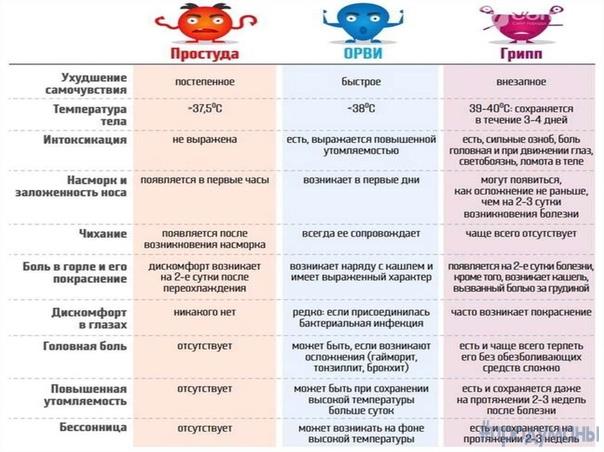 Другие вирусы, вызывающие бронхиолит, включают вирус парагриппа 3-го типа и вирусы гриппа.
Другие вирусы, вызывающие бронхиолит, включают вирус парагриппа 3-го типа и вирусы гриппа.
Грипп
Несмотря на то, что вирусы гриппа обычно вызывают инфекционные заболевания дыхательных путей у взрослых, они все чаще рассматриваются как важная причина инфекционных заболеваний кишечника у детей и, возможно, вторая по значимости причина госпитализации детей с ОРВ после RSV (Neuzil and others 2002). .Хотя грипп считается нечастым в развивающихся странах, его эпидемиология еще требует тщательного изучения. Потенциальное бремя гриппа как причина смерти детей неизвестно. Вирус гриппа типа A может вызывать сезонные вспышки, а тип B может вызывать спорадические инфекции. В последнее время вирус птичьего гриппа стал причиной инфекции, болезней и смерти небольшого числа людей, включая детей, в нескольких азиатских странах. Его потенциал для возникновения вспышек среди людей или пандемии неизвестен, но он может иметь разрушительные последствия для развивающихся стран (Peiris and others 2004) и может представлять угрозу для здоровья во всем мире. Новые штаммы вирусов типа A почти наверняка возникнут в результате мутации, как это произошло в случае пандемий в Азии и Гонконге в 1950-х и 1960-х годах.
Новые штаммы вирусов типа A почти наверняка возникнут в результате мутации, как это произошло в случае пандемий в Азии и Гонконге в 1950-х и 1960-х годах.
ВИЧ-инфекция и педиатрические ИПН
Во всем мире 3,2 миллиона детей живут с ВИЧ / СПИДом, 85 процентов из них — в странах Африки к югу от Сахары (ЮНЭЙДС, 2002). В южной части Африки инфекционные заболевания, связанные с ВИЧ, составляют от 30 до 40 процентов педиатрических госпитализаций и имеют уровень летальности от 15 до 34 процентов, что намного выше, чем 5-10 процентов для детей, не инфицированных ВИЧ (Bobat and others 1999; Мадхи, Петерсен, Мадхи, Хосал и другие, 2000; Натху и другие, 1993; Цви, Петтифиор и Содерлунд, 1999). Pneumocystis jiroveci и цитомегаловирус являются важными условно-патогенными инфекциями более чем у 50 процентов ВИЧ-инфицированных младенцев (Jeena, Coovadia, and Chrystal 1996; Lucas and others 1996). Грамотрицательные бактерии также важны для более чем 70 процентов ВИЧ-инфицированных детей с недостаточным питанием (Ikeogu, Wolf, and Mathe, 1997). Исследования пациентов подтвердили частую ассоциацию этих бактерий, но добавили S. pneumoniae и S. aureus в качестве важных патогенов (Gilks 1993; Goel and others 1999).В первом южноафриканском отчете об общем бремени инвазивной пневмококковой инфекции сообщается о 41,7-кратном увеличении числа ВИЧ-инфицированных детей по сравнению с неинфицированными детьми (Фарли и др., 1994).
Вмешательства
Вмешательства по борьбе с ОРИ можно разделить на четыре основные категории: иммунизация против конкретных патогенов, ранняя диагностика и лечение заболеваний, улучшение питания и более безопасная среда (John 1994). Первые два относятся к сфере ведения системы здравоохранения, тогда как последние два относятся к сфере общественного здравоохранения и требуют многосекторального участия.
Прививки
Широкое использование вакцин против кори, дифтерии, коклюша, Hib, пневмококка и гриппа может существенно снизить заболеваемость ОРИ у детей в развивающихся странах. Влияние вакцин против кори, дифтерии и коклюша обсуждается в главе 20. Ограниченные данные о гриппе в развивающихся странах не позволяют провести подробный анализ потенциальных преимуществ этой вакцины. Поэтому в этой главе основное внимание уделяется потенциальному воздействию вакцин против Hib и пневмококка на LRI.
Вакцина против Hib
В настоящее время доступны три конъюгированные вакцины против Hib для применения у младенцев и детей младшего возраста. Эффективность вакцины против Hib в предотвращении инвазивных заболеваний (в основном менингита, но также и пневмонии) была хорошо задокументирована в нескольких исследованиях, проведенных в промышленно развитых странах (Black and others 1992; Booy and others 1994; Eskola and others 1990; Fritzell and Plotkin 1992; Heath 1998; Lagos and others 1996; Santosham and others 1991) и в одном исследовании в Гамбии (Mulholland and others 1997).Все исследования показали защитную эффективность более 90% против лабораторно подтвержденных инвазивных заболеваний, независимо от выбора вакцины. Следовательно, все промышленно развитые страны включают вакцину против Hib в свои национальные программы иммунизации, что приводит к фактическому устранению инвазивной болезни Hib из-за иммунитета у вакцинированных и эффекта стада у тех, кто не вакцинирован. Имеющиеся данные из нескольких развивающихся стран показывают аналогичный эффект стада (Адегбола и др., 1999; Венгер и др., 1999).
Первоначальное обещание и последующее общее мнение заключалось в том, что вакцина против Hib предназначена для защиты от менингита, но в развивающихся странах вакцина, вероятно, будет иметь больший эффект в предотвращении LRIs. Легко измерить эффект при инвазивных заболеваниях, включая бактериемическую пневмонию. Вакцина, вероятно, оказывает влияние на небактериемическую пневмонию, но этот эффект трудно определить количественно из-за отсутствия адекватного метода установления бактериальной этиологии. В Бангладеш, Бразилии, Чили и Гамбии вакцина против Hib была связана с уменьшением на 20-30 процентов числа госпитализированных с рентгенологически подтвержденной пневмонией (de Andrade and others 2004; Levine and others 1999; Mulholland and others 1997; WHO 2004a ).Однако результаты большого исследования в Ломбоке, Индонезия, не дали окончательных результатов в отношении влияния вакцины против Hib на пневмонию (Gessner and others 2005).
Пневмококковые вакцины
В настоящее время доступны два вида вакцин против пневмококков: 23-валентная полисахаридная вакцина (23-PSV), которая больше подходит для взрослых, чем для детей, и 7-валентная полисахаридная вакцина, конъюгированная с белком (7- PCV). 9-валентная вакцина (9-PCV) прошла клинические испытания в Гамбии и Южной Африке, а 11-валентная вакцина (11-PCV) проходит испытания на Филиппинах.
Исследования эффективности полисахаридной вакцины в профилактике ОРИ или ушных инфекций у детей в промышленно развитых странах показали противоречивые результаты. В то время как некоторые исследования этой вакцины не показывают значительной эффективности (Douglas and Miles 1984; Sloyer, Ploussard and Howie 1981), исследования, проведенные в Финляндии, показывают в целом защитный эффект против серотипов, содержащихся в 14-PSV (Douglas and Miles 1984; Karma and другие 1980; Макела и другие 1980). Эффективность была более выражена у детей старше двух лет, чем у детей младшего возраста.Единственные исследования, оценивающие действие полисахаридной вакцины на детей в развивающихся странах, — это серия из трех испытаний, проведенных в Папуа-Новой Гвинее (Дуглас и Майлз, 1984; Леманн и другие, 1991; Райли и другие, 1981; Райли, Леманн и Альперс, 1991). . Анализ объединенных данных этих испытаний показал снижение смертности от LRI на 59 процентов среди детей до пяти лет на момент вакцинации и на 50 процентов среди детей до двух лет. На основании этих и других исследований исследователи пришли к выводу, что вакцина оказывает влияние на тяжелую пневмонию.Более высокая, чем ожидалось, эффективность в этих испытаниях была приписана большему вкладу более иммуногенных серотипов взрослых в пневмонию в Папуа-Новой Гвинее (Douglas and Miles 1984; Riley, Lehmann, and Alpers 1991). Из-за низкой иммуногенности антигенов в 23-PSV против преобладающих детских серотипов внимание теперь направлено на более иммуногенные конъюгированные вакцины (Mulholland 1998; Obaro 1998; Temple 1991).
Эффективность 7-PCV и 9-PCV была оценена на предмет эффективности против инвазивного пневмококкового заболевания в четырех испытаниях, которые продемонстрировали эффективность вакцины от 71.От 0 до 97,4 процента (от 58 до 65 процентов для ВИЧ-положительных детей, среди которых заболеваемость пневмококком в 40 раз выше, чем среди ВИЧ-отрицательных детей) (Black and others 2000; Cutts and others 2005; Klugman and others 2003; O ‘ Брайен и другие 2003).
В США 7-PCV был включен в плановую вакцинацию младенцев и детей в возрасте до двух лет в 2000 году. К 2001 году заболеваемость всеми инвазивными пневмококковыми заболеваниями в этой возрастной группе снизилась на 69 процентов, а заболевания, вызываемые включенными серотипами. вакцины и родственных серотипов снизились на 78 процентов (Whitney and others 2003).Подобные сокращения были подтверждены в исследовании, проведенном в северной Калифорнии (Black and others 2001). Наблюдалось небольшое увеличение частоты инвазивных заболеваний, вызванных серотипами пневмококков, не включенных в вакцину, но оно было недостаточно большим, чтобы компенсировать существенное снижение заболеваемости, вызванное вакциной. Исследования также обнаружили значительное снижение инвазивной пневмококковой инфекции в непривитых старших возрастных группах, особенно среди взрослых в возрасте от 20 до 39 лет и в возрасте 65 лет и старше, что позволяет предположить, что вакцинация маленьких детей оказала значительный эффект в обществе.Такое преимущество может иметь место даже там, где распространенность ВИЧ-инфекции среди взрослых высока, а пневмококковая инфекция может быть рецидивирующей и опасной для жизни.
Воздействие вакцины на пневмококковую пневмонию как таковое трудно определить из-за проблем, связанных с установлением бактериальной этиологии пневмонии. Три исследования оценивали влияние вакцины на рентгенологическую пневмонию (независимо от этиологического агента) и показали снижение на 20,5–37,0% случаев пневмонии, подтвержденной рентгенологически (9.0 процентов для ВИЧ-инфицированных) (Black and others 2000; Cutts and others 2005; Klugman and others 2003).
Несколько полевых испытаний оценили эффективность PCV против ушной инфекции. Несмотря на то, что вакцина привела к значительному сокращению подтвержденного посевом пневмококка отита, чистого снижения ушной инфекции среди вакцинированных детей не наблюдалось, вероятно, из-за увеличения частоты отита, вызванного видами пневмококков, не охваченных вакциной, ЧАС.influenzae и Moraxella catarrhalis (Eskola and others 2001; Kilpi and others 2003). Однако испытание в северной Калифорнии показало, что вакцина обладает защитным действием против частых инфекций уха и снижает потребность в установке тимпаностомической трубки (Fireman and others 2003). Таким образом, вакцина от ушной инфекции может быть полезной в развивающихся странах с высокими показателями хронического отита и кондуктивной тугоухости, и ее следует оценивать с помощью клинических испытаний.
Самым заметным преимуществом вакцины для общественного здравоохранения в развивающихся странах будет очевидное снижение смертности.Хотя первичным результатом исследования в Гамбии изначально была детская смертность, она была изменена на радиологическую пневмонию. Тем не менее, испытание показало снижение смертности на 16 процентов (уровень достоверности 95 процентов, от 3 до 38). Это испытание проводилось в сельской местности на востоке Гамбии, где трудно обеспечить круглосуточную лечебную помощь, включая ведение больных. Это испытание демонстрирует, что иммунизация, проводимая в рамках аутрич-программ, принесет значительную пользу для здоровья и экономики таких групп населения.Еще одно исследование, оценивающее влияние 11-PCV на радиологическую пневмонию, продолжается на Филиппинах; результаты ожидаются во второй половине 2005 года.
Ведение пациентов
Упрощение и систематизация ведения пациентов для ранней диагностики и лечения ОРИ позволили значительно снизить смертность в развивающихся странах, где доступ к педиатрам ограничен. В клинических рекомендациях ВОЗ по ведению случаев ОРИ (ВОЗ, 1991 г.) используются два ключевых клинических признака: частота дыхания, , чтобы отличить детей с пневмонией от детей без, и втягивание нижней грудной клетки, , для выявления тяжелой пневмонии, требующей направления и госпитализации.Детям со слышимым стридором в спокойном и спокойном состоянии или такими опасными признаками тяжелого заболевания, как неспособность есть, также требуется направление. Дети без этих признаков классифицируются как страдающие ОРИ, но не пневмонией. Детей, у которых наблюдается только учащенное дыхание, лечат от пневмонии амбулаторно. Детей, которые кашляют более 30 дней, направляют для дальнейшего обследования на туберкулез и другие хронические инфекции.
Диагностика пневмонии на основе учащенного дыхания
Первоначальные рекомендации по выявлению пневмонии на основе учащенного дыхания были разработаны в Папуа-Новой Гвинее в 1970-х годах.В исследовании 200 последовательных педиатрических пациентов и 50 последовательных госпитализаций (Shann, Hart, and Thomas 1984) 72 процента детей со слышимым хрипом в легких имели частоту дыхания 50 или более вдохов в минуту, тогда как только 19 процентов детей без потрескивания дышал с такой стремительной скоростью. Поэтому в первоначальных рекомендациях ВОЗ использовался порог в 50 вдохов в минуту, при достижении которого кашель у ребенка считался пневмонией.
Основное беспокойство вызывает относительно низкая чувствительность этого подхода, который может упустить от 25 до 40 процентов случаев пневмонии.Исследование в Веллоре, Индия, показало, что чувствительность можно улучшить, снизив порог до 40 для детей в возрасте от 1 до 4 лет, сохранив порог в 50 вдохов в минуту для младенцев в возрасте от 2 до 11 месяцев (Cherian and others 1988). Последующие исследования показали, что при использовании этих пороговых значений чувствительность улучшилась с 62 до 79 процентов на Филиппинах и с 65 до 77 процентов в Свазиленде, но в то же время специфичность упала с 92 до 77 процентов на Филиппинах и с 92 до 80 процентов. процентов в Свазиленде (Mulholland и др., 1992).На основе этих и других данных (Кэмпбелл, Байасс и др., 1989; Колстад и др., 1997; Перкинс и др., 1997; Редд, 1994; Симоес и др., 1997; Вебер и др., 1997) ВОЗ рекомендует ограничить частоту дыхания на 50 вдохов. в минуту для детей в возрасте от 2 до 11 месяцев и 40 вдохов в минуту для детей в возрасте от 12 месяцев до 5 лет.
Учащенное дыхание, по определению ВОЗ, выявляет около 85 процентов детей с пневмонией, и более 80 процентов детей с потенциально смертельной пневмонией, вероятно, успешно выявляются и лечатся с использованием диагностических критериев ВОЗ.Было показано, что лечение детей с учащенным дыханием антибиотиками снижает смертность (Sazawal and Black 2003). Проблема низкой специфичности критерия учащенного дыхания заключается в том, что от 70 до 80 процентов детей, которые могут не нуждаться в антибиотиках, получат их. Тем не менее, для работников первичной медико-санитарной помощи, для которых важна простота диагностики, учащенное дыхание, несомненно, является наиболее полезным клиническим признаком.
Диагностика пневмонии на основании втягивания грудной стенки
Дети поступают в больницу с тяжелой пневмонией, когда медицинские работники считают, что необходимы кислородные или парентеральные антибиотики (антибиотики, вводимые не перорально), или когда они не уверены в способности матери справиться .Обоснование парентеральных антибиотиков состоит в том, чтобы достичь более высоких уровней антибиотиков и преодолеть опасения по поводу абсорбции пероральных препаратов у больных детей.
В исследовании Папуа-Новой Гвинеи (Shann, Hart, and Thomas 1984) втягивание грудной клетки использовалось в качестве основного показателя тяжести, но исследования, проведенные в разных частях мира, показывают большие различия в темпах втягивания из-за различных определений. Ограничение этого термина втягиванием нижней грудной стенки, определяемым как движение внутрь костных структур грудной стенки с вдохом, предоставило лучший индикатор тяжести пневмонии, который можно научить медработникам.Он более специфичен, чем втяжение межреберных промежутков, которое часто возникает при бронхиолите.
В исследовании, проведенном в Гамбии (Кэмпбелл, Байасс и др., 1989), когорта из 500 детей от рождения до четырех лет посещалась дома еженедельно в течение одного года. За это время в клинику было направлено 222 эпизода LRI (учащенное дыхание, любое втягивание грудной стенки, расширение носа, свистящее дыхание, стридор или признаки опасности). Втягивание грудной клетки имело место в 62 процентах этих случаев, во многих случаях втягивание межреберья.Если бы всех детей с каким-либо втягиванием грудной клетки госпитализировали, их количество превысило бы количество детских стационаров.
Исследования, проведенные на Филиппинах и в Свазиленде (Mulholland и др., 1992), показали, что втягивание нижней грудной стенки было более специфичным, чем втягивание межреберья, для диагностики тяжелой пневмонии, требующей госпитализации. В исследовании Веллора (Cherian and others 1988) втягивание нижней грудной стенки правильно предсказало 79 процентов детей с LRI, которые были госпитализированы педиатром.
Варианты противомикробных препаратов для перорального лечения пневмонии
Выбор противомикробного препарата для лечения основан на хорошо известных данных о том, что большинство бактериальных пневмоний у детей вызывается S. pneumoniae или H. influenzae . Однократная инъекция бензатин-пенициллина, хотя и длится долго, не обеспечивает адекватных уровней пенициллина для уничтожения H. influenzae . У ВОЗ есть технические документы, помогающие оценить соответствующие факторы при выборе противомикробных препаратов первого и второго ряда и сравнения различных противомикробных препаратов в отношении их антибактериальной активности, эффективности лечения и токсичности (ВОЗ, 1990).
Возникновение устойчивости к противомикробным препаратам у S. pneumoniae и H. influenzae вызывает серьезную озабоченность. В некоторых условиях тесты in vitro показывают, что более 50 процентов респираторных изолятов обеих бактерий устойчивы к ко-тримоксазолу, а устойчивость к пенициллину к S. pneumoniae постепенно становится проблемой во всем мире.
При пневмонии, в отличие от менингита, устойчивость возбудителя in vitro не всегда приводит к неэффективности лечения.Сообщения из Испании и Южной Африки предполагают, что пневмонию, вызванную устойчивым к пенициллину S. pneumoniae , можно успешно лечить с помощью достаточно высоких доз пенициллина. Амоксициллин концентрируется в тканях и макрофагах, и его уровни напрямую зависят от пероральных дозировок. Поэтому для успешного лечения ушных инфекций, вызванных устойчивым к пенициллину S. pneumoniae , в настоящее время используются более высокие дозы, чем в прошлом, — назначаемые дважды в день. Амоксициллин явно лучше пенициллина при таких инфекциях.Ситуация с ко-тримоксазолом менее ясна (Strauss и др., 1998), и перед лицом высоких показателей устойчивости к ко-тримоксазолу амоксициллин может быть лучше для детей с тяжелой пневмонией.
Внутримышечные антибиотики для лечения тяжелой пневмонии
Несмотря на то, что хлорамфеникол активен против S. pneumoniae и H. influenzae, его пероральное всасывание у чрезвычайно больных детей неустойчиво. Таким образом, рекомендации ВОЗ рекомендуют вводить хлорамфеникол внутримышечно в половине суточной дозы до срочного направления пациентов с тяжелой пневмонией.Дополнительным объяснением является то, что у крайне больных детей может быть сепсис или менингит, которые трудно исключить и которые необходимо немедленно лечить. Хотя внутривенный хлорамфеникол превосходит внутримышечный хлорамфеникол, процедура может отсрочить срочно необходимое лечение и увеличивает его стоимость.
Исследователи поставили под сомнение адекватность и безопасность внутримышечного хлорамфеникола. Хотя ранние исследования показали, что уровни взрослого в крови после внутримышечного введения были значительно ниже, чем уровни, достигнутые после внутривенного введения, внутримышечный путь введения получил широкое признание после клинических отчетов, которые подтвердили его эффективность.Местные осложнения при внутримышечном введении сукцината левомицетина возникают редко, в отличие от более ранних внутримышечных препаратов. Хотя беспокойство по поводу апластической анемии после приема хлорамфеникола является обычным явлением, это осложнение крайне редко встречается у маленьких детей. Нет никаких доказательств того, что внутримышечный сукцинат хлорамфеникола с большей вероятностью вызывает побочные эффекты, чем другие формы и пути введения хлорамфеникола.
Диагностика гипоксемии на основе критериев ВОЗ
Стратегии ведения случаев ОРИ и комплексного ведения болезней грудного и детского возраста (ИВБДВ) зависят от точного направления больных детей в больницу и правильного стационарного лечения ИРН с применением кислорода или антибиотиков.Гипоксемия (дефицит кислорода в крови) у детей с LRI является хорошим предиктором смертности, коэффициент летальности в 1,2-4,6 раза выше при гипоксемическом LRI, чем при негипоксемическом LRI (Duke, Mgone, and Frank 2001; Onyango and others 1993). ), а кислород снижает смертность. Таким образом, важно как можно раньше выявлять гипоксемию у детей с LRI, чтобы предотвратить смерть. Хотя диагноз острой LRIs очень легко устанавливается путем распознавания тахипноэ, и хотя тяжелая LRI связана с втягиванием грудной стенки, клиническое распознавание гипоксемии более проблематично.Были изучены различные наборы клинических правил для прогнозирования наличия гипоксемии у детей с LRI (Cherian и др., 1988; Onyango и др., 1993; Usen и др., 1999). Хотя некоторые клинические инструменты обладают высокой чувствительностью для выявления гипоксемии, большое количество детей с гипоксемией все же будет пропущено при использовании этих критериев. Пульсоксиметрия — лучший инструмент для быстрого выявления гипоксемии у больных детей. Однако пульсоксиметры дороги и требуют периодических затрат на замену датчиков, по которым они недоступны в большинстве районных или даже специализированных больниц в развивающихся странах.
Руководство по лечению
Текущие рекомендации включают прием ко-тримоксазола два раза в день в течение пяти дней при пневмонии и внутримышечный пенициллин или хлорамфеникол для детей с тяжелой пневмонией. Проблемы повышения устойчивости к ко-тримоксазолу и ненужных направлений детей с втягиванием грудной стенки привели к исследованиям, в которых изучаются альтернативы антибиотикам, которые в настоящее время используются при лечении ОРИ. Одно исследование показало, что амоксициллин и котримоксазол одинаково эффективны при нетяжелой пневмонии (Catchup Study Group 2002), хотя амоксициллин стоит в два раза дороже, чем котримоксазол.Что касается продолжительности лечения антибиотиками, исследования в Бангладеш, Индии и Индонезии показывают, что трехдневный пероральный прием котримоксазола или амоксициллина так же эффективен, как пять дней приема любого из препаратов у детей с нетяжелой пневмонией (Agarwal and others 2004; Kartasasmita 2003). ). В многоцентровом исследовании пенициллина, вводимого внутримышечно, и перорального амоксициллина у детей с тяжелой пневмонией, Аддо-Йобо и другие (2004) обнаружили схожие показатели излечения. Поскольку пациенты получали кислород при необходимости от гипоксемии и были переведены на другие антибиотики, если лечение не помогло, этот режим не подходит для лечения тяжелой пневмонии в амбулаторных условиях.
ВОЗ рекомендует назначать кислород, если он имеется в достаточном количестве, детям с признаками и симптомами тяжелой пневмонии и, если подача ограничена, детям с любым из следующих признаков: неспособность есть и пить, цианоз, частота дыхания выше или равный 70 вдохам в минуту, или серьезное втягивание грудной стенки (ВОЗ, 1993). Кислород следует вводить со скоростью 0,5 литра в минуту для детей младше 2 месяцев и 1 литр в минуту для детей старшего возраста. Поскольку кислород стоит дорого и его не хватает, особенно в отдаленных сельских районах развивающихся стран, ВОЗ рекомендует простые клинические признаки для выявления и лечения гипоксемии.Несмотря на эти рекомендации, исследование 21 учреждения первого уровня и районной больницы в семи развивающихся странах показало, что более 50 процентов госпитализированных детей с LRI неправильно лечились антибиотиками или кислородом (Nolan and others 2001), а в некоторых случаях кислород был в дефиците. Очевидно, что обеспечение кислородом младенцев с гипоксемией спасает жизнь, хотя никаких рандомизированных испытаний, подтверждающих это, не проводилось.
Профилактика и лечение пневмонии у ВИЧ-позитивных детей
Текущие рекомендации группы ВОЗ по лечению пневмонии у ВИЧ-позитивных детей и профилактике Pneumocystis jiroveci следующие (ВОЗ 2003):
Нетяжелая пневмония в возрасте до 5 лет. Пероральный котримоксазол должен оставаться антибиотиком первой линии, но следует использовать пероральный амоксициллин, если он доступен по цене или если ребенок проходил профилактику котримоксазолом.
Тяжелая или очень тяжелая пневмония. Нормальные руководящие принципы ВОЗ по ведению больных следует использовать для детей в возрасте до 2 месяцев. Детям от 2 до 11 месяцев рекомендуются инъекционные антибиотики и лечение пневмонии Pneumocystis jiroveci , а также начинается профилактика пневмонии Pneumocystis jiroveci после выздоровления.Для детей в возрасте от 12 до 59 месяцев лечение состоит из инъекционных антибиотиков и терапии пневмонии Pneumocystis jiroveci . Pneumocystis jiroveci Профилактика пневмонии должна проводиться в течение 15 месяцев детям, рожденным от ВИЧ-инфицированных матерей; однако эта рекомендация редко выполнялась.
Рентабельность вмешательств
Пневмония является причиной примерно пятой части из примерно 10,6 миллиона случаев смерти детей в возрасте до пяти лет в год.Там, где первичная медико-санитарная помощь является слабой, сокращение смертности с помощью мер общественного здравоохранения является приоритетной задачей. Как отмечалось ранее, доступные вмешательства — это первичная профилактика путем вакцинации и вторичная профилактика путем раннего выявления и ведения случаев заболевания.
Рентабельность вакцин против Hib обсуждается в главе 20. Мы не пытались анализировать рентабельность пневмококковых вакцин, поскольку глобальные и региональные оценки бремени пневмококковой пневмонии в настоящее время разрабатываются и будут доступны только после позже в 2005 году.Кроме того, текущие цены на вакцины относительно стабильны в развитых странах, но ожидается, что цены для стран с низким и средним уровнем доходов будут значительно ниже, если вакцины закупаются на глобальном тендере.
Мы оцениваем стратегии вмешательства по ведению случая LRIs у детей в возрасте до пяти лет. Медицинские работники, осуществляющие ведение больных, диагностируют ИРН на основании учащенного дыхания, втягивания нижней грудной стенки или отдельных признаков опасности у детей с респираторными симптомами.Поскольку этот метод не делает различий между пневмонией и бронхиолитом, а также между бактериальной и вирусной пневмонией, мы объединяем эти состояния в общую категорию «клиническая пневмония» (Rudan and others 2004). Этот подход предполагает, что большая часть клинической пневмонии имеет бактериальное происхождение и что медицинские работники могут значительно снизить летальность посредством диагностики частоты дыхания и своевременного приема антибиотиков (Sazawal and Black 2003). Мы рассчитали затраты на лечение по регионам Всемирного банка с использованием стандартизированных исходных затрат, предоставленных редакторами томов, и затрат, опубликованных в Международном справочнике по индикаторам цен на лекарства (Management Sciences for Health 2005) и другой литературе ().В анализе рассматриваются четыре категории ведения пациентов, которые различаются тяжестью инфекции и точкой лечения:
Таблица 25.1
Входные данные для ведения случаев пневмонии в странах с низким и средним уровнем доходов.
нетяжелая пневмония, лечение в больнице
нетяжелая пневмония, лечение в медицинском учреждении
тяжелая пневмония, лечение в больнице
очень тяжелая пневмония, лечение в больнице.
Информация об этих категориях ведения пациентов и их результатах взята из отчета о методологии и предположениях, использованных для оценки затрат на расширение масштабов отдельных медицинских вмешательств, направленных на детей (ВОЗ и Здоровье детей-подростков, готовится к печати). Мы предположили, что для каждого пациента, которого лечит местный медицинский работник, в общей сложности должно быть проведено три контрольных визита, а не два раза в день в течение 10 дней, рекомендованных в отчете. Мы также предположили, что все пациенты с тяжелой пневмонией проходят рентгенологическое обследование, а не только 20 процентов, как предлагается в отчете.Более того, мы приняли пятичасовой рабочий день для общинного медработника, минимальный рабочий день, необходимый для общинных медицинских работников в рамках инициативы «Здоровье и выживание детей» Агентства США по международному развитию (Bhattacharyya and others 2001).
представляет региональные оценки средних затрат на лечение на эпизод для четырех стратегий ведения случая. Поскольку мы считали, что цены на торгуемые товары, такие как лекарства и кислород, постоянны в разных регионах, региональные различия были вызваны различиями в расходах на больницы и медицинских работников.Латинская Америка и Карибский бассейн, Ближний Восток и Северная Африка имели самые высокие затраты на лечение.
Таблица 25.2
Средние затраты на лечение за один эпизод вмешательств по ведению пациентов с острой респираторной инфекцией нижних дыхательных путей (2001 долл. США).
Мы рассчитали региональные коэффициенты экономической эффективности (ССВ) для модельной численности населения в 1 миллион человек в каждом регионе, следуя стандартизированным руководящим принципам для экономического анализа (подробности см. В главе 15). Входные переменные включали стоимость лечения, подробно описанную в и, региональные показатели заболеваемости LRI, адаптированные из материалов Рудана и других (готовится к публикации), региональные показатели смертности и возрастные структуры, предоставленные редакторами томов, а также соотношение городского и сельского населения по регионам (World Банк 2002).Регион Европы и Центральной Азии был исключен из этого анализа из-за отсутствия информации о заболеваемости. Ввиду отсутствия информации по регионам, мы предположили, что уровни эффективности вмешательства будут одинаковыми.
Количество лет жизни с поправкой на инвалидность можно предотвратить за счет сокращения продолжительности болезни и снижения смертности с помощью лечения. Мы предположили, что средняя продолжительность болезни составляет 8,5 дней для тех, кто не лечился, и 6,0 дней для тех, кто лечился. Мы использовали снижение летальности на 36,0% за счет лечения (Sazawal and Black 2003) и специфичность диагноза 78.5 процентов для пациентов, которым поставлен диагноз только на основании частоты дыхания. Вес нетрудоспособности одновременно с инфекцией составил 0,28. Мы не рассматривали инвалидность, вызванную хроническими последствиями LRI, потому что неясно, вызывает ли LRI в детстве долгосрочное нарушение функции легких или дети, у которых развивается нарушение функции легких, более склонны к инфекции (von Mutius 2001).
Поскольку один год этих вмешательств дает только одновременные преимущества — поскольку эффективно пролеченные люди не обязательно доживают до ожидаемой продолжительности жизни, учитывая, что они, вероятно, снова заразятся в следующем году, — мы рассчитали экономическую эффективность пятилетнего вмешательства .Этот период времени позволил нам рассмотреть случай, в котором целая когорта новорожденных до четырехлетнего возраста избежала ранней детской смертности от клинической пневмонии из-за вмешательства и получила преимущество, дожившее до ожидаемой продолжительности жизни. Наконец, в этом анализе учитывались только долгосрочные предельные затраты, которые варьируются в зависимости от количества пациентов, прошедших лечение, и не учитывались постоянные затраты на запуск программы, которых в настоящее время не существует.
представляет ССВ для конкретных регионов четырех категорий ведения случаев, а также ССВ для предоставления всех четырех категорий населению в 1 миллион человек.Во всех странах с низким и средним уровнем доходов лечение нетяжелой клинической пневмонии было более рентабельным на уровне учреждения, чем на уровне общины, и из всех четырех категорий ведения случая лечение очень тяжелой клинической пневмонии на уровне стационара было более эффективным. наименее рентабельный. Лечение нетяжелой клинической пневмонии на уровне учреждения было более рентабельным, чем лечение общинным работником здравоохранения, из-за более низкой стоимости одного посещения медицинского учреждения, чем многократных посещений медицинского работника.CER предоставления всех уровней лечения для всех стран с низким и средним уровнем доходов оценивается в 398 долларов США на год жизни с поправкой на инвалидность.
Таблица 25.3
ССВ вмешательств по ведению пациентов с пневмонией (2001 долл. США / год жизни с поправкой на инвалидность).
Поскольку мы предположили, что показатели эффективности были постоянными, региональные различия в CER для каждой категории ведения случая были связаны только с вариациями затрат на вмешательство, а относительные рейтинги экономической эффективности для стратегий были одинаковыми для всех регионов.Различия в ССВ для оказания всех категорий медицинской помощи также были обусловлены региональным соотношением городского и сельского населения. Мы предположили, что все пациенты в городских районах обращаются за лечением на уровне учреждения или выше, тогда как 80 процентов нетяжелых пациентов в сельской местности получают лечение на уровне сообщества, а остальные обращаются за лечением на уровне учреждения.
Внедрение стратегий борьбы с ОРИ: уроки опыта
Уроки стратегий профилактики и контроля ОРИ, реализованные в рамках национальных программ, включают стратегии вакцинации и ведения больных, описанные ниже.
Vaccine Strategies
Вакцина против Hib была введена в календарь плановой иммунизации младенцев в Северной Америке и Западной Европе в начале 1990-х годов. С созданием Глобального альянса по вакцинам и иммунизации (ГАВИ) и Фонда вакцин был достигнут прогресс в их внедрении в развивающихся странах, хотя серьезные препятствия остаются. К 2002 г. только 84 из 193 стран-членов ВОЗ ввели вакцину против Hib. С тех пор пять стран получили одобрение ГАВИ на поддержку внедрения вакцины против Hib в 2004–2005 годах.
Соединенные Штаты добавили 7-PCV в программу иммунизации младенцев в 2000 году. Некоторые другие промышленно развитые страны планируют включить вакцину в свои национальные программы иммунизации в 2005 году, тогда как другие рекомендуют использовать вакцину только в отдельных группах высокого риска. . В некоторых из этих последних стран определение высокого риска является довольно широким и включает значительную долю всех младенцев. В лицензированном в настоящее время 7-PCV отсутствуют определенные серотипы, важные для развивающихся стран, но 9-PCV и 11-PCV охватят почти 80 процентов серотипов, вызывающих серьезные заболевания во всем мире.
Несмотря на успех вакцины против Hib в промышленно развитых странах и общепризнанное значение LRI как причины детской смертности, в результате действия ряда взаимосвязанных факторов внедрение вакцины в развивающихся странах было медленным. Устойчивое использование вакцины находится под угрозой в нескольких странах, которые ввели вакцину. Во-первых, масштабы заболеваний и смертей, вызванных Hib, не признаются в этих странах, отчасти из-за недостаточного использования бактериологической диагностики (в результате нехватки оборудования и ресурсов).Во-вторых, поскольку охват, достигнутый с помощью традиционных расширенных программ иммунизации вакцинами, остается низким во многих странах, добавление дополнительных вакцин не было определено в качестве приоритета. В-третьих, развивающиеся страны не предпринимали усилий по установлению полезности вакцины до тех пор, пока вакцина не была лицензирована и не использовалась регулярно в течение нескольких лет в промышленно развитых странах. Следовательно, вакцинация против Hib воспринимается как средство вмешательства для богатых стран. В результате всех этих факторов фактический спрос на вакцину оставался низким, даже когда поддержка предоставлялась через ГАВИ и Фонд вакцин.
В 2004 году правление ГАВИ поручило целевой группе по Hib изучить, как лучше всего поддержать национальные усилия по принятию основанных на фактических данных решений о внедрении вакцины против Hib. На основе рекомендаций целевой группы правление ГАВИ одобрило создание Инициативы по Hib для поддержки тех стран, которые хотят либо продолжить вакцинацию против Hib, либо изучить вопрос о том, должно ли внедрение вакцины Hib быть приоритетом для их систем здравоохранения. Консорциум, состоящий из Школы общественного здравоохранения Блумберга Джонса Хопкинса, Лондонской школы гигиены и тропической медицины, Центров по контролю и профилактике заболеваний и ВОЗ, был выбран для руководства этими усилиями.
Стратегии ведения случаев
Метаанализ исследований Сазавала и Блэка (Sazawal and Black, 2003) на уровне сообществ, посвященных стратегии ведения случаев ОРИ, включает 10 исследований, в которых оценивалось ее влияние на смертность, 7 с одновременной контрольной группой. Метаанализ показал снижение смертности от всех причин на 27 процентов среди новорожденных, на 20 процентов среди младенцев и на 24 процента среди детей в возрасте от одного до четырех лет. Смертность от LRI снизилась на 42, 36 и 36 процентов соответственно. Эти данные ясно показывают, что относительно упрощенное, но стандартизованное ведение случаев ОРИ может иметь значительное влияние на смертность не только от пневмонии, но и от других причин у детей от рождения до четырех лет.В настоящее время стратегия ведения пациентов с ОРИ включена в стратегию ИВБДВ, которая в настоящее время применяется более чем в 80 странах (см. Главу 63).
Несмотря на то, что ежегодно от пневмонии гибнет огромное количество людей, обещания, заложенные в упрощенном ведении больных, не были успешно реализованы во всем мире. Одна из основных причин — недостаточное использование медицинских учреждений в странах или сообществах, в которых многие дети умирают от ОРИ. В Бангладеш, например, 92 процента больных детей не попадают в соответствующие медицинские учреждения (ВОЗ, 2002 г.).В Боливии 62 процента умерших детей не были доставлены к врачу в случае болезни (Aguilar and others 1998). В Гвинее 61 процент умерших больных детей не были доставлены к врачу (Schumacher and others 2002). Исследование Шелленберга и других (2003), проведенное в Танзании, показывает, что дети из более бедных семей с меньшей вероятностью получат антибиотики от пневмонии, чем дети из более обеспеченных семей, и что только 41 процент больных детей доставляют в медицинские учреждения.Таким образом, исследования неизменно подтверждают, что больные дети, особенно из бедных семей, не посещают медицинские учреждения.
Ряд стран разработали крупномасштабные и устойчивые программы лечения на уровне сообществ:
- В Гамбии действует национальная программа лечения пневмонии на уровне общин (ВОЗ 2004b).
- В районе Сиая в Кении неправительственная организация эффективно предоставляет медицинскими работниками лечение пневмонии и других детских болезней (ВОЗ, 2004b).
- В Гондурасе управление ОРИ было включено в Национальную интегрированную программу общинного ухода за детьми, в соответствии с которой добровольцы из местных сообществ проводят мониторинг роста, проводят санитарное просвещение и лечат пневмонию и диарею в более чем 1800 сообществах (ВОЗ 2004b).
В Бангладеш Комитет по развитию сельских районов Бангладеш и правительство внедрили программу борьбы с ОРИ, охватывающую 10 подрайонов, с привлечением добровольцев из местных медицинских работников. Каждый работник отвечает за лечение детской пневмонии примерно в 100–120 домашних хозяйствах после трехдневной программы обучения.
- В Непале в 1986–89 гг. Общинная программа лечения ОРИ и диарейных заболеваний была опробована в двух округах и показала существенное снижение смертности от LRI (Pandey and others 1989, 1991). В результате программа была интегрирована в службы здравоохранения Непала и реализуется в 17 из 75 округов страны женщинами-добровольцами, обученными выявлять и лечить пневмонию.
- В Пакистане в программе Lady Health Worker Program работает около 70 000 женщин, которые работают в общинах, обеспечивая образование и ведение детской пневмонии более чем 30 миллионам человек (ВОЗ 2004b).
Программа научных исследований и разработок
Программа исследований и разработок, изложенная ниже, суммирует приоритеты, установленные консультативными группами Инициативы по исследованиям вакцин (стратегии вмешательства в отношении вакцин) и Отдела ВОЗ по охране здоровья детей и подростков (случай- стратегии управления).
Стратегии вакцинации
Целевая группа ГАВИ по иммунизации против Hib дала ряд рекомендаций, которые различаются в зависимости от страны.Страны, внедрившие вакцину против Hib, должны сосредоточиться на документировании ее эффекта и должны использовать данные для информирования национальных органов власти, партнеров по развитию и других учреждений, занимающихся общественным здравоохранением, для обеспечения постоянной поддержки таких программ вакцинации. Страны, имеющие право на поддержку ГАВИ, которые еще не внедрили вакцины против Hib, часто сталкиваются с ограничениями из-за отсутствия местных данных и недостаточной осведомленности о региональных данных. Они могут решать эти вопросы на субрегиональных встречах, на которых страновые эксперты могут объединять данные и анализировать информацию из других стран.Кроме того, большинству стран необходимо проводить экономический анализ, основанный на стандартизированном инструменте. Наконец, всем странам, которые сталкиваются с высоким бременем Hib-инфекции, необходимо создать лабораторное оборудование, чтобы они могли определять заболеваемость Hib-менингитом в выбранных местах. Страны, в которых бремя болезни остается неясным, могут иметь ограниченные возможности для документирования случаев заболевания Hib с использованием протоколов, основанных на эпиднадзоре за инвазивным менингитом. Им необходимо будет изучить возможности использования альтернативных методов измерения бремени болезней, включая использование исследований вакцины.
Основываясь на опыте внедрения вакцин против Hib и гепатита B, ГАВИ проявил инициативу и в 2003 году на базе Школы общественного здравоохранения Джона Хопкинса в Балтиморе учредил инициативу по реализации программы ускоренной разработки и внедрения пневмококковых вакцин ( PneumoADIP; см. Http://www.preventpneumonia.org). Целью программы является установление и информирование о ценности пневмококковых вакцин и поддержка их доставки. Установление ценности вакцины требует разработки местных данных о бремени болезни и потенциальном воздействии вакцины на здоровье населения.Эти усилия могут быть достигнуты за счет усиленного эпиднадзора за болезнями и соответствующих клинических испытаний в выбранном количестве ведущих стран. После создания доказательная база будет передана лицам, принимающим решения, и ключевым лидерам общественного мнения, чтобы гарантировать принятие решений на основе данных. После того, как будет установлена рентабельность плановой вакцинации, необходимо будет создать системы доставки, и странам потребуется финансовая поддержка, чтобы вакцины могли быть включены в их программы иммунизации.Эти мероприятия начинаются до выпуска вакцин, предназначенных для использования в развивающихся странах, чтобы информировать о планировании потенциала, доступности продуктов и ценообразовании.
Стратегии ведения случаев
В 2003 г. Отдел здоровья детей и подростков ВОЗ созвал совещание для обзора данных и доказательств недавних исследований лечения ОРИ и предложения следующих изменений в руководящие принципы ведения случаев и приоритеты будущих исследований:
- Нетяжелая пневмония:
Повышение специфичности клинических диагностических критериев.
Пересмотреть текущие рекомендуемые ВОЗ критерии для выявления и лечения неудач лечения с учетом высоких показателей неудач терапии.
Проведите повторный анализ данных краткосрочных курсов терапии, чтобы лучше определить факторы, определяющие неэффективность лечения.
Провести плацебо-контролируемые испытания среди детей с хрипом и пневмонией в выбранных условиях с высокой распространенностью хрипов, чтобы определить, нуждаются ли такие дети в антибиотиках.
- Тяжелая пневмония. В рандомизированном клиническом исследовании в контролируемой среде Аддо-Йобо и другие (2004) показали, что пероральный амоксициллин так же эффективен, как парентеральный пенициллин или ампициллин; тем не менее, прежде чем его можно будет рекомендовать в целом, необходимо предпринять следующие действия:
Проанализировать данные об исключениях из исследования.
Определите предикторы, которые могут помочь отличить детей, нуждающихся в госпитализации и у которых впоследствии ухудшается состояние.
Переоценить текущие рекомендованные ВОЗ критерии неэффективности лечения тяжелой пневмонии, учитывая в целом высокие показатели неудач терапии.
Провести описательные исследования в условиях общественного здравоохранения в нескольких центрах по всему миру, чтобы оценить клинические результаты перорального приема амоксициллина у детей в возрасте от 2 до 59 месяцев, у которых наблюдается втягивание нижней грудной стенки.
Задокументировать эффективность руководящих принципов ВОЗ по лечению детей с пневмонией и ВИЧ-инфекцией.
- Смертей от LRI:
Чтобы помочь разработать более эффективные меры по снижению смертности от LRI, подробно изучите эпидемиологию смертей от LRI в различных регионах, используя рутинные и передовые лабораторные методы.
- Кислородная терапия:
Проведите исследования, чтобы показать эффективность кислорода для лечения тяжелых респираторных инфекций.
Соберите базовую информацию о наличии и доставке кислорода и его использовании в больницах в странах с низким уровнем дохода.
Изучите возможности пульсоксиметрии для оптимизации кислородной терапии в различных клинических условиях.
Проведение исследований для улучшения специфичности клинических признаков при наложении признаков и симптомов малярии и пневмонии.
Изучите быстрые диагностические тесты на малярию, чтобы оценить их эффективность в различении малярии и пневмонии.
Изучить влияние широкого применения котримоксазола на устойчивость к сульфадоксин-пириметамину к Plasmodium falciparum .
Этиология: Данные об этиологии пневмонии у детей несколько устарели, и необходимы новые этиологические исследования, в которых используются современные технологии для идентификации патогенов.
Выводы: обещания и ловушки
Фактические данные ясно показывают, что подход ВОЗ к ведению больных и более широкое использование имеющихся вакцин снизят смертность от ОРИ среди детей младшего возраста от половины до двух третей. Само по себе систематическое применение упрощенного ведения больных, стоимость которого достаточно низка, чтобы быть доступным практически для любой развивающейся страны, снизит смертность от ОРИ как минимум на треть.Срочно необходимо воплотить эту информацию в жизнь.
Стратегия ведения случая должна применяться и проспективно оцениваться, чтобы возникающие проблемы устойчивости к противомикробным препаратам, снижение эффективности текущего лечения рекомендованными противомикробными препаратами или появление неожиданных патогенов могли быть обнаружены на ранней стадии и чтобы можно было быстро принять меры по исправлению положения. Если действия медицинских работников на уровне сообществ будут дополнены внедрением стратегии ИВБДВ на всех уровнях первичной медико-санитарной помощи, то применять и оценивать эту стратегию будет проще.Такая синергия также может помочь в сборе информации, которая поможет в дальнейшей точной настройке клинических признаков, чтобы даже сельские медицинские работники могли лучше отличить бронхиолит и хрипы от бактериальной пневмонии. Критике того, что меры по ведению пациентов могут привести к чрезмерному использованию противомикробных препаратов, следует противодействовать путем документирования их чрезмерного и неправильного использования врачами и другими медицинскими работниками. Хотя наблюдается возрождение интереса к проведению вмешательств на уровне сообществ, наш анализ показывает, что это может оказаться нерентабельным.Действительно, ведение случаев ОРИ в учреждении первого уровня все еще может быть наиболее рентабельным в сочетании с более эффективными поведенческими вмешательствами, связанными с обращением за медицинской помощью.
Международное медицинское сообщество только начинает осознавать потенциальные преимущества вакцин против Hib и пневмококка. В настоящее время они дороги по сравнению с вакцинами Расширенной программы иммунизации, но цена вакцины Hib может упасть с выходом на рынок большего числа производителей в ближайшие несколько лет. Тем не менее, убедительные доказательства экономической эффективности вакцин необходимы для облегчения принятия национальных решений по внедрению вакцины и ее устойчивому использованию.В странах с низким уровнем дохода одних только положительных соотношений затрат и выгод и экономической эффективности оказывается недостаточно для включения этих вакцин в национальные программы иммунизации.
Ссылки
- Аддо-Йобо Э., Чисака Н., Хассан М., Хибберд П., Лозано Дж. М., Джина П. и др. Пероральный амоксициллин по сравнению с инъекционным пенициллином при тяжелой пневмонии у детей в возрасте от 3 до 59 месяцев: рандомизированное многоцентровое исследование эквивалентности. Ланцет. 2004. 364 (9440): 1141–48. [PubMed: 15451221]
- Адегбола Р.A., Falade A. G., Sam B. E., Aidoo M., Baldeh I., Hazlett D. et al. Этиология пневмонии у недоедающих и хорошо питающихся детей Гамбии. Журнал детских инфекционных болезней. 1994. 13 (11): 975–82. [PubMed: 7845751]
- Адегбола Р. А., Усен С. О., Вебер М., Ллойд-Эванс Н., Джоб К., Малхолланд К. и др. Haemophilus influenzae Менингит типа B в Гамбии после введения конъюгированной вакцины. Ланцет. 1999; 354 (9184): 1091–92. [PubMed: 10509502]
Агилар, А.М., Р. Альварадо, Д. Кордеро, П. Келли, А. Замора и Р. Сальгадо. 1998 г. Обследование смертности в Боливии: окончательный отчет — исследование и определение причин смерти детей в возрасте до пяти лет . Вена, Вирджиния: Базовая поддержка проекта институционализации выживания детей.
- Берман С. Средний отит у детей. Медицинский журнал Новой Англии. 1995a; 332 (23): 1560–65. [PubMed: 7739711]
- ———. 1995b Отитные средства в педиатрии развивающихся стран 961, часть 1126–31. [PubMed: 7596700]
Бхаттачарья, К., П. Винч, К. ЛеБан и М. Тьен. 2001. «Стимулы и сдерживающие факторы для работников здравоохранения в сообществе: как они влияют на мотивацию, удержание и устойчивость». Basic Support for Institutionalizing Child Survival Project Агентства США по международному развитию, Арлингтон, Вирджиния.
- Блэк Р. Э., Моррис С. С., Брайс Дж. Где и почему 10 миллионов детей умирают каждый год? Ланцет. 2003. 361 (9376): 2226–34. [PubMed: 12842379]
- Блэк С. Б., Шайнфилд Х. Р., Файерман Б., Льюис Э., Рэй П., Хансен Дж. Р. Группа Центра изучения вакцин Kaiser Permanente Северной Калифорнии. Эффективность, безопасность и иммуногенность гептавалентной пневмококковой конъюгированной вакцины у детей. Журнал детских инфекционных болезней. 2000. 19 (3): 187–95. [PubMed: 10749457]
- Блэк С. Б., Шайнфилд Х. Р., Файерман Б., Хиатт Р. Безопасность, иммуногенность и эффективность олигосахаридного конъюгата у младенцев Haemophilus influenzae Вакцина типа B для населения США: возможные последствия для оптимального использования.Журнал инфекционных болезней. 1992; 165 (Приложение 43): S139–43. [PubMed: 1588149]
- Блэк С. Б., Шайнфилд Х. Р., Хансен Дж., Элвин Л., Лауфер Д., Малиноски Ф. Постлицензионная оценка эффективности семивалентной пневмококковой конъюгированной вакцины. Журнал детских инфекционных болезней. 2001. 20 (12): 1105–7. [PubMed: 11740313]
- Бобат Р., Кувадия Х. М., Мудли Д., Коутсудис А. Смертность в когорте детей, рожденных ВИЧ-1 инфицированными женщинами из Дурбана, Южная Африка. Южноафриканский медицинский журнал.1999. 89 (6): 646–48. [PubMed: 10443216]
- Booy R., Hodgson S., Carpenter L., Mayon-White R. T., Slack M. P., Macfarlane J. A. et al. Эффективность Haemophilus influenzae PRP-T конъюгированной вакцины типа B. Ланцет. 1994. 344 (8919): 362–66. [PubMed: 7 6]
- Брайс Дж., Боски-Пинто К., Сибуя К., Блэк Р. Э. Справочная группа ВОЗ по эпидемиологии здоровья детей. . Оценки ВОЗ причин смерти у детей. Ланцет. 2005; 365: 1147–52. [PubMed: 15794969]
- Кэмпбелл Х., Армстронг Дж. Р. М., Байасс П. Загрязнение воздуха в помещениях в развивающихся странах и острая респираторная инфекция у детей. Ланцет. 1989; 1 (8645): 1012. [PubMed: 2565480]
- Кэмпбелл Х., Байасс П., Ламонт А. С., Форги И. М., О’Нил К. П., Ллойд-Эанс Н., Гринвуд Б. М. Оценка клинических критериев для выявления тяжелых острых инфекций нижних дыхательных путей у детей. Ланцет. 1989; 1 (8633): 297–99. [PubMed: 2563457]
- Группа изучения догоняющих событий. Клиническая эффективность ко-тримоксазола по сравнению с амоксициллином дважды в день для лечения пневмонии: рандомизированное контролируемое клиническое испытание в Пакистане.Архив болезней детства. 2002; 86: 113–18. [Бесплатная статья PMC: PMC1761064] [PubMed: 11827905]
- Cherian T., John T. J., Simoes E. A., Steinhoff M. C., John M. Оценка простых клинических признаков для диагностики острой инфекции нижних дыхательных путей. Ланцет. 1988. 2: 125–28. [PubMed: 2899187]
- Cherian T., Simoes E. A., Steinhoff M. C., Chitra K., John M., Raghupathy P. et al. Бронхиолит в тропической южной Индии. Американский журнал болезней детей. 1990. 144 (9): 1026–30.[PubMed: 2396617]
- Каттс Ф. Т., Заман С. М. А., Энвере Г., Джаффар С., Левин О. С., Ококо Дж. Б. и др. Эффективность девятивалентной пневмококковой конъюгированной вакцины против пневмонии и инвазивного пневмококкового заболевания в Гамбии: рандомизированное, двойное слепое, плацебо-контролируемое исследование. Ланцет. 2005; 365 (9465): 1139–46. [PubMed: 15794968]
- де Андраде А. Л., де Андраде Дж. Г., Мартелли К. М., Сильва С. А., де Оливейра Р. М., Коста М. С. и др. Эффективность конъюгированной вакцины Haemophilus influenzae B при детской пневмонии: исследование случай-контроль в Бразилии.Международный журнал эпидемиологии. 2004. 33 (1): 173–81. [PubMed: 15075166]
- Денни Ф. У. мл. Клиническое влияние респираторных вирусных инфекций человека. Американский журнал респираторной медицины и реанимации. 1995; 152 (4, часть 2): S4–12. [PubMed: 7551411]
- Dobson M. Концентраторы кислорода обеспечивают экономию средств для развивающихся стран: исследование, основанное на Новой Гвинее. Анестезия. 1991; 146: 217–19. [PubMed: 2014901]
- Дуглас Р. М., Майлз Х. Б. Вакцинация против Streptococcus pneumoniae в детстве: отсутствие очевидной пользы для маленьких австралийских детей.Журнал инфекционных болезней. 1984. 149 (6): 861–69. [PubMed: 6376653]
- Duke T, Mgone J., Frank D. Гипоксемия у детей с тяжелой пневмонией в Папуа-Новой Гвинее. Международный журнал туберкулеза и болезней легких. 2001; 5: 511–19. [PubMed: 11409576]
- Эскола Дж., Кайхти Х., Такала А. К., Пелтола Х., Роннберг П. Р., Кела Э. и др. Рандомизированное проспективное полевое испытание конъюгированной вакцины для защиты младенцев и детей младшего возраста от инвазивной болезни Haemophilus influenzae типа B.Медицинский журнал Новой Англии. 1990. 323 (20): 1381–87. [PubMed: 2233904]
- Eskola J., Kilpi T., Palmu A., Jokinen J., Haapakoski J., Herva E. et al. Эффективность пневмококковой конъюгированной вакцины против острого среднего отита. Медицинский журнал Новой Англии. 2001. 344 (6): 403–9. [PubMed: 11172176]
- Фарли Дж., Кинг Дж. К., Наир П., Хайнс С. Э., Трессьер Р. Л., Винк П. Э. Инвазивное пневмококковое заболевание среди инфицированных и неинфицированных детей матерей с инфекцией, вызванной вирусом иммунодефицита человека.Журнал педиатрии. 1994; 124: 853–58. [PubMed: 8201466]
- Фиддиан-Грин Р. Г., Бейкер С. Нозокомиальная пневмония у критически больных: продукт аспирации или перемещения? Реанимационная медицина. 1991; 19: 763–69. [PubMed: 2055052]
- Файерман Б., Блэк С. Б., Шайнфилд Х. Р., Ли Дж., Льюис Э., Рэй П. Воздействие пневмококковой конъюгированной вакцины на средний отит. Журнал детских инфекционных болезней. 2003. 22 (1): 10–16. [PubMed: 12544402]
- Фритцелл Б., Плоткин С. Эффективность и безопасность вакцины, конъюгированной с капсульным полисахаридом столбняка и белком столбняка, Haemophilus influenzae.Журнал педиатрии. 1992. 121 (3): 355–62. [PubMed: 1517908]
- Гесснер Б. Д., Сутанто А., Линехан М., Джелантик И. Г., Флетчер Т., Герудуг И. К. и др. Заболеваемость гемофильной пневмонией и менингитом, предотвращаемым вакцинацией, Haemophilus Influenzae у индонезийских детей: рандомизированное исследование вакцины Hamlet. Ланцет. 2005; 365 (9453): 43–52. [PubMed: 15643700]
- Гафур А., Номани Н. К., Исхак З., Заиди С. З., Анвар Ф., Берни М. И. и др. Диагностика острых инфекций нижних дыхательных путей у детей в Равалпинди и Исламабаде, Пакистан.Обзоры инфекционных болезней. 1990; 12 (Приложение 8): S907–14. [PubMed: 2270413]
- Гилкс К. Ф. Пневмококковая болезнь и ВИЧ-инфекция. Анналы внутренней медицины. 1993; 118: 393–94. [PubMed: 8430986]
- Гоэль А., Бэмфорд Л., Хансло Д., Хасси Г. Первичная стафилококковая пневмония у детей раннего возраста: обзор 100 случаев. Журнал тропической педиатрии. 1999. 45 (4): 233–36. [PubMed: 10467836]
- Хемент Дж. М., Аэртс П. К., Флир А., Ван Дейк Х., Хармсен Т., Кимпен Дж. Л., Вольфс Т.F. Повышенная адгезия Streptococcus pneumoniae к эпителиальным клеткам человека, инфицированным респираторно-синцитиальным вирусом. Педиатрические исследования. 2004. 55 (6): 972–78. [PubMed: 15103015]
- Heath P. T. Haemophilus influenzae Конъюгированные вакцины типа B: обзор данных об эффективности. Журнал детских инфекционных болезней. 1998. 17 (9 доп.): S117–22. [PubMed: 9781743]
- Hortal M., Mogdasy C., Russi J. C., Deleon C., Suarez A. Микробные агенты, ассоциированные с пневмонией у детей из Уругвая.Обзоры инфекционных болезней. 1990; 12 (Приложение 8): S915–22. [PubMed: 2270414]
- Икеогу М. О., Вольф Б., Мате С. Легочные проявления у ВИЧ-серопозитивных и недоедающих детей в Зимбабве. Архив болезней детства. 1997. 76: 124–28. [Бесплатная статья PMC: PMC1717076] [PubMed:
- 01]
- Джина П. М., Кувадия Х. М., Кристал В. Pneumocystis carinii и cytomegalo Вирусные инфекции у тяжелобольных ВИЧ-инфицированных африканских младенцев. Анналы тропической педиатрии.1996; 16: 361–68. [PubMed: 8985536]
- Цзян З., Нагата Н., Молина Э., Бакалетз Л. О., Хокинс Х., Патель Дж. А. Усиленное прикрепление нетипируемого Haemophilus influenzae , инфицированного респираторно-синцитиальным вирусом, к респираторным эпителиальным клеткам, инфицированным синцитиальным вирусом. Инфекция и иммунитет. 1999; 67: 187–92. [Бесплатная статья PMC: PMC96295] [PubMed: 9864214]
Джон Т. Дж. 1994. «Кто определяет национальную политику здравоохранения?» In Вакцинация и здоровье в мире: четвертый ежегодный форум общественного здравоохранения Лондонской школы гигиены и тропической медицины , изд.Каттс Ф. Т., Смит П. Г., 205–11. Чичестер, Великобритания: Джон Вили.
- Джон Т. Дж., Чериан Т., Стейнхофф М. К., Симоэс Э. А., Джон М. Этиология острых респираторных инфекций у детей в тропиках на юге Индии. Обзоры инфекционных болезней. 1991; 13 (Приложение 6): S463–69. [PubMed: 1862277]
- Камат К. Р., Фельдман Р. А., Рао П. С., Уэбб Дж. К. Инфекция и болезнь в группе южноиндийских семей. Американский журнал эпидемиологии. 1969; 89: 375–83. [PubMed: 5778926]
- Карма П., Луотонен Дж., Тимонен М., Понтинен С., Пукандер Дж., Херва Э. и др. Эффективность пневмококковой вакцины против рецидивирующего среднего отита: предварительные результаты полевых испытаний в Финляндии. Annals of Otology, Rhinology, and Laryngology Suppl. 1980. 89 (3, часть 2): 357–62. [PubMed: 6778346]
Картасасмита, С. 2003. «Пероральный котримоксазол три или пять дней при нетяжелой пневмонии». Документ представлен на Консультативном совещании Всемирной организации здравоохранения по обзору текущих исследований и лечению острых респираторных инфекций, Женева, 29 сентября — 1 октября.
- Килпи Т., Ахман Х., Йокинен Дж., Ланкинен К. С., Палму А., Саволайнен Х. и др. Защитная эффективность второй пневмококковой конъюгированной вакцины против пневмококкового острого среднего отита у младенцев и детей: рандомизированное контролируемое испытание семивалентной конъюгированной вакцины комплексный пневмококковый полисахарид-менингококковый белок-белок внешней мембраны у 1666 детей. Клинические инфекционные болезни. 2003. 37 (9): 1155–64. [PubMed: 14557958]
- Клугман К. П., Мадхи С. А., Хюбнер Р.E., Kohberger R., Mbelle N., Pierce N. et al. Испытание пневмококковой конъюгированной вакцины 9-Valent у детей с ВИЧ-инфекцией и без нее. Медицинский журнал Новой Англии. 2003. 349 (14): 1341–48. [PubMed: 14523142]
- Колстад П. Р., Бернем Г., Калтер Х. Д., Кения-Мугиша Н., Блэк Р. Э. Комплексное ведение детских болезней в Западной Уганде. Бюллетень Всемирной организации здравоохранения. 1997; 75 (Приложение 1): 77–85. [Бесплатная статья PMC: PMC2486998] [PubMed: 9529720]
- Lagos R., Хорвиц И., Торо Дж., Сан Мартин О., Абрего П., Бустаманте С. и др. Масштабная, постлицензионная, селективная вакцинация чилийских младенцев конъюгированной вакциной PRP-T: практичность и эффективность в предотвращении инвазивных инфекций Haemophilus influenzae типа B. Журнал детских инфекционных болезней. 1996; 15: 216–22. [PubMed: 8852909]
- Леманн Д., Маршалл Т. Ф., Райли И. Д., Альперс М. П. Влияние пневмококковой вакцины на заболеваемость острыми инфекциями нижних дыхательных путей у детей Папуа-Новой Гвинеи.Анналы тропической педиатрии. 1991. 11 (3): 247–57. [PubMed: 1719924]
- Левин О. С., Лагос Р., Муньос А., Вильяроэль Дж., Альварес А. М., Абрего П. и др. Определение бремени пневмонии у детей, которую можно предотвратить с помощью вакцинации против Haemophilus influenzae Тип B. Журнал детских инфекционных болезней. 1999. 18 (12): 1060–64. [PubMed: 10608624]
- Лукас С. Б., Пикок С. С., Хунноу А., Браттегаард К., Коффи К., Хонд М. и др. Заболевание у детей, инфицированных ВИЧ в Абиджане, Кот-д’Ивуар.Британский медицинский журнал. 1996; 312: 335–38. [Бесплатная статья PMC: PMC2350283] [PubMed: 8611829]
- Мадхи С.А., Петерсен К., Мадхи А., Хосал М., Клугман К.П. Повышенное бремя болезней и устойчивость бактерий к антибиотикам, вызывающая тяжелые инфекции нижних дыхательных путей, приобретенные в сообществе Дети, инфицированные вирусом иммунодефицита человека 1. Клинические инфекционные болезни. 2000. 31: 170–76. [PubMed: 10
- 7]
- Мадхи С. А., Петерсен К., Мадхи А., Васас А., Клугман К. П.Влияние вируса иммунодефицита человека типа 1 на спектр заболеваний Streptococcus pneumoniae у детей Южной Африки. Журнал детских инфекционных болезней. 2000. 19 (12): 1141–47. [PubMed: 11144373]
- Макела П. Х., Сибаков М., Херва Э., Хенрихсен Дж., Луотонен Дж., Тимонен М. и др. Пневмококковая вакцина и средний отит. Ланцет. 1980; 2 (8194): 547–51. [PubMed: 6106735]
Управленческие науки для здравоохранения. 2005. Международный справочник по индикаторам цен на лекарства .Кембридж, Массачусетс: Управленческие науки для здоровья.
- МакКуллерс Дж. А., Бартмесс К. С. Роль нейраминидазы в летальном синергизме между вирусом гриппа и Streptococcus pneumoniae . Журнал инфекционных болезней. 2003. 187: 1000–9. [PubMed: 12660947]
- Монто А. С., Ульман Б. М. Острое респираторное заболевание в американском сообществе: исследование Текумсе. Журнал Американской медицинской ассоциации. 1974. 227 (2): 164–69. [PubMed: 4357298]
- Малхолланд К., Усен С., Адегбола Р., Использование Вебером пневмококковой полисахаридной вакцины у детей. Ланцет. 1998. 352 (9127): 575–76. [PubMed: 9716087]
- Малхолланд Э. К., Симоэс Э. А., Касталес М. О., МакГрат Э. Дж., Маналак Э. М., Гоув С. Стандартизированная диагностика пневмонии в развивающихся странах. Журнал детских инфекционных болезней. 1992; 11: 77–81. [PubMed: 1741202]
- Малхолланд К., Хилтон С., Адегбола Р., Усен С., Опарауго А., Омосиго С. и др. Рандомизированное исследование Haemophilus influenzae вакцины конъюгированной против столбняка с белком типа B для профилактики пневмонии и менингита у младенцев в Гамбии.Ланцет. 1997. 349 (9060): 1191–97. [PubMed:
- 39]
- Натху К. Дж., Нкрума Ф. К., Ндлову Д., Нхембе Д., Пири Дж., Ково Х. Острая инфекция нижних дыхательных путей у госпитализированных детей в Зимбабве. Анналы тропической педиатрии. 1993; 13: 253–61. [PubMed: 7505550]
- Нойзил К. М., Чжу Ю., Гриффин М. Р., Эдвардс К. М., Томпсон Дж. М., Толлефсон С. Дж., Райт П. Ф. Бремя межпандемического гриппа у детей младше 5 лет: 25-летнее перспективное исследование. Журнал инфекционных болезней.2002; 185: 147–52. [PubMed: 11807687]
- Nolan T., Angos P., Cunha A. J., Muhe L., Qazi S., Simoes E. A. et al. Качество стационарной помощи тяжелобольным детям в менее развитых странах. Ланцет. 2001. 357 (9250): 106–10. [PubMed: 11197397]
- Обаро С., Лич А., Макадам К. В. Использование пневмококковой полисахаридной вакцины у детей. Ланцет. 1998; 352 (9127): 575. [PubMed: 9716086]
- О’Брайен К. Л., Моултон Л. Х., Рид Р., Уэзерхольц Р., Оски Дж., Браун Л. и др. Эффективность и безопасность семивалентной конъюгированной пневмококковой вакцины у детей американских индейцев: групповое рандомизированное исследование.Ланцет. 2003. 362 (9381): 355–61. [PubMed: 12 8]
- Оньянго Ф. Э., Стейнхофф М. С., Вафула Э. М., Вариуа С., Мусиа Дж., Китони Дж. Гипоксемия у маленьких кенийских детей с острой инфекцией нижних дыхательных путей. Британский медицинский журнал. 1993. 306 (6878): 612–15. [Бесплатная статья PMC: PMC1676956] [PubMed: 8369033]
- Пандей М. Р., Даулер Н. М., Старбак Э. С., Хьюстон Р. М., Макферсон К. Снижение общей смертности детей в возрасте до пяти лет в Западном Непале с помощью противомикробного лечения пневмонии на уровне местных сообществ.Ланцет. 1991. 338 (8773): 993–97. [PubMed: 1681351]
- Пандей М. Р., Шарма П. Р., Губхаджу Б. Б., Шакья Г. М., Неупане Р. П., Гаутам А. и др. Воздействие пилотной программы борьбы с острыми респираторными инфекциями (ОРИ) в сельском сообществе Горного региона Непала. Анналы тропической педиатрии. 1989. 9 (4): 212–20. [PubMed: 2482002]
- Педерсон Дж., Найроп М. Анестезиологическое оборудование для развивающихся стран. Британский журнал анестезии. 1991; 66: 264–70. [PubMed: 1817634]
- Пейрис Дж.S., Yu W. C., Leung C. W., Cheung C. Y., Ng W. F., Nicholls J. M. et al. Повторное появление заболевания подтипа H5N1 гриппа человека со смертельным исходом. Ланцет. 2004; 363 (9409): 617–19. [Бесплатная статья PMC: PMC7112424] [PubMed: 14987888]
- Перкинс Б. А., Цукер Дж. Р., Отинео Дж., Джафари Х. С., Пакстон Л., Редд С. С. и др. Оценка алгоритма интегрированного ведения детских болезней в районе Кении с высоким уровнем передачи малярии. Бюллетень Всемирной организации здравоохранения. 1997; 75 (Приложение 1): 33–42.[Бесплатная статья PMC: PMC2487004] [PubMed: 9529716]
Киамбао, Б. П., Э. А. Симоес, Э. Абучехо-Ладесма, Л. С. Гозум, С. П. Луписан, Л. Т. Сомбреро и П. Дж. Рууту (Консорциум ARIVAC). Скоро. «Серьезные детские инфекции, приобретенные в сообществе, в сельских районах Азии (остров Бохол, Филиппины)». Журнал детских инфекционных болезней .
Редд С. Диагностика и лечение острых респираторных инфекций в Лесото. Политика и управление здравоохранением. 1994; 5: 255–60.
- Райли И. Д., Эверингем Ф. А., Смит Д. Э., Дуглас Р. М. Иммунизация поливалентной пневмококковой вакциной: влияние респираторной смертности у детей, живущих в Высокогорье Новой Гвинеи. Архив болезней детства. 1981. 56 (5): 354–57. [Бесплатная статья PMC: PMC1627425] [PubMed: 7020609]
- Райли И. Д., Леманн Д., Альперс М. П. Испытания пневмококковой вакцины в Папуа-Новой Гвинее: взаимосвязь между эпидемиологией пневмококковой инфекции и эффективностью вакцины. Обзоры инфекционных болезней.1991; 13 (Приложение 6): S535–41. [PubMed: 1862283]
- Рудан И., Томаскович Л., Боски-Пинто К., Кэмпбелл Х. Справочная группа ВОЗ по эпидемиологии здоровья детей. Глобальная оценка заболеваемости клинической пневмонией среди детей в возрасте до пяти лет. Бюллетень Всемирной организации здравоохранения. 2004. 82 (12): 895–903. [Бесплатная статья PMC: PMC2623105] [PubMed: 15654403]
Рудан и другие. Скоро.
- Santosham M., Wolff M., Reid R., Hohenboken M., Bateman M., Goepp J.и другие. Эффективность конъюгированной вакцины, состоящей из Haemophilus influenzae типа B и Neisseria meningitidis Внешнемембранного белкового комплекса, у младенцев навахо. Медицинский журнал Новой Англии. 1991. 324 (25): 1767–72. [PubMed: 1
6]
- Сазавал С., Блэк Р. Э. Группа исследований по ведению больных с пневмонией: влияние ведения больных с пневмонией на смертность новорожденных, младенцев и детей дошкольного возраста — метаанализ испытаний на уровне сообществ. Ланцетные инфекционные болезни.2003; 3: 547–56. [PubMed: 12954560]
- Schellenberg J. A., Victora C.G., Mushi A., de Savigny D., Schellenberg D., Mshinda H. et al. Неравенство среди очень бедных: здравоохранение для детей в сельских районах Южной Танзании. Ланцет. 2003. 361 (9357): 561–66. [PubMed: 12598141]
- Шнайдер Г. Обеспечение кислородом в сельских районах Африки: личный опыт. Международный журнал туберкулеза и болезней легких. 2001. 5 (6): 524–26. [PubMed: 11409578]
Шумахер, Р., Э. Сведберг, М.О. Диалло, Д. Р. Кейта, Х. Кальтер, О. Паша. 2002. Исследование смертности в Гвинее: исследование причин смерти детей в возрасте до пяти лет . Арлингтон, Вирджиния: Спасите детей и базовая поддержка для институционализации проекта выживания детей.
- Шэнн Ф. Этиология тяжелой пневмонии у детей в развивающихся странах. Детская инфекционная болезнь. 1986. 5 (2): 247–52. [PubMed: 3952013]
- Шенн Ф., Граттен М., Гермер С., Линнеманн В., Хазлетт Д., Пейн Р. Этиология пневмонии у детей в больнице Горока, Папуа-Новая Гвинея.Ланцет. 1984. 2 (8402): 537–41. [PubMed: 6147602]
- Шенн Ф., Харт К., Томас Д. Острые инфекции нижних дыхательных путей у детей: возможные критерии выбора пациентов для антибактериальной терапии и госпитализации. Бюллетень Всемирной организации здравоохранения. 1984; 62: 749–51. [Бесплатная статья PMC: PMC2536213] [PubMed: 6334573]
- Simoes E. A. Респираторно-синцитиальная вирусная инфекция. Ланцет. 1999. 354 (9181): 847–52. [PubMed: 10485741]
- Симоэс Э. А., Деста Т., Тессема Т., Gerbresellassie T., Dagnew M., Gove S. Эффективность медицинских работников после обучения комплексному ведению детских болезней в Гондаре, Эфиопия. Бюллетень Всемирной организации здравоохранения. 1997; 75 (Приложение 1): 43–53. [Бесплатная статья PMC: PMC2487005] [PubMed: 9529717]
- Слойер Дж. Л. Дж., Плуссард Дж. Х., Хоуи В. М. Эффективность пневмококковой полисахаридной вакцины в предотвращении острого среднего отита у младенцев в Хантсвилле, Алабама. Обзоры инфекционных болезней. 1981; 3 (Прил.): S119–23. [PubMed: 7280444]
- Стенсбаль Л.Г., Девасундарам Дж. К., Симоэс Э. А. Эпидемии респираторно-синцитиального вируса: взлеты и падения сезонного вируса. Журнал детских инфекционных болезней. 2003; 22 (2 доп.): S21–32. [PubMed: 12671449]
- Штраус В. Л., Кази С. А., Кунди З., Номани Н. К., Шварц Б. Группа по изучению ко-тримоксазола. Устойчивость к противомикробным препаратам и клиническая эффективность ко-тримоксазола по сравнению с амоксициллином при пневмонии у детей в Пакистане: рандомизированное контролируемое исследование. Ланцет. 1998. 352: 270–74. [PubMed: 96]
- Темпл К., Гринвуд Б., Инскип Х., Холл А., Коскела М., Лейнонен М. Ответ антител на пневмококковую капсульную полисахаридную вакцину у африканских детей. Журнал детских инфекционных болезней. 1991. 10 (5): 386–90. [PubMed: 2067888]
- Тупаси Т. Э., Лусеро М. Г., Магдангал Д. М., Мангубат Н. В., Сунико М. Э., Торрес К. У. и др. Этиология острой инфекции нижних дыхательных путей у детей из Алабанга, Метро Манила. Обзоры инфекционных болезней. 1990; 12 (Приложение 8): S929–39. [PubMed: 2270415]
ЮНЭЙДС (Объединенная программа Организации Объединенных Наций по ВИЧ / СПИДу).2002. Обновление эпидемии СПИДа . Женева: ЮНЭЙДС.
- Усен С., Вебер М., Малхолланд К., Джаффар С., Опарауго А., Омосиго С. и др. Клинические предикторы гипоксемии у детей Гамбии с острой инфекцией нижних дыхательных путей: проспективное когортное исследование. Британский медицинский журнал. 1999. 318 (7176): 86–91. [Бесплатная статья PMC: PMC27680] [PubMed: 9880280]
- Van den Hoogen BG, de Jong JC, Groen J., Kuiken T., de Groot R., Fouchier RA, Osterhaus AD Недавно обнаруженный человеческий пневмовирус, выделенный у детей раннего возраста при заболевании дыхательных путей.Природная медицина. 2001; 7: 719–24. [Бесплатная статья PMC: PMC7095854] [PubMed: 11385510]
- Вуори-Холопайнен Э., Пелтола Х. Переоценка легочного легочного: обзор старого метода для лучшей этиологической диагностики детской пневмонии. Клинические инфекционные болезни. 2001. 32 (5): 715–26. [PubMed: 11229839]
- Вебер М. В., Малхолланд Э. К., Джаффар С., Трёдссон Х., Гоув С., Гринвуд Б. М. Оценка алгоритма комплексного ведения детских болезней в районе с сезонной малярией в Гамбии.Бюллетень Всемирной организации здравоохранения. 1997; 75 (Приложение 1): 25–32. [Бесплатная статья PMC: PMC2486992] [PubMed: 9529715]
- Венгер Дж. Д., ДиФабио Дж., Ландаверде Дж. М., Левин О.С., Гаафар Т. Внедрение конъюгированных вакцин против Hib-инфекции в непромышленных странах: опыт в четырех странах, которые «недавно приняли» . Вакцина. 1999. 18 (78): 736–42. [PubMed: 10547434]
Венгер, Дж. Д. и М. М. Левин, ред. 1997. Эпидемиологическое влияние конъюгированной вакцины на инвазивное заболевание, вызываемое гемофильной палочкой Haemophilus influenzae Тип B .Нью-Йорк: Марсель Деккер.
- Уитни К. Г., Фарли М. М., Хадлер Дж., Харрисон Л. Х., Беннетт Н. М., Линфилд Р. и др. Снижение инвазивного пневмококкового заболевания после введения протеин-полисахаридной конъюгированной вакцины. Медицинский журнал Новой Англии. 2003. 348 (18): 1737–46. [PubMed: 12724479]
ВОЗ (Всемирная организация здравоохранения). 1990. «Антибиотики в лечении острых респираторных инфекций у детей раннего возраста». Неопубликованный документ WHO / ARI / 90.10, доступный по запросу в Отделе здоровья и развития детей, бывшего Отдела борьбы с диарейными и острыми респираторными заболеваниями, ВОЗ, Женева.
———. 1991. «Ведение маленького ребенка с острой респираторной инфекцией. Модуль обучения навыкам супервизии». Неопубликованный документ, доступный по запросу в Отделе здоровья и развития детей ВОЗ, бывшем Отделении борьбы с диарейными и острыми респираторными заболеваниями, ВОЗ, Женева.
———. 2002. Многострановая оценка эффективности, затрат и воздействия ИВБДВ (MCE): отчет о ходе работы, май 2001 г. — апрель 2002 г. .WHO / FCH / CAH / 02.16. Женева: Отдел здоровья и развития детей и подростков, ВОЗ.
———. 2003. Консультативное совещание по ведению детей с пневмонией и ВИЧ-инфекцией, 30–31 января 2003 г., Хараре, Зимбабве . WHO / FCH / CAH / 03.4. Женева: ВОЗ.
- ———. 2004a Группа по обзору Haemophilus influenzae Бремя болезни типа B (Hib) в Бангладеш, Индонезия и других азиатских странах, Бангкок, 28–29 января 2004 г. Еженедельный эпидемиологический отчет 79 (18): 173–75.[PubMed: 15168565]
———. 2004b. «Совместное заявление ВОЗ / ЮНИСЕФ: ведение пневмонии в общественных местах». WHO / FCH / CAG / 04.06. ВОЗ, Женева.
ВОЗ (Всемирная организация здравоохранения) и здоровье детей-подростков. Скоро. Отчет о методологии и предположениях, использованных для оценки затрат на расширение отдельных мероприятий по охране здоровья детей до 95% с целью снижения смертности детей в возрасте до пяти лет . Женева: ВОЗ.
- Уильямс Б. Г., Гоус Э., Боски-Пинто К., Брайс Дж., Дай С. Оценки глобального распределения детской смертности от острых респираторных инфекций. Ланцетные инфекционные болезни. 2002; 2: 25–32. [PubMed: 11892493]
Всемирный банк. 2002. Показатели мирового развития . CD-ROM. Вашингтон, округ Колумбия: Всемирный банк.
- Цви К. Дж., Петтифиор Дж. М., Содерлунд Н. Педиатрическая больница при городской региональной больнице Южной Африки: влияние ВИЧ, 1992–1997. Анналы тропической педиатрии. 1999; 19: 135–42. [PubMed: 106]
Острые респираторные инфекции у детей — приоритеты борьбы с заболеваниями в развивающихся странах
Острые респираторные инфекции (ОРИ) классифицируются как инфекции верхних дыхательных путей (URI) или инфекции нижних дыхательных путей (LRIs).Верхние дыхательные пути состоят из дыхательных путей от ноздрей до голосовых связок в гортани, включая придаточные пазухи носа и среднее ухо. Нижние дыхательные пути покрывают продолжение дыхательных путей от трахеи и бронхов к бронхиолам и альвеолам. ОРИ не ограничиваются дыхательными путями и имеют системные эффекты из-за возможного распространения инфекции или микробных токсинов, воспаления и снижения функции легких. Дифтерия, коклюш (коклюш) и корь — это болезни, которые можно предотвратить с помощью вакцин, которые могут иметь компонент дыхательных путей, но также влияют на другие системы; они обсуждаются в главе 20.
За исключением неонатального периода, ОРИ являются наиболее частой причиной как болезней, так и смертности детей в возрасте до пяти лет, у которых в среднем от трех до шести эпизодов ОРИ ежегодно, независимо от того, где они живут или каково их экономическое положение (Kamath and others 1969; Монто и Ульман 1974). Однако соотношение легкой и тяжелой формы заболевания варьируется между странами с высоким и низким уровнем доходов, и из-за различий в конкретной этиологии и факторах риска тяжесть ИПП у детей в возрасте до пяти лет хуже в развивающихся странах, что приводит к более высокому уровню заболеваемости. летальность.Хотя медицинская помощь может до некоторой степени снизить как тяжесть заболевания, так и летальный исход, многие тяжелые ИПП не поддаются лечению, в основном из-за отсутствия высокоэффективных противовирусных препаратов. Ежегодно умирает около 10,8 миллиона детей (Black, Morris, and Bryce, 2003). По оценкам, в 2000 году 1,9 миллиона из них умерли от ОРИ, 70 процентов из них — в Африке и Юго-Восточной Азии (Williams and others 2002). По оценкам Всемирной организации здравоохранения (ВОЗ), 2 миллиона детей в возрасте до пяти лет умирают от пневмонии ежегодно (Bryce and others 2005).
Причины ОРИ и бремя болезней
ОРИ у детей серьезно уносят жизни, особенно там, где медицинская помощь недоступна или к ней не обращаются.
Инфекции верхних дыхательных путей
URI являются наиболее распространенными инфекционными заболеваниями. К ним относятся ринит (простуда), синусит, инфекции уха, острый фарингит или тонзиллофарингит, эпиглоттит и ларингит, из которых инфекции уха и фарингит вызывают более серьезные осложнения (глухота и острая ревматическая лихорадка соответственно).Подавляющее большинство URI имеют вирусную этиологию. Риновирусы составляют от 25 до 30 процентов URI; респираторно-синцитиальные вирусы (РСВ), вирусы парагриппа и гриппа, метапневмовирус человека и аденовирусы — от 25 до 35 процентов; вирусы короны на 10 процентов; и неопознанные вирусы для остальных (Denny 1995). Поскольку большинство URI являются самоограничивающимися, их осложнения более важны, чем инфекции. Острые вирусные инфекции предрасполагают детей к бактериальным инфекциям носовых пазух и среднего уха (Berman 1995a), а аспирация инфицированных секретов и клеток может привести к LRIs.
Острый фарингит
Острый фарингит у детей младшего возраста более чем в 70% случаев вызывается вирусами. Типичны легкое покраснение глотки, отек и увеличение миндалин. Стрептококковая инфекция редко встречается у детей до пяти лет и более часто встречается у детей старшего возраста. В странах с многолюдными условиями жизни и группами населения, которые могут иметь генетическую предрасположенность, постстрептококковые последствия, такие как острый ревматизм и кардит, распространены у детей школьного возраста, но могут также возникать у детей младше пяти лет.Острый фарингит в сочетании с развитием перепонки в горле почти всегда вызывается в развивающихся странах Corynebacterium diphtheriae . Однако при почти повсеместной вакцинации младенцев вакциной АКДС (дифтерия-столбняк-коклюш) дифтерия встречается редко.
Острая ушная инфекция
Острая ушная инфекция встречается у 30 процентов URI. В развивающихся странах с неадекватной медицинской помощью это может привести к перфорации барабанных перепонок и хроническим выделениям из уха в более позднем детстве и, в конечном итоге, к ухудшению слуха или глухоте (Berman 1995b).Хроническая ушная инфекция после повторных эпизодов острой ушной инфекции распространена в развивающихся странах, поражая от 2 до 6 процентов детей школьного возраста. Связанная с этим потеря слуха может приводить к инвалидности и влиять на обучение. Повторные ушные инфекции могут привести к мастоидиту, который, в свою очередь, может распространить инфекцию на мозговые оболочки. Мастоидит и другие осложнения, вызванные ОРВИ, являются причиной почти 5% всех смертей от ОРИ во всем мире (Williams и др., 2002).
Инфекции нижних дыхательных путей
Распространенными инфекциями нижних дыхательных путей у детей являются пневмония и бронхиолит.Частота дыхания является ценным клиническим признаком для диагностики острой ЛРН у кашляющих и учащенно дышащих детей. Наличие втягивания нижней грудной стенки указывает на более тяжелое заболевание (Mulholland и др., 1992; Shann, Hart, and Thomas 1984).
В настоящее время наиболее частыми причинами вирусных LRIs являются RSV. Они имеют тенденцию быть очень сезонными, в отличие от вирусов парагриппа, следующей наиболее частой причины вирусных LRI. Эпидемиология вирусов гриппа у детей в развивающихся странах заслуживает срочного исследования, поскольку доступны безопасные и эффективные вакцины.До эффективного использования противокоревой вакцины вирус кори был наиболее важной вирусной причиной заболеваемости и смертности детей, связанных с респираторными путями, в развивающихся странах.
Пневмония
И бактерии, и вирусы могут вызывать пневмонию. Бактериальная пневмония часто вызывается Streptococcus pneumoniae (пневмококк) или Haemophilus influenzae, в основном типом b (Hib) и иногда Staphylococcus aureus или другими стрептококками.Всего от 8 до 12 из множества типов пневмококка вызывают большинство случаев бактериальной пневмонии, хотя конкретные типы могут различаться у взрослых и детей и в разных географических регионах. Другие патогены, такие как Mycoplasma pneumoniae и Chlamydia pneumoniae, , вызывают атипичные пневмонии. Их роль как причины тяжелых заболеваний у детей до пяти лет в развивающихся странах неясна.
Бремя LRIs, вызванных Hib или S. pneumoniae , трудно определить, поскольку современные методы установления бактериальной этиологии не обладают чувствительностью и специфичностью.Результаты посева из глотки не всегда позволяют выявить патоген, который является причиной LRI. Бактериальные культуры образцов аспирата легких часто считаются золотым стандартом, но они не подходят для применения в полевых условиях. Обзор нескольких исследований Вуори-Холопайнен и Пелтола (2001) показывает, что на S. pneumoniae и Hib приходится от 13 до 34 процентов и от 1,4 до 42,0 процентов бактериальных пневмоний, соответственно, тогда как исследования Адегбола и др. (1994), Шэнн, Граттен и другие (1984) и Уолл и другие (1986) предполагают, что Hib составляет от 5 до 11 процентов случаев пневмонии.
Пониженные уровни клинической или радиологической пневмонии при клинических испытаниях девятивалентной пневмококковой конъюгированной вакцины дают оценку бремени болезней, предупреждаемых с помощью вакцины ( валентность указывает количество серотипов, от которых вакцина обеспечивает защиту; конъюгат относится к конъюгации полисахаридов с белковым остовом). В исследовании, проведенном в Гамбии, было предотвращено 37 процентов радиологической пневмонии, что отражает количество заболеваний, вызванных S.pneumoniae, , а смертность снизилась на 16 процентов (Cutts and others 2005).
Колонизация верхних дыхательных путей потенциально патогенными организмами и аспирация зараженных секретов участвуют в патогенезе бактериальной пневмонии у детей младшего возраста. Было показано, что инфицирование верхних дыхательных путей вирусом гриппа или RSV увеличивает связывание как H. influenzae (Jiang и др., 1999), так и S. pneumoniae (Hament and others 2004; McCullers and Bartmess 2003) с подкладкой. клетки носоглотки.Это открытие может объяснить, почему рост пневмококковой пневмонии идет параллельно с эпидемиями гриппа и RSV. Исследование, проведенное в Южной Африке, показало, что вакцинация девятивалентной пневмококковой конъюгированной вакциной снижает заболеваемость вирус-ассоциированной пневмонией, вызывающей госпитализацию, на 31 процент, что позволяет предположить, что пневмококк играет важную роль в патогенезе вирус-ассоциированной пневмонии (Madhi, Petersen, Мадхи, Васас и др. 2000).
Попадание бактерий из кишечника с распространением через кровоток в легкие также было предложено для патогенеза грамотрицательных организмов (Fiddian-Green and Baker 1991), но такие бактерии являются необычными этиологическими агентами пневмонии у иммунокомпетентных дети.Однако у новорожденных и младенцев грамотрицательная пневмония не редкость (Quiambao готовится к печати).
Вирусы ответственны за от 40 до 50 процентов инфекций у младенцев и детей, госпитализированных по поводу пневмонии в развивающихся странах (Hortal and others 1990; John and others 1991; Tupasi and others 1990). Вирус кори, RSV, вирусы парагриппа, вирус гриппа типа A и аденовирусы являются наиболее важными причинами вирусной пневмонии. Рентгенологически сложно отличить вирусную пневмонию от бактериальной, отчасти потому, что поражения выглядят одинаково, а отчасти потому, что бактериальная суперинфекция возникает при гриппе, кори и инфекциях RSV (Ghafoor и др., 1990).
В развивающихся странах уровень летальности среди детей с вирусной пневмонией колеблется от 1,0 до 7,3 процента (John и др., 1991; Stensballe, Devasundaram, and Simoes, 2003), с бактериальной пневмонией от 10 до 14 процентов и со смешанной вирусной и вирусной пневмонией. бактериальные инфекции от 16 до 18 процентов (Ghafoor и др., 1990; Shann, 1986).
Бронхиолит
Бронхиолит возникает преимущественно в первый год жизни и с уменьшающейся частотой во второй и третий годы.Клинические признаки включают учащенное дыхание и втягивание нижней грудной стенки, лихорадку в одной трети случаев и хрипы (Cherian и др., 1990). Воспалительная обструкция мелких дыхательных путей, которая приводит к гиперинфляции легких и коллапсу сегментов легкого. Поскольку признаки и симптомы также характерны для пневмонии, работникам здравоохранения может быть сложно провести различие между бронхиолитом и пневмонией. Две особенности, которые могут помочь, — это определение сезонности RSV в данной местности и умение обнаруживать хрипы.RSV являются основной причиной бронхиолита во всем мире и могут вызывать до 70 или 80 процентов LRI в высокий сезон (Simoes 1999; Stensballe, Devasundaram и Simoes 2003). Недавно обнаруженный метапневмовирус человека также вызывает бронхиолит (Van den Hoogen и др., 2001), который неотличим от болезни RSV. Другие вирусы, вызывающие бронхиолит, включают вирус парагриппа 3-го типа и вирусы гриппа.
Грипп
Несмотря на то, что вирусы гриппа обычно вызывают инфекционные заболевания дыхательных путей у взрослых, они все чаще рассматриваются как важная причина инфекционных заболеваний кишечника у детей и, возможно, вторая по значимости причина госпитализации детей с ОРВ после RSV (Neuzil and others 2002). .Хотя грипп считается нечастым в развивающихся странах, его эпидемиология еще требует тщательного изучения. Потенциальное бремя гриппа как причина смерти детей неизвестно. Вирус гриппа типа A может вызывать сезонные вспышки, а тип B может вызывать спорадические инфекции. В последнее время вирус птичьего гриппа стал причиной инфекции, болезней и смерти небольшого числа людей, включая детей, в нескольких азиатских странах. Его потенциал для возникновения вспышек среди людей или пандемии неизвестен, но он может иметь разрушительные последствия для развивающихся стран (Peiris and others 2004) и может представлять угрозу для здоровья во всем мире.Новые штаммы вирусов типа A почти наверняка возникнут в результате мутации, как это произошло в случае пандемий в Азии и Гонконге в 1950-х и 1960-х годах.
ВИЧ-инфекция и педиатрические ИПН
Во всем мире 3,2 миллиона детей живут с ВИЧ / СПИДом, 85 процентов из них — в странах Африки к югу от Сахары (ЮНЭЙДС, 2002). В южной части Африки инфекционные заболевания, связанные с ВИЧ, составляют от 30 до 40 процентов педиатрических госпитализаций и имеют уровень летальности от 15 до 34 процентов, что намного выше, чем 5-10 процентов для детей, не инфицированных ВИЧ (Bobat and others 1999; Мадхи, Петерсен, Мадхи, Хосал и другие, 2000; Натху и другие, 1993; Цви, Петтифиор и Содерлунд, 1999). Pneumocystis jiroveci и цитомегаловирус являются важными условно-патогенными инфекциями более чем у 50 процентов ВИЧ-инфицированных младенцев (Jeena, Coovadia, and Chrystal 1996; Lucas and others 1996). Грамотрицательные бактерии также важны для более чем 70 процентов ВИЧ-инфицированных детей с недостаточным питанием (Ikeogu, Wolf, and Mathe, 1997). Исследования пациентов подтвердили частую ассоциацию этих бактерий, но добавили S. pneumoniae и S. aureus в качестве важных патогенов (Gilks 1993; Goel and others 1999).В первом южноафриканском отчете об общем бремени инвазивной пневмококковой инфекции сообщается о 41,7-кратном увеличении числа ВИЧ-инфицированных детей по сравнению с неинфицированными детьми (Фарли и др., 1994).
Вмешательства
Вмешательства по борьбе с ОРИ можно разделить на четыре основные категории: иммунизация против конкретных патогенов, ранняя диагностика и лечение заболеваний, улучшение питания и более безопасная среда (John 1994). Первые два относятся к сфере ведения системы здравоохранения, тогда как последние два относятся к сфере общественного здравоохранения и требуют многосекторального участия.
Прививки
Широкое использование вакцин против кори, дифтерии, коклюша, Hib, пневмококка и гриппа может существенно снизить заболеваемость ОРИ у детей в развивающихся странах. Влияние вакцин против кори, дифтерии и коклюша обсуждается в главе 20. Ограниченные данные о гриппе в развивающихся странах не позволяют провести подробный анализ потенциальных преимуществ этой вакцины. Поэтому в этой главе основное внимание уделяется потенциальному воздействию вакцин против Hib и пневмококка на LRI.
Вакцина против Hib
В настоящее время доступны три конъюгированные вакцины против Hib для применения у младенцев и детей младшего возраста. Эффективность вакцины против Hib в предотвращении инвазивных заболеваний (в основном менингита, но также и пневмонии) была хорошо задокументирована в нескольких исследованиях, проведенных в промышленно развитых странах (Black and others 1992; Booy and others 1994; Eskola and others 1990; Fritzell and Plotkin 1992; Heath 1998; Lagos and others 1996; Santosham and others 1991) и в одном исследовании в Гамбии (Mulholland and others 1997).Все исследования показали защитную эффективность более 90% против лабораторно подтвержденных инвазивных заболеваний, независимо от выбора вакцины. Следовательно, все промышленно развитые страны включают вакцину против Hib в свои национальные программы иммунизации, что приводит к фактическому устранению инвазивной болезни Hib из-за иммунитета у вакцинированных и эффекта стада у тех, кто не вакцинирован. Имеющиеся данные из нескольких развивающихся стран показывают аналогичный эффект стада (Адегбола и др., 1999; Венгер и др., 1999).
Первоначальное обещание и последующее общее мнение заключалось в том, что вакцина против Hib предназначена для защиты от менингита, но в развивающихся странах вакцина, вероятно, будет иметь больший эффект в предотвращении LRIs. Легко измерить эффект при инвазивных заболеваниях, включая бактериемическую пневмонию. Вакцина, вероятно, оказывает влияние на небактериемическую пневмонию, но этот эффект трудно определить количественно из-за отсутствия адекватного метода установления бактериальной этиологии. В Бангладеш, Бразилии, Чили и Гамбии вакцина против Hib была связана с уменьшением на 20-30 процентов числа госпитализированных с рентгенологически подтвержденной пневмонией (de Andrade and others 2004; Levine and others 1999; Mulholland and others 1997; WHO 2004a ).Однако результаты большого исследования в Ломбоке, Индонезия, не дали окончательных результатов в отношении влияния вакцины против Hib на пневмонию (Gessner and others 2005).
Пневмококковые вакцины
В настоящее время доступны два вида вакцин против пневмококков: 23-валентная полисахаридная вакцина (23-PSV), которая больше подходит для взрослых, чем для детей, и 7-валентная полисахаридная вакцина, конъюгированная с белком (7- PCV). 9-валентная вакцина (9-PCV) прошла клинические испытания в Гамбии и Южной Африке, а 11-валентная вакцина (11-PCV) проходит испытания на Филиппинах.
Исследования эффективности полисахаридной вакцины в профилактике ОРИ или ушных инфекций у детей в промышленно развитых странах показали противоречивые результаты. В то время как некоторые исследования этой вакцины не показывают значительной эффективности (Douglas and Miles 1984; Sloyer, Ploussard and Howie 1981), исследования, проведенные в Финляндии, показывают в целом защитный эффект против серотипов, содержащихся в 14-PSV (Douglas and Miles 1984; Karma and другие 1980; Макела и другие 1980). Эффективность была более выражена у детей старше двух лет, чем у детей младшего возраста.Единственные исследования, оценивающие действие полисахаридной вакцины на детей в развивающихся странах, — это серия из трех испытаний, проведенных в Папуа-Новой Гвинее (Дуглас и Майлз, 1984; Леманн и другие, 1991; Райли и другие, 1981; Райли, Леманн и Альперс, 1991). . Анализ объединенных данных этих испытаний показал снижение смертности от LRI на 59 процентов среди детей до пяти лет на момент вакцинации и на 50 процентов среди детей до двух лет. На основании этих и других исследований исследователи пришли к выводу, что вакцина оказывает влияние на тяжелую пневмонию.Более высокая, чем ожидалось, эффективность в этих испытаниях была приписана большему вкладу более иммуногенных серотипов взрослых в пневмонию в Папуа-Новой Гвинее (Douglas and Miles 1984; Riley, Lehmann, and Alpers 1991). Из-за низкой иммуногенности антигенов в 23-PSV против преобладающих детских серотипов внимание теперь направлено на более иммуногенные конъюгированные вакцины (Mulholland 1998; Obaro 1998; Temple 1991).
Эффективность 7-PCV и 9-PCV была оценена на предмет эффективности против инвазивного пневмококкового заболевания в четырех испытаниях, которые продемонстрировали эффективность вакцины от 71.От 0 до 97,4 процента (от 58 до 65 процентов для ВИЧ-положительных детей, среди которых заболеваемость пневмококком в 40 раз выше, чем среди ВИЧ-отрицательных детей) (Black and others 2000; Cutts and others 2005; Klugman and others 2003; O ‘ Брайен и другие 2003).
В США 7-PCV был включен в плановую вакцинацию младенцев и детей в возрасте до двух лет в 2000 году. К 2001 году заболеваемость всеми инвазивными пневмококковыми заболеваниями в этой возрастной группе снизилась на 69 процентов, а заболевания, вызываемые включенными серотипами. вакцины и родственных серотипов снизились на 78 процентов (Whitney and others 2003).Подобные сокращения были подтверждены в исследовании, проведенном в северной Калифорнии (Black and others 2001). Наблюдалось небольшое увеличение частоты инвазивных заболеваний, вызванных серотипами пневмококков, не включенных в вакцину, но оно было недостаточно большим, чтобы компенсировать существенное снижение заболеваемости, вызванное вакциной. Исследования также обнаружили значительное снижение инвазивной пневмококковой инфекции в непривитых старших возрастных группах, особенно среди взрослых в возрасте от 20 до 39 лет и в возрасте 65 лет и старше, что позволяет предположить, что вакцинация маленьких детей оказала значительный эффект в обществе.Такое преимущество может иметь место даже там, где распространенность ВИЧ-инфекции среди взрослых высока, а пневмококковая инфекция может быть рецидивирующей и опасной для жизни.
Воздействие вакцины на пневмококковую пневмонию как таковое трудно определить из-за проблем, связанных с установлением бактериальной этиологии пневмонии. Три исследования оценивали влияние вакцины на рентгенологическую пневмонию (независимо от этиологического агента) и показали снижение на 20,5–37,0% случаев пневмонии, подтвержденной рентгенологически (9.0 процентов для ВИЧ-инфицированных) (Black and others 2000; Cutts and others 2005; Klugman and others 2003).
Несколько полевых испытаний оценили эффективность PCV против ушной инфекции. Несмотря на то, что вакцина привела к значительному сокращению подтвержденного посевом пневмококка отита, чистого снижения ушной инфекции среди вакцинированных детей не наблюдалось, вероятно, из-за увеличения частоты отита, вызванного видами пневмококков, не охваченных вакциной, ЧАС.influenzae и Moraxella catarrhalis (Eskola and others 2001; Kilpi and others 2003). Однако испытание в северной Калифорнии показало, что вакцина обладает защитным действием против частых инфекций уха и снижает потребность в установке тимпаностомической трубки (Fireman and others 2003). Таким образом, вакцина от ушной инфекции может быть полезной в развивающихся странах с высокими показателями хронического отита и кондуктивной тугоухости, и ее следует оценивать с помощью клинических испытаний.
Самым заметным преимуществом вакцины для общественного здравоохранения в развивающихся странах будет очевидное снижение смертности.Хотя первичным результатом исследования в Гамбии изначально была детская смертность, она была изменена на радиологическую пневмонию. Тем не менее, испытание показало снижение смертности на 16 процентов (уровень достоверности 95 процентов, от 3 до 38). Это испытание проводилось в сельской местности на востоке Гамбии, где трудно обеспечить круглосуточную лечебную помощь, включая ведение больных. Это испытание демонстрирует, что иммунизация, проводимая в рамках аутрич-программ, принесет значительную пользу для здоровья и экономики таких групп населения.Еще одно исследование, оценивающее влияние 11-PCV на радиологическую пневмонию, продолжается на Филиппинах; результаты ожидаются во второй половине 2005 года.
Ведение пациентов
Упрощение и систематизация ведения пациентов для ранней диагностики и лечения ОРИ позволили значительно снизить смертность в развивающихся странах, где доступ к педиатрам ограничен. В клинических рекомендациях ВОЗ по ведению случаев ОРИ (ВОЗ, 1991 г.) используются два ключевых клинических признака: частота дыхания, , чтобы отличить детей с пневмонией от детей без, и втягивание нижней грудной клетки, , для выявления тяжелой пневмонии, требующей направления и госпитализации.Детям со слышимым стридором в спокойном и спокойном состоянии или такими опасными признаками тяжелого заболевания, как неспособность есть, также требуется направление. Дети без этих признаков классифицируются как страдающие ОРИ, но не пневмонией. Детей, у которых наблюдается только учащенное дыхание, лечат от пневмонии амбулаторно. Детей, которые кашляют более 30 дней, направляют для дальнейшего обследования на туберкулез и другие хронические инфекции.
Диагностика пневмонии на основе учащенного дыхания
Первоначальные рекомендации по выявлению пневмонии на основе учащенного дыхания были разработаны в Папуа-Новой Гвинее в 1970-х годах.В исследовании 200 последовательных педиатрических пациентов и 50 последовательных госпитализаций (Shann, Hart, and Thomas 1984) 72 процента детей со слышимым хрипом в легких имели частоту дыхания 50 или более вдохов в минуту, тогда как только 19 процентов детей без потрескивания дышал с такой стремительной скоростью. Поэтому в первоначальных рекомендациях ВОЗ использовался порог в 50 вдохов в минуту, при достижении которого кашель у ребенка считался пневмонией.
Основное беспокойство вызывает относительно низкая чувствительность этого подхода, который может упустить от 25 до 40 процентов случаев пневмонии.Исследование в Веллоре, Индия, показало, что чувствительность можно улучшить, снизив порог до 40 для детей в возрасте от 1 до 4 лет, сохранив порог в 50 вдохов в минуту для младенцев в возрасте от 2 до 11 месяцев (Cherian and others 1988). Последующие исследования показали, что при использовании этих пороговых значений чувствительность улучшилась с 62 до 79 процентов на Филиппинах и с 65 до 77 процентов в Свазиленде, но в то же время специфичность упала с 92 до 77 процентов на Филиппинах и с 92 до 80 процентов. процентов в Свазиленде (Mulholland и др., 1992).На основе этих и других данных (Кэмпбелл, Байасс и др., 1989; Колстад и др., 1997; Перкинс и др., 1997; Редд, 1994; Симоес и др., 1997; Вебер и др., 1997) ВОЗ рекомендует ограничить частоту дыхания на 50 вдохов. в минуту для детей в возрасте от 2 до 11 месяцев и 40 вдохов в минуту для детей в возрасте от 12 месяцев до 5 лет.
Учащенное дыхание, по определению ВОЗ, выявляет около 85 процентов детей с пневмонией, и более 80 процентов детей с потенциально смертельной пневмонией, вероятно, успешно выявляются и лечатся с использованием диагностических критериев ВОЗ.Было показано, что лечение детей с учащенным дыханием антибиотиками снижает смертность (Sazawal and Black 2003). Проблема низкой специфичности критерия учащенного дыхания заключается в том, что от 70 до 80 процентов детей, которые могут не нуждаться в антибиотиках, получат их. Тем не менее, для работников первичной медико-санитарной помощи, для которых важна простота диагностики, учащенное дыхание, несомненно, является наиболее полезным клиническим признаком.
Диагностика пневмонии на основании втягивания грудной стенки
Дети поступают в больницу с тяжелой пневмонией, когда медицинские работники считают, что необходимы кислородные или парентеральные антибиотики (антибиотики, вводимые не перорально), или когда они не уверены в способности матери справиться .Обоснование парентеральных антибиотиков состоит в том, чтобы достичь более высоких уровней антибиотиков и преодолеть опасения по поводу абсорбции пероральных препаратов у больных детей.
В исследовании Папуа-Новой Гвинеи (Shann, Hart, and Thomas 1984) втягивание грудной клетки использовалось в качестве основного показателя тяжести, но исследования, проведенные в разных частях мира, показывают большие различия в темпах втягивания из-за различных определений. Ограничение этого термина втягиванием нижней грудной стенки, определяемым как движение внутрь костных структур грудной стенки с вдохом, предоставило лучший индикатор тяжести пневмонии, который можно научить медработникам.Он более специфичен, чем втяжение межреберных промежутков, которое часто возникает при бронхиолите.
В исследовании, проведенном в Гамбии (Кэмпбелл, Байасс и др., 1989), когорта из 500 детей от рождения до четырех лет посещалась дома еженедельно в течение одного года. За это время в клинику было направлено 222 эпизода LRI (учащенное дыхание, любое втягивание грудной стенки, расширение носа, свистящее дыхание, стридор или признаки опасности). Втягивание грудной клетки имело место в 62 процентах этих случаев, во многих случаях втягивание межреберья.Если бы всех детей с каким-либо втягиванием грудной клетки госпитализировали, их количество превысило бы количество детских стационаров.
Исследования, проведенные на Филиппинах и в Свазиленде (Mulholland и др., 1992), показали, что втягивание нижней грудной стенки было более специфичным, чем втягивание межреберья, для диагностики тяжелой пневмонии, требующей госпитализации. В исследовании Веллора (Cherian and others 1988) втягивание нижней грудной стенки правильно предсказало 79 процентов детей с LRI, которые были госпитализированы педиатром.
Варианты противомикробных препаратов для перорального лечения пневмонии
Выбор противомикробного препарата для лечения основан на хорошо известных данных о том, что большинство бактериальных пневмоний у детей вызывается S. pneumoniae или H. influenzae . Однократная инъекция бензатин-пенициллина, хотя и длится долго, не обеспечивает адекватных уровней пенициллина для уничтожения H. influenzae . У ВОЗ есть технические документы, помогающие оценить соответствующие факторы при выборе противомикробных препаратов первого и второго ряда и сравнения различных противомикробных препаратов в отношении их антибактериальной активности, эффективности лечения и токсичности (ВОЗ, 1990).
Возникновение устойчивости к противомикробным препаратам у S. pneumoniae и H. influenzae вызывает серьезную озабоченность. В некоторых условиях тесты in vitro показывают, что более 50 процентов респираторных изолятов обеих бактерий устойчивы к ко-тримоксазолу, а устойчивость к пенициллину к S. pneumoniae постепенно становится проблемой во всем мире.
При пневмонии, в отличие от менингита, устойчивость возбудителя in vitro не всегда приводит к неэффективности лечения.Сообщения из Испании и Южной Африки предполагают, что пневмонию, вызванную устойчивым к пенициллину S. pneumoniae , можно успешно лечить с помощью достаточно высоких доз пенициллина. Амоксициллин концентрируется в тканях и макрофагах, и его уровни напрямую зависят от пероральных дозировок. Поэтому для успешного лечения ушных инфекций, вызванных устойчивым к пенициллину S. pneumoniae , в настоящее время используются более высокие дозы, чем в прошлом, — назначаемые дважды в день. Амоксициллин явно лучше пенициллина при таких инфекциях.Ситуация с ко-тримоксазолом менее ясна (Strauss и др., 1998), и перед лицом высоких показателей устойчивости к ко-тримоксазолу амоксициллин может быть лучше для детей с тяжелой пневмонией.
Внутримышечные антибиотики для лечения тяжелой пневмонии
Несмотря на то, что хлорамфеникол активен против S. pneumoniae и H. influenzae, его пероральное всасывание у чрезвычайно больных детей неустойчиво. Таким образом, рекомендации ВОЗ рекомендуют вводить хлорамфеникол внутримышечно в половине суточной дозы до срочного направления пациентов с тяжелой пневмонией.Дополнительным объяснением является то, что у крайне больных детей может быть сепсис или менингит, которые трудно исключить и которые необходимо немедленно лечить. Хотя внутривенный хлорамфеникол превосходит внутримышечный хлорамфеникол, процедура может отсрочить срочно необходимое лечение и увеличивает его стоимость.
Исследователи поставили под сомнение адекватность и безопасность внутримышечного хлорамфеникола. Хотя ранние исследования показали, что уровни взрослого в крови после внутримышечного введения были значительно ниже, чем уровни, достигнутые после внутривенного введения, внутримышечный путь введения получил широкое признание после клинических отчетов, которые подтвердили его эффективность.Местные осложнения при внутримышечном введении сукцината левомицетина возникают редко, в отличие от более ранних внутримышечных препаратов. Хотя беспокойство по поводу апластической анемии после приема хлорамфеникола является обычным явлением, это осложнение крайне редко встречается у маленьких детей. Нет никаких доказательств того, что внутримышечный сукцинат хлорамфеникола с большей вероятностью вызывает побочные эффекты, чем другие формы и пути введения хлорамфеникола.
Диагностика гипоксемии на основе критериев ВОЗ
Стратегии ведения случаев ОРИ и комплексного ведения болезней грудного и детского возраста (ИВБДВ) зависят от точного направления больных детей в больницу и правильного стационарного лечения ИРН с применением кислорода или антибиотиков.Гипоксемия (дефицит кислорода в крови) у детей с LRI является хорошим предиктором смертности, коэффициент летальности в 1,2-4,6 раза выше при гипоксемическом LRI, чем при негипоксемическом LRI (Duke, Mgone, and Frank 2001; Onyango and others 1993). ), а кислород снижает смертность. Таким образом, важно как можно раньше выявлять гипоксемию у детей с LRI, чтобы предотвратить смерть. Хотя диагноз острой LRIs очень легко устанавливается путем распознавания тахипноэ, и хотя тяжелая LRI связана с втягиванием грудной стенки, клиническое распознавание гипоксемии более проблематично.Были изучены различные наборы клинических правил для прогнозирования наличия гипоксемии у детей с LRI (Cherian и др., 1988; Onyango и др., 1993; Usen и др., 1999). Хотя некоторые клинические инструменты обладают высокой чувствительностью для выявления гипоксемии, большое количество детей с гипоксемией все же будет пропущено при использовании этих критериев. Пульсоксиметрия — лучший инструмент для быстрого выявления гипоксемии у больных детей. Однако пульсоксиметры дороги и требуют периодических затрат на замену датчиков, по которым они недоступны в большинстве районных или даже специализированных больниц в развивающихся странах.
Руководство по лечению
Текущие рекомендации включают прием ко-тримоксазола два раза в день в течение пяти дней при пневмонии и внутримышечный пенициллин или хлорамфеникол для детей с тяжелой пневмонией. Проблемы повышения устойчивости к ко-тримоксазолу и ненужных направлений детей с втягиванием грудной стенки привели к исследованиям, в которых изучаются альтернативы антибиотикам, которые в настоящее время используются при лечении ОРИ. Одно исследование показало, что амоксициллин и котримоксазол одинаково эффективны при нетяжелой пневмонии (Catchup Study Group 2002), хотя амоксициллин стоит в два раза дороже, чем котримоксазол.Что касается продолжительности лечения антибиотиками, исследования в Бангладеш, Индии и Индонезии показывают, что трехдневный пероральный прием котримоксазола или амоксициллина так же эффективен, как пять дней приема любого из препаратов у детей с нетяжелой пневмонией (Agarwal and others 2004; Kartasasmita 2003). ). В многоцентровом исследовании пенициллина, вводимого внутримышечно, и перорального амоксициллина у детей с тяжелой пневмонией, Аддо-Йобо и другие (2004) обнаружили схожие показатели излечения. Поскольку пациенты получали кислород при необходимости от гипоксемии и были переведены на другие антибиотики, если лечение не помогло, этот режим не подходит для лечения тяжелой пневмонии в амбулаторных условиях.
ВОЗ рекомендует назначать кислород, если он имеется в достаточном количестве, детям с признаками и симптомами тяжелой пневмонии и, если подача ограничена, детям с любым из следующих признаков: неспособность есть и пить, цианоз, частота дыхания выше или равный 70 вдохам в минуту, или серьезное втягивание грудной стенки (ВОЗ, 1993). Кислород следует вводить со скоростью 0,5 литра в минуту для детей младше 2 месяцев и 1 литр в минуту для детей старшего возраста. Поскольку кислород стоит дорого и его не хватает, особенно в отдаленных сельских районах развивающихся стран, ВОЗ рекомендует простые клинические признаки для выявления и лечения гипоксемии.Несмотря на эти рекомендации, исследование 21 учреждения первого уровня и районной больницы в семи развивающихся странах показало, что более 50 процентов госпитализированных детей с LRI неправильно лечились антибиотиками или кислородом (Nolan and others 2001), а в некоторых случаях кислород был в дефиците. Очевидно, что обеспечение кислородом младенцев с гипоксемией спасает жизнь, хотя никаких рандомизированных испытаний, подтверждающих это, не проводилось.
Профилактика и лечение пневмонии у ВИЧ-позитивных детей
Текущие рекомендации группы ВОЗ по лечению пневмонии у ВИЧ-позитивных детей и профилактике Pneumocystis jiroveci следующие (ВОЗ 2003):
Нетяжелая пневмония в возрасте до 5 лет. Пероральный котримоксазол должен оставаться антибиотиком первой линии, но следует использовать пероральный амоксициллин, если он доступен по цене или если ребенок проходил профилактику котримоксазолом.
Тяжелая или очень тяжелая пневмония. Нормальные руководящие принципы ВОЗ по ведению больных следует использовать для детей в возрасте до 2 месяцев. Детям от 2 до 11 месяцев рекомендуются инъекционные антибиотики и лечение пневмонии Pneumocystis jiroveci , а также начинается профилактика пневмонии Pneumocystis jiroveci после выздоровления.Для детей в возрасте от 12 до 59 месяцев лечение состоит из инъекционных антибиотиков и терапии пневмонии Pneumocystis jiroveci . Pneumocystis jiroveci Профилактика пневмонии должна проводиться в течение 15 месяцев детям, рожденным от ВИЧ-инфицированных матерей; однако эта рекомендация редко выполнялась.
Рентабельность вмешательств
Пневмония является причиной примерно пятой части из примерно 10,6 миллиона случаев смерти детей в возрасте до пяти лет в год.Там, где первичная медико-санитарная помощь является слабой, сокращение смертности с помощью мер общественного здравоохранения является приоритетной задачей. Как отмечалось ранее, доступные вмешательства — это первичная профилактика путем вакцинации и вторичная профилактика путем раннего выявления и ведения случаев заболевания.
Рентабельность вакцин против Hib обсуждается в главе 20. Мы не пытались анализировать рентабельность пневмококковых вакцин, поскольку глобальные и региональные оценки бремени пневмококковой пневмонии в настоящее время разрабатываются и будут доступны только после позже в 2005 году.Кроме того, текущие цены на вакцины относительно стабильны в развитых странах, но ожидается, что цены для стран с низким и средним уровнем доходов будут значительно ниже, если вакцины закупаются на глобальном тендере.
Мы оцениваем стратегии вмешательства по ведению случая LRIs у детей в возрасте до пяти лет. Медицинские работники, осуществляющие ведение больных, диагностируют ИРН на основании учащенного дыхания, втягивания нижней грудной стенки или отдельных признаков опасности у детей с респираторными симптомами.Поскольку этот метод не делает различий между пневмонией и бронхиолитом, а также между бактериальной и вирусной пневмонией, мы объединяем эти состояния в общую категорию «клиническая пневмония» (Rudan and others 2004). Этот подход предполагает, что большая часть клинической пневмонии имеет бактериальное происхождение и что медицинские работники могут значительно снизить летальность посредством диагностики частоты дыхания и своевременного приема антибиотиков (Sazawal and Black 2003). Мы рассчитали затраты на лечение по регионам Всемирного банка с использованием стандартизированных исходных затрат, предоставленных редакторами томов, и затрат, опубликованных в Международном справочнике по индикаторам цен на лекарства (Management Sciences for Health 2005) и другой литературе ().В анализе рассматриваются четыре категории ведения пациентов, которые различаются тяжестью инфекции и точкой лечения:
Таблица 25.1
Входные данные для ведения случаев пневмонии в странах с низким и средним уровнем доходов.
нетяжелая пневмония, лечение в больнице
нетяжелая пневмония, лечение в медицинском учреждении
тяжелая пневмония, лечение в больнице
очень тяжелая пневмония, лечение в больнице.
Информация об этих категориях ведения пациентов и их результатах взята из отчета о методологии и предположениях, использованных для оценки затрат на расширение масштабов отдельных медицинских вмешательств, направленных на детей (ВОЗ и Здоровье детей-подростков, готовится к печати). Мы предположили, что для каждого пациента, которого лечит местный медицинский работник, в общей сложности должно быть проведено три контрольных визита, а не два раза в день в течение 10 дней, рекомендованных в отчете. Мы также предположили, что все пациенты с тяжелой пневмонией проходят рентгенологическое обследование, а не только 20 процентов, как предлагается в отчете.Более того, мы приняли пятичасовой рабочий день для общинного медработника, минимальный рабочий день, необходимый для общинных медицинских работников в рамках инициативы «Здоровье и выживание детей» Агентства США по международному развитию (Bhattacharyya and others 2001).
представляет региональные оценки средних затрат на лечение на эпизод для четырех стратегий ведения случая. Поскольку мы считали, что цены на торгуемые товары, такие как лекарства и кислород, постоянны в разных регионах, региональные различия были вызваны различиями в расходах на больницы и медицинских работников.Латинская Америка и Карибский бассейн, Ближний Восток и Северная Африка имели самые высокие затраты на лечение.
Таблица 25.2
Средние затраты на лечение за один эпизод вмешательств по ведению пациентов с острой респираторной инфекцией нижних дыхательных путей (2001 долл. США).
Мы рассчитали региональные коэффициенты экономической эффективности (ССВ) для модельной численности населения в 1 миллион человек в каждом регионе, следуя стандартизированным руководящим принципам для экономического анализа (подробности см. В главе 15). Входные переменные включали стоимость лечения, подробно описанную в и, региональные показатели заболеваемости LRI, адаптированные из материалов Рудана и других (готовится к публикации), региональные показатели смертности и возрастные структуры, предоставленные редакторами томов, а также соотношение городского и сельского населения по регионам (World Банк 2002).Регион Европы и Центральной Азии был исключен из этого анализа из-за отсутствия информации о заболеваемости. Ввиду отсутствия информации по регионам, мы предположили, что уровни эффективности вмешательства будут одинаковыми.
Количество лет жизни с поправкой на инвалидность можно предотвратить за счет сокращения продолжительности болезни и снижения смертности с помощью лечения. Мы предположили, что средняя продолжительность болезни составляет 8,5 дней для тех, кто не лечился, и 6,0 дней для тех, кто лечился. Мы использовали снижение летальности на 36,0% за счет лечения (Sazawal and Black 2003) и специфичность диагноза 78.5 процентов для пациентов, которым поставлен диагноз только на основании частоты дыхания. Вес нетрудоспособности одновременно с инфекцией составил 0,28. Мы не рассматривали инвалидность, вызванную хроническими последствиями LRI, потому что неясно, вызывает ли LRI в детстве долгосрочное нарушение функции легких или дети, у которых развивается нарушение функции легких, более склонны к инфекции (von Mutius 2001).
Поскольку один год этих вмешательств дает только одновременные преимущества — поскольку эффективно пролеченные люди не обязательно доживают до ожидаемой продолжительности жизни, учитывая, что они, вероятно, снова заразятся в следующем году, — мы рассчитали экономическую эффективность пятилетнего вмешательства .Этот период времени позволил нам рассмотреть случай, в котором целая когорта новорожденных до четырехлетнего возраста избежала ранней детской смертности от клинической пневмонии из-за вмешательства и получила преимущество, дожившее до ожидаемой продолжительности жизни. Наконец, в этом анализе учитывались только долгосрочные предельные затраты, которые варьируются в зависимости от количества пациентов, прошедших лечение, и не учитывались постоянные затраты на запуск программы, которых в настоящее время не существует.
представляет ССВ для конкретных регионов четырех категорий ведения случаев, а также ССВ для предоставления всех четырех категорий населению в 1 миллион человек.Во всех странах с низким и средним уровнем доходов лечение нетяжелой клинической пневмонии было более рентабельным на уровне учреждения, чем на уровне общины, и из всех четырех категорий ведения случая лечение очень тяжелой клинической пневмонии на уровне стационара было более эффективным. наименее рентабельный. Лечение нетяжелой клинической пневмонии на уровне учреждения было более рентабельным, чем лечение общинным работником здравоохранения, из-за более низкой стоимости одного посещения медицинского учреждения, чем многократных посещений медицинского работника.CER предоставления всех уровней лечения для всех стран с низким и средним уровнем доходов оценивается в 398 долларов США на год жизни с поправкой на инвалидность.
Таблица 25.3
ССВ вмешательств по ведению пациентов с пневмонией (2001 долл. США / год жизни с поправкой на инвалидность).
Поскольку мы предположили, что показатели эффективности были постоянными, региональные различия в CER для каждой категории ведения случая были связаны только с вариациями затрат на вмешательство, а относительные рейтинги экономической эффективности для стратегий были одинаковыми для всех регионов.Различия в ССВ для оказания всех категорий медицинской помощи также были обусловлены региональным соотношением городского и сельского населения. Мы предположили, что все пациенты в городских районах обращаются за лечением на уровне учреждения или выше, тогда как 80 процентов нетяжелых пациентов в сельской местности получают лечение на уровне сообщества, а остальные обращаются за лечением на уровне учреждения.
Внедрение стратегий борьбы с ОРИ: уроки опыта
Уроки стратегий профилактики и контроля ОРИ, реализованные в рамках национальных программ, включают стратегии вакцинации и ведения больных, описанные ниже.
Vaccine Strategies
Вакцина против Hib была введена в календарь плановой иммунизации младенцев в Северной Америке и Западной Европе в начале 1990-х годов. С созданием Глобального альянса по вакцинам и иммунизации (ГАВИ) и Фонда вакцин был достигнут прогресс в их внедрении в развивающихся странах, хотя серьезные препятствия остаются. К 2002 г. только 84 из 193 стран-членов ВОЗ ввели вакцину против Hib. С тех пор пять стран получили одобрение ГАВИ на поддержку внедрения вакцины против Hib в 2004–2005 годах.
Соединенные Штаты добавили 7-PCV в программу иммунизации младенцев в 2000 году. Некоторые другие промышленно развитые страны планируют включить вакцину в свои национальные программы иммунизации в 2005 году, тогда как другие рекомендуют использовать вакцину только в отдельных группах высокого риска. . В некоторых из этих последних стран определение высокого риска является довольно широким и включает значительную долю всех младенцев. В лицензированном в настоящее время 7-PCV отсутствуют определенные серотипы, важные для развивающихся стран, но 9-PCV и 11-PCV охватят почти 80 процентов серотипов, вызывающих серьезные заболевания во всем мире.
Несмотря на успех вакцины против Hib в промышленно развитых странах и общепризнанное значение LRI как причины детской смертности, в результате действия ряда взаимосвязанных факторов внедрение вакцины в развивающихся странах было медленным. Устойчивое использование вакцины находится под угрозой в нескольких странах, которые ввели вакцину. Во-первых, масштабы заболеваний и смертей, вызванных Hib, не признаются в этих странах, отчасти из-за недостаточного использования бактериологической диагностики (в результате нехватки оборудования и ресурсов).Во-вторых, поскольку охват, достигнутый с помощью традиционных расширенных программ иммунизации вакцинами, остается низким во многих странах, добавление дополнительных вакцин не было определено в качестве приоритета. В-третьих, развивающиеся страны не предпринимали усилий по установлению полезности вакцины до тех пор, пока вакцина не была лицензирована и не использовалась регулярно в течение нескольких лет в промышленно развитых странах. Следовательно, вакцинация против Hib воспринимается как средство вмешательства для богатых стран. В результате всех этих факторов фактический спрос на вакцину оставался низким, даже когда поддержка предоставлялась через ГАВИ и Фонд вакцин.
В 2004 году правление ГАВИ поручило целевой группе по Hib изучить, как лучше всего поддержать национальные усилия по принятию основанных на фактических данных решений о внедрении вакцины против Hib. На основе рекомендаций целевой группы правление ГАВИ одобрило создание Инициативы по Hib для поддержки тех стран, которые хотят либо продолжить вакцинацию против Hib, либо изучить вопрос о том, должно ли внедрение вакцины Hib быть приоритетом для их систем здравоохранения. Консорциум, состоящий из Школы общественного здравоохранения Блумберга Джонса Хопкинса, Лондонской школы гигиены и тропической медицины, Центров по контролю и профилактике заболеваний и ВОЗ, был выбран для руководства этими усилиями.
Стратегии ведения случаев
Метаанализ исследований Сазавала и Блэка (Sazawal and Black, 2003) на уровне сообществ, посвященных стратегии ведения случаев ОРИ, включает 10 исследований, в которых оценивалось ее влияние на смертность, 7 с одновременной контрольной группой. Метаанализ показал снижение смертности от всех причин на 27 процентов среди новорожденных, на 20 процентов среди младенцев и на 24 процента среди детей в возрасте от одного до четырех лет. Смертность от LRI снизилась на 42, 36 и 36 процентов соответственно. Эти данные ясно показывают, что относительно упрощенное, но стандартизованное ведение случаев ОРИ может иметь значительное влияние на смертность не только от пневмонии, но и от других причин у детей от рождения до четырех лет.В настоящее время стратегия ведения пациентов с ОРИ включена в стратегию ИВБДВ, которая в настоящее время применяется более чем в 80 странах (см. Главу 63).
Несмотря на то, что ежегодно от пневмонии гибнет огромное количество людей, обещания, заложенные в упрощенном ведении больных, не были успешно реализованы во всем мире. Одна из основных причин — недостаточное использование медицинских учреждений в странах или сообществах, в которых многие дети умирают от ОРИ. В Бангладеш, например, 92 процента больных детей не попадают в соответствующие медицинские учреждения (ВОЗ, 2002 г.).В Боливии 62 процента умерших детей не были доставлены к врачу в случае болезни (Aguilar and others 1998). В Гвинее 61 процент умерших больных детей не были доставлены к врачу (Schumacher and others 2002). Исследование Шелленберга и других (2003), проведенное в Танзании, показывает, что дети из более бедных семей с меньшей вероятностью получат антибиотики от пневмонии, чем дети из более обеспеченных семей, и что только 41 процент больных детей доставляют в медицинские учреждения.Таким образом, исследования неизменно подтверждают, что больные дети, особенно из бедных семей, не посещают медицинские учреждения.
Ряд стран разработали крупномасштабные и устойчивые программы лечения на уровне сообществ:
- В Гамбии действует национальная программа лечения пневмонии на уровне общин (ВОЗ 2004b).
- В районе Сиая в Кении неправительственная организация эффективно предоставляет медицинскими работниками лечение пневмонии и других детских болезней (ВОЗ, 2004b).
- В Гондурасе управление ОРИ было включено в Национальную интегрированную программу общинного ухода за детьми, в соответствии с которой добровольцы из местных сообществ проводят мониторинг роста, проводят санитарное просвещение и лечат пневмонию и диарею в более чем 1800 сообществах (ВОЗ 2004b).
В Бангладеш Комитет по развитию сельских районов Бангладеш и правительство внедрили программу борьбы с ОРИ, охватывающую 10 подрайонов, с привлечением добровольцев из местных медицинских работников. Каждый работник отвечает за лечение детской пневмонии примерно в 100–120 домашних хозяйствах после трехдневной программы обучения.
- В Непале в 1986–89 гг. Общинная программа лечения ОРИ и диарейных заболеваний была опробована в двух округах и показала существенное снижение смертности от LRI (Pandey and others 1989, 1991). В результате программа была интегрирована в службы здравоохранения Непала и реализуется в 17 из 75 округов страны женщинами-добровольцами, обученными выявлять и лечить пневмонию.
- В Пакистане в программе Lady Health Worker Program работает около 70 000 женщин, которые работают в общинах, обеспечивая образование и ведение детской пневмонии более чем 30 миллионам человек (ВОЗ 2004b).
Программа научных исследований и разработок
Программа исследований и разработок, изложенная ниже, суммирует приоритеты, установленные консультативными группами Инициативы по исследованиям вакцин (стратегии вмешательства в отношении вакцин) и Отдела ВОЗ по охране здоровья детей и подростков (случай- стратегии управления).
Стратегии вакцинации
Целевая группа ГАВИ по иммунизации против Hib дала ряд рекомендаций, которые различаются в зависимости от страны.Страны, внедрившие вакцину против Hib, должны сосредоточиться на документировании ее эффекта и должны использовать данные для информирования национальных органов власти, партнеров по развитию и других учреждений, занимающихся общественным здравоохранением, для обеспечения постоянной поддержки таких программ вакцинации. Страны, имеющие право на поддержку ГАВИ, которые еще не внедрили вакцины против Hib, часто сталкиваются с ограничениями из-за отсутствия местных данных и недостаточной осведомленности о региональных данных. Они могут решать эти вопросы на субрегиональных встречах, на которых страновые эксперты могут объединять данные и анализировать информацию из других стран.Кроме того, большинству стран необходимо проводить экономический анализ, основанный на стандартизированном инструменте. Наконец, всем странам, которые сталкиваются с высоким бременем Hib-инфекции, необходимо создать лабораторное оборудование, чтобы они могли определять заболеваемость Hib-менингитом в выбранных местах. Страны, в которых бремя болезни остается неясным, могут иметь ограниченные возможности для документирования случаев заболевания Hib с использованием протоколов, основанных на эпиднадзоре за инвазивным менингитом. Им необходимо будет изучить возможности использования альтернативных методов измерения бремени болезней, включая использование исследований вакцины.
Основываясь на опыте внедрения вакцин против Hib и гепатита B, ГАВИ проявил инициативу и в 2003 году на базе Школы общественного здравоохранения Джона Хопкинса в Балтиморе учредил инициативу по реализации программы ускоренной разработки и внедрения пневмококковых вакцин ( PneumoADIP; см. Http://www.preventpneumonia.org). Целью программы является установление и информирование о ценности пневмококковых вакцин и поддержка их доставки. Установление ценности вакцины требует разработки местных данных о бремени болезни и потенциальном воздействии вакцины на здоровье населения.Эти усилия могут быть достигнуты за счет усиленного эпиднадзора за болезнями и соответствующих клинических испытаний в выбранном количестве ведущих стран. После создания доказательная база будет передана лицам, принимающим решения, и ключевым лидерам общественного мнения, чтобы гарантировать принятие решений на основе данных. После того, как будет установлена рентабельность плановой вакцинации, необходимо будет создать системы доставки, и странам потребуется финансовая поддержка, чтобы вакцины могли быть включены в их программы иммунизации.Эти мероприятия начинаются до выпуска вакцин, предназначенных для использования в развивающихся странах, чтобы информировать о планировании потенциала, доступности продуктов и ценообразовании.
Стратегии ведения случаев
В 2003 г. Отдел здоровья детей и подростков ВОЗ созвал совещание для обзора данных и доказательств недавних исследований лечения ОРИ и предложения следующих изменений в руководящие принципы ведения случаев и приоритеты будущих исследований:
- Нетяжелая пневмония:
Повышение специфичности клинических диагностических критериев.
Пересмотреть текущие рекомендуемые ВОЗ критерии для выявления и лечения неудач лечения с учетом высоких показателей неудач терапии.
Проведите повторный анализ данных краткосрочных курсов терапии, чтобы лучше определить факторы, определяющие неэффективность лечения.
Провести плацебо-контролируемые испытания среди детей с хрипом и пневмонией в выбранных условиях с высокой распространенностью хрипов, чтобы определить, нуждаются ли такие дети в антибиотиках.
- Тяжелая пневмония. В рандомизированном клиническом исследовании в контролируемой среде Аддо-Йобо и другие (2004) показали, что пероральный амоксициллин так же эффективен, как парентеральный пенициллин или ампициллин; тем не менее, прежде чем его можно будет рекомендовать в целом, необходимо предпринять следующие действия:
Проанализировать данные об исключениях из исследования.
Определите предикторы, которые могут помочь отличить детей, нуждающихся в госпитализации и у которых впоследствии ухудшается состояние.
Переоценить текущие рекомендованные ВОЗ критерии неэффективности лечения тяжелой пневмонии, учитывая в целом высокие показатели неудач терапии.
Провести описательные исследования в условиях общественного здравоохранения в нескольких центрах по всему миру, чтобы оценить клинические результаты перорального приема амоксициллина у детей в возрасте от 2 до 59 месяцев, у которых наблюдается втягивание нижней грудной стенки.
Задокументировать эффективность руководящих принципов ВОЗ по лечению детей с пневмонией и ВИЧ-инфекцией.
- Смертей от LRI:
Чтобы помочь разработать более эффективные меры по снижению смертности от LRI, подробно изучите эпидемиологию смертей от LRI в различных регионах, используя рутинные и передовые лабораторные методы.
- Кислородная терапия:
Проведите исследования, чтобы показать эффективность кислорода для лечения тяжелых респираторных инфекций.
Соберите базовую информацию о наличии и доставке кислорода и его использовании в больницах в странах с низким уровнем дохода.
Изучите возможности пульсоксиметрии для оптимизации кислородной терапии в различных клинических условиях.
Проведение исследований для улучшения специфичности клинических признаков при наложении признаков и симптомов малярии и пневмонии.
Изучите быстрые диагностические тесты на малярию, чтобы оценить их эффективность в различении малярии и пневмонии.
Изучить влияние широкого применения котримоксазола на устойчивость к сульфадоксин-пириметамину к Plasmodium falciparum .
Этиология: Данные об этиологии пневмонии у детей несколько устарели, и необходимы новые этиологические исследования, в которых используются современные технологии для идентификации патогенов.
Выводы: обещания и ловушки
Фактические данные ясно показывают, что подход ВОЗ к ведению больных и более широкое использование имеющихся вакцин снизят смертность от ОРИ среди детей младшего возраста от половины до двух третей. Само по себе систематическое применение упрощенного ведения больных, стоимость которого достаточно низка, чтобы быть доступным практически для любой развивающейся страны, снизит смертность от ОРИ как минимум на треть.Срочно необходимо воплотить эту информацию в жизнь.
Стратегия ведения случая должна применяться и проспективно оцениваться, чтобы возникающие проблемы устойчивости к противомикробным препаратам, снижение эффективности текущего лечения рекомендованными противомикробными препаратами или появление неожиданных патогенов могли быть обнаружены на ранней стадии и чтобы можно было быстро принять меры по исправлению положения. Если действия медицинских работников на уровне сообществ будут дополнены внедрением стратегии ИВБДВ на всех уровнях первичной медико-санитарной помощи, то применять и оценивать эту стратегию будет проще.Такая синергия также может помочь в сборе информации, которая поможет в дальнейшей точной настройке клинических признаков, чтобы даже сельские медицинские работники могли лучше отличить бронхиолит и хрипы от бактериальной пневмонии. Критике того, что меры по ведению пациентов могут привести к чрезмерному использованию противомикробных препаратов, следует противодействовать путем документирования их чрезмерного и неправильного использования врачами и другими медицинскими работниками. Хотя наблюдается возрождение интереса к проведению вмешательств на уровне сообществ, наш анализ показывает, что это может оказаться нерентабельным.Действительно, ведение случаев ОРИ в учреждении первого уровня все еще может быть наиболее рентабельным в сочетании с более эффективными поведенческими вмешательствами, связанными с обращением за медицинской помощью.
Международное медицинское сообщество только начинает осознавать потенциальные преимущества вакцин против Hib и пневмококка. В настоящее время они дороги по сравнению с вакцинами Расширенной программы иммунизации, но цена вакцины Hib может упасть с выходом на рынок большего числа производителей в ближайшие несколько лет. Тем не менее, убедительные доказательства экономической эффективности вакцин необходимы для облегчения принятия национальных решений по внедрению вакцины и ее устойчивому использованию.В странах с низким уровнем дохода одних только положительных соотношений затрат и выгод и экономической эффективности оказывается недостаточно для включения этих вакцин в национальные программы иммунизации.
Ссылки
- Аддо-Йобо Э., Чисака Н., Хассан М., Хибберд П., Лозано Дж. М., Джина П. и др. Пероральный амоксициллин по сравнению с инъекционным пенициллином при тяжелой пневмонии у детей в возрасте от 3 до 59 месяцев: рандомизированное многоцентровое исследование эквивалентности. Ланцет. 2004. 364 (9440): 1141–48. [PubMed: 15451221]
- Адегбола Р.A., Falade A. G., Sam B. E., Aidoo M., Baldeh I., Hazlett D. et al. Этиология пневмонии у недоедающих и хорошо питающихся детей Гамбии. Журнал детских инфекционных болезней. 1994. 13 (11): 975–82. [PubMed: 7845751]
- Адегбола Р. А., Усен С. О., Вебер М., Ллойд-Эванс Н., Джоб К., Малхолланд К. и др. Haemophilus influenzae Менингит типа B в Гамбии после введения конъюгированной вакцины. Ланцет. 1999; 354 (9184): 1091–92. [PubMed: 10509502]
Агилар, А.М., Р. Альварадо, Д. Кордеро, П. Келли, А. Замора и Р. Сальгадо. 1998 г. Обследование смертности в Боливии: окончательный отчет — исследование и определение причин смерти детей в возрасте до пяти лет . Вена, Вирджиния: Базовая поддержка проекта институционализации выживания детей.
- Берман С. Средний отит у детей. Медицинский журнал Новой Англии. 1995a; 332 (23): 1560–65. [PubMed: 7739711]
- ———. 1995b Отитные средства в педиатрии развивающихся стран 961, часть 1126–31. [PubMed: 7596700]
Бхаттачарья, К., П. Винч, К. ЛеБан и М. Тьен. 2001. «Стимулы и сдерживающие факторы для работников здравоохранения в сообществе: как они влияют на мотивацию, удержание и устойчивость». Basic Support for Institutionalizing Child Survival Project Агентства США по международному развитию, Арлингтон, Вирджиния.
- Блэк Р. Э., Моррис С. С., Брайс Дж. Где и почему 10 миллионов детей умирают каждый год? Ланцет. 2003. 361 (9376): 2226–34. [PubMed: 12842379]
- Блэк С. Б., Шайнфилд Х. Р., Файерман Б., Льюис Э., Рэй П., Хансен Дж. Р. Группа Центра изучения вакцин Kaiser Permanente Северной Калифорнии. Эффективность, безопасность и иммуногенность гептавалентной пневмококковой конъюгированной вакцины у детей. Журнал детских инфекционных болезней. 2000. 19 (3): 187–95. [PubMed: 10749457]
- Блэк С. Б., Шайнфилд Х. Р., Файерман Б., Хиатт Р. Безопасность, иммуногенность и эффективность олигосахаридного конъюгата у младенцев Haemophilus influenzae Вакцина типа B для населения США: возможные последствия для оптимального использования.Журнал инфекционных болезней. 1992; 165 (Приложение 43): S139–43. [PubMed: 1588149]
- Блэк С. Б., Шайнфилд Х. Р., Хансен Дж., Элвин Л., Лауфер Д., Малиноски Ф. Постлицензионная оценка эффективности семивалентной пневмококковой конъюгированной вакцины. Журнал детских инфекционных болезней. 2001. 20 (12): 1105–7. [PubMed: 11740313]
- Бобат Р., Кувадия Х. М., Мудли Д., Коутсудис А. Смертность в когорте детей, рожденных ВИЧ-1 инфицированными женщинами из Дурбана, Южная Африка. Южноафриканский медицинский журнал.1999. 89 (6): 646–48. [PubMed: 10443216]
- Booy R., Hodgson S., Carpenter L., Mayon-White R. T., Slack M. P., Macfarlane J. A. et al. Эффективность Haemophilus influenzae PRP-T конъюгированной вакцины типа B. Ланцет. 1994. 344 (8919): 362–66. [PubMed: 7 6]
- Брайс Дж., Боски-Пинто К., Сибуя К., Блэк Р. Э. Справочная группа ВОЗ по эпидемиологии здоровья детей. . Оценки ВОЗ причин смерти у детей. Ланцет. 2005; 365: 1147–52. [PubMed: 15794969]
- Кэмпбелл Х., Армстронг Дж. Р. М., Байасс П. Загрязнение воздуха в помещениях в развивающихся странах и острая респираторная инфекция у детей. Ланцет. 1989; 1 (8645): 1012. [PubMed: 2565480]
- Кэмпбелл Х., Байасс П., Ламонт А. С., Форги И. М., О’Нил К. П., Ллойд-Эанс Н., Гринвуд Б. М. Оценка клинических критериев для выявления тяжелых острых инфекций нижних дыхательных путей у детей. Ланцет. 1989; 1 (8633): 297–99. [PubMed: 2563457]
- Группа изучения догоняющих событий. Клиническая эффективность ко-тримоксазола по сравнению с амоксициллином дважды в день для лечения пневмонии: рандомизированное контролируемое клиническое испытание в Пакистане.Архив болезней детства. 2002; 86: 113–18. [Бесплатная статья PMC: PMC1761064] [PubMed: 11827905]
- Cherian T., John T. J., Simoes E. A., Steinhoff M. C., John M. Оценка простых клинических признаков для диагностики острой инфекции нижних дыхательных путей. Ланцет. 1988. 2: 125–28. [PubMed: 2899187]
- Cherian T., Simoes E. A., Steinhoff M. C., Chitra K., John M., Raghupathy P. et al. Бронхиолит в тропической южной Индии. Американский журнал болезней детей. 1990. 144 (9): 1026–30.[PubMed: 2396617]
- Каттс Ф. Т., Заман С. М. А., Энвере Г., Джаффар С., Левин О. С., Ококо Дж. Б. и др. Эффективность девятивалентной пневмококковой конъюгированной вакцины против пневмонии и инвазивного пневмококкового заболевания в Гамбии: рандомизированное, двойное слепое, плацебо-контролируемое исследование. Ланцет. 2005; 365 (9465): 1139–46. [PubMed: 15794968]
- де Андраде А. Л., де Андраде Дж. Г., Мартелли К. М., Сильва С. А., де Оливейра Р. М., Коста М. С. и др. Эффективность конъюгированной вакцины Haemophilus influenzae B при детской пневмонии: исследование случай-контроль в Бразилии.Международный журнал эпидемиологии. 2004. 33 (1): 173–81. [PubMed: 15075166]
- Денни Ф. У. мл. Клиническое влияние респираторных вирусных инфекций человека. Американский журнал респираторной медицины и реанимации. 1995; 152 (4, часть 2): S4–12. [PubMed: 7551411]
- Dobson M. Концентраторы кислорода обеспечивают экономию средств для развивающихся стран: исследование, основанное на Новой Гвинее. Анестезия. 1991; 146: 217–19. [PubMed: 2014901]
- Дуглас Р. М., Майлз Х. Б. Вакцинация против Streptococcus pneumoniae в детстве: отсутствие очевидной пользы для маленьких австралийских детей.Журнал инфекционных болезней. 1984. 149 (6): 861–69. [PubMed: 6376653]
- Duke T, Mgone J., Frank D. Гипоксемия у детей с тяжелой пневмонией в Папуа-Новой Гвинее. Международный журнал туберкулеза и болезней легких. 2001; 5: 511–19. [PubMed: 11409576]
- Эскола Дж., Кайхти Х., Такала А. К., Пелтола Х., Роннберг П. Р., Кела Э. и др. Рандомизированное проспективное полевое испытание конъюгированной вакцины для защиты младенцев и детей младшего возраста от инвазивной болезни Haemophilus influenzae типа B.Медицинский журнал Новой Англии. 1990. 323 (20): 1381–87. [PubMed: 2233904]
- Eskola J., Kilpi T., Palmu A., Jokinen J., Haapakoski J., Herva E. et al. Эффективность пневмококковой конъюгированной вакцины против острого среднего отита. Медицинский журнал Новой Англии. 2001. 344 (6): 403–9. [PubMed: 11172176]
- Фарли Дж., Кинг Дж. К., Наир П., Хайнс С. Э., Трессьер Р. Л., Винк П. Э. Инвазивное пневмококковое заболевание среди инфицированных и неинфицированных детей матерей с инфекцией, вызванной вирусом иммунодефицита человека.Журнал педиатрии. 1994; 124: 853–58. [PubMed: 8201466]
- Фиддиан-Грин Р. Г., Бейкер С. Нозокомиальная пневмония у критически больных: продукт аспирации или перемещения? Реанимационная медицина. 1991; 19: 763–69. [PubMed: 2055052]
- Файерман Б., Блэк С. Б., Шайнфилд Х. Р., Ли Дж., Льюис Э., Рэй П. Воздействие пневмококковой конъюгированной вакцины на средний отит. Журнал детских инфекционных болезней. 2003. 22 (1): 10–16. [PubMed: 12544402]
- Фритцелл Б., Плоткин С. Эффективность и безопасность вакцины, конъюгированной с капсульным полисахаридом столбняка и белком столбняка, Haemophilus influenzae.Журнал педиатрии. 1992. 121 (3): 355–62. [PubMed: 1517908]
- Гесснер Б. Д., Сутанто А., Линехан М., Джелантик И. Г., Флетчер Т., Герудуг И. К. и др. Заболеваемость гемофильной пневмонией и менингитом, предотвращаемым вакцинацией, Haemophilus Influenzae у индонезийских детей: рандомизированное исследование вакцины Hamlet. Ланцет. 2005; 365 (9453): 43–52. [PubMed: 15643700]
- Гафур А., Номани Н. К., Исхак З., Заиди С. З., Анвар Ф., Берни М. И. и др. Диагностика острых инфекций нижних дыхательных путей у детей в Равалпинди и Исламабаде, Пакистан.Обзоры инфекционных болезней. 1990; 12 (Приложение 8): S907–14. [PubMed: 2270413]
- Гилкс К. Ф. Пневмококковая болезнь и ВИЧ-инфекция. Анналы внутренней медицины. 1993; 118: 393–94. [PubMed: 8430986]
- Гоэль А., Бэмфорд Л., Хансло Д., Хасси Г. Первичная стафилококковая пневмония у детей раннего возраста: обзор 100 случаев. Журнал тропической педиатрии. 1999. 45 (4): 233–36. [PubMed: 10467836]
- Хемент Дж. М., Аэртс П. К., Флир А., Ван Дейк Х., Хармсен Т., Кимпен Дж. Л., Вольфс Т.F. Повышенная адгезия Streptococcus pneumoniae к эпителиальным клеткам человека, инфицированным респираторно-синцитиальным вирусом. Педиатрические исследования. 2004. 55 (6): 972–78. [PubMed: 15103015]
- Heath P. T. Haemophilus influenzae Конъюгированные вакцины типа B: обзор данных об эффективности. Журнал детских инфекционных болезней. 1998. 17 (9 доп.): S117–22. [PubMed: 9781743]
- Hortal M., Mogdasy C., Russi J. C., Deleon C., Suarez A. Микробные агенты, ассоциированные с пневмонией у детей из Уругвая.Обзоры инфекционных болезней. 1990; 12 (Приложение 8): S915–22. [PubMed: 2270414]
- Икеогу М. О., Вольф Б., Мате С. Легочные проявления у ВИЧ-серопозитивных и недоедающих детей в Зимбабве. Архив болезней детства. 1997. 76: 124–28. [Бесплатная статья PMC: PMC1717076] [PubMed:
- 01]
- Джина П. М., Кувадия Х. М., Кристал В. Pneumocystis carinii и cytomegalo Вирусные инфекции у тяжелобольных ВИЧ-инфицированных африканских младенцев. Анналы тропической педиатрии.1996; 16: 361–68. [PubMed: 8985536]
- Цзян З., Нагата Н., Молина Э., Бакалетз Л. О., Хокинс Х., Патель Дж. А. Усиленное прикрепление нетипируемого Haemophilus influenzae , инфицированного респираторно-синцитиальным вирусом, к респираторным эпителиальным клеткам, инфицированным синцитиальным вирусом. Инфекция и иммунитет. 1999; 67: 187–92. [Бесплатная статья PMC: PMC96295] [PubMed: 9864214]
Джон Т. Дж. 1994. «Кто определяет национальную политику здравоохранения?» In Вакцинация и здоровье в мире: четвертый ежегодный форум общественного здравоохранения Лондонской школы гигиены и тропической медицины , изд.Каттс Ф. Т., Смит П. Г., 205–11. Чичестер, Великобритания: Джон Вили.
- Джон Т. Дж., Чериан Т., Стейнхофф М. К., Симоэс Э. А., Джон М. Этиология острых респираторных инфекций у детей в тропиках на юге Индии. Обзоры инфекционных болезней. 1991; 13 (Приложение 6): S463–69. [PubMed: 1862277]
- Камат К. Р., Фельдман Р. А., Рао П. С., Уэбб Дж. К. Инфекция и болезнь в группе южноиндийских семей. Американский журнал эпидемиологии. 1969; 89: 375–83. [PubMed: 5778926]
- Карма П., Луотонен Дж., Тимонен М., Понтинен С., Пукандер Дж., Херва Э. и др. Эффективность пневмококковой вакцины против рецидивирующего среднего отита: предварительные результаты полевых испытаний в Финляндии. Annals of Otology, Rhinology, and Laryngology Suppl. 1980. 89 (3, часть 2): 357–62. [PubMed: 6778346]
Картасасмита, С. 2003. «Пероральный котримоксазол три или пять дней при нетяжелой пневмонии». Документ представлен на Консультативном совещании Всемирной организации здравоохранения по обзору текущих исследований и лечению острых респираторных инфекций, Женева, 29 сентября — 1 октября.
- Килпи Т., Ахман Х., Йокинен Дж., Ланкинен К. С., Палму А., Саволайнен Х. и др. Защитная эффективность второй пневмококковой конъюгированной вакцины против пневмококкового острого среднего отита у младенцев и детей: рандомизированное контролируемое испытание семивалентной конъюгированной вакцины комплексный пневмококковый полисахарид-менингококковый белок-белок внешней мембраны у 1666 детей. Клинические инфекционные болезни. 2003. 37 (9): 1155–64. [PubMed: 14557958]
- Клугман К. П., Мадхи С. А., Хюбнер Р.E., Kohberger R., Mbelle N., Pierce N. et al. Испытание пневмококковой конъюгированной вакцины 9-Valent у детей с ВИЧ-инфекцией и без нее. Медицинский журнал Новой Англии. 2003. 349 (14): 1341–48. [PubMed: 14523142]
- Колстад П. Р., Бернем Г., Калтер Х. Д., Кения-Мугиша Н., Блэк Р. Э. Комплексное ведение детских болезней в Западной Уганде. Бюллетень Всемирной организации здравоохранения. 1997; 75 (Приложение 1): 77–85. [Бесплатная статья PMC: PMC2486998] [PubMed: 9529720]
- Lagos R., Хорвиц И., Торо Дж., Сан Мартин О., Абрего П., Бустаманте С. и др. Масштабная, постлицензионная, селективная вакцинация чилийских младенцев конъюгированной вакциной PRP-T: практичность и эффективность в предотвращении инвазивных инфекций Haemophilus influenzae типа B. Журнал детских инфекционных болезней. 1996; 15: 216–22. [PubMed: 8852909]
- Леманн Д., Маршалл Т. Ф., Райли И. Д., Альперс М. П. Влияние пневмококковой вакцины на заболеваемость острыми инфекциями нижних дыхательных путей у детей Папуа-Новой Гвинеи.Анналы тропической педиатрии. 1991. 11 (3): 247–57. [PubMed: 1719924]
- Левин О. С., Лагос Р., Муньос А., Вильяроэль Дж., Альварес А. М., Абрего П. и др. Определение бремени пневмонии у детей, которую можно предотвратить с помощью вакцинации против Haemophilus influenzae Тип B. Журнал детских инфекционных болезней. 1999. 18 (12): 1060–64. [PubMed: 10608624]
- Лукас С. Б., Пикок С. С., Хунноу А., Браттегаард К., Коффи К., Хонд М. и др. Заболевание у детей, инфицированных ВИЧ в Абиджане, Кот-д’Ивуар.Британский медицинский журнал. 1996; 312: 335–38. [Бесплатная статья PMC: PMC2350283] [PubMed: 8611829]
- Мадхи С.А., Петерсен К., Мадхи А., Хосал М., Клугман К.П. Повышенное бремя болезней и устойчивость бактерий к антибиотикам, вызывающая тяжелые инфекции нижних дыхательных путей, приобретенные в сообществе Дети, инфицированные вирусом иммунодефицита человека 1. Клинические инфекционные болезни. 2000. 31: 170–76. [PubMed: 10
- 7]
- Мадхи С. А., Петерсен К., Мадхи А., Васас А., Клугман К. П.Влияние вируса иммунодефицита человека типа 1 на спектр заболеваний Streptococcus pneumoniae у детей Южной Африки. Журнал детских инфекционных болезней. 2000. 19 (12): 1141–47. [PubMed: 11144373]
- Макела П. Х., Сибаков М., Херва Э., Хенрихсен Дж., Луотонен Дж., Тимонен М. и др. Пневмококковая вакцина и средний отит. Ланцет. 1980; 2 (8194): 547–51. [PubMed: 6106735]
Управленческие науки для здравоохранения. 2005. Международный справочник по индикаторам цен на лекарства .Кембридж, Массачусетс: Управленческие науки для здоровья.
- МакКуллерс Дж. А., Бартмесс К. С. Роль нейраминидазы в летальном синергизме между вирусом гриппа и Streptococcus pneumoniae . Журнал инфекционных болезней. 2003. 187: 1000–9. [PubMed: 12660947]
- Монто А. С., Ульман Б. М. Острое респираторное заболевание в американском сообществе: исследование Текумсе. Журнал Американской медицинской ассоциации. 1974. 227 (2): 164–69. [PubMed: 4357298]
- Малхолланд К., Усен С., Адегбола Р., Использование Вебером пневмококковой полисахаридной вакцины у детей. Ланцет. 1998. 352 (9127): 575–76. [PubMed: 9716087]
- Малхолланд Э. К., Симоэс Э. А., Касталес М. О., МакГрат Э. Дж., Маналак Э. М., Гоув С. Стандартизированная диагностика пневмонии в развивающихся странах. Журнал детских инфекционных болезней. 1992; 11: 77–81. [PubMed: 1741202]
- Малхолланд К., Хилтон С., Адегбола Р., Усен С., Опарауго А., Омосиго С. и др. Рандомизированное исследование Haemophilus influenzae вакцины конъюгированной против столбняка с белком типа B для профилактики пневмонии и менингита у младенцев в Гамбии.Ланцет. 1997. 349 (9060): 1191–97. [PubMed:
- 39]
- Натху К. Дж., Нкрума Ф. К., Ндлову Д., Нхембе Д., Пири Дж., Ково Х. Острая инфекция нижних дыхательных путей у госпитализированных детей в Зимбабве. Анналы тропической педиатрии. 1993; 13: 253–61. [PubMed: 7505550]
- Нойзил К. М., Чжу Ю., Гриффин М. Р., Эдвардс К. М., Томпсон Дж. М., Толлефсон С. Дж., Райт П. Ф. Бремя межпандемического гриппа у детей младше 5 лет: 25-летнее перспективное исследование. Журнал инфекционных болезней.2002; 185: 147–52. [PubMed: 11807687]
- Nolan T., Angos P., Cunha A. J., Muhe L., Qazi S., Simoes E. A. et al. Качество стационарной помощи тяжелобольным детям в менее развитых странах. Ланцет. 2001. 357 (9250): 106–10. [PubMed: 11197397]
- Обаро С., Лич А., Макадам К. В. Использование пневмококковой полисахаридной вакцины у детей. Ланцет. 1998; 352 (9127): 575. [PubMed: 9716086]
- О’Брайен К. Л., Моултон Л. Х., Рид Р., Уэзерхольц Р., Оски Дж., Браун Л. и др. Эффективность и безопасность семивалентной конъюгированной пневмококковой вакцины у детей американских индейцев: групповое рандомизированное исследование.Ланцет. 2003. 362 (9381): 355–61. [PubMed: 12 8]
- Оньянго Ф. Э., Стейнхофф М. С., Вафула Э. М., Вариуа С., Мусиа Дж., Китони Дж. Гипоксемия у маленьких кенийских детей с острой инфекцией нижних дыхательных путей. Британский медицинский журнал. 1993. 306 (6878): 612–15. [Бесплатная статья PMC: PMC1676956] [PubMed: 8369033]
- Пандей М. Р., Даулер Н. М., Старбак Э. С., Хьюстон Р. М., Макферсон К. Снижение общей смертности детей в возрасте до пяти лет в Западном Непале с помощью противомикробного лечения пневмонии на уровне местных сообществ.Ланцет. 1991. 338 (8773): 993–97. [PubMed: 1681351]
- Пандей М. Р., Шарма П. Р., Губхаджу Б. Б., Шакья Г. М., Неупане Р. П., Гаутам А. и др. Воздействие пилотной программы борьбы с острыми респираторными инфекциями (ОРИ) в сельском сообществе Горного региона Непала. Анналы тропической педиатрии. 1989. 9 (4): 212–20. [PubMed: 2482002]
- Педерсон Дж., Найроп М. Анестезиологическое оборудование для развивающихся стран. Британский журнал анестезии. 1991; 66: 264–70. [PubMed: 1817634]
- Пейрис Дж.S., Yu W. C., Leung C. W., Cheung C. Y., Ng W. F., Nicholls J. M. et al. Повторное появление заболевания подтипа H5N1 гриппа человека со смертельным исходом. Ланцет. 2004; 363 (9409): 617–19. [Бесплатная статья PMC: PMC7112424] [PubMed: 14987888]
- Перкинс Б. А., Цукер Дж. Р., Отинео Дж., Джафари Х. С., Пакстон Л., Редд С. С. и др. Оценка алгоритма интегрированного ведения детских болезней в районе Кении с высоким уровнем передачи малярии. Бюллетень Всемирной организации здравоохранения. 1997; 75 (Приложение 1): 33–42.[Бесплатная статья PMC: PMC2487004] [PubMed: 9529716]
Киамбао, Б. П., Э. А. Симоес, Э. Абучехо-Ладесма, Л. С. Гозум, С. П. Луписан, Л. Т. Сомбреро и П. Дж. Рууту (Консорциум ARIVAC). Скоро. «Серьезные детские инфекции, приобретенные в сообществе, в сельских районах Азии (остров Бохол, Филиппины)». Журнал детских инфекционных болезней .
Редд С. Диагностика и лечение острых респираторных инфекций в Лесото. Политика и управление здравоохранением. 1994; 5: 255–60.
- Райли И. Д., Эверингем Ф. А., Смит Д. Э., Дуглас Р. М. Иммунизация поливалентной пневмококковой вакциной: влияние респираторной смертности у детей, живущих в Высокогорье Новой Гвинеи. Архив болезней детства. 1981. 56 (5): 354–57. [Бесплатная статья PMC: PMC1627425] [PubMed: 7020609]
- Райли И. Д., Леманн Д., Альперс М. П. Испытания пневмококковой вакцины в Папуа-Новой Гвинее: взаимосвязь между эпидемиологией пневмококковой инфекции и эффективностью вакцины. Обзоры инфекционных болезней.1991; 13 (Приложение 6): S535–41. [PubMed: 1862283]
- Рудан И., Томаскович Л., Боски-Пинто К., Кэмпбелл Х. Справочная группа ВОЗ по эпидемиологии здоровья детей. Глобальная оценка заболеваемости клинической пневмонией среди детей в возрасте до пяти лет. Бюллетень Всемирной организации здравоохранения. 2004. 82 (12): 895–903. [Бесплатная статья PMC: PMC2623105] [PubMed: 15654403]
Рудан и другие. Скоро.
- Santosham M., Wolff M., Reid R., Hohenboken M., Bateman M., Goepp J.и другие. Эффективность конъюгированной вакцины, состоящей из Haemophilus influenzae типа B и Neisseria meningitidis Внешнемембранного белкового комплекса, у младенцев навахо. Медицинский журнал Новой Англии. 1991. 324 (25): 1767–72. [PubMed: 1
6]
- Сазавал С., Блэк Р. Э. Группа исследований по ведению больных с пневмонией: влияние ведения больных с пневмонией на смертность новорожденных, младенцев и детей дошкольного возраста — метаанализ испытаний на уровне сообществ. Ланцетные инфекционные болезни.2003; 3: 547–56. [PubMed: 12954560]
- Schellenberg J. A., Victora C.G., Mushi A., de Savigny D., Schellenberg D., Mshinda H. et al. Неравенство среди очень бедных: здравоохранение для детей в сельских районах Южной Танзании. Ланцет. 2003. 361 (9357): 561–66. [PubMed: 12598141]
- Шнайдер Г. Обеспечение кислородом в сельских районах Африки: личный опыт. Международный журнал туберкулеза и болезней легких. 2001. 5 (6): 524–26. [PubMed: 11409578]
Шумахер, Р., Э. Сведберг, М.О. Диалло, Д. Р. Кейта, Х. Кальтер, О. Паша. 2002. Исследование смертности в Гвинее: исследование причин смерти детей в возрасте до пяти лет . Арлингтон, Вирджиния: Спасите детей и базовая поддержка для институционализации проекта выживания детей.
- Шэнн Ф. Этиология тяжелой пневмонии у детей в развивающихся странах. Детская инфекционная болезнь. 1986. 5 (2): 247–52. [PubMed: 3952013]
- Шенн Ф., Граттен М., Гермер С., Линнеманн В., Хазлетт Д., Пейн Р. Этиология пневмонии у детей в больнице Горока, Папуа-Новая Гвинея.Ланцет. 1984. 2 (8402): 537–41. [PubMed: 6147602]
- Шенн Ф., Харт К., Томас Д. Острые инфекции нижних дыхательных путей у детей: возможные критерии выбора пациентов для антибактериальной терапии и госпитализации. Бюллетень Всемирной организации здравоохранения. 1984; 62: 749–51. [Бесплатная статья PMC: PMC2536213] [PubMed: 6334573]
- Simoes E. A. Респираторно-синцитиальная вирусная инфекция. Ланцет. 1999. 354 (9181): 847–52. [PubMed: 10485741]
- Симоэс Э. А., Деста Т., Тессема Т., Gerbresellassie T., Dagnew M., Gove S. Эффективность медицинских работников после обучения комплексному ведению детских болезней в Гондаре, Эфиопия. Бюллетень Всемирной организации здравоохранения. 1997; 75 (Приложение 1): 43–53. [Бесплатная статья PMC: PMC2487005] [PubMed: 9529717]
- Слойер Дж. Л. Дж., Плуссард Дж. Х., Хоуи В. М. Эффективность пневмококковой полисахаридной вакцины в предотвращении острого среднего отита у младенцев в Хантсвилле, Алабама. Обзоры инфекционных болезней. 1981; 3 (Прил.): S119–23. [PubMed: 7280444]
- Стенсбаль Л.Г., Девасундарам Дж. К., Симоэс Э. А. Эпидемии респираторно-синцитиального вируса: взлеты и падения сезонного вируса. Журнал детских инфекционных болезней. 2003; 22 (2 доп.): S21–32. [PubMed: 12671449]
- Штраус В. Л., Кази С. А., Кунди З., Номани Н. К., Шварц Б. Группа по изучению ко-тримоксазола. Устойчивость к противомикробным препаратам и клиническая эффективность ко-тримоксазола по сравнению с амоксициллином при пневмонии у детей в Пакистане: рандомизированное контролируемое исследование. Ланцет. 1998. 352: 270–74. [PubMed: 96]
- Темпл К., Гринвуд Б., Инскип Х., Холл А., Коскела М., Лейнонен М. Ответ антител на пневмококковую капсульную полисахаридную вакцину у африканских детей. Журнал детских инфекционных болезней. 1991. 10 (5): 386–90. [PubMed: 2067888]
- Тупаси Т. Э., Лусеро М. Г., Магдангал Д. М., Мангубат Н. В., Сунико М. Э., Торрес К. У. и др. Этиология острой инфекции нижних дыхательных путей у детей из Алабанга, Метро Манила. Обзоры инфекционных болезней. 1990; 12 (Приложение 8): S929–39. [PubMed: 2270415]
ЮНЭЙДС (Объединенная программа Организации Объединенных Наций по ВИЧ / СПИДу).2002. Обновление эпидемии СПИДа . Женева: ЮНЭЙДС.
- Усен С., Вебер М., Малхолланд К., Джаффар С., Опарауго А., Омосиго С. и др. Клинические предикторы гипоксемии у детей Гамбии с острой инфекцией нижних дыхательных путей: проспективное когортное исследование. Британский медицинский журнал. 1999. 318 (7176): 86–91. [Бесплатная статья PMC: PMC27680] [PubMed: 9880280]
- Van den Hoogen BG, de Jong JC, Groen J., Kuiken T., de Groot R., Fouchier RA, Osterhaus AD Недавно обнаруженный человеческий пневмовирус, выделенный у детей раннего возраста при заболевании дыхательных путей.Природная медицина. 2001; 7: 719–24. [Бесплатная статья PMC: PMC7095854] [PubMed: 11385510]
- Вуори-Холопайнен Э., Пелтола Х. Переоценка легочного легочного: обзор старого метода для лучшей этиологической диагностики детской пневмонии. Клинические инфекционные болезни. 2001. 32 (5): 715–26. [PubMed: 11229839]
- Вебер М. В., Малхолланд Э. К., Джаффар С., Трёдссон Х., Гоув С., Гринвуд Б. М. Оценка алгоритма комплексного ведения детских болезней в районе с сезонной малярией в Гамбии.Бюллетень Всемирной организации здравоохранения. 1997; 75 (Приложение 1): 25–32. [Бесплатная статья PMC: PMC2486992] [PubMed: 9529715]
- Венгер Дж. Д., ДиФабио Дж., Ландаверде Дж. М., Левин О.С., Гаафар Т. Внедрение конъюгированных вакцин против Hib-инфекции в непромышленных странах: опыт в четырех странах, которые «недавно приняли» . Вакцина. 1999. 18 (78): 736–42. [PubMed: 10547434]
Венгер, Дж. Д. и М. М. Левин, ред. 1997. Эпидемиологическое влияние конъюгированной вакцины на инвазивное заболевание, вызываемое гемофильной палочкой Haemophilus influenzae Тип B .Нью-Йорк: Марсель Деккер.
- Уитни К. Г., Фарли М. М., Хадлер Дж., Харрисон Л. Х., Беннетт Н. М., Линфилд Р. и др. Снижение инвазивного пневмококкового заболевания после введения протеин-полисахаридной конъюгированной вакцины. Медицинский журнал Новой Англии. 2003. 348 (18): 1737–46. [PubMed: 12724479]
ВОЗ (Всемирная организация здравоохранения). 1990. «Антибиотики в лечении острых респираторных инфекций у детей раннего возраста». Неопубликованный документ WHO / ARI / 90.10, доступный по запросу в Отделе здоровья и развития детей, бывшего Отдела борьбы с диарейными и острыми респираторными заболеваниями, ВОЗ, Женева.
———. 1991. «Ведение маленького ребенка с острой респираторной инфекцией. Модуль обучения навыкам супервизии». Неопубликованный документ, доступный по запросу в Отделе здоровья и развития детей ВОЗ, бывшем Отделении борьбы с диарейными и острыми респираторными заболеваниями, ВОЗ, Женева.
———. 2002. Многострановая оценка эффективности, затрат и воздействия ИВБДВ (MCE): отчет о ходе работы, май 2001 г. — апрель 2002 г. .WHO / FCH / CAH / 02.16. Женева: Отдел здоровья и развития детей и подростков, ВОЗ.
———. 2003. Консультативное совещание по ведению детей с пневмонией и ВИЧ-инфекцией, 30–31 января 2003 г., Хараре, Зимбабве . WHO / FCH / CAH / 03.4. Женева: ВОЗ.
- ———. 2004a Группа по обзору Haemophilus influenzae Бремя болезни типа B (Hib) в Бангладеш, Индонезия и других азиатских странах, Бангкок, 28–29 января 2004 г. Еженедельный эпидемиологический отчет 79 (18): 173–75.[PubMed: 15168565]
———. 2004b. «Совместное заявление ВОЗ / ЮНИСЕФ: ведение пневмонии в общественных местах». WHO / FCH / CAG / 04.06. ВОЗ, Женева.
ВОЗ (Всемирная организация здравоохранения) и здоровье детей-подростков. Скоро. Отчет о методологии и предположениях, использованных для оценки затрат на расширение отдельных мероприятий по охране здоровья детей до 95% с целью снижения смертности детей в возрасте до пяти лет . Женева: ВОЗ.
- Уильямс Б. Г., Гоус Э., Боски-Пинто К., Брайс Дж., Дай С. Оценки глобального распределения детской смертности от острых респираторных инфекций. Ланцетные инфекционные болезни. 2002; 2: 25–32. [PubMed: 11892493]
Всемирный банк. 2002. Показатели мирового развития . CD-ROM. Вашингтон, округ Колумбия: Всемирный банк.
- Цви К. Дж., Петтифиор Дж. М., Содерлунд Н. Педиатрическая больница при городской региональной больнице Южной Африки: влияние ВИЧ, 1992–1997. Анналы тропической педиатрии. 1999; 19: 135–42. [PubMed: 106]
ОРВИ, обструктивная болезнь легких, бронхит
Острые респираторные вирусные инфекции (ОРВИ), грипп и простуда
Эти заболевания чаще всего возникают в нашей жизни и в жизни членов нашей семьи.С наступлением холодов почти все время от времени становятся жертвами этих хоть и краткосрочных, но, тем не менее, чахоточных заболеваний. Что мы делаем в большинстве случаев? Мы идем в аптеку за лекарствами / порошками / таблетками от простуды, которые дадут нам желаемый облегчающий эффект. Хотя этот эффект весьма желателен, он носит лишь симптоматический характер. Порошки и таблетки от простуды не содержат компонентов, побеждающих причину заболевания — инфекцию.
Фармацевтическая промышленность пошла вперед и предлагает рынку продукты, обеспечивающие радикальное и безопасное решение проблемы ОРВИ и гриппа.Это ингаляционные противовирусные и антисептические препараты:
1) Уничтожают вирусы и бактерии;
2) Они оказывают локальное действие и поэтому безопасны.
Несколько слов о симптомах ОРВИ / гриппа / простуды. Наиболее частыми проявлениями этих состояний являются лихорадка, боль в горле, ощущение першения в горле, кашель, чихание, насморк, ломота в теле, головная боль.
ОСНОВНАЯ НЕБУЛАЙЗЕРНАЯ ТЕРАПИЯ:
- Декасан ® ингаляции (1-2 небулы на ингаляцию, согласно основной инструкции по назначению) 2-3 раза в день в течение 4-7 дней.
- Для противовирусных целей: AKK ® (выбрать путь введения согласно BPI) до 8 раз в сутки в течение 4-7 дней.
СИМПТОМАТИЧЕСКАЯ ТЕРАПИЯ:
- Для разжижения и удаления мокроты из дыхательных путей используйте ингаляции Lorde ® hyal (взрослые и дети старше 645 лет) / Lorde (детям до 6 лет) 2–3 раза в сутки в течение 4–7 дней.
- Другие симптоматические средства (жаропонижающие, сосудосуживающие и другие средства — следуйте рекомендациям врача).
Перед применением лекарственного препарата для устранения вышеперечисленных симптомов проконсультируйтесь с врачом или фармацевтом.
Профилактика гриппа и ОРВИ в холодное время года
Профилактика — лучшее лечение. В нашей стране мы редко прибегаем к профилактическим мерам. Как правило, мы начинаем беспокоиться о своем здоровье, когда уже столкнулись со свершившимся фактом болезни.Заболевание — это состояние, которое дешевле предотвратить, не говоря уже о том, что профилактические меры не имеют последствий для нашего повседневного образа жизни. Чтобы предотвратить болезнь, нам не нужно брать больничный, перестать ходить в школу, работать… и, более того, мы не становимся источником инфекции для наших родственников (в том числе детей), друзей и просто случайных знакомых. Похоже, мы говорим инфекции: «Мы — твой тупик». И инфекция держится подальше от нас и находит другую жертву, чтобы жить и развиваться — того, кто заранее не заботился о профилактике ОРВИ и гриппа.
Профилактика ОРВИ и гриппа может быть успешной без таблеток и порошка, если вы:
- принимаете АКК (выбираете способ введения по БПИ) 1-2 раза в день в течение 7-10 дней в течение «опасного» периода. сезон, когда высок риск заражения (осень-зима).
- промывать нос Назисофтом 2–3 раза в день в течение 7–10 дней. Вымывая микроорганизмы со слизистой оболочки (устранение), мы не оставляем шансов вирусам и бактериям прикрепиться к слизистой оболочке и спровоцировать процесс инфекционного воспаления.Процесс прикрепления значительно затрудняется гиалуроновой кислотой, содержащейся в Nasisoft.
Фарингит: особенности заболевания и схема лечения
Фарингит — инфекционно-воспалительный процесс в горле, а точнее на слизистой оболочке задней стенки глотки. Если при осмотре глотки вы видите налет на миндалинах (он может быть едва заметен), у вас болит горло, и мы настоятельно рекомендуем вам проконсультироваться с врачом для уточнения диагноза.Это связано с тем, что ангина относится к категории очень серьезных заболеваний, которые, если их не лечить надлежащим образом, могут привести к плохим результатам. К таким заболеваниям относятся, прежде всего, дифтерия и инфекционный мононуклеоз.
Каковы проявления фарингита? Прежде всего, это боль в горле и ощущение зуда в горле. Эта симптоматика может сочетаться с повышением температуры тела, кашлем, общей слабостью. В целом фарингит — это проявление ОРВИ, гриппа и, как мы его называли, простуды.
В дополнение к основной и симптоматической терапии рекомендуется использовать Декасан ® ингаляции (1-2 небулы по БПИ) 2–3 раза в день в течение 7–10 дней.
С противовирусным назначением: AKK ® (путь введения выбирайте согласно BPI) до 8 раз в сутки в течение 4-7 дней.
Для ингаляций, как у взрослых, так и у детей, маска — лучший вариант, так как она позволяет в большей степени воздействовать на верхние дыхательные пути.
Перед применением лекарственного препарата для устранения вышеперечисленных симптомов проконсультируйтесь с лечащим врачом или фармацевтом.
Бронхит
Наиболее частые проявления бронхита — лихорадка и кашель. В начале болезни кашель часто бывает сухим, мокроты практически не выделяется. Муколитическая терапия и правильный режим приема жидкости позволяют сделать кашель продуктивным, с легким отхождением мокроты. В начале заболевания мокрота прозрачная, слизистая, а по мере прогрессирования заболевания мокрота может приобретать желтоватый оттенок или даже зеленую окраску, что свидетельствует о присоединении к инфекционно-воспалительному процессу бактериальной микрофлоры.Если в мокроте есть прожилки крови, обратитесь к врачу.
ОСНОВНАЯ НЕБУЛАЙЗЕРНАЯ ТЕРАПИЯ:
- Декасан ® ингаляции (1-2 небулы на ингаляцию, согласно BPI) 2-3 раза в день в течение 4-7 дней.
- В противовирусных целях: АКК ® (ингаляции или капли в нос) до 8 раз в сутки в течение 4-7 дней.
СИМПТОМАТИЧЕСКАЯ ТЕРАПИЯ:
- Для разжижения и вывода мокроты из дыхательных путей используйте ингаляции Nasisoft (взрослые и дети старше 6 лет) / Lorde ® Hyal (дети до 6 лет) 2-3 раза в день в течение 4-7 дней.
- Другие симптоматические средства (жаропонижающие, сосудосуживающие и другие средства — следуйте рекомендациям врача).
Перед применением лекарственного препарата для устранения вышеперечисленных симптомов проконсультируйтесь с врачом или фармацевтом.
Пневмония
Пневмония или воспаление легких — серьезное заболевание, требующее наблюдения врача. Умеренные и тяжелые формы пневмонии чаще всего лечат в условиях стационара из-за высокого риска осложнений, особенно у маленьких детей.Наиболее частые проявления пневмонии — повышение температуры тела, кашель, общая слабость, недомогание.
В дополнение к базисной терапии с целью усиления противомикробной терапии и сокращения продолжительности заболевания рекомендуется проводить ингаляции Декасан ® (1-2 небулы по ПБИ) 2-3 раза в день. на 7-10 дней.
При необходимости показаны муколитики для облегчения отхождения мокроты — ингаляции с Lorde ® hyal 2 раза в день в течение 4-7 дней.Ингаляционный путь доставки муколитиков обеспечивает быстрый эффект и минимальный риск побочных реакций.
Для ингаляций, как у взрослых, так и у детей, лучше использовать мундштук, так как он позволяет в большей степени воздействовать на нижние дыхательные пути.
Перед применением лекарственного препарата для устранения вышеперечисленных симптомов проконсультируйтесь с лечащим врачом или фармацевтом.
Муковисцидоз
Муковисцидоз — это генетическое заболевание, вызванное мутацией гена.Синоним муковисцидоза — «муковисцидоз». Как правило, наличие этого заболевания у человека выявляют в раннем детстве — 70% случаев муковисцидоза выявляются в течение первых двух лет жизни. Есть несколько форм этого заболевания; одна из форм — легочная. У пациентов с легочной формой заболевания затруднен процесс отхождения мокроты. Из-за особенностей образования мокроты у людей с муковисцидозом для разжижения и отхождения мокроты требуется «тяжелая артиллерия муколитиков».К муколитикам с выраженным эффектом разжижения мокроты относятся Okistar hyal 7.
Ингаляции Okistar hyal 7 выполняются 2 раза в день или по мере необходимости.
Если вы испытываете дискомфорт при вдохе (ощущение першения в горле, одышка), мы рекомендуем вам использовать Lorde ® hyal.
Для ингаляций, как у взрослых, так и у детей, лучше использовать мундштук, так как он позволяет в большей степени воздействовать на нижние дыхательные пути.
Перед применением лекарственного препарата для устранения вышеперечисленных симптомов проконсультируйтесь с лечащим врачом или фармацевтом.
Аллергический ринит (заложенность носа)
Аллергический ринит или то, что часто называют «заложенностью носа» — что это такое?
Аллергический ринит (насморк) — воспалительный процесс слизистой оболочки носа, вызванный аллергеном. Да, мы привыкли, что воспаление чаще всего спровоцировано инфекцией. При аллергическом рините (как и при других аллергических заболеваниях) воспаление вызывается аллергеном (цветение, разлет пыльцы, пыль).Не всегда удается выявить аллерген и убрать его из своей жизни. А иногда выявление аллергена не приводит к облегчению состояния. Что делать в сезон цветения амброзии? Вы уедете из страны на пару месяцев? Это будет сложно сделать. Поэтому необходимо использовать фармацевтические препараты, которые могут вернуть вам нормальную жизнь и спокойный сон.
Желательно, чтобы лекарство, которым вы лечитесь, не калечило вас одновременно.Поэтому ознакомьтесь со следующей информацией:
- Незаменимый предмет — ULAIZER ® с назальной канюлей (мундштук не подойдет). Самая удобная для вас модель — это модель «Воздух». Он ультрапортативный, его можно заряжать от сигарной розетки или от аккумулятора;
- Lorde ® Hyal — настоящий пикап для вас. Удалит аллерген со слизистой оболочки носа (нет аллергена — нет аллергии) и будет способствовать восстановлению слизистой оболочки носа благодаря наличию гиалуроновой кислоты;
- Если в разгар цветения / распространения пыльцы ничто не может обеспечить вам спокойный сон и нормальный образ жизни, вы можете выбрать глюкокортикостероиды (ГКС), которые устранят воспаление и дадут вам желанное свободное дыхание!
- Если частое употребление наркотиков привело к кровотечению из носа, вам поможет AKK ® ! AKK ® остановит кровотечение и защитит вас от вирусной инфекции, ведь аллергическое воспаление способствует проникновению вирусной инфекции!
Перед применением лекарственного препарата для устранения вышеперечисленных симптомов проконсультируйтесь с врачом или фармацевтом.
Инфекционное обострение бронхиальной астмы (ba) и хронической обструктивной болезни легких (ХОБЛ)
Обострения БА и ХОБЛ необходимо лечить под наблюдением врача. Это, в первую очередь, связано с ярко выраженной «непредсказуемостью» этих состояний, если объем проводимой терапии недостаточен для устранения обострения. Это может привести к поступлению заболевшего в реанимацию в связи с развитием опасной для жизни стадии нарушения функции дыхания.
Помимо основной и неотложной терапии, Декасан ® для ингаляций (1-2 небулы, согласно BPI) можно использовать 2–3 раза в день в течение 7–10 дней.
Для разжижения и удаления мокроты из дыхательных путей используйте ингаляции Lorde ® Hyal 2–3 раза в день в течение 7–10 дней в соответствии с предписаниями врача. Для более выраженного муколитического эффекта используйте концентрацию продукта Lorde — Okistar hyal 7 (следите, чтобы не возникало неприятных ощущений).
Для ингаляций, как у взрослых, так и у детей, лучше использовать мундштук, так как он позволяет в большей степени воздействовать на нижние дыхательные пути.
Перед применением лекарственного препарата для устранения вышеперечисленных симптомов проконсультируйтесь с лечащим врачом или фармацевтом.
Ларингит
Пациентам с диагнозом ларингит лечат антисептическими средствами для гортани. Основная терапия направлена на борьбу с источниками заболевания — вирусными или бактериальными инфекциями. Если имеется небулайзер, ваш врач порекомендует вам лечить ларингит с помощью ингаляций:
- 1-2 Декасан ® небул (два раза в день, продолжительность лечения от 7 до 10 дней).
- Противовирусное респираторное средство АКК ® (до 8 ингаляций в день, продолжительность лечения от 4 до 7 дней).
При крупе используются антигистаминные препараты, глюкокортикоиды по назначению врача.
Перед применением лекарственного препарата для устранения вышеперечисленных симптомов проконсультируйтесь с лечащим врачом или фармацевтом.
Дифференциальный диагноз инфекций верхних дыхательных путей
[Рекомендации] Бисно А.Л., Гербер М.А., Гвалтни Дж. М. мл., Каплан Е. Л., Шварц Р. Х.Диагностика и лечение стрептококкового фарингита группы А: практическое руководство. Общество инфекционных болезней Америки. Клиническая инфекция . 1997 Сентябрь 25 (3): 574-83. [Медлайн].
[Рекомендации] Shulman ST, Bisno AL, Clegg HW, Gerber MA, Kaplan EL, Lee G, et al. Руководство по клинической практике по диагностике и лечению стрептококкового фарингита группы А: обновление 2012 г., подготовленное Американским обществом инфекционных болезней. Клиническая инфекция . 2012 15 ноя.55 (10): 1279-82. [Медлайн]. [Полный текст].
[Рекомендации] Уолд Э.Р., Эпплгейт К.Э., Бордли С., Дэрроу Д.Х., Глод М.П., Марси С.М. и др. Руководство по клинической практике по диагностике и лечению острого бактериального синусита у детей в возрасте от 1 до 18 лет. Педиатрия . 2013 июл.132 (1): e262-80. [Медлайн].
Департамент здравоохранения штата Юта, Бюро эпидемиологии. Звуковые файлы коклюша. Департамент здравоохранения штата Юта, Бюро эпидемиологии.Доступно на http://health.utah.gov/epi/diseases/pertussis/pertussis_sounds.htm. Доступ: 29 ноября 2012 г.
Центры по контролю и профилактике заболеваний. Коклюш (коклюш): клинические особенности. Доступно по адресу http://www.cdc.gov/pertussis/clinical/features.html. Доступ: 27 октября 2013 г.
Ahovuo-Saloranta A, Borisenko OV, Kovanen N, Varonen H, Rautakorpi UM, Williams JW Jr, et al. Антибиотики при остром гайморите. Кокрановская база данных Syst Rev . 2008 16 апреля. CD000243. [Медлайн].
[Рекомендации] Чоу А.В., Беннингер М.С., Брук И., Брозек Д.Л., Гольдштейн Е.Дж., Хикс Л.А. и др. Руководство IDSA по клинической практике острого бактериального риносинусита у детей и взрослых. Клиническая инфекция . 2012 г., 54 (8): e72-e112. [Медлайн]. [Полный текст].
Chung LP, Waterer GW. Генетическая предрасположенность к респираторным инфекциям и сепсису. Критический обзор Clin Lab Sci .2011 сен-дек. 48 (5-6): 250-68. [Медлайн].
Horby P, Nguyen NY, Dunstan SJ, Baillie JK. Роль генетики хозяина в восприимчивости к гриппу: систематический обзор. PLoS Один . 2012. 7 (3): e33180. [Медлайн]. [Полный текст].
Juno J, Fowke KR, Keynan Y. Иммуногенетические факторы, связанные с тяжелым респираторным заболеванием, вызванным зоонозными вирусами гриппа h2N1 и H5N1. Клин Дев Иммунол . 2012. 2012: 797180. [Медлайн].[Полный текст].
Мерилуото М., Хедман Л., Таннер Л., Симелл В., Мякинен М., Симелл С. и др. Связь инфекции бокавируса человека 1 с респираторными заболеваниями в ходе последующего наблюдения в детстве, Финляндия. Emerg Infect Dis . 2012 18 февраля (2): 264-71. [Медлайн]. [Полный текст].
Национальный центр инфекционных болезней. Отделение бактериальных и микотических болезней. Болезнь Haemophilus influenzae серотипа b (Hib). Центры по контролю и профилактике заболеваний.Доступно по адресу http://www.cdc.gov/hi-disease/clinICAL.html. Доступ: 29 ноября 2012 г.
Национальный центр инфекционных болезней. Отделение респираторных и кишечных вирусов. Вирусы парагриппа человека (ВПЧ). Центры по контролю и профилактике заболеваний. Доступно по адресу http://www.cdc.gov/ncidod/dvrd/revb/respiratory/hpivfeat.htm. Доступ: 30 апреля 2009 г.
[Рекомендации] Schwartz SR, Cohen SM, Dailey SH, et al. Рекомендации по клинической практике: охриплость голоса (дисфония). Отоларингол Хирургия головы и шеи . 2009 Сентябрь 141 (3 Дополнение 2): S1-S31. [Полный текст].
Cherry DK, Hing E, Woodwell DA, Rechtsteiner EA. Национальное исследование амбулаторной медицинской помощи: Резюме 2006 г. 2008 г. Доступно по адресу http://www.cdc.gov/nchs/data/nhsr/nhsr003.pdf.
Fagnan LJ. Острый синусит: экономичный подход к диагностике и лечению. Ам Фам Врач . 1998 15 ноября. 58 (8): 1795-802, 805-6. [Медлайн].
Центры по контролю и профилактике заболеваний.Доступ 30 апреля 2009 г. Неспецифическая инфекция верхних дыхательных путей. Доступно по адресу http://www.cdc.gov/drugresistance/community/hcp-info-sheets/adult-nurti.pdf.
Isakson M, Hugosson S. Острый эпиглоттит: эпидемиология и распределение серотипов Streptococcus pneumoniae у взрослых. Дж Ларингол Отол . 2011 Апрель 125 (4): 390-3. [Медлайн].
Центры по контролю и профилактике заболеваний. Наблюдение за коклюшем (коклюшем) и отчетность.Доступно по адресу http://www.cdc.gov/pertussis/surv-reporting.html. Дата обращения: 12 июня 2012 г.
Беттиол С., Ван К., Томпсон М.Дж., Робертс Н.В., Перера Р., Хенеган С.Дж. и др. Симптоматическое лечение кашля при коклюше. Кокрановская база данных Syst Rev . 2012 16 мая. 5: CD003257. [Медлайн].
Центры по контролю и профилактике заболеваний. Вспышки респираторных заболеваний, ошибочно приписываемых коклюшу — Нью-Гэмпшир, Массачусетс и Теннесси, 2004–2006 гг. MMWR Morb Mortal Wkly Rep . 2007 24 августа. 56 (33): 837-42. [Медлайн]. [Полный текст].
Центры CDC по контролю и профилактике заболеваний. Сезонный грипп (грипп). Центры по контролю и профилактике заболеваний. Доступно по адресу http://www.cdc.gov/flu/about/disease/index.htm. Дата обращения: 12 июня 2012 г.
Национальный центр инфекционных болезней. Отделение бактериальных и микотических болезней. Вирус Эпштейна-Барра и инфекционный мононуклеоз.Центры по контролю и профилактике заболеваний. Доступно по адресу http://www.cdc.gov/ncidod/diseases/ebv.htm. Доступ: 30 апреля 2009 г.
Центры по контролю и профилактике заболеваний. CDC. Дифтерия. Центры по контролю и профилактике заболеваний. CDC.gov. Доступно по адресу http://www.cdc.gov/ncidod/dbmd/diseaseinfo/diptheria_t.htm. Дата обращения: 12 июня 2012 г.
Национальный институт аллергии и инфекционных заболеваний. Простуда. Национальный институт аллергии и инфекционных заболеваний.Доступно по адресу http://www.niaid.nih.gov/topics/commoncold/Pages/default.aspx. Дата обращения: 12 июня 2012 г.
Wald ER, Guerra N, Byers C. Инфекции верхних дыхательных путей у маленьких детей: продолжительность и частота осложнений. Педиатрия . 1991 Февраль 87 (2): 129-33. [Медлайн].
CDC. Центры по контролю и профилактике заболеваний. Сезонный грипп (грипп): госпитализации, связанные с сезонным гриппом, в США.Центры по контролю и профилактике заболеваний. Доступно по адресу http://www.cdc.gov/flu/about/qa/hospital.htm. Доступ: 29 ноября 2012 г.
CDC. Центры по контролю и профилактике заболеваний. Коклюш (коклюш): клинические осложнения. Доступно по адресу http://www.cdc.gov/pertussis/clinical/complications.html. Дата обращения: 12 июня 2012 г.
Arola M, Ruuskanen O, Ziegler T, Mertsola J, Näntö-Salonen K, Putto-Laurila A, et al. Клиническая роль респираторной вирусной инфекции при остром среднем отите. Педиатрия . 1990 декабрь 86 (6): 848-55. [Медлайн].
Шульман УЛ. Детские аутоиммунные психоневрологические расстройства, связанные со стрептококками (PANDAS): обновленная информация. Curr Opin Pediatr . 2009 21 февраля (1): 127-30. [Медлайн].
Национальный институт аллергии и инфекционных заболеваний. Простуда: симптомы. Доступно по адресу http://www.niaid.nih.gov/topics/commonCold/Pages/symptoms.aspx. Доступ: 17 октября 2013 г.
[Рекомендации] Отдел профилактики ЗППП, CDC.Гонококковые инфекции. Руководство по лечению заболеваний, передающихся половым путем, 2010. Центры по контролю и профилактике заболеваний. Доступно по адресу http://www.cdc.gov/std/treatment/2010/gonococcal-infections.htm. Доступ: 29 ноября 2012 г.
Винсент М.Т., Селестин Н., Хуссейн А.Н. Фарингит. Ам Фам Врач . 2004 15 марта. 69 (6): 1465-70. [Медлайн].
CDC. Центры по контролю и профилактике заболеваний. Коклюш (коклюш): сбор образцов.Полный текст: http://cid.oxfordjournals.org/content/early/2012/09/06/cid.cis629.full. Доступно по адресу http://www.cdc.gov/pertussis/clinical/diagnostic-testing/specimen-collection.html. Доступ: 17 октября 2013 г.
Чау AW. Острый синусит: современное состояние этиологии, диагностика и лечение. Curr Clin Top Infect Dis . 2001. 21: 31-63. [Медлайн].
[Рекомендации] Workowski KA, Berman SM. Руководство по лечению заболеваний, передающихся половым путем, 2006 г. MMWR Рекомендуемая Репутация . 2006 4 августа. 55: 1-94. [Медлайн]. [Полный текст].
CDC. Центры по контролю и профилактике заболеваний. Коклюш (коклюш): диагностическое обследование. Центры по контролю и профилактике заболеваний. Доступно по адресу http://www.cdc.gov/pertussis/clinical/diagnostic-testing/index.html. Доступ: 29 ноября 2012 г.
Эпиглоттит у взрослых: передовая медицина [Интернет-база данных]. Апрель 2000 г .;
Ragosta KG, Orr R, Detweiler MJ.Повторное посещение эпиглоттита: протокол — значение боковых рентгенограмм шеи. Дж. Ам Остеопат Асс . 1997 Apr.97 (4): 227-9. [Медлайн].
MacReady N. AAP выпускает новые принципы для антибиотиков URI. Медицинские новости Medscape. Доступно на http://www.medscape.com/viewarticle/814533. Дата обращения: 26 ноября 2013 г.
Hersh AL, Jackson MA, Hicks LA. Принципы разумного назначения антибиотиков при бактериальных инфекциях верхних дыхательных путей в педиатрии. Педиатрия . 2013 18 ноября. [Medline].
Литтл П., Мур М., Келли Дж. И др. Стратегии отсроченного назначения антибиотиков при инфекциях дыхательных путей в первичной медико-санитарной помощи: практическое, факторное, рандомизированное контролируемое исследование. BMJ . 2014 6 марта. 348: g1606. [Медлайн]. [Полный текст].
Kissoon N, Mitchell I. Неблагоприятные эффекты рацемического адреналина при эпиглоттите. Скорая помощь педиатру . 1985 Сентябрь 1 (3): 143-4. [Медлайн].
Weber JE, Chudnofsky CR, Younger JG, Larkin GL, Boczar M, Wilkerson MD, et al. Рандомизированное сравнение гелий-кислородной смеси (Heliox) и рацемического адреналина для лечения умеренного и тяжелого крупа. Педиатрия . 2001 июн 107 (6): E96. [Медлайн].
[Рекомендации] Ирвин Р.С., Бауманн М.Х., Болсер Д.К., Буле Л.П., Браман С.С., Брайтлинг С.Э. и др. Диагностика и лечение кашля. Краткое изложение: клинические рекомендации ACCP, основанные на фактических данных. Сундук . 2006 Январь 129 (1 доп.): 1С-23С. [Медлайн].
Обновление: активность гриппа — США, 28 сентября 2008 г. — 31 января 2009 г. MMWR Morb Mortal Wkly Rep . 2009 13 февраля. 58 (5): 115-9. [Медлайн]. [Полный текст].
van den Aardweg MT, Boonacker CW, Rovers MM, Hoes AW, Schilder AG. Эффективность аденоидэктомии у детей с рецидивирующими инфекциями верхних дыхательных путей: открытое рандомизированное контролируемое исследование. BMJ . 2011 6 сентября. 343: d5154. [Медлайн]. [Полный текст].
Харви Р., Ханнан С.А., Бадиа Л., Скэддинг Г. Орошение носа физиологическим раствором (соленой водой) при симптомах хронического риносинусита. Кокрановская база данных Syst Rev . 24 января 2007 г. Выпуск 3: [Medline]. [Полный текст].
Rabago D, Zgierska A, Mundt M, Barrett B, Bobula J, Maberry R. Эффективность ежедневного орошения носа гипертоническим солевым раствором у пациентов с синуситом: рандомизированное контролируемое исследование. Дж. Фам Практ . 2002 декабрь 51 (12): 1049-55. [Медлайн]. [Полный текст].
Paul IM, Beiler J, McMonagle A, Shaffer ML, Duda L., Berlin CM Jr. Влияние меда, декстрометорфана и отсутствия лечения на ночной кашель и качество сна у кашляющих детей и их родителей. Arch Pediatr Adolesc Med . 2007 декабрь 161 (12): 1140-6. [Медлайн]. [Полный текст].
Sharfstein JM, North M, Serwint JR. Без рецепта, но больше не под радаром — детские лекарства от кашля и простуды. N Engl J Med . 2007 декабрь 6. 357 (23): 2321-4. [Медлайн].
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов. Заявление FDA после объявления CHPA о безрецептурных лекарствах от кашля и простуды для детей. FDA: Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. Доступно по адресу http://www.fda.gov/bbs/topics/NEWS/2008/NEW01899.html. Доступ: 10 мая 2009 г.
Wiklund L, Stierna P, Berglund R, Westrin KM, Tonnesson M. Эффективность оксиметазолина, вводимого через носовой сильфон и в сочетании с пероральным феноксиметил-пенициллином при лечении острого гайморита верхней челюсти. Acta Otolaryngol Suppl . 1994. 515: 57-64. [Медлайн].
Hayden FG, Diamond L, Wood PB, Korts DC, Wecker MT. Эффективность и безопасность интраназального ипратропия бромида при простудных заболеваниях. Рандомизированное двойное слепое плацебо-контролируемое исследование. Энн Интерн Мед. . 1996 15 июля. 125 (2): 89-97. [Медлайн].
Тернер Р. Б., Спербер С. Дж., Соррентино СП, О’Коннор Р. Р., Роджерс Дж., Батули А. Р. и др. Эффективность клемастина фумарата для лечения ринореи и чихания, связанных с простудой. Клиническая инфекция . 1997 25 октября (4): 824-30. [Медлайн].
[Руководство] Американская академия педиатрии. Руководство по клинической практике: лечение синусита. Педиатрия . 2001 сентябрь 108 (3): 798-808. [Медлайн].
Zalmanovici A, Yaphe J. Стероиды для лечения острого синусита. Кокрановская база данных Syst Rev . 18 апреля 2007 г. CD005149. [Медлайн].
Американская педиатрическая академия. Применение у детей средств от кашля, содержащих кодеин и декстрометорфан.Американская академия педиатрии. Комитет по наркотикам. Педиатрия . 1997 июн. 99 (6): 918-20. [Медлайн].
Wing A, Villa-Roel C, Yeh B, Eskin B, Buckingham J, Rowe BH. Эффективность лечения кортикостероидами при остром фарингите: систематический обзор литературы. Acad Emerg Med . 2010 май. 17 (5): 476-83. [Медлайн].
Hirt M, Nobel S, Barron E. Цинковый назальный гель для лечения симптомов простуды: двойное слепое плацебо-контролируемое исследование. Ухо-носовое горло J . 2000 Oct. 79 (10): 778-80, 782. [Medline].
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. По состоянию на 16 июня 2009 г. Zicam, средство от простуды, средства для носа (гель для носа Cold Remedy, мазки для носа и пилы для снятия холода, размер для детей). Консультации по вопросам общественного здравоохранения MedWatch. Доступно по адресу http://www.fda.gov/Safety/MedWatch/SafetyInformation/SafetyAlertsforHumanMedicalProducts/ucm166996.htm.
Сингх М., Дас РР. Цинк от простуды. Кокрановская база данных Syst Rev . 2011 16 февраля 2: CD001364. [Медлайн].
Тейлор Дж. А., Вебер В., Стэндиш Л., Куинн Г., Гоэслинг Дж., МакГанн М. и др. Эффективность и безопасность эхинацеи при лечении инфекций верхних дыхательных путей у детей: рандомизированное контролируемое исследование. ЯМА . 3 декабря 2003 г. 290 (21): 2824-30. [Медлайн].
Барретт Б., Браун Р., Ракель Д., Мундт М., Боун К., Барлоу С. и др. Эхинацея для лечения простуды: рандомизированное исследование. Энн Интерн Мед. . 2010 21 декабря. 153 (12): 769-77. [Медлайн].
Brinckmann J, Sigwart H, van Houten Taylor L. Безопасность и эффективность традиционных лекарственных трав (Throat Coat) в симптоматическом временном облегчении боли у пациентов с острым фарингитом: многоцентровое, проспективное, рандомизированное, двойное слепое, плацебо контролируемое исследование. Дж. Альтернативная медицина . 2003 апр. 9 (2): 285-98. [Медлайн].
D’Souza AL, Rajkumar C, Cooke J, Bulpitt CJ.Пробиотики в профилактике диареи, связанной с антибиотиками: метаанализ. BMJ . 2002 г. 8 июня. 324 (7350): 1361. [Медлайн].
Уолш Н.П., Глисон М., Шепард Р.Дж., Глисон М., Вудс Д.А. и др. Заявление о позиции. Часть первая: иммунная функция и упражнения. Exerc Immunol Ред. . 2011. 17: 6-63. [Полный текст].
Kretsinger K, Broder KR, Cortese MM, Joyce MP, Ortega-Sanchez I, Lee GM, et al. Профилактика столбняка, дифтерии и коклюша среди взрослых: использование столбнячного анатоксина, уменьшенного количества дифтерийного анатоксина и бесклеточной коклюшной вакцины рекомендации Консультативного комитета по практике иммунизации (ACIP) и рекомендации ACIP при поддержке Консультативного комитета по практике борьбы с инфекциями в здравоохранении (HICPAC) , для использования Tdap среди медицинского персонала. MMWR Рекомендуемая Репутация . 2006 15 декабря. 55: 1-37. [Медлайн]. [Полный текст].
[Рекомендации] Workowski KA, Levine WC. Руководство по лечению заболеваний, передающихся половым путем: 2002 [Веб-сайт Центров по контролю и профилактике заболеваний]. MMWR . 2002. 51 (RR06): 1-80. [Полный текст].
Американская педиатрическая академия. Профилактика коклюша среди подростков: рекомендации по применению столбнячного анатоксина, восстановленного дифтерийного анатоксина и бесклеточной коклюшной вакцины (Tdap). Педиатрия . 2006 Март 117 (3): 965-78. [Медлайн].
[Рекомендации] Центры безопасных и здоровых людей по контролю и профилактике заболеваний. Коклюш: Краткое изложение рекомендаций по вакцинам. Более безопасные и здоровые люди. Доступно на http://www.cdc.gov/vaccines/vpd-vac/pertussis/recs-summary.htm. Дата обращения: 10.02.2011.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. Заявление FDA относительно азитромицина (Zithromax) и риска смерти от сердечно-сосудистых заболеваний.Доступно на http://www.fda.gov/Drugs/DrugSafety/ucm304372.htm. 12 марта 2013 г .; Доступ: 17 февраля 2017 г.
Фитофтороз листьев таро
Брукс, Ф.Э. 2005. Фитофтороз листьев таро. Инструктор по охране здоровья растений . DOI: 10.1094 / PHI-I-2005-0531-01. Обновлено 2015 г.
Фитофтороз листьев таро
Phytophthora colocasiae
Limited, в основном ароиды (Araceae), в том числе Colocasia esculenta (таро, кало, дашин) и Alocasia macrorrhiza (гигантское таро)
Автор
Фред Брукс
Гавайский университет в Маноа
Заболоченные (затопленные) таро только с двумя или тремя
зрелыми листьями из-за болезни листьев таро.
Симптомы и признаки
Phytophthora colocasiae в первую очередь является патогеном для листвы, но он также поражает черешки и клубнелуковицы своих хозяев. Первыми симптомами таро ( Colocasia esculenta ) являются маленькие темно-коричневые пятна или светло-коричневые пятна на верхней поверхности листа (рис. 2). Эти ранние пятна часто появляются на кончиках и краях листьев, где скапливается вода. Пятна быстро увеличиваются, становятся круглыми, зональными и имеют цвет от пурпурно-коричневого до коричневого (рис. 3).На нижней поверхности листа пятна имеют влажный или сухой серый цвет, иногда присутствуют твердые шарики растительного экссудата (рис. 4). По мере увеличения размера пятна они сливаются и быстро разрушают лист (рис. 5). В сухую погоду или на некоторых устойчивых сортах очаги поражения становятся бумажными и выпадают, создавая вид «дырки». Мертвые листья часто висят на своих длинных черешках, как флаги (рис. 6).
Ярко-оранжевый или красновато-коричневый экссудат растений, сочащийся из мест заражения, является еще одним симптомом фитофтороза у таро (рис. 7).Наличие желтой ткани вокруг поражений (рис. 8) не совсем понятно, но может быть реакцией конкретного сорта или стрессовой реакцией на засушливую погоду. Ткань инфицированной клубнелуковицы коричневая, плотная и быстро развивается после сбора урожая. Ярким признаком P. colocasiae является беловатое кольцо спорангиев по краю поражения в периоды высокой относительной влажности (рис. 9).
| Рисунок 7 | Рисунок 8 |
| Рисунок 9 | |
Биология патогена
Отдел Oomycota содержит множество важных патогенов растений.Двумя из его наиболее разрушительных видов являются ложная мучнистая роса и водяная плесень, последняя включает Phytophthora и Pythium . Хотя традиционно эти организмы преподаются вместе с грибами на курсах патологии растений, исследования показывают, что эти организмы более тесно связаны с водорослями, такими как гигантские бурые водоросли. Оомикоты теперь размещены большинством авторитетов в королевстве Хромиста, хотя некоторые помещают их в королевство Страмипила (Stramenopila).
Между оомицетами и настоящими грибами существуют важные различия.Например, оомицеты имеют клеточные стенки, состоящие из β-глюканов и целлюлозы, а не хитина. Оомицеты также не могут производить стерины. Эти различия могут влиять на изоляцию, культивирование и управление патогенами оомицетов. Мицелий видов Phytophthora состоит из трубчатых гиф с небольшим количеством перегородок (поперечных стенок) или без них, в отличие от перегородок грибов. Их ядра являются диплоидными ( 2n ) по сравнению с гаплоидными (n) или дикариотическими ( n + n ) ядрами в мицелиях большинства грибов.
Бесполое размножение – Phytophthora colocasiae , воздушный вид, похожий на P. infestans , встречается на влажной листве. Спорангии образуются на концах коротких, неразветвленных или умеренно разветвленных спорангиеносцев по краям очагов поражения. Спорангии имеют овальную или эллипсовидную форму с отчетливой узкой апикальной пробкой (полусосочковые) и имеют средний размер от 40 до 50 x 23 мкм с соотношением длины к ширине 1,6: 1 (Рисунок 10). Спорангии обычно отделяются от спорангиеносцев дождем, в результате чего к их основанию прикрепляется стебель (цветоножка) длиной от 3 до 10 мкм (рис. 11).Во влажных условиях спорангии прорастают на верхней поверхности листьев и на черешках. При низких температурах, близких к 20 ° C (68 ° F), и высокой относительной влажности (≥90%) большинство спорангиев прорастают косвенно (Рисунок 12), производя зооспоры, которые плавают в течение нескольких минут, инцизируют, а затем образуют зародыши. трубки (рисунок 13). Этот процесс может занять два часа или меньше. При более высоких температурах, до 30 ° C (86 ° F), спорангии могут прорастать напрямую и образовывать зародышевые трубочки (рис. 14), но в большинстве случаев прорастание происходит косвенно.Инкубационный период (время от проникновения зародышевой трубки к хозяину до развития симптомов) составляет от двух до четырех дней при оптимальных температурах от 24 до 27 ° C (от 75 до 80 ° F).
Половое размножение этого гетероталлического вида зависит от наличия обоих типов спаривания A1 и A2. Гормоны, продуцируемые одним типом спаривания, стимулируют выработку антеридий (самцов) и оогоний (самок) при противоположном типе спаривания. Каждый антеридий прикрепляется к основанию оогониума, окружая его стеблевидное прикрепление (амфигинное) (рис. 15).Ядра в этих органах подвергаются мейозу, и гаплоидное ядро антеридия объединяется с гаплоидным ядром оогониума, образуя диплоидную ооспору диаметром от 18 до 30 мкм (в среднем 23 мкм) (рис. 15).
| Рисунок 15 |
Семь изолятов «A1A2» P. colocasiae были обнаружены на Тайване во время обследования в 2006 и 2007 годах. Эти гомоталлические изоляты обладали способностью формировать необходимые мужские и женские репродуктивные структуры. для получения ооспор в лаборатории без противоположного типа спаривания.Интересно, что когда гаплоидные зооспоры образовывались в конце полового цикла (см. Цикл болезни ниже), они были типами A1, A2 и A1A2. Изоляты каждого из этих типов были способны вызывать инфекцию, а изолят A1A2 был способен образовывать ооспоры в растительной ткани, как и комбинация изолятов A1 и A2. Это открытие, хотя и редкое, имеет значение для выживаемости патогенов между культурами и для увеличения генетической изменчивости за счет половой рекомбинации.
Phytophthora colocasiae — патоген для теплой погоды, наиболее быстро растущий при температуре от 27 до 30 ° C (от 80 до 86 ° F).Минимальная и максимальная температура для роста составляет 10 ° C (50 ° F) и 35 ° C (95 ° F) соответственно. Хламидоспоры (толстостенные бесполые споры) иногда образуются в культуре и развиваются либо на конце, либо вдоль гиф. Их диаметр составляет от 17 до 38 мкм (в среднем 27 мкм), а толщина стенок составляет от 2 до 3 мкм.
Цикл болезней и эпидемиология
Спорангии отделяются от спорангиеносцев на краю поражения и распространяются под воздействием брызг дождя и дождя, переносимого ветром. Они прорастают на листьях и черешках или смываются в почву, где могут заразить клубнелуковицы таро.
Патоген выживает в виде мицелия в тканях растений или в виде инцистированных зооспор в почве. Если присутствуют типы спаривания A1 и A2 или тип спаривания A1A2, антеридии и оогонии могут образовывать и производить ооспоры. Ооспоры могут действовать как структуры выживания в тканях растений или в почве между культурами. Однако до настоящего времени об образовании ооспор сообщалось только в лабораторных исследованиях, а не в полевых условиях. Зараженный посадочный материал, наряду со спорангиями и зооспорами во время ветрового дождя, является основным источником инокулята в новых насаждениях.
Эпидемиология
Спорангии и зооспоры распространяются брызгами дождя и переносимым ветром дождем между растениями (Рисунок 16) или на одном и том же растении (Рисунок 17). Из-за почти вертикального роста большинства листьев таро и их толстой восковой кутикулы многие спорангии и зооспоры смываются в почву или разбрызгиваются на черешки, что часто приводит к их разрушению (рис. 18). Поражения черешка быстро разрастаются и могут давать красновато-оранжевый экссудат (рис. 19). Эти поражения не следует путать с небольшими поражениями, созданными цикадкой таро ( Tarophagus proserpina ), однако, которые также производят экссудат (рис. 20).При выращивании таро на заболоченных (затопленных) территориях спорангии и зооспоры распространяются между растениями и полями в проточной воде.
Теплый влажный климат тропиков позволяет выращивать таро круглый год, обеспечивая постоянный приток растений-хозяев. Taro размножается вегетативно, а P. colocasiae распространяется с поля на поле и на большие расстояния с больным посадочным материалом. Клубнелуковицы, оставленные на поле после сбора урожая, также могут служить источником инокулята для вновь засаженных участков таро.Мицелий обычно сохраняется в почве менее 5 дней, но инцистированные зооспоры могут выжить до 3 месяцев. Ооспоры и хламидоспоры редко встречаются в природе, но могут действовать как структуры выживания в инфицированной растительной ткани или в почве.
Управление болезнями
Культурные обычаи
Раннее лечение заболеваний направлено на снижение уровня посевного материала и относительной влажности в поле. Однако фитофтороз листьев таро является взрывоопасным заболеванием, и культурные и физические методы борьбы с ним обычно неэффективны во время эпидемии.Обман (удаление всех или части зараженных листьев) снижает уровень посевного материала. Однако по мере усиления тяжести заболевания и растекания листьев физическое удаление листьев имитирует фитофтороз за счет дальнейшего уменьшения общей площади поверхности листьев.
Санитария поля может снизить уровень посевного материала в начале сезона, но спорулирующие поражения листьев снабжают достаточным количеством пропагул (спорангии, зооспоры) для увеличения заболеваемости. Удаление растений дальше друг от друга мало влияет на эпидемию фитофтороза таро. Эксперименты как с наличием, так и с отсутствием фитофтороза показали, что более тесная посадка таро улучшает урожайность.Близкое расстояние (например, 0,5 м или 2 фута) может увеличить серьезность фитофтороза, но также увеличивает общий вес и количество клубнелуковиц, хотя отдельные клубнелуковицы меньше.
Химический менеджмент
Защитные химические спреи, содержащие медь, марганец или цинк, были эффективны против фитофтороза листьев таро, но сильные дожди требуют повторного нанесения. Сообщалось о приемлемом подавлении оомицетов с помощью системных пестицидов, содержащих металаксил или моно- и дикалиевые соли фосфористой кислоты.Однако во многих странах и островных государствах таро является натуральной культурой, и его обычное химическое использование неприемлемо с экономической точки зрения, с экологической или культурной точки зрения.
Генетическая устойчивость
Устойчивые сортапредлагают лучшее долгосрочное решение борьбы с фитофторозом листьев таро. Однако желательные культурные характеристики и пищевые качества часто теряются при обычном разведении. Таким образом, наряду с усилиями по повышению устойчивости, селекционные программы также должны учитывать повышение урожайности, сосания (желательно для вегетативного размножения), вкуса, текстуры и времени созревания.
Анализ изоферментов и ДНК-маркеры (RAPD) выявил значительные генетические различия в изолятах P. colocasiae внутри и между странами, которые могут повлиять на патогенность изолятов. Имея это в виду, таро из селекционных программ следует тестировать против изолятов P. colocasiae , уже имеющихся в странах, до того, как будут введены новые селекционные линии.
Значение
Taro, Colocasia esculenta , выращивается в условиях затопления (водно-болотные угодья, равнины) и не затопляемых (засушливые, высокогорные) культуры на площади более 1.8 миллионов га (4,5 миллиона акров) и является четырнадцатым по величине потребляемым овощем в мире. Это важная основная культура тропиков и часть традиционной культуры в таких местах, как Гавайи и Самоанский архипелаг. Листья едят приготовленными, а клубнелуковицу запекают, варят, жарят, растирают в пасту (пои) или превращают в муку.
Мариан Рациборски впервые сообщил о Phytophthora colocasiae , причине болезни листьев таро, на Яве в 1900 году. Из-за своего происхождения, возможно, в восточной Индии или Индо-Малайзии, он распространился в тропическом климате Юго-Восточной Азии и Тихого океана, Африки. , Карибский бассейн и Америка.Сообщается о снижении урожайности клубнелуковиц на 25–50% в Тихом океане и на 25–35% на Филиппинах. Потери могут быть больше среди очень восприимчивых сортов. Сообщалось о потерях урожая 95% для восприимчивых сортов на Гавайях.
Примером ущерба, причиненного фитофторозом листьев таро, является эпидемия, произошедшая на Самоанском архипелаге в 1993 и 1994 годах. В начале 1993 года экспортный рынок таро для Независимого государства Самоа составлял 3,5 миллиона долларов США, что составляло 58% всего объема продаж Самоа. экспорт.К 1994 году на островах распространился фитофтороз, существенно снизив урожай таро, так что экспорт таро оценивался менее чем в 60 000 долларов США. В Американском Самоа, расположенном в 90 км (75 миль) к востоку, в 1993 году было произведено 357 000 кг (786 000 фунтов) таро. Это количество упало примерно до 22 000 кг (50 000 фунтов) в 1994 году и 5 000 кг (11 000 фунтов) в 1995 году. эта эпидемия произошла в основном из-за обширного возделывания одного восприимчивого сорта на всем архипелаге.
Теплые влажные дни и прохладные влажные ночи тропиков идеально подходят для размножения и распространения P.colocasiae . Во влажных условиях листья сортов таро, которые обычно живут от 30 до 40 дней, могут быть уничтожены фитофторозом листьев таро менее чем за 20 дней. Следовательно, здоровое растение с 5-7 функциональными листьями может иметь только 2 или 3 листа при серьезном заболевании. Это снижает чистый фотосинтез, что приводит к снижению урожайности клубнелуковиц. Сильно восприимчивые сорта, по-видимому, тают в поле, давая все более мелкие листья на более коротких и более коротких черешках.
Избранные источники
CAB International, Invasive Species Compendium (литература по фитофторозу листьев таро): http: // www.cabi.org/isc/search/?q=taro+leaf+blight&page=2&s0=0&s1=0
Cox, P.G., and C. Kasimani. 1990. Влияние фитофтороза листьев таро на количество листьев. Журнал сельского, лесного и рыбного хозяйства Папуа-Новой Гвинеи 35: 43-48.
Эрвин, округ Колумбия, и О.К. Рибейро. 1996. Болезни фитофторы во всем мире. Пресса Американского Фитопатологического Общества, Сент-Пол, Миннесота.
Голлифер Д.Э. и Дж.Ф. Браун. 1974. Фитофтороз Colocasia esculenta на Британских Соломоновых островах.Сельскохозяйственный журнал Папуа-Новой Гвинеи 25: 6-11.
Lebot, V., C. Herail, J. Pardales, M. Prana, M. Thongjiiem, and N.Viet. 2003. Вариация изофермента и RAPD среди изолятов Phytophthora colocasiae из Юго-Восточной Азии и Тихого океана. Патология растений 52: 303-313.
Lin, MJ. И WH. Ко. 2008. Появление изолятов Phytophthora colocasiae на Тайване с гомоталлическим поведением и его значение. Mycologia 100 (5): 727-734 (он-лайн по адресу http: // www.mycologia.org/content/100/5/727.full.pdf+html).
Рациборски М. 1900. Паразитические водоросли и грибы, Ява. Бюллетень Batavia Государственного музея Нью-Йорка 19: 189.
Россман, A.Y., и Палм, M.E. 2006. Почему Phytophthora и другие Oomycota не являются настоящими грибами ?: http://www.apsnet.org/edcenter/intropp/pathogengroups/pages/oomycetes.aspx.
Трухильо, E.E. 1965. Влияние влажности и температуры на фитофтороз таро. Фитопатология 55: 183-188.
Чжан, К.М., F.C. Чжэн, Ю. Ли, П.Дж. Энн и У. Ко. 1994. Изоляты Phytophthora colocasiae с острова Хайнань в Китае: свидетельства, указывающие на азиатское происхождение этого вида. Mycologia 86: 108-112.
Симптомы или признаки потенциального бесплодия
Симптомы или признаки потенциального бесплодия у женщины
Печально осознавать, что не существует особых симптомов, по которым можно было бы диагностировать бесплодие самостоятельно. С другой стороны, есть некоторые предварительные симптомы или признаки, которые могут вам помочь.
- Менструальный цикл, который длится 35 дней и более, или слишком короткий — менее 21 дня, или отсутствует / нерегулярный, может указывать на то, что у вас нет овуляции. Изменения цикла и овуляции могут быть симптомом какого-то заболевания, связанного с бесплодием.
- Менструальный цикл, при котором кровотечение обильное или более легкое, чем обычно, может быть связано с симптомом бесплодия.
- Боль в спине, тазовая боль или спазмы, приводящие к болезненным менструациям, слишком связаны с бесплодием.
- Гормональные проблемы также могут привести к женскому бесплодию. Симптомами этого являются:
- Рост темных волос на губах, груди и коже
- Изменения на коже, такие как увеличение количества прыщей
- Увеличение веса
- Выпадение или истончение волос
- Изменение сексуального желания
- Даже если во время секса возникают боли или молочно-белые выделения из сосков без надобности, это можно рассматривать как некоторые симптомы бесплодия.
Симптомы или признаки потенциального бесплодия у мужчины
Что касается мужчины, то о его бесплодии можно узнать только тогда, когда он пытается завести ребенка.Давайте посмотрим на несколько симптомов, которые могут быть связаны с его бесплодием:
- Проблемы с эрекцией и эякуляцией могут быть связаны с тем же.
- Изменения сексуального желания, подобные женскому, снова могут быть симптомом.
- Маленькие твердые яички или боль или отек в яичках могут привести к бесплодию.
- Изменение роста волос, тоже симптом.
Было замечено, что более чем в трети случаев бесплодия проблема связана с мужчиной.Причиной этого часто были проблемы, связанные с доставкой или производством спермы. Производство и рост спермы имеет большое значение. Проблемы могут помешать клеткам перерасти в сперматозоиды или сперматозоидам достичь яйцеклетки. Фактически, температура мошонки (кожный мешок под половым членом) также может влиять на фертильность. Говоря о проблемах / нарушениях со спермой, можно сказать следующее:
- Сперма может иметь странную форму
- Сперма не может расти полностью
- Сперма может двигаться неправильным путем
- Химическая завивка может вообще не производиться (азооспермия)
- химическая завивка может производиться в очень малых количествах (олигоспермия)
употребление алкоголя, курение и т. Д.может снизить количество сперматозоидов. Длительное недомогание, гормональные проблемы или детские инфекции также могут служить причиной нарушения спермы.
Помимо заболеваний сперматозоидов, существует несколько других причин, связанных с бесплодием у мужчин.
Например, варикоцеле — это опухшие вены в мошонке. Они наносят вред росту сперматозоидов, блокируя отток крови. Фактически, варикоцеле может заставить кровь течь обратно в мошонку из живота. Затем яички становятся слишком теплыми, чтобы производить сперму, и, следовательно, количество сперматозоидов уменьшается.Этим страдают 40 из 100 бесплодных мужчин.
Другой нечастой причиной бесплодия у мужчин является иммунное бесплодие. Травма, операция или инфекция могут вызвать образование антител у мужчин. И это становится врагом его спермы. Эти антитела могут затруднять движение сперматозоидов к маточной трубе и попадание в яйцеклетку, что снова приводит к бесплодию.
Ретроградная эякуляция — еще одна причина бесплодия у мужчин. Это относится к обратному движению спермы в теле.Происходит то, что сперма не выходит из полового члена, а попадает в мочевой пузырь. Таким образом, сперма не попадает во влагалище для последующего наступления беременности / зачатия. Это происходит, когда мышцы и нервы мочевого пузыря не смыкаются во время оргазма или кульминации. К этому могут привести некоторые операции, лекарства или проблемы со здоровьем нервной системы. Это можно заметить, увидев меньшее количество жидкой или «сухой» эякуляции или мутную мочу после эякуляции.
Иногда сперматозоиды блокируются, и это может происходить из-за повторных инфекций, отеков или пороков развития.Эта закупорка или любой тип такой закупорки может не позволить сперматозоидам из яичек уйти во время эякуляции. Это действует как причина бесплодия.
Некоторые лекарства, предлагаемые при раке, повышенном кровяном давлении, артрите, депрессии, инфекциях и т. Д., Также могут стать причиной нарушений со стороны сперматозоидов.
Первая консультация и вы
Неважно, выглядите ли вы в хорошей форме и здоровы. Важно то, насколько вы здоровы изнутри и насколько ваше тело внутренне готово к зачатию! Первая консультация относится к вашей первой надлежащей встрече с врачом и его способу понимания вещей, то есть ваших сексуальных привычек, проблем, симптомов и т. Д.Кроме того, он / она проводит ваши консультации надлежащим образом, давая определенные предложения / рекомендации. Нет ничего плохого в том, чтобы признать, что вы страдаете бесплодием. Ни вы один страдаете бесплодием, ни совершали преступления.
Инфекционист рассказал об общих симптомах ОРВИ и коронавируса
Симптомы любого ОРВИ можно принять за проявления коронавируса, поскольку все эти заболевания характеризуются поражением дыхательных путей, — сказал Сергей Вознесенский, врач-инфекционист, доцент кафедры инфекционных болезней РУДН.
По словам эксперта, каждое респираторное заболевание поражает какую-то часть дыхательной системы. Так, при коронавирусе чаще всего поражаются носовая полость и легкие, однако могут возникать такие симптомы, как боль в горле, першение и кашель с поражением гортани или трахеи.
Также врач напомнил об интоксикационном синдроме, который также может возникать при любой инфекции и проявляется головной болью, ломотой в теле и лихорадкой. Специалист-инфекционист подчеркнула, что для постановки правильного диагноза в этом случае необходимы лабораторные исследования.РИА Новости.
Он также добавил, что иногда симптомы коронавируса можно заметить у людей с повышенной тревожностью, склонных к депрессивным проявлениям. У них может даже подняться температура, даже если они на самом деле здоровы.
Источник: Росбалт по www.rosbalt.ru.
* Статья переведена на материалы Росбалт сайта www.rosbalt.ru. Если есть какие-либо проблемы с содержанием, авторскими правами, оставьте, пожалуйста, отчет под статьей.Мы постараемся обработать как можно быстрее, чтобы защитить права автора. Большое спасибо!
* Мы просто хотим, чтобы читатели получали более быстрый и легкий доступ к информации с другим многоязычным контентом, а не с информацией, доступной только на определенном языке.
* Мы всегда уважаем авторские права на контент автора и всегда включаем исходную ссылку на исходную статью. Если автор не согласен, просто оставьте отчет под статьей, статья будет отредактирована или удалена по запросу автор.Спасибо большое! С наилучшими пожеланиями!
.
