Врачи назвали главные ошибки в лечении гриппа и ОРВИ :: Общество :: РБК
Фото: Евгений Курсков / ТАСС
Применение антибиотиков при гриппе и ОРВИ без необходимости является самой серьезной ошибкой в лечении этих заболеваний, рассказал РБК терапевт, клинический фармаколог Андрей Кондрахин.
«Когда мы начинаем самостоятельно принимать антибиотики, мы ударяем по собственной микрофлоре в кишечнике. Эта микрофлора нам и дает иммунитет. И после этого мы можем заболеть повторно так называемой суперинфекцией, когда любая бактерия для нас будет очень тяжелой. Любое вирусное заболевание в этом случае может осложниться бактериальной инфекцией — воспалением легких и т. д.», — объяснил он.
По словам медика, антибиотики необходимо принимать только по назначению врача и только в случае присоединения к вирусной инфекции бактериальной.
Также можно навредить организму, если попытаться сбить невысокую температуру. Врач напомнил, что жаропонижающие можно принимать, только когда температура поднимается выше 38 градусов, а до этого лучше «помочь организму обильным питьем».
«Вторая ошибка — применение раньше, чем нужно, так называемых наборов от простуды: «Тамифлю», «Колдрекс», «Терафлю». Они содержат очень сильные компоненты, в том числе жаропонижающие. Повышение температуры — это нормальная реакция организма на любую вирусную инфекцию. Иммунитет запускается, когда температура поднимается до 37,5 градуса. Клетки иммунной системы при этой температуре начинают активироваться. Как только мы эту температуру сбиваем, иммунитет считает, что все хорошо, и начинает ослабевать. Меньше включается интерферонов, меньше вырабатывается антител, и человек получает хроническую простуду», — отметил Кондрахин.
Они содержат очень сильные компоненты, в том числе жаропонижающие. Повышение температуры — это нормальная реакция организма на любую вирусную инфекцию. Иммунитет запускается, когда температура поднимается до 37,5 градуса. Клетки иммунной системы при этой температуре начинают активироваться. Как только мы эту температуру сбиваем, иммунитет считает, что все хорошо, и начинает ослабевать. Меньше включается интерферонов, меньше вырабатывается антител, и человек получает хроническую простуду», — отметил Кондрахин.
Всегда ли антибиотики — самое подходящее решение? — Baltic Medical Centre
Лихорадочное состояние, насморк, кашель, общая слабость… Что поможет, если болезнь начнет прогрессировать более стремительно? Большинство из нас все еще думает, что в случае болезни антибиотики помогут вероятнее всего. Но так ли это? Являются ли антибиотики лекарством от всех болезней? Когда необходимо их употреблять? Об этом поговорим с Инной Ахметовой, врачом медицинского центра Baltic Medical Centre.
1. Что такое антибиотики?
Антибиотики — это лекарство, действующее против бактерий, попавших в организм. Возбудителями бактериальных инфекций являются различные бактерии, следовательно, существуют и разные антибиотики. Разные антибиотики действуют на микробов по-разному. Одни уничтожают микробы, а другие останавливают их рост и размножение.
2. Когда нужно их употреблять?
Антибиотики не являются лекарством от всех болезней, хотя не мало людей ошибочно думают обратное.
Антибиотики не рекомендуется применять при лечении простудных и вирусных заболеваний, поскольку они не воздействуют на вирусы.
В идеальном случае, антибиотики назначаются после выявления возбудителя инфекции и его чувствительности к антибиотикам.
Для определения возбудителя заболевания берется материал из источника воспаления для проведения посева и антибиотикограммы. Но ответ нужно ждать в течение 3-4 суток. Поэтому чаще всего антибиотики назначаются с предположением возможного возбудителя и его чувствительности.
3. Почему только врач может назначить антибиотики?
Существует множество причин, по которым только врач может назначить антибиотики.
Поскольку антибиотик уничтожает только бактерии, перед их назначением необходимо знать точную причину заболевания. Антибиотики не борются с инфекциями, возбудителями которых являются вирусы, например, простудой, гриппом, больным горлом, бронхитом, множеством ушных инфекций. Поэтому антибиотики не всегда подходят для лечения.
Только врач может должным образом оценить особенности пациента и заболевания, изменения состояния здоровья и решить, какое лекарство назначить и как долго его принимать. Разные антибиотики оказывают разное воздействие на организм. Одни более эффективно действуют в кишечнике, другие — в костях, третьи — в других органах. Таким образом, не рекомендуется употреблять антибиотики без назначения врача.
4. Правда ли, что употребление антибиотиков без необходимости не только не помогает, но даже может нанести вред здоровью?
Употребление антибиотиков без необходимости может вызвать аллергические реакции, изменения в микрофлоре кишечника, боль в области живота и понос. При употреблении неэффективных против возбудителей антибиотиков может развиться резистентность бактерий, иными словами, устойчивость к антибиотикам.
При употреблении неэффективных против возбудителей антибиотиков может развиться резистентность бактерий, иными словами, устойчивость к антибиотикам.
5. Каких правил необходимо придерживаться при употреблении антибиотиков?
Антибиотики нужно употреблять только в назначенных дозах и в течение назначенного времени. В случае употребления дозы, меньше назначенной, тоже может развиться устойчивость к антибиотикам. Если при употреблении назначенной дозы появились побочные реакции, необходимо сообщить об этом врачу. Ни в коем случае нельзя самостоятельно уменьшить дозу или прервать лечение. Преждевременное прекращение лечения может повторно вызвать инфекцию, поскольку не все возбудители были уничтожены. Важно знать, что незаконченный курс лечения антибиотиками и сниженная по своему усмотрению доза антибиотиков стимулируют появление устойчивости бактерий к лекарствам.
6. Всегда ли нужно сразу обращаться к врачу при появлении первых симптомов болезни?
Часто люди спешат на прием к врачу без надобности при появлении первых симптомов простуды. При появлении простуды, основными признаками которой является чиханье, насморк, боль в горле, можно лечиться самостоятельно в течение 2-3 дней. Только если температура поднялась выше 39 градусов, появляются другие симптомы — высыпание, рвота и др., в таком случае просто необходимо обратиться к врачу. Необходимо незамедлительно обратиться к врачу, если заболел ребенок в возрасте до 2 лет, а также в случае сильного проявления симптомов заболевания.
При появлении простуды, основными признаками которой является чиханье, насморк, боль в горле, можно лечиться самостоятельно в течение 2-3 дней. Только если температура поднялась выше 39 градусов, появляются другие симптомы — высыпание, рвота и др., в таком случае просто необходимо обратиться к врачу. Необходимо незамедлительно обратиться к врачу, если заболел ребенок в возрасте до 2 лет, а также в случае сильного проявления симптомов заболевания.
7. Как отличить
Только объективное обследование поможет установить истинного возбудителя заболевания — простуду, вирус или инфекцию. Чаще всего простуда проявляется в виде насморка, чиханья, головной боли и боли в горле. Даже при простуде температура может подняться до 38 градусов и выше. Для заболевания, вызванного вирусом, характерны большая слабость, лихорадка, сильная боль в мышцах, сильная головная боль и боль в области глаз. Вирусное заболевание характеризуется резким началом, сухим кашлем.
8.
При вирусных инфекциях рекомендуется симптоматическое лечение. Нужно пить много жидкости, витамин С, при температуре выше 38 градусов употреблять жаропонижающие средства. Но если температура держится более 3 дней или появились другие симптомы (высыпание, рвота), необходимо обратиться к врачу.
КАК ПОБЕДИТЬ ОРЗ И ГРИПП
С наступлением осени людей пугает не похолодание, а эпидемии
О том, как быстро и безопасно справиться с болезнью, рассказала зав.отд.врачей общей практики Сафронова Надежда Александровна.
— Повышенная температура, общее недомогание, неприятные ощущения в горле
Как понять, это ОРВИ или грипп?
ОРВИ- это острые респираторные заболевания. Возбудителями ОРЗ могут быть самые различные вирусы, в том числе, и вирус гриппа. В период отсутствия эпидемий вирус гриппа среди возбудителей ОРЗ занимает всего порядка 5%, а само заболевание в это время может протекать не так выражено. Другое дело – период эпидемий, тогда опасность гриппа возрастает в разы! Особенной опасности в плане развития осложнений подвергаются группы риска – дети, беременные женщины, пожилые, люди с хроническими заболеваниями органов дыхания,с ослабленным иммунитом..
Другое дело – период эпидемий, тогда опасность гриппа возрастает в разы! Особенной опасности в плане развития осложнений подвергаются группы риска – дети, беременные женщины, пожилые, люди с хроническими заболеваниями органов дыхания,с ослабленным иммунитом..
ОРВИ как правило» разворачивается» постепенно. Начинается заболевание с озноба,насморка,болей в горле,кашдя. На первой стадии заболевания может пояаиться только один из симптомов,а остальные дать о себе знать в ближайшие два-три дня.Температура тела при ОРВИ повышается до 38 градусов и держится около 2-4 суток.После ее снижения болезнь начинает отступать и как правило уже через неделю человек возвращается к обычной жизни.. Если симптомы не проходят, то мы имеем дело с осложнениями.
Вирусы гриппа способны вывести человека из строя буквально за считанные часы.Еще утром вы чувствовали себя хорощо,а к полудню-температура 39 градусов и выше.озноб.слабость,ломота во всем теле,головные боли.При этом сбить температуру нелегко и держится она до пяти дней. Другие симптомы гриппа-боль в горле.упорный сухой кашель.заложенность в груди. Если человек столкнулся с вирусом гриппа.то даже после завершения его острой стадии он может чувствовать слабость.недомогание в течение 2-3 недель.. При гриппе всегда нужно вызывать врача на дом, никуда не ходить, это чревато осложнениями, да и создает неблагоприятную эпидемиологическую обстановку.
Другие симптомы гриппа-боль в горле.упорный сухой кашель.заложенность в груди. Если человек столкнулся с вирусом гриппа.то даже после завершения его острой стадии он может чувствовать слабость.недомогание в течение 2-3 недель.. При гриппе всегда нужно вызывать врача на дом, никуда не ходить, это чревато осложнениями, да и создает неблагоприятную эпидемиологическую обстановку.
Можно ли защититься от гриппа с помощью прививки?
Можно и нужно. Ее делают один раз ежегодно,в начале каждого сезона простуд. Октябрь- свмый подходящий этого месяц. Так что поторопитесь защить себя и всю свою семью от гриппа
Поможет ли прием противовирусных препаратов справиться с болезнью?
Среди населения в последнее время стало модно принимать противовирусные препараты, например, «Арбидол», «Реленза» или «Тамифлю» и т.д. Почему-то люди считают, что они помогают от всего сразу – и лечат грипп и все остальные ОРЗ, и повышают иммунитет. На самом деле эти препараты характеризуются своим спектром действия и предназначены для лечения вируса гриппа. Более того, постепенно некоторые штаммы вируса гриппа демонстрируют устойчивость к содержащимся в этих препаратах противовирусным веществам. Стоит отметить, что при использовании таких препаратов нужно обязательно консультироваться с врачом. Тот, кто самостоятельно назначает себе лечение, лишний раз может навредить своему организму.
На самом деле эти препараты характеризуются своим спектром действия и предназначены для лечения вируса гриппа. Более того, постепенно некоторые штаммы вируса гриппа демонстрируют устойчивость к содержащимся в этих препаратах противовирусным веществам. Стоит отметить, что при использовании таких препаратов нужно обязательно консультироваться с врачом. Тот, кто самостоятельно назначает себе лечение, лишний раз может навредить своему организму.
Нужно ли принимать антибиотики, чтобы быстро победить болезнь?
Принимая антибиотики с первого дня болезни, занимаясь самолечением, вы только наносите большой вред своему организму! Антибиотики назначаются только врачами и только в случае осложнений – легкие формы заболеваний ими не лечатся! Иначе в лучшем случае вы заработаете дисбактериоз, а в худшем – серьезно подорвете свое здоровье.
Нужно ли лечить симптомы болезни?
Жаропонижающие средства в т.ч. нестероидные противовоспалительные препараты обычно не назначаются пациенту при температуре ниже 38 градусов. Высокая температуратела является защитным фактором, и снижать ее нужно разумно. Эти перпараты назначаются в случаях.когда имеется сильная непереносимая головная боль.судорожный синдром. Кроме того, некоторые пациенты не могут переносить даже небольшое повышение температуры (лица, страдающие заболеваниями сердца и сосудов, беременные и др.).
Высокая температуратела является защитным фактором, и снижать ее нужно разумно. Эти перпараты назначаются в случаях.когда имеется сильная непереносимая головная боль.судорожный синдром. Кроме того, некоторые пациенты не могут переносить даже небольшое повышение температуры (лица, страдающие заболеваниями сердца и сосудов, беременные и др.).
У части пациентов после или в момент ОРЗ имеется склонность к развитию воспаления придаточных пазух носа или аллергических ринитов. Поэтому у таких людей необходимо лечить насморк соответственно противоотечными и противоаллергическими препаратами. В аптеках продается множество комбинированных» противопростудных» симптоматических препаратов.Они содержат необходимые для лечения вещества в сбалансированных дозах, что уменьшает риск передозировки. Только нужно помнить, что их употребление должно быть тоже по показаниям и в соответствии с рекомендуемыми суточными дозировками. Бывают случаи бесконтрольного применения этих препаратов. Кроме того, иногда пациенты не смотрят, что содержится в комбинированных препаратах, и дублируют использование лекарственных средств – например, вместе с указанными препаратами употребляют дополнительно нестероидные противовоспалительные средства. Такое тоже недопустимо.
Кроме того, иногда пациенты не смотрят, что содержится в комбинированных препаратах, и дублируют использование лекарственных средств – например, вместе с указанными препаратами употребляют дополнительно нестероидные противовоспалительные средства. Такое тоже недопустимо.
Вообще рекомендуется перед покупкой любых комбинированных препаратов обязательно ознакомится с их составом, инструкцией, и, если не уверены, посоветуйтесь с врачом, который назначит подходящий вам препарат исходя из полной картины заболевания
Нужно ли заниматься профилактикой и поддержкой иммунной системы?
Для профилактики ОРВИ целесообразны закаливающие процедуры,прием поливитаминов,рациональное питание с употреблением овощей и фруктов.содержащих аскорбиновую кислоту. Для профилактики гриппа лучшей профилактикой является своевременно сделанная прививка.
НА ЗАМЕТКУ
Теперь каждый туляк может внести свои предложения и высказать мнение по оказанию медицинских услуг на сайте лечебного учреждения и сайте Министерства здравоохранения РФ .
Эксперты называют этот опрос формой общественного контроля качества оказания медицинских услуг. На официальных сайтах тульских клиник теперь можно найти две формы анкет – для оценки качества оказания услуг поликлиниками и стационарами. Опросники анонимные и единые для всех лечебных учреждений не только Тульской области, но и по всей Российской Федерации
Пациенты могут оценить профессионализм, доброжелательность медицинского персонала, условия обслуживания, доступность медицинских услуг, внести свои пожелания и предложения.
Результаты анкетирования помогут улучшить качество медицинской помощи.. И повлиять на этот показатель своим голосом сегодня может каждый пациент.
Сайт Больницы им. Д.Я.Ваныкина www.bsmp-tula.ru
Сайт Министерства здравоохранения РФ- https://www.rosminzdrav.ru
Правильно выбираем препараты против гриппа и простуды
Выбирая лекарство от гриппа и простуды, в первую очередь нужно обратить внимание на то, что эти заболевания вызваны вирусами. Основу терапии в данном случае будут составлять противовирусные препараты, а также средства, снимающие такие неприятные проявления ОРВИ, как, повышенная температура, насморк, кашель, боль в горле.
Основу терапии в данном случае будут составлять противовирусные препараты, а также средства, снимающие такие неприятные проявления ОРВИ, как, повышенная температура, насморк, кашель, боль в горле.
Противовирусные средства
Неотложной помощью при первых признаках простуды считается прием противовирусных препаратов: Амиксин, Арбидол, Амизон, Ремантадин, Ацикловир. Чем быстрее вы начнете принимать подобные лекарства от гриппа и простуды, тем больше шансов на быстрое и успешное выздоровление. Действие подобных средств высоко избирательно, и для здоровых клеток организма они не представляют никакой опасности.
Коварные вирусы способны развивать устойчивость к этой группе препаратов, иногда же эффект может не наступать из-за слабой иммунной активности организма. В этом случае назначают прием интерферонов, обычно в виде назальных капель (Назаферон, Интерферон) и ректальных свечей Виферон, Генферон.
Восстановить функции иммунной системы при затяжном течении заболевания помогают иммуномодуляторы: таблетки и капли Иммунал, Рибомунил, Бронхомунал, спрей ИРС-19, а также растительный препарат, хорошо зарекомендовавшей себя компании Бионорика – Имупрет.
Избавляемся от симптомов
Устранить чувство заложенности носа помогут назальные капли на основе ксилометазолина (Галазолин, Длянос, Отривин) и оксиметазолина (Називин, Нокспрей, Назалонг). Также для сужения сосудов слизистой носа принимают таблетки и чаи, в состав которых входит фенилпропаноламин или фенилэфрин: Колдфлю и Фармацитрон.
Снизить температуру и снять воспаление способна Мефенаминовая кислота, которые также способствуют образованию интерферона в организме, оказывая тем самым дополнительное противовирусное действие.
К лечению кашля подходят исходя из того, влажный он или сухой. Отхаркивающие препараты не эффективны при сухом кашле. И наоборот, если при наличии мокроты назначить средство, подавляющее кашлевой рефлекс, ее застой может привести даже к развитию пневмонии.
Антибиотики при гриппе и простуде
Антибиотики бессильны в борьбе с вирусами и не оказывают на них абсолютно никакого влияния. К сожалению, из-за повсеместной любви к самолечению, их прием часто не обоснован и приносит больше вреда, чем пользы. Уничтожая полезную микрофлору кишечника, антибиотики тем самым ослабляют естественный иммунитет, делая организм еще более уязвимым перед вирусом.
Уничтожая полезную микрофлору кишечника, антибиотики тем самым ослабляют естественный иммунитет, делая организм еще более уязвимым перед вирусом.
Когда высокая температура (выше 38 градусов) держится более трех дней и улучшений состояния больного не наблюдается – это признак присоединения вторичной бактериальной инфекции, и без антибиотика здесь просто не обойтись. При развитии таких осложнений гриппа, как бронхит и пневмония врач после проведения проб на чувствительность возбудителя к антибиотику может назначить Амоксициллин, Амоксиклав, Аугментин.
Иногда назначают цефалоспорины в уколах: Цефотаксим, Цефтриаксон или макролиды: Сумамед, Клацид, Фромилид. В тяжелых случаях прибегают к помощи фторхинолонов (Левофлоксацин).
Несмотря на то, что каждый из нас хотя бы однажды сталкивался с простудой и боролся с симптомами самостоятельно, не стоит недооценивать данное заболевание и пускать его на самотек. Ведь самостоятельно отличить простуду от проявлений гриппа способны далеко не все, а грипп, как известно, опасен своими осложнениями. Не возлагайте также надежд на одно чудодейственное средство, лекарство от гриппа и простуды должен подбирать врач, применяя комплексное лечение и учитывая индивидуальные особенности организма.
Не возлагайте также надежд на одно чудодейственное средство, лекарство от гриппа и простуды должен подбирать врач, применяя комплексное лечение и учитывая индивидуальные особенности организма.
Министерство здравоохранения
В нашей стране укоренилось мнение: если хочешь быстрее выздороветь, принимай антибиотики. Это весьма опасное заблуждение. На самом деле антибиотики лечат далеко не все, зато вред организму могут нанести весьма существенный.
Совершенно бесполезно лечить
антибиотиками вирусные заболевания: краснуху, гепатиты, грипп, ОРВИ, герпес, потому
что на эти болезни антибиотики не действуют. Так же бесполезно использовать
антибиотики при повышенной температуре, расстройствах кишечника, воспалительных процессах, т.к. они не обладают жаропонижающим,
обезболивающим или противовоспалительным действием. Антибиотики не действуют на
грибки, в том числе грибки рода Кандида, вызывающие молочницу.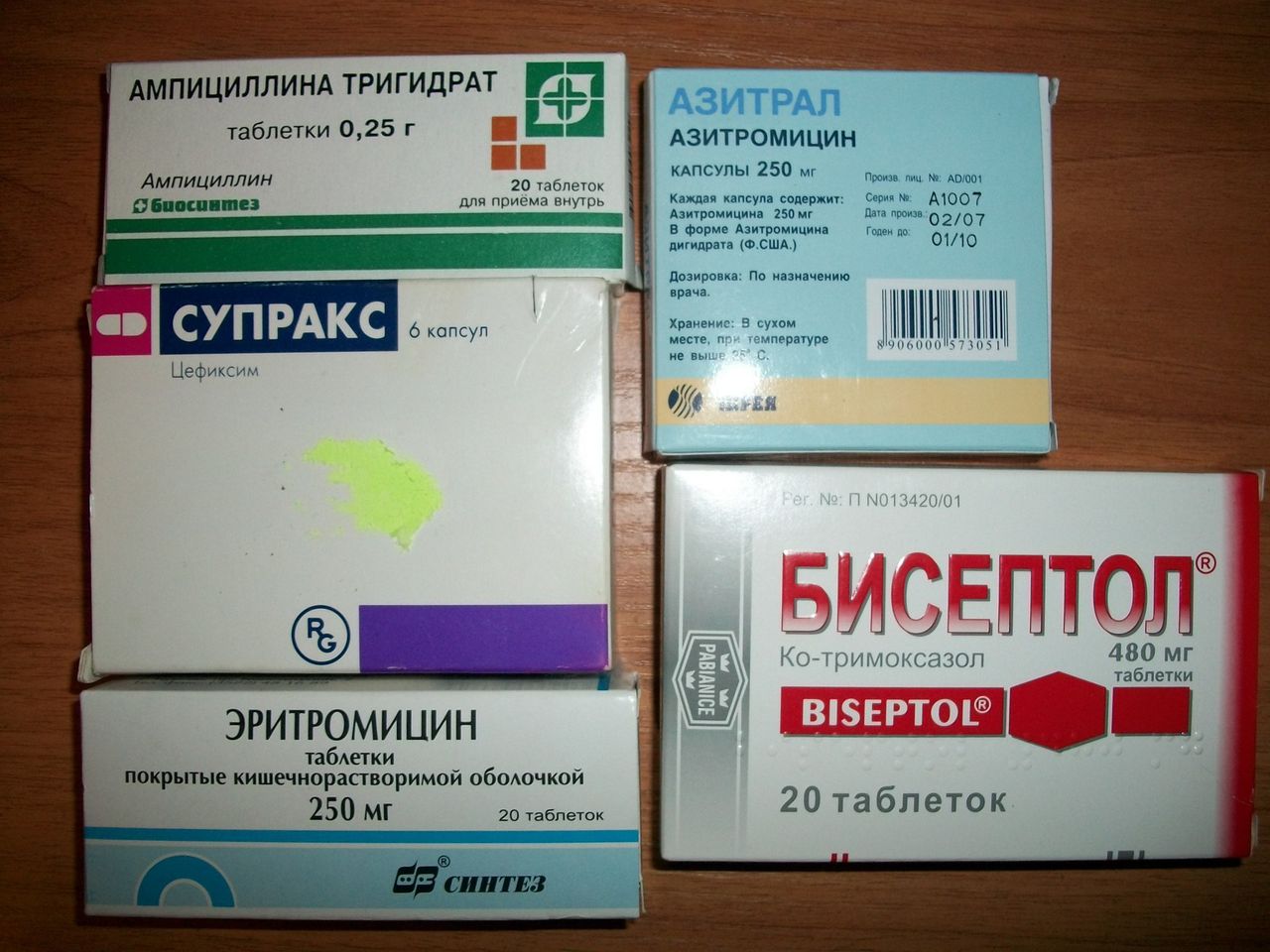 Не могут
антибиотики бороться с глистами и прочими паразитами, являющимися причиной
некоторых инфекционных заболеваний.
Не могут
антибиотики бороться с глистами и прочими паразитами, являющимися причиной
некоторых инфекционных заболеваний.
В прошлом считалось, что
антибиотики нужно назначать при самых незначительных признаках инфекции. Однако
применение этих средств по любому поводу привело к возникновению лекарственной
устойчивости — на некоторые виды бактерий уже не действует ни один антибиотик.
Особенно быстро устойчивость микроорганизмов, являющихся возбудителем инфекции,
развивается при условии использования
человеком одного и того же антибиотика или разных антибиотиков из одной
группы. Плодами бесконтрольного потребления антибиотиков стали: аллергические
реакции, дисбактериоз, ряд аутоиммунных заболеваний, таких как ревматоидный
артрит, системная красная волчанка, а так же видоизмененные
менингит, воспаление легких, туберкулез, брюшной тиф. Вылечить эти болезни
стало невероятно трудно, или даже невозможно.
Необходимо знать, что самолечение антибиотиками приводит к результату обратному противоположному: вы по-прежнему больны, а вот определить, чем именно, врачу становиться труднее, так как на фоне антибиотиков болезнь может иметь «стертые» симптомы.
Следует запомнить, что антибиотики может назначать только врач, а не соседи или лучшие друзья. Только медик может определить тяжесть заболевания, учесть сопутствующие заболевания, поставить правильный диагноз и назначить адекватное лечение, подобрав дозу, вид и способ введения антибиотика для каждого пациента, а значит свести к минимуму возможность осложнений и побочных действий.
Лечение
должно проводиться в полном объеме – длительность приема, режим и доза препарата
должны соответствовать предписаниям лечащего врача. Использование повышенных доз антибиотика («для большей
эффективности») приводит к поражению печени и почек. Снижение доз загоняет
инфекцию вглубь и способствует возникновению новых штаммов бактерий. Обязательно пропивайте
курс лечения полностью даже в том случае, если вы почувствовали значительное
улучшение раньше окончания назначенного курса, иначе
болезнь вернется, но этот антибиотик уже не поможет, потому что у бактерий
появится устойчивость к нему.
Снижение доз загоняет
инфекцию вглубь и способствует возникновению новых штаммов бактерий. Обязательно пропивайте
курс лечения полностью даже в том случае, если вы почувствовали значительное
улучшение раньше окончания назначенного курса, иначе
болезнь вернется, но этот антибиотик уже не поможет, потому что у бактерий
появится устойчивость к нему.
Обратите внимание на применяемые Вами лекарственные препараты; не используйте антибиотики без назначения врача.
Грипп и острые респираторные заболевания
Острые респираторные вирусные инфекции (ОРВИ) являются одними из самых распространенных в мире заболеваний. Они вызываются вирусами, которые живут и размножаются в клетках слизистой оболочки дыхательных путей человека и выделяются в окружающую среду с мельчайшими частичками слизи при чихании и кашле. Попадая на предметы обихода, они могут некоторое время сохраняться на них. Источником инфекции является больной человек, особенно в первые 7 дней заболевания. Чаще всего заражение происходит при вдыхании инфицированного воздуха, но возможна передача вируса и через загрязненные предметы гигиены больного, посуду, детские игрушки. Заразиться можно при посещении общественных мест, магазинов, при поездке в городском транспорте. Активной передаче вирусов способствуют большая скученность людей в помещениях, высокая влажность, плохое проветривание, снижение общей резистентности организма.
Чаще всего заражение происходит при вдыхании инфицированного воздуха, но возможна передача вируса и через загрязненные предметы гигиены больного, посуду, детские игрушки. Заразиться можно при посещении общественных мест, магазинов, при поездке в городском транспорте. Активной передаче вирусов способствуют большая скученность людей в помещениях, высокая влажность, плохое проветривание, снижение общей резистентности организма.
Инкубационный период при гриппе составляет 2-7 дней, но может укорачиваться до 1 суток. Начало заболевания острое с озноба, недомогания, слабости, ломоты в теле и суставах, головной боли, боли в глазных яблоках и подъёма температуры чаще всего до высоких цифр (38-400С). Температура может нарастать и постепенно, достигая высоких значений в течение 1-1,5 суток. Насморк бывает нечасто. Характерны першение, боль в горле и за грудиной, сухой кашель. На 1-й неделе болезни возможен дискомфорт в животе, рвота, водянистый стул без примесей 2-10 раз в сутки. Лицо больного слегка одутловато, с ярким румянцем на щеках, либо бледное, но глаза, как правило, покрасневшие. При высокой температуре отмечается сердцебиение и склонность к снижению артериального давления. При неосложненном течении к концу недели температура снижается, прекращаются ознобы и ломота в теле, уменьшается кашель, и больной выздоравливает, однако еще около 1 недели остается снижение самочувствия в виде слабости, быстрой утомляемости, потливости. Если грипп протекает нетяжело, лечение проводят на дому участковые терапевты. В приезде врача «скорой помощи» эти больные не нуждаются.
Лицо больного слегка одутловато, с ярким румянцем на щеках, либо бледное, но глаза, как правило, покрасневшие. При высокой температуре отмечается сердцебиение и склонность к снижению артериального давления. При неосложненном течении к концу недели температура снижается, прекращаются ознобы и ломота в теле, уменьшается кашель, и больной выздоравливает, однако еще около 1 недели остается снижение самочувствия в виде слабости, быстрой утомляемости, потливости. Если грипп протекает нетяжело, лечение проводят на дому участковые терапевты. В приезде врача «скорой помощи» эти больные не нуждаются.
Самым частым и очень опасным осложнением гриппа является пневмония, нередко развиваются синуситы: гайморит, фронтит, этмоидит.
Какие же симптомы указывают на тяжелое течение гриппа и начинающиеся осложнения, когда нужно срочно обращаться не просто к врачу, а на «скорую помощь», поскольку состояние больного может ухудшаться быстро? Вот они, и помнить о них нужно обязательно:
— затрудненное дыхание, одышка, синюшность губ, серый оттенок кожи;
— боль или чувство сдавления в груди или животе;
— сильная или не прекращающаяся рвота;
— появление кровяных прожилок в мокроте (кровохарканье), носовое кровотечение;
— резкое головокружение, вялость, спутанность сознания;
— у детей – отказ от достаточного количества питья, возбуждение или вялость, сонливость.
В отличие от гриппа, ОРВИ протекают более благоприятно. Каждая из них имеет свои особенности:
1. Риновирусная инфекция – температура или невысокая (37,1-37,30С), или вовсе не повышается. В 1- ый день из носа буквально течет вода, со 2-3-го дня нос заложен и общее самочувствие нарушается мало.
2. Парагрипп – начинается с першения в горле, осиплости голоса и сухого «лающего» кашля, температура нарастает постепенно и сохраняется не дольше недели, беспокоит ломота в теле, познабливание, слабость. У детей возможно осложнение: ложный круп, когда внезапно появляется одышка и затрудненное дыхание, и ребенок нуждается в срочной медицинской помощи.
3. Аденовирусная инфекция начинается остро, протекает с высокой длительной температурой, которая чаще формирует 2-3 волны лихорадки. Насморк, кашель, боли в горле выраженные, увеличиваются миндалины, шейные, подмышечные, паховые лимфоузлы, может появиться отёк и покраснение глаз, нередко бывают боли в животе и жидкий стул.
4. Респираторно-синцитиальная инфекция протекает с умеренной (37,5-38,50) температурой. Насморк нехарактерен, как правило, имеется кашель, затрудненное свистящее дыхание, одышка. Часто развиваются приступы удушья, побуждающие обращаться за экстренной помощью.
Без специальных исследований точно определить, какой именно вирус вызвал заболевание, трудно, но это чаще всего не очень важно, ведь принципы лечения ОРВИ одинаковы. Для того, чтобы избежать осложнений, необходимо обратиться к врачу рано, при появлении первых симптомов заболевания.
При первых проявлениях гриппа нужно начинать принимать противовирусные препараты, так как они наиболее эффективны при начале приема в первые 2 суток болезни.
Для лечения гриппа используются:
· Противовирусные препараты (дозы для взрослых):
— Осельтамивир (Тамифлю) 1 капсула (75мг), принимать внутрь 2 раза в день 5 дней
— Ингавирин 1 капсула (90 мг), принимать внутрь 1 раз в день 7 дней (для взрослых)
— Ингавирин детский (для детей в возрасте 7-18 лет) 1 капсула (60 мг), принимать внутрь 1 раз в день 7 дней
— Занамивир (Реленза) в ингаляциях, 10 мг (2 вдоха по 5 мг) 2 раза в день 5 дней
— Арбидол
2 таблетки (200 мг) принимать 4 раза в день 5-7 дней. Этот препарат наиболее эффективно использовать в сочетании с Кагоцелом.
Этот препарат наиболее эффективно использовать в сочетании с Кагоцелом.
Беременным женщинам можно принимать Тамифлю и Реленза, детям старше 1 года – Тамифлю, старше 5 лет – Реленза, старше 7 лет – Ингавирин детский, Арбидол – детям любого возраста. Препараты принимаются в дозах согласно возрасту и весу. Для лечения ОРВИ используют Ингавирин и Арбидол в тех же дозировках.
· Препараты интерферона и его индукторов могут использоваться при гриппе и ОРВИ в качестве дополнения к противовирусным препаратам:
— Гриппферон закапывать по 2-3 капли в каждую ноздрю 3-4 раза в сутки
— Виферон 1000 000 ЕД в свечах 2 раза в день в прямую кишку
— Амиксин 1 таблетка (125 мг) в 1-2-е сутки 2 таблетки 1раз в день, на 3-4-е сутки 1 таблетка 1 раз в день
— Кагоцел: в 1-2-е сутки 2 таблетки (24 мг) 3 раза в день после еды, на 3-4-е сутки 1 таблетка (12 мг) 3 раза в день после еды
Важно: Все противовирусные препараты должны приниматься по назначению врача!
· При температуре выше 380С необходимо снизить температуру тела. Для этого используются:
Для этого используются:
1. Физические методы охлаждения:
— раскрыть больного
— приложить холод на область лба и шеи
— обтереть тело губкой, смоченной прохладной водой.
Если при высокой температуре ребенок бледен, губ и ногти у него синюшные, руки и ноги холодные, то нужно растереть ему конечности, слегка разминая мышцы.
2. Лекарственные препараты:
— Парацетамол (Эффералган, Панадол и др.) для взрослых 1 таблетка (500 мг) на прием
— Нурофен (Ибупрофен) 1 таблетка (200 мг) на прием или Нимесулид (Найз) 1 таблетка (50 мг) на прием. Препараты желательно запить молоком
— детям можно давать Парацетамол в детской дозировке, в возрасте старше 3 месяцев – Нурофен. При рвоте лучше использовать свечи Цефекон (50, 100 или 250 мг в зависимости от возраста и веса) или Нурофен (60 мг).
Важно: Пауза между приемами жаропонижающих средств должна быть не менее 4-5 часов. Ацетилсалициловую кислоту и метамизол натрия при гриппе принимать нельзя!
· Для уменьшения явлений интоксикации необходимо обильное питьё: минеральная вода без газа, чай, фруктовые отвары, морсы, компоты. Если беспокоит тошнота и рвота, пить нужно часто по нескольку глотков.
· При сухом кашле показаны отхаркивающие средства: Амброксол (Амбробене, Амброгексал и др.) в таблетках, пастилках или сиропе 45 мг в день, Ацетилцистеин (АЦЦ) в таблетках, растворе или сиропе 500 мг в день.
Важно: пока сохраняется повышенная температура, использовать банки и горчичники категорически запрещено!
· Полезно принимать Аскорбиновую кислоту 500 мг в сутки.
· Антибиотики показаны лишь при осложнениях. Решение о назначении антибиотиков принимает только врач!
Решение о назначении антибиотиков принимает только врач!
· Обязателен постельный режим на период высокой температуры!
· Пища должна быть легкой (каши, бульон, паровая или отварная рыба, мясное суфле), содержать достаточное витаминов (фрукты, овощи, ягоды).
· Категорически противопоказан прием алкоголя!
Профилактика гриппа и ОРВИ
Наиболее эффективным методом профилактики гриппа является вакцинация. В 2017 г. в Москве активно проводилась кампания по вакцинации против гриппа, охват населения прививками превысил 75%. В итоге, в период сезонного подъёма, заболеваемость гриппом и ОРВИ в отличие от многих регионов Российской Федерации не превысила эпидемический уровень, т.е. эпидемии в Москве не было. Случаев смерти от гриппа зимой 2017-2018 г. также не было. Среди вакцинированных в этот период было зарегистрировано всего 3 случая заболевания гриппом, болезнь у них протекала не тяжело.
Среди вакцинированных в этот период было зарегистрировано всего 3 случая заболевания гриппом, болезнь у них протекала не тяжело.
Следует помнить, что прививка вызывает формирование активного специфического иммунитета, но на его выработку требуется время – не менее 2 недель, поэтому вакцинироваться против гриппа необходимо до начала подъёма заболеваемости, в сентябре-октябре. Привиться можно как в районной поликлинике, так и на мобильных прививочных пунктах, расположенных в шаговой доступности от станций метрополитена.
Для экстренной профилактики гриппа (после контакта с больным) срочно вакцинироваться поздно, для этого используются неспецифические методы, либо лекарственная профилактика. Избежать заболевания острыми респираторными инфекциями поможет соблюдение следующих правил:
1. По возможности ограничить потенциальные контакты с больными, избегать посещения мест скопления людей.
2. Носить маску в местах скопления людей. Полезно нанести на внутреннюю поверхность маски несколько капель масла сосны или можжевельника.
Полезно нанести на внутреннюю поверхность маски несколько капель масла сосны или можжевельника.
3. Чаще проветривать помещения, мыть руки, умываться и промывать носовые ходы растворами морской соли («Аквалор», «Аквамарис»).
4. При лечении больного на дому необходимо выделить больному отдельную посуду и предметы обихода; всем членам семьи мыть руки с мылом, промывать нос водой, носить защитную маску, которая должна закрывать рот и нос.
5. В пищу включать свежие фрукты, зелень, лук и чеснок. Увеличить употребление жидкости, пить травяные чаи с медом, лимоном, имбирем. Спать не менее 7-8 часов в сутки.
6. Лекарственная профилактика:
— Ингавирин 1 капсула (90 мг) (для детей старше 7 лет 1 капсула 60 мг) 1 раз в сутки внутрь в течение 5-7 дней после контакта с больным
— Кагоцел 7-дневный цикл: 1-ые и 2-ые сутки по 2 таблетки (24 мг) взрослым или по 1 таблетке (12 мг) детям 1 раз в день, затем 5 дней перерыв; такие циклы повторяют весь период эпидемии.
— Арбидол по 1 таблетке (100 мг) взрослым или ½ таблетки (50 мг) детям 1 раз в день весь период эпидемии
— Амиксин 1 таблетка (125 мг) 1 раз в неделю в течение 6 недель.
— Интерферон альфа (Гриппферон) закапывать в нос по 3 капли в каждую ноздрю 2 раза в сутки в течение 5-7 дней
— Интерферон гамма закапывать в нос по 2-3 капли в каждую ноздрю за 30 минут до завтрака в течение 10 дней. При необходимости курс можно повторять.
Ребёнку назначили антибиотики при ОРВИ. Что делать?
Вы спрашиваете — «Мел» отвечает
Кашель, больное горло и температура — мало у кого из детей получается не подхватить простуду в марте. Часто для того, чтобы выздороветь, достаточно просто позволить организму самому справиться с инфекцией. Но бывает, что врачи при первых признаках простуды назначают антибактериальные и противовирусные средства. Что делать в таком случае и нужно ли их принимать, объясняет педиатр и аллерголог компании «Инвитро» Ирина Карина.
Рассылка «Мела»
Мы отправляем нашу интересную и очень полезную рассылку два раза в неделю: во вторник и пятницу
Ответ. В большинстве случаев ОРВИ — это самоограничивающая инфекция респираторного тракта, которая может проявляться воспалением слизистых оболочек верхних дыхательных путей, насморком, чиханием, кашлем, лихорадкой и болями в горле. Чаще всего возбудителем такой инфекции становятся вирусы.
Эта группа заболеваний — наиболее частая причина назначения лекарственных средств, в том числе и ненужных, в ряду которых есть и антибиотики. Многое зависит от причины возникновения вирусных заболеваний. Если это будет подтвержденный грипп А (Н1N1), назначаются противовирусные препараты. Если это не грипп, от противовирусных средств не будет эффекта, то есть врач не должен их выписывать.
Что касается антибактериальной терапии, то при неосложненных формах течения болезни в первые 10–14 дней её назначение не рекомендуется. И даже если вирусная инфекция сопровождается риносинуситом, конъюнктивитом, ларингитом, крупом, бронхитом или бронхообструктивным синдромом, это всё равно не будет показанием для назначения антибактериальной терапии в первые две недели болезни..jpg)
Но есть и исключения: например, дети первого года жизни — группа риска, их организм может тяжело переносить ОРВИ. Им может потребоваться более раннее назначение антибиотиков. Но тоже только в том случае, если высокая температура (до 39°) держится дольше трёх суток, сохраняются симптомы интоксикации и выраженные катаральные явления (отек слизистых, кашель и насморк), ребёнок вялый, плохо ест и пьет мало воды. Обязательное условие для назначения антибиотиков — результаты общего анализа крови. Кроме того, назначение антибактериальной терапии требует обязательного ежедневного наблюдения.
В первые дни заболевания антибиотики показаны только детям с хронической патологией, которая затрагивает бронхо-легочную систему, например с муковисцидозом. А также детям с первичными иммунодефицитными состояниями, в частности с нейтропенией.
Короткий же ответ на этот вопрос звучит так: попросите врача объяснить, по каким именно показаниям они назначены, и узнайте о возможных осложнениях и аллергических реакциях на антибиотики. Если ответы врача вас не удовлетворяют, сходите к другому специалисту и выслушайте второе мнение.
Если ответы врача вас не удовлетворяют, сходите к другому специалисту и выслушайте второе мнение.
Теперь в медицинском офисе «Инвитро» принимает квалифицированный педиатр. Если ребёнку уже поставили диагноз, с педиатром «Инвитро» можно обсудить выводы вашего лечащего врача и еще раз перепроверить все назначения. Педиатр подробно объяснит вам, что произошло, почему врач назначил именно такие таблетки, и расскажет, какие ещё существуют методы лечения.
Ученые надеются победить инфекции после обнаружения бактериального шпионажа
Арви Йыерс — старший научный сотрудник по молекулярной микробиологии Тартуского университета. Предоставлено: Авторские права: Кристьян Тидема / Postimees / ScanpixУченые Тартуского университета надеются найти решение для лечения хронических инфекций, которые не поддаются лечению антибиотиками, после того, как обнаружили механизмы, позволяющие прислушиваться к спящим бактериям.
Недавно вместе со своей командой опубликовав исследовательскую статью по этой теме в журнале Scientific Reports , старший научный сотрудник в области молекулярной микробиологии Арви Йыерс пишет о способности бактерий прислушиваться друг к другу и о значении этого открытия для медицины.
Жизнь бактерий нелегка. Если пищи достаточно, они быстро размножаются, но не стремятся ее накапливать. Как только бактерии перестают питаться, для них все кончено: их метаболизм замедляется, и они переходят в состояние сна. В таком состоянии бактерии достаточно устойчивы к условиям окружающей среды и могут даже пережить трудные времена. В этом они похожи на медведя в спячке: в ожидании лучших времен тратится минимум энергии. Они прибывают с новой едой.
Как только пищи снова становится достаточно, все бактерии просыпаются и начинают быстро размножаться. Однако бактерии могут проявлять большую неуверенность, если пищи мало и она не самого лучшего качества. Стоит ли вообще оставлять безопасное государство ради такой паршивой еды? Может, это даже не настоящая еда, а какая-то уловка? Естественно, бактерии не придерживаются этого мнения. Вместо этого в ходе эволюции они разработали механизмы, которые предлагают решения таких дилемм.
Одним из характерных признаков того, что окружающая среда достаточно хороша для роста и размножения бактерий, является рост других бактерий. Ученые Тартуского университета обнаружили, что спящие бактерии могут узнавать о росте других бактерий, шпионя за ними.
Ученые Тартуского университета обнаружили, что спящие бактерии могут узнавать о росте других бактерий, шпионя за ними.
А именно, по мере роста бактерии вытесняют материал из своих клеточных стенок в окружающую среду. Клеточная стенка представляет собой довольно жесткую структуру, которая окружает каждую бактериальную клетку и защищает ее от внешней среды. Чтобы бактерия выросла в размерах, клеточная стенка должна стать мягче и в определенной степени уступить. В результате подобных изменений часть материала клеточной стенки попадает в окружающую среду, посылая спящим бактериям сигнал о том, что условия улучшились и у других есть достаточно пищи для роста.
Как только спящие бактерии идентифицируют материал, происходящий из клеточных стенок других бактерий в окружающей среде, они быстро и в большом количестве просыпаются, чтобы получить свою долю вновь поступивших питательных веществ.
Спящие бактерии, не желающие просыпаться, представляют серьезную проблему для медицины. Известно, что антибиотики, прежде всего, убивают активно растущие бактерии, и они не часто действуют на спящие бактериальные клетки. Таким образом, спящие бактерии могут пережить курс антибиотиков в организме человека и снова начать расти позже, когда человек закончит лечение.Эти клетки называются клетками-персистерами, и они могут вызывать длительные хронические инфекции, которые не поддаются лечению антибиотиками.
Известно, что антибиотики, прежде всего, убивают активно растущие бактерии, и они не часто действуют на спящие бактериальные клетки. Таким образом, спящие бактерии могут пережить курс антибиотиков в организме человека и снова начать расти позже, когда человек закончит лечение.Эти клетки называются клетками-персистерами, и они могут вызывать длительные хронические инфекции, которые не поддаются лечению антибиотиками.
Если бы ученые теперь могли использовать это новое знание, чтобы обмануть спящие бактерии и заставить их проснуться с помощью какого-то вещества, похожего на клеточную стенку, была бы надежда убить их антибиотиками с первой попытки. Это позволит лечить бактериальные инфекции одним курсом лечения.
Пробуждение спящих бактерий для борьбы с инфекциями
Дополнительная информация: Арви Йыерс и др.
 , Муропептиды стимулируют возобновление роста из стационарной фазы у Escherichia coli, Scientific Reports (2019).DOI: 10.1038 / s41598-019-54646-5
, Муропептиды стимулируют возобновление роста из стационарной фазы у Escherichia coli, Scientific Reports (2019).DOI: 10.1038 / s41598-019-54646-5Предоставлено Эстонский исследовательский совет
Ссылка : Ученые надеются победить инфекции после обнаружения бактериального шпионажа (14 января 2020 г.) получено 6 февраля 2021 г. с https: // физ.org / новости / 2020-01-ученые-победить-инфекции-бактериальные-шпионаж.html
Этот документ защищен авторским правом. За исключением честных сделок с целью частного изучения или исследования, нет
часть может быть воспроизведена без письменного разрешения. Контент предоставляется только в информационных целях.
За исключением честных сделок с целью частного изучения или исследования, нет
часть может быть воспроизведена без письменного разрешения. Контент предоставляется только в информационных целях.
Влияние противовирусной терапии на частоту бактериальных обострений и назначения системных антибиотиков у пациентов с острыми респираторными вирусными инфекциями и гриппом (результаты международного когортного обсервационного исследования)
Цель:
оценить частоту бактериальных обострений и назначения антибиотиков с анализом эффективности противовирусной терапии у амбулаторных больных острой респираторной вирусной инфекцией (ОРВИ) и гриппом.Материал и методы:
Международное когортное открытое неинтервенционное исследование <Лечение ОРВИ и гриппа в повседневной клинической практике? был проведен. Анализ данных охватывает результаты лечения 18946 амбулаторных пациентов в возрасте от 18 до 93 лет с клиническим диагнозом ОРВИ или гриппа в 262 центрах России, Молдовы, Армении и Грузии. Одна группа пациентов получала лечение в соответствии с утвержденными и действующими в их стране схемами комплексного лечения ОРВИ и гриппа; в другую группу вошли пациенты, получавшие комплексное лечение, в том числе противовирусный препарат Кагоцел @ (Россия).При каждом из 3 посещений оценивались клинические симптомы (в баллах), наличие бактериального обострения и эффективность медикаментозного лечения, включая антибактериальную терапию. Результаты:
Бактериальные обострения зафиксированы в 8,3% случаев, системные антибиотики назначены врачами в 9,3% случаев. Частота бактериальных обострений и назначения системных антибиотиков возрастала пропорционально возрасту пациентов, тяжести заболевания, времени первого посещения врача и начала лечения.Назначение Кагоцела® в комплексном лечении ОРВИ и гриппа способствует снижению количества бактериальных обострений в 1,65 раза (p <0,01) и снижает необходимость системной антибактериальной терапии в 1,51 раза (p <0,01), что приводит к лучшему исходу заболевания.
Одна группа пациентов получала лечение в соответствии с утвержденными и действующими в их стране схемами комплексного лечения ОРВИ и гриппа; в другую группу вошли пациенты, получавшие комплексное лечение, в том числе противовирусный препарат Кагоцел @ (Россия).При каждом из 3 посещений оценивались клинические симптомы (в баллах), наличие бактериального обострения и эффективность медикаментозного лечения, включая антибактериальную терапию. Результаты:
Бактериальные обострения зафиксированы в 8,3% случаев, системные антибиотики назначены врачами в 9,3% случаев. Частота бактериальных обострений и назначения системных антибиотиков возрастала пропорционально возрасту пациентов, тяжести заболевания, времени первого посещения врача и начала лечения.Назначение Кагоцела® в комплексном лечении ОРВИ и гриппа способствует снижению количества бактериальных обострений в 1,65 раза (p <0,01) и снижает необходимость системной антибактериальной терапии в 1,51 раза (p <0,01), что приводит к лучшему исходу заболевания. в разное время начала терапии. Максимальная эффективность и меньшее количество обострений лечения отмечены у пациентов трудоспособного возраста. Выводы:
Противовирусная терапия показала свою эффективность при лечении ОРВИ и гриппа, ее применение приводит к снижению частоты бактериальных обострений.
в разное время начала терапии. Максимальная эффективность и меньшее количество обострений лечения отмечены у пациентов трудоспособного возраста. Выводы:
Противовирусная терапия показала свою эффективность при лечении ОРВИ и гриппа, ее применение приводит к снижению частоты бактериальных обострений.
Совместное возникновение устойчивости к различным антибиотикам у водных бактерий | BMC Microbiology
Изоляция исследуемой популяции
Для изучения устойчивости к антибиотикам в естественной среде поверхностных вод мы выделили устойчивые изоляты бактерий из реки Эмайыги. Для выделения использовали среду на основе природной воды с добавлением пептона и дрожжевого экстракта. Эта среда позволяет изолировать широкий филогенетический и физиологический диапазон водных бактерий.В предыдущих исследованиях, посвященных изучению устойчивых к антибиотикам бактерий в пресноводных средах, в основном использовались питательные среды, которые отбирались для определенных филогенетических или физиологических типов бактерий [7, 29, 30]. Наиболее похожей на используемую нами питательной средой является Лурия-Бертани, более питательная и редко применяемая [31]. Наш метод прямого посева должен позволить изолировать большое разнообразие от сообщества, включая редкие виды. Альтернативный подход, который может быть использован, — это предварительное обогащение членов сообщества партиями культур, содержащих только естественную среду i.е. речная вода, дополненная антибиотиками. Однако этот метод позволит изучать только преобладающие бактерии и пропустить редкие виды.
Наиболее похожей на используемую нами питательной средой является Лурия-Бертани, более питательная и редко применяемая [31]. Наш метод прямого посева должен позволить изолировать большое разнообразие от сообщества, включая редкие виды. Альтернативный подход, который может быть использован, — это предварительное обогащение членов сообщества партиями культур, содержащих только естественную среду i.е. речная вода, дополненная антибиотиками. Однако этот метод позволит изучать только преобладающие бактерии и пропустить редкие виды.
В качестве селективных агентов использовали пять антибиотиков: ампициллин, хлорамфеникол, канамицин, норфлоксацин и тетрациклин. Эти антибиотики были выбраны для охвата целого ряда лекарственных мишеней: репликации ДНК, трансляции белков и синтеза клеточной стенки. Концентрации антибиотика были выбраны так, чтобы они были больше или близки к пороговым значениям минимальной ингибирующей концентрации (МИК) для устойчивости согласно EUCAST [32].
Бактерии были выделены путем высева пробы воды непосредственно на селективную среду с последующей инкубацией при 18 ° C в течение нескольких дней. Точный период инкубации был скорректирован в соответствии со скоростью роста колоний. После инкубации из каждого планшета отбирали набор колоний и повторно штриховали несколько раз для получения чистых штаммов. С каждой чашки собирали не менее десяти колоний. Эти колонии были отобраны с учетом различных наблюдаемых морфологий колоний. Если на чашке было более десяти морфологических типов, количество собранных изолятов увеличивалось, чтобы включить представителей всех морфотипов.
Точный период инкубации был скорректирован в соответствии со скоростью роста колоний. После инкубации из каждого планшета отбирали набор колоний и повторно штриховали несколько раз для получения чистых штаммов. С каждой чашки собирали не менее десяти колоний. Эти колонии были отобраны с учетом различных наблюдаемых морфологий колоний. Если на чашке было более десяти морфологических типов, количество собранных изолятов увеличивалось, чтобы включить представителей всех морфотипов.
В коллекции 760 изолятов. Для всех изолятов ген 16S рРНК амплифицировали с помощью ПЦР из геномной ДНК и секвенировали. Изоляты были собраны с использованием проекта базы данных рибосом в соответствии с последовательностями гена 16S рРНК в 9 филогенетических классов: актинобактерии, альфа-протеобактерии, бациллы, бетапротеобактерии, дейнококки, флавобактерии, гаммапротеобактерии, сфингобактерии и термопротеи (рисунок 1). В эти классы, в свою очередь, входят представители 59 родов.Класс, содержащий наибольшее количество изолятов, — это Gammaproteobacteria, почти половина (49%) изолятов. Более половины (58%) изолятов Gammaproteobacteria представляют собой 217 штаммов Pseudomonas . Ни один другой род не был представлен более чем 100 изолятами. Следующими по величине родами были род Chryseobacterium из Flavobacteria и род Stenotrophomonas из Gammaproteobacteria с 86 и 73 изолятами соответственно. Четырнадцать из 59 родов были представлены менее чем 10 изолятами.Филогенетический состав культивируемого сообщества, выделенного в нашем исследовании в присутствии антибиотиков, существенно не отличался от общего профиля любой водной среды [33–35]. Селекция в сторону Gammaproteobacteria — хорошо известная предвзятость бактериальных сообществ водных бактерий [36]. Когда изоляты из планшетов, содержащих антибиотики, сравнивали с изолятами, выращенными на среде ZoBell, не содержащей лекарств, не наблюдалось заметных различий между основными родами (Peeter Laas, неопубликованные данные).
Более половины (58%) изолятов Gammaproteobacteria представляют собой 217 штаммов Pseudomonas . Ни один другой род не был представлен более чем 100 изолятами. Следующими по величине родами были род Chryseobacterium из Flavobacteria и род Stenotrophomonas из Gammaproteobacteria с 86 и 73 изолятами соответственно. Четырнадцать из 59 родов были представлены менее чем 10 изолятами.Филогенетический состав культивируемого сообщества, выделенного в нашем исследовании в присутствии антибиотиков, существенно не отличался от общего профиля любой водной среды [33–35]. Селекция в сторону Gammaproteobacteria — хорошо известная предвзятость бактериальных сообществ водных бактерий [36]. Когда изоляты из планшетов, содержащих антибиотики, сравнивали с изолятами, выращенными на среде ZoBell, не содержащей лекарств, не наблюдалось заметных различий между основными родами (Peeter Laas, неопубликованные данные).
Некорневое байесовское филогенетическое дерево 760 изолятов с использованием последовательностей гена 16S рРНК. Масштабная линейка представляет 1,0 ожидаемых изменения на позицию нуклеотида. Узлы имеют цветовую маркировку в соответствии с антибиотиками, используемыми для выделения штаммов, но площадь не пропорциональна количеству изолятов этого антибиотика. Ширина узла пропорциональна количеству изолятов в каждом узле. Обозначены антибиотики: Амп — ампициллин, Кам — хлорапменикол, Кан — канамицин, Нор — норфлоксацин, Тет — тетрациклин.Цифрами обозначены роды следующим образом: 1 — Flexibacteriaceae , 2 — Sphingobacterium , 3 — Pedobacter , 4 — Flavobacterium , 5 — Elizabethkingia cus, 6 — Chryseobacterium — 0006, Chryseobacterium — 0006, — Brachybacterium , 9 — Microbacteriaceae , 10 — Cellulomonadaceae , 11 — Micrococcaceae , 12 — Nocardiaceae , 13 — Nocardioidaceae , 14 — — Sanguibiba , 14 — Sanguibib. Sphingomonadaceae , 17 — Hyphomicrobiaceae , 18 — Caulobacteraceae , 19 — Ensifer , 20 — Alcaligenaceae , 21 — Oxalobacteriaceae , 22 — , Comamonadaceae , Aeromonas cedis — Incertia cedis — , 25 — Enterobacteriaceae , 26 — Acinetobacter , 27 — Pseudomonas , 28 — Xanthomonada ceae .
Масштабная линейка представляет 1,0 ожидаемых изменения на позицию нуклеотида. Узлы имеют цветовую маркировку в соответствии с антибиотиками, используемыми для выделения штаммов, но площадь не пропорциональна количеству изолятов этого антибиотика. Ширина узла пропорциональна количеству изолятов в каждом узле. Обозначены антибиотики: Амп — ампициллин, Кам — хлорапменикол, Кан — канамицин, Нор — норфлоксацин, Тет — тетрациклин.Цифрами обозначены роды следующим образом: 1 — Flexibacteriaceae , 2 — Sphingobacterium , 3 — Pedobacter , 4 — Flavobacterium , 5 — Elizabethkingia cus, 6 — Chryseobacterium — 0006, Chryseobacterium — 0006, — Brachybacterium , 9 — Microbacteriaceae , 10 — Cellulomonadaceae , 11 — Micrococcaceae , 12 — Nocardiaceae , 13 — Nocardioidaceae , 14 — — Sanguibiba , 14 — Sanguibib. Sphingomonadaceae , 17 — Hyphomicrobiaceae , 18 — Caulobacteraceae , 19 — Ensifer , 20 — Alcaligenaceae , 21 — Oxalobacteriaceae , 22 — , Comamonadaceae , Aeromonas cedis — Incertia cedis — , 25 — Enterobacteriaceae , 26 — Acinetobacter , 27 — Pseudomonas , 28 — Xanthomonada ceae .
У нас было две станции отбора проб: одна выше города с населением 100 000 жителей (Тарту, Эстония), а другая ниже по течению. Никаких статистически значимых различий в филогенетической принадлежности и паттернах AR не наблюдалось при сравнении бактерий, выделенных из верхнего или нижнего течения (данные не показаны).
Характеристика устойчивости к антибиотикам
Поскольку наши изоляты показали большое разнообразие скоростей роста и формы кривых роста, стандартный тест МИК не мог быть применен.Вместо этого мы выращивали изоляты в 96-луночных планшетах в присутствии и в отсутствие антибиотика. Культуры выращивали при 20 ° C без встряхивания, и OD измеряли через 16, 20, 24, 40 и 64 часа.
Все пять антибиотиков, использованных для выделения штаммов, были использованы для проверки уровня устойчивости всех изолятов в коллекции. Поскольку коллекция содержала большое количество штаммов Pseudomonas , а повышенная устойчивость к карбапенемам является проблемой в медицинских учреждениях Эстонии [37], мы включили в тестирование устойчивости один из антибиотиков этой группы — меропенем.
Рост чувствительного к антибиотику штамма подавляется лекарством, что приводит к более низкой оптической плотности. Разделив значение OD тестовой культуры, содержащей антибиотик, на контрольную культуру без антибиотика, мы получили количественное значение AR для каждой временной точки. Это значение варьировалось от 0 (отсутствие роста в присутствии антибиотика) до 1 (отсутствие ингибирования антибиотиком) и использовалось во всех последующих анализах. Желательно уменьшить показания AR с течением времени до одного значения, характеризующего конкретный изолят.Таким образом, все изоляты характеризовались наименьшим значением устойчивости за время роста.
Мы протестировали все антибиотики в трех концентрациях, в результате чего получили три значения AR для каждого изолята. Мы предположили, что концентрация антибиотика, приводящая к наибольшей вариабельности значений AR между изолятами, будет наиболее информативной для характеристики уровней устойчивости в популяции. Для оценки вариабельности при различных концентрациях антибиотика были рассчитаны попарные различия в значениях устойчивости для всех изолятов и значения объединены, чтобы дать общую сумму для каждой конкретной концентрации антибиотика. Концентрация с наибольшим итогом была определена как наиболее информативная и выбрана для дальнейшего анализа. Информативные концентрации: 100 мкг мл -1 для ампициллина, 5 мкг мл -1 для хлорамфеникола, 1 мкг мл -1 для канамицина, 0,5 мкг мл -1 для норфлоксацина, 5 мкг мл -1 для тетрациклина и 0,3 мкг мл -1 для меропенема.
Концентрация с наибольшим итогом была определена как наиболее информативная и выбрана для дальнейшего анализа. Информативные концентрации: 100 мкг мл -1 для ампициллина, 5 мкг мл -1 для хлорамфеникола, 1 мкг мл -1 для канамицина, 0,5 мкг мл -1 для норфлоксацина, 5 мкг мл -1 для тетрациклина и 0,3 мкг мл -1 для меропенема.
Распределение устойчивости
Мы проанализировали распространенность устойчивости к антибиотикам у восьми родов, которые были представлены более чем 20 изолятами каждый: Aeromonas с 57 изолятами (представленными 3 операционными таксономическими единицами (OTU), как определено 16S рРНК). типы последовательностей), Pseudomonas 217 (7 OTU), Stenotrophomonas 73 (5 OTU), Chryseobacterium 86 (25 OTU), Pedobacter 61 (7 OTU), Flavobacter Microbacterium 37 (6 OTU) и Brevundimonas 23 (5 OTU).Количество OTU указывает на то, что фактическое видовое богатство может быть ниже, чем можно оценить по количеству изолятов. С другой стороны, сходство последовательностей 16S рРНК не всегда является достаточно чувствительным критерием для различения разных видов [38, 39]. В большинстве случаев одна OTU содержит небольшое количество изолятов, что делает невозможным анализ данных на уровне OTU. Поэтому последующий анализ (рис. 2) проводился на уровне рода. Тем не менее, интересно отметить, что три основных OTU Chrysobacterium имели значительно разные паттерны устойчивости по сравнению друг с другом (Таблица 1).OTU «A», содержащая 18 изолятов, значительно более чувствительна к ампициллину, меропенему (значение p 10 -5 ) и норфлоксацину по сравнению с OTU «C», содержащим 13 изолятов. OTU «B», содержащая 11 изолятов, была более чувствительна к ампициллину, меропенему, норфлоксацину и тетрациклину по сравнению с OTU «C». Существенных различий между «А» и «Б» не было.
С другой стороны, сходство последовательностей 16S рРНК не всегда является достаточно чувствительным критерием для различения разных видов [38, 39]. В большинстве случаев одна OTU содержит небольшое количество изолятов, что делает невозможным анализ данных на уровне OTU. Поэтому последующий анализ (рис. 2) проводился на уровне рода. Тем не менее, интересно отметить, что три основных OTU Chrysobacterium имели значительно разные паттерны устойчивости по сравнению друг с другом (Таблица 1).OTU «A», содержащая 18 изолятов, значительно более чувствительна к ампициллину, меропенему (значение p 10 -5 ) и норфлоксацину по сравнению с OTU «C», содержащим 13 изолятов. OTU «B», содержащая 11 изолятов, была более чувствительна к ампициллину, меропенему, норфлоксацину и тетрациклину по сравнению с OTU «C». Существенных различий между «А» и «Б» не было.
Средние значения коэффициентов устойчивости в определенном роде, сгруппированные по антибиотикам (A) и родам (B). ( A ) Роды организованы по протестированным антибиотикам. 1 — Aeromonas , 2 — Pseudomonas , 3 — Stenotrpophomonas , 4 — Chryseobacterium , 5 — Pedobacter , 6 — Flavobacterium , 7 — 0005 Brembacterium. ( B ) Проверенные антибиотики сгруппированы по родам. Концентрации антибиотиков составляли: AMP — ампициллин 100 мкг мл -1 , CAM — хлорамфеникол 5 мкг мл -1 , KAN — канамицин 1 мкг мл -1 , MER — меропенем 0.3 мкг мл -1 , NOR — норфлоксацин 0,5 мкг мл -1 и TET — тетрациклин 5 мкг мл -1 .
( A ) Роды организованы по протестированным антибиотикам. 1 — Aeromonas , 2 — Pseudomonas , 3 — Stenotrpophomonas , 4 — Chryseobacterium , 5 — Pedobacter , 6 — Flavobacterium , 7 — 0005 Brembacterium. ( B ) Проверенные антибиотики сгруппированы по родам. Концентрации антибиотиков составляли: AMP — ампициллин 100 мкг мл -1 , CAM — хлорамфеникол 5 мкг мл -1 , KAN — канамицин 1 мкг мл -1 , MER — меропенем 0.3 мкг мл -1 , NOR — норфлоксацин 0,5 мкг мл -1 и TET — тетрациклин 5 мкг мл -1 .
Мы обнаружили, что с каждым антибиотиком некоторые роды были почти полностью устойчивы к препарату ( Aeromonas ). к ампициллину), тогда как другие были весьма чувствительны ( Flavobacterium к ампициллину; рис. 2А).Единственным исключением был меропенем, где все охарактеризованные роды имели среднее значение устойчивости 0,5 или выше. Ни один из 6 антибиотиков не смог существенно подавить рост всех изолятов ни в одной из филогенетических групп.
2А).Единственным исключением был меропенем, где все охарактеризованные роды имели среднее значение устойчивости 0,5 или выше. Ни один из 6 антибиотиков не смог существенно подавить рост всех изолятов ни в одной из филогенетических групп.
Когда мы проанализировали данные в соответствии с филогенетическими группами, мы обнаружили, что в каждой группе некоторые антибиотики подавляли большинство изолятов, а некоторые не подавляли ни одного (рис. 2B). Следовательно, некоторая часть устойчивости может определяться филогенетической принадлежностью, что, вероятно, указывает на внутренние механизмы устойчивости [4, 40].
Несколько родов имели среднее значение сопротивления около 0,5 (от 0,3 до 0,7). Чтобы оценить, были ли эти средние значения устойчивости вызваны присутствием смеси полностью устойчивых и полностью чувствительных изолятов или же они были вызваны промежуточной устойчивостью всех изолятов, мы проанализировали распределение коэффициентов устойчивости внутри каждого рода (рисунок 3 и дополнительные файл 1: Рисунок S1). Во всех случаях наблюдалось широкое распределение значений устойчивости, хотя в некоторых случаях можно было наблюдать группировку вокруг самых низких и высоких значений (например, изоляты Pseudomonas , проанализированные на тетрациклине (рис. 3A)).Высокая вариабельность устойчивости внутри филогенетических групп предполагает, что причиной этого явления является приобретенная устойчивость.
Во всех случаях наблюдалось широкое распределение значений устойчивости, хотя в некоторых случаях можно было наблюдать группировку вокруг самых низких и высоких значений (например, изоляты Pseudomonas , проанализированные на тетрациклине (рис. 3A)).Высокая вариабельность устойчивости внутри филогенетических групп предполагает, что причиной этого явления является приобретенная устойчивость.
Примеры распределения коэффициента сопротивления. Аббревиатуры антибиотиков указаны в легенде к рисунку 2. Распределение коэффициентов устойчивости среди восьми наиболее многочисленных родов к антибиотикам, где среднее значение устойчивости для рода составляло от 0,3 до 0,7, представлено в дополнительном файле 1: Рисунок S1.
Распределение мультирезистентности
Несколько филогенетических групп показали высокую устойчивость к более чем одному антибиотику. Это могло быть связано с существованием «супербактерий», устойчивых ко многим лекарствам и известных как успешные в клинических условиях [41]. В качестве альтернативы, может быть случайное распределение уровней внутренней и естественной устойчивости.
В качестве альтернативы, может быть случайное распределение уровней внутренней и естественной устойчивости.
Чтобы проверить это, мы объединили значения уровней резистентности для каждого изолята по всем шести антибиотикам. Результаты показывают (рис.4), что уровни устойчивости к разным лекарствам демонстрируют нормальное распределение, что подтверждено тестом Колмогорова-Смирнова на нормальность (p = 0.40). Это указывает на то, что у детерминант устойчивости нет тенденции группироваться вместе или избегать друг друга, предполагая, что множественная резистентность возникает случайно и что в пресноводной среде нет отбора для нее. Существование мультирезистентных «супербактерий» проявилось бы как смещение в сторону правого локтя, но такой тенденции нет.
Рис. 4 Распределение комбинированных значений резистентности, измеренных для шести использованных антибиотиков. Столбики показывают количество изолятов с комбинированными значениями сопротивления с шагом 0,5. Серая линия показывает теоретическое нормальное распределение для популяции с таким же размером и средним значением.
Серая линия показывает теоретическое нормальное распределение для популяции с таким же размером и средним значением.
Следует отметить, что если изолят полностью устойчив ко всем используемым антибиотикам, то комбинированное значение будет 6. Большие значения в нашем наборе данных указывают на неконтролируемые колебания в измерении ОП или штаммы, которые могут использовать антибиотики для собственной пользы. [42].
Корреляции сопротивления
Очевидно случайное группирование уровней сопротивления (рис. 4) не исключает возможности того, что некоторые специфические сопротивления группируются вместе.Чтобы проверить это, мы рассчитали коэффициенты корреляции для уровней устойчивости между всеми парами антибиотиков в наборе данных. Наблюдались восемь значимых (p <0,05) положительных корреляций и четыре отрицательных корреляции (рисунок 5). Наибольшая корреляция была между уровнями устойчивости к тетрациклину и хлорамфениколу с коэффициентом корреляции 0,669 (p <0,05, N = 760). Все остальные корреляции были между -0,5 и 0,5 (рис. 5). Помимо парных корреляций, мы также исследовали возможность корреляций между тремя антибиотиками, которые не могли бы быть объяснены парными корреляциями, но мы не наблюдали таких корреляций.
Все остальные корреляции были между -0,5 и 0,5 (рис. 5). Помимо парных корреляций, мы также исследовали возможность корреляций между тремя антибиотиками, которые не могли бы быть объяснены парными корреляциями, но мы не наблюдали таких корреляций.
Тепловая карта коэффициентов корреляции (p-значение <0,05) между парами антибиотиков. Белые клетки означают, что корреляции не было или что корреляция была статистически недостоверной (p-значение> 0,05). AMP — ампициллин, CAM — хлорамфеникол, KAN — канамицин, MER — меропенем, NOR — норфлоксацин и TET — тетрациклин.
Возможно, что корреляция между уровнями резистентности вызвана очень сильной корреляцией внутри конкретной филогенетической группы, а не является свойством полного набора данных.Чтобы проанализировать это, мы также вычислили корреляции в восьми более крупных родах, каждый из которых содержал более 20 изолятов (рис. 5). Сильная положительная корреляция между устойчивостью к тетрациклину и устойчивостью к хлорамфениколу наблюдалась в шести из восьми проанализированных филогенетических групп, в случае Aeromonas коэффициент корреляции достиг 0,859 (p <0,05, N = 57). Это широко распространенное связывание устойчивости к тетрациклину и хлорамфениколу предполагает, что либо существует общий множественный лекарственный отток, активный для обоих соединений [11], либо отдельные детерминанты устойчивости объединены в одну плазмиду или транспозон, способный к эффективному горизонтальному распространению.Эти молекулярные механизмы ждут дальнейших исследований.
Это широко распространенное связывание устойчивости к тетрациклину и хлорамфениколу предполагает, что либо существует общий множественный лекарственный отток, активный для обоих соединений [11], либо отдельные детерминанты устойчивости объединены в одну плазмиду или транспозон, способный к эффективному горизонтальному распространению.Эти молекулярные механизмы ждут дальнейших исследований.
Проблема бактериальных осложнений после респираторных вирусных инфекций
Каждый человек в течение своей жизни неоднократно заражается различными респираторными вирусами, которые представляют собой факторы риска развития бактериальных осложнений. Наиболее опасным из этиологических факторов ОРВИ является вирус гриппа А. Этот вирус способен вызывать катастрофические пандемии с высокой смертностью, в основном из-за вторичной бактериальной пневмонии.Как показали многочисленные недавние исследования, основным механизмом провоцирования бактериальных инфекций независимо от типа респираторного вируса является несбалансированный ответ противовирусного врожденного иммунитета — чрезмерный ответ интерферона и неконтролируемое воспаление. Вероятность тяжелых бактериальных осложнений при течении ОРВИ определяется как вирулентностью самого вируса, так и составом респираторной микробиоты на момент вирусной инфекции, а также генетическими особенностями организма.На возникновение серьезных бактериальных осложнений также влияют хронические заболевания, которые влияют на регуляцию врожденного иммунного ответа. В этом обзоре кратко излагается современная концепция механизмов развития поствирусных бактериальных осложнений, а также возможные стратегии профилактики этих осложнений.
Вероятность тяжелых бактериальных осложнений при течении ОРВИ определяется как вирулентностью самого вируса, так и составом респираторной микробиоты на момент вирусной инфекции, а также генетическими особенностями организма.На возникновение серьезных бактериальных осложнений также влияют хронические заболевания, которые влияют на регуляцию врожденного иммунного ответа. В этом обзоре кратко излагается современная концепция механизмов развития поствирусных бактериальных осложнений, а также возможные стратегии профилактики этих осложнений.
По оценкам Всемирной организации здравоохранения (ВОЗ), от острых респираторных вирусных инфекций (ОРВИ) ежегодно умирает 3,9 миллиона человек [1].Эти инфекции поражают все возрастные группы, но сильнее всего влияют на здоровье детей, пожилых людей и людей с хроническими заболеваниями. Риск ОРВИ определяется их способностью вызывать вирусную пневмонию и вторичные бактериальные инфекции, например бактериальная пневмония, отит, менингит, а также хронические заболевания легких. Таким образом, респираторные вирусы участвуют примерно в половине всех случаев внебольничной пневмонии (ВП) у детей. Кроме того, они вызывают более 90% случаев бронхиолита у младенцев и 85-95% случаев обострения астмы у детей.Вне периода пандемического гриппа ОРВИ являются причиной 30-50% случаев ВП, 80% обострений астмы и 20-60% обострений хронической обструктивной болезни легких (ХОБЛ) у взрослых. В целом эти инфекции являются одной из пяти основных причин смертности населения в мире, а во многих развивающихся странах они являются ведущими причинами смертности детей в возрасте до пяти лет.
Таким образом, респираторные вирусы участвуют примерно в половине всех случаев внебольничной пневмонии (ВП) у детей. Кроме того, они вызывают более 90% случаев бронхиолита у младенцев и 85-95% случаев обострения астмы у детей.Вне периода пандемического гриппа ОРВИ являются причиной 30-50% случаев ВП, 80% обострений астмы и 20-60% обострений хронической обструктивной болезни легких (ХОБЛ) у взрослых. В целом эти инфекции являются одной из пяти основных причин смертности населения в мире, а во многих развивающихся странах они являются ведущими причинами смертности детей в возрасте до пяти лет.
В отличие от других респираторных вирусов, вирус гриппа A представляет наибольшую опасность из-за его циркуляции у разных видов животных и способности реассортировать геномные фрагменты, что приводит к быстрой модификации основных поверхностных антигенов вируса — гемагглютинина (HA) и нейраминидазы ( NA) (антигенный сдвиг).Этот механизм определяет возможность появления новых антигенных вариантов вирусов гриппа А, таких как h2N1, h3N2, h4N2, h2N1pdm09, вызвавших четыре известные пандемии [2, 3].
В периоды между пандемиями вирусы гриппа также претерпевают антигенные изменения, вызванные постепенным накоплением мутаций в HA и NA (антигенный дрейф), что приводит к возникновению сезонных эпидемий.
Даже сейчас, в 21 веке, когда доступны противогриппозные препараты и антибиотики широкого спектра действия, у людей с сезонным гриппом есть вероятность развития осложнений.Таким образом, как вирус-индуцированный острый респираторный дистресс-синдром (ОРДС), так и вторичная бактериальная пневмония могут развиться в течение первой недели после вирусной инфекции. По данным ВОЗ, от гриппа ежегодно умирает до 650 000 человек во всем мире [1]. Согласно данным Центров по контролю и профилактике заболеваний (CDC, Атланта, Джорджия, США), в США с населением около 300 миллионов человек уровень смертности от гриппа колеблется от 16 000 до 56 000 случаев в год. В Российской Федерации с населением около 140 миллионов человек смертность от сезонного гриппа оценивается на уровне нескольких сотен в год, хотя официальных данных в открытом доступе нет. Различие в статистике смертности от гриппа в разных странах можно определить по разнице в методах расчета. Например, статистика смертности от бактериальной пневмонии может не учитывать роль вирусного этиологического фактора как провокатора вторичной инфекции. Таким образом, лица, умершие от бактериальной пневмонии, не могут быть включены в расчет смертности от гриппа, даже если бактериальные осложнения были спровоцированы первичной инфекцией гриппа.
Различие в статистике смертности от гриппа в разных странах можно определить по разнице в методах расчета. Например, статистика смертности от бактериальной пневмонии может не учитывать роль вирусного этиологического фактора как провокатора вторичной инфекции. Таким образом, лица, умершие от бактериальной пневмонии, не могут быть включены в расчет смертности от гриппа, даже если бактериальные осложнения были спровоцированы первичной инфекцией гриппа.
Пандемия вируса гриппа A (h2N1) (испанский грипп) 1918 года была самой смертельной из когда-либо зарегистрированных эпидемий гриппа. В ходе этой пандемии, случившейся во время Первой мировой войны, было инфицировано 50% населения мира, в результате чего погибло около 40-50 миллионов человек [4]. От пандемии больше всего страдали люди в возрасте 20-40 лет, служившие в армии. Поскольку вирус гриппа был открыт в 1933 году, во время пандемии в Испании этиологический агент болезни еще не был идентифицирован.В то время микробиологи пытались связать испанский грипп с различными бактериальными возбудителями, в частности с Haemophilus influenzae (H. influenzae) [5]. Теперь, благодаря доступности метода ПЦР, стало возможным идентифицировать гены вируса гриппа в вскрытых и гистологических образцах того времени и реконструировать испанский вирус h2N1 с помощью обратной генетики. Удивительно, но реконструированный вирус не имел радикальных отличий по генетической структуре от циркулирующих в настоящее время вирусов [6].Последующее изучение вскрытых образцов показало, что более 90% проанализированных образцов легочной ткани умерших во время пандемии гриппа в Испании имели признаки бактериальной инфекции [7-9]. Оказалось, что 95% смертей были вызваны не самим вирусом гриппа, а последовательной бактериальной пневмонией. В частности, было доказано, что Streptococcus pneumoniae (S. pneumoniae) был основным инфекционным агентом, вызвавшим диагностированную пневмонию [10]. Вскрытие показало наличие S.pneumoniae в легких 44% и в крови 33% больных, умерших от испанского гриппа [10, 11]. Хотя S. pneumoniae была основной причиной смертности, другие инфекционные агенты, такие как Staphylococcus aureus (S.
influenzae) [5]. Теперь, благодаря доступности метода ПЦР, стало возможным идентифицировать гены вируса гриппа в вскрытых и гистологических образцах того времени и реконструировать испанский вирус h2N1 с помощью обратной генетики. Удивительно, но реконструированный вирус не имел радикальных отличий по генетической структуре от циркулирующих в настоящее время вирусов [6].Последующее изучение вскрытых образцов показало, что более 90% проанализированных образцов легочной ткани умерших во время пандемии гриппа в Испании имели признаки бактериальной инфекции [7-9]. Оказалось, что 95% смертей были вызваны не самим вирусом гриппа, а последовательной бактериальной пневмонией. В частности, было доказано, что Streptococcus pneumoniae (S. pneumoniae) был основным инфекционным агентом, вызвавшим диагностированную пневмонию [10]. Вскрытие показало наличие S.pneumoniae в легких 44% и в крови 33% больных, умерших от испанского гриппа [10, 11]. Хотя S. pneumoniae была основной причиной смертности, другие инфекционные агенты, такие как Staphylococcus aureus (S..jpg) aureus) , H. influenzae и ряд других Streptococcus spp . были также идентифицированы при вскрытии легкого [5, 7]. Следовательно, катастрофический исход пандемии гриппа 1918 года мог быть определен нехваткой вакцин и противовирусных препаратов против вируса гриппа, а также отсутствием антибиотиков, которые могли бы подавить вторичные бактериальные осложнения.
aureus) , H. influenzae и ряд других Streptococcus spp . были также идентифицированы при вскрытии легкого [5, 7]. Следовательно, катастрофический исход пандемии гриппа 1918 года мог быть определен нехваткой вакцин и противовирусных препаратов против вируса гриппа, а также отсутствием антибиотиков, которые могли бы подавить вторичные бактериальные осложнения.
Пандемия гриппа в эпоху антибиотиков при отсутствии вакцинации и противовирусных препаратов
В 1957 году пандемия азиатского гриппа поразила 40-50% людей во всем мире, а общая смертность оценивалась от 1,5 до 4 миллионов человек [13], а число погибших в Соединенных Штатах достигло около 69 800 человек [13-15]. Причиной пандемии стал штамм вируса гриппа A (h3N2) [12]. Анализ образцов вскрытия показал наличие бактериальной инфекции в 80% всех тяжелых и летальных случаев [8, 16, 17].Следует отметить, что к этому времени такие антибиотики, как пенициллин и стрептомицин, уже были доступны и использовались в медицинской практике в развитых странах. Однако во время этой пандемии в США и ряде других стран наблюдалось заметное увеличение числа госпитализаций, связанных с пневмонией, вызванной в основном S. pneumoniae , H. influenzae и S. aureus [18 ]. Аналогичные данные были получены в Нидерландах, где из 148 смертей, предположительно вызванных азиатской пандемией гриппа, 75% были связаны с бактериальной пневмонией, спровоцированной в 15% случаев S.pneumoniae и в 59% случаев — S. aureus [16]. Следует отметить, что приведенные данные бактериологического исследования могли быть сильно искажены, поскольку в то время многие пациенты уже получали лечение антибиотиками [19].
Однако во время этой пандемии в США и ряде других стран наблюдалось заметное увеличение числа госпитализаций, связанных с пневмонией, вызванной в основном S. pneumoniae , H. influenzae и S. aureus [18 ]. Аналогичные данные были получены в Нидерландах, где из 148 смертей, предположительно вызванных азиатской пандемией гриппа, 75% были связаны с бактериальной пневмонией, спровоцированной в 15% случаев S.pneumoniae и в 59% случаев — S. aureus [16]. Следует отметить, что приведенные данные бактериологического исследования могли быть сильно искажены, поскольку в то время многие пациенты уже получали лечение антибиотиками [19].
Общее число погибших от пандемии в Гонконге 1968-1969 гг., Вызванной штаммом вируса гриппа A (h4N2), составило около 2 миллионов человек [20, 21]. Увеличение смертности от респираторных инфекций на 55%, большинство случаев сопровождались вторичной бактериальной пневмонией, было зарегистрировано в Великобритании в 1969 г. [22].Стафилококковая пневмония оказалась основным осложнением гонконгского гриппа h4N2. Например, из 129 взрослых с диагнозом пандемический грипп пневмония была обнаружена в 16% случаев, из которых 40% (6% из всех 129 случаев гриппа) закончились летальным исходом. S. aureus или Pseudomonas aeruginosa (P. aeruginosa) были обнаружены в 75% вскрытых образцов умершего [23]. Следует отметить, что в ходе пандемии в Испании большинство летальных случаев вторичной бактериальной пневмонии было вызвано S.pneumonia , но во время пандемий 1957 и 1968 годов преобладающим этиологическим агентом вторичной бактериальной пневмонии стал S. aureus . Это можно объяснить повышенной устойчивостью к антибиотикам S. aureus из-за широкого использования антибиотиков населением в то время.
[22].Стафилококковая пневмония оказалась основным осложнением гонконгского гриппа h4N2. Например, из 129 взрослых с диагнозом пандемический грипп пневмония была обнаружена в 16% случаев, из которых 40% (6% из всех 129 случаев гриппа) закончились летальным исходом. S. aureus или Pseudomonas aeruginosa (P. aeruginosa) были обнаружены в 75% вскрытых образцов умершего [23]. Следует отметить, что в ходе пандемии в Испании большинство летальных случаев вторичной бактериальной пневмонии было вызвано S.pneumonia , но во время пандемий 1957 и 1968 годов преобладающим этиологическим агентом вторичной бактериальной пневмонии стал S. aureus . Это можно объяснить повышенной устойчивостью к антибиотикам S. aureus из-за широкого использования антибиотиков населением в то время.
Пандемия гриппа в присутствии противогриппозных вакцин, противовирусных препаратов и антибиотиков
Вспышка вируса гриппа A (h2N1) pdm09 в 2009 г. распространилась на 41 страну в течение четырех недель и переросла в пандемию [20, 24 ].Компонент h2N1 вакцин против сезонного гриппа, произведенных в 2009 г., не соответствовал антигенным свойствам недавно появившемуся пандемическому штамму A (h2N1) pdm09. Считается, что общее число погибших от этой пандемии составило около 284 000 человек во всем мире [25]. Частыми причинами смерти в ходе этой пандемии в США были вторичные бактериальные инфекции, вызванные в основном S. pneumoniae и S. pyogenes [26, 27]. Другие исследования в США показали, что почти в 30% из 77 летальных случаев инфекция гриппа сопровождалась бактериальными инфекциями, 46% из которых были вызваны S.pneumoniae , 9% — S. aureus и 1% — H. influenzae . Palacios et al. исследовал мазки из носоглотки почти 200 пациентов с пандемическим гриппом и обнаружил H. influenzae в 52% образцов, S. pneumoniae в 31% и S. aureus в 18% образцов соответственно [28 ].
распространилась на 41 страну в течение четырех недель и переросла в пандемию [20, 24 ].Компонент h2N1 вакцин против сезонного гриппа, произведенных в 2009 г., не соответствовал антигенным свойствам недавно появившемуся пандемическому штамму A (h2N1) pdm09. Считается, что общее число погибших от этой пандемии составило около 284 000 человек во всем мире [25]. Частыми причинами смерти в ходе этой пандемии в США были вторичные бактериальные инфекции, вызванные в основном S. pneumoniae и S. pyogenes [26, 27]. Другие исследования в США показали, что почти в 30% из 77 летальных случаев инфекция гриппа сопровождалась бактериальными инфекциями, 46% из которых были вызваны S.pneumoniae , 9% — S. aureus и 1% — H. influenzae . Palacios et al. исследовал мазки из носоглотки почти 200 пациентов с пандемическим гриппом и обнаружил H. influenzae в 52% образцов, S. pneumoniae в 31% и S. aureus в 18% образцов соответственно [28 ]. Тяжесть заболевания чаще всего была связана с вторичной инфекцией, вызванной S. pneumoniae .
Тяжесть заболевания чаще всего была связана с вторичной инфекцией, вызванной S. pneumoniae .
В другом исследовании 838 тяжелобольных детей в США было показано, что через 72 часа после госпитализации в отделение интенсивной терапии бактериальная суперинфекция развилась у 33% пациентов, 48% из которых были вызваны метициллин-резистентными. С.aureus (MRSA), в 5,5% случаев — S. pneumoniae и 5% — H. influenzae [29].
Таким образом, несмотря на повсеместное внедрение сезонных противогриппозных вакцин, противовирусных препаратов и антибиотиков, проблема бактериальных осложнений течения гриппа не перестает быть актуальной. Более того, в связи с развитием устойчивости бактериальной флоры к современным антибиотикам эта проблема может обостриться в случае новой пандемии гриппа [30].
Респираторные вирусные инфекции не гриппозной этиологии как провокаторы вторичной бактериальной пневмонии
Современная диагностика позволяет ученым анализировать бактериальные осложнения при различных респираторных инфекциях, не связанных с гриппом. В таблице 1 обобщены многочисленные исследования, которые показывают связь респираторных вирусных патогенов с некоторыми бактериями, которые могут вызывать пневмонию, средний отит, синусит и менингит в качестве осложнений. Несмотря на то, что другие респираторные вирусы не способны вызывать пандемии, эти вирусы оказались столь же опасными, как и грипп, в провоцировании вторичных бактериальных осложнений.Например, представитель семейства Paramyxoviridae , метапневмовирус человека (hMPV), может вызывать тяжелые осложнения, такие как вирус гриппа, включая как вирусную пневмонию с развитием ОРДС, так и бактериальную пневмонию [31]. Другой представитель этого семейства — респираторно-синцитиальный вирус (RSV) — оказался даже более опасным, чем грипп, по уровню смертности среди госпитализированных пациентов с диагнозом пневмония. Таким образом, смертность от всех причин через 20 дней после госпитализации была выше у пациентов с RSV-инфекцией (18.4%), чем у больных гриппом (6,7%) [32].
В таблице 1 обобщены многочисленные исследования, которые показывают связь респираторных вирусных патогенов с некоторыми бактериями, которые могут вызывать пневмонию, средний отит, синусит и менингит в качестве осложнений. Несмотря на то, что другие респираторные вирусы не способны вызывать пандемии, эти вирусы оказались столь же опасными, как и грипп, в провоцировании вторичных бактериальных осложнений.Например, представитель семейства Paramyxoviridae , метапневмовирус человека (hMPV), может вызывать тяжелые осложнения, такие как вирус гриппа, включая как вирусную пневмонию с развитием ОРДС, так и бактериальную пневмонию [31]. Другой представитель этого семейства — респираторно-синцитиальный вирус (RSV) — оказался даже более опасным, чем грипп, по уровню смертности среди госпитализированных пациентов с диагнозом пневмония. Таким образом, смертность от всех причин через 20 дней после госпитализации была выше у пациентов с RSV-инфекцией (18.4%), чем у больных гриппом (6,7%) [32]. К сожалению, нет вакцин и эффективных противовирусных препаратов для профилактики и лечения пневмовирусов, а также большинства респираторных вирусов не гриппозной этиологии.
К сожалению, нет вакцин и эффективных противовирусных препаратов для профилактики и лечения пневмовирусов, а также большинства респираторных вирусов не гриппозной этиологии.
Хотя обсервационные исследования взаимосвязи вирусных и бактериальных инфекций, проведенные в разных регионах мира, приводят к согласованным выводам, они могут различаться в оценке роли, которую различные патогены играют в развитии бактериальной ВП.Это можно объяснить значительным влиянием климатических условий и генетических характеристик населения на распространенность отдельных вирусных и бактериальных патогенов.
В США обследовали 1024 пациента с ВП и сравнили с группой из 759 контрольных пациентов без симптомов [48]. Оказалось, что вирусы гриппа, RSV, hMPV и, в меньшей степени, вирусы парагриппа и коронавирусы значительно чаще выделялись из группы пациентов с диагнозом пневмония, независимо от возраста пациента.В то же время риновирусы были частой причиной ВП у взрослых, но практически не диагностировались у детей с пневмонией. Напротив, аденовирусы были связаны с ВП только у детей младше 2 лет.
Напротив, аденовирусы были связаны с ВП только у детей младше 2 лет.
В исследовании, проведенном в Японии с участием 2617 пожилых (≥65 лет) пациентов с диагнозом хронические респираторные или другие сопутствующие заболевания, вирусные патогены были изолированы в 23,1% случаев [49]. Риновирусы были наиболее частой причиной пневмонии (9.8%), тогда как грипп и RSV были обнаружены в 3,9% случаев. RSV чаще всего диагностировался у лиц с хроническими респираторными заболеваниями, тогда как другие вирусы были связаны с пневмонией, независимо от наличия респираторных и других хронических заболеваний. В целом вирусные инфекции не предопределяли повышенного риска смертности пациентов с пневмонией, но грипп приводил к трехкратному увеличению смертности пациентов с хроническими респираторными заболеваниями. Следовательно, вклад вирусной инфекции в смертность от пневмонии зависит от типа вирусного агента и наличия сопутствующих заболеваний.
Южнокорейское метааналитическое исследование, проведенное на 5298 пациентах разных возрастных групп, показало, что провокация бактериальной суперинфекции характерна для всех вирусных респираторных инфекций [50]..gif) Однако тип бактериального патогена, вызывающего вторичную инфекцию, может зависеть как от типа вирусной инфекции, так и от возраста пациента. Например, вирусные инфекции гриппа A и B, риновирус и hMPV вызвали пневмонию у взрослых пациентов, которая была связана с S.aureus , тогда как коронавирус, вирус парагриппа и RSV привели к пневмонии, связанной с грамотрицательными бактериями Klebsiella spp . и Acinetobacter spp. Инфекция микоплазмы ( M. pneumonia ) была наиболее частой причиной бактериальной пневмонии у детей независимо от типа предыдущей вирусной инфекции. Эти исследования подчеркивают важность вирусной диагностики у пациентов с вторичной бактериальной пневмонией с точки зрения выбора правильной антибактериальной терапии.Например, поствирусная пневмония у младенцев и детей должна лечиться антибиотиками, активными против M. pneumoniae (макролиды). Взрослых с гриппом, hMPV или риновирусной инфекцией следует лечить антибиотиками, которые эффективно убивают стафилококковые бактерии, тогда как антибиотики, которые активны против широкого спектра грамотрицательных бактерий, следует назначать в случаях заражения коронавирусом и вирусом парагриппа.
Однако тип бактериального патогена, вызывающего вторичную инфекцию, может зависеть как от типа вирусной инфекции, так и от возраста пациента. Например, вирусные инфекции гриппа A и B, риновирус и hMPV вызвали пневмонию у взрослых пациентов, которая была связана с S.aureus , тогда как коронавирус, вирус парагриппа и RSV привели к пневмонии, связанной с грамотрицательными бактериями Klebsiella spp . и Acinetobacter spp. Инфекция микоплазмы ( M. pneumonia ) была наиболее частой причиной бактериальной пневмонии у детей независимо от типа предыдущей вирусной инфекции. Эти исследования подчеркивают важность вирусной диагностики у пациентов с вторичной бактериальной пневмонией с точки зрения выбора правильной антибактериальной терапии.Например, поствирусная пневмония у младенцев и детей должна лечиться антибиотиками, активными против M. pneumoniae (макролиды). Взрослых с гриппом, hMPV или риновирусной инфекцией следует лечить антибиотиками, которые эффективно убивают стафилококковые бактерии, тогда как антибиотики, которые активны против широкого спектра грамотрицательных бактерий, следует назначать в случаях заражения коронавирусом и вирусом парагриппа.
Однако, как отмечалось выше, взаимосвязь между генотипом популяции и климатическими условиями, с одной стороны, и спектром колонизирующей микробной флоры, с другой стороны, требует дальнейшего изучения с целью разработки адекватных медицинских стандартов для лечения респираторные инфекции у пациентов в разных странах.
Человеческое тело является переносчиком различных видов бактерий, которые вместе называются микробиотой [51]. Обычно эти бактерии, которые называются комменсальными штаммами, живут во взаимовыгодном симбиозе с хозяином и обеспечивают множество полезных функций для хозяина, такие как защита организма хозяина посредством конкуренции с патогенными бактериями. Обычно небольшое количество патогенных бактерий, в том числе S. pneumoniae , S. aureus , H.influenzae , S. pyogenes , Moraxella catarrhalis и MRSA присутствуют в микробиоте верхних дыхательных путей человека без серьезных последствий для организма [52].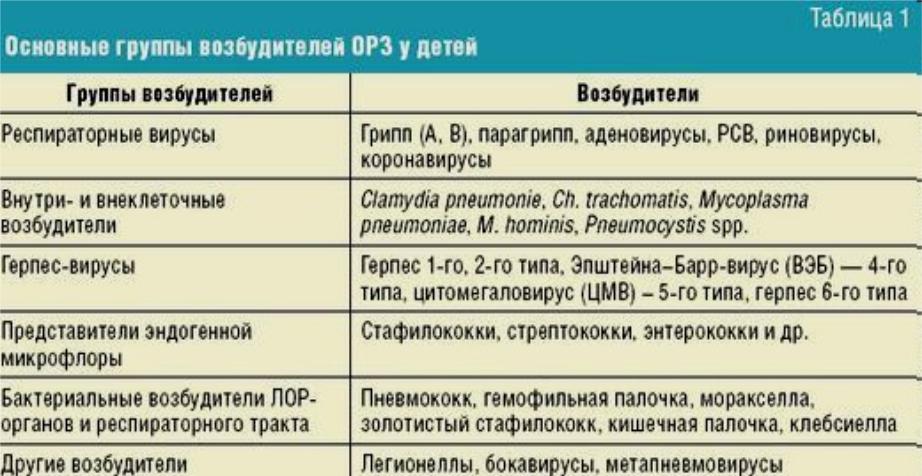 Сдвиг микробиоты в сторону увеличения патогенных штаммов может происходить при вирусных респираторных инфекциях за счет подавления факторов антибактериальной защиты. В результате вторичные бактериальные инфекции дыхательных путей, спровоцированные вирусной инфекцией, чаще всего вызываются резидентными патогенными бактериями, а не внешней инфекцией [53, 54].
Сдвиг микробиоты в сторону увеличения патогенных штаммов может происходить при вирусных респираторных инфекциях за счет подавления факторов антибактериальной защиты. В результате вторичные бактериальные инфекции дыхательных путей, спровоцированные вирусной инфекцией, чаще всего вызываются резидентными патогенными бактериями, а не внешней инфекцией [53, 54].
На сегодняшний день известно множество факторов, которые способствуют бактериальной колонизации в ходе вирусных инфекций:
Действие большинства из этих факторов зависит не только от природы вирусного патогена, но и от типа колонизирующих бактерий. . Например, известно, что S. aureus может усиливать репродукцию вируса в результате подавления передачи сигнала IFN типа I путем ингибирования димеризации STAT-1 – STAT-2 [68]. При течении RSV-инфекции у детей степень тяжести заболевания можно определить по распространенности S.pneumoniae и H. influenzae в микробиоте до начала вирусного заболевания [69].
Тем не менее, результаты экспериментов на животных и клинических наблюдений показывают, что колонизация дыхательных путей патогенными бактериальными штаммами чаще всего вызывается вирусными инфекциями. Первичное заражение мышей сублетальной дозой бактерий с последующим заражением сублетальной дозой вируса гриппа не приводило к вторичной бактериальной пневмонии, тогда как обратная последовательность инфекций вызывала пневмонию с летальным исходом [70–72].В случае вирусной инфекции бактериальное осложнение чаще всего возникало на 4-й день у животных после вирусной инфекции или на 7-й день у человека после клинического проявления вирусной инфекции [42, 73]. В этом случае, независимо от типа вирусного патогена, ответ IFN типа I играет основную роль, фокусируя действие системы врожденного иммунитета на борьбу с вирусной инфекцией, но в то же время снижая активность факторов антибактериальной защиты, таких как как фагоцитоз или продукция антибактериальных пептидов.
Роль IFN-ответа в патогенезе вторичных бактериальных инфекций
Несмотря на различия в структурной и генетической организации вирусов разных семейств, они имеют общее свойство — все они являются внутриклеточными патогенами, вызывающими IFN-ответ типа I. Система врожденного иммунитета распознает вирусную инфекцию с помощью Toll-подобных рецепторов, расположенных на клеточной мембране, или цитоплазматических рецепторов распознавания образов RIG-1 и MDA5 (PRR).Эти рецепторы обнаруживают компоненты патогенов, такие как двухцепочечная РНК (дцРНК) или липосахариды (ЛПС), которые нетипичны для нормальных клеток, но присутствуют в очаге инфекции. Распознавание вирусной инфекции приводит к индукции цитокинового ответа, в первую очередь IFN I, II и III типов. Система врожденного противовирусного иммунитета подробно описана в обзорах [74, 75]. Защитные эффекты IFN обусловлены их способностью индуцировать синтез противовирусных белков в инфицированных и окружающих клетках, а также регулированием активации и миграции клеток врожденного иммунитета, которые определяют развитие специфических B- и T- клеточный иммунный ответ [76–78].
Система врожденного иммунитета распознает вирусную инфекцию с помощью Toll-подобных рецепторов, расположенных на клеточной мембране, или цитоплазматических рецепторов распознавания образов RIG-1 и MDA5 (PRR).Эти рецепторы обнаруживают компоненты патогенов, такие как двухцепочечная РНК (дцРНК) или липосахариды (ЛПС), которые нетипичны для нормальных клеток, но присутствуют в очаге инфекции. Распознавание вирусной инфекции приводит к индукции цитокинового ответа, в первую очередь IFN I, II и III типов. Система врожденного противовирусного иммунитета подробно описана в обзорах [74, 75]. Защитные эффекты IFN обусловлены их способностью индуцировать синтез противовирусных белков в инфицированных и окружающих клетках, а также регулированием активации и миграции клеток врожденного иммунитета, которые определяют развитие специфических B- и T- клеточный иммунный ответ [76–78].
С другой стороны, большая часть недавних экспериментальных данных показывает, что влияние IFN-ответа на течение ОРВИ может быть пагубным. В случае прогрессирующего развития инфекции постоянное и избыточное производство IFN может привести к развитию воспаления из-за гиперпродукции хемокинов, таких как CCL2 и CXCL10, и инфильтрации альвеол провоспалительными моноцитами / макрофагами и плазмацитоидами. дендритные клетки. В этом случае проникновение вирусных и бактериальных лигандов Toll-подобных рецепторов, таких как LPS или dsRNA, в зону воспаления может привести к усиленной продукции провоспалительных цитокинов этими клетками с возможностью развития так называемого цитокинового шторма [79]. .Тогда неконтролируемая продукция провоспалительных цитокинов и чрезмерная инфильтрация тканей легких клетками врожденного иммунитета может стать ведущей причиной повреждения легких [80, 81].
В случае прогрессирующего развития инфекции постоянное и избыточное производство IFN может привести к развитию воспаления из-за гиперпродукции хемокинов, таких как CCL2 и CXCL10, и инфильтрации альвеол провоспалительными моноцитами / макрофагами и плазмацитоидами. дендритные клетки. В этом случае проникновение вирусных и бактериальных лигандов Toll-подобных рецепторов, таких как LPS или dsRNA, в зону воспаления может привести к усиленной продукции провоспалительных цитокинов этими клетками с возможностью развития так называемого цитокинового шторма [79]. .Тогда неконтролируемая продукция провоспалительных цитокинов и чрезмерная инфильтрация тканей легких клетками врожденного иммунитета может стать ведущей причиной повреждения легких [80, 81].
Экспрессия проапоптотического лиганда TRIAL, индуцированная IFN типа I, также приводит к массивному апоптозу эпителиальных клеток, которые вносят вклад в развитие ARDS [82].
Важным фактором риска развития неконтролируемого воспаления является генетическая предрасположенность организма к регуляции ответа IFN. Например, мыши DBA, которые продуцируют высокие уровни IFN типа I в ответ на инфекцию гриппа, демонстрируют высокую смертность при инфицировании дозами, безопасными для мышей C57BL / 6 с умеренным продуцированием INF [83, 84]. Люди с синдромом Дауна имеют повышенную чувствительность к респираторным инфекциям и высокую вероятность серьезных осложнений, связанных с генетически обусловленной гиперпродукцией IFN α / γ в ответ на вирусную инфекцию [85].
Например, мыши DBA, которые продуцируют высокие уровни IFN типа I в ответ на инфекцию гриппа, демонстрируют высокую смертность при инфицировании дозами, безопасными для мышей C57BL / 6 с умеренным продуцированием INF [83, 84]. Люди с синдромом Дауна имеют повышенную чувствительность к респираторным инфекциям и высокую вероятность серьезных осложнений, связанных с генетически обусловленной гиперпродукцией IFN α / γ в ответ на вирусную инфекцию [85].
Помимо стимуляции цитокинового шторма, ИФН I типа могут участвовать в патогенезе вторичной бактериальной инфекции [86, 87].Развитие IFN-ответа в ходе вирусной инфекции приводит к снижению как миграции, так и фагоцитарной функции нейтрофилов и макрофагов за счет проапоптотических механизмов или посредством эпигенетической регуляции их функций [61, 88, 89].
IFN типа I также способны подавлять антибактериальную защиту, подавляя продукцию IL-17 Т-клетками [63, 90]. Отсутствие ответа на ИЛ-17 приводит к снижению продукции антибактериальных пептидов, таких как липокалин 2 и BPIFA1, что, в свою очередь, приводит к увеличению бактериального роста в очаге вирусной инфекции [87].
Тот факт, что генетически модифицированные мыши, дефицитные по рецепторам IFN типа I (IFNAR), были более устойчивы к развитию ARDS, бактериальной пневмонии или сепсиса по сравнению с мышами с нормальной передачей сигналов IFN, доказывает отрицательный эффект сверхэкспрессии IFN [61, 62, 84, 91, 92]. Использование индуктора поли (I: C) IFN до заражения мышей пневмококком привело к 100-кратному увеличению колонизации легких введенными бактериями [64].
Следовательно, развитие тяжелых осложнений после ОРВИ может зависеть не только от вирулентности самого вируса или состава респираторной микробиоты во время вирусной инфекции, но и от способности организма регулировать выраженность реакций врожденного иммунитета, особенно ответа на ИФН.
Роль противовирусной вакцинации и противовирусной терапии в профилактике вторичных бактериальных осложнений
В настоящее время существует множество доказательств того, что противовирусная вакцинация может снизить риск бактериальных осложнений после ОРВИ. Было показано, что иммунизация инактивированной противогриппозной вакциной значительно снижает тяжесть бактериальной суперинфекции у мышей, инфицированных гриппом [93]. В другом исследовании было показано, что иммунизация мышей инактивированной или живой вакциной против гриппа может в равной степени снизить летальность вирусной и последующей бактериальной инфекции, но в то же время она не может ограничить рост S.pyogenes в легких. В этом случае было показано, что вакцинация против гриппа, приводящая к снижению вирусной нагрузки, приводит к снижению провоспалительных цитокинов и индукции IFNγ в легких во время бактериальной суперинфекции [94]. К сожалению, информации о влиянии вакцинации против гриппа на вторичные бактериальные осложнения мало. Это объясняется сложностью подобных исследований, поскольку для этого потребуется параллельная оценка противовирусного и антибактериального иммунитета к большому количеству потенциальных патогенов.Однако в ограниченном исследовании, проведенном в США среди военнослужащих, вакцина против гриппа снизила уровень заболеваемости, вызываемой S.
Было показано, что иммунизация инактивированной противогриппозной вакциной значительно снижает тяжесть бактериальной суперинфекции у мышей, инфицированных гриппом [93]. В другом исследовании было показано, что иммунизация мышей инактивированной или живой вакциной против гриппа может в равной степени снизить летальность вирусной и последующей бактериальной инфекции, но в то же время она не может ограничить рост S.pyogenes в легких. В этом случае было показано, что вакцинация против гриппа, приводящая к снижению вирусной нагрузки, приводит к снижению провоспалительных цитокинов и индукции IFNγ в легких во время бактериальной суперинфекции [94]. К сожалению, информации о влиянии вакцинации против гриппа на вторичные бактериальные осложнения мало. Это объясняется сложностью подобных исследований, поскольку для этого потребуется параллельная оценка противовирусного и антибактериального иммунитета к большому количеству потенциальных патогенов.Однако в ограниченном исследовании, проведенном в США среди военнослужащих, вакцина против гриппа снизила уровень заболеваемости, вызываемой S. pyogenes [95]. Аналогичным образом вакцинация детей живой вакциной, адаптированной к холоду, показала снижение заболеваемости средним отитом [96].
pyogenes [95]. Аналогичным образом вакцинация детей живой вакциной, адаптированной к холоду, показала снижение заболеваемости средним отитом [96].
Таким образом, вакцинация против респираторных вирусов может помочь предотвратить вторичные бактериальные осложнения из-за различных механизмов неспецифической защиты путем модуляции врожденного иммунитета.Разумно предположить, что снижение репродукции вируса из-за эффективной вакцинации может привести к снижению противовирусного ответа IFN и, как следствие, к ограничению негативного действия IFN на эффекторы антибактериальной защиты. Кроме того, снижение концентрации вируса может помочь сохранить респираторный эпителий и уменьшить адгезию бактериальных клеток [56].
Действие противовирусных препаратов, таких как ингибиторы NA, на предотвращение вторичных бактериальных инфекций также может быть связано со снижением ответа IFN из-за ингибирования репликации вируса.Исследования на животных моделях показали, что ингибиторы NA могут снижать восприимчивость животных, инфицированных гриппом, к вторичной бактериальной пневмонии [97]. Клинические испытания у взрослых и детей показали, что прием ингибиторов НА (занамивир и осельтамивир) приводит к снижению частоты бронхита и, как следствие, к меньшему количеству назначений антибиотиков [98-101].
Клинические испытания у взрослых и детей показали, что прием ингибиторов НА (занамивир и осельтамивир) приводит к снижению частоты бронхита и, как следствие, к меньшему количеству назначений антибиотиков [98-101].
Открытие антибиотиков и разработка противогриппозных и бактериальных вакцин значительно снизили шансы повторения катастрофических пандемий, таких как испанский грипп 1918 года [102].Однако грипп и другие респираторные вирусы остаются одной из основных причин бактериальных осложнений и ВП. С другой стороны, растущая устойчивость бактериальных патогенов к современным антибиотикам из-за их широкого использования становится все более тревожной.
К сожалению, в настоящее время практически отсутствуют вакцины или противовирусные препараты для профилактики и лечения респираторных вирусов, за исключением гриппа. Несмотря на прогресс, достигнутый в разработке пневмококковых и других антибактериальных вакцин, а также обширные усилия по разработке вакцин против респираторных вирусов, маловероятно, что в обозримом будущем появится эффективная комплексная система вакцинации против распространенных вирусных и бактериальных респираторных патогенов. Создание специфических противовирусных препаратов против различных групп респираторных вирусов, эффективных на поздней стадии инфекции, имеет низкую вероятность успеха. Следовательно, существует острая необходимость в разработке патогенетических препаратов, снижающих реакции врожденного иммунитета, ослабляющие факторы антибактериальной защиты при вирусной инфекции. Одним из возможных подходов может быть поиск лекарств, предотвращающих чрезмерную продукцию IFN на пике вирусной инфекции.Подавление избыточной передачи сигналов IFN может стать важным терапевтическим подходом к предотвращению как эффектов цитокинового шторма, так и развития вторичных бактериальных осложнений в областях, прилегающих к дыхательным путям [79, 82, 103-105].
Создание специфических противовирусных препаратов против различных групп респираторных вирусов, эффективных на поздней стадии инфекции, имеет низкую вероятность успеха. Следовательно, существует острая необходимость в разработке патогенетических препаратов, снижающих реакции врожденного иммунитета, ослабляющие факторы антибактериальной защиты при вирусной инфекции. Одним из возможных подходов может быть поиск лекарств, предотвращающих чрезмерную продукцию IFN на пике вирусной инфекции.Подавление избыточной передачи сигналов IFN может стать важным терапевтическим подходом к предотвращению как эффектов цитокинового шторма, так и развития вторичных бактериальных осложнений в областях, прилегающих к дыхательным путям [79, 82, 103-105].
Эта работа была поддержана грантом RSF-FWF № 18-45-05002 (VLP-подход к борьбе с бактериальными инфекциями после гриппа).
Автор не преследует коммерческих или финансовых интересов.
Егоров А. Проблема бактериальных осложнений после респираторных вирусных инфекций. МИР Ж, 2018; 5 (1), 12-21, DOI: 10.18527 / 2500-2236-2018-5-1-12-21.
МИР Ж, 2018; 5 (1), 12-21, DOI: 10.18527 / 2500-2236-2018-5-1-12-21.
© Егоров, 2018. Это статья в открытом доступе, распространяемая в соответствии с условиями Международной общественной лицензии Creative Commons AttributionNonCommercial-ShareAlike 4.0 (CC-BY-NC-SA), которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии, что материал не используется в коммерческих целях при условии ссылки на автора и источник.
1. Инициатива «Битва с респираторными вирусами» (BRaVe).Всемирная организация здоровья. Доступно: http://www.who.int/influenza/patient_care/clinical/brave/en/#; http://www.who.int/mediacentre/factsheets/fs211/en/
2. Kilbourne ED. Пандемии гриппа ХХ века. Emerg Infect Dis 2006; 12 (1), 9-14. DOI: 10.3201 / eid1201.051254.
3. Cheng VC, To KK, Tse H, Hung IF, Yuen KY. Через два года после пандемии гриппа A / 2009 / h2N1: что мы узнали? Clin Microbiol Rev 2012; 25 (2), 223-63. DOI: 10.1128 / CMR.05012-11.
DOI: 10.1128 / CMR.05012-11.
4. Оксфорд Дж. С., Сефтон А., Джексон Р., Иннес В., Дэниэлс Р. С., Джонсон Н. П.. Первая мировая война, возможно, привела к появлению «испанского» гриппа. Lancet Infect Dis 2002; 2 (2), 111-4. PubMed PMID: 112.
5. Брем В.В., Боллинг Г.Е., Каспер Э.Дж. Пандемия гриппа и вторичная пневмония в Кэмп-Фремонт, Калифорния. J Am Med Assoc, 1918; 71, 2138-44. DOI: 10.1001 / jama.1918.26020520007010b.
6. Таубенбергер Дж. К., Балтимор Д., Доэрти П. К., Маркель Х., Моренс Д. М., Вебстер Р. Г. и др.Реконструкция вируса гриппа 1918 года: неожиданные награды из прошлого. MBio 2012; 3 (5). DOI: 10.1128 / mBio.00201-12.
7. Моррис Д.Е., Клири Д.В., Кларк СК. Вторичные бактериальные инфекции, связанные с пандемиями гриппа. Front Microbiol 2017; 8, 1041. DOI: 10.3389 / fmicb.2017.01041.
8. Morens DM, Taubenberger JK, Fauci AS. Преобладающая роль бактериальной пневмонии как причины смерти при пандемическом гриппе: последствия для готовности к пандемическому гриппу. J Infect Dis 2008; 198 (7), 962-70. DOI: 10,1086 / 591708.
J Infect Dis 2008; 198 (7), 962-70. DOI: 10,1086 / 591708.
9. Чиен Ю.В., Клугман К.П., Моренс Д.М. Бактериальные патогены и смерть во время пандемии гриппа 1918 г. N Engl J Med 2009; 361 (26), 2582-3. DOI: 10.1056 / NEJMc06.
10. Brundage JF, Shanks GD. Смертность от бактериальной пневмонии во время пандемии гриппа 1918-19 гг. Emerg Infect Dis 2008; 14 (8), 1193-9. DOI: 10.3201 / eid1408.071313.
11. Вин М.К., Чен М.И., Баркхэм Т., Лин Ц., Тан А., Лин Р. и др.Бремя заболевания гриппом среди взрослых по подтипам после начальной эпидемии пандемии h2N1 в Сингапуре. Другие вирусы гриппа Respir 2011; 5 (6), е563-7. DOI: 10.1111 / j.1750-2659.2011.00282.x.
12. Поттер CW. История гриппа. J Appl Microbiol 2001; 91 (4), 572-9. PubMed PMID: 11576290.
13. Вибоуд К., Симонсен Л., Фуэнтес Р., Флорес Дж., Миллер М.А., Човелл Г. Глобальное влияние пандемии гриппа 1957–1959 гг. На смертность. J Infect Dis 2016; 213 (5), 738-45.DOI: 10.1093 / infdis / jiv534.
14. Eickhoff TC, Sherman IL, Serfling RE. Наблюдения за повышенной смертностью, связанной с эпидемическим гриппом. JAMA 1961; 176, 776-82. PubMed PMID: 13726091.
15. Хиллеман MR. Реалии и загадки вирусного гриппа человека: патогенез, эпидемиология и борьба. Вакцина 2002; 20 (25-26), 3068-87. PubMed PMID: 12163258.
16. Херс Дж. Ф., Мазурел Н., Малдер Дж. Бактериология и гистопатология дыхательных путей и легких при фатальном азиатском гриппе.Lancet 1958; 2 (7057), 1141-3. PubMed PMID: 13612141.
17. Гилл Дж. Р., Шенг З. М., Эли С.Ф., Гвине Д.Г., Бисли М.Б., Су Дж. И др. Легочные патологические находки фатальных вирусных инфекций пандемического гриппа A / h2N1 2009 г. Arch Pathol Lab Med 2010; 134 (2), 235-43. DOI: 10.1043 / 1543-2165-134.2.235.
18. Петерсдорф Р.Г., Фуско Дж. Дж., Хартер Д.Х., Олбринк В.С. Легочные инфекции, осложняющие азиатский грипп. AMA Arch Intern Med 1959; 103 (2), 262-72. PubMed PMID: 13616762.
19.Робертсон Л. , Кейли Дж. П., Мур Дж. Важность Staphylococcus aureus при пневмонии во время эпидемии гриппа 1957 г. A. Lancet 1958; 2 (7040), 233-6. PubMed PMID: 13564806.
, Кейли Дж. П., Мур Дж. Важность Staphylococcus aureus при пневмонии во время эпидемии гриппа 1957 г. A. Lancet 1958; 2 (7040), 233-6. PubMed PMID: 13564806.
20. Михаэлис М., Доерр Х.В., Цинатл Дж. Младший. Новый вирус гриппа А свиного происхождения у людей: еще одна пандемия, стучащаяся в дверь. Med Microbiol Immunol 2009; 198 (3), 175-83. DOI: 10.1007 / s00430-009-0118-5.
21. Климов А., Симонсен Л., Фукуда К., Кокс Н. Эпиднадзор и влияние гриппа в США.Vaccine 1999; 17 Дополнение 1, S42-6. PubMed PMID: 10471179.
22. Тиллетт Х.Э., Смит Дж. В., Гуч CD. Повышенная смертность от гриппа в Англии и Уэльсе: возраст на момент смерти и подтвержденная причина. Int J Epidemiol 1983; 12 (3), 344-52. PubMed PMID: 6629624.
23. Линдсей М.И., мл., Херрманн Е.К., мл., Морроу Г.В., мл., Браун А.Л., мл. Гонконгский грипп: клинические, микробиологические и патологические особенности в 127 случаях. JAMA 1970; 214 (10), 1825-32. PubMed PMID: 5537337.
24.Ван Т. Т., Палезе П. Раскрытие тайны вируса свиного гриппа. Cell 2009; 137 (6), 983-5. DOI: 10.1016 / j.cell.2009.05.032.
Т., Палезе П. Раскрытие тайны вируса свиного гриппа. Cell 2009; 137 (6), 983-5. DOI: 10.1016 / j.cell.2009.05.032.
25. Chertow DS, Memoli MJ. Бактериальная коинфекция при гриппе: общий обзор. JAMA 2013; 309 (3), 275-82. DOI: 10.1001 / jama.2012.194139.
26. Ли Э. Х., Ву С., Ли ЕС, Стаут А., Хэнсон Х., Кук Х. А. и др. Смертельные случаи, связанные с вирусом гриппа A 2009 h2N1 в Нью-Йорке. Clin Infect Dis 2010; 50 (11), 1498-504.DOI: 10,1086 / 652446.
27. Лукас С. Прогностические клинико-патологические особенности, полученные на основе систематического вскрытия трупов пациентов, умерших от инфекции гриппа A / h2N1 в пандемии 2009-10 в Великобритании. Оценка медицинских технологий 2010; 14 (55), 83-114. DOI: 10.3310 / hta14550-02.
28. Паласиос Г., Хорниг М., Цистерна Д., Савджи Н., Буссетти А.В., Капур В. и др. Коинфекция Streptococcus pneumoniae коррелирует с тяжестью пандемического гриппа h2N1. PLoS One 2009; 4 (12), е8540.DOI: 10.1371 / journal.pone. 0008540.
0008540.
29. Рэндольф А.Г., Вон Ф., Салливан Р., Рубинсон Л., Томпсон Б.Т., Юн Г. и др. Дети в критическом состоянии во время пандемии гриппа 2009-2010 гг. В США. Педиатрия 2011; 128 (6), е1450-8. DOI: 10.1542 / peds.2011-0774.
30. Живич А. Борьба с бактериальной устойчивостью: подходы, проблемы и возможности в поиске новых антибиотиков. Часть 1. Антибиотики, применяемые в клинической практике: механизмы действия и развитие резистентности бактерий.МИР Ж 2017; 4 (1), 31-51. DOI: 10.18527 / 2500-2236-2017-4-1-31-51.
31. Хасволд Дж., Сджодинг М., Поль К., Кук С., Хизи Р.С. Роль метапневмовируса человека у взрослого пациента в критическом состоянии. J Crit Care 2016; 31 (1), 233-7. DOI: 10.1016 / j.jcrc.2015.09.035.
32. Квон Ю.С., Пак С.Х., Ким М.А., Ким Х.Дж., Пак Дж.С., Ли М.И. и др. Риск смерти, связанный с респираторно-синцитиальным вирусом и инфекцией гриппа у взрослых. BMC Infect Dis 2017; 17 (1), 785. DOI: 10.1186 / s12879-017-2897-4.
33. Prasso JE, Deng JC. Поствирусные осложнения: бактериальная пневмония. Clin Chest Med 2017; 38 (1), 127-38. DOI: 10.1016 / j.ccm.2016.11.006.
Prasso JE, Deng JC. Поствирусные осложнения: бактериальная пневмония. Clin Chest Med 2017; 38 (1), 127-38. DOI: 10.1016 / j.ccm.2016.11.006.
34. Метерский М.Л., Мастертон Р.Г., Лоде Х., Файл TM, мл., Бабинчак Т. Эпидемиология, микробиология и рекомендации по лечению бактериальной пневмонии, осложняющей грипп. Int J Infect Dis 2012; 16 (5), е321-31. DOI: 10.1016 / j.ijid.2012.01.003.
35. Mulcahy ME, McLoughlin RM. Золотистый стафилококк и вирус гриппа А: партнеры в коинфекции.MBio 2016; 7 (6). DOI: 10.1128 / mBio.02068-16.
36. Сафеян Ф., Нахаи М.Р., Сейфи С.Дж., Кафил Х.С., Садеги Дж. Количественное определение Staphylococcus aureus, Streptococcus pneumoniae и Haemophilus influenzae у пациентов с новым вирусом гриппа A (h2N1) / 2009 и гриппом A / 2010. GMS Hyg Infect Control 2015; 10, Doc06. DOI: 10.3205 / dgkh000249.
37. Дженнингс Л.С., Андерсон Т.П., Бейнон К.А., Чуа А., Лейнг Р.Т., Верно А.М. и др. Заболеваемость и характеристики вирусной внебольничной пневмонии у взрослых. Thorax 2008; 63 (1), 42-8. DOI: 10.1136 / thx.2006.075077.
Thorax 2008; 63 (1), 42-8. DOI: 10.1136 / thx.2006.075077.
38. Лидерот К., Ахл М., Озенци В. Вторичные бактериальные инфекции у пациентов с сезонным гриппом A и пандемией h2N1. Biomed Res Int 2013; 2013, 376219. DOI: 10.1155 / 2013/376219.
39. Чонмайтри Т., Дженнингс К., Головко Г., Ханипов К., Пименова М., Патель Дж. А. и др. Микробиота носоглотки у младенцев и изменения во время вирусной инфекции верхних дыхательных путей и острого среднего отита. PLoS One 2017; 12 (7), e0180630.DOI: 10.1371 / journal.pone.0180630.
40. Якобс Дж. Х., Вибоуд К., Тчетген Е. Т., Шварц Дж., Штайнер С., Симонсен Л. и др. Связь менингококковой инфекции с гриппом в США, 1989-2009 гг. PLoS One 2014; 9 (9), e107486. DOI: 10.1371 / journal.pone.0107486.
41. Брили Дж. К., Чаппелл К. Дж., Гэлбрейт С., Фантино Е., Гайдон Дж., Тозер С. и др. Колонизация носоглотки Streptococcus pneumoniae связана с усилением тяжести респираторно-синцитиальной вирусной инфекции у детей раннего возраста. Респирология 2018; 23 (2), 220-7. DOI: 10.1111 / resp.13179.
Респирология 2018; 23 (2), 220-7. DOI: 10.1111 / resp.13179.
42. Hendaus MA, Jomha FA, Alhammadi AH. Вторичная бактериальная инфекция, вызванная вирусами: краткий обзор. Ther Clin Risk Manag 2015; 11, 1265-71. DOI: 10.2147 / TCRM.S87789.
43. Луи Дж. К., Рой-Берман А., Гуардия-Лабар Л., Бостон Э. Дж., Кианг Д., Падилла Т. и др. Риновирус, связанный с тяжелыми инфекциями нижних дыхательных путей у детей. Pediatr Infect Dis J 2009; 28 (4), 337-9. DOI: 10.1097 / INF.0b013e31818ffc1b.
44. Маллиа П., Футит Дж., Сотеро Р., Джепсон А., Контоли М., Трухильо-Торральбо МБ и др. Риновирусная инфекция вызывает деградацию антимикробных пептидов и вторичную бактериальную инфекцию при хронической обструктивной болезни легких. Am J Respir Crit Care Med 2012; 186 (11), 1117-24. DOI: 10.1164 / rccm.201205-0806OC.
45. Kloepfer KM, Lee WM, Pappas TE, Kang TJ, Vrtis RF, Evans MD, et al. Обнаружение патогенных бактерий при риновирусной инфекции связано с усилением респираторных симптомов и обострениями астмы. J Allergy Clin Immunol 2014; 133 (5), 1301-7, 7 е1-3. DOI: 10.1016 / j.jaci.2014.02.030.
J Allergy Clin Immunol 2014; 133 (5), 1301-7, 7 е1-3. DOI: 10.1016 / j.jaci.2014.02.030.
46. Корппи М., Лейнонен М., Макела PH, Лауниала К. Участие бактерий в вирусной инфекции парагриппа у детей. Scand J Infect Dis 1990; 22 (3), 307-12. PubMed PMID: 2164707.
47. Verkaik NJ, Nguyen DT, de Vogel CP, Moll HA, Verbrugh HA, Jaddoe VW, et al. Воздействие Streptococcus pneumoniae связано с сероконверсией метапневмовируса человека и повышенной восприимчивостью к инфекции HMPV in vitro.Clin Microbiol Infect 2011; 17 (12), 1840-4. DOI: 10.1111 / j.1469-0691.2011.03480.x.
48. Self WH, Williams DJ, Zhu Y, Ampofo K, Pavia AT, Chappell JD, et al. Выявление респираторных вирусов у детей и взрослых: сравнение бессимптомных контролей и пациентов с внебольничной пневмонией. J Infect Dis 2016; 213 (4), 584-91. DOI: 10.1093 / infdis / jiv323.
49. Кацурада Н., Сузуки М., Аошима М., Яэгаши М., Ишифудзи Т., Асо Н. и др. Влияние вирусных инфекций на смертность от пневмонии у взрослых сложное: проспективное многоцентровое обсервационное исследование.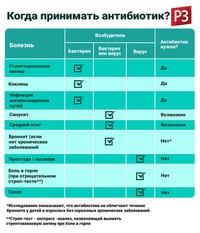 BMC Infect Dis 2017; 17 (1), 755. DOI: 10.1186 / s12879-017-2858-у.
BMC Infect Dis 2017; 17 (1), 755. DOI: 10.1186 / s12879-017-2858-у.
50. Юнг Х.С., Кан Б.Дж., Ра С.В., Со К.В., Джегал Й., Джун Дж. Б. и др. Выявление патогенов, вызывающих бактериальную пневмонию, у пациентов с респираторной вирусной инфекцией. Tuberc Respir Dis (Сеул) 2017; 80 (4), 358-67. DOI: 10.4046 / trd.2017.0044.
51. Хупер Л.В., Литтман Д.Р., Макферсон А.Дж. Взаимодействие между микробиотой и иммунной системой. Наука 2012; 336 (6086), 1268-73. DOI: 10.1126 / наука.1223490.
52. Чарлсон Е.С., Биттингер К., Хаас А.Р., Фицджеральд А.С., Франк И., Ядав А. и др. Топографическая преемственность бактериальных популяций в дыхательных путях здорового человека. Am J Respir Crit Care Med 2011; 184 (8), 957-63. DOI: 10.1164 / rccm.201104-0655OC.
53. Богерт Д., Де Гроот Р., Херманс П. В.. Колонизация Streptococcus pneumoniae: ключ к пневмококковой инфекции. Lancet Infect Dis 2004; 4 (3), 144-54. DOI: 10.1016 / S1473-3099 (04) 00938-7.
54.Bosch AA, Biesbroek G, Trzcinski K, Sanders EA, Bogaert D. Взаимодействие с вирусами и бактериями в верхних дыхательных путях. PLoS Pathog 2013; 9 (1), e1003057. DOI: 10.1371 / journal.ppat.1003057.
Взаимодействие с вирусами и бактериями в верхних дыхательных путях. PLoS Pathog 2013; 9 (1), e1003057. DOI: 10.1371 / journal.ppat.1003057.
55. Ян Х, Стойкерс Л., Фориер К., Сюн Р., Брекманс К., Ван Рит К. и др. Благоприятная роль нейраминидазы в проникновении вируса гриппа через дыхательную слизь. PLoS One 2014; 9 (10), e110026. DOI: 10.1371 / journal.pone.0110026.
56. Avadhanula V, Rodriguez CA, Devincenzo JP, Wang Y, Webby RJ, Ulett GC, et al.Респираторные вирусы усиливают адгезию бактериальных патогенов к респираторному эпителию в зависимости от вида вируса и типа клеток. J Virol 2006; 80 (4), 1629-36. DOI: 10.1128 / JVI.80.4.1629-1636.2006.
57. Ли Н, Рен А., Ван Х, Фан Х, Чжао И, Гао Г.Ф. и др. Вирусная нейраминидаза гриппа вызывает бактериальную коинфекцию через TGF-бета-опосредованную экспрессию рецепторов клетки-хозяина. Proc Natl Acad Sci U S A 2015; 112 (1), 238-43. DOI: 10.1073 / pnas.1414422112.
58.Карсон Дж. Л., Кольер А. М., Ху СС. Приобретенные дефекты ресничек носового эпителия у детей с острыми вирусными инфекциями верхних дыхательных путей. N Engl J Med 1985; 312 (8), 463-8. DOI: 10.1056 / NEJM198502213120802.
N Engl J Med 1985; 312 (8), 463-8. DOI: 10.1056 / NEJM198502213120802.
59. Питтет Л.А., Холл-Стодли Л., Рутковски М.Р., Хармсен АГ. Инфекция вируса гриппа снижает мукоцилиарную скорость в трахее и клиренс Streptococcus pneumoniae. Am J Respir Cell Mol Biol 2010; 42 (4), 450-60. DOI: 10.1165 / rcmb.2007-0417OC.
60. Sun K, Metzger DW.Подавление антибактериальной защиты легких интерфероном-гамма во время выздоровления от инфекции гриппа. Nat Med 2008; 14 (5), 558-64. DOI: 10,1038 / нм1765.
61. Shahangian A, Chow EK, Tian X, Kang JR, Ghaffari A, Liu SY, et al. IFN типа I опосредуют развитие бактериальной пневмонии после гриппа у мышей. J Clin Invest 2009; 119 (7), 1910-20. DOI: 10.1172 / JCI35412.
62. Накамура С., Дэвис К.М., Вайзер Дж. Н.. Синергетическая стимуляция интерферонов типа I во время коинфекции вирусом гриппа способствует колонизации Streptococcus pneumoniae у мышей.J Clin Invest 2011; 121 (9), 3657-65. DOI: 10,1172 / JCI57762.
63. Кудва А., Шеллер Э.В., Робинсон К.М., Кроу С.Р., Чой С.М., Слайт С.Р. и др. Грипп A подавляет Th27-опосредованную защиту хозяина от бактериальной пневмонии у мышей. J Immunol 2011; 186 (3), 1666-74. DOI: 10.4049 / jimmunol.1002194.
Кудва А., Шеллер Э.В., Робинсон К.М., Кроу С.Р., Чой С.М., Слайт С.Р. и др. Грипп A подавляет Th27-опосредованную защиту хозяина от бактериальной пневмонии у мышей. J Immunol 2011; 186 (3), 1666-74. DOI: 10.4049 / jimmunol.1002194.
64. Тиан X, Сюй Ф., Лунг В.Й., Мейерсон С., Гаффари А.А., Ченг Дж. И др. Поли I: C повышает восприимчивость к вторичным легочным инфекциям, вызываемым грамположительными бактериями. PLoS One 2012; 7 (9), e41879.DOI: 10.1371 / journal.pone.0041879.
65. Astry CL, Jakab GJ. Иммунные комплексы, индуцированные вирусом гриппа, подавляют фагоцитоз альвеолярных макрофагов. J Virol 1984; 50 (2), 287-92. PubMed PMID: 6708169.
66. Franke-Ullmann G, Pfortner C, Walter P, Steinmuller C., Lohmann-Matthes ML, Kobzik L, et al. Изменение функции легочных макрофагов инфекцией респираторно-синцитиального вируса in vitro. J Immunol 1995; 154 (1), 268-80. PubMed PMID: 7995946.
67.Jakab GJ. Иммунное нарушение фагоцитоза альвеолярных макрофагов при пневмонии, вызванной вирусом гриппа. Am Rev Respir Dis 1982; 126 (5), 778-82. DOI: 10.1164 / arrd.1982.126.5.778.
Am Rev Respir Dis 1982; 126 (5), 778-82. DOI: 10.1164 / arrd.1982.126.5.778.
68. Warnking K, Klemm C, Loffler B, Niemann S, van Kruchten A, Peters G, et al. Суперинфекция Staphylococcus aureus подавляет индуцированную вирусом гриппа передачу сигналов IFN типа I за счет нарушения димеризации STAT1-STAT2. Cell Microbiol 2015; 17 (3), 303-17. DOI: 10,1111 / cmi.12375.
69.de Steenhuijsen Piters WA, Heinonen S, Hasrat R, Bunsow E, Smith B, Suarez-Arrabal MC и др. Микробиота носоглотки, транскриптом хозяина и тяжесть заболевания у детей с респираторно-синцитиальной вирусной инфекцией. Am J Respir Crit Care Med 2016; 194 (9), 1104-15. DOI: 10.1164 / rccm.201602-0220OC.
70. Jia L, Xie J, Zhao J, Cao D, Liang Y, Hou X и др. Механизмы сопутствующих бактериальных инфекций, связанных с тяжелой смертностью, после инфицирования вирусом гриппа. Front Cell Infect Microbiol 2017; 7, 338.DOI: 10.3389 / fcimb.2017.00338.
71. Джеймисон А.М., Пашман Л., Ю. С., Гамрад П. , Гомер Р. Дж., Деккер Т. и др. Роль защиты тканей при летальной респираторной вирусно-бактериальной коинфекции. Наука 2013; 340 (6137), 1230-4. DOI: 10.1126 / science.1233632.
, Гомер Р. Дж., Деккер Т. и др. Роль защиты тканей при летальной респираторной вирусно-бактериальной коинфекции. Наука 2013; 340 (6137), 1230-4. DOI: 10.1126 / science.1233632.
72. Ли Л.Н., Диас П., Хан Д., Юн С., Ши А., Захаров В. и др. Мышиная модель летального синергизма между вирусом гриппа и Haemophilus influenzae. Am J Pathol 2010; 176 (2), 800-11. DOI: 10.2353 / ajpath.2010.0
.73. McCullers JA. Совместное патогенез вирусов гриппа с бактериями в легких. Nat Rev Microbiol 2014; 12 (4), 252-62. DOI: 10,1038 / nrmicro3231.
74. Трипати С., Гарсиа-Састре А. Противовирусный врожденный иммунитет через призму системной биологии. Virus Res 2016; 218, 10-7. DOI: 10.1016 / j.virusres.2015.11.024.
75. Бреннан К., Боуи АГ. Активация вирусами рецепторов распознавания образов хозяина. Curr Opin Microbiol 2010; 13 (4), 503-7.DOI: 10.1016 / j.mib.2010.05.007.
76. Чен X, Лю С., Горая М.Ю., Мааруф М., Хуанг С., Чен Дж.Л. Иммунный ответ хозяина на инфекцию вирусом гриппа А. Фронт Иммунол 2018; 9, 320. DOI: 10.3389 / fimmu.2018.00320.
Фронт Иммунол 2018; 9, 320. DOI: 10.3389 / fimmu.2018.00320.
77. Шим Дж. М., Ким Дж., Тенсон Т., Мин Дж. Я., Кайнов Д.Е. Инфекция вирусом гриппа, интерфероновый ответ, вирусный контрреагент и апоптоз. Вирусы 2017; 9 (8), 223. DOI: 10.3390 / v23.
78. Андреакос Э., Салагянни М, Галани И.Е., Кольцида О.Интерферон-лямбды: передовые стражи иммунитета и гомеостаза в дыхательных путях. Фронт Иммунол 2017; 8, 1232. DOI: 10.3389 / fimmu.2017.01232.
79. Горицка М., Дюрант Л. Р., Перейра С., Салек-Ардакани С., Опеншоу П. Дж., Йоханссон С. Передача сигналов рецептора альфа / бета интерферона усиливает раннюю продукцию провоспалительных цитокинов в легких во время респираторно-синцитиальной вирусной инфекции. J Virol 2014; 88 (11), 6128-36. DOI: 10.1128 / JVI.00333-14.
80. Доэрти П.С., Тернер С.Дж., Уэбби Р.Г., Томас П.Г.Грипп и вызов иммунологии. Нат Иммунол 2006; 7 (5), 449-55. DOI: 10,1038 / NI1343.
81. Пейрис Дж. С., Ю. В. К., Люнг К. В., Чунг С. Ю., Нг В. Ф., Николлс Дж. М. и др. Повторное возникновение фатального человеческого гриппа A подтипа H5N1. Lancet 2004; 363 (9409), 617-9. DOI: 10.1016 / S0140-6736 (04) 15595-5.
Ю., Нг В. Ф., Николлс Дж. М. и др. Повторное возникновение фатального человеческого гриппа A подтипа H5N1. Lancet 2004; 363 (9409), 617-9. DOI: 10.1016 / S0140-6736 (04) 15595-5.
82. Макрис С., Полсен М., Йоханссон С. Интерфероны типа I как регуляторы воспаления легких. Фронт Иммунол 2017; 8, 259. DOI: 10.3389 / fimmu.2017.00259.
83.Шривастава Б., Блажеевская П., Хессманн М., Брудер Д., Гефферс Р., Мауэль С. и др. Генетический фон хозяина сильно влияет на реакцию на инфекции вируса гриппа А. PLoS One 2009; 4 (3), е4857. DOI: 10.1371 / journal.pone.0004857.
84. Davidson S, Crotta S, McCabe TM, Wack A. Патогенный потенциал интерферона алфавита при острой гриппозной инфекции. Nat Commun 2014; 5, 3864. DOI: 10.1038 / ncomms4864.
85. Броерс С.Дж., Гемке Р.Дж., Вейерман М.Э., ван дер Слуис К.Ф., ван Фурт А.М.Повышенная выработка провоспалительных цитокинов у детей с синдромом Дауна при стимуляции живым вирусом гриппа А. J Clin Immunol 2012; 32 (2), 323-9. DOI: 10.1007 / s10875-011-9625-4.
DOI: 10.1007 / s10875-011-9625-4.
86. Rynda-Apple A, Робинсон KM, Alcorn JF. Грипп и бактериальная суперинфекция: освещение иммунологических механизмов заболевания. Infect Immun 2015; 83 (10), 3764-70. DOI: 10.1128 / IAI.00298-15.
87. Ли Б., Робинсон К.М., МакХью К.Дж., Шеллер Е.В., Мандалапу С., Чен С. и др.Интерферон типа I, индуцированный гриппом, увеличивает восприимчивость к грамотрицательной и грамположительной бактериальной пневмонии у мышей. Am J Physiol Lung Cell Mol Physiol 2015; 309 (2), Л158-67. DOI: 10.1152 / ajplung.00338.2014.
88. Шлихе С., Флинн Е.К., Вилагос Б., Ричсон Ю., Сваминантан С., Босняк Б. и др. Метилтрансфераза Setdb2 опосредует вирус-индуцированную чувствительность к бактериальной суперинфекции. Нат Иммунол 2015; 16 (1), 67-74. DOI: 10.1038 / NI.3046.
89. Кроец Д. Н., Аллен Р. М., Шаллер М. А., Кавалларо К., Ито Т., Кункель С. Л..Эпигенетическая регуляция макрофагов, индуцированная интерфероном I типа, подавляет врожденный и адаптивный иммунитет при острой респираторной вирусной инфекции.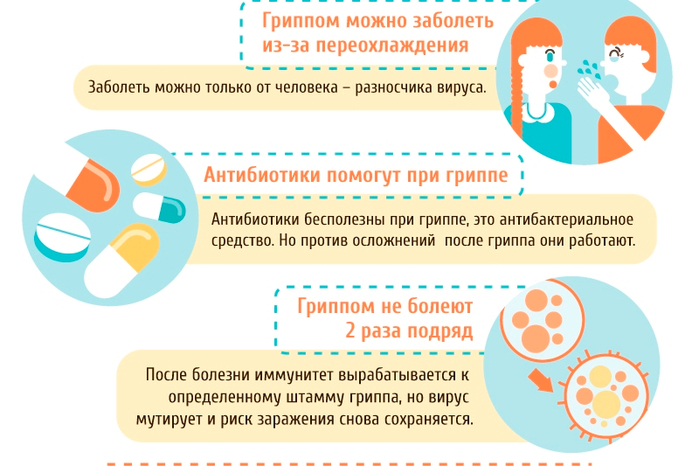 PLoS Pathog 2015; 11 (12), e1005338. DOI: 10.1371 / journal.ppat.1005338.
PLoS Pathog 2015; 11 (12), e1005338. DOI: 10.1371 / journal.ppat.1005338.
90. Цао Дж., Ван Д., Сюй Ф., Гун Й., Ван Х., Сун З. и др. Активация передачи сигналов IL-27 способствует развитию постгриппозной пневмококковой пневмонии. EMBO Mol Med 2014; 6 (1), 120-40. DOI: 10.1002 / emmm.201302890.
91. Ли В., Мольтедо Б., Моран TM. Индукция интерферона типа I во время инфицирования вирусом гриппа увеличивает восприимчивость к вторичной инфекции Streptococcus pneumoniae за счет отрицательной регуляции гаммадельта-Т-клеток.J Virol 2012; 86 (22), 12304-12. DOI: 10.1128 / JVI.01269-12.
92. Dejager L, Vandevyver S, Ballegeer M, Van Wonterghem E, An LL, Riggs J, et al. Фармакологическое подавление передачи сигналов интерферона типа I защищает мышей от летального сепсиса. J Infect Dis 2014; 209 (6), 960-70. DOI: 10.1093 / infdis / jit600.
93. Хубер В. К., Пелтола В., Айверсон А. Р., МакКуллерс Дж. Вклад индуцированного вакциной иммунитета к HA или NA компоненту вирусов гриппа ограничивает вторичные бактериальные осложнения. J Virol 2010; 84 (8), 4105-8. DOI: 10.1128 / JVI.02621-09.
J Virol 2010; 84 (8), 4105-8. DOI: 10.1128 / JVI.02621-09.
94. Chaussee MS, Sandbulte HR, Schuneman MJ, Depaula FP, Addengast LA, Schlenker EH, et al. Инактивированные и живые аттенуированные вакцины против гриппа защищают мышей от гриппа: суперинфекций Streptococcus pyogenes. Вакцина 2011; 29 (21), 3773-81. DOI: 10.1016 / j.vaccine.2011.03.031.
95. Ли С.Е., Эйк А., Блум М.С., Брандейдж Дж.Ф. Иммунизация против гриппа и последующая диагностика стрептококковой болезни группы А среди U.С. Стажеры армии, 2002-2006 гг. Вакцина 2008; 26 (27-28), 3383-6. DOI: 10.1016 / j.vaccine.2008.04.041.
96. Белше РБ, Грубер WC. Профилактика среднего отита у детей с помощью живой аттенуированной вакцины против гриппа, вводимой интраназально. Pediatr Infect Dis J 2000; 19 (5 доп.), С66-71. PubMed PMID: 10821474.
97. McCullers JA. Влияние противовирусного лечения на исход вторичной бактериальной пневмонии после гриппа. J Infect Dis 2004; 190 (3), 519-26. DOI: 10,1086 / 421525.
98. Hayden FG, Osterhaus AD, Treanor JJ, Fleming DM, Aoki FY, Nicholson KG, et al. Эффективность и безопасность занамивира, ингибитора нейраминидазы, при лечении гриппозавирусных инфекций. GG167 Исследовательская группа по гриппу. N Engl J Med 1997; 337 (13), 874-80. DOI: 10.1056 / NEJM199709253371302.
99. Кайзер Л., Кин О.Н., Хаммонд Дж. М., Эллиотт М., Хайден Ф. Г.. Влияние занамивира на использование антибиотиков при респираторных осложнениях после острого гриппа у подростков и взрослых.Arch Intern Med 2000; 160 (21), 3234-40. PubMed PMID: 11088083.
100. Кайзер Л., Уот С., Миллс Т., Махони П., Уорд П., Хайден Ф. Влияние лечения осельтамивиром на связанные с гриппом осложнения со стороны нижних дыхательных путей и госпитализации. Arch Intern Med 2003; 163 (14), 1667-72. DOI: 10.1001 / archinte.163.14.1667.
101. Николсон К.Г., Аоки Ф.Й., Остерхаус А.Д., Троттье С., Каревич О., Мерсье С.Х. и др. Эффективность и безопасность осельтамивира при лечении острого гриппа: рандомизированное контролируемое исследование. Группа исследователей лечения гриппа с ингибиторами нейраминидазы. Lancet 2000; 355 (9218), 1845-50. PubMed PMID: 10866439.
Группа исследователей лечения гриппа с ингибиторами нейраминидазы. Lancet 2000; 355 (9218), 1845-50. PubMed PMID: 10866439.
102. Смит AM, Huber VC. Неожиданное влияние вакцин на вторичные бактериальные инфекции после гриппа. Вирусный Иммунол 2018; 31 (2), 159-73. DOI: 10.1089 / vim.2017.0138.
103. Zang N, Xie X, Deng Y, Wu S, Wang L, Peng C и др. Опосредованное ресвератролом уменьшение гамма-интерферона предотвращает воспаление дыхательных путей и гиперреактивность дыхательных путей у мышей с иммунодефицитом, инфицированных респираторно-синцитиальным вирусом.J Virol 2011; 85 (24), 13061-8. DOI: 10.1128 / JVI.05869-11.
104. Баумгарт Н., Келсо А. Блокада гамма-интерферона in vivo влияет на гуморальный и местный клеточный иммунный ответ в ткани легких, вызванный вирусом гриппа. J Virol 1996; 70 (7), 4411-8. PubMed PMID: 8676464.
105. Вольф С., Джонсон С., Первитасари О., Махалингам С., Трипп Р.А. Нацеленность на провоспалительный фактор CCL2 (MCP-1) с помощью Биндарита для лечения гриппа A (H7N9). Clin Transl Immunology 2017; 6 (3), е135.DOI: 10.1038 / cti.2017.8.
Clin Transl Immunology 2017; 6 (3), е135.DOI: 10.1038 / cti.2017.8.
Оценка эффективности схемы лечения ОРВИ, включая этиотропное (йодид енизама) и симптоматическое лечение —
TY — JOUR
T1 — Оценка эффективности схемы лечения ОРВИ, включая этиотропное (йодид енизама) и симптоматическое лечение
AU — , DA
AU — Карнаухова, EJ
AU — Zubkova, TG
AU — Shakhlanskaya, EV
PY — 2020/1/1
Y1 — 2020/1/1
N2 — © 2020 Consilium Medikum.Все права защищены. Цель. Оценить эффективность использования противовирусного препарата енизамиум йодид в комплексной терапии острых респираторных вирусных инфекций (ОРВИ), вызванных различными возбудителями, в повседневной клинической практике. Материалы и методы. В проспективное рандомизированное исследование вошли 134 пациента, лечившихся в эпидемический сезон гриппа и ОРВИ в 2018-2019 гг. Все пациенты были обследованы на наличие вирусов гриппа A и B, респираторно-синцитиального вируса, метапневмовируса человека, вируса парагриппа, коронавирусов, риновирусов, аденовирусов в мазках из носоглотки методом ПЦР. Пациенты основной группы получали йодид энисамиума на фоне симптоматической терапии, контрольная группа — только симптоматическая терапия. Первичный параметр эффективности терапии оценивался по шкале общей тяжести проявлений ОРВИ (Total Symptom Score — TSS) со 2-го по 4-й день и по второстепенным критериям эффективности: оценка длительности ОРВИ. , степень тяжести лихорадки, доля пациентов с нормальной температурой тела, продолжительность основных клинических симптомов ОРВИ, доля пациентов, у которых отмечены осложнения, требующие применения антибиотиков, динамика интерферонового статуса на 6-е сутки.Для проведения статистического анализа в зависимости от параметра эффективности в качестве ковариат, критерия сравнения количественных показателей в двух независимых группах, использовался метод ANCOVA с фиксированным групповым фактором и начальным баллом по шкале тяжести TSS. Результаты. По результатам анализа первичного показателя эффективности медиана (межквартильный размах) среднего балла по шкале общей тяжести проявлений ОРВИ в основной группе составила 4,33 (3,67-5.
Пациенты основной группы получали йодид энисамиума на фоне симптоматической терапии, контрольная группа — только симптоматическая терапия. Первичный параметр эффективности терапии оценивался по шкале общей тяжести проявлений ОРВИ (Total Symptom Score — TSS) со 2-го по 4-й день и по второстепенным критериям эффективности: оценка длительности ОРВИ. , степень тяжести лихорадки, доля пациентов с нормальной температурой тела, продолжительность основных клинических симптомов ОРВИ, доля пациентов, у которых отмечены осложнения, требующие применения антибиотиков, динамика интерферонового статуса на 6-е сутки.Для проведения статистического анализа в зависимости от параметра эффективности в качестве ковариат, критерия сравнения количественных показателей в двух независимых группах, использовался метод ANCOVA с фиксированным групповым фактором и начальным баллом по шкале тяжести TSS. Результаты. По результатам анализа первичного показателя эффективности медиана (межквартильный размах) среднего балла по шкале общей тяжести проявлений ОРВИ в основной группе составила 4,33 (3,67-5. 83), в группе сравнения — 6,00 (4,67-7,25; p <0,001). Продолжительность системных и местных проявлений ОРВИ была статистически значимо меньше в основной группе (p = 0,002 и p = 0,019 соответственно). Назначение дополнительной терапии потребовалось 2 (2,9%) пациентам основной группы (пациенты, принимавшие йодид енизама) по сравнению с 8 (11,9%) пациентами контрольной группы. Уровни интерферона α и интерферона γ в сыворотке крови в последний день лечения были статистически значимо выше у пациентов основной группы по сравнению с контрольной группой (p <0.001). Лечение (отличное) оценили 42 (62,7%) пациента, тогда как в контрольной группе только 17 (25,8%) пациентов дали аналогичные оценки. И пациенты (p <0,001), и врачи (p <0,002) оценили переносимость терапии лучше в исследуемой группе. Заключение. Результаты подтвердили безопасность и эффективность йодида енизамиума для лечения ОРВИ и гриппа. Противовирусные, интерфероногенные и противовоспалительные свойства препарата участвуют в формировании противовирусного ответа и снижают риск развития осложнений, что позволяет уменьшить количество используемых симптоматических средств.
83), в группе сравнения — 6,00 (4,67-7,25; p <0,001). Продолжительность системных и местных проявлений ОРВИ была статистически значимо меньше в основной группе (p = 0,002 и p = 0,019 соответственно). Назначение дополнительной терапии потребовалось 2 (2,9%) пациентам основной группы (пациенты, принимавшие йодид енизама) по сравнению с 8 (11,9%) пациентами контрольной группы. Уровни интерферона α и интерферона γ в сыворотке крови в последний день лечения были статистически значимо выше у пациентов основной группы по сравнению с контрольной группой (p <0.001). Лечение (отличное) оценили 42 (62,7%) пациента, тогда как в контрольной группе только 17 (25,8%) пациентов дали аналогичные оценки. И пациенты (p <0,001), и врачи (p <0,002) оценили переносимость терапии лучше в исследуемой группе. Заключение. Результаты подтвердили безопасность и эффективность йодида енизамиума для лечения ОРВИ и гриппа. Противовирусные, интерфероногенные и противовоспалительные свойства препарата участвуют в формировании противовирусного ответа и снижают риск развития осложнений, что позволяет уменьшить количество используемых симптоматических средств.
AB — © 2020 Consilium Medikum. Все права защищены. Цель. Оценить эффективность использования противовирусного препарата енизамиум йодид в комплексной терапии острых респираторных вирусных инфекций (ОРВИ), вызванных различными возбудителями, в повседневной клинической практике. Материалы и методы. В проспективное рандомизированное исследование вошли 134 пациента, лечившихся в эпидемический сезон гриппа и ОРВИ в 2018-2019 гг. Все пациенты были обследованы на наличие вирусов гриппа A и B, респираторно-синцитиального вируса, метапневмовируса человека, вируса парагриппа, коронавирусов, риновирусов, аденовирусов в мазках из носоглотки методом ПЦР.Пациенты основной группы получали йодид энисамиума на фоне симптоматической терапии, контрольная группа — только симптоматическая терапия. Первичный параметр эффективности терапии оценивался по шкале общей тяжести проявлений ОРВИ (Total Symptom Score — TSS) со 2-го по 4-й день и по второстепенным критериям эффективности: оценка длительности ОРВИ. , степень тяжести лихорадки, доля пациентов с нормальной температурой тела, продолжительность основных клинических симптомов ОРВИ, доля пациентов, у которых отмечены осложнения, требующие применения антибиотиков, динамика интерферонового статуса на 6-е сутки.Для проведения статистического анализа в зависимости от параметра эффективности в качестве ковариат, критерия сравнения количественных показателей в двух независимых группах, использовался метод ANCOVA с фиксированным групповым фактором и начальным баллом по шкале тяжести TSS. Результаты. По результатам анализа первичного показателя эффективности медиана (межквартильный размах) среднего балла по шкале общей тяжести проявлений ОРВИ в основной группе составила 4,33 (3,67-5.83), в группе сравнения — 6,00 (4,67-7,25; p <0,001). Продолжительность системных и местных проявлений ОРВИ была статистически значимо меньше в основной группе (p = 0,002 и p = 0,019 соответственно). Назначение дополнительной терапии потребовалось 2 (2,9%) пациентам основной группы (пациенты, принимавшие йодид енизама) по сравнению с 8 (11,9%) пациентами контрольной группы.
, степень тяжести лихорадки, доля пациентов с нормальной температурой тела, продолжительность основных клинических симптомов ОРВИ, доля пациентов, у которых отмечены осложнения, требующие применения антибиотиков, динамика интерферонового статуса на 6-е сутки.Для проведения статистического анализа в зависимости от параметра эффективности в качестве ковариат, критерия сравнения количественных показателей в двух независимых группах, использовался метод ANCOVA с фиксированным групповым фактором и начальным баллом по шкале тяжести TSS. Результаты. По результатам анализа первичного показателя эффективности медиана (межквартильный размах) среднего балла по шкале общей тяжести проявлений ОРВИ в основной группе составила 4,33 (3,67-5.83), в группе сравнения — 6,00 (4,67-7,25; p <0,001). Продолжительность системных и местных проявлений ОРВИ была статистически значимо меньше в основной группе (p = 0,002 и p = 0,019 соответственно). Назначение дополнительной терапии потребовалось 2 (2,9%) пациентам основной группы (пациенты, принимавшие йодид енизама) по сравнению с 8 (11,9%) пациентами контрольной группы.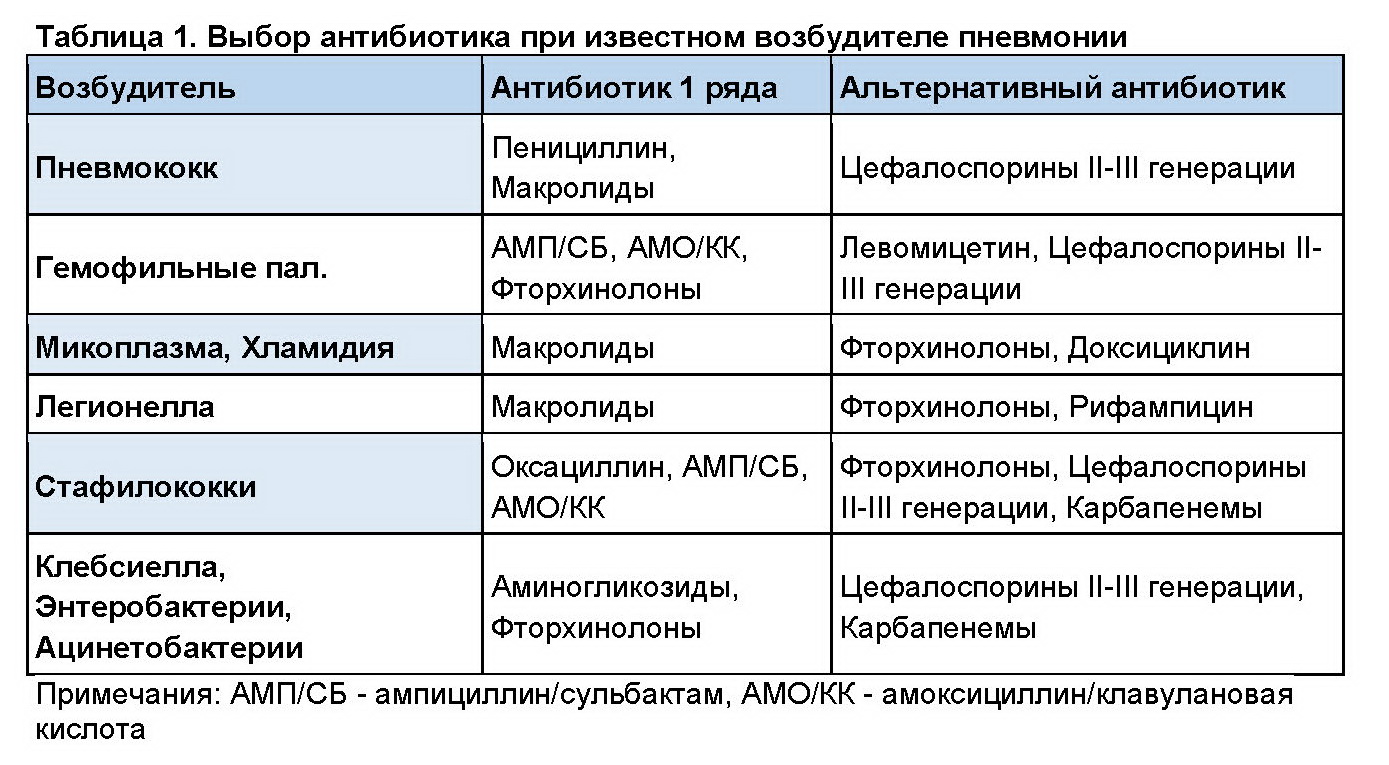 Уровни интерферона α и интерферона γ в сыворотке крови в последний день лечения были статистически значимо выше у пациентов основной группы по сравнению с контрольной группой (p <0.001). Лечение (отличное) оценили 42 (62,7%) пациента, тогда как в контрольной группе только 17 (25,8%) пациентов дали аналогичные оценки. И пациенты (p <0,001), и врачи (p <0,002) оценили переносимость терапии лучше в исследуемой группе. Заключение. Результаты подтвердили безопасность и эффективность йодида енизамиума для лечения ОРВИ и гриппа. Противовирусные, интерфероногенные и противовоспалительные свойства препарата участвуют в формировании противовирусного ответа и снижают риск развития осложнений, что позволяет уменьшить количество используемых симптоматических средств.
Уровни интерферона α и интерферона γ в сыворотке крови в последний день лечения были статистически значимо выше у пациентов основной группы по сравнению с контрольной группой (p <0.001). Лечение (отличное) оценили 42 (62,7%) пациента, тогда как в контрольной группе только 17 (25,8%) пациентов дали аналогичные оценки. И пациенты (p <0,001), и врачи (p <0,002) оценили переносимость терапии лучше в исследуемой группе. Заключение. Результаты подтвердили безопасность и эффективность йодида енизамиума для лечения ОРВИ и гриппа. Противовирусные, интерфероногенные и противовоспалительные свойства препарата участвуют в формировании противовирусного ответа и снижают риск развития осложнений, что позволяет уменьшить количество используемых симптоматических средств.
UR — http://www.scopus.com/inward/record.url?scp=85085131601&partnerID=8YFLogxK
U2 — 10.26442 / 00403660.2020.03.000572
DO — 10.26442 / 004036603.20203000
000 M0002000
000
000 Артикул
000 VL — 92
JO — Терапевтический архив
JF — Терапевтический архив
IS — 3
ER —
Оценка эффективности схемы лечения ОРВИ, включая этиотропное (энизамий йодид
эффективность лечения ОРВИ) и симптоматическое лечение схема лечения, включающая этиотропное (йодид енизама) и симптоматическое лечение | МетаТерапевтический архив
Д А ЛиозновЕ В Шахланская
Реферат
Оценить эффективность применения противовирусного препарата енизамия йодид в комплексном лечении острых респираторных вирусных инфекций (ОРВИ), вызываемых различными возбудителями, в повседневной клинической практике. В проспективное рандомизированное исследование вошли 134 пациента, которые лечились в сезон эпидемии гриппа и ОРВИ в 2018-2019 гг. Все пациенты были обследованы на наличие вирусов гриппа A и B, респираторно-синцитиального вируса, метапневмовируса человека, вируса парагриппа, коронавирусов, риновирусов, аденовирусов. в мазках из носоглотки методом ПЦР. Пациенты основной группы получали йодид энисамиума на фоне симптоматической терапии, контрольная группа — только симптоматическая терапия. Первичный параметр эффективности терапии оценивался по шкале общей тяжести проявлений ОРВИ (Total Symptom Score TSS) со 2-го по 4-й день и по вторичным критериям эффективности: оценка длительности ОРВИ, выраженность лихорадки, доля пациентов с нормальной температурой тела, длительность основных клинических симптомов ОРВИ, доля пациентов, у которых отмечены осложнения, требующие применения антибиотиков, динамика интерферонового статуса…Продолжить чтение
В проспективное рандомизированное исследование вошли 134 пациента, которые лечились в сезон эпидемии гриппа и ОРВИ в 2018-2019 гг. Все пациенты были обследованы на наличие вирусов гриппа A и B, респираторно-синцитиального вируса, метапневмовируса человека, вируса парагриппа, коронавирусов, риновирусов, аденовирусов. в мазках из носоглотки методом ПЦР. Пациенты основной группы получали йодид энисамиума на фоне симптоматической терапии, контрольная группа — только симптоматическая терапия. Первичный параметр эффективности терапии оценивался по шкале общей тяжести проявлений ОРВИ (Total Symptom Score TSS) со 2-го по 4-й день и по вторичным критериям эффективности: оценка длительности ОРВИ, выраженность лихорадки, доля пациентов с нормальной температурой тела, длительность основных клинических симптомов ОРВИ, доля пациентов, у которых отмечены осложнения, требующие применения антибиотиков, динамика интерферонового статуса…Продолжить чтение
Связанные концепции
Амизон
Противовирусные агенты
Homo sapiens
Йодиды
Перспективные исследования
Пиридины
000000000000 Антивирусные препараты 9122000 9122000 9122000 Антивирусные инфекции 9122000 9122000 9122000 9122000 Антивирусные инфекции 9122000 9122000 9122000 9122000 9122000 9122000 9122000 Инфекции КормаАллергия и инфекционные заболевания (ASM)
Аллергия возникает в результате повышенной реактивности иммунной системы на некоторые вещества окружающей среды и может быть опасной для жизни. Инфекционные заболевания вызываются организмами, включая бактерии, вирусы, грибки и паразиты. Они могут передаваться разными путями, например от человека к человеку. Вот последние исследования аллергии и инфекционных заболеваний.
Инфекционные заболевания вызываются организмами, включая бактерии, вирусы, грибки и паразиты. Они могут передаваться разными путями, например от человека к человеку. Вот последние исследования аллергии и инфекционных заболеваний.
Противовирусные препараты
Противовирусные препараты — это лекарства, которые используются специально для лечения вирусных инфекций. Ознакомьтесь с последними исследованиями в области противовирусных препаратов здесь.
Аллергия и инфекционные заболевания
Аллергия возникает в результате гиперреактивности иммунной системы к некоторым веществам окружающей среды и может быть опасной для жизни.Инфекционные заболевания вызываются организмами, включая бактерии, вирусы, грибки и паразиты. Они могут передаваться разными путями, например от человека к человеку.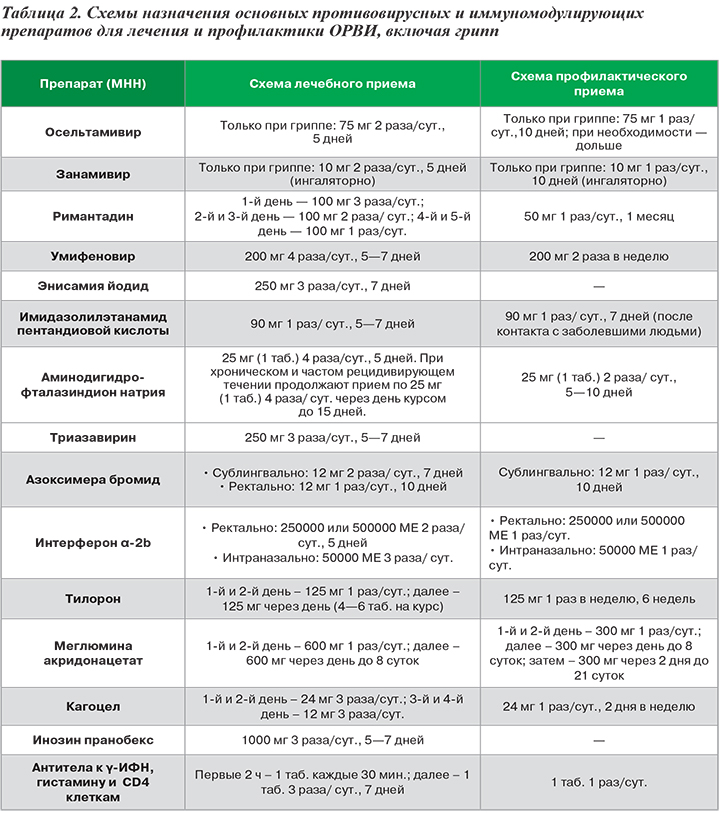 Вот последние исследования аллергии и инфекционных заболеваний.
Вот последние исследования аллергии и инфекционных заболеваний.
Противовирусные препараты (ASM)
Противовирусные препараты — это лекарства, которые используются специально для лечения вирусных инфекций. Ознакомьтесь с последними исследованиями в области противовирусных препаратов здесь.
Связанные материалы
Terapevticheskiĭ АРХИВ
Е.В. SilinaG Еганян
Проблемы туберкулеза и
Н.В. KossiĭZ Р Абрамовой
Terapevticheskiĭ АРХИВ
В.К. FazylovB М Korsantia
Terapevticheskiĭ АРХИВ
А. А. Зайцев
Terapevticheskiĭ АРХИВ
И.Г. СитниковE В Силина
/ статьи / оценка-эффективности-лечения-арви / 32598793
Муропептиды стимулируют возобновление роста Escherichia coli из стационарной фазы
Abstract
Когда питательные вещества заканчиваются, бактерии переходят в состояние покоя. Эта низкая или неопределяемая метаболическая активность помогает бактериям сохранять свои скудные запасы на будущее, но также снижает их способность отслеживать окружающую среду в поисках новых субстратов, способствующих росту. Однако рост соседних микробов является верным индикатором благоприятной окружающей среды и, следовательно, может служить сигналом для выхода из состояния покоя. Здесь мы сообщаем, что для Escherichia coli этот сигнал является основной единицей пептидогликана (т. Е. Муропептидом). Мы показываем, что некоторые формы муропептидов могут стимулировать возобновление роста покоящихся E.coli , но связь сахар-пептид имеет решающее значение для активности. Мы также демонстрируем, что муропептиды из нескольких разных видов могут вызывать возобновление роста E. coli , а также Pseudomonas aeruginosa . Эти результаты вместе с предыдущей идентификацией муропептидов как сигнала прорастания бактериальных спор делают муропептиды довольно универсальным сигналом для роста бактерий.
Эта низкая или неопределяемая метаболическая активность помогает бактериям сохранять свои скудные запасы на будущее, но также снижает их способность отслеживать окружающую среду в поисках новых субстратов, способствующих росту. Однако рост соседних микробов является верным индикатором благоприятной окружающей среды и, следовательно, может служить сигналом для выхода из состояния покоя. Здесь мы сообщаем, что для Escherichia coli этот сигнал является основной единицей пептидогликана (т. Е. Муропептидом). Мы показываем, что некоторые формы муропептидов могут стимулировать возобновление роста покоящихся E.coli , но связь сахар-пептид имеет решающее значение для активности. Мы также демонстрируем, что муропептиды из нескольких разных видов могут вызывать возобновление роста E. coli , а также Pseudomonas aeruginosa . Эти результаты вместе с предыдущей идентификацией муропептидов как сигнала прорастания бактериальных спор делают муропептиды довольно универсальным сигналом для роста бактерий.
Введение
Свободноживущие бактерии могут сталкиваться с большими колебаниями в условиях окружающей среды, например при переходе от изобилия и дефицита питательных веществ, т.е.е. застолье и голодный цикл. Когда ростовые субстраты истощаются, бактерии запускают определенные программы развития, которые подготавливают их к длительному периоду покоя. Многие грамположительные бактерии образуют споры, которые очень устойчивы к неблагоприятным условиям и могут выжить сотни лет 1 . Морфологический переход грамотрицательных клеток, связанный с развитием спящих клеток, в целом менее радикален, но изменения все же происходят.
Грамотрицательные бактерии претерпевают значительные изменения в характере экспрессии генов и метаболизме при переходе в стационарную фазу 2 .Эти изменения в значительной степени регулируются алармоном (p) ppGpp, который изменяет транскрипцию многих генов, снижая экспрессию ориентированного на рост гена и увеличивая экспрессию ориентированного на выживание 3,4,5 . Синтез рибосом снижается, и позже образуются неактивные 100S рибосомные частицы. Репликация ДНК также подавляется. По окончании этих изменений клетки переходят в состояние покоя, готовые выдерживать длительный период без питательных веществ.
Синтез рибосом снижается, и позже образуются неактивные 100S рибосомные частицы. Репликация ДНК также подавляется. По окончании этих изменений клетки переходят в состояние покоя, готовые выдерживать длительный период без питательных веществ.
Гораздо меньше известно о выходе из состояния покоя, когда питательные вещества снова становятся доступными.Теперь ясно, что клетки демонстрируют значительную фенотипическую неоднородность по времени восстановления — в клональной популяции некоторые клетки начинают расти довольно быстро, тогда как другие остаются бездействующими дольше и начинают рост только позже 6,7 . Было предложено, чтобы время возобновления роста зависело от случайного процесса, но в некоторых отчетах также описываются различные состояния покоя (неглубокий и глубокий покой) и предполагается, что возобновление роста из поверхностного покоя происходит быстрее 8,9 . Мы показали, что порядок возобновления роста клеток в некоторых условиях определяется порядком их перехода в стационарную фазу, что указывает на эффект долговременной памяти у E. coli 10 .
coli 10 .
Персистеры представляют собой устойчивые к антибиотикам клетки в обычно чувствительной к антибиотикам бактериальной популяции 11 . В настоящее время наблюдается консенсус, что персистеры в основном являются неделящимися клетками и выживают при антибиотиках из-за их неактивности (Балабан и др., Рукопись представлена в Nature Reviews Microbiology). Они только выходят из состояния покоя и начинают расти после длительной лаг-фазы, и к тому времени антибиотик обычно удаляется. Учитывая, что персистеры ответственны за несколько рецидивирующих инфекций 12,13 , важно понимать механизмы, которые управляют процессом возобновления роста.
На скорость возобновления роста может влиять окружающая среда. E. coli выходит из стационарной фазы быстрее в богатой среде, что приводит к меньшему количеству устойчивых к антибиотикам клеток 6 . Медленное восстановление в присутствии неоптимального источника углерода может быть ускорено небольшим количеством глюкозы, которая, вероятно, действует как сигнал, а не как питательное вещество 10 ..gif) В Micrococcus luteus растущие клетки секретируют белок Rpf, который может индуцировать возобновление роста спящих клеток 14 и спящих клеток Staphylococcus aureus можно реанимировать с помощью надосадочной жидкости израсходованной культуры 15 . Споры Bacillus способны обнаруживать питательные вещества и другие молекулы через специфические рецепторы и инициировать прорастание в ответ 16,17 . Здесь мы описываем сигнал возобновления роста для E. coli , состоящий из муропептидов. Эти молекулы производятся активно растущими клетками, тем самым стимулируя возобновление роста клеток, все еще находящихся в состоянии покоя. Более того, клетки E. coli способны возобновлять рост также в ответ на муропептиды других видов и, таким образом, являются бездействующими клетками Pseudomonas aeruginosa , что указывает на их роль в межвидовой передаче сигналов.Мы описываем структурные требования для активности муропептидов и выделяем мутанты с измененной чувствительностью к муропептидам.
В Micrococcus luteus растущие клетки секретируют белок Rpf, который может индуцировать возобновление роста спящих клеток 14 и спящих клеток Staphylococcus aureus можно реанимировать с помощью надосадочной жидкости израсходованной культуры 15 . Споры Bacillus способны обнаруживать питательные вещества и другие молекулы через специфические рецепторы и инициировать прорастание в ответ 16,17 . Здесь мы описываем сигнал возобновления роста для E. coli , состоящий из муропептидов. Эти молекулы производятся активно растущими клетками, тем самым стимулируя возобновление роста клеток, все еще находящихся в состоянии покоя. Более того, клетки E. coli способны возобновлять рост также в ответ на муропептиды других видов и, таким образом, являются бездействующими клетками Pseudomonas aeruginosa , что указывает на их роль в межвидовой передаче сигналов.Мы описываем структурные требования для активности муропептидов и выделяем мутанты с измененной чувствительностью к муропептидам.
Результаты
Делящиеся клетки секретируют фактор, способствующий возобновлению роста
В ходе наших исследований неоднородности возобновления роста 10 мы предположили, что растущие клетки производят сигнал, который стимулирует возобновление роста еще нерастущих клеток. Чтобы напрямую проверить эту гипотезу, мы подготовили кондиционированную среду и проверили ее влияние на клетки, возобновляющие рост из стационарной фазы.Клетки стационарной фазы промывали и ресуспендировали в свежей среде. Половину культуры немедленно центрифугировали, а супернатант стерилизовали фильтрацией, чтобы использовать в качестве контрольной среды для сравнений. Другая половина выращивалась до средней экспоненциальной фазы и использовалась для приготовления кондиционированной среды. Эта кондиционированная среда все еще содержала достаточно субстратов для поддержки роста, а также содержала факторы, секретируемые растущими клетками. Мы снова взяли клетки из стационарной фазы и сравнили их возобновление роста в свежей, контрольной и кондиционированной среде. Сначала мы использовали наш анализ возобновления роста одной клетки 10 , в котором клетки, несущие две плазмиды, кодирующие флуоресцентные белки GFP и Crimson, растут в стационарной фазе с индуцированной экспрессией Crimson. После этого индуктор Crimson удаляют и добавляют свежий источник углерода вместе с индуктором GFP. Клетки, которые возобновляют рост, что проявляется в активном синтезе белка, сначала становятся GFP-положительными, а затем разжижаются малиновым путем деления клеток (рис. 1а). GFP-положительные клетки явно быстрее накапливаются в кондиционированной среде.Тот же эффект очевиден при сравнении оптической плотности различных культур — лаг-фаза короче в кондиционированной среде (рис. 1b).
Сначала мы использовали наш анализ возобновления роста одной клетки 10 , в котором клетки, несущие две плазмиды, кодирующие флуоресцентные белки GFP и Crimson, растут в стационарной фазе с индуцированной экспрессией Crimson. После этого индуктор Crimson удаляют и добавляют свежий источник углерода вместе с индуктором GFP. Клетки, которые возобновляют рост, что проявляется в активном синтезе белка, сначала становятся GFP-положительными, а затем разжижаются малиновым путем деления клеток (рис. 1а). GFP-положительные клетки явно быстрее накапливаются в кондиционированной среде.Тот же эффект очевиден при сравнении оптической плотности различных культур — лаг-фаза короче в кондиционированной среде (рис. 1b).
а . Клетки стационарной фазы ресуспендировали либо в кондиционированной, либо в контрольной среде, и индуцировали экспрессию GFP. Клетки, возобновляющие рост, являются GFP-положительными, а делящиеся клетки имеют пониженное содержание Кримсона из-за разбавления путем деления клеток. б . Клетки стационарной фазы разбавляли свежей средой, а свежую среду смешивали с кондиционированной средой или контрольной средой. Клетки выращивали в 96-луночном планшете, и OD измеряли каждые 15 минут. Клетки, подвергшиеся воздействию кондиционированной среды, возобновляют рост раньше, чем клетки в свежей среде. с . Количественная оценка результатов на панели b. Δt, рассчитывалась разница во времени (в минутах) достижения OD 0,06 (фактическое значение для 100 мкл культуры) между тестовой средой и свежей средой. Коэффициент разбавления показывает, сколько раз тестируемая среда была разбавлена свежей средой.Показаны средние значения трех независимых экспериментов, полосы ошибок указывают стандартную ошибку среднего.
б . Клетки стационарной фазы разбавляли свежей средой, а свежую среду смешивали с кондиционированной средой или контрольной средой. Клетки выращивали в 96-луночном планшете, и OD измеряли каждые 15 минут. Клетки, подвергшиеся воздействию кондиционированной среды, возобновляют рост раньше, чем клетки в свежей среде. с . Количественная оценка результатов на панели b. Δt, рассчитывалась разница во времени (в минутах) достижения OD 0,06 (фактическое значение для 100 мкл культуры) между тестовой средой и свежей средой. Коэффициент разбавления показывает, сколько раз тестируемая среда была разбавлена свежей средой.Показаны средние значения трех независимых экспериментов, полосы ошибок указывают стандартную ошибку среднего.
По сравнению со свежей средой возобновление роста в контрольной среде немного подавлено. Вероятно, это происходит из-за некоторых ингибирующих соединений, переносимых клетками с неподвижной фазой (см. Выше, как делается контрольная среда). В то же время скорость роста в экспоненциальной фазе была одинаковой для всех культур, что свидетельствует о влиянии только на возобновление роста. Для количественной оценки мы сравнили время, необходимое различным культурам для достижения ОП 0.06 (измеренное значение OD для 100 мкл культуры на 96-луночном планшете, выбранное приблизительно в середине экспоненциальной фазы) и рассчитали разницу между кондиционированной (или контрольной) средой и культурой, выращенной в свежей среде (Δt). Стимулирующий рост эффект кондиционированной среды зависел от концентрации и все еще четко определялся при разбавлении в несколько раз (рис. 1с). Эти результаты демонстрируют, что кондиционированная среда обладает активностью, способствующей возобновлению роста.
В то же время скорость роста в экспоненциальной фазе была одинаковой для всех культур, что свидетельствует о влиянии только на возобновление роста. Для количественной оценки мы сравнили время, необходимое различным культурам для достижения ОП 0.06 (измеренное значение OD для 100 мкл культуры на 96-луночном планшете, выбранное приблизительно в середине экспоненциальной фазы) и рассчитали разницу между кондиционированной (или контрольной) средой и культурой, выращенной в свежей среде (Δt). Стимулирующий рост эффект кондиционированной среды зависел от концентрации и все еще четко определялся при разбавлении в несколько раз (рис. 1с). Эти результаты демонстрируют, что кондиционированная среда обладает активностью, способствующей возобновлению роста.
Муропептиды, полученные из клеточной стенки, вызывают возобновление роста
Мы пытались очистить эту активность от кондиционированного супернатанта, но не смогли получить достаточно чистого материала для идентификации.Однако в ходе этого процесса мы узнали, что молекула, способствующая росту, имеет относительно низкую молекулярную массу и гидрофильна, но не сильно заряжена. Муропептиды (МП), происходящие из клеточной стенки, соответствуют этому описанию и могут индуцировать прорастание спор в Bacillus 17 , поэтому мы проверили, могут ли МП также стимулировать возобновление роста в E. coli . Мы очистили пептидогликан (PG) из растущих клеток E. coli , как описано ранее 17 , и переварили его мутанолизином, чтобы получить отдельные MP, состоящие из дисахарида (N-ацетил-глюкозамин, связанный с N-ацетилмурамовой кислотой) и короткий пептид, связанный с мурамовой кислотой (рис. 2а).При добавлении в свежую среду солюбилизированные MP обладают активностью, способствующей возобновлению роста, тогда как непереваренные PG — нет (рис. 2b).
Муропептиды (МП), происходящие из клеточной стенки, соответствуют этому описанию и могут индуцировать прорастание спор в Bacillus 17 , поэтому мы проверили, могут ли МП также стимулировать возобновление роста в E. coli . Мы очистили пептидогликан (PG) из растущих клеток E. coli , как описано ранее 17 , и переварили его мутанолизином, чтобы получить отдельные MP, состоящие из дисахарида (N-ацетил-глюкозамин, связанный с N-ацетилмурамовой кислотой) и короткий пептид, связанный с мурамовой кислотой (рис. 2а).При добавлении в свежую среду солюбилизированные MP обладают активностью, способствующей возобновлению роста, тогда как непереваренные PG — нет (рис. 2b).
а . Схематическое изображение пептидогликана и муропептида. NAG — N-ацетил-глюкозамин, NAM — N-ацетилмурамовая кислота. б . Муропептиды (MP), но не пептидогликан (PG), могут стимулировать возобновление роста клеток стационарной фазы в свежей среде. К восстанавливающимся клеткам добавляли различные количества MP или PG и рассчитывали Δt.Показаны средняя и стандартная ошибка среднего из четырех независимых экспериментов. с . Различные варианты MP могут быть обнаружены из кондиционированной среды, но не из свежей среды, с помощью масс-спектрометрии. M4N — ангидромуротетрапептид, M3N — ангидромуротрипептид, M5N — ангидромуропентапептид, N.D. — не обнаружено. Показанные значения являются средним значением для двух технических повторений.
К восстанавливающимся клеткам добавляли различные количества MP или PG и рассчитывали Δt.Показаны средняя и стандартная ошибка среднего из четырех независимых экспериментов. с . Различные варианты MP могут быть обнаружены из кондиционированной среды, но не из свежей среды, с помощью масс-спектрометрии. M4N — ангидромуротетрапептид, M3N — ангидромуротрипептид, M5N — ангидромуропентапептид, N.D. — не обнаружено. Показанные значения являются средним значением для двух технических повторений.
Чтобы позволить увеличение клеток, пептидогликангидролазы расщепляют саккулус PG во время роста клеток, генерируя фрагменты PG.Высвободившиеся MP обычно восстанавливаются — как грамположительные, так и грамотрицательные бактерии имеют системы рециркуляции MP, которые транспортируют фрагменты PG обратно в цитоплазму, где их можно повторно использовать 18,19 . Однако некоторые депутаты избегают транспортной системы и попадают в среду роста. Мы проанализировали, есть ли MP в нашей кондиционированной среде. Для этого свежую кондиционированную среду концентрировали и подвергали анализу UPLC-MS и . Мы обнаружили ангидродисахарид с три-, тетра- или пентапептидом в кондиционированной среде, но не в контрольной (свежей) среде (рис. 2с).Это соответствует предыдущим результатам 20 и дополнительно поддерживает нашу гипотезу о том, что MP действуют как сигнал возобновления роста в кондиционированной среде.
Для этого свежую кондиционированную среду концентрировали и подвергали анализу UPLC-MS и . Мы обнаружили ангидродисахарид с три-, тетра- или пентапептидом в кондиционированной среде, но не в контрольной (свежей) среде (рис. 2с).Это соответствует предыдущим результатам 20 и дополнительно поддерживает нашу гипотезу о том, что MP действуют как сигнал возобновления роста в кондиционированной среде.
Следует отметить, что эффект МП проявляется только при достаточно длительной лаг-фазе. Более длительная стационарная фаза, хорошая аэрация во время стационарной фазы и «неоптимальный» источник углерода в среде для возобновления роста — все это продлевает лаг-фазу и демонстрирует эффект MPs. Когда клетки со стационарной фазой ресуспендируют в подходящей среде (LB или MOPS-глюкоза), все клетки быстро возобновляют рост, и эффект MP не обнаруживается на этом фоне.
Бактериальный PG довольно хорошо сохраняется в разных таксонах, и его основная структура одинакова у большинства видов 21 . Таким образом, разумно предположить, что возобновление роста E. coli также может быть стимулировано МП других видов. Одним из заметных отличий между составом PG от грамотрицательных и некоторых грамположительных является аминокислота, присутствующая в третьей позиции пептидной основы: грамотрицательные вещества, включая E. coli , обычно содержат мезо -диаминопимелиновой кислоты ( m ). DAP) в этом положении, тогда как большинство грамположительных содержат L-лизин (Lys) 21 .Мы приготовили МП из грамположительных бактерий Enterococcus faecalis (содержат Lys) и Bacillus subtilis (содержат m DAP), а также из грамотрицательных бактерий Pseudomonas aeruginosa (содержат m DAP). Оказалось, что растворимые МП, но не PG, от всех этих видов могут способствовать возобновлению роста клеток E. coli (рис. 3a). Кроме того, все эти МП также были способны способствовать возобновлению роста P.
Таким образом, разумно предположить, что возобновление роста E. coli также может быть стимулировано МП других видов. Одним из заметных отличий между составом PG от грамотрицательных и некоторых грамположительных является аминокислота, присутствующая в третьей позиции пептидной основы: грамотрицательные вещества, включая E. coli , обычно содержат мезо -диаминопимелиновой кислоты ( m ). DAP) в этом положении, тогда как большинство грамположительных содержат L-лизин (Lys) 21 .Мы приготовили МП из грамположительных бактерий Enterococcus faecalis (содержат Lys) и Bacillus subtilis (содержат m DAP), а также из грамотрицательных бактерий Pseudomonas aeruginosa (содержат m DAP). Оказалось, что растворимые МП, но не PG, от всех этих видов могут способствовать возобновлению роста клеток E. coli (рис. 3a). Кроме того, все эти МП также были способны способствовать возобновлению роста P. aeruginosa (рис. 3b).Это, вместе с тем фактом, что кондиционированная среда из E. coli может индуцировать прорастание спор B. subtilis 17 , указывает на то, что MP являются универсальными индукторами возобновления роста для многих видов бактерий.
aeruginosa (рис. 3b).Это, вместе с тем фактом, что кондиционированная среда из E. coli может индуцировать прорастание спор B. subtilis 17 , указывает на то, что MP являются универсальными индукторами возобновления роста для многих видов бактерий.
а . Муропептиды разных видов стимулируют возобновление роста клеток E. coli . б . Муропептиды разных видов стимулируют возобновление роста P.aeruginosa клеток. Показаны репрезентативные результаты по крайней мере трех независимых экспериментов.
Сахар-пептидная связь муропептидов имеет решающее значение для индукции возобновления роста
Переваривание PG мутанолизином приводит к смеси несшитых (мономеров) и сшитых (например, димеров и тримеров) MP, которые могут различаться по длине пептидного стержня и состав 22 . Кроме того, такой препарат может содержать остатки липидов и белков, связанных с PG.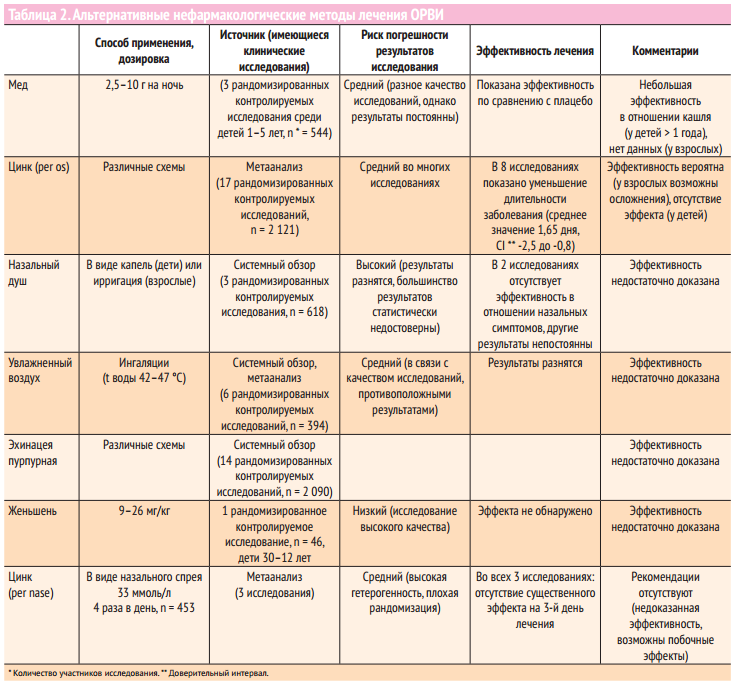 Чтобы лучше понять активность различных вариантов MP, мы очистили четко определенные структуры из смеси MP и протестировали их свойства возобновления роста. Несколько структур активны в анализе возобновления роста (рис. 4). Все дисахариды с пептидами, содержащими 4, 3 или 2 аминокислоты, способны стимулировать возобновление роста, а ангидроформы имеют тенденцию быть более активными, чем их гидрогенизированные аналоги. Даже моносахарид N-ацетилмурамовой кислоты, присоединенный к 4-аминокислотному пептиду (ангидромурамилтетрапептиду), может стимулировать возобновление роста.Напротив, только N-ацетилмурамовая кислота или один трипептид не проявляли активности, способствующей возобновлению роста. Это указывает на то, что связь между сахаром и пептидом имеет решающее значение для активности возобновления роста, и если она присутствует, клетки могут отвечать на несколько вариантов MP.
Чтобы лучше понять активность различных вариантов MP, мы очистили четко определенные структуры из смеси MP и протестировали их свойства возобновления роста. Несколько структур активны в анализе возобновления роста (рис. 4). Все дисахариды с пептидами, содержащими 4, 3 или 2 аминокислоты, способны стимулировать возобновление роста, а ангидроформы имеют тенденцию быть более активными, чем их гидрогенизированные аналоги. Даже моносахарид N-ацетилмурамовой кислоты, присоединенный к 4-аминокислотному пептиду (ангидромурамилтетрапептиду), может стимулировать возобновление роста.Напротив, только N-ацетилмурамовая кислота или один трипептид не проявляли активности, способствующей возобновлению роста. Это указывает на то, что связь между сахаром и пептидом имеет решающее значение для активности возобновления роста, и если она присутствует, клетки могут отвечать на несколько вариантов MP.
Различные варианты MP были очищены и протестированы в анализе возобновления роста. Структуры с интактной связью сахар-пептид могут стимулировать возобновление роста, но только NAM или трипептид не могут.Показано среднее из трех независимых биологических повторов, полосы ошибок указывают стандартную ошибку среднего.
Структуры с интактной связью сахар-пептид могут стимулировать возобновление роста, но только NAM или трипептид не могут.Показано среднее из трех независимых биологических повторов, полосы ошибок указывают стандартную ошибку среднего.
Обнаружение муропептидов клетками
E. coli имеет хорошо описанную систему рециркуляции МП, которая импортирует, разлагает и рециркулирует ангидромуропептиды, высвобождаемые во время роста клеток 18 . Ответственные гены включают ampG (пермеаза), ampD (амидаза), nagZ (N-ацетилглюкозаминидаза), mpaA (γ-D-Glu-DAP амидаза) и nagB (глюкозамин-6-фосфат-6-фосфат. дезаминаза).Мы ожидали, что эта система будет отвечать также за облегчение передачи сигналов MP во время возобновления роста. Однако ни один из штаммов с единичным нокаутом генов, упомянутых выше, не имел какого-либо фенотипа в анализе возобновления роста, и все они отвечали на стимуляцию MP, как wt (данные не показаны). Это предполагает, что первичный сигнальный рецептор MP расположен либо на поверхности клетки, либо в периплазматическом пространстве.
Это предполагает, что первичный сигнальный рецептор MP расположен либо на поверхности клетки, либо в периплазматическом пространстве.
В случае спор Bacillus МП обнаруживаются с помощью эукариотоподобной протеинкиназы PrkC 17 .Однако это семейство генов отсутствует у E. coli . Следовательно, очевидно, что в грамотрицательных клетках должен быть задействован какой-то новый путь обнаружения МП. Чтобы идентифицировать предполагаемый сигнальный путь, мы провели генетический скрининг, чтобы найти мутанты, возобновляющие рост относительно медленно в присутствии MPs, но с нормальной скоростью в отсутствие MPs (подробности см. В материалах и методах). В результате мы идентифицировали клон (BW1.3), реакция которого на МП изменилась (рис. 5а). Клетки BW1.3 более чувствительны к МП при более низких концентрациях и обнаруживают немонотонную концентрационную зависимость.Мы секвенировали геном BW1.3 и идентифицировали 2 мутации, которые приводят к замене аминокислот в двух разных белках. В гене rpoA , который кодирует альфа-субъединицу РНК-полимеразы, аминокислота валин была заменена на аланин в положении 287 (V287A), а в гене yggW , кодирующем предполагаемую оксидоредуктазу, аспартат в положении 108 был заменен на глутамат. (D108E).
В гене rpoA , который кодирует альфа-субъединицу РНК-полимеразы, аминокислота валин была заменена на аланин в положении 287 (V287A), а в гене yggW , кодирующем предполагаемую оксидоредуктазу, аспартат в положении 108 был заменен на глутамат. (D108E).
а . Штамм BW1.3 имеет измененную чувствительность к МП. б . Точечные мутации в генах rpoA и yggW ответственны за изменение чувствительности к МП. Показано среднее значение трех биологических повторов, полосы ошибок указывают стандартную ошибку среднего.
Чтобы подтвердить роль этих мутаций, мы повторно ввели эти изменения в фон дикого типа, используя метод CRMAGE 23 . Мутации вносили как в виде отдельных изменений, так и в комбинации, и полученные штаммы тестировали в анализе возобновления роста.Штамм BW-V287A более чувствителен к более низким концентрациям MP (по сравнению с wt), но эффект MP ослабляется при более высоких концентрациях (рис. 5b). BW-D108E больше похож на wt, а штамм с двойным мутантом сочетает в себе два фенотипа, проявляющих эффект MP с двойными максимумами. Мутации V287A и D108E могут повторять фенотип BW1.3 и, таким образом, являются причиной изменения чувствительности MP.
5b). BW-D108E больше похож на wt, а штамм с двойным мутантом сочетает в себе два фенотипа, проявляющих эффект MP с двойными максимумами. Мутации V287A и D108E могут повторять фенотип BW1.3 и, таким образом, являются причиной изменения чувствительности MP.
Обсуждение
Спящие бактерии должны следить за своей средой, чтобы обнаруживать возможные субстраты для роста.Быть готовым ко всем возможным все время было бы энергетически требовательным и могло бы истощить последние запасы энергии спящих клеток, что приведет к их гибели. Рост других микробов, безусловно, является признаком благоприятной окружающей среды, поэтому обнаружение роста других микробов по некоторому сигналу может заменить отслеживание многих возможных субстратов для роста. Здесь мы идентифицируем происходящие из клеточной стенки MPs как такой сигнал, который может индуцировать возобновление роста спящих клеток. Мы показываем, что помимо их роли в качестве сигнала прорастания спор 17 , MP как грамотрицательных, так и грамположительных бактерий могут вызывать возобновление роста E. coli и P. aeruginosa . Связь сахар-пептид является важным структурным элементом для этой активности, и при обнаружении MPs спящими бактериями не используется известный путь рециклинга MP.
coli и P. aeruginosa . Связь сахар-пептид является важным структурным элементом для этой активности, и при обнаружении MPs спящими бактериями не используется известный путь рециклинга MP.
Пептидогликангидролазная активность и одновременная солюбилизация фрагментов PG происходит во время роста клеток 24 . И грамположительные, и грамотрицательные бактерии имеют системы рециркуляции, которые способны восстанавливать некоторые из высвободившихся фрагментов обратно в цитоплазму и повторно использовать их 18,19 .Однако некоторые из солюбилизированных продуктов попадают во внешнюю среду и, таким образом, становятся сигналом роста и деления клеток. Конкурирующие бактерии также могут уловить этот сигнал, поэтому имеет смысл ограничить распространение MP. Система рециркуляции MP в E. coli способна работать эффективно, так что только 6-8% генерируемых MPs теряются при делении клеток 20 . Учитывая, что PG составляет только 2% клеточной массы, система рециркуляции не дает большого энергетического преимущества, и предполагалось, что она, возможно, имеет другое конкретное преимущество 25,18 . Ограничение распространения депутатов как сигнал к среде, поддерживающей рост, безусловно, может быть одним из них.
Ограничение распространения депутатов как сигнал к среде, поддерживающей рост, безусловно, может быть одним из них.
Теория разведки была предложена как способ для ограниченной популяции клеток выжить в течение длительного периода покоя при постоянном сканировании окружающей среды в поисках благоприятных условий 26 . В спящей популяции некоторые клетки случайным образом выходят из спящего режима и активно сканируют свое окружение. Если рост невозможен, клетка умирает, исчерпав свои запасы энергии. Однако, если среда поддерживает рост, клетка начинает размножаться и может сигнализировать своим братьям и сестрам «проснуться», а также начать рост.MP, безусловно, подходят на роль такого сигнала или подсказки, хотя их производство кажется более неизбежным, а не вызванным конкретными условиями.
MP действуют как сигнал прорастания спор Bacillus 17 . В Bacillus они связываются и активируют серин-треонинкиназу PrkC, подобную эукариотам. Показано, что эта киназа фосфорилирует двухкомпонентную систему WalRK 27 , которая дополнительно контролирует многие гены, связанные с метаболизмом клеточной стенки. Микобактерии имеют несколько гомологов PrkC, из которых PknB необходим для роста 28 и может связывать фрагменты PG 29 .Однако семейство белков PrkC ограничено грамположительными, а E. coli или другие грамотрицательные белки не содержат детектируемого гомолога PrkC. Эффект MP в E. coli также не поддерживается системой рециркуляции MP, поскольку устранение ключевых компонентов этого пути не повлияло на эффект возобновления роста MPs (данные не показаны).
Показано, что эта киназа фосфорилирует двухкомпонентную систему WalRK 27 , которая дополнительно контролирует многие гены, связанные с метаболизмом клеточной стенки. Микобактерии имеют несколько гомологов PrkC, из которых PknB необходим для роста 28 и может связывать фрагменты PG 29 .Однако семейство белков PrkC ограничено грамположительными, а E. coli или другие грамотрицательные белки не содержат детектируемого гомолога PrkC. Эффект MP в E. coli также не поддерживается системой рециркуляции MP, поскольку устранение ключевых компонентов этого пути не повлияло на эффект возобновления роста MPs (данные не показаны).
Несмотря на наши усилия, нам не удалось определить истинный рецептор для MPs у E. coli . Однако мы идентифицировали мутант с измененным поведением в ответ на МП (рис. 5).Штамм, несущий одну аминокислотную замену в гене rpoA (V287A), имеет приглушенный ответ при более высоких концентрациях MP, но повышенную чувствительность при более низких концентрациях. rpoA кодирует альфа-субъединицу РНК-полимеразы, и область вокруг положения 287 участвует в связывании с активаторами транскрипции. Было показано, что мутация валина 287 в аланин изменяет взаимодействие между субъединицей Pol альфа РНК и CRP 30 , увеличивает FNR-зависимую транскрипцию 31 и снижает CI-зависимую лямбда-фага 32 и MelR-зависимую 33 транскрипция.Правильный транскрипционный ответ, по-видимому, необходим для wt-подобного ответа на MPs. Мутация D108E в гене yggW , предполагаемой оксидоредуктазы, имеет гораздо более мягкий эффект на возобновление роста.
rpoA кодирует альфа-субъединицу РНК-полимеразы, и область вокруг положения 287 участвует в связывании с активаторами транскрипции. Было показано, что мутация валина 287 в аланин изменяет взаимодействие между субъединицей Pol альфа РНК и CRP 30 , увеличивает FNR-зависимую транскрипцию 31 и снижает CI-зависимую лямбда-фага 32 и MelR-зависимую 33 транскрипция.Правильный транскрипционный ответ, по-видимому, необходим для wt-подобного ответа на MPs. Мутация D108E в гене yggW , предполагаемой оксидоредуктазы, имеет гораздо более мягкий эффект на возобновление роста.
Тот факт, что как грамотрицательные, так и грамположительные бактерии реанимируются в ответ на фрагменты, полученные из PG, но обнаруживают их через разные рецепторы, является примером конвергентной эволюции. Он подчеркивает важность отслеживания микробной активности в окружающей среде путем мониторинга растворимых MP, поскольку для этой функции независимо развились две разные системы обнаружения. Кроме того, эукариоты имеют несколько рецепторов PG, а у млекопитающих NOD1 и NOD2 используются иммунными клетками для обнаружения присутствия бактерий 34 . Это еще раз подчеркивает важность МП как верного признака активных бактерий, которые различные организмы эволюционировали для обнаружения.
Кроме того, эукариоты имеют несколько рецепторов PG, а у млекопитающих NOD1 и NOD2 используются иммунными клетками для обнаружения присутствия бактерий 34 . Это еще раз подчеркивает важность МП как верного признака активных бактерий, которые различные организмы эволюционировали для обнаружения.
Материалы и методы
Штаммы бактерий и плазмиды
Штамм E. coli BW25113 (F-, Δ (araD-araB) 567, ΔlacZ4787 (:: rrnB-3), λ-, rph-1, Δ ( rhaD-rhaB) 568, hsdR514) и его производные использовались во всех E.coli экспериментов. Плазмиды pET-GFP и pBAD-Crimson 10 использовали для индукции экспрессии GFP и E2-Crimson соответственно. Кроме того, использовали штамм PAO1 P. aeruginosa .
Анализ возобновления роста
В случае клетки E. coli выращивали в среде MOPS с добавлением 0,1% глицерина в течение 4–5 дней в объеме 2 мл в пробирках. Клетки центрифугировали в течение 1 мин при 13 200 rcf, супернатант удаляли и осадок ресуспендировали в равном количестве стерильной деионизированной воды.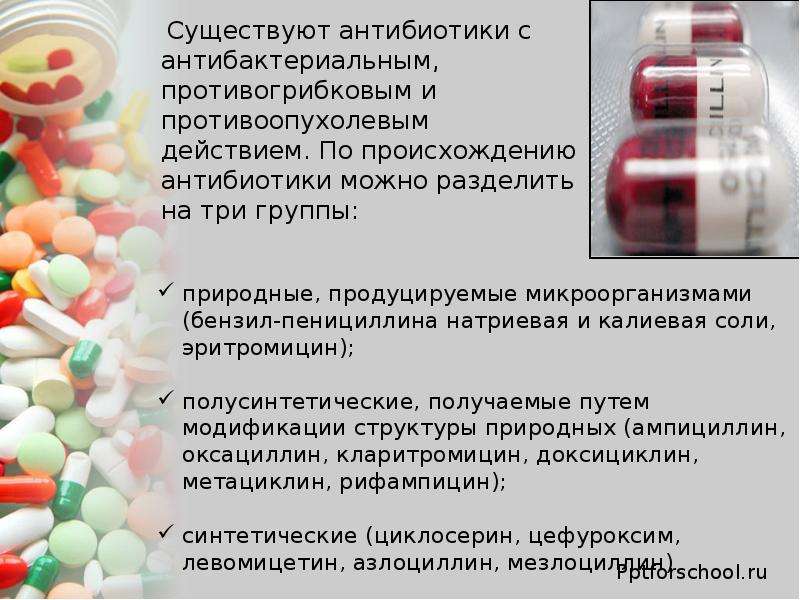 Клетки снова центрифугировали и ресуспендировали в том же количестве деионизированной воды. Суспензию клеток разбавляли 1:20 в свежем 0,1% глюконате MOPS (или 0,1% глицерина, данные не показаны) и переносили в 96-луночный планшет с плоским дном, 100 мкл на лунку. MPs / PG добавляли в первую колонку на планшете и производили серийное разведение в два этапа. В случае кондиционированной среды первая колонка содержала смесь свежей и кондиционированной среды в соотношении 1: 1. Планшет инкубировали в ридере для планшетов Biotek SynergyMx при 37 ° C при постоянном встряхивании.Оптическую плотность при 600 нм измеряли каждые 15 мин. в ходе эксперимента. В случае P. aeruginosa клетки выращивали в 0,1% глюкозе MOPS в течение 5 дней и высевали на 96-луночный планшет в той же среде.
Клетки снова центрифугировали и ресуспендировали в том же количестве деионизированной воды. Суспензию клеток разбавляли 1:20 в свежем 0,1% глюконате MOPS (или 0,1% глицерина, данные не показаны) и переносили в 96-луночный планшет с плоским дном, 100 мкл на лунку. MPs / PG добавляли в первую колонку на планшете и производили серийное разведение в два этапа. В случае кондиционированной среды первая колонка содержала смесь свежей и кондиционированной среды в соотношении 1: 1. Планшет инкубировали в ридере для планшетов Biotek SynergyMx при 37 ° C при постоянном встряхивании.Оптическую плотность при 600 нм измеряли каждые 15 мин. в ходе эксперимента. В случае P. aeruginosa клетки выращивали в 0,1% глюкозе MOPS в течение 5 дней и высевали на 96-луночный планшет в той же среде.
Анализ проточной цитометрии
Клетки E. coli с плазмидами pBAD-Crimson и pET-GFP выращивали в 0,1% глицерине MOPS, содержащем хлорамфеникол (25 мкг / мл), канамицин (25 мкг / мл) и арабинозу (1 мМ). чтобы вызвать E2-Crimson. После 4 дней инкубации в стационарной фазе клетки промывали водой и ресуспендировали либо в свежем MOPS 0.1% глюконата или в кондиционированной среде, содержащей 1 мМ IPTG, для индукции экспрессии GFP. Клетки выращивали при 37 ° C на шейкере, образцы для проточной цитометрии отбирали в указанное время, смешивали с равным количеством 30% глицерина в PBS и хранили при -70 ° C в ожидании анализа.
чтобы вызвать E2-Crimson. После 4 дней инкубации в стационарной фазе клетки промывали водой и ресуспендировали либо в свежем MOPS 0.1% глюконата или в кондиционированной среде, содержащей 1 мМ IPTG, для индукции экспрессии GFP. Клетки выращивали при 37 ° C на шейкере, образцы для проточной цитометрии отбирали в указанное время, смешивали с равным количеством 30% глицерина в PBS и хранили при -70 ° C в ожидании анализа.
Анализ проточной цитометрии выполняли, как описано в 10 , с использованием LSR II (BD Biosciences) с синим (488 нм) и красным (638 нм) лазерами. Окна обнаружения для GFP и E2-Crimson составляли 530 ± 15 нм и 660 ± 10 нм соответственно.Данные проточной цитометрии анализировали с использованием программного пакета FloJo. Для каждой выборки было собрано не менее 20 000 событий.
Выделение пептидогликана
PG очищали, как описано 17 . Вкратце, клетки выращивали в течение ночи в LB ( P. aeruginosa, B. subtilis, E. faecalis ) или 0,2% глицерине MOPS ( E. coli ). 100 мл бактериальной культуры центрифугировали, дважды промывали деионизированной водой (100 мл и 15 мл) и ресуспендировали в 4 мл 4% SDS. Суспензию кипятили 30 мин, инкубировали при комнатной температуре в течение ночи и снова кипятили 10 мин на следующий день.Материал, нерастворимый в SDS, собирали центрифугированием при 13 200 rcf в течение 15 минут при комнатной температуре. Гранулы промывали четыре раза деионизированной водой, один раз в 12,5 мМ Na-фосфатном буфере (pH 5,8) и ресуспендировали в 1 мл того же буфера. Ресуспендированный PG переваривали мутанолизином (Sigma), добавляя 1kU фермента к 0,7 мл суспензии PG и инкубируя смесь при 37 ° C в течение ночи при постоянном встряхивании. На следующий день мутанолизин инактивировали при 80 ° C в течение 20 мин.
coli ). 100 мл бактериальной культуры центрифугировали, дважды промывали деионизированной водой (100 мл и 15 мл) и ресуспендировали в 4 мл 4% SDS. Суспензию кипятили 30 мин, инкубировали при комнатной температуре в течение ночи и снова кипятили 10 мин на следующий день.Материал, нерастворимый в SDS, собирали центрифугированием при 13 200 rcf в течение 15 минут при комнатной температуре. Гранулы промывали четыре раза деионизированной водой, один раз в 12,5 мМ Na-фосфатном буфере (pH 5,8) и ресуспендировали в 1 мл того же буфера. Ресуспендированный PG переваривали мутанолизином (Sigma), добавляя 1kU фермента к 0,7 мл суспензии PG и инкубируя смесь при 37 ° C в течение ночи при постоянном встряхивании. На следующий день мутанолизин инактивировали при 80 ° C в течение 20 мин.
Обнаружение муропептидов в кондиционированной среде с помощью UPLC-MS
Отфильтрованные свежие и кондиционированные среды сушили и ресуспендировали в деионизированной воде (конечные образцы были в 10 раз более концентрированными, чем исходная среда), кипятили в течение 20 минут и центрифугировали при 14000 об / мин в течение 15 мин для осаждения белков и нерастворимого материала перед инъекцией UPLC-MS. Данные МС были получены с использованием режима сбора данных MS и . Эти данные были обработаны, и для поиска МП была использована встроенная библиотека соединений в UNIFI, которая содержит структуру нескольких ангидро и невосстановленных форм m моно- и дисахаридных пептидов DAP-типа. Для построения библиотеки соединений молекулярная структура MP была получена с помощью ChemSketch (www.acdlabs.com). После автоматической идентификации соединения структура согласованных компонентов была проверена путем поиска соответствующих фрагментных ионов и сравнения масс-спектров с данными МС / МС, ранее полученными для стандартных MP.Площадь МС-хроматограммы, полученная для каждого идентифицированного МП, считалась количественной величиной.
Данные МС были получены с использованием режима сбора данных MS и . Эти данные были обработаны, и для поиска МП была использована встроенная библиотека соединений в UNIFI, которая содержит структуру нескольких ангидро и невосстановленных форм m моно- и дисахаридных пептидов DAP-типа. Для построения библиотеки соединений молекулярная структура MP была получена с помощью ChemSketch (www.acdlabs.com). После автоматической идентификации соединения структура согласованных компонентов была проверена путем поиска соответствующих фрагментных ионов и сравнения масс-спектров с данными МС / МС, ранее полученными для стандартных MP.Площадь МС-хроматограммы, полученная для каждого идентифицированного МП, считалась количественной величиной.
UPLC-MS выполняли в системе UPLC, сопряженной с масс-спектрометром Xevo G2 / XS Q-TOF (Waters Corp.). Хроматографическое разделение было достигнуто с использованием колонки ACQUITY UPLC-BEH C18 (Waters Corp. 2,1 мм × 150 мм; размер частиц 1,7 мкм), нагретой до 45 ° C. В качестве подвижных фаз использовали 0,1% муравьиной кислоты в воде Milli-Q (буфер A) и 0,1% муравьиной кислоты в ацетонитриле (буфер B), и градиент буфера B был установлен следующим образом: 0-3 мин 5%, 3-6 мин 5-6.8%, 6-7,5 мин. 6,8-9%, 7,5-9 мин. 9-14%, 9-11 мин. 14-20%, 11-12 мин. Выдержка при 20% с расходом 0,175 мл / мин; 12-12,10 мин 20-90%, 12,1-13,5 мин выдержка 90%, 13,5-13,6 мин 90-2%, 13,6-16 мин выдержка 2% с расходом 0,3 мл / мин; и затем 16-18 мин выдерживают при 2% скорости потока 0,25 мл / мин. Прибор QTOF-MS работал в режиме положительной ионизации с использованием режима сбора данных MS и . Параметры, установленные для ESI, были следующими: капиллярное напряжение 3,0 кВ, температура источника до 120 ° C, температура десольватации до 350 ° C, напряжение на конусе образца до 40 В, поток газа в конусе 100 л / ч и поток газа десольватации 500 л / ч.Масс-спектры были получены для молекул, элюируемых только после 6-й минуты (из-за наличия обильной фоновой молекулы, элюирующей на 5-й минуте как в свежей, так и в активной среде) со скоростью 0,25 с / сканирование, и сканирование находилось в диапазоне 100– 1600 м / з.
В качестве подвижных фаз использовали 0,1% муравьиной кислоты в воде Milli-Q (буфер A) и 0,1% муравьиной кислоты в ацетонитриле (буфер B), и градиент буфера B был установлен следующим образом: 0-3 мин 5%, 3-6 мин 5-6.8%, 6-7,5 мин. 6,8-9%, 7,5-9 мин. 9-14%, 9-11 мин. 14-20%, 11-12 мин. Выдержка при 20% с расходом 0,175 мл / мин; 12-12,10 мин 20-90%, 12,1-13,5 мин выдержка 90%, 13,5-13,6 мин 90-2%, 13,6-16 мин выдержка 2% с расходом 0,3 мл / мин; и затем 16-18 мин выдерживают при 2% скорости потока 0,25 мл / мин. Прибор QTOF-MS работал в режиме положительной ионизации с использованием режима сбора данных MS и . Параметры, установленные для ESI, были следующими: капиллярное напряжение 3,0 кВ, температура источника до 120 ° C, температура десольватации до 350 ° C, напряжение на конусе образца до 40 В, поток газа в конусе 100 л / ч и поток газа десольватации 500 л / ч.Масс-спектры были получены для молекул, элюируемых только после 6-й минуты (из-за наличия обильной фоновой молекулы, элюирующей на 5-й минуте как в свежей, так и в активной среде) со скоростью 0,25 с / сканирование, и сканирование находилось в диапазоне 100– 1600 м / з. Сбор и обработка данных выполнялись с помощью программного пакета UNIFI (Waters Corp.).
Сбор и обработка данных выполнялись с помощью программного пакета UNIFI (Waters Corp.).
Производство и выделение муропептидов
Чистые MP были получены путем сбора пиков MP, разделенных с помощью ВЭЖХ (высокоэффективной жидкостной хроматографии).Дисахарид-тетрапептид (M4) и дисахарид-дипептид (M2) собирали из расщепленных мурамидазой саккулов стационарных культур клеток Vibrio cholerae и Gluconobacter oxydans , выращенных в среде LB и YPM (дрожжевой пептон , ), соответственно, , 35134, среда , соответственно. Ангидродисахарид-тетрапептид (M4N) получали путем переваривания саккулов V.cholerae с неподвижной фазой с помощью литической трансгликозилазы Slt70 35 . Для получения трипептидов M3 и M3N, M4 и M4N переваривали очищенным V.cholerae L, D-карбоксипептидаза LdcV (Hernández et al., в разработке) 36 . Ангидромурамилтетрапептиды (anhNAM-P4) были получены расщеплением M4N очищенным гомологом NagZ V. cholerae (Hernández et al., В разработке) 37,38 . Для сбора MP восстановленные MP фракционировали с помощью обращенно-фазовой ВЭЖХ (Waters Corp.) на колонке с пептидами Aeris (250 × 4,6 мм; размер частиц 3,6 мкм; Phenomenex, США) с использованием 0,1% муравьиной кислоты и 0,1% муравьиной кислоты. в 40% ацетонитрила в качестве органических растворителей за 30 минут пробегает 39,35 .Собранные фракции полностью сушили и растворяли в воде. Идентичность отдельных собранных MP подтверждали анализом LC-MS. Трипептид Ala-γ-D-Glu- m DAP был приобретен у AnaSpec, а N-ацетилмурамовая кислота у Sigma-Aldrich.
cholerae (Hernández et al., В разработке) 37,38 . Для сбора MP восстановленные MP фракционировали с помощью обращенно-фазовой ВЭЖХ (Waters Corp.) на колонке с пептидами Aeris (250 × 4,6 мм; размер частиц 3,6 мкм; Phenomenex, США) с использованием 0,1% муравьиной кислоты и 0,1% муравьиной кислоты. в 40% ацетонитрила в качестве органических растворителей за 30 минут пробегает 39,35 .Собранные фракции полностью сушили и растворяли в воде. Идентичность отдельных собранных MP подтверждали анализом LC-MS. Трипептид Ala-γ-D-Glu- m DAP был приобретен у AnaSpec, а N-ацетилмурамовая кислота у Sigma-Aldrich.
Скрининг мутантов, не отвечающих на MP
. Для идентификации генов, участвующих в обнаружении MP, мы использовали штамм E.coli BW25113, несущий плазмиду pET-GFP. Клетки выращивали в стационарной фазе в присутствии IPTG для индукции экспрессии GFP в MOPS 0.1% глицерин. Через четыре дня клетки промывали деионизированной водой и разбавляли 1:20 свежим 0,1% глюконатом MOPS, содержащим MP. Возобновление роста контролировали методом разбавления GFP, и неделящиеся (с высоким содержанием GFP) клетки сортировали, когда они составляли приблизительно 20% от общей популяции. Отсортированные клетки объединяли и подвергали еще одному циклу возобновления роста, на этот раз без добавления MP и без сортировки. В первом раунде мы отбираем клетки, которые возобновляют рост медленно даже в присутствии MP, во втором мы выбираем клетки, которые возобновляют рост с нормальной скоростью в отсутствие MP.После четырех раундов клетки наносили штрихами на чашку с агаром, и отдельные колонии тестировали в анализе возобновления роста. Чтобы идентифицировать мутации, лежащие в основе фенотипа, мы секвенировали геномы двух клонов с измененной чувствительностью к MP (BW1.2 и BW1.3) и двух клонов с поведением, подобным wt (BW1.4 и BW1.5), вместе со штаммом wt.
Возобновление роста контролировали методом разбавления GFP, и неделящиеся (с высоким содержанием GFP) клетки сортировали, когда они составляли приблизительно 20% от общей популяции. Отсортированные клетки объединяли и подвергали еще одному циклу возобновления роста, на этот раз без добавления MP и без сортировки. В первом раунде мы отбираем клетки, которые возобновляют рост медленно даже в присутствии MP, во втором мы выбираем клетки, которые возобновляют рост с нормальной скоростью в отсутствие MP.После четырех раундов клетки наносили штрихами на чашку с агаром, и отдельные колонии тестировали в анализе возобновления роста. Чтобы идентифицировать мутации, лежащие в основе фенотипа, мы секвенировали геномы двух клонов с измененной чувствительностью к MP (BW1.2 и BW1.3) и двух клонов с поведением, подобным wt (BW1.4 и BW1.5), вместе со штаммом wt.
Секвенирование генома и биоинформатический анализ
Геномы были секвенированы с использованием платформы MiSeq (Illumina). Изолят дикого типа (BW25113) собирали с помощью SPAdes (версия 3. 10.1) 40 и используется в качестве эталонного генома. Считывания секвенирования из изолятов BW1.2, BW1.3, BW1.4 и BW1.5 были сопоставлены с BW25113 с использованием bowtie2 (версия 2.0.0-beta7) 41 . SNP и небольшие индели для каждого изолята были вызваны с помощью Samtools (версия 1.9) 42 . Полученные варианты были дополнительно отфильтрованы, чтобы оставить только те, которые присутствовали в изолятах BW1.2 и BW1.3, но не в изолятах BW1.4 и BW1.5, по сравнению с диким типом. Вариации в областях кодирования белка были проверены с помощью секвенирования по Сэнгеру.Некартированные чтения из каждого изолята BW1.2-BW1.5 были собраны de novo , чтобы гарантировать, что мы не пропустили другие потенциальные связанные с фенотипом последовательности, которые не были представлены в эталонной сборке дикого типа.
10.1) 40 и используется в качестве эталонного генома. Считывания секвенирования из изолятов BW1.2, BW1.3, BW1.4 и BW1.5 были сопоставлены с BW25113 с использованием bowtie2 (версия 2.0.0-beta7) 41 . SNP и небольшие индели для каждого изолята были вызваны с помощью Samtools (версия 1.9) 42 . Полученные варианты были дополнительно отфильтрованы, чтобы оставить только те, которые присутствовали в изолятах BW1.2 и BW1.3, но не в изолятах BW1.4 и BW1.5, по сравнению с диким типом. Вариации в областях кодирования белка были проверены с помощью секвенирования по Сэнгеру.Некартированные чтения из каждого изолята BW1.2-BW1.5 были собраны de novo , чтобы гарантировать, что мы не пропустили другие потенциальные связанные с фенотипом последовательности, которые не были представлены в эталонной сборке дикого типа.
Модификация генома
Две точечные мутации, идентифицированные при селекции, повторно вводили в геном дикого типа с использованием CRMAGE 23 . Этот метод сочетает введение мутации олигонуклеотидом (рекомбинирование) и контрселекцию против wt с использованием CRISPR-Cas9.Наличие мутаций было подтверждено секвенированием по Сэнгеру.
Этот метод сочетает введение мутации олигонуклеотидом (рекомбинирование) и контрселекцию против wt с использованием CRISPR-Cas9.Наличие мутаций было подтверждено секвенированием по Сэнгеру.
Вклад авторов
AJ, FC и TT разработали и разработали исследование. AJ, KV, RM и MP провели микробиологические эксперименты, SBH проанализировали и очистили MP. AB и MR выполнили сборку генома и биоинформатический анализ. Рукопись написали AJ, SBH, FC и TT.
Конкурирующие интересы
Авторы заявляют об отсутствии конкурирующих интересов.
Благодарности
Эта работа была поддержана Эстонским исследовательским советом (грант PRG335) и Европейским фондом регионального развития (через Центр передового опыта в области молекулярной клеточной инженерии).Исследования в лаборатории Cava поддерживаются MIMS, Фондом Кнута и Алисы Валленберг (KAW), Шведским исследовательским советом и Фондом Кемпе. AB и MR финансировались за счет институционального гранта IUT34-11 от Министерства образования и исследований Эстонии и гранта Европейского фонда регионального развития № 2014-2020..gif)
