Гликоли — Википедия
Материал из Википедии — свободной энциклопедии
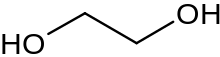
Глико́ли (дио́лы, двухатомные спирты) — класс органических соединений, содержащих в молекуле две гидроксильные группы. Имеют общую формулу CnH2n(OH)2. Простейшим гликолем является этиленгликоль НО−СН2−СН2−ОН.
Названия гликолей образованы от названий соответствующих углеводородов с суффиксами -диол или -гликоль:
- HO−Ch3−Ch3−OH{\displaystyle {\ce {HO-Ch3-Ch3-OH}}} — 1,2-этандиол, этиленгликоль,
- HO−Ch3−Ch3−Ch3−OH{\displaystyle {\ce {HO-Ch3-Ch3-Ch3-OH}}} — 1,3-пропандиол, 1,3-пропиленгликоль.
Низшие гликоли представляют собой бесцветные прозрачные жидкости со сладковатым вкусом. Безводные гликоли гигроскопичны. Из-за наличия двух полярных OH-групп в молекулах гликолей у них высокие вязкость, плотность, температуры плавления и кипения.
Низшие гликоли хорошо растворяются в воде и органических растворителях (спиртах, кетонах, кислотах и аминах). В то же время гликоли сами являются хорошими растворителями для многих веществ, за исключением ароматических и высших предельных углеводородов
Гликоли обладают всеми свойствами спиртов (образуют алкоголяты, простые и сложные эфиры), при этом гидроксильные группы реагируют независимо друг от друга, образовывая смесь продуктов.
С альдегидами и кетонами гликоли образуют 1,3-диоксоланы и 1,3-диоксаны.
Гликоли синтезируют несколькими основными способами:
- гидролиз соответствующих дихлоралканов
- Cl−Ch3−Ch3−Cl→200 ∘C, 10 MPaNa2CO3HO−Ch3−Ch3−OH,{\displaystyle {\ce {Cl-Ch3-Ch3-Cl->[{\ce {Na2CO3}}][200~^{\circ }{\text{C, 10 MPa}}]HO-Ch3-Ch3-OH,}}}
- окисление алкенов перманганатом калия,
- гидратация оксиранов (эпоксидов).
Гликоли служат в качестве растворителей и пластификаторов. Этиленгликоль и пропиленгликоль используются в качестве антифриза и гидравлических жидкостей. Благодаря высокой температуре кипения (например, 285 °C у триэтиленгликоля), гликоли нашли применение в качестве тормозной жидкости. Гликоли применяются для получения различных эфиров, полиуретанов и др.
- Химическая энциклопедия / Редкол.: Кнунянц И. Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1 (Абл — Дар). — 623 с.
Гликоль и область его применения
Промывка- Промывка
- Промывка труб отопления
- Промывка теплоносителей
- Промывка кондиционера
- Промывка вентиляции
- Промывка пластинчатых теплообменников
- Промывка систем холодоснабжения

На рынке есть достаточно много хладо- и теплоносителей. Чтобы подобрать материал для этих задач нужно изучить существующие варианты составов. Сегодня вы узнаете где используется гликоль, и что из себя представляет это вещество.
Характеристика материала
Существует несколько разновидностей раствора на основе гликоли. Они различаются между собой температурой замерзания, которая может составить от -15°C до -65°C. В составе раствора, как правило, используют:
- демирализованную воду;
- разнообразные присадки;
- моноэтиленгликоль или пропиленгликоль.
Чтобы правильно подобрать раствор нужно учитывать множество деталей. Прежде всего свойства применяемого оборудования и климатические условия. Сфера применения растворов ограничена. Например, в пищевой промышленности и косметологии можно использовать только смеси на основе безвредного для здоровья людей пропиленгликоля.
Срок службы антифриза достаточно длительный. Конечно, он зависит от условий эксплуатации. В системах отопления он составляет не менее пяти лет. Все растворы гликоля не содержат элементом, создающих опасные концерогены. Применение растворов вещества в отопительных системах поможет сохранить трубы в идеальном состоянии.
Где приобрести антифриз?
Теперь вы знаете где используется гликоль. Если вам необходим этот материал, нужно обратиться к производителю этих смесей. Только там вы получите действительно квалифицированную помощь. Сотрудники компании-производителя подберут для вас наиболее эффективный вариант гликоля.
Интересные статьи
Этиленгликоль — Википедия
Материал из Википедии — свободной энциклопедии
| Этиленгликоль | |||
|---|---|---|---|
| |||
| Систематическое наименование | этандиол-1,2 | ||
| Традиционные названия | гликоль, этиленгликоль, 1,2-диоксиэтан, 1,2-этандиол | ||
| Хим. формула | C2H6O2 | ||
| Рац. формула | C2H4(OH)2 | ||
| Состояние | бесцветная жидкость | ||
| Молярная масса | 62,068 г/моль | ||
| Плотность | 1,113 г/см³ | ||
| Температура | |||
| • плавления | −12,9 °C | ||
| • кипения | 197,3 °C | ||
| • вспышки | 111 °C | ||
| Пределы взрываемости | 3,2 ± 0,1 об.%[3] | ||
| Энтальпия | |||
| • кипения | 50,5 кДж/моль[1] и 57,4 кДж/моль[2] | ||
| Давление пара | 0,06 ± 0,01 мм рт.ст.[3] | ||
| Константа диссоциации кислоты pKa{\displaystyle pK_{a}} | 15,1 ± 0,1[4] | ||
| Показатель преломления | 1,4318 | ||
| Рег. номер CAS | 107-21-1 | ||
| PubChem | 174 | ||
| Рег. номер EINECS | 203-473-3 | ||
| SMILES | |||
| InChI | |||
| RTECS | KW2975000 | ||
| ChEBI | 30742 | ||
| ChemSpider | 13835235 | ||
| Предельная концентрация | 5 мг/м3 | ||
| ЛД50 | 4700 мг/кг (крысы, перорально) | ||
| Токсичность | ядовит | ||
| Фразы риска (R) | | ||
| Краткие характер. опасности (H) | |||
| Меры предостор. (P) | P264, P270, P301+P312, P330, P501 | ||
| Пиктограммы СГС |  | ||
| NFPA 704 |  | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |||
Этиленглико́ль (гликоль, 1,2-диоксиэтан, этандиол-1,2), HO—CH2—CH2—OH — кислородсодержащее органическое соединение, двухатомный спирт, простейший представитель полиолов (многоатомных спиртов). В очищенном виде представляет собой прозрачную бесцветную жидкость слегка маслянистой консистенции. Не имеет запаха и обладает сладковатым вкусом. Токсичен. Попадание этиленгликоля или его растворов в организм человека может привести к необратимым изменениям в организме и к летальному исходу.
Этиленгликоль впервые был получен в 1859 году французским химиком Вюрцем из диацетата этиленгликоля омылением гидроксидом калия и в 1860-м гидратацией этиленоксида. Он не находил широкого применения до Первой мировой войны, когда в Германии его стали получать из дихлорэтана для использования в качестве замены глицерина при производстве взрывчатых веществ. В США полупромышленное производство начато в 1917 году через этиленхлоргидрин. Первое крупномасштабное производство начато с возведением завода в 1925 году около Саут Чарлстона (Западная Вирджиния, США) компанией «Carbide and Carbon Chemicals Co.» (англ.). К 1929 году этиленгликоль использовался практически всеми производителями динамита.
В 1937 компания Carbide начала первое крупномасштабное производство, основанное на газофазном окислении этилена до этиленоксида. Монополия компании Carbide на данный процесс продолжалась до 1953 года.
В промышленности этиленгликоль получают путём гидратации оксида этилена при 10 атм и 190‒200 °С или при 1 атм и 50‒100 °С в присутствии 0,1‒0,5% серной или ортофосфорной кислоты, достигая 90% выхода. Побочными продуктами при этом являются диэтиленгликоль, триэтиленгликоль и незначительное количество высших полимергомологов этиленгликоля.
Благодаря своей дешевизне этиленгликоль нашёл широкое применение в технике.
- Как компонент автомобильных антифризов и тормозных жидкостей, что составляет 60% его потребления. Смесь 60% этиленгликоля и 40% воды замерзает при −49 °С. Коррозионно активен, поэтому применяется с ингибиторами коррозии;
- Используется как теплоноситель с содержанием не более 50% в системах отопления (частные дома в основном)
- В качестве теплоносителя в виде раствора в автомобилях, в системах жидкостного охлаждения компьютеров;
- В производстве целлофана, полиуретанов и ряда других полимеров. Это второе основное применение;
- Как растворитель красящих веществ;
- В органическом синтезе:
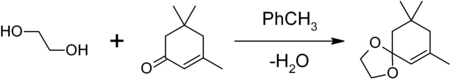
1,3-диоксоланы могут быть получены также при реакции этиленгликоля с карбонильными соединениями в присутствии триметилхлорсилана[6] или комплекса диметилсульфат-ДМФА[7] 1,3-диоксалана устойчивы к действию нуклеофилов и оснований. Легко регенерируют исходное карбонильное соединение в присутствии кислоты и воды.
- Как компонент противоводокристаллизационной жидкости «И».
- Для поглощения воды, для предотвращения образования гидрата метана (ингибитор гидратообразования), который забивает трубопроводы при добыче газа в открытом море. На наземных станциях его регенерируют путём осушения и удаления солей.
- Этиленгликоль является исходным сырьём для производства взрывчатого вещества нитрогликоля.
Этиленгликоль также применяется:
Осушается молекулярным ситом 4А, полуводным сульфатом кальция, сульфатом натрия, Mg+I2, фракционной перегонкой под пониженным давлением, азеотропной отгонкой с бензолом. Чистота полученного продукта легко определяется по плотности.
Таблица плотности водных растворов этиленгликоля, 20°С
| Концентрация % | 30 | 35 | 40 | 45 | 50 | 55 | 60 |
|---|---|---|---|---|---|---|---|
| Плотность, г/мл | 1,050 | 1,058 | 1,067 | 1,074 | 1,082 | 1,090 | 1,098 |
Этиленгликоль — горючее вещество. Температура вспышки паров 120 °C. Температура самовоспламенения 380 °C. Температурные пределы воспламенения паров в воздухе, °С: нижний — 112, верхний — 124. Пределы воспламенения паров в воздухе от нижнего до верхнего, 3,8‒6,4% (по объему).
Этиленгликоль умеренно токсичен[8][9]. По степени воздействия на организм относится к веществам 3-го класса опасности.
Летальная доза при однократном пероральном употреблении составляет 100‒300 мл этиленгликоля (1,5‒5 мл/кг массы тела)[10]. Имеет относительно низкую летучесть при нормальной температуре, пары обладают не столь высокой токсичностью и представляют опасность лишь при хроническом вдыхании. Определённую опасность представляют туманы, однако при их вдыхании об опасности сигнализируют раздражение и кашель. Противоядием при отравлении этиленгликолем являются этанол и 4-метилпиразол[11].
В организме метаболизируется путём окисления до альдегида гликолевой кислоты и далее до гликолевой кислоты, которая затем распадается до муравьиной кислоты и диоксида углерода. Также он частично окисляется до щавелевой кислоты, которая вызывает повреждения почечной ткани. Этиленгликоль и его метаболиты выводятся из организма с мочой[12].
- ↑ https://pubchem.ncbi.nlm.nih.gov/compound/174#section=Heat-of-Vaporization
- ↑ https://webbook.nist.gov/cgi/cbook.cgi?ID=C107211&Mask=4
- ↑ 1 2 http://www.cdc.gov/niosh/npg/npgd0272.html
- ↑ P. Ballinger, Long F. A. Acid Ionization Constants of Alcohols. II. Acidities of Some Substituted Methanols and Related Compounds 1,2 // J. Am. Chem. Soc. / P. J. Stang — American Chemical Society, 1960. — Vol. 82, Iss. 4. — P. 795–798. — ISSN 0002-7863; 1520-5126; 1943-2984 — doi:10.1021/JA01489A008
- ↑ Monograph on the Potential Human Reproductive and Developmental Effects of Ethylene Glycol (неопр.) (недоступная ссылка). Дата обращения 8 января 2009. Архивировано 13 января 2009 года.
- ↑ SYNTHESIS 1983, No 3,pp 203—205
- ↑ Liebigs Annalen Chemie 1979, pp 1362—1369
- ↑ CDC — The Emergency Response Safety and Health Database: Systemic Agent: ETHYLENE GLYCOL — NIOSH
- ↑ Архивированная копия (неопр.) (недоступная ссылка). Дата обращения 24 января 2018. Архивировано 15 октября 2018 года.
- ↑ Е.Ю.Бонитенко и др. Отравления этиленгликолем и его эфирами – СПб.: «Изд-во НИИХ СПбГУ», 2003 г. — Medline.Ru
- ↑ Flomenbaum, Goldfrank et al. Goldfrank’s Toxicologic Emergencies. 8th Edition. — McGraw Hill, 2006. — С. 1460, 1465. — 2170 с. — ISBN 0071437630.
- ↑ В. Ф. Крамаренко. Токсикологическая химия. — К.: Выща шк., 1989. — 447 с. — 6 000 экз. — ISBN 5-11-000148-0.
Гликоль и область его применения
Изобрел вещество французский химик Шарль Вюрц, сделавший ряд открытий в сфере неорганической химии. В наши дни работа множества механизмов и видов оборудования функционирует с помощью составов, открытых ученым.
Гликоль был получен сложным методом на основе предварительных испытаний Уильямса и Бертло. В результате появился двухатомный спирт с отличными физическими свойствами: он отличался высокой температурой кипения, а замерзал при –65 градусах Цельсия. Промышленное производство гликоля началось в первой половине прошлого века с применения в системах охлаждения двигателей внутреннего сгорания, а также в холодильных установках.
Уникальность вещества заключается в низкой себестоимости изготовления. Его получают методом гидрации окиси этилена, поэтому он дешевый, но относится к токсичным материалам. Особенно опасна жидкость для здоровья человека, при ее попадании в организм возникают неизлечимые заболевания или летальный исход.
Использование в качестве теплоносителя
Гликоль в сравнении с водой оказывает меньшее коррозионное воздействие на металл. В промышленности его применяют с различными добавками. Без присадок охладительный контур быстро загрязняется, внутри появляются пробки, что ведет к поломкам оборудования. Самым распространенным является раствор гликоля (40 %) с антикоррозионными веществами — ингибиторами. Такая смесь отличается уникальной стойкостью к образованию ржавчины. Гликолевый раствор с дистиллированной водой и карбоновыми кислотами прослужит больше 10 лет, находясь в закрытом контуре отопительной или охлаждающей сети.
Купить качественный гликоль в качестве теплоносителя можно для исключения появления паровых пробок в системе и уменьшения явления кавитации. В процессе эксплуатации уменьшается эрозия радиатора и металла трубок, увеличивается рабочий ресурс оборудования.
Основные промышленные отрасли, где используется вещество:
- химическая,
- автомобилестроение,
- судостроение,
- газо- и нефтедобывающая,
- приборостроение,
- пищевая и др.
Типы гликоля
Существует несколько основных видов материала, который востребован в качестве теплоносителя, — это этиленгликоль, монопропилен и пропиленгликоль. Первый тип растворяют водой и используют в отопительных контурах. Монопропилен применяют в изготовлении тормозных жидкостей, алкидных и полиэфирных смол, шампуней, кремов, паст и пр. Пропиленгликоль обладает более низкими теплофизическими свойствами, но безопасен для здоровья человека, поэтому рекомендован для использования в пищевой промышленности.
Гликоль +в косметике
С некоторых пор стало модно придирчиво изучать этикетку с точки зрения натуральности. Не дай бог в составе будет какая-то «синтетика». Однако даже самые натуральные средства могут быть неидеальными. Даже у самых зеленых брендов в числе компонентов бывают «нефтепродукты» — пропилен и бутиленгликоль.
При этом у наиболее принципиальных адептов «натуральности» сразу возникает вопрос: «Ну почему, почему надо все портить химией?». Нужно ли бойкотировать гликоли или все же можно «отступиться от принципов» — читайте в этой статье.
Для чего нужны гликоли
Гликоли — двухатомные спирты, в которых растворяется большинство веществ, а сами они растворяются в воде, что, согласитесь, очень удобно для создания любого вида средства: от мицеллярной воды до маски для волос.
Читайте также:
О косметике и нефти
Пропиленгликоль, бутиленгликоль, пентиленгликоль — вещества, которые чаще всего и успешнее всего используются в качестве экстрагентов для выделения полезных веществ из растительного сырья. А экстракты растений, как вы понимаете, — это «звезды» органической косметики. Всеми любимые полифенолы, антиоксиданты и любые биологически активные вещества из растений необходимо «вытащить», и лучше всего с этой задачей справляются этиловый спирт, глицерин и гликоли.

Однако предпочтение именно гликолям отдали не просто так:
- Гликоли предотвращают кристаллизацию активных веществ (кристаллизованные вещества теряют свою активность полностью).
- Гликоли предотвращают высыхание активных веществ (в отличие от спирта, который испаряется), т. е. обеспечивают жизнеспособность биологически активных компонентов.
- Гликоли улучшают адгезию активных веществ с кожей и усиливают их пенетрацию.
- Гликоли (особенно пентиленгликоль) обладают активностью против бактерий и грибов, тем самым их добавление в формулу помогает снизить количество консервантов (которые, как известно, самые популярные раздражители).
Откуда нелюбовь к гликолям?
Гликоли — это совсем не новая вещь в косметологии, у них длительная история применения и они полностью изучены. Законодательно утверждены нормы введения, которых придерживаются все производители. Почему же потребители все еще стараются избегать таких компонентов?
Основная причина нелюбви — то, что эти ингредиенты производятся из нефти, а именно этого вообще никак не хотят любители «зеленой» косметики. Все мы привыкли связывать продукты нефтепереработки с загрязнением окружающей среды: все эти дымящие заводы, выбросы токсичных отходов в озера и реки, разливы нефти и пр. Такой ингредиент непременно окажет негативное влияние на кожу, ну не может же «спиртовой растворитель», элемент «незамерзайки» для автомобилей, быть полезным для нежной кожи лица. Только натуральное, только природное приносит пользу. В общем-то, логика понятна, но если оценить все трезвым взглядом, здесь не все так однозначно.
Миф 1. Всё из нефти

Нефть — это невозобновляемый ресурс, чтобы ее «создать», потребуются тысячи лет. Но на сегодняшний день это самое дешевое и доступное сырье, поэтому нефть используется везде, человечество пока еще сжигает ее в сумасшедших масштабах, она просто не успевает восстановиться. Тем не менее, благодаря усилиям экологов, в последние 10 лет отношение к нефти стало бережнее — там, где можно ее не использовать, ее не используют.
Замена нефти уже найдена. Собственно, нынешние гликоли получают из растительного сырья, его добывают из растительных масел, на данный момент из кукурузного. Также гликоли могут получать из глицерина, а его в свою очередь — из кокосовых орехов. Правда, сертификата «органик» такие гликоли все равно не получат, поскольку в процессе задействованы генетически модифицированные ферментированные E. coli бактерии. Но для потребителей важно природное сырье, и теперь, пожалуйста, — это оно и есть. Конечно, такое производство дороже, но зато не нефтепереработка.
Правда, есть один подвох. Например, для производства «натуральных» гликолей потребуется больше кукурузных полей и плантаций кокосовых пальм, под которые вырубят часть лесов. Действительно ли такая альтернатива лучше, вопрос философский.
Миф 2. Токсичность и раздражение

Некоторые говорят о том, что пропиленгликоль используется в антифризах, поэтому на лицо «это» наносить нельзя ни в коем случае. Однако пропиленгликоль для косметических целей очищен до 99,5–99,9 % (т. е. вредных примесей там нет вообще). Исследования зафиксировали, что гликоли вызывают раздражение кожи при дозировках 25 % и выше, таких концентраций в косметических продуктах вы не найдете никогда, типичный уровень будет ниже 5 %, что допустимо и безопасно.
Гликоли по косметическим стандартам не содержат канцерогенных, сенсибилизирующих веществ, даже при потреблении внутрь они не представляют серьезной опасности. Так, пропиленгликоль в организме быстро метаболизируется в пировиноградную, уксусную и молочную кислоту, а также пропиональдегид (не накапливается в организме). Даже с большой натяжкой его нельзя назвать токсичным.
Миф 3. Грязное производство

Давайте перестанем мыслить стереотипами. Промышленные процессы в наши дни — это чистое и эффективное производство, даже промежуточные химические вещества по экологическим стандартам должны быть безопасными и экологически чистыми. Гликоли очень быстро разлагаются в почвах и воде, не нарушая экосистем. Время, когда все токсичные отходы сбрасывали в окружающую среду, уже прошло, по крайней мере у основных игроков химической промышленности, таких как BASF и Dow Chemicals, существуют специальные резервуары, где хранятся и перерабатываются без вреда для экологии наиболее вредные элементы.
Нужно понять, что производство есть производство, и выпускает ли завод растительные экстракты с сертификатом «органик» или нефтехимический пропиленгликоль — в любом случае работают машины, а не феи с волшебными палочками. И эти машины требуют места, энергии, топлива, т. е. потребляют ресурсы.
Думаю, идею о том, что гликоли в креме — это монстры, которых стоит избегать всеми силами, стоит как минимум переосмыслить. Найти что-то очень плохое о гликолях довольно сложно, но люди часто настроены против любых ингредиентов, которые ассоциируются с «химией», и хотя иногда это имеет смысл, в случае гликолей такое предубеждение совершенно напрасно.
Татьяна Моррисон
Фото istockphoto.com
ГЛИКОЛИ — это… Что такое ГЛИКОЛИ?
(алкандиолы), двухатомные спирты жирного ряда общей ф-лы С n Н 2n (ОН)2. Группы ОН в молекулах могут находиться у одного атома С (геминальные Г.), у соседних атомов (вицинальные) и т. д. Названия Г. производят от названий соответствующих алканов или ал-кенов и соотв. суффиксов «диол» или «гликоль», напр. НОСН 2 СН 2 ОН-1,2-этандиол или этиленгликоль, НОСН 2 СН 2 СН 2 ОН-1,3-пропандиол или 1,3-пропиленгликоль (триметиленгликоль).
Наиб, практич. значение имеют этиленгликоль, пропиленгликоли, бутиленгликоли и нек-рые их производные, содержащие одну или более простых эфирных групп в молекуле (т. н. полигликоли, напр. диэтиленгликолъ), высокомолекулярные полиэтиленгликоли (см. Полиэтиленоксид).
Низшие Г.-бесцв. прозрачные вязкие жидкости (см. табл.) без запаха, имеют сладковатый вкус, гигроскопичны. Наличие в молекуле двух групп ОН обусловливает более высокие плотность, вязкость и т-ру кипения Г., чем соответствующих одноатомных спиртов. Геминальные Г. нестойки, напр. метиленгликоль существует только в водных р-рах.
СВОЙСТВА ПИКОЛЕЙ 
Низшие Г. (С 2 -С 7) смешиваются с водой, спиртами, альдегидами, кетонами, к-тами, аминами во всех соотношениях. Г., особенно полигликоли, хорошо растворяют синтетич. смолы, лаки, краски, эфирные масла, каучуки. Ароматич. углеводороды растворяются в Г. ограниченно, предельные алифатич. углеводороды не растворяются. Благодаря водородным связям Г. образуют ассоциаты с водой (гидраты), аминами и др. При образовании гидратов значительно понижается т-ра замерзания водных р-ров Г. На этом св-ве основано применение их как антифризов.
Г. обладают всеми хим. св-вами, характерными для спиртов. Гидроксильные группы Г. реагируют независимо друг от друга или одновременно (поэтому иногда образуются соответствующие смеси продуктов). Со щелочными металлами и их гидроксидами Г. образуют гликоляты (напр., NaOCH2CH2ONa), с одноосновными карбоновыми к-тами, их ангидридами или хлорангидридами — сложные моно- и диэфиры, с двухосновными к-тами и их производными-линейные сложные полиэфиры типа [ЧOROЧ(O)CR’C(O)Ч]n, с низкомол. двухосновными к-тами или их эфирами-циклич. соединения, напр.: 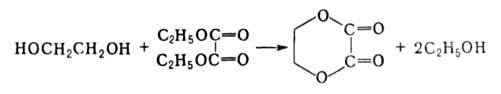
При действии галогеноводородов Г. легко превращаются в галогенгидрины, напр. при нагр. с НС1 1,2-пропиленгликоля образуется смесь С1СН 2 СН(ОН)СН 3 и НОСН 2 СН(С1)СН 3; однако вторая группа ОН замещается на галоген труднее (лучше — действием РС15 или SOC12).
С альдегидами и кетонами (кат.-FеС13, Н 3 РО 4) Г. дают циклич. ацетали (1,2-Г.-1,3-диоксоланы, 1,3-Г.-1,3-диоксаны), напр.: 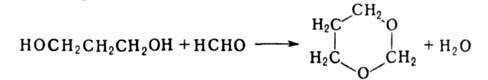
Под действием щелочных катализаторов Г. реагируют с ацетиленом с образованием виниловых и дивиниловых эфиров: напр.: 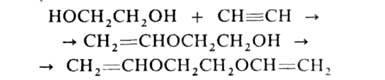
с акрилонитрилом — моно- или бис-цианэтиловых эфиров, напр.: 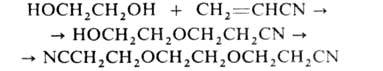
с эпоксидами при 140-180
Химическая энциклопедия. — М.: Советская энциклопедия. Под ред. И. Л. Кнунянца. 1988.
Раствор гликоля
Промывка- Промывка
- Промывка труб отопления
- Промывка теплоносителей
- Промывка кондиционера
- Промывка вентиляции
- Промывка пластинчатых теплообменников
- Промывка систем холодоснабжения

Водные растворы гликолей — вещества, применяемые в промышленности для нормальной работы теплоносителей (или хладоносителей). Они отличаются хорошей влагоемкостью, смеси на основе пропиленгликоля не вредны для человека, стабильны при работе и не агрессивны для металлов. Степень гигроскопичности гликоля определяется концентрацией гидроксильных и эфирных групп, которые могут входить в их состав. Эти компоненты необходимы для взаимодействия с водой и образования водородных связей
Растворы гликолей на водной основе бывают в концентрации от 5 % до 99,8 % от веса вещества, но в качестве теплоносителей используются 40-45 % составы. Такая насыщенность равна точке эвтектики вещества гликоль-вода. Применение растворов такой насыщенности позволяет избежать замерзания гликоля.
Вязкость жидкости возрастает пропорционально увеличению концентрации и повышению давления и уменьшается с ростом температуры. Когда вязкость материала достигает значения более 100 мПа, процесс массообмена растворов и водного пара значительно ухудшается. В итоге равновесие фаз не может быть достигнуто.
Виды теплоносителей и отличия между ними
Существует несколько основных жидкостей, применяемых в качестве теплоносителя:
- антифриз, на основе этилового спирта;
- антифриз на основе этиленгликоля;
- на основе пропиленгликоля.
Вода — дешевая жидкость, безопасная для окружающей среды. При случайных утечках такой теплоноситель не приносит вреда человеку. Восстановить прежний объем жидкости, просто долив воду в расширительный бак.
Недостатки воды в качестве теплоносителя:
- в процессе эксплуатации образуется накипь, которая снижает теплоотдачу, вследствие чего повышаются расходы энергии;
- в случае отключения нагревателя и уменьшения давления в системе при минусовой температуре — замерзает, расширяется и приводит в негодность всю отопительную систему;
- необходимо производить замену не реже чем раз в год, в отличие от антифриза, который может работать более 5 лет.
Антифриз отличается низкой температурой замерзания. Он сохраняет контур системы даже при отключении нагревателя. Антифриз — это раствор, состоящий из воды и гликоля, с добавлением присадок.
Антифриз на базе этилового спирта
Раствор спирта и воды применяется в концентрации 40-55 %. Температура замерзания такого состава равна -30 ˚С. Вещество безопасно и экологично. Подобного типа смеси рекомендуется использовать только в системах с закрытым контуром, где осуществляется принудительная циркуляция жидкости. Спирт — это летучий материал, который хорошо испаряется и со временем эксплуатации в открытой системе его концентрация снижается. Не рекомендуется раствор этилового спирта применять и при высоких температурах, так как его точка кипения составляет 90 ˚С.
Этиленгликоль в составе антифриза
Для домашних нужд применяются смеси на базе этиленгликоля. Это токсичное вещество, которое в случае попадания на кожу приводит к химическим повреждениям и отравлениям. Температура замерзания равна — 30 ˚С, при концентрации в 45 %. Когда количество этиленгликоля равно 65 % точка замерзания достигает – 65 ˚С. Можно выбрать самый оптимальный вариант состава на сайте, в зависимости от индивидуальных особенностей и конечных целей.
Недостаток — чувствительность к перегреву. Кратковременный подъем температуры выше заявленного предела ведет к тому, что раствор раскладывается на кислоты и выпадает осадок, нерастворимый в воде. Осадок может образовывать нагар, который снижает эффективность работы теплообменника, вызывая повторный перегрев и образование осадка. Кислоты вступают в химическую реакцию с металлическими элементам системы — образовывая локальные очаги коррозии, которые в итоге ведут к разрушению контура.
Необходимо тщательно следить за температурой теплообменника, где используется теплоноситель на базе этиленгликоля.
Пропиленгликоль
Пропиленгликоль — одна из разновидностей гликоля, применяемого в качестве теплоносителя. Он менее опасен для организма человека. В состав такого антифриза должны входить дополнительные присадки, которые позволяют сохранять целостность металла, применяемого в системе. Используются добавки, которые предотвращают окисления, уменьшают пенообразование.
Такие составы можно применять в котлах двухконтурного типа, как так в случае протечки их попадание в воду не вредит человеку.
Недостаток — высокая стоимость. Состав на базе пропиленгликоля обходится в 2-2,5 раза дороже, чем аналогичное вещество, созданное на основе этиленгликоля.
Что нужно учитывать при выборе антифриза
Когда температура в контуре не опускается ниже +5 ˚С, можно использовать очищенную и подготовленную воду. Если есть вероятность работы системы при минусовых значениях — выбирают антифриз. Выбирая состав, следует учесть следующие параметры:
- какая максимальная низкая температура допустима;
- наличие присадок и их характеристики;
- как вещество взаимодействует с черными и цветными металлами;
- срок работы до следующей замены;
- периодичность обновления и диагностики;
- влияние на организм человека — не все материалы можно применять в домашних условиях.
Раствор гликоля, соответствующий индивидуальным параметрам можно подобрать в соответствующем разделе, проконсультировавшись со специалистом компании. Сотрудник подскажет оптимальный состав под заявленные цели и нужды.
Интересные статьи

 Читайте также:
Читайте также: