Барсучий жир при туберкулезе лёгких
При диагностировании туберкулеза легких лечение осуществляется при помощи лекарственных препаратов. В качестве дополнительной терапии можно использовать барсучий жир, которые имеет несколько полезных свойств и помогает купировать неприятные симптомы. Кроме этого, комплексное лечение ускорит процесс выздоровления и предотвратит развитие осложнений. Барсучий жир при туберкулезе используется уже долге время.
Полезные свойства барсучьего жира
Барсучий жирБарсучий жир уже долгое время используется в рецептах народной медицины для лечения многих заболеваний. По внешнему виду он представляет маслянистую кремообразную массу, имеющую специфический запах. При незначительном повешении температуры он становится более жидким, а при понижении – приобретает густоту.
Жир считается ценным, когда был добыт еще в начале зимы, так как барсуки в этот период откладывают его большое количество. В нем содержится максимальное количество полезных веществ, микроэлементов и витаминов.
- Витамины А, Е и В. Они помогают укрепить иммунитет, восстановить процесс обмена веществ.
- Ненасыщенные жирные кислоты. Они обладают высокой плотностью и при применении жира оказывают регенерирующее и антиоксидантное воздействие, положительно сказываются на работе сердечной мышцы, лечат заболевания ЖКТ, сосудов, дыхательной системы и мышц.
- Органические кислоты. В несколько раз усиливают бактерицидное воздействие, препятствуют повышению мочевой кислоты и восстанавливают процесс пищеварения.
Использование барсучьего жира при туберкулезе легких помогает повысить сопротивляемость организма, предотвратить развитие онкологии, восстановить уровень гормонов.
Особенности лечения
Продолжительность лечения туберкулеза при помощи барсучьего жира зависит от степени тяжести заболевания.
Целебной воздействие оказывается благодаря наличию особого вещества, по многим качествам напоминающего антибиотик. Именно при его воздействии погибают туберкулезные палочки, легкие начинают очищаться от скопившегося гноя и слизи.
Внутрь принимать барсучий жир можно детям по достижению шестилетнего возраста. До этого периода детский организм не способен переработать продукт. Для лечения детей его используют для втирания.
Показания к применению
Слабый иммунитетБарсучий жир в составе комплексной терапии применяется только после консультации с врачом при:
- Сниженном иммунитете, когда человека беспокоят частые простуды.
- В период восстановления после перенесенных тяжелых заболеваний.
- Установленных гнойных патологиях.
- Наличии ран и язв, которые долгое время не проходят.
- Воспалительных заболеваниях дыхательной системы.
- Развитии патологий пищеварительной системы.
- Воспалении органов мочеполовой системы.
- Нарушении работоспособности сердечной мышцы.
Барсучий жир эффективен также и при дерматологических заболеваниях, таких как экзема или псориаз. Благодаря активным компонентам может применяться в косметологических целях, так как помогает избавиться от мелких морщин.
Противопоказания
БеременностьИспользовать барсучий жир категорически запрещено для лечения детей в возрасте до 6 лет. В этот период возможно появление аллергии на входящие в состав компоненты.
К противопоказаниям также относятся:
- Заболевания поджелудочной железы и печени. Жир барсука может усугубить течение патологии.
- Беременность и лактация. Влияние продукта в данные периоды не установлено и лучше всего от него отказаться.
- Аллергическая реакция. Применять барсучий жир при туберкулезе в случае появления сыпи, тошноты и других симптомов запрещено.
По мнению некоторых специалистов, применение барсучьего жира при развитии туберкулеза легких является малоэффективным методом. Использовать его лучше в комплексе с лекарственными препаратами.
Прием и дозировка
При использовании барсучьего жира следует строго соблюдать все дозировки. Детям до 6 лет показано только наружное применение после консультации с врачом. При лечении детей в возрасте от 6 до 10 лет можно давать по половине чайной ложки средства.
Детям до 6 лет показано только наружное применение после консультации с врачом. При лечении детей в возрасте от 6 до 10 лет можно давать по половине чайной ложки средства.
Детям старше 10 лет и взрослым следует принимать по одной чайной ложки. Жир рекомендуется смешивать с медом, при условии отсутствия аллергической реакции на него. Запивать средство лучше отваром шиповника для улучшения усвоения и повышения целебных свойств. Барсучий жир также употребляют и с теплым молоком.
При приеме внутрь важно, чтобы желудок был пустым, так как средство имеет свойство впитываться не в кровь, а в пищу, после чего выводиться естественным путем.
Хранение и качество барсучьего жира
Для того чтобы лечение было эффективным, в первую очередь следует правильно выбрать барсучий жир. Качественный продукт имеет следующие признаки:
- Белый или немного желтоватый цвет.
- Характерный запах и вкус.
Некачественный барсучий жир имеет желтый цвет и неприятный запах с гнилью. При покупке следует обращать внимание на срок годности.
При покупке следует обращать внимание на срок годности.
Средство выпускается в виде капсул и флаконах, которые хранят в прохладном, сухом месте, защищенном от солнечных лучей. При соблюдении условий хранения срок годности жира составляет до 2 лет.
Перед каждым приемом следует проверить жир на присутствие посторонних запахов или примесей. Если наблюдаются неприятный запах, горьковатый привкус или желтый цвет, такое средство лучше не использовать. При применении некачественного барсучьего жира может возникать отравление.
То, как применять или пить барсучий жир, указано в инструкции. Следует соблюдать все указанные дозировки, так как существует вероятность развития аллергии. Средство обладает большой эффективностью при туберкулезе легких и используется в качестве дополнительной терапии. Барсучий жир имеет ряд противопоказаний и перед его применением нужно проконсультироваться у врача.
легких, как принимать правильно, лечить, отзывы, пить, помогает ли, лечебные свойства, народными средствами, мед, настойка
Барсучий жир при туберкулезе помогает не только устранить симптоматику болезни, но и активизирует защитные силы организма больного.
Полезные свойства
Барсучий жир — это натуральная субстанция, состоящая из подкожного сала барсука. Данный продукт имеет желтоватый оттенок, маслянистую консистенцию и своеобразный запах. При низких температурах окружающего воздуха он становится густым и твердым, в тепле — растапливается и растекается.
Наибольшую ценность представляет жир, добытый в конце осени или в начале зимы, когда в нем скапливается максимальное количество полезных элементов.
Его неповторимый состав, включающий природный антибиотик, гармоничное сочетание витаминов групп В, С, А, органических кислот, ненасыщенных жирных кислот и иных полезных элементов, обуславливает выраженное проявление следующих целебных свойств:
- способствует укреплению иммунитета;
- губительно действует на различные виды патогенных бактерий, в их числе — на микобактерии туберкулеза;
- многократно усиливает противомикробное действие лечебных средств на организм больного;
- очищает легкие от гнойной слизи, образующейся при развернутом туберкулезном процессе;
- обладает хорошим противовоспалительным действием и ранозаживляющим эффектом;
- усиливает процессы регенерации поврежденных органов, клеточного обновления;
- улучшает кровообращение;
- повышает гемоглобин;
- нормализует обмен веществ и процессы пищеварения;
- быстро приводит в норму истощенный болезнью организм.

Часто пациенты интересуются тем, можно ли вылечить туберкулез данным продуктом без применения медикаментов. Барсучий жир вместе с другими народными средствами можно применять в лечении указанной тяжелой болезни только наряду с традиционной медициной.
Как принимать
Барсучий жир при туберкулезе легких следует принимать продолжительное время, с момента обнаружения начальных симптомов болезни до выздоровления. Перед приемом средства нужно проконсультироваться с лечащим врачом.
Рекомендуется использовать данное натуральное лекарство в следующих дозировках:
- детям с 6 до 10 лет — по 0,5 ч.л.;
- взрослым и детям старше 10 лет — по 1 ч.л.
Запивать жир лучше всего теплым молоком или настоем шиповника.
Хорошо в данное лекарство добавлять мед, если нет на него аллергических реакций.
Первые 2 недели смалец следует применять за час до еды 3 раза в день. Затем нужно перейти на одноразовый прием в вечернее время, лучше перед сном, до полного исцеления.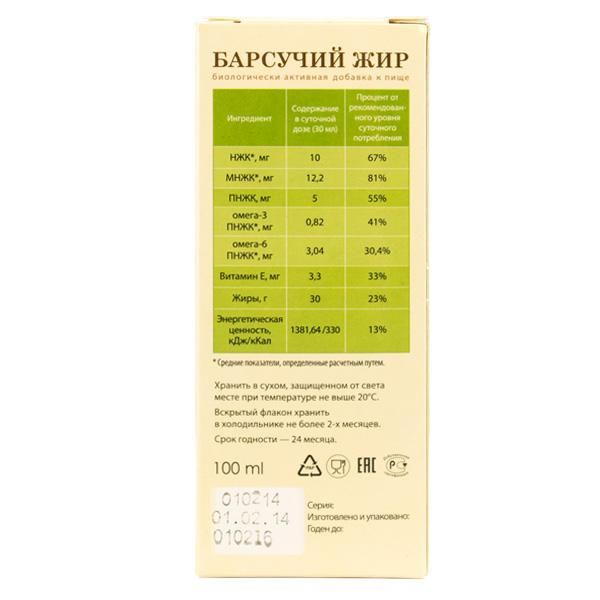
Лечение жиром эффективно только при применении на голодный желудок. Средство должно впитаться в кровь и разойтись по всему организму. При наполненности желудка оно вместе с пищей выйдет наружу. При правильном приеме данный лечебный продукт способен полностью усвоиться организмом больного.
Детям до 6 лет использовать это лекарство внутрь запрещено. С разрешения специалиста допускается только наружное применение барсучьего жира. Для этого рекомендуется втирать продукт в кожу груди и спины и после этого укутывать ребенка теплым пледом.
Противопоказания и побочные эффекты
Существует ряд противопоказаний для борьбы с туберкулезом барсучьим жиром. К ним относятся:
- Детский возраст (до 6 лет). Из-за физиологической неспособности незрелого организма усвоить указанный продукт.
- Беременность и период лактации. Специальные исследования по применению препарата в указанные периоды жизни женщины не проводились.

- Аллергические реакции на продукт. Они проявляются в виде характерных кожных высыпаний, дизурических явлений.
- Любые патологии поджелудочной железы, печени, желчного пузыря. Использование барсучьего жира для лечения туберкулеза может ухудшить состояние данных внутренних органов и привести к обострению воспалительных процессов.
В редких случаях могут возникнуть побочные эффекты на лечение туберкулезной инфекции барсучьим жиром.
Это может быть связано с передозировкой продукта, с его индивидуальной непереносимостью, с истекшим сроком годности. К негативным последствиям применения смальца следует отнести:
- появление непрекращающейся диареи;
- тошноту, рвоту;
- головокружение;
- отсутствие аппетита;
- аллергические реакции и пр.
При обнаружении таких проявлений необходимо немедленно прекратить прием данного натурального средства. Употребление большого объема жидкости способствует быстрому выведению продукта из организма. При необходимости следует обратиться за помощью к специалисту.
При необходимости следует обратиться за помощью к специалисту.
Барсучий жир при туберкулезе легких
Барсучий жир с незапамятных времен применяется для врачевания туберкулеза легких. Лучшим считается природный жир из Алтая. Средство особенно эффективно в комплексном лечении с медвежьим жиром, прием внутрь сочетается с растирками. Купить настоящий барсучий жир можно в нашем интернет-магазине «СИБХАНТЕРС».
Лечение туберкулеза легких с помощью барсучьего жира
В народной медицине барсучий жир применяется при простудах, в лечении суставов, как растирка при остеохондрозах и радикулитах, от невралгии и кожных заболеваний. Но основным показанием являются все же патологии органов дыхания, и туберкулез легких занимает особое место.
До появления медикаментозных способов лечения медвежий жир и нутряной смалец куньих были едва ли не основными методом лечения. Большую пользу принесет нутряной жир и при включении в современные схемы лечения, ведь не случайно больным туберкулезом рекомендуется богатая животными жирами пища.
Туберкулез легких – типы и симптомы
Возбудителем болезни является специфичная микобактерия длиной 0,3-7 нмк — палочка Коха. По данным ВОЗ каждый третий житель планеты инфицирован туберкулезной палочкой. Смертность составляет порядка 3 млн. человек в год.
Суставы, кожа, ЦНС и мозг – все это может стать мишенью микобактерии, однако в общей структуре заболеваемости чаще встречается туберкулез легких.
Причины и симптомы
Инфекционный процесс можно заподозрить при хронических системных болезнях (к примеру, при длительном и безуспешном лечении суставов). При этом к патологии приводят внешние «катализаторы»:
- иммунодефицит, диабет, онкопроцессы, поражения костно-мышечной системы;
- контакт с больными открытой формой;
- социальные факторы – недостаток питания, курение, неудовлетворительные социально-бытовые условия.
При остром процессе симптомы напоминают воспаление, бронхиты, простуду. Манифестация сопровождается лихорадкой, загрудинными болями, одышкой. У подострого течения четкой картины не прослеживается. Но если человека беспокоит сухой кашель, субфебрилитет, несвойственная человеку потливость (даже в покое), надо пройти внеплановое обследование.
Манифестация сопровождается лихорадкой, загрудинными болями, одышкой. У подострого течения четкой картины не прослеживается. Но если человека беспокоит сухой кашель, субфебрилитет, несвойственная человеку потливость (даже в покое), надо пройти внеплановое обследование.
Особенности течения
Первичный туберкулез: Возникает у лиц без специфического иммунитета. Чаще всего это дети и подростки, ослабленные люди, пожилые и старики.
Вторичный процесс: Развивается в результате активации инфекции из первичных очагов, после повторных контактов с возбудителем. Описаны случаи патогенеза у пожилых лиц, перенесших первичный туберкулез ранее и полностью излечившихся.
Патогенез проявляется образованием воспалительных очагов в легочной ткани с общей интоксикацией организма. Контактная опасность больного зависит от наличия в мокроте микобактерий:
- открытая форма (ВК+) — с мокротой выделяются микобактерии;
- закрытое течение (ВК-) – возбудитель не попадает во внешнюю среду;
- периодическое выделение бацилл (ВК±).

Оказавшись в организме, туберкулезные микобактерии способны годами ждать удобного для активации момента. Бацилла может «проспать» на протяжении всей жизни человека, а может обернуться крайне опасным заболеванием. Вот почему купить и пропить нутряной жир стоит людям из групп риска и тем, кто уже переболел опасным заболеванием.
Как действует барсучий жир при туберкулезе
В нутряном жире собрано огромное количество питательных и биологически активных веществ, необходимых барсуку во время зимней спячки. Они представлены в легко усвояемой форме, работают комплексно. Если баночка из интернет-магазина содержит правильно заготовленный натуральный жир, его усвоение приближается к 100%.
Активные вещества смальца барсука:
- полиненасыщенные жирные кислоты класса омега-3, 6 и 9- противовоспалительный и заживляющий эффект, антиоксидантное действие;
- витаминно-минеральный комплекс и в небольшом количестве протеиновая группа веществ – питание, активизация иммунитета;
- органические кислоты — бактерицидное воздействие, улучшение пищеварения и усвоения питательных веществ из пищи.

Также в составе смальца есть вещества с мощным противомикробным действием, что бесценно в лечении туберкулезного процесса. После применения барсучьего жира:
- стихают инфекционные процессы;
- очищаются легкие;
- закрываются свищи и гнойные очаги в легких;
- смалец увеличивает калорийность и питательность рациона больного.
В лечении туберкулеза легких применяются «тяжелые» фармакологические препараты. Тут получаемая после переработки смальца жировая эмульсия защищает слизистую ЖКТ, печени. Переваривание смальца проходит таким образом, что все полезные вещества сохраняют свою биологическую силу и поступают с кровотоком в легкие.
Схемы лечения
При туберкулезе легких народные средства лучше работают в комплексе. Хорошо сочетать внутреннее и наружное использование. Важно, чтобы жир собрали перед началом зимней спячки животных. В интернет-магазине «СИБХАНТЕРС» можно приобрести нутряной смалец диких животных осенней заготовки.
Комплексное применение
Барсучий и медвежий жир с бобровой струей. Состав одновременно дает несколько эффектов:
- мускус и природные антибиотики жиров подавляют туберкулезные микобактерии;
- органические кислоты и омега-комплекс очищают от гноя и слизи легочную ткань и дыхательные пути;
- витамины и минералы питают организм.
Трижды в день за 2 часа до еды принимают по 1 ст. ложке боровой струи, после чего употребляют 1 ст. ложку барсучьего жира. Перед сном грудь и спину растирают медвежьим жиром — по 1-2 ст. ложки на сегмент до полного впитывания. Минимальный курс составляет 2-3 месяца, поэтому выгодно купить упаковку с продуктом на 500/1000 мл.
Прием внутрь
Барсучий жир вкусным не назовешь. В чистом виде его смогут съесть лишь совсем непритязательные люди, поэтому на его основе готовят лечебные смеси. Здесь сразу две цели: «забить» неприятный привкус и усилить лечебный эффект.
Молоко и нутряной жир: На стакан горячего молока (250 мл) добавляют по 1 ч. л. нутряного смальца и цветочного меда. Состав принимать на ночь. Для детей достаточно ½ стакана.
Очищение легких смальцем с алоэ: Рецепт оценят любители сладкого. В кастрюлю помещают плитку темного шоколада, 5 ст. ложек меда, 5 ст. ложек жира, 2 ст. ложки сока алоэ. Ингредиенты растапливают на водяной бане до однородной смеси. Взрослые принимают по 2 ст. ложки пасты 2-3 раза в день, дети – по десертной ложке. Курс не меньше месяца.
Мед, алоэ, барсучий жир и коньяк — подавление возбудителя, повышение иммунитета: Еще у средства хороший противокашлевый эффект. Взять по 2 ст. ложки барсучьего жира, коньяка, меда. Крупный лист алоэ прокрутить на мясорубке. Смешать в единую массу и добавить ложку какао-порошка. Полученное средство принимать по ст. ложке 3-4 раза перед едой, запивать ½ стакана горячего молока.
Растирка и компресс
При поражении легких костно-мышечная система также может попасть под удар. Лечение суставов при туберкулезном поражении проводится перорально по общим схемам лечения органов дыхания.
Лечение суставов при туберкулезном поражении проводится перорально по общим схемам лечения органов дыхания.
Рекомендуются местные растирки очагов поражения:
- чистым смальцем барсука 3-4 раза в стуки;
- смешать смалец барсука с медвежьим жиром в соотношении 1:1 и втирать с той же периодичностью.
Для усиления эффекта укутать сустав шерстяной тканью, пуховым платком и выдержать компресс 2-3 часа.
Как выбрать хороший смалец
Убедиться в качестве жира можно после вскрытия баночки. На хорошее снадобье даже смотреть приятно. Однородная консистенция густейшей сметаны или вазелина, молочный либо бежевый оттенок. В тепле жир быстро тает, в холодильнике твердеет.
Мы предлагаем купить в интернет-магазине «СИБХАНТЕРС» смалец из Алтайского края. Продукт собран в сентябре, вытоплен на паровой бане, закрыт вакуумной крышкой. Безопасность и качество подтверждает экспертиза ветеринарной службы. Подключайте барсучий жир в стандартные протоколы лечения, и больной быстрее пойдет на поправку.
Барсучий жир, медведка и алкоголь от туберкулеза не вылечат! — Слава Севастополя
За то время пока в Украине продолжается эпидемия туберкулеза, наверное, каждому из нас приходилось слышать о том или ином средстве народной медицины, якобы способном излечить от этого заболевания. Стоит только посетовать, что у ребенка реакция Манту «расползлась» по руке, как обязательно найдется бабушка-соседка, которая посоветует трижды в день выпивать по стакану парного молока со скипидаром («хорошо помогает!»), есть борщ из крапивы («в войну так лечились!») или раздобыть собачий жир (мол, один бомж собак ел и вылечился!). Естественно, болеть туберкулезом никому не хочется, и ради здорового будущего люди готовы если не на все, то на многое. Вот только насколько эффективны подобные средства?ГЛАВНОЕ — НЕ НАВРЕДИТЬ
По мнению специалистов, сейчас одними лишь бабушкиными снадобьями туберкулез не вылечишь. В настоящее время не существует убедительных данных об эффективности народных средств для лечения этого заболевания, и если кто-то рассказывает истории со счастливым концом, то это исключения, которые приходятся на случаи самоизлечения. Напротив, врачи имеют большой негативный опыт, когда сталкиваются с пациентами с тяжелыми формами туберкулеза, применявшими методы народной медицины в качестве самолечения.
Напротив, врачи имеют большой негативный опыт, когда сталкиваются с пациентами с тяжелыми формами туберкулеза, применявшими методы народной медицины в качестве самолечения.
Существует много мифов о чудодейственном воздействии барсучьего жира, восковой моли, медведок и других насекомых или употреблении алкоголя для лечения. Миф о барсучьем жире связан с тем, что в нем, как и в жире других животных, впадающих в спячку, содержатся полезные вещества — витамины и микроэлементы. Однако длительное потребление жира негативно влияет на печень и поджелудочную железу, поэтому польза от попадания в организм небольшого количества содержащихся в нем витаминов не может превысить ущерб именно от жира. К тому же сегодня все необходимые для сопутствующего лечения витамины и микроэлементы есть в лекарственных препаратах, и когда пациент их принимает, врач точно уверен в их дозировке.
Миф о целительных свойствах и эффекте от поедания насекомых основан на том, что в них содержатся микроэлементы, которые сегодня также можно получить в форме медицинских препаратов.
Что касается употребления алкоголя, то его ни в коем случае нельзя рассматривать в качестве метода дезинфекции или лечения туберкулеза, так как алкоголь травмирует печень.
Несмотря на все это, многие методы народной медицины действительно полезны и могут широко применяться вместе с основным лечением, но они никогда не заменят медицинские препараты.
ЛЕЧЕНИЕ ТУБЕРКУЛЕЗА ДОЛЖНО БЫТЬ КОМПЛЕКСНЫМ…
В качестве сопутствующего лечения можно рассматривать прежде всего проветривание помещения и увлажнение воздуха в нем, прогулки на свежем воздухе в любое время года, питание, которое нравится больному человеку (например, бульон из свежей домашней курицы, простокваша, творог, фрукты), употребление растительных чаев (с мятой, ромашкой, зверобоем и т.д.).
Можно употреблять отвары и настои из трав, которые помогут легче откашливать мокроту или успокоить кашель, снизить температуру тела и улучшить аппетит, нормализовать работу кишечника (при запорах или диарее). Полезным является применение желчегонных и витаминных чаев (с шиповником, бессмертником и другими растениями, обладающими желчегонным действием). То есть для сторонников средств народной медицины существует довольно широкое поле действий при проведении основного курса лечения туберкулеза и после его завершения. Но пользоваться народными средствами необходимо грамотно, и тогда процесс лечения будет более эффективным.
Полезным является применение желчегонных и витаминных чаев (с шиповником, бессмертником и другими растениями, обладающими желчегонным действием). То есть для сторонников средств народной медицины существует довольно широкое поле действий при проведении основного курса лечения туберкулеза и после его завершения. Но пользоваться народными средствами необходимо грамотно, и тогда процесс лечения будет более эффективным.
Во время лечения не стоит употреблять биологически активные добавки, поскольку они не являются лекарствами. БАДы содержат большое количество компонентов, действие которых не проверено на больных в клинических исследованиях. При употреблении таких веществ может произойти ухудшение лечения туберкулеза (через стимулирующее воздействие на определенное звено иммунной системы) или снижение концентрации и потеря эффективности противотуберкулезных препаратов в крови из-за нейтрализации их компонентами биологических добавок.
…А ПИТАНИЕ — КАЛОРИЙНЫМ И СБАЛАНСИРОВАННЫМ!
Также больным туберкулезом необходимо сбалансированное калорийное питание, особенно при больших распространенных процессах поражения организма, сопровождающихся потерей массы тела.
Учитывая, что при туберкулезе у больных, как правило, плохой аппетит, который также может ухудшаться под влиянием противотуберкулезных препаратов, питание в таких случаях должно быть ориентировано на предпочтения пациента — есть то, что нравится.
Вообще терапевтические мероприятия у больных туберкулезом направлены на усиление способности пораженных органов к заживлению, улучшение обмена веществ, а также на укрепление иммунной системы организма, что в большой степени может быть достигнуто сбалансированным питанием. С этой целью необходимо вводить в рацион увеличенное количество белка (не менее 120-140 г в сутки), потребность в котором у больных повышена.
Рекомендуются легкоусвояемые белковые продукты (молоко, рыба, яйца, мясо). Количество жиров — в пределах физиологической нормы (100-120 г в сутки). Причем следует отдавать предпочтение легкоусвояемым жирам и продуктам, содержащим большое количество витамина А (сливочное масло, молоко, сливки, сметана). Около 1/3 жиров должны быть растительного происхождения как источник полиненасыщенных жирных кислот, особенно необходимых на этапе обострения туберкулезного процесса.
Количество углеводов — в пределах физиологической нормы (450-500 г в сутки). В случаях, когда при туберкулезе имеет место нарушение углеводного обмена (увеличенная масса тела), больным следует ограничить потребление углеводов до 300-400 г за счет углеводов, которые легко усваиваются (сахар, мед, сиропы и др.).
Кроме того, при активном туберкулезном процессе возможно увеличение вывода минералов из организма (кальций, калий, фосфор, хлорид натрия), поэтому в пищевой рацион больных необходимо вводить продукты, содержащие минералы в большом количестве (молоко, сыр, яйца, инжир, курага, изюм, мясо, рыба, орехи и др.).
Больные туберкулезом страдают от дефицита витаминов (особенно С, А и витаминов группы В). Введение в рацион достаточного количества аскорбиновой кислоты повышает свойства сыворотки крови уничтожать микобактерии туберкулеза, уменьшает интоксикацию. Особенно высока потребность в витамине С у больных кавернозными формами туберкулеза. Наряду с введением в диету достаточного количества овощей и фруктов больным необходимо периодически принимать до 300 мг аскорбиновой кислоты в сутки.
Повышенную потребность в витамине А (около 5 мг) испытывают больные туберкулезом легких, гортани, кишечника и кожи для улучшения свойств организма к заживлению. Им нужно употреблять молочные продукты, рыбий жир, яичный желток, продукты, содержащие каротин (морковь, томаты, абрикосы, красный перец и др.).
Особое значение имеют витамины группы В, которые прежде всего касаются белкового обмена: больной испытывает в них повышенную потребность. Наряду с введением в рацион продуктов, содержащих большое количество витаминов группы В (свежие овощи, мясо, блюда с отрубями, пивные или пекарские дрожжи), их принимают в виде препаратов в течение всего периода лечения.
Соблюдение для каждого больного индивидуального режима питания, а также гигиены и физических нагрузок (лечебная физкультура, прогулки) — необходимое условие успеха любого метода комплексного лечения туберкулеза.
ВПЕРЕДИ — СЕЗОН ПРОСТУД
Осень — традиционное время простуд, под которые так часто маскируется туберкулез. А значит, сейчас необходимо более внимательно относиться к своему здоровью.
А значит, сейчас необходимо более внимательно относиться к своему здоровью.
Туберкулез длительное время развивается в организме человека без каких-либо внешних признаков. В этот период микобактерия туберкулеза, попавшая в легкие, начинает размножаться там или в других органах, а иммунная система пытается остановить или замедлить этот процесс. Когда степень поражения органа достигает значительных размеров, человек начинает чувствовать недомогание и у него наблюдаются: кашель, длящийся больше 2-3 недель; обильное потоотделение ночью; слабость; необъяснимая потеря веса; повышение температуры тела до 37. и выше без видимой причины, длящееся неделю и дольше. В некоторых случаях могут быть кровохарканье, боль в грудной клетке, одышка.
Поэтому, если вы не убереглись и простудились, после чего появился хотя бы один из вышеперечисленных симптомов, не поленитесь обратиться к врачу, чтобы исключить туберкулез. А вообще сейчас самое время переосмыслить свой образ жизни: отказаться от вредных привычек, заняться физическими упражнениями, начать рационально питаться и перестать болеть!
Как принимать барсучий жир при туберкулёзе лёгких pulmono.
 ru
ruБарсучий жир при туберкулёзе используется уже несколько столетий. Этим веществом натирают спину и грудь больного, а также применяют для приготовления различных снадобий. Это абсолютно натуральное средство помогает быстро избавиться от симптомов туберкулёза и восстановить жизненные силы организма. Эффективность этого лекарственного средства обусловлена богатым составом. В барсучьем смальце есть много витаминов, микроэлементов и питательных веществ, которые крайне необходимы человеческому организму.
Полезные свойства
Барсучий жир активно применяется в народной медицине для лечения различных заболеваний дыхательных органов. Высокая эффективность этого средства доказана годами использования и многочисленными больными, которые быстро пошли на поправку.В конце осени барсуки впадают в продолжительную спячку. Перед этим зверьки усиленно питаются и накапливают излишки жира, который и помогает им выжить без еды несколько месяцев. В таком жиру содержится много питательных веществ и витаминов, поэтому польза его для человека просто неоценима.
Барсучий жир оказывает самое благоприятное воздействие на человеческий организм. Этот натуральный продукт обладает такими полезными свойствами:
- Активизирует кровообращение и обмен веществ.
- Улучшает функции пищеварительных органов.
- Хорошо очищает раны от гнойного содержимого и способствует их быстрому затягиванию.
- Губительно действует на многие виды бактерий, которые провоцируют развитие гнойных процессов.
- Способствует укреплению иммунитета.
- Губительно действует на микобактерии туберкулёза.
Смалец барсука рекомендуется принимать при различных заболеваниях. Особенно часто врачи прописывают этот продукт при патологиях дыхательных путей и при сильном истощении организма. Незаменимо это натуральное средство при лечении туберкулёза лёгких.
Несмотря на то, что лечение барсучьим жиром больше относится к рецептам народной медицины, квалифицированные врачи хорошо относятся к этому средству и часто прописывают его больным.
Противопоказания
Принимать жир барсука при туберкулёзе можно не во всех случаях. Есть ряд противопоказаний, которые необходимо знать и обязательно учитывать. Нельзя прибегать к подобному лечению в таких случаях:- В детском возрасте, если ребёнку ещё нет 6 лет. Организм маленьких детей не в силах переваривать такой тяжёлый продукт. Кроме того, нередко барсучий смалец приводит к тяжёлым аллергическим реакциям у малышей.
- При некоторых патологиях печени и поджелудочной железы. В этом случае тяжёлый, жирный продукт может привести к ухудшению состояния больного.
- На всех сроках беременности и при кормлении ребёночка грудью. Действие смальца на пациентов этих групп не было достаточно изучено, поэтому от лечения лучше отказаться.
- Если есть склонность к аллергии, то тоже не стоит экспериментировать. Любые высыпания на коже, а также диспепсические явления считаются строгим противопоказанием.
Начинать лечиться барсучьим жиром можно только по предписанию врача. При этом нужно понимать, что монолечение при туберкулёзе лёгких эффекта не даст, поэтому жиром можно только дополнить медикаментозное лечение.
При этом нужно понимать, что монолечение при туберкулёзе лёгких эффекта не даст, поэтому жиром можно только дополнить медикаментозное лечение.
Если во время лечения возникла тяжесть в желудке или появились кожные высыпания, препарат сразу прекращают принимать и обращаются к врачу.
Применение жира при туберкулёзе
Применение барсучьего жира при туберкулёзе лёгких рекомендуется не только народными знахарями, но и врачами традиционной медицины. Такое средство активно применялось для лечения патологий лёгких ещё нашими прадедами, когда медикаментов как таковых не было, и в основном лечились народными методами. В основном лечение туберкулёза сводилось к приёму барсучьего жира, как в чистом виде, так и в составе различных снадобий. Стоит понимать, что эффективность такого средства выше, если начинать его принимать при первых признаках инфицирования микобактериями.В составе смальца есть природный антибиотик, который губительно действует на разные виды болезнетворных бактерий и приводит к быстрому выздоровлению. Продукт не только убивает микобактерии, но и способствует очищению лёгких от вязкой слизи. Принимать такое лекарственное средство необходимо с первых симптомов и до полного выздоровления.
Продукт не только убивает микобактерии, но и способствует очищению лёгких от вязкой слизи. Принимать такое лекарственное средство необходимо с первых симптомов и до полного выздоровления.
Продолжительность лечения туберкулёза жиром барсука напрямую зависит от формы болезни и её запущенности.
Особенности лечения
Лечить туберкулёз лёгких барсучьим жиром желательно комплексно. Помимо приёма смальца внутрь, им следует регулярно растирать спину и грудь больного. После растирания торс оборачивают целлофаном и закутывают одеялом. Биологически активные вещества будут проникать в организм через поры кожи, благодаря чему выздоровление наступит быстрее.
Снадобье с какао и коньяком
Такое снадобье укрепляет иммунитет, уменьшает интенсивность кашля и ускоряет выздоровление. Для приготовления целебного состава следует взять такие компоненты:- 2 столовых ложки барсучьего жира.
- 2 столовых ложки какао-порошка.
- Крупный лист алоэ.

- Столовую ложку коньяка.
Лист алоэ промывают и измельчают на мясорубке. Барсучий жир предварительно оставляют при комнатной температуре на пару часов, чтобы он стал мягким. Все ингредиенты перемешивают до получения однородной массы.
Принимать такой состав можно взрослым по столовой ложке 4 раза в день. Деткам хватит десертной ложки, в день 3 раза. Принимать снадобье необходимо за полчаса до приёма пищи. Запивать его желательно горячим молоком.
Для приготовления лекарственного состава необходимо брать лист алоэ от растения, которому больше 2 лет.
С мёдом и чёрным шоколадом
Такое лекарственное средство для лечения туберкулёза понравится как взрослым, так и детям. Готовят его из таких компонентов:- Плитка чёрного шоколада – 100 граммов.
- Мёд – 4 столовых ложки.
- Барсучий жир 3 столовых ложки.
- Сок алоэ – 1 столовая ложка.
Все ингредиенты складывают в эмалированную мисочку и ставят на водяную баню. Проваривают состав до тех пор, пока он не станет однородным. После чего переливают в чистую баночку, которую хранят в холодильнике.
Проваривают состав до тех пор, пока он не станет однородным. После чего переливают в чистую баночку, которую хранят в холодильнике.
Принимать такую пасту нужно по 2 столовых ложки взрослым три раза в день. Для лечения деток хватит десертной ложки, кратность приёма как для взрослых.
Принимать такой лекарственный состав можно на протяжении месяца. После этого следует сделать перерыв 10 дней и при необходимости курс повторить.
Молоко с жиром
При туберкулёзе рекомендуется принимать и горячее молоко, с добавлением барсучьего жира. На стакан молока кладут чайную ложечку барсучьего смальца и столько же мёда. Пить такой состав желательно перед сном. Детям можно давать ½ стакана горячего напитка. Для улучшения вкуса в молоко можно добавить немного растворимого какао.
Барсучий жир можно принимать и в чистом виде, запивая его горячим молоком.
Лечение барсучьим жиром туберкулёза лёгких даёт хорошие результаты, особенно если таким народным методом дополнена традиционная терапия. Для большей эффективности желательно чередовать различные снадобья и напитки на основе натурального смальца. Не стоит забывать о регулярных растираниях больного.
Для большей эффективности желательно чередовать различные снадобья и напитки на основе натурального смальца. Не стоит забывать о регулярных растираниях больного.
ТУБЕРКУЛЕЗ КОВАРЕН, НО ИЗЛЕЧИМ
С начала 80-х годов по решению Всемирной организации здравоохранения 24 марта
ежегодно отмечается Всемирный день борьбы с туберкулезом – в день, когда
в 1882 году немецкий микробиолог Роберт Кох объявил об открытии
возбудителя туберкулеза.
С незапамятных времен человечество преследуют инфекционные болезни. Под натиском эпидемий чумы, холеры, тифа вымирали целые города. В ХХ веке врачи с этими болезнями научились достаточно успешно бороться, но побежден ли туберкулез? На этот и другие вопросы отвечает фтизиатр Нефтеюганской районной больницы Миляуша Карымова, по словам которой, благодаря лекарственным препаратам, созданным в ХХ веке, туберкулез 100% излечим.
– Туберкулез выявляется при флюорографическом обследовании, но снимок делается раз в год, а заразиться можно в любое время. Какие симптомы позволяют заподозрить туберкулез и к какому врачу обращаться?
– Чаще всего после инфицирования микобактериями туберкулеза заболевание протекает бессимптомно, но примерно один из десяти случаев переходит в активную форму. Классические симптомы туберкулезной инфекции – длительный кашель с выделением мокроты, слабость, утомляемость, беспричинное снижение веса более 10 кг в год. Часто происходит повышение температуры до 37-37, 2°С. Однако туберкулез поражает не только легкие, но и все органы и ткани, кроме волос и ногтей. Когда есть какие-то симптомы, в первую очередь надо обратиться в поликлинику к участковому терапевту или педиатру. Но если нет возможности попасть к этим специалистам, то обратиться можно напрямую к фтизиатру.
– Есть ли прививка от туберкулеза?
– Да, основной профилактикой является вакцина БЦЖ, которая надежно защищает детское население России. В соответствии с национальным календарем профилактических прививок вакцина БЦЖ ставится на третьи-седьмые сутки после рождения в роддоме и дальнейшая ревакцинация проводится в семь лет. Взрослых же не прививают.
В соответствии с национальным календарем профилактических прививок вакцина БЦЖ ставится на третьи-седьмые сутки после рождения в роддоме и дальнейшая ревакцинация проводится в семь лет. Взрослых же не прививают.
– В Нефтеюганском районе ежегодно туберкулез выявляется у 20-30 человек: в 2015 году – 28 человек, в 2016-м – 18. Новички в основном прибывают за счет освободившихся из исправительных учреждений – четыре человека в 2016 году. Много пациентов, которых направляет врач-инфекционист. Это 50% от стоящих на учете – людей, страдающих активной формой туберкулеза, 38 человек.
Это немного, в сравнении с 2010 годом, когда состояло на учете 75 человек «активных», вот это много даже для общей численности населения района. Я работаю 13 лет в Нефтеюганской районной больнице, приехала как раз в тот момент, когда в Лемпино болели 20 человек, в основном коренных жителей, взрослые, дети. Диагностировали туберкулез глаз, костей, внутригрудных лимфоузлов – все сельчане выздоровели. Потом были заболевания в Чеускино, Каркатеевы, Усть-Югане, Юганской Оби. Сейчас высокая заболеваемость в Салыме, Куть-Яхе, Сингапае. Территории меняются быстро, без какой-либо объяснимой тенденции. У заболевших похожий, часто асоциальный, образ жизни: не имеют постоянного места жительства, едят и употребляют алкогольные продукты вместе, заражаются друг от друга и заболевают уже не один из десяти, а все десять!
Потом были заболевания в Чеускино, Каркатеевы, Усть-Югане, Юганской Оби. Сейчас высокая заболеваемость в Салыме, Куть-Яхе, Сингапае. Территории меняются быстро, без какой-либо объяснимой тенденции. У заболевших похожий, часто асоциальный, образ жизни: не имеют постоянного места жительства, едят и употребляют алкогольные продукты вместе, заражаются друг от друга и заболевают уже не один из десяти, а все десять!
В 2015 году в Пойковском болели восемь человек, в Каркатеевы – двое, в Салыме – пять.
– Это все местные жители или прибывшие?
– Год назад было много пациентов – беженцев из Украины – все пролечены в стационарах. Каждый год прибывают лица из исправительных учреждений, причем с тяжелыми формами туберкулеза, множественной лекарственной устойчивостью – они и являются основными источниками инфекции.
– В Лемпино, чтобы побороть туберкулез, даже открывали дневной стационар. Что делается сейчас?
– Всех пациентов с активной формой туберкулеза стараемся госпитализировать в 100% случаев в стационары, где они проходят курс лечения 8-10 месяцев. Тем самым мы снизили заболеваемость до 38 активных пациентов только за счет госпитализации. После стационара – санаторно-курортное лечение.
Тем самым мы снизили заболеваемость до 38 активных пациентов только за счет госпитализации. После стационара – санаторно-курортное лечение.
Пиковая заболеваемость туберкулезом отмечалась в 2010 году. Мы впервые выявили 40 человек, при этом на учете уже было около 80. Потом заболеваемость постепенно снижалась благодаря профилактике. Началась пропаганда здорового образа жизни, люди меньше стали употреблять алкоголь, улучшили жилищно-бытовые условия, устроились на работу. Но главное – в практику вошло контролируемое лечение пациентов: назначенные препараты человек принимает в кабинете врача, под его контролем. Благодаря этому число выздоровевших увеличилось в разы. В 2010 году они стояли на учете по три-пять лет по активной форме, с введением контроля вскоре 50% были переведены в здоровую группу.
– И как часто ходят к врачу?
– Каждый день. Обязательно получают бесплатное санаторно-курортное лечение, где могут находиться до трех месяцев. В это время их оздоравливают, кормят, обучают здоровому образу жизни.
После излечения они переводятся в здоровую группу, где наблюдаются в течение трех лет и обследуются каждые полгода, получают противорецидивное лечение – только потом их снимают с учета, примерно 15-16 человек ежегодно. К сожалению, среди больных есть социально-дезадаптированные люди, которые не принимают таблетки ни на дому, ни в поликлинике.
– И много таких? Как вы с ними работаете?
– Хронические пациенты принудительно госпитализируются в стационар, но в связи с тем, что и там нарушают режим, их часто выписывают за самовольный уход из отделения. Они возвращаются домой, и продолжается все то же: употребляют алкоголь и наркотические вещества, не лечатся. Их у нас мало, но один такой больной в год заражает около десяти человек, из которых как минимум один житель точно заболевает туберкулезом. А если это тяжелая форма с множественной лекарственной устойчивостью – лечение долгое и дорогое. У нас из 38 человек с активной формой 18 имеют множественную лекарственную устойчивость. В таких случаях до полного выздоровления нужно около полутора лет непрерывного лечения: каждый день по четыре-шесть, а для некоторых – до 15 таблеток все полтора года!
В таких случаях до полного выздоровления нужно около полутора лет непрерывного лечения: каждый день по четыре-шесть, а для некоторых – до 15 таблеток все полтора года!
– Люди за это время меняются?
– Большинство пациентов осознают, что болеют, если стимулы высоки, они и выздоравливают за полтора года. За это время они становятся для нас почти родными. Мы с ними проводим беседы, во время лечения посещаем на дому, помогаем морально и материально. Иногда у них нет продуктов питания – мы сами покупаем. Если у человека нет документов, он не может получить государственную помощь – даем деньги на проезд до стационара или санатория – нам важно, чтобы они прошли курс лечения и больше не представляли опасности для окружающих. Со временем у них меняется отношение к нам, себе, государству: они становятся ответственнее, начинают работать, вести здоровый образ жизни.
– Ваши пациенты – люди какого возраста?
– Заболевают в основном от 18 до 44 лет, в последние годы чаще стали болеть пожилые, неработающие пенсионеры. По структуре занятости среди заболевших неработающих примерно 65%, 25% – пенсионеры, оставшийся небольшой процент – работающее население. Видимо, настолько тяжело жить на одну пенсию, что экономят на питании, а ослабленные заболевают первыми.
По структуре занятости среди заболевших неработающих примерно 65%, 25% – пенсионеры, оставшийся небольшой процент – работающее население. Видимо, настолько тяжело жить на одну пенсию, что экономят на питании, а ослабленные заболевают первыми.
– Но туберкулезом болеют и вполне благополучные, хорошо устроенные в жизни…
– Это случается и, скорее всего, связано со стрессовыми ситуациями в жизни. И, конечно, при контакте с туберкулезными больными – на работе, дома или в гостях.
Мы не допускаем больных пациентов на предприятия общепита, в детские учреждения, но по остальным профессиям ограничений нет. Бывают случаи, когда на работу берут без медосмотра или договора – в итоге сотрудники заражаются.
– Как можно заразиться?
– Туберкулез передается воздушно-капельным путем: в мокроте и слюне в среднем два-три миллиона микобактерий. При близком контакте туберкулезные палочки заглатываются, попадают в лимфатическую
систему, оттуда – в кровеносную, по ней – в ослабленные органы. У нас встречаются туберкулез легких, лимфоузлов, костей. У ВИЧ-инфицированных чаще других поражаются костная, центральная нервная, мочеполовая и пищеварительная системы.
У нас встречаются туберкулез легких, лимфоузлов, костей. У ВИЧ-инфицированных чаще других поражаются костная, центральная нервная, мочеполовая и пищеварительная системы.
– Миляуша Шаукатовна, расскажите, как проходит лечение больных? Есть ли универсальная система?
– Каждый больной лечится индивидуально. ВИЧ-инфицированные – непременно в стационаре, кроме того, получают бесплатно высокотехнологичную хирургическую медицинскую помощь и протезирование в НИИ Тюмени и Екатеринбурга. Без лечения они могут умереть от генерализации процесса: из зараженного органа с кровотоком возбудитель проникает в другие органы и ткани. Только операция, металлосинтез и прием противотуберкулезных препаратов позволяют им восстановить здоровье и трудовую деятельность.
Лет 20 назад пациенту нужно было принимать 15-16 таблеток одномоментно, сейчас – четыре-шесть. Из народных средств только мед убивает туберкулезную палочку, барсучий, медвежий жир – укрепляют организм, но на возбудитель не действуют.
– Летальные исходы среди больных туберкулезом случаются?
– Один-два человека в год, в основном ВИЧ-инфицированные.
– Если не лечиться, в какие временные рамки укладывается жизнь от заражения до смерти?
– Если у человека много вредных привычек, от начала заболевания до смерти может пройти около двух лет. У ВИЧ-инфицированных – два-три месяца – человек сгорает полностью, резко заболевает туберкулезом – и уже не спасти. Были случаи, люди жили и по пять лет – у них не было вредных привычек, но и лечиться не хотели.
– Почему?
– Пессимистически были настроены, а заставить нельзя.
– Фтизиатрический кабинет только в Пойковском, а в поселениях нагрузка ложится на местных врачей?
– В районе десять амбулаторий, ФАП в Лемпино – врачи общей практики помогают нам. А когда лечение доступно, то оно эффективно.
– Здоровы ли сейчас жители юрт?
– Последние три года нет ни одного пациента из коренных жителей. У них повысился уровень жизни, улучшились материально-бытовые условия, они меньше пьют, им доступны различные продукты питания, витамины.
У них повысился уровень жизни, улучшились материально-бытовые условия, они меньше пьют, им доступны различные продукты питания, витамины.
– Статистика заболеваемости туберкулезом снижается, можно ли окончательно с ним справиться?
– Я считаю, что если человек будет проходить флюорографию раз в год, то он предотвратит заражение себя и других людей. Тогда не будет ни запущенных случаев, ни увеличения показателей смертности, будет снижаться заболеваемость.
Ведь выявленный в течение года туберкулез вылечивается быстро и легко. После двух лет болезнь поддается намного труднее из-за распространившихся процессов. В Нефтеюганском районе больше тысячи человек не проходили флюорографию более двух лет… Они сами являются группой риска, из этих же людей мы выделяем тех, у кого туберкулез с уже распространенной формой выявлен впервые.
– Миляуша Шаукатовна, спасибо за диалог. Желаем Вам и фтизиатрам всего мира абсолютной победы над туберкулезом.
Чем полезен барсучий жир и нужен ли он вам
Барсучий жир — штука крайне негуманная: чтобы его получить, животное убивают. К тому же он обладает весьма сомнительной полезностью.
Лайфхакер выяснил подробности о популярном ингредиенте старых народных рецептов.
Как использовали барсучий жир
Знаешь ли ты, что жир барсука от всяких болезней помогает? Живот у человека больной — барсучий жир пьёт, чахоткой заболеет — опять жир пьёт, ногу кто косой порежет — перво‑наперво жиром заливает…
Из книги «Записки натуралиста» советского зоолога и писателя Евгения Спангенберга
Собственно, Спангенберг пересказал свойства, которые приписывали барсучьему жиру жители Сибири и Дальнего Востока.
Зимой охотники смазывали им кожу рук и лица, чтобы защититься от обветривания и обморожений. Позже люди заметили, что под слоем жира быстрее заживают царапины, и начали применять его для лечения ран и болезней кожи. Им растирали нос и грудь при простуде. Всё тело — при болях в суставах и отёчности.
Им растирали нос и грудь при простуде. Всё тело — при болях в суставах и отёчности.
Отдельно стоит отметить употребление барсучьего жира при чахотке — туберкулёзе. Оно не лишено оснований: до изобретения антибиотиков туберкулёзный очаг в лёгких действительно более‑менее успешно подавляли приёмом жира. Действовал следующий механизм: жирные кислоты, принесённые в лёгкие кровью, окислялись и подменяли собой схожие с ними аминокислоты, из которых состоит клеточная стенка туберкулёзной бактерии — палочки Коха. Стенки бактерий повреждались, микробы теряли активность, недуг отступал.
Однако современные препараты действуют намного активнее. Поэтому лечение барсучьим жиром — пережиток прошлого. И это ключевой момент.
Барсучий жир был незаменим в отсутствие аптек и адекватной медицинской помощи. Но использовать его сегодня — значит игнорировать все достижения цивилизации.
Чем полезен барсучий жир и кому он нужен (спойлер: точно не вам)
Полезные вещества в барсучьем жире действительно есть. Перечислим их (исключительно в информационных целях).
Перечислим их (исключительно в информационных целях).
- Полиненасыщенные жирные кислоты омега‑3, омега‑6 и омега‑9. Они относятся к незаменимым: человек может получить их только с пищей.
- Вещества‑антиоксиданты . Они борются со свободными радикалами, которые повреждают молекулы органов и тканей.
- Витамины А, группы В, Е.
В целом выглядит полезненько: хоть снаружи, хоть внутрь. Но концентрация всех этих полезностей не настолько велика, чтобы ради них стоило лишать жизни 20‑килограммового барсука. К тому же и жирные кислоты, и антиоксиданты, и витамины можно получить из пищи или из биодобавок, которые при необходимости с радостью пропишет вам терапевт.
Собственно, поэтому не существует международно признанных исследований, которые анализировали бы пользу барсучьего жира и его влияние на человеческий организм.
Вердикт: если у вас есть доступ к аптечным средствам и медицинскому сервису, лучше оставить барсучье барсукам.
Это и рациональнее, и человечнее.
Читайте также 🦡🥄🐟
ТипированиеДНК изолятов Mycobacterium bovis из барсуков (Meles meles), выращенных в районах Ирландии с различным уровнем распространения туберкулеза
барсуков ( Meles meles ) были причастны к передаче Mycobacterium bovis и инфекции крупного рогатого скота в Ирландии. ВЕЛИКОБРИТАНИЯ. Недавние исследования в Ирландии показали, что, хотя это заболевание является эндемическим для барсуков, его распространенность неоднородна по всей стране и может варьироваться в зависимости от субпопуляций.Степень, в которой уровни распространенности барсуков влияют на распространенность крупного рогатого скота, неизвестна. Ранее фингерпринтинг ДНК показал, что типов штаммов M. bovis являются общими для барсуков и крупного рогатого скота, и что существует большое количество типов штаммов, циркулирующих у этих двух видов. В этом исследовании мы провели сполиготипирование и анализ тандемных повторов с переменным числом тандемных повторов (VNTR) изолятов M. bovis из двух групп барсуков, представляющих обширный географический район, с разными уровнями распространенности туберкулеза.Результаты типирования показывают, что не существует географической кластеризации типов штаммов, связанных с распространенностью. Однако были идентифицированы два профиля VNTR, которые, по-видимому, связаны с высоким и низким уровнями инфицирования M. bovis соответственно с высокой и низкой распространенностью. Кроме того, сполиготипирование и анализ VNTR впервые предоставили доказательства множественных инфекций отдельных барсуков различными штаммами M. bovis .
В этом исследовании мы провели сполиготипирование и анализ тандемных повторов с переменным числом тандемных повторов (VNTR) изолятов M. bovis из двух групп барсуков, представляющих обширный географический район, с разными уровнями распространенности туберкулеза.Результаты типирования показывают, что не существует географической кластеризации типов штаммов, связанных с распространенностью. Однако были идентифицированы два профиля VNTR, которые, по-видимому, связаны с высоким и низким уровнями инфицирования M. bovis соответственно с высокой и низкой распространенностью. Кроме того, сполиготипирование и анализ VNTR впервые предоставили доказательства множественных инфекций отдельных барсуков различными штаммами M. bovis .
1. Введение
В Ирландии (RoI) и Великобритании туберкулез (TB) присутствует в популяциях барсуков [1]; инфицированные барсуки считаются поддерживающими хозяевами и непосредственно участвуют в передаче Mycobacterium bovis крупному рогатому скоту [2]. В РИ, как часть среднесрочной стратегии борьбы с туберкулезом крупного рогатого скота, барсуки удаляются (очаговая выбраковка), когда эпидемиологическое расследование связывает поражение туберкулезом стада крупного рогатого скота с присутствием инфицированных барсуков. Исследования с использованием всестороннего патологоанатомического обследования и бактериального посева тканей показали, что у этих забитых барсуков распространенность инфекции составляет 36-50% [3] (Corner, неопубликовано).
В РИ, как часть среднесрочной стратегии борьбы с туберкулезом крупного рогатого скота, барсуки удаляются (очаговая выбраковка), когда эпидемиологическое расследование связывает поражение туберкулезом стада крупного рогатого скота с присутствием инфицированных барсуков. Исследования с использованием всестороннего патологоанатомического обследования и бактериального посева тканей показали, что у этих забитых барсуков распространенность инфекции составляет 36-50% [3] (Corner, неопубликовано).
В недавнем сравнительном исследовании мы определили распространенность инфекции у барсуков в районах с исторически и стабильно низкой распространенностью инфекции крупного рогатого скота [4].Барсуки были удалены с географически удаленных участков, и все они были исследованы с использованием подробных патологоанатомических и бактериологических процедур. У этих барсуков была обнаружена значительно меньшая распространенность инфекции M. bovis , чем у барсуков, удаленных во время очаговой выбраковки. Хотя результаты подтвердили использование крупного рогатого скота в качестве дозорных для туберкулеза у барсуков, они также подняли вопросы о природе инфекции M. bovis у барсуков в популяциях с высокой и низкой распространенностью. Одна из возможностей для различных уровней распространенности заключается в том, что штаммы M.bovis , циркулирующие в этих популяциях, различаются по вирулентности и способности передаваться от барсука к барсуку и от барсука к крупному рогатому скоту. Хотя о потенциале вирулентности полевых изолятов M. bovis известно очень мало, ДНК-фингерпринтинг штаммов был использован для изучения динамики туберкулеза у животных и изучения связей между инфекциями у сельскохозяйственных и диких видов [5, 6] . Эти исследования выявили множество различных штаммов, циркулирующих в популяциях крупного рогатого скота в RoI и Великобритании, хотя подробный анализ показал, что более 99% штаммов происходят из единого клонального комплекса под названием Eu1 [7].
Хотя результаты подтвердили использование крупного рогатого скота в качестве дозорных для туберкулеза у барсуков, они также подняли вопросы о природе инфекции M. bovis у барсуков в популяциях с высокой и низкой распространенностью. Одна из возможностей для различных уровней распространенности заключается в том, что штаммы M.bovis , циркулирующие в этих популяциях, различаются по вирулентности и способности передаваться от барсука к барсуку и от барсука к крупному рогатому скоту. Хотя о потенциале вирулентности полевых изолятов M. bovis известно очень мало, ДНК-фингерпринтинг штаммов был использован для изучения динамики туберкулеза у животных и изучения связей между инфекциями у сельскохозяйственных и диких видов [5, 6] . Эти исследования выявили множество различных штаммов, циркулирующих в популяциях крупного рогатого скота в RoI и Великобритании, хотя подробный анализ показал, что более 99% штаммов происходят из единого клонального комплекса под названием Eu1 [7]. В предыдущих исследованиях генотипирование 452 изолятов M. bovis с помощью анализа полиморфизма длины рестрикционных фрагментов (RFLP) в RoI показало, что наиболее распространенные типы RFLP широко распространены и присутствуют как у крупного рогатого скота, так и у барсуков [8]. Взаимосвязь между штаммами, выделенными от крупного рогатого скота и барсуков на больших территориях, показала, что барсуки и крупный рогатый скот, как правило, имели сходные штаммы, что согласуется с общностью штаммов M. bovis на территории и предоставляет доказательства межвидовой передачи [9].
В предыдущих исследованиях генотипирование 452 изолятов M. bovis с помощью анализа полиморфизма длины рестрикционных фрагментов (RFLP) в RoI показало, что наиболее распространенные типы RFLP широко распространены и присутствуют как у крупного рогатого скота, так и у барсуков [8]. Взаимосвязь между штаммами, выделенными от крупного рогатого скота и барсуков на больших территориях, показала, что барсуки и крупный рогатый скот, как правило, имели сходные штаммы, что согласуется с общностью штаммов M. bovis на территории и предоставляет доказательства межвидовой передачи [9].
Разработка методов молекулярного типирования штаммов для дифференциации штаммов M. bovis значительно расширила возможности проведения эпидемиологических исследований передачи болезней среди диких животных и домашнего скота [10]. В RoI комбинация сполиготипирования и типирования MIRU-VNTR оказалась лучше любого теста по отдельности в выявлении разнообразия штаммов M. bovis , циркулирующих у крупного рогатого скота и барсуков [11]. В настоящем исследовании мы применили комбинацию сполиготипирования и MIRU-VNTR-типирования M.изоляты bovis от барсуков в районах с высокой и низкой распространенностью туберкулеза крупного рогатого скота; Цель заключалась в том, чтобы выяснить, связаны ли одинаковые или разные типы штаммов с уровнем распространенности инфекции в этих популяциях.
В настоящем исследовании мы применили комбинацию сполиготипирования и MIRU-VNTR-типирования M.изоляты bovis от барсуков в районах с высокой и низкой распространенностью туберкулеза крупного рогатого скота; Цель заключалась в том, чтобы выяснить, связаны ли одинаковые или разные типы штаммов с уровнем распространенности инфекции в этих популяциях.
2. Материалы и методы
2.1. Отбор барсуков из разных популяций по распространенности
Группа низкой распространенности (LP). Подробный процесс отбора для определения поселений барсуков в районах страны с самой низкой распространенностью туберкулеза крупного рогатого скота в стаде был описан в другом месте [4].Вкратце, в процессе использовалась ирландская национальная база данных по болезням крупного рогатого скота (компьютерная система здоровья животных, AHCSI), географическая база данных Системы идентификации земельных участков (LPIS) и аналитическое программное обеспечение географических информационных систем (GIS). Барсуки были обнаружены в районах со стадами, где исторически была низкая распространенность туберкулеза среди крупного рогатого скота (<2 стандартных реакторов за предыдущие 5 лет). Поскольку барсук является охраняемым видом в Ирландии, возможность отбраковки животных строго ограничена из-за отсутствия явных признаков наличия болезни.Поскольку участки LP не подходят для рутинной выбраковки барсуков, нам был предоставлен доступ только к барсукам на территории LP на очень ограниченной основе, и нам было запрещено собирать одного барсука на участок с активными наборами.
Барсуки были обнаружены в районах со стадами, где исторически была низкая распространенность туберкулеза среди крупного рогатого скота (<2 стандартных реакторов за предыдущие 5 лет). Поскольку барсук является охраняемым видом в Ирландии, возможность отбраковки животных строго ограничена из-за отсутствия явных признаков наличия болезни.Поскольку участки LP не подходят для рутинной выбраковки барсуков, нам был предоставлен доступ только к барсукам на территории LP на очень ограниченной основе, и нам было запрещено собирать одного барсука на участок с активными наборами.
Районы (участки с низкой распространенностью) были выявлены в 24 различных округах. Эти районы были обследованы на предмет скопления барсуков или признаков активности барсуков, и 138 районов были признаны активными. На этих участках проводился отлов, и один барсук был удален из 101 участка вблизи поселков, где обитали барсучки.Затем барсук был умерщвлен и подвергнут детальному вскрытию трупа с забором пулов тканей для бактериальной культуры. Зараженные барсуки были обнаружены в 10 различных округах, в результате чего показатель распространенности инфекции в этих популяциях барсуков составил 15,8%.
Зараженные барсуки были обнаружены в 10 различных округах, в результате чего показатель распространенности инфекции в этих популяциях барсуков составил 15,8%.
Группа высокой распространенности (HP) . Для сравнения, барсуки () были получены в результате операций по выбраковке, связанных с падением стада крупного рогатого скота, и были получены из районов в 16 различных округах в РИ [3]. Размеры социальных групп варьировались от 1 до 7 со средним значением 1.62 и медиана 1. Не было значительных различий в распространенности инфекции между социальными группами разного размера [3]. Распространенность инфекции M. bovis в этой популяции составила 36,3%.
2.2. Патологоанатомическое исследование
Отловленных барсуков анестезировали гидрохлоридом кетамина (0,1 мл / кг) и медетомидином (Domitor; 0,1 мл / кг), а затем подвергали эвтаназии передозировкой пентабарбитона натрия внутривенно. Барсуки были подвергнуты тщательному вскрытию, включая исследование на предмет укусов и ран. Для патологоанатомического исследования тушу поместили в положение лежа на спине на стол с нисходящим потоком (Astec Microflow). Чтобы свести к минимуму риск перекрестного заражения, отдельные стерильные инструменты использовались для обнажения лимфатических узлов, для открытия брюшной и грудной полостей, а также для обнажения и отделения свободных лимфатических узлов от окружающего жира и соединительной ткани, а также для сбора срезов висцеральных органов. . От каждого барсука 20 отдельных образцов лимфатических узлов и образцов почек, селезенки и печени были культивированы в виде пулов (лимфатические узлы головы, туши и грудной клетки, лимфатические узлы и органы брюшной полости, а также легкие) и любые раны от укусов, подкожные абсцессы или предполагаемые грубые поражения. культивировали отдельно [3, 4].Все образцы перед культивированием хранили при -20 ° C.
Для патологоанатомического исследования тушу поместили в положение лежа на спине на стол с нисходящим потоком (Astec Microflow). Чтобы свести к минимуму риск перекрестного заражения, отдельные стерильные инструменты использовались для обнажения лимфатических узлов, для открытия брюшной и грудной полостей, а также для обнажения и отделения свободных лимфатических узлов от окружающего жира и соединительной ткани, а также для сбора срезов висцеральных органов. . От каждого барсука 20 отдельных образцов лимфатических узлов и образцов почек, селезенки и печени были культивированы в виде пулов (лимфатические узлы головы, туши и грудной клетки, лимфатические узлы и органы брюшной полости, а также легкие) и любые раны от укусов, подкожные абсцессы или предполагаемые грубые поражения. культивировали отдельно [3, 4].Все образцы перед культивированием хранили при -20 ° C.
2.3. Культура
M. bovis , экстракция ДНК и сполиготипирование. Образцы культивировали на селективных микобактериальных средах, как описано Murphy et al. [3, 4]. Для целей данного исследования барсук считался инфицированным, когда M. bovis было выделено с помощью бактериальной культуры из любого образца. Множественные колонии, образованные из каждого образца ткани, соскребали с твердой среды и переносили в одну микропробирку, содержащую 500 мкл л фосфатно-солевого буфера с твином 20 (PBS-Tw) (Sigma Aldrich, Wicklow, Ирландия).ДНК экстрагировали тепловым лизированием клеток, как описано McLernon et al. (2010) [11]. ДНК-матрицу хранили при -20 ° C. Сполиготипирование проводили по методу, описанному Kamerbeek et al. [12], за исключением того, что использовалась система мечения и обнаружения дигоксигенина (Roche Diagnostics, West Sussex). Образцам сполиготипов были даны имена, присвоенные в базе данных сполиготипирования M. bovis на http://www.mbovis.org/.
[3, 4]. Для целей данного исследования барсук считался инфицированным, когда M. bovis было выделено с помощью бактериальной культуры из любого образца. Множественные колонии, образованные из каждого образца ткани, соскребали с твердой среды и переносили в одну микропробирку, содержащую 500 мкл л фосфатно-солевого буфера с твином 20 (PBS-Tw) (Sigma Aldrich, Wicklow, Ирландия).ДНК экстрагировали тепловым лизированием клеток, как описано McLernon et al. (2010) [11]. ДНК-матрицу хранили при -20 ° C. Сполиготипирование проводили по методу, описанному Kamerbeek et al. [12], за исключением того, что использовалась система мечения и обнаружения дигоксигенина (Roche Diagnostics, West Sussex). Образцам сполиготипов были даны имена, присвоенные в базе данных сполиготипирования M. bovis на http://www.mbovis.org/.
2.4. Типирование VNTR
Типирование VNTR было выполнено с использованием шести локусов; 2163a (альтернативное имя, QUB 11a), 2163b (альтернативное имя, QUB 11b), 2165 (альтернативное имя, ETR A), 2996 (альтернативное имя, MIRU 26), 4052 (альтернативное имя QUB26) и 1895. Шесть геномных локусов амплифицировали отдельно с использованием праймеров и процедур полимеразной цепной реакции (ПЦР), описанных McLernon et al. [11]. После завершения ПЦР амплифицированные продукты хранили при -18 ° C до анализа с использованием MegaBACE 1000 (GE Healthcare Life Sciences), как описано McLernon et al. [11].
Шесть геномных локусов амплифицировали отдельно с использованием праймеров и процедур полимеразной цепной реакции (ПЦР), описанных McLernon et al. [11]. После завершения ПЦР амплифицированные продукты хранили при -18 ° C до анализа с использованием MegaBACE 1000 (GE Healthcare Life Sciences), как описано McLernon et al. [11].
2,5. Статистический анализ
Сравнение линий барсуков проводилось между районами, а не отдельными особями в пределах районов. Данные анализировали с помощью GraphPad Prism (GraphPad Software, США, http: // www.graphpad.com/). Для анализа географического распределения сполиготипов использовался критерий хи-квадрат.
3. Результаты
3.1. Географическое распределение барсуков и распространение инфекции среди барсуков
В популяциях с высокой (HP) и низкой (LP) распространенностью инфицированные животные были получены вблизи активных поселений на обширной географической территории, в 16 округах для группы HP и 10 округов для населения LP. Это минимизировало влияние географических кластеров инфекции и определенных типов штаммов.Всего было типизировано 51 изолятов от 36 барсуков в популяции HP (в среднем 1,4 изолята на барсука, диапазон 1–3) и 42 изолята от 16 барсуков в популяции LP (в среднем 2,6 изолята на барсука, диапазон 1–5). Два или более изолята были получены от 20 барсуков: 2 пула тканей были положительными у 11 барсуков, 3 пула — у 2 барсуков и ≥4 пулов — у 7 барсуков. Пять барсуков были коинфицированы двумя разными штаммами: 3 из группы HP и 2 из группы LP.
Это минимизировало влияние географических кластеров инфекции и определенных типов штаммов.Всего было типизировано 51 изолятов от 36 барсуков в популяции HP (в среднем 1,4 изолята на барсука, диапазон 1–3) и 42 изолята от 16 барсуков в популяции LP (в среднем 2,6 изолята на барсука, диапазон 1–5). Два или более изолята были получены от 20 барсуков: 2 пула тканей были положительными у 11 барсуков, 3 пула — у 2 барсуков и ≥4 пулов — у 7 барсуков. Пять барсуков были коинфицированы двумя разными штаммами: 3 из группы HP и 2 из группы LP.
3.2. Сполиготипирование
M.bovis Изоляты у барсуков HP и LP Было выявлено 9 различных сполиготипов у барсуков, 7 типов у барсуков 36 HP и 4 среди 16 барсуков LP. SB0140 был наиболее распространенным сполиготипом в обеих популяциях барсуков и, за исключением SB0130, единственным сполиготипом, общим для этих двух групп (Таблица 1). Не было никаких свидетельств географической кластеризации SB0140, поскольку он был обнаружен во всех регионах, откуда были получены барсуки для каждой группы. Достоверной разницы (тест,) в доле барсуков, инфицированных этим сполиготипом, между группами не было, он присутствовал в 13 из 16 (81.3%) барсуков LP-популяции и 24 из 36 (66,7%) барсуков HP-группы.
Достоверной разницы (тест,) в доле барсуков, инфицированных этим сполиготипом, между группами не было, он присутствовал в 13 из 16 (81.3%) барсуков LP-популяции и 24 из 36 (66,7%) барсуков HP-группы.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 4. Коинфекция барсуков множественными типами штаммов M. bovis 4. Коинфекция барсуков множественными типами штаммов M. bovis Пять барсуков были коинфицированы двумя разными штаммами: 3 из группы HP и два из группы LP (таблица 3). У двух из этих штаммов барсуки были дифференцированы с помощью сполиготипирования, в то время как остальные три были коинфицированы штаммами, несущими сполиготип SB0140, которые были дифференцированы с помощью анализа VNTR. Между коинфицированными барсуками не было пространственной взаимосвязи, каждое животное происходило из разных мест.У одного барсука, принадлежащего к группе LP, один из штаммов соинфекции был выделен из поражения, описанного как «увеличенный поднижнечелюстной лимфатический узел». Распределение инфицированных тканей, из которых был изолирован штамм соинфекции (таблица 3), не выявило каких-либо участков предрасположенности.
4. Обсуждение Обсуждение В RoI исследования распространенности у барсуков, проведенные с использованием подробного патологоанатомического и бактериологического исследования, показали, что распространенность инфекции M. bovis , в районах, связанных с высокой распространенностью инфекции крупного рогатого скота, значительно выше, чем в областях с низкая распространенность инфекции крупного рогатого скота [3, 4]. Хотя могут быть различные эпидемиологические факторы, ответственные за эти различия в распространенности, большинство из которых не совсем очевидны, один вопрос, который можно решить, заключается в возможности того, что различия в распространенности связаны со штаммами, циркулирующими в популяции барсуков.В этом исследовании штаммов M. bovis , несущих сполиготип SB0140, преобладали среди групп барсуков HP и LP. В предыдущем исследовании приблизительно 50% из 386 штаммов, в основном крупного рогатого скота и барсуков, имели этот сполиготип [11]. В настоящем исследовании доля штаммов, несущих сполиготип SB0140, была выше, особенно среди LP-группы барсуков, где 81,3% штаммов принадлежали к этому типу. Когда анализ VNTR использовался для дальнейшей дифференциации штаммов, наибольшее количество профилей VNTR было обнаружено у штаммов SB0140, за которыми следовало SB0130. Это согласуется с анализом гораздо большего числа изолятов крупного рогатого скота, барсуков и оленей [11].Наиболее интригующим результатом настоящего исследования было неравное представление двух профилей VNTR штаммов SB0140 между группами HP и LP барсуков. Наблюдение за тем, что эти профили имеют широкое географическое распространение, предполагает, что их частота встречаемости не связана с недавней локальной клональной экспансией определенного типа штамма. Обнаружение барсуков, коинфицированных разными штаммами M. Коинфекция разными типами штаммов может не быть связана с распространенностью среди населения, поскольку она была обнаружена в каждой группе распространенности.Барсук, являющийся носителем нескольких штаммов, вероятно, является результатом нескольких случаев передачи, поскольку аэрозольные инфекции являются результатом единичных бактериальных клонов [14]. Источником множественных инфекций, вероятно, была передача от других барсуков той же социальной группы или от барсуков-иммигрантов. Было замечено, что в районах, где барсуки убивали в последующие годы, профили штаммов RFLP M. У инфицированных барсуков высокая распространенность легочной инфекции убедительно свидетельствует о том, что легкие являются основным местом первичной инфекции, а вдыхание инфекционных аэрозольных частиц является основным путем передачи. Однако известны и другие пути передачи, включая передачу через инфицированные раны от укусов [3]. Распределение разных типов VNTR у каждого коинфицированного барсука не давало информации для определения возможного пути заражения. Трансмиссия и обслуживание M.bovis в популяциях барсуков — это сложный процесс, в котором многие факторы влияют на распространенность внутри популяции и скорость передачи. Вероятно, инфекционная доза каждого штамма могла определять уровень его распространения в организме. Результаты этого исследования предоставляют дополнительные доказательства экстерриториального перемещения барсуков и различения линий путем сполиготипирования, а анализ VNTR показывает, что взаимодействия между барсуками могут приводить к коинфекциям отдельных барсуков с разными штаммами.Идентификация различных профилей VNTR также предполагает, что разные штаммы могут быть связаны с местной распространенностью инфекции. В настоящее время проводятся полевые испытания вакцинации барсуков вакциной БЦЖ [18]. Хотя было продемонстрировано, что БЦЖ эффективна для защиты содержащихся в неволе барсуков от экспериментальной инфекции M. bovis , еще предстоит определить, одинаково ли эффективна вакцина против многих типов штаммов M. bovis , обнаруженных у барсуков [19] . Выражение признательности Эта работа финансировалась в рамках гранта Европейского Союза по проекту 7, № KBBE-2007-1, TB-Step) при поддержке Министерства сельского хозяйства, продовольствия и морской пищевой программы ERAD. Происхождение бешенства барсука хорька и его новое значение как потенциального источника передачи бешенства в Юго-Восточном Китае | BMC Infectious DiseasesЭпидемиологическое исследование случаев бешенства у людей, связанных с FB Ретроспективное исследование эпидемий бешенства было проведено в провинциях Чжэцзян, Цзянси и Аньхой на юго-востоке Китая.Данные были собраны и обобщены из провинциальной системы эпиднадзора CDC и эпидемиологических записей. Некоторая информация была получена устно после интервьюирования торговцев животными или охотников в эндемичных районах. В случаях бешенства у людей и его потенциальной связи с передачей FB мы провели предварительное исследование плотности популяции FB, частоты воздействия больных FB на людей и ведения ПКП от бешенства после укуса FB. FB и образцы головного мозга собак и тест на флуоресцентные антитела (FAT)Мертвые или живые FB, собранные на полях и в домах, а также собаки, укусившие людей, были отправлены отобранными фермерами в определенные лаборатории для диагностики.Обследованные горные районы: Хучжоу, Ханчжоу, Цзиньхуа, Цючжоу, Лишуй в провинции Чжэцзян; Наньчан, Цзиндэчжэнь, Шанграо, Уюань в провинции Цзянси; и Хуаншань, Сюаньчэн, Аньцин, Цзинсянь в провинции Аньхой. Головы животных были надлежащим образом упакованы и отправлены в нашу лабораторию в холодных условиях. Мозг удаляли путем вскрытия черепа в стерильных условиях. Эксперименты на животных, связанные с данным исследованием, были одобрены Комитетом по защите животных и этике Института ветеринарных исследований Академии военно-медицинских наук.Гуманные конечные точки использовались на протяжении всего исследования в соответствии с этическими принципами исследований in vivo. Все животные, включая хорьков, барсуков, собак и мышей, у которых проявлялись клинические признаки инфекции, были убиты гуманно. FAT на образцах мозга выполняли в соответствии с методами, описанными в другом месте [14].Вкратце, на предметных стеклах делали оттиски мозговой ткани. После сушки на воздухе предметные стекла фиксировали 80% ацетоном в течение 20 мин. Добавляли конъюгированные с FITC нуклеопротеиновые моноклональные антитела против вируса бешенства (изготовленные в лаборатории эпидемиологии Ветеринарного института, Чанчунь, для стандартной диагностики бешенства) и инкубировали в течение 40 минут при 37 ° C. После трехкратной промывки с использованием буфера PBS (0,01 M, pH 7,4) -Tween-20 (0,1%) слайды оставляли сушиться на воздухе при температуре окружающей среды и наблюдали под УФ-флуоресцентным микроскопом (Zeiss Corporation, Германия. ) для типичного окрашивания вирусом бешенства. Тест на прививку мышей (MIT)Для FAT-положительных образцов суспензию образца вводили внутрицеребрально однодневным мышам-сосункам (мышам Kunming, Animal Core Laboratory, Changchun Institute of Biological Products) в соответствии с протоколами, описанными в другом месте [15]. За мышами наблюдали ~ 28 дней. Мазок головного мозга был сделан для повторной проверки наличия антигена вируса бешенства с использованием FAT, если зараженные мыши погибли с 6 по 28 день. Последовательности генов нуклеопротеинов и гликопротеинов и филогенетический анализОбщая РНК инфицированных FB мозг экстрагировали с использованием реагента Trizol (Invitrogen, Carlsbad, CA).Гены нуклеопротеина (N) и гликопротеина (G) амплифицировали с помощью ОТ-ПЦР в соответствии с протоколом, описанным Надином-Дэвисом и др. [16], с использованием общей РНК со следующими праймерами. Положения праймеров относили к штамму FJ009 (GenBank , акк. № . FJ866836.1). RV-N-F (1-25): 5′-ACGCTTAACAACAAAACCATAGAAG-3 ‘; RV-N-R (1515-1538): 5′-CGGATTGACGAAGATCTTGCTCAT-3 ‘; RV-G-F (3291-3315): 5′-CATCCCTCAAAAGACTTAAGGAAAG-3 ‘; RV-G-R (4918-4941): 5′-CCGAGGAGATGAGGTCTTCGGGAC-3 ‘, TaKaRa (TaKaRa Corp Ltd, Далянь, Китай) была контрактной компанией, ответственной за секвенирование ампликонов. Нейтрализующие антитела к вирусу бешенства (RV) в образцах сыворотки собак и FB Образцы сыворотки были собраны у отловленных FB и собак в наших расширенных обследованных областях. Все FB были живы и выглядели здоровыми на момент сбора сыворотки.Сыворотки собак были получены от сторожевых собак, принадлежащих жителям разных деревень в провинциях Чжэцзян, Цзянси и Аньхой. Метод титрования вирус-нейтрализующих антител (VNA) с помощью теста нейтрализации вируса флуоресцентными антителами (FAVN) описан в другом месте [17]. Вкратце, 3-кратные серийные разведения стандартной сыворотки (0,5 международных единиц, МЕ / мл) и исследуемых образцов сыворотки готовили в микропланшетах в четырех повторностях. В каждую лунку также добавляли пятьдесят мкл контрольного вируса бешенства (CVS-11), содержащего 100 TCID 50 . (PDF) Патогены и паразиты у американских барсуковQuinn et al. 293 Журнал ветеринарных исследований 60: 351–355. МакКью, П. М. и Т. П. О’Фаррелл. 1988 г. Серологическое исследование отдельных болезней у находящихся под угрозой исчезновения лисиц Сан-Хоакин (Vulpes macrotis mutica). Журнал болезней дикой природы 24: 274–281. Макдауэлл, Дж. У., Х. Г. Скотт, К. Дж. Стоянович и Х. Б. Вайнбург. 1964. Туляремия. Мимеограф, Министерство здравоохранения, образования и социального обеспечения США, Служба общественного здравоохранения, Центр инфекционных заболеваний, Атланта, Джорджия, США. Мессик, Дж. П. и М. Г. Хорнокер. 1981. Экология барсука на юго-западе штата Айдахо . Монографии дикой природы 76: 1–53. Мессик, Дж. П., Дж. У. Смит и А. М. Барнс. 1983. Серологическое тестирование барсуков на мониторе чумы в юго-западном Айдахо. Журнал болезней дикой природы 19: 1–6. Миллер Б. луговых собачек. Западно-североамериканский натуралист 72: 228–240. Миллер, Массачусетс, У.А. Миллер, П.А. Конрад, Э.Р. Джеймс, А.С. Мелли, С.М. Лойтенеггер, HA Dabritz, AE Packham, D. Paradies, M. Harris, J. Ames, DA Jessup, K. Worcester, и М.Э. Григг. 2008. Тип X Toxoplasma gondii в дикой мидии и наземных хищников из прибрежной Калифорнии: новые связи между наземными млекопитающими, сток и токсоплазмоз каланов. Международный журнал паразитологии 38: 1319– 1328. Минта, С. К. и Р. Э. Марш. 1988. Барсуки (Taxidea taxus) как эпизодические вредители в сельском хозяйстве . Труды конференции по позвоночным вредителям 13: 199–208 Минта, С. К., К. А. Минта и Д. Ф. Лотт. 1992. Охотничьи ассоциации между барсуками (Taxidea taxus) и койотами (Canis latrans). Журнал маммологии 73: 814–820. Мор, К. О. 1948. Домашние крысы, чай и местные грызуны в связи с чумой в Соединенных Штатах. Центр инфекционных заболеваний, Атланта, Джорджия, США. Нельсон Б., М. Хебблвайт, В. Эзенва, Т. Шури, Э. Х. Меррил, П. К. Паке, Ф. Шмигелоу, Д. Зайп, Г. Скиннер и Н. Уэбб. 2012. Распространенность антител к парвовирусу собак и вирусу чумы у волков в Скалистых горах Канады. Journal of Wildlife Diseases 48: 68–76. Ньюхаус, Н. и Т. Кинли. 2001. Экология барсуков вблизи предела ареала обитания в Британской Колумбии . Отчет в Программе компенсации за рыбу и дикую природу Колумбийского бассейна, Нельсон, BC Parks Canada, Radium Hot Springs, Британская Колумбия, Канада. О’Брайен, Д. Дж., С. М. Шмитт, С. Д. Фитцджеральд, Д. Э. Берри и Г. Дж. Хиклинг. 2006. Управление резервуаром Mycobacterium bovis в дикой природе: опыт штата Мичиган, США, .Ветеринарная микробиология 112: 313–323. Группа восстановления американских барсуков Онтарио. (Taxidea taxus) в Онтарио. Серия стратегий восстановления Онтарио. Подготовлено для Министерство природных ресурсов Онтарио, Питерборо, Онтарио, Канада. О’Махони, Д. Этот том. Количественная оценка количества посещений европейских барсуков на фермах — Последствия передачи туберкулеза крупного рогатого скота. Страницы 257–272 в G.Пру и Э. До Линь Сан, редакторы. Барсуки: систематика, биология, охрана и методы исследования. Alpha Wildlife Publications, Шервуд-парк, Альберта, Канада. О’Тул Д., Э. С. Уильямс, В. Уэлч и К. Э. Нунамейкер. 1993. Субэпидермальный % PDF-1.4
%
8081 0 объект
>
endobj
xref
8081 105
0000000016 00000 н.
0000013134 00000 п.
0000013406 00000 п.
0000013452 00000 п.
0000013490 00000 п.
0000014485 00000 п.
0000014524 00000 п.
0000014607 00000 п.
0000014669 00000 п.
0000015979 00000 п.
0000016908 00000 н.
0000018640 00000 п. Никотинамид: пероральный противомикробный агент с активностью против Mycobacterium tuberculosis и вируса иммунодефицита человека | Клинические инфекционные болезниАннотация Коинфекция Mycobacterium tuberculosis и вирусом иммунодефицита человека (ВИЧ) является причиной одной трети всех случаев смерти в результате синдрома приобретенного иммунодефицита. История антимикобактериальной способности никотинамида многим неизвестна, потому что литература предшествовала карьере большинства людей, которые в настоящее время занимаются лечением этих инфекций, а также базе данных PubMed Национального института здравоохранения [1]. Два структурно родственных соединения, пиразинамид и изониазид, оказались эффективными против M. Рисунок 1 Структура никотинамида и родственных соединений Рисунок 1 Структура никотинамида и родственных соединений К 1990-м годам вся эта информация оказалась в относительной безвестности.Фактически, всесторонний обзор фармацевтических эффектов никотинамида, опубликованный в 1991 году (год первого зарегистрированного использования никотинамида в исследованиях ВИЧ), не упоминает его действие против M. За последнее десятилетие три разные гипотезы побудили протестировать никотинамид для использования в качестве терапии ВИЧ. Во-первых, несколько групп изучали влияние никотинамида на ВИЧ, уделяя внимание его ингибирующей активности в отношении ядерного фермента поли-АДФ-рибозо-полимеразы (PARP) [11, 12].Во-вторых, в 1995 году, когда мы сообщили, что никотинамид является ингибитором ВИЧ [13], наша гипотеза была сформирована из интереса к потенциальной корреляции между пеллагрой и СПИДом [14]. В-третьих, Cossarizza et al. [15] продолжили исследования никотинамида в контексте его антиоксидантных свойств и сообщили о ингибировании клеточного повреждения, вызванного ВИЧ. Интересно, что все эти гипотезы преследовались без ссылки на данные по борьбе с M. tuberculosis , которые предшествовали им на 30–50 лет. Отдельные агенты с активностью как против ВИЧ, так и против M. tuberculosis встречаются редко. Любой такой агент вызывает интерес и как потенциальная терапия, и как окно в патогенез. Никотинамид как лекарственное средство Ниацин — это общее название двух соединений: никотинамида и никотиновой кислоты. И никотинамид, и никотиновая кислота были впервые клинически использованы в 1937 году, когда было показано, что каждое из этих недавно очищенных соединений действует как «предотвращающий пеллагру» фактор [19]. Таблица 1 Действие соединений ниацина (никотинамид [NAm] и никотиновая кислота [NAc]) против ВИЧ и Mycobacterium tuberculosis . Таблица 1 Эффекты соединений ниацина (никотинамид [NAm] и никотиновая кислота [NAc]) против ВИЧ и Mycobacterium tuberculosis . Недавнее исследование использования никотинамида для лечения ВИЧ-инфицированных пациентов подтвердило, что дозы 3 г / день могут хорошо переноситься [22]. В исследованиях использования никотинамида для лечения M. tuberculosis использовались аналогичные дозировки (например, 50 мг / кг / день) без приписываемой токсичности [9]. Фармакокинетика никотинамида изучалась на людях; исследование приема перорального никотинамида дважды в день в общей суточной дозе 25 мг / кг показало период полувыведения из плазмы 3. Дополнительные клинические испытания использования монотерапии никотинамидом у людей последовали за первоначальным наблюдением Хуанта. Эти исследования были опубликованы в виде небольших серий или отчетов о случаях и проводились в основном в Европе [25]. Tanner [8] описал 11 пациентов с легочной инфекцией M. tuberculosis , у большинства из которых отсутствовала терапия стрептомицином, пара-аминосалициловой кислотой или обоими.Он лечил этих пациентов монотерапией никотинамидом в среднем 112 дней, отметив клиническое или бронхоскопическое улучшение у 7 из 11 пациентов. Хотя, по-видимому, не было никаких прямых испытаний с участием людей, сравнивающих монотерапию никотинамидом с другими видами терапии для M. tuberculosis , действие никотинамида против M. tuberculosis сравнивалось на мышиной модели, где оно превышало эффект пара-аминосалициловой кислоты. В 1953 году, вскоре после первого клинического применения изониазида, стало очевидно, что этот препарат оказывает неблагоприятное воздействие на нормальный метаболизм 2 витаминов комплекса B: B 6 [29] и ниацин [30]. По сей день изониазид остается более известным из-за его более часто наблюдаемого воздействия на витамин B 6 и возникающей в результате периферической невропатии, которая может возникать у пациентов, которые не получают достаточного количества витамина B 6 . Клиницистам менее известно, что изониазид также может значительно влиять на метаболизм ниацина и что он вызывает клиническую пеллагру (т.е.э., истощение ниацина) [31]. Одним из звеньев между витамином B 6 и никотинамидом является путь окисления триптофана, в котором витамин B 6 используется в качестве кофактора при обычном превращении 1–2% пищевого триптофана в никотинамид и никотинамидные нуклеотиды (рис. Рисунок 2 Окислительный метаболизм триптофана. Менее 2% диетического триптофана обычно превращается в нуклеотиды ниацина и никотинамида у неинфицированных людей. Остаток триптофана с пищей используется в производстве белка, синтезе серотонина и в ветви ацетилкофермента A (CoA) этого пути. ACMSDase, аминокарбоксимуконовая полуальдегидаза; НАД, никотинамидадениндинуклеотид. Рисунок 2 Окислительный метаболизм триптофана.Менее 2% диетического триптофана обычно превращается в нуклеотиды ниацина и никотинамида у неинфицированных людей. Остаток триптофана с пищей используется в производстве белка, синтезе серотонина и в ветви ацетилкофермента A (CoA) этого пути. ACMSDase, аминокарбоксимуконовая полуальдегидаза; НАД, никотинамидадениндинуклеотид. В 1961 году, частично на основании исследований, в которых было успешно использовано производное никотинамида лекарственное средство пиразинамид в сочетании с изониазидом [34], Jordahl et al.[9] тестировали комбинацию изониазида и никотинамида для лечения людей. Их опубликованное исследование 33 пациентов с легочной инфекцией M. tuberculosis , 32 из которых страдали полостными заболеваниями, показало, что использование никотинамида и изониазида в качестве комбинированной терапии привело к «обращению заразности», значительно меньшему, чем у исторического контроля, описанного в исследование, опубликованное 3 года назад [35]. Только 27% пациентов, получавших двойное лечение, по сравнению с 72% контрольной группы, получавшей монотерапию изониазидом, достигли выведения микобактерий из мокроты через 6 месяцев после начала терапии.На момент проведения этого исследования многие пришли к выводу, что «любая схема, содержащая изониазид, превосходит все другие» [36, с. 75], и, таким образом, эти результаты по существу остановили клиническое использование никотинамида в микобактериологии. Антимикобактериальный механизм действия изониазида оставался неясным на протяжении почти полувека, несмотря на широкое использование этого препарата. В 1998 году Rozwarski et al. [37] опубликовали данные о механизме, основанном на ковалентном связывании изониазида с никотинамидным кольцом НАДН в активном центре лекарственной мишени.Разумно предположить, что наблюдаемый антагонизм между никотинамидом и изониазидом может быть результатом конкуренции никотинамида с НАДН за связывание изониазида (рисунок 3), и можно также ожидать, что пиразинамид, хотя и имеет структурное родство, будет менее эффективным ингибитором изониазида, учитывая изменение его 6-членной кольцевой структуры. Независимо от точного механизма взаимного антагонизма, можно ожидать, что клинические неудачи, а также появление устойчивых к лекарствам M. tuberculosis будут рисками сочетания изониазида и никотинамида, потому что стандартные дозы антагонистической терапии приводят к субтерапевтическим «эффективным концентрациям». Рисунок 3 Предлагаемый путь образования изоникотинового ингибитора ацил-НАДН InhA. Печатается с разрешения из [37]. Фигура 3 Предлагаемый путь образования изоникотинового ингибитора ацил-НАДН InhA. Печатается с разрешения из [37]. Пиразинамид, по-видимому, не противостоит никотинамиду. Эти агенты, однако, имеют общий механизм перекрестной резистентности за счет инактивации микобактериального фермента никотинамидазы, также известного как пиразинамидаза [38].Таким образом, хотя комбинация этих препаратов, по-видимому, не противопоказана, стандартные рекомендации по терапии с использованием трех и четырех препаратов, направленные на предотвращение возникновения резистентности, не должны изменяться вне контролируемых клинических испытаний [39]. Hiv-1 и никотинамид Первое исследование никотинамида против ВИЧ было опубликовано в 1991 году [11]. Это исследование показало эффективность никотинамида и других ингибиторов PARP в качестве антиретровирусных средств. Мы предположили, что ВИЧ вызывает истощение запасов ниацина. Это основано на 4 наблюдениях: пентаде признаков, общих для ВИЧ и пеллагры (таблица 2), существовании модели клинически значимого авитаминоза, вызванного инфекцией (например, кори и витамина А) [42], существовании других индуцируемые состояния дефицита ниацина, не связанные с диетой (таблица 3), и отсутствие какого-либо специфического дефицита ниацина с пищей у ВИЧ-положительных пациентов [43]. Таблица 2 Пентада общих характеристик классической диетической пеллагры и ВИЧ-инфекции. Таблица 2 Пентада общих черт классической диетической пеллагры и ВИЧ-инфекции. Таблица 3 Диетические и недиетические причины пеллагры. Таблица 3 Диетические и недиетические причины пеллагры. Наблюдательные исследования потребления ниацина (т. Е. Объединенной никотиновой кислоты и никотинамида) среди ВИЧ-инфицированных в Соединенных Штатах показали, что даже небольшое увеличение потребления ниацина связано с положительными результатами. Рисунок 4 Кривая выживаемости Каплана-Мейера, демонстрирующая улучшение выживаемости ВИЧ-инфицированных пациентов при ежедневном потреблении ниацина ≥64 мг / день (относительный риск, 0.57). Группа пациентов ( n = 281) наблюдалась в течение 8 лет (1984–1992). Печатается с разрешения из [45]. Рис. 4 Кривая выживаемости Каплана-Мейера, демонстрирующая улучшение выживаемости ВИЧ-инфицированных пациентов при ежедневном потреблении ниацина ≥64 мг / день (относительный риск 0,57). Группа пациентов ( n = 281) наблюдалась в течение 8 лет (1984–1992). Печатается с разрешения из [45]. Противомикробный механизм действия никотинамида Антимикробный механизм действия никотинамида в настоящее время неизвестен.Его активность можно понимать как действие непрямого антимикробного средства, которое в первую очередь оказывает прогностический эффект. Среди причин предполагать эффект прогоста — это литература, в которой сообщается об иммуномодулирующей роли никотинамида в большом количестве экспериментальных систем [47–51]. Что касается как M. tuberculosis , так и ВИЧ-инфекции, было замечено, что реакция хозяина включает повышение уровня ниацина в крови [58, 59]. Методология, использованная для измерения уровня ниацина в крови в этих исследованиях, объединяет никотиновую кислоту вместе с никотинамидом, так что вклад отдельных соединений в общее повышение не известен. Благоприятные эффекты никотинамида для лечения ВИЧ-инфекции, по-видимому, связаны с утилизацией НАД клетками. Никотинамид, по-видимому, лишен какого-либо ингибирования внеклеточной обратной транскриптазы или вирулицидной активности [13]. Однако несколько наблюдений, связанных с клетками, связывают ВИЧ, никотинамид и НАД. ВИЧ-инфицированные клетки демонстрируют усиление АДФ-рибозилирования белков, феномен, при котором НАД используется в качестве донатора АДФ-рибозы для ковалентной модификации белков [40].Как правило, никотинамид ингибирует реакции рибозилирования АДФ. Рибозилирование белка АДФ может происходить в ядре, в цитоплазме и на клеточной поверхности лимфоцитов. PARP — это ядерный фермент, который катализирует образование полимеров ADP-рибозы, которые присоединяются к множеству различных белков. Активность PARP имеет решающее значение для интеграции чужеродной ДНК, включая провирусную ДНК; ингибирование или отсутствие этого фермента прерывает жизненный цикл ВИЧ [41]. Наряду с поли-АДФ-рибозилированием, в стадии монорибозилирования также вовлекаются белки в клетках, включая АДФ-рибозилирование как белка Tat ВИЧ [61], так и клеточных дефенсинов [62, 63].Антимикробное действие никотинамида может также работать через модуляцию определенных реакций гистондезактилазы (например, белков Sir2), которые используют НАД для подавления экспрессии хромосомной ДНК [64]. ЗаключениеДля определения точного механизма действия никотинамида необходимы дополнительные исследования; однако очевидно, что повышение концентрации никотинамида посредством фармакологических добавок согласуется с естественной реакцией хозяина как на M.туберкулез и ВИЧ. Однако нельзя предположить, что инфицированные пациенты выиграют от простого фармакологического введения любых или всех «натуральных продуктов». У пациентов с ВИЧ-инфекцией повышенный уровень цинка, по-видимому, представляет собой риск прогрессирования заболевания [45], а витамин A, по-видимому, оказывает вредное действие в крайних пределах диапазона средних доз и пользу в диапазоне средних доз [45]. ]. Было показано, что витамин D приносит пользу пациентам с M. tuberculosis , но, по-видимому, стимулирует выработку ВИЧ in vitro [33, 65, 66].Обычно считается, что витамин B 6 имеет решающее значение для иммунной функции [45, 67], и его польза может быть частично связана с его функцией в качестве кофактора в производстве никотинамида и никотинамидных нуклеотидов из триптофана [68, 69 ]. В борьбе с туберкулезом, как и в борьбе с большинством болезней, отказались от некоторых терапевтических подходов, чтобы сосредоточить ресурсы на наиболее многообещающих методах лечения. Отказ от никотинамида в 1961 году для лечения инфекции M. tuberculosis в 1961 году казался разумным в свое время, но с учетом новой перспективы его активности против ВИЧ-инфекции его использование потребует переоценки.Хотя никотинамидная терапия обычно доступна без рецепта, существуют серьезные медицинские проблемы, которые оправдывают ее фармакологическое использование только в условиях контролируемых клинических испытаний, пока не будет доступна дополнительная информация. Наиболее значительными среди этих опасений является антагонизм терапии изониазидом и возможность появления лекарственно-устойчивого M. tuberculosis– , включая первичную устойчивость к никотинамиду, перекрестную резистентность к пиразинамиду и резистентность к изониазиду, вторичную по отношению к антагонизму. Никотиновая кислота как липид-модулирующий агент вызывает интерес у ВИЧ-инфицированных пациентов, получающих ВААРТ, и было начато несколько клинических испытаний [21, 70]. Ожидается, что никотиновая кислота, используемая в фармакологических дозах, повысит концентрацию никотинамида в крови у участвующих пациентов за счет конверсии в печени и эритроцитах. Хотя возможно, что эти клинические испытания могут пролить свет на использование соединений ниацина для лечения ВИЧ-инфицированных пациентов, выводы из вторичного анализа любого исследования всегда требуют осторожности. Число погибших, связанных с ВИЧ- коинфекцией M. tuberculosis , по оценкам, составило 1 миллион смертей в 1999 г. [71]. Хотя никотинамид по сравнению с большинством фармакологических агентов является относительно слабым ингибитором при обеих инфекциях, есть несколько причин для проведения оценки его потенциального применения: он нетоксичен, доступен для перорального применения, недорог и, по-видимому, имеет побочные эффекты. Никотинамид содержится в пище, но, в отличие от других витаминов, он также может синтезироваться в организме человека; поэтому его можно рассматривать как витамин или пищевую добавку в низких концентрациях или как лекарство при использовании в фармакологических концентрациях.Как и в случае с любым другим лекарственным препаратом, использование никотинамида необходимо контролировать на предмет возможных побочных эффектов. Никотинамид, средство, «предотвращающее пеллагру», впервые использованное в 1937 году, может в конечном итоге внести вклад в терапевтические подходы 21 века как часть схем, используемых в качестве «средств профилактики СПИДа» [72] и средств профилактики туберкулеза. БлагодарностиЯ благодарю Дж. К. Саккеттини, Д. П. Роджерса, Р. Р. МакГрегора и М. М. Мюррея за их полезные комментарии и критический обзор рукописи. Список литературы1База данных PubMed национальных институтов здравоохранения 2,.Стрептомицин в лечении клинического туберкулеза: предварительный отчет ,Протоколы совещаний персонала клиники Мэйо ,1945 , vol.20 (стр.313 —8 ) 3.Note sur l’action de tres fortes sizes d’amide nicotinique dans les bacillaires ,Gazette Hopitau ,1945 , vol.118 (стр.259 —60 ) 4.Action de l’amide nicotinique sur les bacilles du genre Mycobacterium ,C R Acad Sci III ,1945 , vol.220 (стр.150 —1 ) 5,,,,.Влияние амида никотиновой кислоты на экспериментальный туберкулез белых мышей ,J Lab Clin Med ,1948 , vol.33 (стр.1249 —53 ) 6« и др.Экспериментальная химиотерапия туберкулеза. II. Синтез пиразинамидов и родственных соединений ,J Am Chem Soc ,1952 , т.74 (стр.3617 —21 ) 7.История INH ,J Infect Dis ,1969 , т.119 (стр.678 —83 ) 8.Uber den Versuch einer neuer medikamentosen Therapie der Bronchustuberkulose ,Helv Med Acta ,1951 , vol.18 (стр.456 —60 ) 9,,,,.Неэффективность никотинамида и изониазида при лечении туберкулеза легких ,Am Rev Respir Dis ,1961 , vol.83 (стр.899 —901 ) 10,.Использование ниацина в качестве лекарственного средства ,Annu Rev Nutr ,1991 , vol.11 (стр.169 —87 ) 11« и др.Ингибиторы рибозилирования АДФ как противовирусные агенты: экспериментальное исследование на модели ВИЧ-инфекции [Русский] ,Vopr Virusol ,1991 , vol.36 (стр.216 —8 ) 12,,.Ингибиторы поли (АДФ-рибозы) полимеразы подавляют УФ-индуцированную экспрессию гена вируса иммунодефицита человека типа 1 на посттранскрипционном уровне. ,Mol Cell Biol ,1991 , vol.11 (стр.3522 —7 ) 13,.Никотинамид ингибирует ВИЧ-1 как при острой, так и при хронической инфекции in vitro ,Biochem Biophys Res Commun ,1995 , vol.210 (стр.954 —9 ) 14,,.ВИЧ-инфекция снижает содержание внутриклеточного никотинамидадениндинуклеотида [NAD] ,Biochem Biophys Res Commun ,1995 , vol.212 (стр.126 —31 ) 15« и др.Изменения митохондрий и резкая тенденция к апоптозу лимфоцитов периферической крови при остром синдроме ВИЧ ,AIDS ,1997 , vol.11 (стр.19 —26 ) 16« и др.Антибактериальная активность и механизм действия 3′-азидо-3′-дезокситимидина (BW A509U) ,Антимикробные агенты Chemother ,1987 , т.31 (стр.274 —80 ) 17.Цитокинотерапия микобактериальных инфекций ,Adv Intern Med ,2000 , vol.45 (стр.431 —52 ) 18,.Использование цитокинов у пациентов, инфицированных вирусом иммунодефицита человека: колониестимулирующие факторы, эритропоэтин и интерлейкин-2 ,Clin Infect Dis ,2001 , vol.32 (стр.766 —73 ) 19,.Структура и оценка натуральных продуктов, функционально связанных с никотиновой кислотой ,Chem Rev ,1942 , vol.41 (стр.185 —208 ) 20.Ниацин ,Annu Rev Nutr ,1983 , т.3 (стр.289 —307 ) 21« и др.Предварительные рекомендации по оценке и лечению дислипидемии у взрослых, инфицированных вирусом иммунодефицита человека и получающих антиретровирусную терапию: рекомендации Целевой группы по сердечно-сосудистым заболеваниям Группы клинических испытаний СПИДа у взрослых ,Clin Infect Dis ,2000 , vol.31 (стр.1216 —24 ) 22,,.Повышенный уровень триптофана в плазме у ВИЧ-инфицированных пациентов, получавших фармакологические дозы никотинамида ,Nutrition ,2001 , vol.17 (стр.654 —6 ) 23,,.Мета-анализ лечения никотинамидом у пациентов с недавно развившимся ИЗСД. Исследователи Никотинамида ,Diabetes Care ,1996 , vol.19 (стр.1357 —63 ) 24,,,.Фармакокинетика никотинамида у человека и грызунов ,Диабет ,1995 , vol.44 (стр.152 —5 ) 25.Behandlung der Lungentuberkulose mit nikotinsaureamid: vorlanfige therapeutische mitteilung ,Dtsch Med Wochenschr ,1952 , vol.77 (стр.1480 —1 ) 26,.Uber die antituberkulose wirkung des nikotylamids ,Helv Med Acta ,1951 , vol.31 (стр.449 —55 ) 27.Пиразинамид-изониазид при туберкулезе ,American Reviews of Tuberculosis ,1954 , vol.69 (стр.319 —50 ) 28,,,,,.Влияние пиразинамида на экспериментальный туберкулез у мышей ,American Reviews of Tuberculosis ,1952 , vol.65 стр.511 29.Прием пиридоксина во время терапии изониазидом ,Tubercle ,1980 , vol.61 (стр.191 —6 ) 30,.Острая пеллагра на фоне терапии изониазидом ,Ланцет ,1952 , т.263 (стр.959 —60 ) 31,,,.Пеллагра, вызванная изониазидом, несмотря на прием пиридоксина ,Clin Exp Dermatol ,1999 , vol.24 (стр.167 —9 ) 32,,.Ингибирование in vivo активности кинуренинаминотрансферазы гидразидом изоникотиновой кислоты у крыс ,Biosci Biotechnol Biochem ,1996 , vol.60 (стр.874 —6 ) 33,,,,.Влияние дефицита витамина B 6 на коэффициент превращения триптофана в ниацин ,Biosci Biotechnol Biochem ,1995 , vol.59 (стр.2060 —3 ) 34,,,,,.Пиразинамид-изониазид при туберкулезе: результаты у 58 пациентов с поражением легких через год после начала терапии ,American Reviews of Tuberculosis ,1954 , vol.70 (стр.743 —7 ) 35,,,,.Дальнейший опыт применения монотерапии (изониазид) при хроническом туберкулезе легких: начальная терапия изониазидом в высоких дозах ,Am Rev Tuberc Pulm ,1958 , vol.77 (стр.539 —42 ) 36.Tuberculosis ,N Engl J Med ,1959 , vol.261 (стр.30 —6 ) 37,,,,.Модификация НАДН мишени изониазида (InhA) из Mycobacterium tuberculosis ,Science ,1998 , vol.279 (стр.98 —102 ) 38,,.Молекулярная основа устойчивости к изониазиду, рифампину и пиразинамиду у Mycobacterium tuberculosis ,Respir Res ,2001 , vol.2 (стр.164 —8 ) 39Целевое туберкулиновое тестирование и лечение латентной туберкулезной инфекции ,Am J Respir Crit Care Med ,2000 , vol.161 (стр.221 —47 ) 40,,.Повышенная активность поли (АДФ-рибоза) полимеразы в клетках, инфицированных вирусом иммунодефицита человека типа 1 ,Microbiologica ,1991 , vol.14 (стр.141 —8 ) 41,,,,,.Поли (АДФ-рибоза) полимераза-1 требуется для эффективной интеграции ВИЧ-1. ,Proc Natl Acad Sci USA ,2001 , vol.98 (стр.3364 —8 ) 42,.Дефицит витамина А, вызванный корью ,Ann NY Acad Sci ,1992 , vol.669 (стр.188 —96 ) 43,,,.Состояние питания и потребление пищи при инфицировании вирусом иммунодефицита человека. GI / HIV Study Group ,J Acquir Immune Defic Syndr ,1992 , vol.5 (стр.1091 —8 ) 44,,.Проспективное исследование диетического питания и синдрома приобретенного иммунодефицита у ВИЧ-серопозитивных гомосексуальных мужчин ,J Acquir Immune Defic Syndr ,1993 , vol.6 (стр.949 —58 ) 45,,.Влияние потребления микронутриентов на выживаемость при инфицировании вирусом иммунодефицита человека типа 1 ,Am J Epidemiol ,1996 , vol.143 (стр.1244 —56 ) 46« и др.Изменение содержания пуриновых нуклеотидов в субпопуляциях лимфоцитов пациентов, инфицированных ВИЧ ,Clin Chim Acta ,1994 , vol.225 (стр.147 —53 ) 47,.Стрептозотоцин: угнетение пиридиновых нуклеотидов печени мыши ,Cancer Res ,1968 , vol.28 (стр.1501 —6 ) 48,,,,,.Влияние никотинамида и ниацина на острое повреждение, вызванное блеомицином, и последующий фиброз легких хомяка ,Exp Lung Res ,1994 , vol.20 (стр.263 —81 ) 49,,,,.Защитные эффекты ниацинамида при токсичности, вызванной стафилококковым энтеротоксином B ,Toxicology ,1996 , vol.107 (стр.69 —81 ) 50,,,.Ингибирующее действие никотинамида на рекомбинантную человеческую молекулу-1 межклеточной адгезии, индуцированную гамма-интерфероном (ICAM-1), и экспрессию антигена HLA-DR на культивируемых эндотелиальных клетках человека ,Immunol Lett ,1992 , vol.31 (стр.35 —9 ) 51,,,,.Никотинамид и 3-аминобензамид снижают экспрессию молекул MHC класса II (HLA-DR и -DP), индуцированную гамма-интерфероном, на культивируемых эндотелиальных клетках и фибробластах человека ,Immunopharmacol Immunotoxicol ,1991 , vol.13 (стр.263 —80 ) 52,,,.Никотинамид и 3-аминобензамид подавляют экспрессию рекомбинантного человеческого гамма-интерферона HLA-DR, но не экспрессию антигенов HLA-A, -B, -C, на культивируемых клетках щитовидной железы человека ,Clin Endocrinol (Oxf) ,1992 , т.36 (стр.91 —5 ) 53« и др.Изучение парадокса патогенеза туберкулеза легких у человека: активация и подавление / анергия иммунной системы ,Tuberc Lung Dis ,1997 , vol.78 (стр.145 —58 ) 54« и др.Никотинамид снижает вызванную цитокинами активацию орбитальных фибробластов у пациентов с тироид-ассоциированной офтальмопатией ,J Clin Endocrinol Metab ,1998 , vol.83 (стр.121 —4 ) 55« и др.Защита от никотинамида Ингибирование индуцированного интерлейкином-1 бета образования оксида азота в клетках RIN связано с индукцией активности фермента MnSOD ,Endocrinology ,1996 , vol.137 (стр.4806 —10 ) 56,,,,,.Ингибирующее действие никотинамида на экспрессию молекулы-1 межклеточной адгезии на культивируемых клетках щитовидной железы человека ,Immunology ,1993 , vol.80 (стр.330 —2 ) 57,,,,,.Ингибирование пролиферации Т-клеток катаболизмом триптофана макрофагов ,J Exp Med ,1999 , vol.189 (стр.1363 —72 ) 58,,,.Роль туберкулезных микобактерий в повышении уровня никотиновой кислоты в крови ,J Egypt Med Assoc ,1953 , vol.36 (стр.435 —44 ) 59« и др.Профили микронутриентов у ВИЧ-1-инфицированных гетеросексуальных взрослых ,J Acquir Immune Defic Syndr Hum Retrovirol ,1996 , vol.12 (стр.75 —83 ) 60,,,.Оценка роли ниацина в канцерогенезе человека ,Biochimie ,1995 , vol.77 (стр.394 —8 ) 61,,,,,.Белок Tat ВИЧ-1 представляет собой поли (АДФ-рибозил), атированный in vitro ,Biochem Biophys Res Commun ,1999 , vol.261 (стр.90 —4 ) 62« и др.Вклад человеческого α-дефенсина-1, -2 и -3 в активность антивирусного фактора CD8 против ВИЧ-1. ,Science ,2002 , vol.298 (стр.995 —1000 ) 63« и др.АДФ-рибозилирование нейтрофильного пептида-1 человека регулирует его биологические свойства ,Proc Natl Acad Sci USA ,2002 , vol.99 (стр.8231 —5 ) 64.Ферментативная активность Sir2 и подавление хроматина ,Curr Opin Cell Biol ,2001 , vol.13 (стр.232 —8 ) 65.Лечение туберкулеза в начале следующего века ,Int J Tuberc Lung Dis ,1999 , vol.3 (стр.651 —62 ) 66,,,,,.Усиление репликации вируса иммунодефицита человека 1 в моноцитах 1,25-дигидроксихолекальциферолом ,Proc Natl Acad Sci USA ,1991 , vol.88 (стр.6632 —6 ) 67,.Витамин B 6 и иммунная компетентность ,Nutr Rev ,1993 , vol.51 (стр.217 —25 ) 68« и др.Специфические нарушения питания при бессимптомной инфекции ВИЧ-1 ,AIDS ,1992 , vol.6 (стр.701 —8 ) 69« и др.Связь статуса витамина B 6 с параметрами иммунной функции на ранней стадии ВИЧ-1 инфекции ,J Acquir Immune Defic Syndr ,1991 , vol.4 (стр.1122 —32 ) 70,,.Уровень холестерина липопротеинов высокой плотности является низким у ВИЧ-инфицированных пациентов с липодистрофическим увеличением жировой ткани: значение для патогенеза перераспределения жира ,AIDS ,2002 , vol.16 (стр.1785 —9 ) 71,,.Соучастники в преступлении: сопутствующие инфекции в развивающихся странах ,Clin Exp Immunol ,2000 , vol.122 (стр.296 —9 ) 72.Ниацин как потенциальный фактор профилактики СПИДа ,Med Hypotheses ,1999 , vol.53 (стр.375 —9 )© 2003 Американского общества инфекционных болезней Приглашенный обзор: Экономические последствия паратуберкулеза крупного рогатого скота и борьба с нимПаратуберкулез (также называемый болезнью Джона) — хроническое заболевание, вызываемое Mycobacterium avium ssp. paratuberculosis (MAP), поражающий жвачных и других животных. Эпидемиология паратуберкулеза сложна, и клинические проявления и экономические последствия этого заболевания у крупного рогатого скота могут варьироваться в зависимости от таких факторов, как управление стадом, возраст, доза инфекции и распространенность болезни, среди прочих. Кроме того, при борьбе с паратуберкулезом крупного рогатого скота возникают серьезные проблемы, такие как отсутствие точных и надежных диагностических тестов. Тем не менее, усилия направлены на борьбу с этим заболеванием, поскольку оно может привести к значительным экономическим потерям для животноводства, в основном из-за увеличения преждевременной выбраковки, затрат на замену, снижения надоев молока, снижения эффективности преобразования корма, проблем с фертильностью, снижения показателей убоя и увеличения предрасположенность к другим заболеваниям или состояниям.Вариабельность и неопределенность оценок распространенности и воздействия паратуберкулеза влияют на разработку, реализацию и эффективность программ борьбы в различных регионах мира. В этом обзоре рассматриваются важные аспекты экономического воздействия паратуберкулеза и борьбы с ним, включая проблемы, связанные с обнаружением заболеваний, оценками распространенности и экономических последствий болезни, а также осуществлением программ борьбы. Борьба с паратуберкулезом может улучшить здоровье и благополучие животных, повысить продуктивность, уменьшить потенциальные проблемы на рынке и повысить общую прибыльность бизнеса.О преимуществах борьбы с паратуберкулезом необходимо сообщать всем заинтересованным сторонам отрасли, чтобы способствовать внедрению программ борьбы. Более того, если будет установлена подозреваемая связь между болезнью Джона у жвачных животных и болезнью Крона у людей, можно ожидать значительных экономических потерь, особенно для молочной промышленности, что сделает борьбу с этой болезнью приоритетной во всех молочных отраслях во всем мире. Ссылки | Конвергенция инфекционных и неинфекционных заболеваний: материалы семинараДж.Эскобедо-де ла Пенья, CH Fall, F. Farzadfar, FJ Felix-Redondo, TS Ferguson, D. Fernández-Bergés, M. Ferrari, C. Ferreccio, EJ Feskens, JD Finn, B. Föger, LH Foo, AS Forslund , HM Fouad, DK Francis, C. Franco Mdo, OH Franco, G. Frontera, T. Furusawa, Z. Gaciong, SP Garnett, JM Gaspoz, M. Gasull, L. Gates, JM Geleijnse, A. Ghasemian, A. Гимире, С. Джампаоли, Ф. Джанфанья, Дж. Джованнелли, А. Гиверкман, М. Г. Гросс, Дж. П. Гонсалес Ривас, М. Б. Горбеа, Ф. Готтранд, Д.Grafnetter, T. Grodzicki, A. Grøntved, G. Gruden, D. Gu, OP Guan, R. Guerrero, I. Guessous, AL Guimaraes, L. Gutierrez, IR Hambleton, R. Hardy, R. Hari Kumar, J. Hata, J. He, C. Heidemann, S. Herrala, IT Hihtaniemi, SY Ho, SC Ho, A. Hofman, CM Hormiga, BL Horta, L. Houti, C. Howitt, TT Htay, AS Htet, MM Htike, Ю. Ху, А. С. Хуссени, И. Хайбрехтс, Н. Хвалла, Л. Яковьелло, А. Г. Янноне, М. М. Ибрагим, Н. Икеда, М. А. Икрам, В. Э. Иразола, М. Ислам, М. Ивасаки, Дж.М. Якобс, Т. Джафар, К. М. Джамиль, Г. Ясиенска, К. К. Цзян, Дж. Б. Йонас, П. Джоши, А. Кафатос, О. Кальтер-Лейбовичи, А. Касаэян, Дж. Кац, П. Каур, М. Кавуси , С. Кейнянен-Киукаанниеми, Р. Келишади, А.П. Кенгне, М. Керстинг, Ю.С. Хадер, Д. Халили, Ю.Х. Ханг, С. Кехл, Дж. Ким, П. Кольстерен, П. Корровиц, В. Крацер, Д. Kromhout, UM Kujala, K. Kula, C. Kyobutungi, T. Laatikainen, C. Lachat, Y. Laid, TH Lam, O. Landrove, V. Lanska, G. Lappas, A. Laxmaiah, C. Leclercq, J. Ли, Дж. Ли, Т.Lehtimäki, R. Lekhraj, LM León-Muñoz, Y. Li, WY Lim, MF Lima-Costa, HH Lin, X. Lin, L. Lissner, R. Lorbeer, JE Lozano, D. Luksiene, A. Lundqvist, P .Литси, Г. Ма, Г.Л. Мачадо-Коэльо, С. Мачи, С. Магги, Д. Д. Маглиано, М. Макдисс, К. Маллихарджуна Рао, Ю. Маниос, Э. Манзато, П. Маргоццини, П. Маркес-Видаль, Р. Марторелл, С. Р. Масуди, Э. Б. Матизен, Т. Э. Матша, Дж. К. Мбанья, С. Р. Макфарлейн, С. Т. МакГарви, С. Маклахлан, Б. А. МакНалти, С. Медьене-Бенчекор, А. Мейрхэге, А.M. Menezes, S. Merat, Meshram, II, J. Mi, JF Miquel, JJ Miranda, MK Mohamed, K. Mohammad, N. Mohammadifard, V. Mohan, MF Mohd Yusoff, NC Møller, D. Molnár, CK Mondo , А. Морехон, Л. А. Морено, К. Морган, Г. Мошонис, М. Мосаковска, А. Мостафа, Дж. Мота, Дж. Мотта, Т. Т. Му, М. Л. Муйесан, М. Мюллер-Нурасьид, Дж. Мурсу, Г. Nagel, J. Námešná, EE Nang, VB NangThetia, EM Navarrete-Muñoz, NC Ndiaye, I. Nenko, F. Nervi, ND Nguyen, QN Nguyen, RE Nieto-Martínez, G. Ning, T.Ниномия, М. Ноале, Д. Ното, М. А. Нсур, А. М. Очоа-Авилес, К. О, А. Онат, П. Ордунес, К. Осмонд, Дж. А. Отеро, Э. Овусу-Дабо, Э. Пахомова, Л. Пальмиери , S. Panda-Jonas, F. Panza, M. Parsaeian, SV Peixoto, C. Pelletier, M. Peltonen, A. Peters, N. Peykari, ST Pham, A. Pilav, F. Pitakaka, A. Piwonska, J Пивонски, П. Планы-Рубио, М. Порта, М.Л. Портегиш, Х. Поустчи, Р. Прадипа, Дж. Ф. Прайс, М. Пунаб, Р. Ф. Касрави, М. Корбани, Р. Радисаускас, М. Рахман, О. Райтакари, С. Р. Рао, А. Рамачандран, Дж.Рамке, Р. Рамос, С. Рампал, В. Ратманн, Дж. Редон, П. Ф. Реганит, Ф. Риго, С. М. Робинсон, К. Робитайл, Ф. Родригес-Арталехо, К. Родригес-Перес Мдел, Л. А. Родригес-Вильямисар, Р. Рохас-Мартинес, К. Ронкайнен, А. Розенгрен, А. Рубинштейн, О. Руи, Б. С. Руис-Бетанкур, Р. В. Руссо Хоримото, М. Рутковски, К. Сабанаягам, Х. С. Сачдев, О. Саиди, С. Сакарья, Б. Саланаве, Дж. Т. Салонен, М. Сальветти, Х. Санчес-Абанто, Д. Сантос, Р. Н. душ Сантуш, Р. Сантос, Дж. Л. Сарамиес, Л. Б. Сардинья, Н. Саррафзадеган, К.У. Саум, М. Сказуфка, Х. Шаргродский, К. Шайдтнейв, А.А. Сейн, С.К. Шарма, Дж. Э. Шоу, К. Шибуя, Ю. Шин, Р. Шири, Р. Сиантар, А. М. Сибай, М. Саймон, Дж. Саймонс, Л.А. Симонс, М. Шостром, Дж. Словиковска-Хильцер, П. Слусарчик, Л. Смит, М.Б. Снейдер, Х.К. Со, Э. Собнгви, С. Содерберг, В. Сольфриззи, Э. Сонестедт, А. Сумаре, Дж. А. Staessen, MG Stathopoulou, J. Steene-Johannessen, P. Stehle, AD Stein, J. Stessman, D. Stöckl, J. Stokwiszewski, K. Stronks, MW Strufaldi, CA Sun, J.Сундстрём, Ю. Т. Сунг, П. Суриявонгпайсал, Р. Г. Си, Э. С. Тай, А. Тамосиунас, Л. Танг, М. Таравне, К. Б. Тарки-Мамани, А. Тейлор, . | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||








 3. Анализ VNTR изолятов M. bovis
3. Анализ VNTR изолятов M. bovis 
 Однако эти различия могли быть связаны с факторами выборки и небольшим количеством изолятов, доступных для типирования.Сполиготип SB0140 имеет широкое распространение и давно установлен в RoI [11], и, будучи обнаруженным с одинаковой высокой частотой как в районах с высокой, так и с низкой распространенностью, он, по-видимому, не является определяющим фактором распространенности инфекции у барсуков.
Однако эти различия могли быть связаны с факторами выборки и небольшим количеством изолятов, доступных для типирования.Сполиготип SB0140 имеет широкое распространение и давно установлен в RoI [11], и, будучи обнаруженным с одинаковой высокой частотой как в районах с высокой, так и с низкой распространенностью, он, по-видимому, не является определяющим фактором распространенности инфекции у барсуков. Возникает соблазн предположить, что их чрезмерная представленность в каждой группе распространенности свидетельствует о вирулентных свойствах штаммов, которые влияют на распространенность инфекции в этих двух популяциях.Анализ гораздо большей выборки должен помочь уточнить национальное распространение каждого типа штамма и может разрешить их связь с распространенностью инфекции у барсуков. Профили VNTR из большой выборки изолятов крупного рогатого скота показывают, что оба типа VNTR присутствовали у крупного рогатого скота, поэтому профили не являются уникальными для инфицированных барсуков (неопубликованные результаты). В Испании аналогичные исследования по типированию штаммов, проведенные на диких животных (олени, кабаны, иберийские рыси и лисы) и крупном рогатом скоте, показали, что в то время как многие M.Сполиготипы bovis были общими для диких животных и крупного рогатого скота, были сполиготипы, уникально выделенные от крупного рогатого скота [13].
Возникает соблазн предположить, что их чрезмерная представленность в каждой группе распространенности свидетельствует о вирулентных свойствах штаммов, которые влияют на распространенность инфекции в этих двух популяциях.Анализ гораздо большей выборки должен помочь уточнить национальное распространение каждого типа штамма и может разрешить их связь с распространенностью инфекции у барсуков. Профили VNTR из большой выборки изолятов крупного рогатого скота показывают, что оба типа VNTR присутствовали у крупного рогатого скота, поэтому профили не являются уникальными для инфицированных барсуков (неопубликованные результаты). В Испании аналогичные исследования по типированию штаммов, проведенные на диких животных (олени, кабаны, иберийские рыси и лисы) и крупном рогатом скоте, показали, что в то время как многие M.Сполиготипы bovis были общими для диких животных и крупного рогатого скота, были сполиготипы, уникально выделенные от крупного рогатого скота [13]. Наблюдение за коинфекцией животных также предполагает, что существует ограниченный иммунитет, обеспечиваемый инфицированием исходным штаммом, который не предотвращает последующее инфицирование. Следовательно, повторное заражение любым из распространенных путей заражения может привести к инициированию инфекции дополнительными штаммами. Мы могли идентифицировать множественные инфекции только через различия в типах штаммов, и множественные инфекции могли быть более распространенными, чем мы сообщали, потому что штаммы могли быть неразличимы, а барсуки могли быть повторно инфицированы штаммами того же сполиготипа или профиля VNTR, что и исходные. инфекционное заболевание.Кроме того, поскольку образцы изначально были объединены для культивирования, любой штамм соинфекции, присутствующий в очень низких концентрациях в пуле, мог не быть обнаружен.
Наблюдение за коинфекцией животных также предполагает, что существует ограниченный иммунитет, обеспечиваемый инфицированием исходным штаммом, который не предотвращает последующее инфицирование. Следовательно, повторное заражение любым из распространенных путей заражения может привести к инициированию инфекции дополнительными штаммами. Мы могли идентифицировать множественные инфекции только через различия в типах штаммов, и множественные инфекции могли быть более распространенными, чем мы сообщали, потому что штаммы могли быть неразличимы, а барсуки могли быть повторно инфицированы штаммами того же сполиготипа или профиля VNTR, что и исходные. инфекционное заболевание.Кроме того, поскольку образцы изначально были объединены для культивирования, любой штамм соинфекции, присутствующий в очень низких концентрациях в пуле, мог не быть обнаружен. bovis в определенных поселениях могут изменяться из года в год и, скорее всего, являются следствием внутренней миграции новых барсуков.Поскольку группа LP была получена из районов с исторически низким уровнем заболеваемости туберкулезом крупного рогатого скота, наиболее вероятно, что инфекция была вызвана передачей от барсуков к барсуку, поскольку в RoI было очень мало сообщений о инфекции M. bovis у других диких животных, только у диких оленей [15, 16]. Учитывая распространенность инфекции в обеих группах распространенности, наиболее правдоподобным объяснением является то, что множественные инфекции возникают в результате контакта барсуков с разных территорий в результате перемещения между территориями.Хотя анализ VNTR показывает большое разнообразие линий в популяциях, обнаружение нескольких линий у отдельных барсуков может отражать большое количество взаимодействий между барсуками. Коинфекция диких животных (благородный олень, лань и кабан) множественными штаммами M. bovis была зарегистрирована в Испании, что подчеркивает сложность многоузловых взаимодействий и передачи множественных штаммов [17].
bovis в определенных поселениях могут изменяться из года в год и, скорее всего, являются следствием внутренней миграции новых барсуков.Поскольку группа LP была получена из районов с исторически низким уровнем заболеваемости туберкулезом крупного рогатого скота, наиболее вероятно, что инфекция была вызвана передачей от барсуков к барсуку, поскольку в RoI было очень мало сообщений о инфекции M. bovis у других диких животных, только у диких оленей [15, 16]. Учитывая распространенность инфекции в обеих группах распространенности, наиболее правдоподобным объяснением является то, что множественные инфекции возникают в результате контакта барсуков с разных территорий в результате перемещения между территориями.Хотя анализ VNTR показывает большое разнообразие линий в популяциях, обнаружение нескольких линий у отдельных барсуков может отражать большое количество взаимодействий между барсуками. Коинфекция диких животных (благородный олень, лань и кабан) множественными штаммами M. bovis была зарегистрирована в Испании, что подчеркивает сложность многоузловых взаимодействий и передачи множественных штаммов [17]. Заражение M. bovis чаще всего в латентной форме наблюдается у барсуков [3], и, поскольку эта форма инфекции будет иметь минимальное влияние на поведение барсука, вероятность заражения новой инфекцией вряд ли будет зависеть от предыдущих инфекции.
Заражение M. bovis чаще всего в латентной форме наблюдается у барсуков [3], и, поскольку эта форма инфекции будет иметь минимальное влияние на поведение барсука, вероятность заражения новой инфекцией вряд ли будет зависеть от предыдущих инфекции.
 Авторы выражают признательность за поддержку, оказанную Эльвирой Рамович и сотрудниками Центральной лаборатории ветеринарных исследований (CVRL), Бэквестон, графство Килдэр, Ирландия.
Авторы выражают признательность за поддержку, оказанную Эльвирой Рамович и сотрудниками Центральной лаборатории ветеринарных исследований (CVRL), Бэквестон, графство Килдэр, Ирландия.
 Это исследование не касалось каких-либо вопросов человеческой этики, поскольку были собраны и проанализированы только эпидемиологические данные, а образцы не были собраны у каких-либо здоровых или заразившихся людей.
Это исследование не касалось каких-либо вопросов человеческой этики, поскольку были собраны и проанализированы только эпидемиологические данные, а образцы не были собраны у каких-либо здоровых или заразившихся людей.
 Мы создали филогенетическое дерево, используя метод Neighbor-Joining (NJ) в MEGA 4 (MegAlign, DNASTAR Software Suite, версия 7.1.0, Copyright 1989-2006, DNASTAR Inc.). Значения Bootstrap были рассчитаны из 1000 повторов с использованием порогового значения 70%.
Мы создали филогенетическое дерево, используя метод Neighbor-Joining (NJ) в MEGA 4 (MegAlign, DNASTAR Software Suite, версия 7.1.0, Copyright 1989-2006, DNASTAR Inc.). Значения Bootstrap были рассчитаны из 1000 повторов с использованием порогового значения 70%. После 60 мин инкубации при 37 ° C в увлажненном инкубаторе с 5% CO 2 в каждую лунку добавляли 50 мкл клеточной суспензии, содержащей 2 × 10 4 клеток, и планшеты инкубировали в течение 48 часов при 37 ° C. После фиксации при комнатной температуре в течение 30 мин в 80% ацетоне монослои клеток окрашивали путем добавления в каждую лунку FITC-конъюгированных моноклональных антител против нуклеопротеидов бешенства (Лаборатория эпидемиологии Ветеринарного института, Чанчунь, Китай). Окрашивание проводили в инкубаторе при 37 ° C в течение 30 мин, флуоресценцию наблюдали с помощью УФ-микроскопа (Zeiss, Германия).Лунки, не демонстрирующие специфической флуоресценции, считали положительными на антитела. Титры нейтрализующих антител рассчитывали по формуле Спирмена-Кербера и выражали в МЕ / мл по сравнению с эталонной сывороткой (13,5 МЕ / мл, продукт AFSSA, Франция), 0,1 МЕ / мл считается пороговым значением сероконверсии после заражение вирусом бешенства как у хорьков, так и у собак.
После 60 мин инкубации при 37 ° C в увлажненном инкубаторе с 5% CO 2 в каждую лунку добавляли 50 мкл клеточной суспензии, содержащей 2 × 10 4 клеток, и планшеты инкубировали в течение 48 часов при 37 ° C. После фиксации при комнатной температуре в течение 30 мин в 80% ацетоне монослои клеток окрашивали путем добавления в каждую лунку FITC-конъюгированных моноклональных антител против нуклеопротеидов бешенства (Лаборатория эпидемиологии Ветеринарного института, Чанчунь, Китай). Окрашивание проводили в инкубаторе при 37 ° C в течение 30 мин, флуоресценцию наблюдали с помощью УФ-микроскопа (Zeiss, Германия).Лунки, не демонстрирующие специфической флуоресценции, считали положительными на антитела. Титры нейтрализующих антител рассчитывали по формуле Спирмена-Кербера и выражали в МЕ / мл по сравнению с эталонной сывороткой (13,5 МЕ / мл, продукт AFSSA, Франция), 0,1 МЕ / мл считается пороговым значением сероконверсии после заражение вирусом бешенства как у хорьков, так и у собак.
 и Р. П. Рединг. 2012. Проблемы восстановления черноногих хорьков: защита
и Р. П. Рединг. 2012. Проблемы восстановления черноногих хорьков: защита Бюллетень CDC для Службы общественного здравоохранения Федерального агентства безопасности
Бюллетень CDC для Службы общественного здравоохранения Федерального агентства безопасности 2010. Стратегия восстановления американского барсука
2010. Стратегия восстановления американского барсука 0000020269 00000 п.
0000021874 00000 п.
0000023547 00000 п.
0000023944 00000 п.
0000024274 00000 п.
0000024680 00000 п.
0000024745 00000 п.
0000026437 00000 п.
0000028098 00000 п.
0000092570 00000 п.
0000094504 00000 п.
0000094833 00000 п.
0000095344 00000 п.
0000097197 00000 п.
0000097508 00000 п.
0000097994 00000 п.
0000100651 00000 н.
0000100979 00000 н.
0000101501 00000 п.
0000106280 00000 н.
0000107077 00000 п.
0000107152 00000 н.
0000107310 00000 п.
0000107432 00000 н.
0000107606 00000 н.
0000107744 00000 н.
0000107884 00000 н.
0000108091 00000 н.
0000108382 00000 п.
0000108637 00000 п.
0000108800 00000 н.
0000109013 00000 н.
0000109277 00000 н.
0000109539 00000 п.
0000109746 00000 н.
0000109950 00000 н.
0000110182 00000 п.
0000110360 00000 п.
0000110612 00000 п.
0000110866 00000 н.
0000111018 00000 н.
0000111167 00000 н.
0000111320 00000 н.
0000111465 00000 н.
0000111617 00000 н.
0000111816 00000 н.
0000112015 00000 н.
0000112202 00000 н.
0000020269 00000 п.
0000021874 00000 п.
0000023547 00000 п.
0000023944 00000 п.
0000024274 00000 п.
0000024680 00000 п.
0000024745 00000 п.
0000026437 00000 п.
0000028098 00000 п.
0000092570 00000 п.
0000094504 00000 п.
0000094833 00000 п.
0000095344 00000 п.
0000097197 00000 п.
0000097508 00000 п.
0000097994 00000 п.
0000100651 00000 н.
0000100979 00000 н.
0000101501 00000 п.
0000106280 00000 н.
0000107077 00000 п.
0000107152 00000 н.
0000107310 00000 п.
0000107432 00000 н.
0000107606 00000 н.
0000107744 00000 н.
0000107884 00000 н.
0000108091 00000 н.
0000108382 00000 п.
0000108637 00000 п.
0000108800 00000 н.
0000109013 00000 н.
0000109277 00000 н.
0000109539 00000 п.
0000109746 00000 н.
0000109950 00000 н.
0000110182 00000 п.
0000110360 00000 п.
0000110612 00000 п.
0000110866 00000 н.
0000111018 00000 н.
0000111167 00000 н.
0000111320 00000 н.
0000111465 00000 н.
0000111617 00000 н.
0000111816 00000 н.
0000112015 00000 н.
0000112202 00000 н. 0000112374 00000 н.
0000112688 00000 н.
0000112817 00000 н.
0000113076 00000 н.
0000113285 00000 н.
0000113453 00000 н.
0000113702 00000 н.
0000113925 00000 н.
0000114138 00000 н.
0000114300 00000 н.
0000114550 00000 н.
0000114743 00000 н.
0000114906 00000 н.
0000115117 00000 н.
0000115314 00000 п.
0000115551 00000 н.
0000115808 00000 н.
0000116045 00000 н.
0000116274 00000 н.
0000116441 00000 н.
0000116614 00000 н.
0000116770 00000 н.
0000116965 00000 н.
0000117182 00000 н.
0000117371 00000 н.
0000117631 00000 н.
0000117796 00000 н.
0000117935 00000 п.
0000118182 00000 н.
0000118469 00000 н.
0000118618 00000 н.
0000118823 00000 н.
0000119072 00000 н.
0000119257 00000 н.
0000119452 00000 н.
0000119758 00000 н.
0000119954 00000 н.
0000120154 00000 н.
0000120302 00000 н.
0000120451 00000 п.
0000120600 00000 н.
0000120736 00000 н.
0000120942 00000 н.
0000121210 00000 н.
0000002396 00000 н.
трейлер
] / Назад 4976303 >>
startxref
0
%% EOF
8185 0 объект
> поток
ч {iTJ $ &
«QEd` @@ TTPTAq @ AP NJ7M» ܭ} _ թ JR ~]] K
0000112374 00000 н.
0000112688 00000 н.
0000112817 00000 н.
0000113076 00000 н.
0000113285 00000 н.
0000113453 00000 н.
0000113702 00000 н.
0000113925 00000 н.
0000114138 00000 н.
0000114300 00000 н.
0000114550 00000 н.
0000114743 00000 н.
0000114906 00000 н.
0000115117 00000 н.
0000115314 00000 п.
0000115551 00000 н.
0000115808 00000 н.
0000116045 00000 н.
0000116274 00000 н.
0000116441 00000 н.
0000116614 00000 н.
0000116770 00000 н.
0000116965 00000 н.
0000117182 00000 н.
0000117371 00000 н.
0000117631 00000 н.
0000117796 00000 н.
0000117935 00000 п.
0000118182 00000 н.
0000118469 00000 н.
0000118618 00000 н.
0000118823 00000 н.
0000119072 00000 н.
0000119257 00000 н.
0000119452 00000 н.
0000119758 00000 н.
0000119954 00000 н.
0000120154 00000 н.
0000120302 00000 н.
0000120451 00000 п.
0000120600 00000 н.
0000120736 00000 н.
0000120942 00000 н.
0000121210 00000 н.
0000002396 00000 н.
трейлер
] / Назад 4976303 >>
startxref
0
%% EOF
8185 0 объект
> поток
ч {iTJ $ &
«QEd` @@ TTPTAq @ AP NJ7M» ܭ} _ թ JR ~]] K Более 99% случаев коинфекции ВИЧ- M. tuberculosis происходит в развивающихся странах, где ограниченные ресурсы делают безотлагательной поиск эффективных и доступных методов лечения. Хотя противомикробные агенты против каждой из этих инфекций доступны, отдельные агенты, обладающие активностью как против M. tuberculosis , так и против ВИЧ, встречаются редко. Активность никотинамида оценивалась в 2 разные эпохи: в исследованиях против M. tuberculosis , проведенных в 1945–1961 годах, и в исследованиях против ВИЧ, проведенных с 1991 года по настоящее время.Этот обзор объединяет эти две группы исследований и поднимает вероятность того, что после дополнительных исследований эта небольшая молекула может появиться в начале 21 века либо как терапевтическое средство само по себе, либо как ведущее соединение для нового класса агентов с активность против M. tuberculosis и ВИЧ.
Более 99% случаев коинфекции ВИЧ- M. tuberculosis происходит в развивающихся странах, где ограниченные ресурсы делают безотлагательной поиск эффективных и доступных методов лечения. Хотя противомикробные агенты против каждой из этих инфекций доступны, отдельные агенты, обладающие активностью как против M. tuberculosis , так и против ВИЧ, встречаются редко. Активность никотинамида оценивалась в 2 разные эпохи: в исследованиях против M. tuberculosis , проведенных в 1945–1961 годах, и в исследованиях против ВИЧ, проведенных с 1991 года по настоящее время.Этот обзор объединяет эти две группы исследований и поднимает вероятность того, что после дополнительных исследований эта небольшая молекула может появиться в начале 21 века либо как терапевтическое средство само по себе, либо как ведущее соединение для нового класса агентов с активность против M. tuberculosis и ВИЧ. В 1945 году первые испытания стрептомицина на людях проходили в Соединенных Штатах [2], и во всем мире велись поиски других эффективных препаратов против Mycobacterium tuberculosis . В том же году в Париже Эрнст Хуант [3] сообщил об удачном открытии относительно использования никотинамида для лечения пациентов, проходящих лучевую терапию от «опухолей легких». Он обнаружил, что терапия никотинамидом, которую он начал в попытке защитить слизистые оболочки пациентов от воздействия радиации, уменьшила те инфильтраты в легких, которые были вызваны M.туберкулез . Этот отчет дополнил другой отчет из Франции Chorine [4], который предположил новую роль никотинамида, отличную от его известного витаминного эффекта, в качестве терапии против M. tuberculosis . McKenzie et al. [5], которые, по-видимому, проводили скрининг соединений, не зная ни о работе Huant, ни о Chorine, независимо подтвердили эти результаты.
В 1945 году первые испытания стрептомицина на людях проходили в Соединенных Штатах [2], и во всем мире велись поиски других эффективных препаратов против Mycobacterium tuberculosis . В том же году в Париже Эрнст Хуант [3] сообщил об удачном открытии относительно использования никотинамида для лечения пациентов, проходящих лучевую терапию от «опухолей легких». Он обнаружил, что терапия никотинамидом, которую он начал в попытке защитить слизистые оболочки пациентов от воздействия радиации, уменьшила те инфильтраты в легких, которые были вызваны M.туберкулез . Этот отчет дополнил другой отчет из Франции Chorine [4], который предположил новую роль никотинамида, отличную от его известного витаминного эффекта, в качестве терапии против M. tuberculosis . McKenzie et al. [5], которые, по-видимому, проводили скрининг соединений, не зная ни о работе Huant, ни о Chorine, независимо подтвердили эти результаты. tuberculosis в терапии в период с 1945 по 1951 год; Эти открытия были частично сделаны благодаря использованию никотинамида в качестве ведущего соединения (рис. 1) [6, 7].Монотерапия никотинамидом привела к клиническому улучшению до 64% из инфицированных M. tuberculosis пациентов, описанных в опубликованных отчетах [8]. Однако интерес к никотинамиду как к препарату для лечения M. tuberculosis быстро угас, когда одна из ведущих исследовательских групп того времени сообщила об антагонизме между никотинамидом и изониазидом, когда они использовались вместе в качестве терапевтического режима с двумя лекарствами [9].
tuberculosis в терапии в период с 1945 по 1951 год; Эти открытия были частично сделаны благодаря использованию никотинамида в качестве ведущего соединения (рис. 1) [6, 7].Монотерапия никотинамидом привела к клиническому улучшению до 64% из инфицированных M. tuberculosis пациентов, описанных в опубликованных отчетах [8]. Однако интерес к никотинамиду как к препарату для лечения M. tuberculosis быстро угас, когда одна из ведущих исследовательских групп того времени сообщила об антагонизме между никотинамидом и изониазидом, когда они использовались вместе в качестве терапевтического режима с двумя лекарствами [9]. tuberculosis [10].
tuberculosis [10]. Хотя было показано, что некоторые из ингибиторов нуклеозидной обратной транскриптазы обладают антибактериальным ингибирующим действием в дополнение к их известным антиретровирусным эффектам, эта антибактериальная активность не распространяется на микобактерии [16]. Было показано, что ряд цитокинов играет важную роль при обеих инфекциях, и доставка терапевтических цитокинов при этих инфекционных заболеваниях является областью активных исследований [17, 18].Никотинамид не является ни ингибитором обратной транскриптазы, ни цитокином. Хотя никотинамид является недорогим и доступным для перорального применения агентом без значительных побочных эффектов, который используется в течение 65 лет, остается много безответных вопросов относительно его необычного антимикробного спектра.
Хотя было показано, что некоторые из ингибиторов нуклеозидной обратной транскриптазы обладают антибактериальным ингибирующим действием в дополнение к их известным антиретровирусным эффектам, эта антибактериальная активность не распространяется на микобактерии [16]. Было показано, что ряд цитокинов играет важную роль при обеих инфекциях, и доставка терапевтических цитокинов при этих инфекционных заболеваниях является областью активных исследований [17, 18].Никотинамид не является ни ингибитором обратной транскриптазы, ни цитокином. Хотя никотинамид является недорогим и доступным для перорального применения агентом без значительных побочных эффектов, который используется в течение 65 лет, остается много безответных вопросов относительно его необычного антимикробного спектра. Ниацин, также известный как витамин B 3 , считается частью комплекса витаминов B. Ниацин может быть синтезирован в организме или получен непосредственно из пищевых источников; Фактически, по некоторым определениям, ниацин не является витамином, учитывая, что его синтез в организме человека достижим. Большая часть готового пищевого ниацина представляет собой никотинамид, а не никотиновую кислоту, хотя оба соединения легко транспортируются через желудочно-кишечный эпителий [10]. В организме никотиновая кислота превращается в никотинамид в гепатоцитах и эритроцитах, а затем никотинамид может транспортироваться в плазме для использования всеми клетками для синтеза никотинамидных нуклеотидов (т.е.например, никотинамидадениндинуклеотид [НАД] и никотинамидадениндинуклеотидфосфат) [20]. Для выполнения повседневных диетических требований требуется всего 20 мг ниацина. Когда эта диетическая потребность значительно превышена, ниацин в любой форме считается фармакологическим агентом или лекарством.
Ниацин, также известный как витамин B 3 , считается частью комплекса витаминов B. Ниацин может быть синтезирован в организме или получен непосредственно из пищевых источников; Фактически, по некоторым определениям, ниацин не является витамином, учитывая, что его синтез в организме человека достижим. Большая часть готового пищевого ниацина представляет собой никотинамид, а не никотиновую кислоту, хотя оба соединения легко транспортируются через желудочно-кишечный эпителий [10]. В организме никотиновая кислота превращается в никотинамид в гепатоцитах и эритроцитах, а затем никотинамид может транспортироваться в плазме для использования всеми клетками для синтеза никотинамидных нуклеотидов (т.е.например, никотинамидадениндинуклеотид [НАД] и никотинамидадениндинуклеотидфосфат) [20]. Для выполнения повседневных диетических требований требуется всего 20 мг ниацина. Когда эта диетическая потребность значительно превышена, ниацин в любой форме считается фармакологическим агентом или лекарством. Хотя никотинамид и никотиновая кислота могут использоваться взаимозаменяемо для лечения пеллагры, связанной с диетой, их другие фармакологические действия часто различаются (таблица 1) [10].
Хотя никотинамид и никотиновая кислота могут использоваться взаимозаменяемо для лечения пеллагры, связанной с диетой, их другие фармакологические действия часто различаются (таблица 1) [10]. 5 ч, а средняя максимальная концентрация в плазме составила 42,1 мкг / мл (0,3 м M ) [24].
5 ч, а средняя максимальная концентрация в плазме составила 42,1 мкг / мл (0,3 м M ) [24]. кислоты и был больше или равен эффекту стрептомицина [26, 27], хотя никотинамид был в 7 раз менее эффективен, чем пиразинамид [28].
кислоты и был больше или равен эффекту стрептомицина [26, 27], хотя никотинамид был в 7 раз менее эффективен, чем пиразинамид [28]. 2). Исследования на моделях неинфицированных животных показали, что изониазид ингибирует ферменты в пути окисления триптофана в организме хозяина [32]. Кроме того, при отсутствии достаточного количества доступного витамина B 6 ингибируется превращение триптофана в НАД [33].
2). Исследования на моделях неинфицированных животных показали, что изониазид ингибирует ферменты в пути окисления триптофана в организме хозяина [32]. Кроме того, при отсутствии достаточного количества доступного витамина B 6 ингибируется превращение триптофана в НАД [33].

 »Этих лекарств.
»Этих лекарств. Также в 1991 году Ямагоэ и др. [12] сообщили, что никотинамид может ингибировать длинный терминальный повтор ВИЧ в индуцибельной системе in vitro. Furlini et al. [40] продемонстрировали, что ВИЧ-инфекция связана с повышенным внутриклеточным рибозилированием белков АДФ. Недавно было показано, что активность PARP имеет решающее значение для эффективного действия интегразы ВИЧ, и ингибирование этого фермента никотинамидом может вызывать ингибирование в точке провирусной интеграции [41], хотя активность никотинамида в постинтеграционной модельной системе ВИЧ предполагает, что другие точки в системе вируса жизненный цикл также затронут.
Также в 1991 году Ямагоэ и др. [12] сообщили, что никотинамид может ингибировать длинный терминальный повтор ВИЧ в индуцибельной системе in vitro. Furlini et al. [40] продемонстрировали, что ВИЧ-инфекция связана с повышенным внутриклеточным рибозилированием белков АДФ. Недавно было показано, что активность PARP имеет решающее значение для эффективного действия интегразы ВИЧ, и ингибирование этого фермента никотинамидом может вызывать ингибирование в точке провирусной интеграции [41], хотя активность никотинамида в постинтеграционной модельной системе ВИЧ предполагает, что другие точки в системе вируса жизненный цикл также затронут. Дефицит триптофана в плазме, который является одной из пяти общих черт ВИЧ и пеллагры, был продемонстрирован у ВИЧ-положительных пациентов несколькими группами.В тесте использования фармакологических доз никотинамида для ВИЧ-инфицированных мы обнаружили специфическое и значительное повышение уровня триптофана в плазме после 2 месяцев лечения высокими дозами никотинамида [22]. Необходимы дальнейшие исследования, чтобы определить, влияет ли эта терапия на вирусную нагрузку, иммунную функцию или клинические исходы.
Дефицит триптофана в плазме, который является одной из пяти общих черт ВИЧ и пеллагры, был продемонстрирован у ВИЧ-положительных пациентов несколькими группами.В тесте использования фармакологических доз никотинамида для ВИЧ-инфицированных мы обнаружили специфическое и значительное повышение уровня триптофана в плазме после 2 месяцев лечения высокими дозами никотинамида [22]. Необходимы дальнейшие исследования, чтобы определить, влияет ли эта терапия на вирусную нагрузку, иммунную функцию или клинические исходы. Abrams et al. [44] отметили, что более высокое потребление ниацина было связано с более высоким количеством клеток CD4.Когда Tang et al. [45] изучали когорту многоцентрового когортного исследования СПИДа с использованием времени до смерти в качестве клинической конечной точки, они отметили, что ежедневное потребление ниацина, равное 3–4-кратной рекомендованной дневной дозе в США, коррелировало как независимая переменная с более медленным прогрессированием и улучшением выживание. Эти данные означают, что увеличение потребления ниацина с рекомендованной в США суточной нормы 20 мг / день (~ 0,3 мг / кг / день) до> 64 мг / день (~ 1 мг / кг / день), независимо от других вмешательств, может продлить жизнь ВИЧ-инфицированным пациентам (рисунок 4).Хотя нельзя ожидать, что такая доза ниацина приведет к концентрациям в плазме, сравнимым с наблюдаемым порогом противовирусного воздействия in vitro, эффекты ниацина, наблюдаемые Tang et al. [45] и Abrams et al. [44] может быть результатом других преимуществ, помимо прямых противовирусных эффектов, таких как восполнение внутриклеточных концентраций НАД в неинфицированных не Т-лимфоцитарных «клетках-свидетелях» [46].
Abrams et al. [44] отметили, что более высокое потребление ниацина было связано с более высоким количеством клеток CD4.Когда Tang et al. [45] изучали когорту многоцентрового когортного исследования СПИДа с использованием времени до смерти в качестве клинической конечной точки, они отметили, что ежедневное потребление ниацина, равное 3–4-кратной рекомендованной дневной дозе в США, коррелировало как независимая переменная с более медленным прогрессированием и улучшением выживание. Эти данные означают, что увеличение потребления ниацина с рекомендованной в США суточной нормы 20 мг / день (~ 0,3 мг / кг / день) до> 64 мг / день (~ 1 мг / кг / день), независимо от других вмешательств, может продлить жизнь ВИЧ-инфицированным пациентам (рисунок 4).Хотя нельзя ожидать, что такая доза ниацина приведет к концентрациям в плазме, сравнимым с наблюдаемым порогом противовирусного воздействия in vitro, эффекты ниацина, наблюдаемые Tang et al. [45] и Abrams et al. [44] может быть результатом других преимуществ, помимо прямых противовирусных эффектов, таких как восполнение внутриклеточных концентраций НАД в неинфицированных не Т-лимфоцитарных «клетках-свидетелях» [46].
 Одним из специфических иммуномодулирующих эффектов является изменение экспрессии HLA-DR [52]. Интересно, что экспрессия HLA-DR на Т-клетках удваивается у пациентов с моноинфекцией M. tuberculosis и втрое у пациентов с M.tuberculosis — коинфекция ВИЧ [53]; влияние никотинамида на HLA-DR Т-клеток у пациентов с M. tuberculosis или ВИЧ еще не изучено. Другие потенциально важные иммуномодулирующие эффекты никотинамида включают модуляцию действия цитокинов [54], изменения продукции оксида азота [55] и регуляцию молекулы межклеточной адгезии [56]. Недавние исследования закладывают основу для изучения роли никотинамида в обращении остановки пролиферации Т-клеток, связанной с истощением триптофана [57].
Одним из специфических иммуномодулирующих эффектов является изменение экспрессии HLA-DR [52]. Интересно, что экспрессия HLA-DR на Т-клетках удваивается у пациентов с моноинфекцией M. tuberculosis и втрое у пациентов с M.tuberculosis — коинфекция ВИЧ [53]; влияние никотинамида на HLA-DR Т-клеток у пациентов с M. tuberculosis или ВИЧ еще не изучено. Другие потенциально важные иммуномодулирующие эффекты никотинамида включают модуляцию действия цитокинов [54], изменения продукции оксида азота [55] и регуляцию молекулы межклеточной адгезии [56]. Недавние исследования закладывают основу для изучения роли никотинамида в обращении остановки пролиферации Т-клеток, связанной с истощением триптофана [57]. Хотя исследования неинфицированных здоровых субъектов показывают, что никотинамид составляет> 80% циркулирующего ниацина, необходимы дальнейшие исследования, чтобы определить, сохраняется ли такое же соотношение никотинамида и никотиновой кислоты 4: 1 у инфицированных людей [60].Степень повышения уровня ниацина в крови у пациентов с обеими инфекциями одинакова: у пациентов с инфекцией M. tuberculosis это повышение на 22% больше, чем в контрольной группе [58], а у пациентов с ВИЧ-инфекцией уровень высота на 17% больше, чем в контроле [59]. Когда в 1950-х годах повышенный уровень ниацина в крови был впервые обнаружен у пациентов с M. tuberculosis , было высказано предположение, что это повышение может быть связано с прямым производством никотиновой кислоты микобактериями; однако тот факт, что ВИЧ не может синтезировать ниацин, ставит под сомнение производство ниацина микробами как полное объяснение его повышенных уровней.На сегодняшний день не сообщалось об исследованиях уровня ниацина в крови у пациентов с коинфекцией.
Хотя исследования неинфицированных здоровых субъектов показывают, что никотинамид составляет> 80% циркулирующего ниацина, необходимы дальнейшие исследования, чтобы определить, сохраняется ли такое же соотношение никотинамида и никотиновой кислоты 4: 1 у инфицированных людей [60].Степень повышения уровня ниацина в крови у пациентов с обеими инфекциями одинакова: у пациентов с инфекцией M. tuberculosis это повышение на 22% больше, чем в контрольной группе [58], а у пациентов с ВИЧ-инфекцией уровень высота на 17% больше, чем в контроле [59]. Когда в 1950-х годах повышенный уровень ниацина в крови был впервые обнаружен у пациентов с M. tuberculosis , было высказано предположение, что это повышение может быть связано с прямым производством никотиновой кислоты микобактериями; однако тот факт, что ВИЧ не может синтезировать ниацин, ставит под сомнение производство ниацина микробами как полное объяснение его повышенных уровней.На сегодняшний день не сообщалось об исследованиях уровня ниацина в крови у пациентов с коинфекцией. При обеих инфекциях есть данные об активации окислительного метаболизма триптофана в ответ на инфекцию; этот ответ может повышать концентрацию ниацина в крови независимо от микробного метаболизма (рис. 2). Дальнейшее изучение врожденного стремления повышать уровень ниацина в крови во время этих инфекций, вероятно, будет способствовать нашему пониманию антимикробного механизма действия экзогенного никотинамида.
При обеих инфекциях есть данные об активации окислительного метаболизма триптофана в ответ на инфекцию; этот ответ может повышать концентрацию ниацина в крови независимо от микробного метаболизма (рис. 2). Дальнейшее изучение врожденного стремления повышать уровень ниацина в крови во время этих инфекций, вероятно, будет способствовать нашему пониманию антимикробного механизма действия экзогенного никотинамида.