ФАРМАТЕКА » Нецелесообразность назначения антибиотиков при бронхиолите и обструктивном бронхите у детей раннего возраста
Острые респираторные вирусные инфекции, протекающие с синдромом бронхиальной обструкции, являются одной из основных причин госпитализации и смертности в раннем возрасте. Бронхиолит, наиболее тяжелая форма поражения нижних дыхательных путей (НДП), требует стационарного лечения исходно здоровых детей и угрожает жизни недоношенных, младенцев с врожденными пороками сердца, бронхолегочной дисплазией, иммунодефицитными состояниями [1].
Бронхит и бронхиолит у детей имеют вирусную природу в 80 и 90 % случаев соответственно [2]. Первостепенную роль среди них играет респираторно-синцитиальный (РС) вирус [3, 4]. Однако нередко дети с этими заболеваниями получают антибактериальную терапию (АБТ) в отсутствие признаков сопутствующей бактериальной инфекции и/или тяжелой фоновой патологии [5].
Согласно нашей гипотезе, АБТ не влияет на течение острого бронхиолита (ОБЛ) или обструктивного бронхита (ОББ) у детей раннего возраста. Целью исследования является сравнение тяжести течения и длительность синдрома бронхиальной обструкции на фоне респираторной вирусной инфекции у детей, получавших и не получавших АБТ. Таким образом, мы надеемся избавить значительное большинство детей с вирусными инфекциями НДП от приема антибиотика, но при этом своевременно назначать антибиотик нуждающимся в нем больным.
Материал и методы
Исследование проведено в два этапа. Первая часть работы посвящена изучению распространенности бактериальных инфекций среди детей в возрасте до 24 месяцев, госпитализированных в круглосуточный стационар по поводу ОБЛ или ОББ. Критериями исключения из исследования являлись диагностированная бронхиальная астма и рентгенологически подтвержденная острая пневмония. С октября 2008 по декабрь 2011 г. на базе отделения диагностики и восстановительного лечения ФГБУ НЦЗД РАМН были обследованы 148 детей.
Во второй части исследования мы подвергли более детальному анализу 54 детей из общей выборки. Дополнительными критериями отбора были возраст до 12 месяцев, госпитализация не позднее 72 часов от появления бронхообструктивного синдрома и отсутствие АБТ на догоспитальном этапе. Критериями исключения являлись хронические болезни легких и сердца, диагностированная бронхиальная астма, а также крайне тяжелое состояние ребенка, требующее перевода пациента в реанимационное отделение. Это исследование проведено с октября 2009 по декабрь 2011 г.
Дополнительными критериями отбора были возраст до 12 месяцев, госпитализация не позднее 72 часов от появления бронхообструктивного синдрома и отсутствие АБТ на догоспитальном этапе. Критериями исключения являлись хронические болезни легких и сердца, диагностированная бронхиальная астма, а также крайне тяжелое состояние ребенка, требующее перевода пациента в реанимационное отделение. Это исследование проведено с октября 2009 по декабрь 2011 г.
Согласно классификации болезней НДП у детей, которой мы придерживались, ОБЛ и ОББ характеризуются признаками инфекции верхних дыхательных путей и бронхообструктивным синдромом, который проявляется сухим кашлем, тахипноэ, экспираторной одышкой с участием в акте дыхания вспомогательной мускулатуры и втяжениями уступчивых мест грудной клетки, а также аускультативными изменениями в легких, прежде всего в виде свистящих хрипов. Бронхиолит отличают от ОББ признаки выраженной дыхательной недостаточности и обилие влажных мелкопузырчатых хрипов, в то время как при ОББ преимущественно выслушиваются сухие свистящие хрипы.
Таблица 1. Шкала RDAI
Пациентам произведен забор носоглоточных смывов для определения РС-вируса методом иммунохроматографии и мазков из зева для выявления антигенов вирусов гриппа, парагриппа, РС- и аденовирусов с помощью реакции непрямой иммунофлуоресценции. Было принято считать РС-вирус положительным, если он был выявлен хотя бы одним из двух методов. Кроме того, каждому ребенку выполнен общий анализ крови.
Пациентам проведена ингаляционная бронхолитическая терапия и выполнены вспомогательные мероприятия, такие как аспирация слизистого отделяемого из носа, кислородотерапия, внутривенная регидратация по показаниям. Дети получали увлажненный кислород через лицевую маску при SpO2 менее 93 % (при дыхании комнатным воздухом).
Для оценки степени дыхательных нарушений использованы такие показатели, как частота дыхательных движений (ЧД), насыщение гемоглобина кислородом (SpO2), шкала респираторных нарушений (“Respiratory Distress Assessment Instrument”– RDAI), показывающая степень бронхиальной обструкции (см.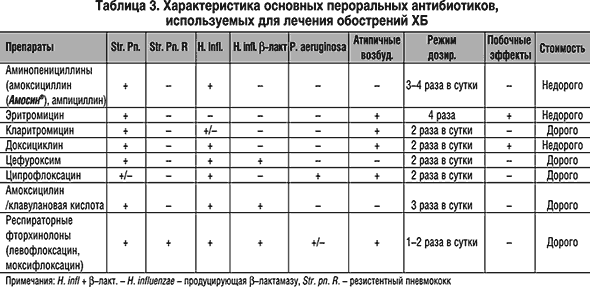 табл. 1).
табл. 1).
Динамические показатели состояния ребенка оценены при поступлении и далее ежедневно утром до ингаляции, по возможности – в спокойном состоянии. Если ребенок находился на оксигенотерапии, оценка его состояния производилась после того, как пациент дышал комнатным воздухом не менее 5 минут.
Кроме таких параметров, как частота дыхательных движений, SpO2, баллы по шкале респираторных нарушений, критериями эффективности терапии являлись частота и продолжительность оксигенотерапии, частота внеплановых бронхолитических ингаляций и частота введения системных глюкокортикостероидов, а также длительность госпитализации. За “длительность госпитализации” был принят промежуток времени от поступления в стационар до того момента, когда ребенок удовлетворял критериям выписки из стационара, таким как менее 4 баллов по шкале респираторных нарушений, SpO2 ≥ 95 % при дыхании комнатным воздухом, сохраняющееся на таком уровне не менее 4 часов, нормальный аппетит.
Статистический анализ полученных данных проведен с помощью программы Statistica 8.0 (StatSoft, USA). Использовались средства описательной статистики для переменных, имеющих нормальное и ненормальное распределение. Качественные данные были представлены как доли. Для сравнения двух независимых групп использован критерий Стьюдента при нормальном распределении признака и ранговый анализ вариаций по Краскелу–Уоллису в противном случае. Для сравнения несвязанных групп по частоте бинарного признака использован критерий χ2. Для лейкоцитоза рассчитаны прогностичность положительного и отрицательного результатов. Значение p < 0,05 принято в качестве порогового уровня статистической значимости.
Результаты
Среди исследованных 148 детей у 75 (51 %) пациентов был диагностирован ОБЛ, у 73 (49 %) – ОББ. Средний возраст составил 7,1 ± 6,9 месяца, соотношение мальчиков и девочек – 108/40.
На догоспитальном этапе антибиотики получал 51 (34 %) ребенок. Использовались антибиотики широкого спектра действия: защищенные аминопенициллины (13 детей) и цефалоспорины III поколения (13 детей), а также аминопенициллины, цефалоспорины I и II поколений и макролиды. Основанием к назначению антибиотиков на догоспитальном этапе для 6 детей были острый средний отит (ОСО), а для остальных 45 детей – подозрение на пневмонию, лихорадка, бронхит, лейкоцитоз более 10 тыс/мкл, сопутствующий кишечный синдром.
Основанием к назначению антибиотиков на догоспитальном этапе для 6 детей были острый средний отит (ОСО), а для остальных 45 детей – подозрение на пневмонию, лихорадка, бронхит, лейкоцитоз более 10 тыс/мкл, сопутствующий кишечный синдром.
В табл. 2 представлена сравнительная характеристика детей, которые получали и не получали антибиотики на догоспитальном этапе, на момент поступления. Обращает на себя внимание, что дети, которым назначались антибиотики, поступали на более поздних сроках болезни. В остальном группы детей не различались.
Таблица 2. Сравнительная характеристика детей, получавших и не получавших антибиотики на догоспитальном этапе
Среди пациентов, получавших антибиотики до госпитализации, лишь для 10 (20 %) АБТ была продолжена. Показания были следующими: у 7 детей – ОСО, у 1 – инфекция мочевыводящих путей (ИМП), у 2 – бактериальный энтероколит. Еще 24 детям антибиотик назначен в стационаре, среди них у 22 пациентов диагностирован ОСО, у 1 развилась бактериемия, у 1 – бактериальный энтероколит.
Решение о назначении антибиотиков принималось на основании клинических признаков – при выявлении очага бактериальной инфекции или при наличии признаков интоксикации и высокой лихорадки. Данные лабораторных исследований играли вспомогательную роль.
Мы проанализировали значимость лейкоцитоза для диагностики бактериальных инфекций у детей, страдавших ОБЛ или ОББ, и выявили, что лейкоцитоз 10–15 тыс/мкл отмечен у 56 (39 %) детей, 15 тыс/мкл и более – у 20 (14 %). Основными критериями диагностики вирусной инфекции являлись помимо идентификации вирусов клиническая картина и гладкое течение на фоне лечения без антибиотиков. Бактериальная инфекция отсутствовала с вероятностью 85 % при уровне лейкоцитов менее 15 тыс/мкл (
Системные глюкокортикостероиды на догоспитальном этапе получали 25 (17 %) детей. Среди этих пациентов лейкоцитоз ≥ 10 тыс./мкл при поступлении выявлен у 18 детей (p = 0,08), лейкоцитоз ≥ 15 тыс./мкл – у 4 детей (p = 0,7), т. е. не обнаружено влияния системных глюкокортикостероидов на уровень лейкоцитов у детей с бронхиолитом или обструктивным бронхитом. Динамика болезни была проанализирована для 54 из 148 детей с ОБЛ и ОББ. Средний возраст пациентов в этой группе составил 4,3 ± 2,4 месяца. Соотношение мальчиков и девочек составило 40 : 14. У 33 (61 %) детей был диагностирован ОБЛ, у 21 (39 %) – ОББ.
Среди этих пациентов лейкоцитоз ≥ 10 тыс./мкл при поступлении выявлен у 18 детей (p = 0,08), лейкоцитоз ≥ 15 тыс./мкл – у 4 детей (p = 0,7), т. е. не обнаружено влияния системных глюкокортикостероидов на уровень лейкоцитов у детей с бронхиолитом или обструктивным бронхитом. Динамика болезни была проанализирована для 54 из 148 детей с ОБЛ и ОББ. Средний возраст пациентов в этой группе составил 4,3 ± 2,4 месяца. Соотношение мальчиков и девочек составило 40 : 14. У 33 (61 %) детей был диагностирован ОБЛ, у 21 (39 %) – ОББ.
После госпитализации антибиотик был назначен 12 (22 %) детям – всем по поводу ОСО. Использовались антибиотики из следующих фармакологических групп: незащищенные аминопенициллины у 4 детей, защищенные аминопенициллины у 8 пациентов.
При сравнительном анализе состояния детей, получавших и не получавших антибиотик, по временной оси статистически значимых различий в течении болезни, отражающихся в динамике частоты дыхания, SpO2, оценки по шкале респираторных нарушений, не выявлено (рис.
Обсуждение
Современные протоколы лечения ОБЛ и ОББ у детей первых лет жизни подчеркивают вирусную этиологию поражения НДП и рекомендуют использовать антибиотики только при наличии признаков сопутствующей бактериальной инфекции [1, 2]. Так как выявить очаг бактериальной инфекции возможно не всегда, заподозрить бактериальную инфекцию у ребенка с ОБЛ или ОББ помогают наличие высокой лихорадки, признаки интоксикации (вялость, отказ от питья), повышенный уровень воспалительных маркеров крови. К сожалению, на практике дети, страдающие ОБЛ или ОББ, нередко получают антибиотики только из-за раннего возраста [6], повышения температуры тела [7], тревоги врача по поводу вторичной ИМП более вероятна, чем бактериемия или менингит. Среди 2396 детей с диагнозом РС-вирусного бронхиолита у 27 (69 %) из 39 детей с тяжелой бактериальной инфекцией диагностирована ИМП [14]. Проспективные исследования пациентов с ОБЛ и/или РС-вирусной инфекцией также продемонстрировали невысокую частоту тяжелой бактериальной инфекции, которая составила 1–12 % [18–20].
Проспективные исследования пациентов с ОБЛ и/или РС-вирусной инфекцией также продемонстрировали невысокую частоту тяжелой бактериальной инфекции, которая составила 1–12 % [18–20].
Таблица 3. Структура исследуемой группы детей по наличию/отсутствию бактериальной инфекции и по уровню лейкоцитоза
Отдельной категорией выступают дети первого месяца жизни. Для детей, заболевших ОБЛ в период новорожденности, риск тяжелой бактериальной инфекции составляет 9,7 %, что незначительно ниже риска для детей, не имеющих признаков бронхиолита (9,7 против 15,7). Общий риск тяжелой бактериальной инфекции у детей младше 28 дней, больных ОБЛ, не зависит от наличия или отсутствия РС-вирусной инфекции (10,1 и 14,2 % соответственно) [19]. Чаще всего очагом бактериальной инфекции у детейв возрасте до 1 месяца является инфекция мочевых путей, которая может приводить к развитию бактериемии. Во всех случаях тяжелой бактериальной инфекции у детей в возрасте от 29 до 60 дней с РС-вирусным бронхиолитом была диагностирована ИМП [19]. В отличие от новорожденных детей у лихорадящих пациентов в возрасте от 1 до 3 месяцев риск тяжелой бактериальной инфекции при наличии симптомов ОБЛ меньше, чем у детей без признаков бронхиолита (12,2 против 4 %) [19, 21, 22]. Частота ИМП у РС-положительных пациентов в возрасте от 28 до 60 дней была значительно меньше, чем у РС-отрицательных детей (5,5 и 11,7 % соответственно).
Рис. 1 Сранительная динамика частоты дыхания в различных группах детей (n=54), вов всех случаях p>0.05
Рис. 2Сранительная динамика SpO2 в различных группах детей (n=54), вов всех случаях p>0.05
Рис. 3Сранительная динамика бронхообструктивного синдрома по шкале респираторных нарушений в различных группах детей (n=54), вов всех случаях p>0.05
Эти литературные данные соответствуют нашим результатам. Частота сопутствующих бактериальных инфекций у детей, страдающих ОБЛ или ОББ, относительно невелика. Распространенность ИМП среди участников исследования составила 0,7 %. А среди всех детей раннего возраста, госпитализированных с лихорадкой, частота инфекции мочевыводящих путей составляет 11 % [23].
А среди всех детей раннего возраста, госпитализированных с лихорадкой, частота инфекции мочевыводящих путей составляет 11 % [23].
Вероятность бактериальной пневмонии у детей с бронхообструктивным синдромом крайне мала [24]. Более того, по данным Hall [25], приблизительно 25 % госпитализированных по поводу бронхиолита детей имеют рентгенологические признаки ателектазов или инфильтратов, часто неправильно интерпретируемых как вероятная бактериальная инфекция. По данным Sahib El-Radhi [26], лихорадка у детей с ОБЛ ассоциируется с наличием легочных инфильтративных изменений и более тяжелым течением болезни.
Таблица 4. Сравнительный анализ тяжести течения и длительности болезни в зависимости от назначения АБТ
ОСО часто сопутствует ОБЛ и ОББ. Хотя он может иметь РС-вирусную этиологию, нет никаких клинических признаков, которые позволяют отличить вирусный ОСО от бактериального. Andrade и соавт. [27] в проспективном исследовании выявил ОСО у 62 % пациентов с ОБЛ – у 50 % детей на момент включения в исследование, и у 12 % детей он развился в течение последующих 10 дней. Бактериальные патогены были выделены в 94 % аспиратов из среднего уха, среди них наиболее часто встречались Streptococcuspneumoniae, Haemophilusinfluenzaeи Moraxellacatarrhalis. В другой работе были исследованы 150 детей, госпитализированных по поводу ОБЛ [28]. У 79 (53 %) детей развился ОСО, причем 2/3 – в течение первых двух дней госпитализации. Тимпаноцентез был выполнен для 64 детей с ОСО, в 33 аспиратах среднего уха выявлены указанные выше бактериальные патогены. ОСО не влиял на респираторную симптоматику и лабораторные данные при ОБЛ [29].
Бесполезность лейкоцитоза как критерия диагностики тяжелой бактериальной инфекции у детей первых лет жизни, госпитализированных по поводу РС-вирусного поражения НДП, продемонстрирована в работе Brand [30], и эти результаты соответствуют нашим данным. Trautner и соавт. [31] показали, что ни уровень лейкоцитоза, ни абсолютное число нейтрофилов не являлись прогностическими маркерами бактериальной инфекции у больных с гиперпирексией. У детей с РС-вирусным бронхиолитом показано, что только лейкоцитоз выше 30 × 109/л может указывать на наличие тяжелой бактериальной инфекции [32].
У детей с РС-вирусным бронхиолитом показано, что только лейкоцитоз выше 30 × 109/л может указывать на наличие тяжелой бактериальной инфекции [32].
Не следует забывать об атипичной природе острого бронхита и пневмонии в первые месяцы жизни. Приступообразный кашель “стаккато” наряду с конъюнктивитом, тахипноэ и влажными хрипами в легких ребенка первых трех месяцев жизни говорят о хламидийной пневмонии [2]. При этом конъюнктивит может появиться у ребенка после первого месяца жизни. Для инфекции Chlamydiatrachomatisналичие лихорадки и сухих хрипов в легких не характерно. В крови опреде ляется эозинофилия, рентгенологические изменения включают вздутие легких и незначительную инфильтрацию интерстициального и альвеолярного характера. Обычно есть указания на генитальный хламидиоз у матери во время беременности. Такие дети требуют лечения антибиотиком из группы макролидов, предпочтительно использование джозамицина в суспензии, поскольку другие макролиды иногда вызывают явления пилороспазма у детей до 3 месяцев.
Итак, ОБЛ и ОББ имеют вирусную этиологию. АБТ не способствует более быстрому купированию респираторных нарушений и не сокращает длительность госпитализации. АБТ связана с серьезными экономическими затратами [5], а также нередко может приводить к развитию таких неблагоприятных последствий, как нарушение микробиоценоза, аллергические реакции, а также к росту антибиотикорезистентности бактериальной флоры. Наряду с этим не следует забывать об опасности не лечить ребенка, имеющего бактериальную инфекцию, и в этом прежде всего помогают клинические признаки, в частности лихорадка, интоксикация, отоскопические изменения, общий анализ мочи. Описанные выше критерии помогут более рациональному использованию антибиотиков детьми, страдающими бронхиолитом или ОББ.
Антибиотики – что же это такое?
Антибиотики – что же это такое?
Антибиотики (от анти… и греч. bĺоs — жизнь), вещества биологического происхождения, синтезируемые микроорганизмами, которым свойственно как подавлять рост патогенных микроорганизмов, так и полностью уничтожать их.
Еще каких-нибудь 100 лет назад люди погибали от таких недугов как менингит, воспаление легких и многих других инфекционныхболезней. Их гибель была обусловлена отсутствием каких-либо противомикробных препаратов. Получается, что антибиотики спасли людей от вымирания. Именно с их помощью удалось снизить смертность больных с различными инфекционными заболеваниями в сотни, а порой и в тысячи раз.
Какие бывают антибиотики
К настоящему времени создано более 200 противомикробных препаратов, из них более 150 используются для лечения детей. Их мудреные названия нередко ставят в тупик людей, не имеющих отношения к медицине. Как же разобраться в обилии замысловатых терминов? Все антибиотики делятся на группы — в зависимости от способа воздействия на микроорганизмы. Первая группа – бактерицидные антибиотики, они воздействуют на микробы, уничтожая их. Вторая группа – бактериостатики, они подавляют рост бактерий.
Когда же необходимо давать ребенку антибиотики?
Если Вы заподозрили какое-то инфекционное заболевание, то первый кому Вы должны об этом сообщить – это врач. Именно он поможет Вам определить, что случилось и выставит диагноз. Заболевание можно лечить правильно лишь тогда, когда правильно выставлен диагноз! Именно доктор должен Вам назначить необходимый антибиотик, определить дозировку и способ введения, дать рекомендации по режиму приема и сообщить о возможных побочных эффектах. Важно, чтобы данное лечение назначал врач, так как только он может адекватно оценить состояние ребенка, тяжесть заболевания, учесть сопутствующие заболевания , а потому свести к минимуму возможность осложнений.
Как долго принимают антибиотик?
При большинстве острых болезней его дают в течение 2-3 дней после падения температуры, однако есть и исключения. Так, отит обычно лечат амоксициллином не более 7-10 дней, а ангину — не менее 10 дней, иначе может быть рецидив.
В какой форме лучше давать антибиотик ребенку?
Для детей выпускаются препараты в специальных детских формах. Это могут быть растворимые таблетки, их легко дать с молоком или чаем, сиропы или гранулы для приготовления суспензий. Часто они имеют приятный аромат и вкус, что не вызывает отрицательных эмоций у больного ребенка
Это могут быть растворимые таблетки, их легко дать с молоком или чаем, сиропы или гранулы для приготовления суспензий. Часто они имеют приятный аромат и вкус, что не вызывает отрицательных эмоций у больного ребенка
Антибиотики и дисбактериоз — всегда вместе?
Поскольку антибиотики подавляют нормальную флору организма, они могут вызывать дисбактериоз, т.е. размножение патогенных бактерий или грибов, не свойственных кишечнику. Однако лишь в редких случаях такой дисбактериоз опасен: при коротких курсах лечения антибиотиками проявления дисбактериоза встречаются крайне редко. Так что противогрибковые (нистатин) и бактериальные (Линекс,Бифидумбактерин и др.) препараты применяются для предупреждения дисбактериоза лишь в случаях длительного лечения несколькими лекарственными препаратами широкого антибактериального спектра.
Какие побочные эффекты возможны при приеме антибиотиков?
Опасности, связанные с приемом антибиотиков, часто преувеличивают, но помнить о них необходимо всегда. О дисбактериозе мы уже говорили. Еще одна опасность, подстерегающая при приеме антибиотиков, — аллергия. У некоторых людей (в том числе и у грудных детей) имеется аллергия к пенициллинам и другим препаратам-антибиотикам: сыпи, шоковые реакции (последние, к счастью, встречаются очень редко). Если у вашего ребенка уже наблюдалась реакция на тот или иной антибиотик, об этом надо обязательно сообщить врачу, и он легко подберет замену. Особенно часты аллергические реакции в тех случаях, когда антибиотик дают больному, страдающему заболеванием небактериальной (вирусной) природы: дело в том, что многие бактериальные инфекции как бы снижают «аллергическую готовность» больного, что уменьшает риск реакции на антибиотик.
К наиболее серьезным нежелательным явлениям относятся специфические поражения органов и систем, развивающиеся под воздействием отдельных лекарств. Именно поэтому к разрешенным для применения у детей младших возрастных групп (и беременных женщин) относятся только хорошо изученные в течение многих лет препараты. Из опасных для детей антибиотиков можно назватьаминогликозиды(стрептомицин, гентамицин и др.)которые могут вызывать поражение почек и глухоту; тетрациклины (доксициклин) окрашивают эмаль растущих зубов, их дают детям только после 8 лет, препараты фторхинолонов (норфлоксацин, ципрофлоксацин) детям не назначают из-за опасности нарушения роста, их дают лишь по жизненным показаниям.
Из опасных для детей антибиотиков можно назватьаминогликозиды(стрептомицин, гентамицин и др.)которые могут вызывать поражение почек и глухоту; тетрациклины (доксициклин) окрашивают эмаль растущих зубов, их дают детям только после 8 лет, препараты фторхинолонов (норфлоксацин, ципрофлоксацин) детям не назначают из-за опасности нарушения роста, их дают лишь по жизненным показаниям.
Нужны ли антибиотики при лечении ОРВИ?
Антибиотики способны излечить заболевание, вызванное бактериями, грибками и простейшими, но не вирусами. Надо ли при каждом эпизоде заболевания давать антибиотик? Родители должны понимать, что естественная частота инфекций дыхательных путей у детей дошкольного возраста составляет 6 – 10 эпизодов в год и назначение антибиотиков при каждом эпизоде инфекции – непомерная нагрузка на организм ребенка. Известно, что острый ринит и острый бронхит практически всегда вызываются вирусами, а ангина, острый отит и синусит в значительной части случаев – бактериями. Поэтому при остром рините (насморке) и бронхите антибиотики не показаны. Особо следует отметить, что за очень популярным критерием назначения антибиотиков при вирусных инфекциях — сохранение повышенной температуры в течение 3-х дней – нет ровным счетом никаких обоснований. Естественная длительность лихорадочного периода при вирусных инфекциях дыхательных путей у детей может составлять от 3 до 7 дней, иногда и больше. Более длительное сохранение так называемой субфебрильной температуры (37,0-37,5° градусов С) может быть связано со многими причинами. В таких ситуациях попытки добиться нормализации температуры тела назначением последовательных курсов различных антибиотиков обречены на неудачу и откладывают выяснение истиной причины патологического состояния. Типичным вариантом течения вирусной инфекции также является сохранение кашля на фоне улучшения общего состояния и нормализации температуры тела. Необходимо помнить, что антибиотики – не являются противокашлевыми средствами. У родителей в этой ситуации есть широкие возможности по применению народных противокашлевых средств. Кашель является естественным защитным механизмом, он исчезает последним из всех симптомов заболевания.
Кашель является естественным защитным механизмом, он исчезает последним из всех симптомов заболевания.
Антибиотики это достижение цивилизации от которого нам не следует отказываться, но и применять их надо грамотно, только под контролем врача, и строго по показаниям!
диагностика и современное лечения заболевания. — Into-Sana
Бронхит — это воспаление бронхов (нижних дыхательных путей). Данное заболевание часто диагностируется в раннем возрасте. Связано это с тем, что у маленьких детей еще не сформировался общий и местный иммунитет, слизистая оболочка бронхов рыхлая и чувствительная к раздражителям, мукоцилиарный аппарат развит недостаточно, гладкая мускулатура бронхиол склонна к спазму, мышцы грудной клетки слабые, кашлевой центр еще адаптируется. Все это делает бронхи ребенка идеальной мишенью для патогенных микроорганизмов.
Причины возникновения бронхита
Причины возникновения бронхита могут иметь биологическую, химическую или аллергическую природу. Выделяют следующие группы факторов:
- Вирусы. Грипп, парагрипп, аденовирусная инфекция и другие возбудители поражают слизистую оболочку дыхательных путей и приводят к воспалению, интоксикации, общему недомоганию. Заражается ребенок воздушно-капельным путем, находясь в контакте с больными ОРВИ. Пик заболеваемости приходится на период весна-осень, когда организм наиболее восприимчив к вирусам на фоне авитаминоза.
- Бактерии. Иногда они тоже являются причиной бронхита. Стрептококки, моракселлы, гемофильные палочки, стафилококки и другие микроорганизмы могут попасть в организм ребенка в тот момент, когда он кладет в рот немытые продукты или игрушки. Следует помнить, что часто мы имеем дело со смешанной бактериально-вирусной этиологией бронхита, так как под воздействием вируса иммунная система у детей ослабляется, обезоруживая организм перед бактериями.
- Химические факторы.
 Пары агрессивных веществ раздражают слизистую оболочку бронхов. Ребенок страдает от их воздействия, если вы проживаете возле химического предприятия или в загруженном транспортом районе. Но чаще всего причина бытовая – это пассивное курение. Контакт с табачным дымом происходит дома, на улице, в школе или других общественных местах.
Пары агрессивных веществ раздражают слизистую оболочку бронхов. Ребенок страдает от их воздействия, если вы проживаете возле химического предприятия или в загруженном транспортом районе. Но чаще всего причина бытовая – это пассивное курение. Контакт с табачным дымом происходит дома, на улице, в школе или других общественных местах. - Аллергены. Ребенок может иметь повышенную чувствительность к любым аллергенам: пыль, пыльца растений, шерсть домашних животных и др. При постоянном контакте с ними возникает аллергическое воспаление, характеризующееся обильной продукцией слизи и склонностью к бронхиальной обструкции (сужению просвета дыхательных путей).
- Патологии развития бронхов. Дети могут иметь от рождения различные аномалии (структурные отклонения) дыхательных путей. Среди них встречаются врожденные бронхоэктазы (расширения бронхов), гипоплазии или аплазии (недоразвитие или полное отсутствие той или иной части дыхательной системы), врожденные кисты. Они проявляются предрасположенностью к воспалительным заболеваниям. Поэтому если Ваш ребенок страдает на частые ОРВИ, которые осложняются тяжелым бронхитом или пневмонией, стоит задуматься о наличии пороков развития дыхательных путей. Здесь немаловажную роль играет наследственность. Кроме анатомического несовершенства при рецидивирующих бронхитах следует помнить и о нарушении мукоцилиарного барьера, который наблюдается при муковисцидозе.
Виды бронхита
Бронхит классифицируется по характеру течения болезни, типу поражения слизистой бронхов, этиологии.
По характеру течения различают:
- Острый бронхит.Симптомы возникают за несколько дней. Как правило, болезнь начинается с классических проявлений ОРВИ (общее недомогание, боль в горле, насморк), затем присоединяется сухой или продуктивный влажный кашель. Длится острый бронхит около двух недель. В основе заболевание лежит воспалительный процесс в слизистой оболочке бронхов без клинических признаков поражения легочной ткани.

- Хронический бронхит. Симптоматика стертая, мало выраженная. Врач ставит этот диагноз, если ребенок кашляет непрерывно более 6 недель, если имеется 3 и больше обострений в год на протяжении двух лет. Даже в период ремиссий наблюдается периодический кашель. Для хронического бронхита характерно поражение всех слоев бронхиальной стенки.
Этиологические причины бронхитов у детей зависят от возраста и эпидемиологической ситуации. Основными возбудителями заболевания в любой возрастной группе являются такие вирусы, как грипп, парагрипп, риновирус, аденовирусная инфекция. У малышей до 3 лет чаще встречаются риносинцитиальный вирус, бактериальные микроорганизмы (Haemophilus influenzae, Streptococcus pneumoniae, Moraxella catarrhalis). Для возникновения бронхита огромное значение имеет сезонность (осенне-зимний период), “скученность” (нахождение в большом детском коллективе, проживание в домах-интернатах, общежитии), эпидемия.
В клинической практике широко распространено разделение патологии в зависимости от бронхиальной обструкции (сужения просвета и нарушения проходимости бронхов разного калибра вследствие отека слизистой оболочки, гиперсекреции вязкой слизи, бронхоспазма) на обструктивный и необструктивный тип. Дети первых 3 лет жизни имеют повышенную склонность к бронхоспастическому синдрому при контакте с раздражителем любой этиологии ввиду анатомо-физиологических особенностей. В большинстве случаев после купирования острого воспаления проходимость бронхов восстанавливается, но иногда (крайне редко у детей) в результате гиперчувствительности бронхов болезнь может перейти в хронический обструктивный бронхит.
Симптомы бронхита
Клиническая картина во многом зависит от этиологии бронхита. При вирусном поражении болезнь начинается с общего недомогания, ухудшения аппетита, покашливания, насморка. Это классические признаки ОРВИ. Однако каждый из вирусов имеет свою специфику. Например, при гриппе на первый план выступает боль за грудиной и сухой кашель. Аденовирусы же приводят к повышенному слезотечению.
Аденовирусы же приводят к повышенному слезотечению.
Непосредственные симптомы бронхита проявляются спустя несколько дней после появления классических признаков ОРВИ. Ребенок кашляет, вначале без выделения мокроты. На пятый-шестой день кашель становится продуктивным, появляется мокрота. Но цвет мокроты еще ничего не говорит о возбудителе: если появилась зеленая мокрота — это еще не признак того, что присоединилась патологическая бактериальная флора и ребенку пора давать антибиотики. Температура поднимается до 38-39°C, проявляются симптомы общей интоксикации: ухудшение сна, вялость, потливость. При вирусном бронхите такая температура длится 2-3 дня, затем снижается. При присоединении же бактериальной инфекции или изначально бактериальном бронхите, температура с каждым днем склонна к повышению.
Обструктивный бронхит и бронхиолит (воспаление нижних отделов дыхательных путей у детей младшего возраста) проявляются отличительной симптоматикой. Ребенок беспокоен, чувствует одышку, нехватку воздуха, можно услышать клокочущее дыхание со свистом, булькающие влажные хрипы определяются даже через грудную клетку, кашель становится малопродуктивным и изнуряющим, отмечается западение грудины и межреберных промежутков при затрудненном вдохе, сердцебиение учащается, появляется синюшность кожи и слизистых.
Диагностика бронхита
Диагностика включает в себя выяснение анамнеза, объективный осмотр (перкуссия, аускультация), лабораторные и инструментальные методы исследования.
- Общий анализ крови. Формула крови дает возможность предположить первопричину болезни.
- Однако наиболее точный анализ, который отличает бактериальное воспаление от небактериального – это измерение уровня прокальцитонина в крови. При его повышении можно с уверенностью говорить о бактериальном бронхите.
- Анализ мокроты. Для более точного определения этиологии применяют исследование образца мокроты. Можно проводить бактериологический посев с идентификацией возбудителя или микроскопический анализ.
 С целью быстрой диагностики делают ПЦР – полимеразную цепную реакцию, которая позволяет выявить ДНК или РНК микроорганизма.
С целью быстрой диагностики делают ПЦР – полимеразную цепную реакцию, которая позволяет выявить ДНК или РНК микроорганизма. - Рентген органов грудной полости в двух проекциях. Быстрый и достаточно точный метод исследования. Его назначают в тех случаях, когда необходимо отличить бронхит от пневмонии. Позволяет увидеть очаги воспаления в легочной ткани или изменения легочного рисунка.
- Спирография. Применяется у детей с обструктивным бронхитом или бронхиальной астмой. Дает возможность определить уровень обструкции, ее обратимость.
- Бронхоскопия при бронхите делается только при подозрении на врожденные аномалии развития трахео-бронхиального дерева или с лечебной целью для тщательной санации бронхов от чрезмерной вязкой слизи и гноя, расширения просвета бронхов, местного введения лекарственных средств (антибиотики, муколитики, гормоны) непосредственно в очаг воспаления. Это информативный метод, позволяющий уточнить характер течения заболевания и установить его причину.
Методы лечения бронхита
Лечение бронхита медикаментозное. Также важную роль играет режим дня больного и его рацион: необходимо уделять внимание легко усваиваемым продуктам (супам, бульонам, молочным кашам). Питье должно быть обильным (компоты из ягод или сухофруктов, теплое молоко, щелочные минеральные воды).
Вирусные бронхиты в первые 48 часов от начала болезни требуют назначения этиотропной противовирусной терапии: блокаторов М2-каналов и ингибиторов нейраминидазы. Остальные же вирусные бронхиты требуют только симптоматического лечения.
Бактериальный бронхит лечится с помощью антибиотиков, выбор которых зависит от возбудителя. При вирусном бронхите антибиотики даются только при присоединении бактериальной инфекции.
Обструктивный бронхит требует назначения ингаляций топических бронхолитиков, если обструкция выраженная. Если же изменения незначительные, то зачастую при исчезновении воспаления исчезает и обструкция.
В периоде выздоровления может назначаться физиотерапия: вибрационный массаж, ингаляции, ускоряющие эвакуацию мокроты из бронхов.
Последствия бронхита
При неправильном лечении или низкой сопротивляемости организма бронхит может иметь серьезные последствия. Прежде всего, это пневмония. У ребенка возникает дополнительный очаг воспаления в ткани легких, что приводит к дыхательной недостаточности.
Также возможен переход бронхита в хроническую форму. Это осложнение появляется при преждевременном прекращении терапии, нерегулярном приеме медикаментов, раздражении бронхов химическими веществами.
Если Вам дорого здоровье своего ребенка, не занимайтесь самолечением. Обратитесь к грамотному специалисту, который проведет полноценную диагностику и назначит правильную терапию. В клинике Into-Sana Вы можете записаться на прием и пройти обследование в удобное время.
Азитрокс суспензии — макролидный антибиотик широкого спектра действия для детей с 6 мес.
АЗИТРОКС – макролидный антибиотик широкого спектра действия для детей с 6 мес.
Свойства молекулы и препарата
- широкий спектр антимикробного действия – обладает активностью в отношении грамположительных, грамотрицательных, анаэробных, внутриклеточных и других микроорганизмов
- блокировка роста и размножения бактерий
- способность оказывать бактерицидное действие
- высокие тканевые и внутриклеточные концентрации – в 50 раз выше, чем в плазме крови
- направленное и пролонгированное действие в очагах инфекции:
- проходит через гистогематические барьеры
- доставляется непосредственно к месту инфекции макрофагами
- концентрация в очаге инфекции на 24-34% больше, чем в здоровых тканях
- сохраняет терапевтические концентрации в очаге воспаления до 5-7 дней после приема последней дозы
- длительный период полувыведения (2-4 дня) обеспечивает возможность однократного приема в сутки
- короткие курсы лечения
- возможность использования в детской практике с 6-месячного возраста
Особенности формы выпуска
- двухкомпонентная крышка с контролем первого вскрытия и защитой от самостоятельного употребления препарата детьми
- фруктовый аромат приготовленной суспензии – банан-вишня-ваниль
- комплектация упаковки двумя дозирующими устройствами:
- двухсторонняя мерная ложечка на 2.
 5 и 5 мл
5 и 5 мл - пипетка для дозирования в форме мерного шприца
- две формы выпуска для детей разных возрастных и весовых групп
- суспензия 100 мг/ 5 мл – рекомендуется для лечения детей весом до 10 кг
- суспензия 200 мг/ 5 мл – предпочтительна при лечении детей весом более 10 кг
Показания к применению
инфекционно-воспалительные заболевания, вызванные чувствительными к препарату микроорганизмами:
- инфекции верхних отделов дыхательных путей и ЛОР-органов, в т.ч.:
- тонзиллит
- фарингит
- синусит
- средний отит
- инфекции нижних отделов дыхательных путей, в т.ч.:
- острый бронхит
- обострение хронического бронхита
- внебольничная пневмония
- инфекции кожи и мягких тканей:
- рожа
- импетиго
- вторичные пиодерматозы
- болезнь Лайма – начальная стадия (мигрирующая эритема – erythema migrans)
- угри обыкновенные (акне) средней степени тяжести
- инфекции мочеполовых путей, вызванные C.trachomatis:
- уретрит
- цервицит
Противопоказания к применению
- детский возраст до 6 месяцев
- повышенная чувствительность к азитромицину и другим компонентам препарата
- нарушение функции печени (более подробно – см. инструкцию по медицинскому применению).
ИНФОРМАЦИЯ ПРЕДНАЗНАЧЕНА ДЛЯ СПЕЦИАЛИСТОВ ЗДРАВООХРАНЕНИЯ
Другие формы выпуска
Когда и зачем назначать антибиотики при бронхиолите у детей?
Бронхиолит — это самоограничивающаяся, легко диагностируемая острая респираторная инфекция у детей в возрасте до 4 лет. Национальные и международные руководящие принципы не рекомендуют использовать рентгеновские лучи для диагностики и использовать стероиды и антибиотики для их лечения.
В Юго-Восточной Азии; муссон играет важную роль в возникновении, распространении и распространении различных вирусных инфекций у детей, включая грипп, пневмонию и бронхиолит.Эти клинические синдромы часто совпадают в клинических картинах лихорадки, хрипов, комплекса тахипноэ, что затрудняет дифференциальный диагноз.
Кроме того, младенцы младшего возраста имеют низкий иммунитет, и местная иммуносупрессия респираторного эпителия может сделать ребенка предрасположенным к вторичным вирусным или бактериальным инфекциям; со временем ухудшение ситуации. Педиатры — профессионалы, которые больше всего боятся бактериальных инфекций и злоупотребляют антибиотиками при инфекциях дыхательной системы; поскольку суждения разных педиатров могут отличаться на разных стадиях заболевания в течение одного дня из-за динамического характера респираторных инфекций.Вирусная инфекция, которая сегодня называется ринитом, завтра может быть бронхиолитом или пневмонией; что не так легко предсказать, когда ребенок не госпитализирован и не находится под наблюдением.
Почти все причины бронхиолита являются вирусными, за исключением микоплазмы, которая может вызывать бронхиолит у детей старше двух лет и требует лечения антибиотиками.
Отговорить от использования антибиотиков при бронхиолите легко, но так же трудно указать, когда их использовать, если диагноз во всех случаях является эмпирическим.Здесь мы обсуждаем, почему предполагаемый случай бронхиолита может быть не так и может потребоваться антибиотик. Желательно, чтобы эти вопросы освещались всеми органами, разрабатывающими руководства, чтобы юридически облегчить жизнь практикующим педиатрам.
1. Бронхиолит с отказом от пищи и вялостью: Большинство случаев бронхиолита легко поддаются лечению в амбулаторных условиях с помощью симптоматической терапии. Когда у младенца развивается летаргия; это ранний клинический маркер дыхательной недостаточности, усталости или пневмонии.Эти случаи близки к прогрессированию сепсиса; действительно заслуживают эмпирической антибактериальной терапии.
2. Бронхиолит со стойкой гипоксией: случаи бронхиолита, при котором гипоксия не разрешается только с помощью распыления; нужна постоянная кислородная поддержка в течение дня или двух. Если эта потребность продлевается до четырех дней с сохранением лихорадки; Не исключено подозрение на добавление бактериальной инфекции.
3. Бронхиолит без насморка в анамнезе: Большинство бронхиолитов являются вирусными инфекциями, вызванными RSV.RSV обычно вызывает двухдневную лихорадку с насморком в начале. Если у пациента нет насморка; Вероятно, это инвазивная инфекция, и ее следует лечить специальными эмпирическими антибиотиками.
4. Бронхиолит с асимметрией клинических признаков: при подозрении на бронхиолит; асимметрия узлов, бляшки на горле или дольчатая консолидация должны требовать соответствующего антибактериального курса.
5. Бронхиолит с лейкемоидной реакцией на общий анализ крови: это может быть проявлением инфекции Bacillus Pertussis.Следовательно, следует начать прием соответствующих антибиотиков.
6. Бронхиолит с преобладанием кашля. Часто бронхиолит представляет собой заболевание, которое проявляется недомоганием и хрипами; но если кашель становится доминирующим симптомом; Конечно, мы упускаем из виду вероятность аспирационной пневмонии или микоплазменной инфекции. Это нельзя считать консервативным и требует использования антибиотиков.
Таким образом, даже несмотря на то, что при бронхиолите легко отказаться от применения антибиотиков; неоднозначность клинического диагноза на ранних стадиях инфекции и динамики заболевания заставляют педиатра эмпирически подумать о начале курса антибиотиков в выбранном случае на основании вышеуказанных оснований; с должным уважением к руководящим принципам.Автор рекомендует не иметь жесткой политики, помня об этом.
Влияние использования антибиотиков при остром бронхиолите на впервые возникшую астму у детей
Наши результаты показывают, что раннее применение антибиотиков у детей с острым бронхиолитом в значительной степени связано с развитием впервые возникшей астмы. Кроме того, наше сравнение эффектов отдельных антибиотиков показало, что использование высоких доз азитромицина оказало наибольшее влияние на развитие впервые возникшей астмы.
Кроме того, наше сравнение эффектов отдельных антибиотиков показало, что использование высоких доз азитромицина оказало наибольшее влияние на развитие впервые возникшей астмы.
Бронхиолит — самая частая причина госпитализации младенцев и детей раннего возраста. Респираторно-синцитиальный вирус (РСВ) и риновирус являются двумя наиболее распространенными возбудителями острого бронхиолита 12 , и инфицирование любым из этих вирусов увеличивает риск аллергических заболеваний. Предыдущие исследования показали, что азитромицин может уменьшить количество эпизодов свистящего дыхания при бронхиолите, опосредованном RSV, благодаря своему противовоспалительному эффекту 13 . На Тайване детям младше 2 лет могут назначаться антибиотики для лечения острого бронхиолита, чтобы предотвратить бактериальную супраинфекцию или уменьшить хрипы.В последние десятилетия наблюдается высокий уровень использования антибиотиков детьми с инфекциями нижних дыхательных путей, особенно в младенчестве 14 . Использование антибиотиков в младенчестве увеличивает риск детской астмы 15,16 . Более того, когда беременные женщины принимают антибиотики в третьем триместре беременности, их дети имеют несколько повышенный риск астмы в дошкольных учреждениях 17 .
Астма — это многофакторное заболевание, и генетические факторы и факторы окружающей среды могут влиять на риск развития астмы.Диагностика астмы в раннем детстве особенно трудна, потому что сотрудничество во время функционального тестирования затруднено, и из-за респираторных инфекций могут возникать частые приступы хрипов. Таким образом, врачи диагностируют астму у детей раннего возраста на основании симптомов, используя дифференциальный диагноз и реакцию на противоастматические препараты. Из-за политики национального медицинского страхования на Тайване иногда встречается чрезмерно диагностированная астма, а диагностика настоящей астмы в молодом возрасте затруднена.В нашем исследовании мы обследовали детей с диагнозом астма, которые получали селективные бета-2 агонисты и / или ингаляционные кортикостероиды дважды в течение 1 года, чтобы отличить астму от преходящего свистящего дыхания.
Во время беременности иммунный фенотип смещен в сторону клеток Th3, которые защищают развивающийся эмбрион от материнского иммунного ответа и тем самым предотвращают выкидыш и преждевременные роды 18 . Таким образом, Th3-ассоциированные хемокины — CCL17 и CCL22 — наиболее высоки у новорожденных и постепенно снижаются в течение следующих 2 лет 19 .Наличие внешних стимулов во время беременности и в начале жизни может потенциально влиять на Th2 / Th3 иммунитет и программирование, влияя на процессы ремоделирования хроматина 20 . В частности, преобладание Th3 может сместиться в преобладание Th2 после контакта с инфекционными микроорганизмами. Однако нарушение нормальной перестройки Th2 / Th3 в младенчестве может привести к развитию атопического заболевания и аллергии 20 .
Большинство взаимодействий между иммунной системой хозяина и микробиомом происходит в кишечнике.Симбиотические или патогенные микроорганизмы в кишечнике человека могут влиять на иммунный ответ через ассоциированные с кишечником лимфоидные ткани и Toll-подобные рецепторы, что в конечном итоге приводит к различным воспалительным заболеваниям 21 . Использование антибиотиков в молодом возрасте может изменить микробиоту кишечника и привести к воспалительным и аллергическим заболеваниям. Эти побочные эффекты от использования антибиотиков уменьшаются с возрастом, согласно результатам настоящего исследования (таблица 4) и предыдущего когортного исследования, в котором сообщалось, что риск развития астмы у детей был выше, когда они использовали антибиотики в течение первого года жизни. 15 .
Никаких предыдущих исследований не изучали одновременное присутствие острого бронхиолита и использование антибиотиков на развитие астмы у детей. Однако в предыдущих когортных исследованиях в Европе и Канаде сообщалось о взаимосвязи использования ампициллина, цефалоспорина и макролидов с развитием астмы, а также о положительной корреляции накопленной дозы антибиотиков с астмой 9,16 . Мы обнаружили, что использование азитромицина по сравнению с другими антибиотиками приводит к более высокому риску развития астмы у детей младше 5 лет, у которых когда-либо был острый бронхиолит.В предыдущем многоцентровом когортном исследовании сообщалось, что использование макролидов в течение первого года жизни было связано с повышенным риском хрипов к 36 месяцам 9 . Макролиды обладают антибактериальным действием и иммуномодулирующими свойствами, поскольку они ингибируют активацию Т-клеток, подавляют провоспалительные цитокины, снижают синтез слизи и способствуют апоптозу воспалительных клеток в эпителии бронхов 22,23 . Кроме того, макролиды могут снизить частоту обострений эозинофильной астмы 24 и назначаются младенцам, у которых наблюдаются симптомы свистящего дыхания в результате острого бронхиолита.Однако механизм, с помощью которого введение макролидов в младенчестве вызывает новую астму в детстве, неизвестен. Необходимы дальнейшие исследования этой важной темы.
Мы обнаружили, что использование азитромицина по сравнению с другими антибиотиками приводит к более высокому риску развития астмы у детей младше 5 лет, у которых когда-либо был острый бронхиолит.В предыдущем многоцентровом когортном исследовании сообщалось, что использование макролидов в течение первого года жизни было связано с повышенным риском хрипов к 36 месяцам 9 . Макролиды обладают антибактериальным действием и иммуномодулирующими свойствами, поскольку они ингибируют активацию Т-клеток, подавляют провоспалительные цитокины, снижают синтез слизи и способствуют апоптозу воспалительных клеток в эпителии бронхов 22,23 . Кроме того, макролиды могут снизить частоту обострений эозинофильной астмы 24 и назначаются младенцам, у которых наблюдаются симптомы свистящего дыхания в результате острого бронхиолита.Однако механизм, с помощью которого введение макролидов в младенчестве вызывает новую астму в детстве, неизвестен. Необходимы дальнейшие исследования этой важной темы.
Наше исследование имело несколько ограничений в том, что мы не принимали во внимание влияние социально-экономического статуса, воздействия вторичного табачного дыма и наличия атопических заболеваний у родителей, братьев и сестер. Более того, окончательный диагноз астмы у детей дошкольного возраста затруднен, а неполный диагноз мог привести к неуместному исключению некоторых детей.
В заключение, наши результаты свидетельствуют о том, что младенцы с острым бронхиолитом, принимающие пенициллин, цефалоспорин или макролиды, особенно азитромицин, имеют повышенный риск развития новой астмы в детстве. Эти результаты согласуются с предсказаниями гипотезы гигиены.
Что такое стойкий бактериальный бронхит?
Д-р Марк Розенталь Стойкий бактериальный бронхит — одна из возможных причин хронического кашля у детей.Если вашему ребенку был поставлен диагноз этого состояния, возможно, вы захотите узнать о нем немного больше.
Диагноз стойкого бактериального бронхита может сбить с толку, если вы не знаете, что означают эти термины. Это может помочь понять следующие определения.
- Постоянно: состояние, которое длится долгое время. Кашель обычно считается хроническим, если он длится более 4 недель.
- Бактериальные: Инфекция вызывается скорее бактериями, чем вирусом.Это означает, что мы должны иметь возможность лечить это с помощью антибиотиков.
- Бронхит: Инфекция находится в бронхах или бронхах. Это трубки, соединяющие дыхательное горло с легкими. После попадания в легкие они разветвляются на более мелкие трубки, называемые бронхиолами. Бронхит относится к любой инфекции, которая находится в бронхах, а не в других частях дыхательной системы.
Стойкий бактериальный бронхит возникает при росте вредных бактерий внутри бронхов.Не совсем понятно, почему это происходит, но это может быть связано с частым кашлем и простудой, которые раздражают дыхательные пути, делая их более уязвимыми для бактериальных инфекций. У детей, у которых есть другие проблемы со здоровьем дыхательных путей, также может быть больше шансов заболеть стойким бактериальным бронхитом.
Симптомы стойкого бактериального бронхитаОсновной симптом бронхита — влажный кашель. Звук исходит из-за избытка слизи в дыхательных путях.Некоторые дети могут выделять слизь при кашле. Вы также можете услышать хрипы или свистящие звуки, поэтому это может сильно походить на астматический кашель. Однако бронхит вызывает более влажный кашель, и он поддается лечению. Дети с хроническим бактериальным бронхитом могут кашлять в любое время дня и ночи. Кашель без лечения продлится не менее четырех недель.
Диагностика и лечение Если у вашего ребенка постоянный кашель, рекомендуется посетить врача, чтобы выяснить причину. Опытные специалисты по респираторным заболеваниям, такие как доктор Марк Розенталь, часто могут диагностировать проблему, задавая вопросы о симптомах и истории болезни вашего ребенка. Иногда могут потребоваться дополнительные тесты, чтобы исключить другие случаи, и может быть взят образец слизи. Слизь может быть проверена, чтобы подтвердить, что инфекция является бактериальной, или проверить, какие антибиотики будут эффективны против нее.
Опытные специалисты по респираторным заболеваниям, такие как доктор Марк Розенталь, часто могут диагностировать проблему, задавая вопросы о симптомах и истории болезни вашего ребенка. Иногда могут потребоваться дополнительные тесты, чтобы исключить другие случаи, и может быть взят образец слизи. Слизь может быть проверена, чтобы подтвердить, что инфекция является бактериальной, или проверить, какие антибиотики будут эффективны против нее.
В большинстве случаев стойкий бактериальный бронхит у детей улучшается после курса антибиотиков.Обычно вашему ребенку необходимо регулярно принимать лекарство в течение нескольких недель. Избавление от кашля и устранение вызывающих его бактерий должно помочь вашему ребенку почувствовать себя намного лучше. Однако важно знать, что около 40% детей, страдающих этим заболеванием, заболеют им снова в будущем. Вы можете вернуться к доктору Марку Розенталю, если заметите еще один постоянный кашель в будущем.
Бронхиолит | Госпиталь на Грейт-Ормонд-стрит
Команда будет поддерживать ребенка в период его болезни различными способами.
Опора для дыхания
• Кислород с высокой скоростью потока — смесь воздуха и кислорода, подаваемая с «высокой скоростью» через короткие пластиковые трубки, расположенные непосредственно внутри ноздрей, помогая открыть дыхательные пути вашего ребенка и легкие могут добавлять кислород в свою кровь
• Постоянное положительное давление воздуха (CPAP) — смесь воздуха и кислорода, доставляемая под высоким давлением через короткие пластиковые трубки или маску для лица. Давление этой смеси открывает дыхательные пути ребенка
• Интубация и вентиляция — если ваш ребенок истощен или не получает достаточно кислорода после поддержки кислородом с высоким потоком или CPAP, или если он перестает дышать часто или на длительное время, мы можем предложить положить их на вентилятор или «дыхательную машину». Аппарат ИВЛ будет дышать за них, пока они нездоровы, уменьшая усилия, необходимые для дыхания, и увеличивая приток кислорода в легкие.
Аппарат ИВЛ будет дышать за них, пока они нездоровы, уменьшая усилия, необходимые для дыхания, и увеличивая приток кислорода в легкие.
Дыхательная трубка, подключенная к аппарату ИВЛ, проходит в их дыхательные пути через рот или нос. Мы дадим им лекарство, которое заставит их спать и уменьшить подвижность, чтобы они не чувствовали дискомфорта. Дыхательная трубка означает, что ребенок не сможет плакать или издавать звуки, находясь на тренажере.
• Высокочастотные колебания — если сатурация кислорода у вашего ребенка остается низкой, мы можем предложить другую машину.Его вентилятор нагнетает кислород в их легкие и из них через одну и ту же трубку, но доставляет их очень короткими и быстрыми вдохами. Этот аппарат шумный, поэтому мы дадим вашему ребенку лекарство, чтобы он не двигался во время лечения.
Антибиотики
Хотя бронхиолит вызван вирусом, некоторым детям в отделениях интенсивной терапии будет назначен курс антибиотиков для лечения любой бактериальной инфекции грудной клетки, которая может возникнуть одновременно.
Жидкости и кормление
Когда они поступят, мы будем начинать вашего ребенка на внутривенное введение жидкости, а не на молоко, пока не будет выбран наиболее подходящий тип поддержки дыхания.После стабилизации назогастральный зонд вводят в одну ноздрю и спускают по трубке к желудку, чтобы ваш ребенок мог получать молоко.
Небулайзеры
Небулайзеры могут помочь вашему ребенку дышать. Гипертонический физиологический раствор, раствор соли и воды, может затем разжижить густую слизь в легких, что облегчает ее удаление. Небулайзеры адреналина также могут помочь на короткое время расширить суженные дыхательные пути.
Физиотерапия
Физиотерапевт может назначить вашему ребенку физиотерапию грудной клетки, которая помогает ослабить и очистить дыхательные пути ребенка от слизи.
Обследование ребенка с рецидивирующими инфекциями дыхательных путей | Британский медицинский бюллетень
Аннотация
Ребенок с рецидивирующими инфекциями органов дыхания ставит перед клиницистом сложную диагностическую задачу. Есть ли у ребенка легко управляемая причина своих симптомов, например, рецидивирующие респираторные вирусные инфекции или астма, или есть доказательства более серьезной патологии, такой как бронхоэктазы? Таким образом проявляется множество различных заболеваний, включая муковисцидоз, ряд синдромов иммунодефицита и врожденные аномалии дыхательных путей.У некоторых пораженных детей поражение легких следует за одной тяжелой пневмонией, у других — в результате вдыхания пищи или инородного тела.
Оценка этих детей требовательна: она требует пристального внимания к анамнезу и обследованию, а в отдельных случаях — обширных исследований. Ранняя и точная диагностика важна для обеспечения оптимального лечения и сведения к минимуму риска прогрессирующего или необратимого повреждения легких.
Цель этой главы — изучить причины рецидивирующих инфекций дыхательных путей и описать, как следует оценивать и исследовать эту сложную группу детей.
Рецидивирующие инфекции грудной клетки — частая причина, по которой дети обращаются к терапевту (GP) или педиатру. Рецидивирующий или постоянный кашель может быть единственным симптомом, но часто в анамнезе также имеются хрипы, одышка, выделение мокроты или общее плохое самочувствие. Эти особенности могут проявляться рядом расстройств (Таблица 1). Многие из этих детей просто болеют повторяющимися вирусными инфекциями верхних дыхательных путей, которые являются нормальным явлением в взрослении. В других случаях симптомы являются первыми проявлениями астмы.Но у значительного меньшинства в анамнезе есть стойкие или повторяющиеся эпизоды пневмонии или хронического выделения мокроты, указывающие на более серьезную патологию.
Причины повторяющегося или стойкого кашля
| Астма | Очень часто | ||||||||||||
| Рецидивирующие «нормальные» инфекции | Очень часто | ||||||||||||
| Длительная инфекция ( например, . | Обычный | ||||||||||||
| Курение сигарет (пассивное / активное) | Обычное | ||||||||||||
| Привычный или психогенный кашель | Обычный | ||||||||||||
| Идиопатический | Обычный | Aspiration | Гастроэзофагеальный рефлюкс | Нечасто | |||||||||
| Некоординированное глотание | Нечасто | ||||||||||||
| Интрабронхиальное инородное тело | Нечасто | 9019 ЛегкиеРедкие | Дисастинальные легочные | Легкие | |||||||||
| Все необычные | |||||||||||||
| Муковисцидоз | |||||||||||||
| Постинфекционный ( e.г . аденовирус, коклюш) | |||||||||||||
| Туберкулез | |||||||||||||
| Цилиарная аномалия | |||||||||||||
| инородное тело | инородное тело | ||||||||||||
| Иммунодефицит | |||||||||||||
| Астма | Очень часто | ||||||
| Рецидивирующие «нормальные» инфекции | Очень распространенная | ||||||
| Обычное | |||||||
| Курение сигарет (пассивное / активное) | Обычное | ||||||
| Привычный или психогенный кашель | Обычный | ||||||
| Неорганизованный | |||||||
| Гастроэзофагеальный рефлюкс | Нечасто | ||||||
| Некоординированное глотание | Нечасто | ||||||
| Легочная опухоль | РедкаяРедкая | Легочная опухоль | Редкая | Гнойное заболевание легких | Все нечасто | ||
| Муковисцидоз | |||||||
Постинфекционный ( e. г . аденовирус, коклюш) г . аденовирус, коклюш) | |||||||
| Туберкулез | |||||||
| Цилиарная аномалия | |||||||
| инородное тело | инородное тело | ||||||
| Иммунодефицит | |||||||
Причины рецидивирующего или стойкого кашля
| Астма | Очень часто | ||||||
| Рецидивирующие инфекции | Обычные | Рецидивирующие инфекции Длительная инфекция ( e.г . pertussis, mycoplasma, RSV) | Обычное | ||||
| Курение сигарет (пассивное / активное) | Обычное | ||||||
| Привычный или психогенный кашель | Обычный | ||||||
| Неорганизованный | |||||||
| Гастроэзофагеальный рефлюкс | Нечасто | ||||||
| Некоординированное глотание | Нечасто | ||||||
| Легочная опухоль | РедкаяРедкая | Легочная опухоль | Редкая | Гнойное заболевание легких | Все нечасто | ||
| Муковисцидоз | |||||||
| Постинфекционный ( e.г . аденовирус, коклюш) | |||||||
| Туберкулез | |||||||
| Цилиарная аномалия | |||||||
| инородное тело | инородное тело | ||||||
| Иммунодефицит | |||||||
| Астма | Очень часто | ||||||
| Рецидивирующие «нормальные» инфекции | Очень распространенная | ||||||
| Обычное | |||||||
| Курение сигарет (пассивное / активное) | Обычное | ||||||
| Привычный или психогенный кашель | Обычный | ||||||
| Неорганизованный | |||||||
| Гастроэзофагеальный рефлюкс | Нечасто | ||||||
| Некоординированное глотание | Нечасто | ||||||
| Легочная опухоль | РедкаяРедкая | Легочная опухоль | Редкая | Гнойное заболевание легких | Все нечасто | ||
| Муковисцидоз | |||||||
Постинфекционный ( e. г . аденовирус, коклюш) г . аденовирус, коклюш) | |||||||
| Туберкулез | |||||||
| Цилиарная аномалия | |||||||
| инородное тело | инородное тело | ||||||
| Иммунодефицит | |||||||
Задача врача состоит в том, чтобы отличить ребенка с самоограничивающимися или незначительными проблемами от ребенка с серьезным, возможно, прогрессирующим заболеванием легких.Для этого необходимо оценить степень тяжести и диагностировать причину появления симптомов. Это во многом зависит от сбора подробного анамнеза, обнаружения каких-либо аномальных физических признаков и, в отдельных случаях, от проведения соответствующих исследований. Должен быть высокий индекс подозрений в отношении необычных заболеваний, таких как иммунодефицит, аномалии ресничек или врожденные аномалии дыхательных путей. Моя цель — описать, как следует оценивать этих детей.
Заболеваемость респираторными инфекциями у детей
Острые респираторные инфекции — самые частые болезни детского возраста.В Великобритании на их долю приходится треть всех консультаций между терапевтами и детьми и 8–18% госпитализаций в неотложную помощь 1 , 2 . В большинстве случаев поражаются только верхние дыхательные пути, но в 10–30% поражаются и нижние дыхательные пути. Дети часто болеют 6–10 инфекциями верхних дыхательных путей (ИВДП) в год 3 , 4 . Пик заболеваемости приходится на возраст от 6 до 12 месяцев, с повышением, когда ребенок впервые встречается с большим количеством детей в детском саду или школе.
Большинство респираторных инфекций протекают легко, проходят самостоятельно и вызываются вирусами. Наиболее распространенными вирусными патогенами являются риновирусы, коронавирусы, респираторно-синцитиальный вирус (RSV), грипп и парагрипп, а также аденовирусы. Streptococcus pneumoniae (пневмококк) и другие стрептококки, Haemophilus influenzae , Mycoplasma pneumoniae , Chlamydia pneumoniae и Moraxella catarrhalis являются наиболее распространенными невирусными возбудителями инфекций нижних отделов дыхательных путей 30. Коинфекция более чем одним типом бактерий или вирусов присутствует в 8–30% случаев пневмонии 3 , 5 . Во многих случаях патоген не может быть идентифицирован.
Коинфекция более чем одним типом бактерий или вирусов присутствует в 8–30% случаев пневмонии 3 , 5 . Во многих случаях патоген не может быть идентифицирован.
Частота инфекций нижних дыхательных путей (ИДПТ), таких как пневмония, бронхиолит и бронхит, оценивалась в проспективных исследованиях 5 , 6 . Райт показал совокупную частоту острых инфекций нижних дыхательных путей в 33% на первом году жизни в когорте новорожденных из 1179 младенцев в Тусоне 7 .RSV был наиболее частым из 12 выявленных патогенов, и на острый бронхиолит приходилось 60% эпизодов. Мерфи в 11-летнем исследовании на уровне сообщества показал пик заболеваемости ИДПТ в конце первого года жизни: четверть этих ИДП были пневмонией 8 . В большом финском исследовании 9 Йокинен обнаружил, что частота случаев пневмонии, подтвержденной рентгенологически, составляет 36 на 1000 детей в год в возрасте до 5 лет и 16 на 1000 детей в год у детей в возрасте 5–14 лет. Общая частота госпитализаций по поводу пневмонии составляла 4/1000 детей в год в возрасте от 1 месяца до 15 лет, но в 5 раз выше у детей в возрасте до 2 лет 10 .В исследованиях на уровне сообщества не сообщалось о заболеваемости рецидивирующей пневмонией, но у 10% из более чем 2900 детей, поступивших в Больницу Торонто с пневмонией, было два или более эпизода 11 .
Факторы, влияющие на частоту инфекций нижних дыхательных путей
При оценке детей с повторными инфекциями органов дыхания важно распознавать факторы, влияющие на частоту этих инфекций у детей (таблица 2). 3 .
Таблица 2.Факторы риска инфекций нижних дыхательных путей у детей
| Возраст |
| Мужской пол |
| Недоношенность |
| Курение родителей |
| Большая семья, скученность |
| Иммунодефицит |
| Возраст | |
| Мужской пол | |
| Недоношенность | |
| Врожденное курение | |

Факторы риска инфекций нижних дыхательных путей у детей
| Возраст | ||
| Мужской пол | ||
| Недоношенность | ||
| Курение родителей | ||
| Большая семья, | аномалии | , врожденная скученностьИммунодефицит |
| Возраст |
| Мужской пол |
| Недоношенность |
| Родительское курение |
| Нарушение здоровья |
| Физическая и физиологическая защита | |||
| Фильтрация частиц в дыхательных путях | |||
| Кашель | |||
| Чихание | |||
| Слизь в дыхательных путях | |||
| Респираторные реснички | |||
| Движение альвеолярной жидкости | Клеточные защитные клетки ) | ||
| Легочные макрофаги | |||
| Нейтрофилы | |||
| Секреторная защита | |||
| Иммуноглобулины M, A | G, A|||
| Коллектины | |||
| α 1 –антитрипсин и α 2 -макроглобулин | |||
| Лизоцим | α- и β-дефенсины | ||
| Интерферон | |||
| Физическая и физиологическая защита | |||||||||||||||||||
| Фильтрация частиц в дыхательных путях | |||||||||||||||||||
| Бронхоспазм | |||||||||||||||||||
| Мукоцилиарный клиренс | |||||||||||||||||||
| Слизь в дыхательных путях | |||||||||||||||||||
| 9019 | Движение альвеолярной жидкости | ||||||||||||||||||
| Клеточная защита | |||||||||||||||||||
| Лимфоциты (Т- и В-клетки) | |||||||||||||||||||
| Легочные макрофаги 8 | |||||||||||||||||||
| Иммуноглобулины G, A, M и E | |||||||||||||||||||
| Коллектины | |||||||||||||||||||
| α 1 –Антитрипсин | L 9019loin 9019lo 8 9019lo 9019lo 8|||||||||||||||||||
| Лактоферрин | |||||||||||||||||||
| Комплемент | |||||||||||||||||||
| α и β Дефенсины | |||||||||||||||||||
| Интерферон | |||||||||||||||||||
| Физический и | Интерферон | 0198 | Фильтрация частиц в дыхательных путях | ||||||||||||||||
| Кашель | |||||||||||||||||||
| Чихание | |||||||||||||||||||
| Бронхоконстрикция | 9019 9019 9019 9019 9019 9019 9019 9019 9019 9019 9019 9019 | Респираторные реснички | |||||||||||||||||
| Движение альвеолярной жидкости | |||||||||||||||||||
| Клеточная защита | |||||||||||||||||||
| Лимфоциты (Т- и В-клетки) | Макрофаги МакрофагиНейтрофилы | ||||||||||||||||||
| Секреторная защита | |||||||||||||||||||
| Иммуноглобулины G, A, M и E | |||||||||||||||||||
| Коллектины | |||||||||||||||||||
| α1 9101 | 9 d α 2 -макроглобулин|||||||||||||||||||
| Лизоцим | |||||||||||||||||||
| Лактоферрин | |||||||||||||||||||
| Комплемент | |||||||||||||||||||
| Физическая и физиологическая защита | |||||||||||||||||||
| Фильтрация частиц в дыхательных путях | |||||||||||||||||||
| Кашель | |||||||||||||||||||
| Чихание | |||||||||||||||||||
| Слизь в дыхательных путях | |||||||||||||||||||
| Реснички дыхательных путей | |||||||||||||||||||
| Движение альвеолярной жидкости | |||||||||||||||||||
| Клеточная защита | |||||||||||||||||||
| Лимфоциты (Т- и В-клетки) | |||||||||||||||||||
| Легочные макрофаги | |||||||||||||||||||
| Нейтрофилы | |||||||||||||||||||
| Коллектины | |||||||||||||||||||
| α 1 –Антитрипсин и α 2 -макроглобулин | |||||||||||||||||||
| Lysozyme | Lysozyme | ||||||||||||||||||
| α- и β-дефенсины | |||||||||||||||||||
| Интерферон | |||||||||||||||||||
Возраст ребенка влияет на тип и частоту всех респираторных инфекций. Нормальное снижение заболеваемости ИДП с возрастом отражает характер контакта с инфекцией и развитие иммунитета ребенка. Некоторые инфекции возникают только у детей определенного возраста. Например, острый бронхиолит встречается почти исключительно у младенцев в возрасте от 1 до 8 месяцев, хотя у многих пораженных детей в течение нескольких месяцев или лет после этого наблюдается периодический кашель, хрипы и одышка. Возраст также влияет на тяжесть заболевания, и две трети детских смертей от респираторных инфекций приходится на младенчество 3 .Инфекции нижних дыхательных путей чаще встречаются у мальчиков, чем у девочек, по неизвестным причинам.
Нормальное снижение заболеваемости ИДП с возрастом отражает характер контакта с инфекцией и развитие иммунитета ребенка. Некоторые инфекции возникают только у детей определенного возраста. Например, острый бронхиолит встречается почти исключительно у младенцев в возрасте от 1 до 8 месяцев, хотя у многих пораженных детей в течение нескольких месяцев или лет после этого наблюдается периодический кашель, хрипы и одышка. Возраст также влияет на тяжесть заболевания, и две трети детских смертей от респираторных инфекций приходится на младенчество 3 .Инфекции нижних дыхательных путей чаще встречаются у мальчиков, чем у девочек, по неизвестным причинам.
Младенцы, рожденные недоношенными, и особенно те, у которых после вентиляции легких развивается бронхолегочная дисплазия (хроническое заболевание легких у недоношенных), в раннем детстве часто требуется госпитализация по поводу респираторных инфекций. Смертность от инфекции у этих младенцев выше, чем у доношенных.
Иммунопротекторный эффект грудного вскармливания против респираторных инфекций наиболее важен в неиндустриальных странах, но также очевиден в промышленно развитых странах. 12 .
Курение родителей увеличивает риск всех респираторных заболеваний и симптомов, особенно инфекций нижних дыхательных путей, у детей 13 , 14 . Эффект сильнее у младенцев, чем у детей старшего возраста, больше связан с курением матери, чем отцов, и зависит от дозы. Как курение матери во время беременности, так и постнатальное пассивное воздействие предрасполагают детей курильщиков к рецидивирующим респираторным инфекциям и симптомам 14 .
Контакт с другими детьми влияет на количество инфекций, которые развиваются у детей.Младенцы, имеющие старших братьев и сестер или живущие в переполненных домах, чаще болеют респираторными инфекциями. Когда дети впервые посещают школу или детский сад, количество зараженных ими инфекций возрастает.
Дети с врожденными пороками дыхательных путей, такими как трахео-пищеводный свищ или секвестрация, и дети с врожденным пороком сердца подвергаются повышенному риску рецидивирующей респираторной инфекции. Особенно уязвимы дети с неврологическими недостатками. Рецидивирующие или постоянные инфекции грудной клетки являются частым признаком муковисцидоза, самой частой причины бронхоэктазов у детей.Инфекции у всех этих групп детей не только более распространены, но и более серьезны, чем у нормальных детей, с повышенным риском дыхательной недостаточности и смерти.
Особенно уязвимы дети с неврологическими недостатками. Рецидивирующие или постоянные инфекции грудной клетки являются частым признаком муковисцидоза, самой частой причины бронхоэктазов у детей.Инфекции у всех этих групп детей не только более распространены, но и более серьезны, чем у нормальных детей, с повышенным риском дыхательной недостаточности и смерти.
У некоторых детей с рецидивирующими или стойкими инфекциями грудной клетки имеется дефект сложной системы защитных механизмов, которые обычно защищают легкие от враждебной микробиологической среды. К ним относятся физическая защита, такая как кашель и мукоцилиарный клиренс, защита циркулирующих и резидентных клеток, а также ряд гуморальных или секреторных механизмов (Таблица 3).В совокупности их функция заключается в предотвращении проникновения или удалении инородного материала из легких. Подробные сведения об организации и свойствах этой защиты приведены в других разделах этого выпуска и в обзорных статьях 15 –18 .
Дифференциальная диагностика рецидивирующих инфекций органов дыхания
Большинство детей, направленных с рецидивирующими респираторными инфекциями, обладают нормальной иммунной и другой респираторной защитой. Они просто находятся на одном из концов нормального распространения острых респираторных инфекций, часто из-за своего возраста или окружающей среды.Рубин 19 охарактеризовал этих детей как «нормальных, но невезучих». Характерно, что они растут и развиваются нормально, осмотр и рентген грудной клетки в норме между эпизодами, в семейном анамнезе тяжелых инфекций и серьезных внелегочных инфекций нет. Все, что требуется, — это уверенность.
Астма
Несмотря на недавние достижения в области оказания медицинской помощи, у многих детей, направленных с «рецидивирующими инфекциями грудной клетки» или «постоянным кашлем», будет обнаружена недиагностированная астма. Более пристальное внимание к анамнезу показывает, что большинство, но не все, имеют повторяющиеся эпизоды кашля, хрипов и одышки, часто с характерными триггерами ИВДП, физическими упражнениями, холодным воздухом, эмоциональным расстройством или контактом с домашними животными и другими аэроаллергенами. Часто в личном или семейном анамнезе имеются другие атопические состояния, такие как экзема или аллергический ринит. Возможно, они отреагировали на бронходилататоры или противовоспалительную терапию. Во время консультации обследование часто является нормальным, но спирометрия может указывать на сужение дыхательных путей и чувствительность к бронходилататорам.Не существует согласованного клинического определения или патогномонического теста для детской астмы, и постановка диагноза может быть трудной, особенно у детей в возрасте до 3 лет 20 . Более того, у некоторых детей астма сосуществует с другим заболеванием, таким как дефицит специфических антител. Признаки, которые позволяют предположить альтернативный или дополнительный диагноз, включают асимметричные или очаговые признаки грудной клетки, удары пальцами, неспособность к развитию или признаки системного заболевания. Кашель с гнойной мокротой не является признаком астмы.
Более пристальное внимание к анамнезу показывает, что большинство, но не все, имеют повторяющиеся эпизоды кашля, хрипов и одышки, часто с характерными триггерами ИВДП, физическими упражнениями, холодным воздухом, эмоциональным расстройством или контактом с домашними животными и другими аэроаллергенами. Часто в личном или семейном анамнезе имеются другие атопические состояния, такие как экзема или аллергический ринит. Возможно, они отреагировали на бронходилататоры или противовоспалительную терапию. Во время консультации обследование часто является нормальным, но спирометрия может указывать на сужение дыхательных путей и чувствительность к бронходилататорам.Не существует согласованного клинического определения или патогномонического теста для детской астмы, и постановка диагноза может быть трудной, особенно у детей в возрасте до 3 лет 20 . Более того, у некоторых детей астма сосуществует с другим заболеванием, таким как дефицит специфических антител. Признаки, которые позволяют предположить альтернативный или дополнительный диагноз, включают асимметричные или очаговые признаки грудной клетки, удары пальцами, неспособность к развитию или признаки системного заболевания. Кашель с гнойной мокротой не является признаком астмы.
Постинфекционный кашель
Некоторые родители четко описывают кашель, который впервые появился на фоне острой инфекции и с тех пор сохраняется в течение нескольких недель или месяцев. Это обычное явление после инфекций Bordetella pertussis (коклюш) и M. pneumoniae 3 . У этих патогенов кашель, который может быть приступообразным, может давать прозрачную или белую слизь. Это результат гиперреактивности бронхов и нарушения мукоцилиарного клиренса, которые следуют за воспалением, возникающим при этих инфекциях.Кашель обычно проходит в течение 2–6 месяцев. Эпизоды хрипов, кашля и одышки, которые могут повторяться в течение месяцев или лет, часто встречаются у младенцев, поступивших в больницу с бронхиолитом, вызванным RSV 21 , 22 . Патофизиология этого «постбронхиолитного синдрома» сложна и включает нарушения как иммунной функции, так и роста дыхательных путей.
Патофизиология этого «постбронхиолитного синдрома» сложна и включает нарушения как иммунной функции, так и роста дыхательных путей.
Вдыхаемое инородное тело
Возможность вдыхания инородного тела следует учитывать у любого ребенка младшего возраста, у которого развивается стойкий продуктивный кашель, особенно если оно было острым после приступа удушья.Некоторые внутрибронхиальные инородные тела, особенно арахис, вызывают сильное воспаление слизистой оболочки бронхов, которое быстро приводит к обструкции дыхательных путей и дистальной инфекции. Даже после того, как был поставлен диагноз инородного тела и оно было удалено бронхоскопическим путем, может наблюдаться стойкое локализованное повреждение дыхательных путей, нарушение функции легких и постоянный кашель 23 .
Хроническая гнойная болезнь легких
У меньшинства детей с рецидивирующими инфекциями органов дыхания основным симптомом является постоянный или повторяющийся рыхлый кашель с выделением желтой или зеленой мокроты.Это указывает на хроническое гнойное заболевание легких (Таблица 1) и, возможно, бронхоэктаз, который определяется как цилиндрическая или саккулярная дилатация субсегментарных бронхов. Частота возникновения этих состояний неизвестна 24 . У некоторых детей с хроническим гнойным заболеванием легких наблюдается рецидивирующая или стойкая пневмония: хотя у любого нормального ребенка может быть один эпизод пневмонии, рецидивирующие или плохо разрешающиеся эпизоды часто указывают на лежащую в основе аномалию.
У некоторых из этих детей также будут рецидивирующие инфекции ушей или носовых пазух.Хрипы и боли в груди присутствуют более чем у пятой части детей с бронхоэктазами 24 . Поскольку дифференциальный диагноз включает несколько наследственных состояний (например, муковисцидоз, цилиарную дискинезию и некоторые иммунодефициты), важно собрать подробный семейный анамнез тяжелых или рецидивирующих респираторных или системных инфекций в детстве. Поскольку некоторые острые инфекции, такие как аденовирусная пневмония, могут привести к бронхоэктазу, очень важно получить подробную историю первого эпизода симптомов.Следует выяснить наличие в анамнезе затрудненного глотания, удушья при кормлении или гастроэзофагеального рефлюкса, так как периодическая аспирация корма является важной причиной рецидивирующей пневмонии 11 и хронического гнойного заболевания легких, особенно у детей с проблемами нервного развития 25 , 26 . Острое появление симптомов после приступа удушья с большой вероятностью указывает на вдыхание инородного тела у маленьких детей.
Поскольку некоторые острые инфекции, такие как аденовирусная пневмония, могут привести к бронхоэктазу, очень важно получить подробную историю первого эпизода симптомов.Следует выяснить наличие в анамнезе затрудненного глотания, удушья при кормлении или гастроэзофагеального рефлюкса, так как периодическая аспирация корма является важной причиной рецидивирующей пневмонии 11 и хронического гнойного заболевания легких, особенно у детей с проблемами нервного развития 25 , 26 . Острое появление симптомов после приступа удушья с большой вероятностью указывает на вдыхание инородного тела у маленьких детей.
Клиническое обследование может выявить важные признаки, такие как хрипы, хрипы, гиперинфляция, удары пальцами по пальцам, гепатоспленомегалия, заболевания носа, поражения кожи и нарушение нормального развития.На простом рентгеновском снимке грудной клетки могут быть выявлены как очаговые, так и широко распространенные изменения, такие как ателектаз, гиперинфляция, уплотнение или патологические паттерны дыхательных путей. Чаще всего поражаются левая нижняя, язычная и правая средняя доли 24 .
Муковисцидоз
Муковисцидоз — самая частая причина хронического гнойного заболевания легких у детей, поражая одного из 2500 новорожденных у европейцев. У большинства пораженных детей в раннем детстве рецидивирующие инфекции грудной клетки, и более 90% также страдают мальабсорбцией и задержкой развития из-за недостаточности поджелудочной железы.Около 10–20% имеют непроходимость кишечника у новорожденных из-за непроходимости мекония. Другим диагноз ставится на основании семейного анамнеза этого аутосомно-рецессивного состояния или в результате неонатального скрининга.
Вязкая слизь в мелких дыхательных путях предрасполагает к хронической инфекции, сначала Staphylococcus aureus или H.influenzae , а затем Pseudomonas aeruginosa (см. В другом месте в этом выпуске). Инфекция и воспалительная реакция на нее приводят к прогрессирующему повреждению бронхиальной стенки, бронхоэктазу, кистозным поражениям и, в конечном итоге, к фиброзу легких.Муковисцидоз всегда следует рассматривать на ранней стадии дифференциальной диагностики рецидивирующих инфекций легких.
Инфекция и воспалительная реакция на нее приводят к прогрессирующему повреждению бронхиальной стенки, бронхоэктазу, кистозным поражениям и, в конечном итоге, к фиброзу легких.Муковисцидоз всегда следует рассматривать на ранней стадии дифференциальной диагностики рецидивирующих инфекций легких.
Бронхоэктазы после острой пневмонии
В прошлом многие случаи детских бронхоэктазов возникали после острых инфекций нижних дыхательных путей, вызванных коклюшем, корью или туберкулезом. Сейчас это редкость. Практически все дети с нормальной иммунной функцией полностью выздоравливают от пневмонии или бронхиолита, даже если острый приступ был тяжелым.Однако из этого правила есть важные исключения. Аденовирусы серотипов 3, 4, 7 и 21 могут вызывать тяжелый бронхиолит, пневмонию и смерть 27 , 28 . До 40–70% выживших остаются с необратимым повреждением дыхательных путей (облитерирующий бронхиолит) с сегментарным или долевым ателектазом, участками гиперинфляции и нарушением функции легких 29 . У четверти детей с облитерирующим бронхиолитом впоследствии развиваются бронхоэктазы 30 . Как правило, у этих детей остаются постоянные хрипы (которые плохо поддаются лечению бронходилататорами), постоянный кашель (который вначале сухой, но затем становится продуктивным с гнойной мокротой) и характерные рентгенологические изменения облитерирующего бронхиолита.После этих инфекций также был описан синдром Свайера-Джеймса или Маклоеда, при котором имеется небольшая гиперлюцентная доля с нарушением перфузии и вентиляции. Подобные повреждения могут возникнуть после тяжелой микоплазменной пневмонии. Совместное инфицирование аденовирусом и M. pneumoniae особенно разрушительно.
Хотя большинство детей полностью выздоравливают от бактериальной пневмонии, у некоторых наблюдается медленное или неполное выздоровление с сохраняющимися локализованными клиническими признаками и ателектазом или воспалением на рентгенограмме грудной клетки. Это может быть связано с закупоркой бронха пробкой слизистой оболочки или локализованным повреждением бронха и прилегающей паренхимы легкого, но в некоторых случаях это отражает лежащую в основе аномалию анатомии легких или защитных механизмов или вдыхаемое инородное тело. Кашель продолжается и может выделяться мокрота: могут быть обострения с повышением температуры тела. Эти дети нуждаются в детальном обследовании.
Это может быть связано с закупоркой бронха пробкой слизистой оболочки или локализованным повреждением бронха и прилегающей паренхимы легкого, но в некоторых случаях это отражает лежащую в основе аномалию анатомии легких или защитных механизмов или вдыхаемое инородное тело. Кашель продолжается и может выделяться мокрота: могут быть обострения с повышением температуры тела. Эти дети нуждаются в детальном обследовании.
Нарушения иммунодефицита
Дыхательные пути — это система органов, наиболее часто вызывающая иммунодефицитные расстройства.Часто между появлением симптомов и постановкой диагноза проходит несколько лет: эта задержка увеличивает риск возникновения бронхоэктазов и необратимого повреждения легких до того, как будет проведено соответствующее лечение. 31 .
Иммунный дефект следует рассматривать у любого ребенка с респираторными инфекциями, которые являются необычно тяжелыми, рецидивирующими, не поддающимися традиционному лечению или нетипичными. Общие ассоциированные признаки включают неспособность к развитию, которая часто является вторичной по отношению к желудочно-кишечному заболеванию, тяжелое атопическое заболевание, такое как экзема, и иногда аутоиммунное заболевание. 4 , 31 , 32 .Некоторые дети с определенными синдромами, такими как синдромы ДиДжорджи и Дауна, имеют нарушения иммунитета, а также сердечные, лицевые и другие аномалии. Поскольку многие иммунодефициты передаются по наследству, следует выяснить семейный анамнез тяжелой инфекции, ранней смерти или кровного родства. Помимо респираторных инфекций, могут возникать тяжелые инфекции кожи, желудочно-кишечного тракта и мягких тканей, а также лимфаденопатия. Клиническое обследование у детей с иммунодефицитом часто дает отклонения от нормы.
Иммунодефициты делятся на первичные (врожденные) и вторичные (приобретенные). В прошлом вторичные иммунодефициты чаще всего были результатом таких заболеваний, как злокачественные новообразования, иммуносупрессивная терапия, корь или недоедание, но во многих странах ВИЧ-инфекция в настоящее время является наиболее частой причиной приобретенного иммунодефицита.
Выявлено более 80 различных первичных иммунодефицитов. Их можно классифицировать на основе того, какая из четырех частей «иммунного оркестра» (антитела, Т-лимфоциты, фагоциты или система комплемента) задействована, но расстройства, при которых есть отклонения более чем в одной части, являются общими.Например, при тяжелых комбинированных иммунодефицитах (ТКИД), которые являются наиболее тяжелыми нарушениями, наблюдаются дефекты как функции, опосредованной клетками (Т-лимфоциты), так и функции антител (В-лимфоциты). Дефекты гуморального (антителного) иммунитета составляют 50% первичных иммунодефицитов, комбинированные гуморальные и клеточные дефициты составляют 20–30% случаев, дефекты фагоцитов — приблизительно 18% и дефекты комплемента — менее 2% 31 .
Как и следовало ожидать, чем младше ребенок при первом появлении инфекции, тем более серьезным может быть иммунный дефект.Большинство дефектов клеточного иммунитета проявляются в течение первых 6 месяцев жизни, часто с триадой пневмонии, трудноизлечимой диареи и кожно-слизистого кандидоза 31 . Дефицит антител, такой как X-связанная агамма-глобулинемия (XLA), часто вызывает рецидивирующие респираторные инфекции в возрасте от 4 месяцев — когда уровни материнского IgG упали — до 2 лет, но часто наблюдается задержка на 2–2 года. За 5 лет до диагностики поставлен 31 . На этой стадии также могут присутствовать фагоциты и редкие дефекты комплемента.Общий вариабельный иммунодефицит, гетерогенная группа заболеваний с гипогаммаглобулинемией и нарушением продукции антител, обычно проявляется в возрасте старше 5 лет, часто во втором или третьем десятилетии жизни.
В таблице 4 перечислены основные категории иммунодефицита и приведены некоторые примеры нарушений в каждой категории, которые могут проявляться тяжелыми, рецидивирующими, стойкими или необычными инфекциями грудной клетки. Поскольку природа иммунного дефекта определяет восприимчивость к определенным микроорганизмам, идентификация патогена не только важна для принятия решения о том, какое лечение подходит, но также может указывать, какая часть иммунной системы является дефектной. Например, идентификация Pneumocystis carinii и вируса цитомегала (CMV) в жидкости бронхиального лаважа ребенка с интерстициальной пневмонией может указывать на дефект функции Т-лимфоцитов, в то время как рецидивирующая кавитирующая стафилококковая пневмония, резистентная к соответствующим антибиотикам, предполагает наличие нейтрофилов. дефект, например, хроническая гранулематозная болезнь.
Например, идентификация Pneumocystis carinii и вируса цитомегала (CMV) в жидкости бронхиального лаважа ребенка с интерстициальной пневмонией может указывать на дефект функции Т-лимфоцитов, в то время как рецидивирующая кавитирующая стафилококковая пневмония, резистентная к соответствующим антибиотикам, предполагает наличие нейтрофилов. дефект, например, хроническая гранулематозная болезнь.
Классификация первичных иммунодефицитов
| Иммунодефицит и примеры . | . | Основные патогены этой группы . | Расследования . | ||||||
|---|---|---|---|---|---|---|---|---|---|
| ДЕФИЦИТ АНТИТЕЛ (В-КЛЕТОК) | |||||||||
| Х-сцепленная агаммаглобулинемия (XLA) | , Mmunlobulinemia | , M иммуноглобулин,] E) | |||||||
| IgA, дефицит подкласса IgG | Strep.pneumoniae | Подклассы IgG | |||||||
| Специфическая недостаточность антител | Giardia lamblia | Специфические антитела | |||||||
| Общий вариабельный иммунодефицит | Вирус ECHO | Вирус ECHO | виды | ||||||
| M. pneumoniae | |||||||||
| ДЕФЕКТИВНЫЙ КЛЕТОЧНЫЙ ИММУНИТЕТ (дефицит Т-лимфоцитов) и ТЯЖЕЛАЯ КОМБИНИРОВАННАЯ ИММУНОДЕФИКАЦИЯ (ТКИД) | ] | Простой герпес, опоясывающий лишай | Дифференциал белых клеток | ||||||
| Синдром гипер-IgM | ЦМВ, ВЭБ, корь, RSV | Рентген грудной клетки (тень тимуса) | |||||||
| Большой дефицит гистосовместимости Pn.carinii | Популяции лимфоцитов | ||||||||
| Синдром Вискотта-Олдрича | Стрептококки, H. influenzae influenzae | Митогеновые ответы | |||||||
| 9019 9019 9019 9019 9019 9019 | Микобактерии (типичные и атипичные) | ||||||||
| Cryptosporidium | |||||||||
| PHAGOCYTE DEFECTS | гранулометрическое заболевание Staph.aureus | Дифференциал лейкоцитов | |||||||
| Семейная, циклическая или аутоиммунная нейтропения | Стрептококки | Хемотаксис, фагоцитоз | |||||||
| Дефекты адгезии лейкоцитов | |||||||||
| Синдром гипер-IgE (синдром Джоба) | Кишечные грамотрицательные бактерии | ||||||||
| ДЕФИЦИТ КОМПЛЕКТА | |||||||||
| Манноза-связывающий белок | 9198 9198 9pneumoniae, H. influenzaeУровни C3, C4, CH 50 | ||||||||
| Дефицит C3 или C5 | Neisseria meningitidis |
| Иммунодефицит и примеры . | . | Основные патогены этой группы . | Расследования . | ||||||
|---|---|---|---|---|---|---|---|---|---|
| ДЕФИЦИТ АНТИТЕЛ (B-КЛЕТОК) | |||||||||
| Х-сцепленная агаммаглобулинемия (XLA) | ] | H.influenzae | Иммуноглобулины (G, A, M, E) | ||||||
| IgA, дефицит подкласса IgG | Strep. pneumoniae | Подклассы IgG | |||||||
| Специфическая недостаточность антител | Giardia lamblia | Специфические антитела | |||||||
| Общий вариабельный иммунодефицит | Вирус ECHO | Вирус ECHO | виды | ||||||
M. pneumoniae pneumoniae | |||||||||
| ДЕФЕКТИВНЫЙ КЛЕТОЧНЫЙ ИММУНИТЕТ (дефицит Т-лимфоцитов) и ТЯЖЕЛАЯ КОМБИНИРОВАННАЯ ИММУНОДЕФИКАЦИЯ (ТКИД) | ] | Простой герпес, опоясывающий лишай | Дифференциал белых клеток | ||||||
| Синдром гипер-IgM | ЦМВ, ВЭБ, корь, RSV | Рентген грудной клетки (тень тимуса) | |||||||
| Большой дефицит гистосовместимости Pn.carinii | Популяции лимфоцитов | ||||||||
| Синдром Вискотта-Олдрича | Стрептококки, H.influenzae | Митогеновые ответы | |||||||
| 9019 9019 9019 9019 9019 9019 | Микобактерии (типичные и атипичные) | ||||||||
| Cryptosporidium | |||||||||
| PHAGOCYTE DEFECTS | гранулометрическое заболевание Staph.aureus | Дифференциал лейкоцитов | |||||||
| Семейная, циклическая или аутоиммунная нейтропения | Стрептококки | Хемотаксис, фагоцитоз | |||||||
| Дефекты адгезии лейкоцитов | |||||||||
| Синдром гипер-IgE (синдром Джоба) | Кишечные грамотрицательные бактерии | ||||||||
| ДЕФИЦИТ КОМПЛЕКТА | |||||||||
| Манноза-связывающий белок | 9198 9198 9pneumoniae, H.influenzaeУровни C3, C4, CH 50 | ||||||||
| Дефицит C3 или C5 | Neisseria meningitidis |
Классификация первичных иммунодефицитов
03
03
03

Кандидоз 9011 Asperblue
Тест на адгезию лейкоцитов
 influenzae
influenzae| Иммунодефицит и примеры . | . | Основные патогены этой группы . | Расследования . | ||||||
|---|---|---|---|---|---|---|---|---|---|
| ДЕФИЦИТ АНТИТЕЛ (B-КЛЕТОК) | |||||||||
| Х-сцепленная агаммаглобулинемия (XLA) | ] | H.influenzae | Иммуноглобулины (G, A, M, E) | ||||||
| IgA, дефицит подкласса IgG | Strep. pneumoniae | Подклассы IgG | |||||||
| Специфическая недостаточность антител | Giardia lamblia | Специфические антитела | |||||||
| Общий вариабельный иммунодефицит | Вирус ECHO | Вирус ECHO | виды | ||||||
| M. pneumoniae | |||||||||
| ДЕФЕКТИВНЫЙ КЛЕТОЧНЫЙ ИММУНИТЕТ (дефицит Т-лимфоцитов) и ТЯЖЕЛАЯ КОМБИНИРОВАННАЯ ИММУНОДЕФИКАЦИЯ (ТКИД) | ] | Простой герпес, опоясывающий лишай | Дифференциал белых клеток | ||||||
| Синдром гипер-IgM | ЦМВ, ВЭБ, корь, RSV | Рентген грудной клетки (тень тимуса) | |||||||
| Большой дефицит гистосовместимости Pn.carinii | Популяции лимфоцитов | ||||||||
| Синдром Вискотта-Олдрича | Стрептококки, H.influenzae | Митогеновые ответы | |||||||
| 9019 9019 9019 9019 9019 9019 | Микобактерии (типичные и атипичные) | ||||||||
| Cryptosporidium | |||||||||
| PHAGOCYTE DEFECTS | гранулометрическое заболевание Staph. aureus aureus | Дифференциал лейкоцитов | |||||||
| Семейная, циклическая или аутоиммунная нейтропения | Стрептококки | Хемотаксис, фагоцитоз | |||||||
| Дефекты адгезии лейкоцитов | |||||||||
| Синдром гипер-IgE (синдром Джоба) | Кишечные грамотрицательные бактерии | ||||||||
| ДЕФИЦИТ КОМПЛЕКТА | |||||||||
| Манноза-связывающий белок | 9198 9198 9pneumoniae, H. influenzaeУровни C3, C4, CH 50 | ||||||||
| Дефицит C3 или C5 | Neisseria meningitidis |
Дефекты продукции антител
Дефицит антител является наиболее частым из иммунодефицитов 33 . Существует множество различных типов дефицита антител, от тяжелого дефицита всех иммуноглобулинов (Х-сцепленная агаммаглобулинемия, болезнь Брутона) до умеренного дефицита специфических антител у детей с нормальным уровнем иммуноглобулинов.Они могут возникать как изолированный дефект или как часть более широкого иммунодефицита. Невозможно дать исчерпывающий обзор всех этих дефектов, и здесь описаны лишь некоторые из наиболее распространенных типов, которые проявляются проблемами грудной клетки у детей.
Нормальный доношенный ребенок имеет неопределяемые сывороточные уровни IgM и IgA при рождении, и они постепенно повышаются в первые 2–3 года жизни 32 , 33 . Материнский IgG, который проникает через плаценту к плоду, исчезает в течение 5-7 месяцев.Собственный IgG младенца появляется на значительном уровне в 4–8 месяцев и повышается в течение 2–3 лет. Антибелковые антитела вырабатываются в первые несколько месяцев жизни, но способность вырабатывать антитела IgG против полисахаридных антигенов, таких как капсулы некоторых бактерий, созревает намного медленнее и становится эффективной только через 2 года. IgG имеет четыре подкласса (1–4), которые различаются по концентрации, структуре и функциям. Антитела против белка в основном относятся к подклассам IgG1 и IgG3, а антитела против полисахаридов — преимущественно к подклассу IgG2.
IgG имеет четыре подкласса (1–4), которые различаются по концентрации, структуре и функциям. Антитела против белка в основном относятся к подклассам IgG1 и IgG3, а антитела против полисахаридов — преимущественно к подклассу IgG2.
В настоящее время признано, что многие дети с рецидивирующими инфекциями органов дыхания имеют отклонения в их способности вырабатывать специфические антитела к распространенным респираторным патогенам, таким как стрептококк . pneumoniae или H. influenzae , которые обычно выделяют из их мокроты. У многих из этих детей диагностирована астма, и они получают высокие дозы ингаляционных стероидов и другие методы лечения астмы. Важные ключи к диагнозу включают отсутствие ответа на лечение астмы высокими дозами, наличие продуктивного кашля и окрашенной мокроты, а также улучшение после курсов антибиотиков.В анамнезе могут быть рецидивирующие инфекции верхних дыхательных путей, такие как средний отит или тонзиллит. Если подозревается дефицит антител, следует измерить общий уровень сывороточных IgG, IgM, IgA и IgE. Поскольку нормальные диапазоны этих белков меняются в детстве, измеренные значения необходимо сравнивать с соответствующими возрасту нормальными значениями, в идеале из той же лаборатории. Существуют разногласия относительно ценности измерения уровней подкласса IgG, поскольку не все дети с «недостаточными» подклассами имеют доказательства повышенной восприимчивости к инфекции 34 .Тем не менее, дефицит подкласса IgG, и особенно дефицит IgG2, может быть связан с тяжелыми бронхоэктазами, и многие клиницисты все еще измеряют подклассы IgG.
Важно измерить сывороточные уровни специфических антител против белковых антигенов (столбнячный и дифтерийный токсоиды) и полисахаридных антигенов ( H. influenzae тип b [Hib] и Strep. Pneumoniae ). Ключевым элементом оценки гуморального иммунитета является оценка способности ребенка вырабатывать нормальные уровни специфических антител в ответ на обычные детские иммунизации или через 4 недели после тестовой вакцинации Hib и поливалентной пневмококковой вакциной (Pneumovax ® ). Требуется осторожность при интерпретации этих тестов, поскольку возраст ребенка сильно влияет на реакцию на эти прививки. Например, постоянно низкий уровень антипневмококковых антител после применения Pneumovax ® у 10-летнего ребенка свидетельствует о патологическом дефекте продукции антител, тогда как низкий уровень и отсутствие ответа у 2–3-летнего ребенка. это нормально и просто указывает на физиологическую незрелость. Трудно поставить точный диагноз дефицита специфических антипневмококковых антител у ребенка в возрасте до 5–6 лет.
Требуется осторожность при интерпретации этих тестов, поскольку возраст ребенка сильно влияет на реакцию на эти прививки. Например, постоянно низкий уровень антипневмококковых антител после применения Pneumovax ® у 10-летнего ребенка свидетельствует о патологическом дефекте продукции антител, тогда как низкий уровень и отсутствие ответа у 2–3-летнего ребенка. это нормально и просто указывает на физиологическую незрелость. Трудно поставить точный диагноз дефицита специфических антипневмококковых антител у ребенка в возрасте до 5–6 лет.
Селективный дефицит IgA — самый распространенный иммунодефицит с частотой 1: 400–700 32 , 33 . Многие больные не имеют симптомов, но другие, особенно те, у кого есть связанный подкласс IgG или специфический дефицит антител, страдают от рецидивирующих синопульмональных инфекций. Поскольку сывороточные уровни IgA у здоровых детей низкие и не достигают уровня взрослых до 8 или 9 лет, диагноз дефицита IgA не следует ставить у детей в возрасте до 4 лет 33 .
При другом важном дефиците антител, Х-сцепленной агаммаглобулинемии, наблюдаются низкие или неопределяемые уровни всех основных иммуноглобулинов из-за аномалий гена BTK и дифференцировки В-клеток у пораженных мальчиков. Может быть ассоциированная нейтропения. Пиогенные инфекции, такие как пневмония, впервые появляются через 6–12 месяцев. Если не лечить регулярную внутривенную или подкожную терапию иммуноглобулином и агрессивное лечение антибиотиками острых инфекций, это быстро прогрессирует до хронического бактериального бронхита и необратимого поражения легких с бронхоэктазами.
Дефицит Т-лимфоцитов
Т-лимфоциты необходимы не только для борьбы с вирусными, грибковыми, микобактериальными и протозойными инфекциями, но и для помощи В-клеткам в производстве иммуноглобулинов. 33 . Дети с дефицитом Т-клеток могут иметь тяжелые бактериальные инфекции, а также классические условно-патогенные инфекции. Первичная недостаточность Т-лимфоцитов — редкое наследственное заболевание. У детей с тяжелым комбинированным иммунодефицитом (ТКИД) сильно нарушена функция Т- и В-клеток.Хотя они могут проявляться рецидивирующими инфекциями грудной клетки, они часто связаны с другими тяжелыми острыми инфекциями, включая сепсис, тяжелые и резистентные кожно-слизистые грибковые инфекции и энтеропатии 35 . Большинство нелеченных детей умирают в младенчестве, и единственным лекарством является трансплантация костного мозга или стволовых клеток.
Первичная недостаточность Т-лимфоцитов — редкое наследственное заболевание. У детей с тяжелым комбинированным иммунодефицитом (ТКИД) сильно нарушена функция Т- и В-клеток.Хотя они могут проявляться рецидивирующими инфекциями грудной клетки, они часто связаны с другими тяжелыми острыми инфекциями, включая сепсис, тяжелые и резистентные кожно-слизистые грибковые инфекции и энтеропатии 35 . Большинство нелеченных детей умирают в младенчестве, и единственным лекарством является трансплантация костного мозга или стволовых клеток.
Многие дети с синдромом ДиДжорджи, у которых имеется микроделеция хромосомы 22q11.2, имеют более умеренный дефицит Т-клеток, с пониженным числом лимфоцитов и Т-клеток и плохими in vitro Т-клеточная пролиферация. митогены, такие как фитогемоглуттинин или митоген тыквенных сорняков.Эти дефекты часто улучшаются по мере взросления ребенка, но у пораженных детей в раннем детстве могут быть рецидивирующие инфекции грудной клетки и бронхоэктазы.
Нарушения фагоцитов
Первичные нарушения количества или функции фагоцитов относительно редко встречаются у детей 36 . Рецидивирующие синопульмональные, желудочно-кишечные инфекции и инфекции мягких тканей, вызванные Staph. aureus , Burkholderia cepacia , Serratia marcascens и грибы являются обычным способом представления.У мальчиков с хронической гранулематозной болезнью (ХГБ) частым проявлением является кавитационная пневмония, которая плохо поддается лечению антибиотиками, — наиболее распространенное серьезное фагоцитарное расстройство, при котором наблюдается неполноценное уничтожение проглоченных микроорганизмов. Тяжелые пневмонии, эмпиемы и бронхоэктазы часто встречаются у детей с синдромом гипер-IgE (Job), у которых имеется широкий спектр дефектов нейтрофильной, лимфоцитарной и гуморальной функции, а также очень высокий уровень сывороточного IgE 37 .
Нарушения функции ресничек
У здоровых детей микрочастицы респираторного эпителия бьются регулярно и согласованно, выталкивая слизь проксимальнее ротоглотки, где она проглатывается или откашливается. Слизь обеспечивает физический и химический барьер для патогенов 15 , 38 .
Слизь обеспечивает физический и химический барьер для патогенов 15 , 38 .
Предполагаемая распространенность первичной цилиарной дискинезии (ПЦД) составляет 1: 16,000–20,000 38 . Недавние разработки в области высокоскоростной цифровой визуализации привели к выявлению растущего числа врожденных дефектов цилиарной структуры, характера и частоты биений при использовании в сочетании с электронно-микроскопическими исследованиями биопсий носового эпителия щеткой 15 .Многие случаи PCD не диагностированы 38 , что свидетельствует о плохой осведомленности о спектре клинических паттернов этих заболеваний и о сложности постановки точного диагноза. Большинство случаев являются аутосомно-рецессивными, но сообщалось о других типах наследования — пораженные гены еще не идентифицированы. В равной степени страдают самцы и самки.
Дети с первичной цилиарной дискинезией имеют аномальный мукоцилиарный клиренс. PCD может проявляться у новорожденных с тахипноэ или пневмонией, иногда связанной с заложенностью носа и слизисто-гнойными выделениями.У младенцев старшего возраста и детей это обычно проявляется стойким продуктивным кашлем, атипичной астмой или иногда тяжелым гастроэзофагеальным рефлюксом, а позже — с признаками бронхоэктазии. Поскольку также поражаются верхние дыхательные пути, часто также присутствуют хронический гнойный ринит, синусит и хронический секреторный средний отит с выпотом и кондуктивной глухотой. 38 . У половины детей с классическим синдромом Картагенера в дополнение к этим признакам наблюдается обратное сидение и декстрокардия, а также повышается частота врожденных пороков сердца, гидроцефалии и атрезии пищевода.Большинство пораженных мужчин бесплодны из-за неподвижных сперматозоидов, а пораженные женщины могут быть субфертильными.
Диагностировать первичную цилиарную дискинезию технически сложно. Это зависит от оценки структуры и функции ресничек с использованием специализированных методов, упомянутых выше, и лишь немногие центры могут дать надежные результаты. Ложноотрицательные и ложные срабатывания случаются. Нарушение функции ресничек также наблюдается при астме, муковисцидозе и после некоторых вирусных и бактериальных инфекций (вторичная цилиарная дискинезия).Традиционные тесты на мукоцилиарный клиренс, такие как сахариновая проба, у детей ненадежны. Оксид азота в носу ниже у детей с PCD, чем у здоровых детей контрольной группы или у детей с астмой и другими формами бронхоэктазов, и это может оказаться полезным скрининговым тестом для этой группы состояний в будущем. 39 .
Ложноотрицательные и ложные срабатывания случаются. Нарушение функции ресничек также наблюдается при астме, муковисцидозе и после некоторых вирусных и бактериальных инфекций (вторичная цилиарная дискинезия).Традиционные тесты на мукоцилиарный клиренс, такие как сахариновая проба, у детей ненадежны. Оксид азота в носу ниже у детей с PCD, чем у здоровых детей контрольной группы или у детей с астмой и другими формами бронхоэктазов, и это может оказаться полезным скрининговым тестом для этой группы состояний в будущем. 39 .
Врожденные аномалии легкого
Рецидивирующие или стойкие инфекции грудной клетки часто встречаются у детей с врожденными аномалиями дыхательных путей, паренхимы легких и легочной сосудистой сети 39 , 41 .Например, повторяющиеся эпизоды пневмонии часто являются характерным признаком секвестрации долей, бронхиального стеноза и бронхомаляции, а также кистозно-аденоматоидных мальформаций легких 42 . Такое отклонение следует заподозрить, если одна доля инфицирована повторно или если после лечения наблюдается неполное разрешение. Компьютерная томография и магнитно-резонансное сканирование помогают определить аномалию перед хирургическим удалением.
Дети, рожденные с атрезией пищевода и трахео-пищеводным свищом, в раннем возрасте часто имеют повторные эпизоды пневмонии и бронхита в результате сохраняющихся нарушений функции дыхательных путей и пищевода 43 .Заболеваемость заболеванием составляет 1: 3000, а связанные с ним дефекты позвоночника, анального канала, сердца, почек или конечностей (аномалии VACTERL) наблюдаются у 50% пораженных детей 42 . В одной серии из 334 выживших после трахео-пищеводного свища с атрезией пищевода у 31% был один или несколько эпизодов пневмонии в первые 5 лет жизни, а 5% были госпитализированы более 5 раз. У многих был рецидивирующий «бронхит» в детстве 44 . По мере взросления детей заболеваемость пневмонией и бронхитом снижается. Гастроэзофагеальный рефлюкс, нарушение моторики пищевода и стриктуры предрасполагают к рецидивирующей аспирационной пневмонии у этих детей. Некоторым требуется дополнительная операция на пищеводе, чтобы предотвратить прогрессирующее повреждение легких и обеспечить адекватное питание. Как рестриктивные, так и обструктивные паттерны легочной дисфункции присутствуют у 18–60% выживших. 43 , 45 .
Гастроэзофагеальный рефлюкс, нарушение моторики пищевода и стриктуры предрасполагают к рецидивирующей аспирационной пневмонии у этих детей. Некоторым требуется дополнительная операция на пищеводе, чтобы предотвратить прогрессирующее повреждение легких и обеспечить адекватное питание. Как рестриктивные, так и обструктивные паттерны легочной дисфункции присутствуют у 18–60% выживших. 43 , 45 .
Туберкулез
Туберкулез следует рассматривать у любого ребенка с постоянным продуктивным кашлем, особенно если есть системные признаки, такие как лихорадка, потеря веса или общее недомогание.Поскольку большинство туберкулезных инфекций передается через дыхательные пути, первичные поражения легких возникают у более 95% инфицированных детей. Как и у взрослых, существует несколько различных клинических и радиологических паттернов заболевания легких, которые могут развиться из первичного комплекса. К ним относятся излияния, кавитация, бронхиальная обструкция из-за средостенной лимфаденопатии с ателектазом или дистальной эмфиземой, туберкулезная пневмония, эндобронхиальный туберкулез или милиарное заболевание. Посттуберкулезные бронхоэктазы в настоящее время встречаются редко.Внелегочные проявления, из которых наиболее серьезным является менингит, чаще встречаются у детей, чем у взрослых. Диагноз зависит от высокого индекса подозрительности, туберкулиновой кожной пробы, радиологии и микробиологии мокроты и промываний желудка.
Обследование ребенка с хроническим гнойным заболеванием легких
Невозможно переоценить важность истории болезни и обследования при оценке состояния этих детей.
Простой рентгеновский снимок грудной клетки полезен для оценки степени тяжести и распределения поражения легких.Широко распространенные изменения, такие как утолщение бронхиальной стенки или воспаление, охватывающее несколько долей, указывают на системное заболевание, такое как муковисцидоз, цилиарная дискинезия или иммунодефицитное расстройство. Очаговые изменения чаще встречаются при врожденной патологии, вдыхании инородного тела или бронхиальной обструкции по какой-либо другой причине. Компьютерная томография высокого разрешения (КТВР) более чувствительна, чем обычные рентгенограммы, при обнаружении бронхоэктазов: она в значительной степени заменила бронхографию. Он также может показать локализованные области захвата газов (гиперинфляции) и интерстициального фиброза, которые не видны на рентгенограмме грудной клетки, например, у детей с облитерирующим бронхиолитом.КТ-сканирование и магнитно-резонансная томография полезны для оценки врожденных анатомических аномалий, таких как секвестрация или кистозно-аденоматоидные мальформации. Сканирование изотопов дает полезные доказательства региональной вентиляции и перфузии.
Очаговые изменения чаще встречаются при врожденной патологии, вдыхании инородного тела или бронхиальной обструкции по какой-либо другой причине. Компьютерная томография высокого разрешения (КТВР) более чувствительна, чем обычные рентгенограммы, при обнаружении бронхоэктазов: она в значительной степени заменила бронхографию. Он также может показать локализованные области захвата газов (гиперинфляции) и интерстициального фиброза, которые не видны на рентгенограмме грудной клетки, например, у детей с облитерирующим бронхиолитом.КТ-сканирование и магнитно-резонансная томография полезны для оценки врожденных анатомических аномалий, таких как секвестрация или кистозно-аденоматоидные мальформации. Сканирование изотопов дает полезные доказательства региональной вентиляции и перфузии.
Всем детям с постоянным кашлем следует измерять электролиты пота. Потовый тест остается стандартным диагностическим тестом для CF, хотя исследования мутаций гена CF используются все чаще. Другие исследования включают бактериологические исследования мокроты, если она может быть произведена; уровни вирусных и микоплазменных антител; туберкулиновая кожная проба; а в отдельных случаях — тесты на иммунную функцию.Всем детям следует сделать полный анализ крови и лейкоциты: стойкая лимфопения или нейтропения может присутствовать даже в том случае, если ребенок здоров.
Выбор иммунных тестов будет зависеть от характера и тяжести респираторных симптомов. Например, у ребенка, у которого были повторные приступы кашля с гнойной мокротой, содержащей Strep. pneumoniae или H.influenzae , но который в остальном чувствует себя хорошо, без клинических или радиологических свидетельств повреждения легких, измерение уровней подкласса иммуноглобулинов и иммуноглобулинов, а также уровни специфических антител против пневмококка, столбняка и Hib будут подходящими в качестве специфических антител дефицит — наиболее вероятный диагноз.Детей с низким уровнем Hib и антипневмококковых антител следует иммунизировать Hib-вакциной и (в возрасте старше 4 лет) Pneumovax ® и повторить уровни антител через 4–6 недель. Напротив, ребенок с тяжелой условно-патогенной пневмонией требует детальной оценки клеточной и гуморальной иммунной функции (таблица 4). Это следует запланировать с клиническим иммунологом.
Напротив, ребенок с тяжелой условно-патогенной пневмонией требует детальной оценки клеточной и гуморальной иммунной функции (таблица 4). Это следует запланировать с клиническим иммунологом.
Гибкая волоконно-оптическая бронхоскопия в настоящее время признана ключевым исследованием при обследовании детей с хроническим сепсисом легких или подозрением на иммунодефицит.Микробиологические и клеточные образцы можно получить путем аспирации, использования защищенной щетки или бронхоальвеолярного лаважа. Бронхоскопия также позволяет детально оценить трахеобронхиальную анатомию и динамику, а также идентифицировать неожиданные инородные тела.
Если история болезни предполагает повторную аспирацию, это может быть обнаружено с помощью изотопного сканирования молока. Некоординированное глотание, которое чаще всего наблюдается у детей с серьезными проблемами развития нервной системы, такими как церебральный паралич или тяжелые миопатии, следует оценивать с помощью видеофлюороскопического глотания с барием 26 .Хотя мониторинг pH пищевода может давать как ложноположительные, так и ложноотрицательные результаты, он остается лучшим тестом для оценки частоты и тяжести гастроэзофагеального рефлюкса. Для исследования респираторных ресничек требуется направление в специализированный центр.
Организация опеки
Оценка и ведение детей с хроническим гнойным заболеванием легких или рецидивирующей тяжелой инфекцией сложны. Это требует участия нескольких специалистов, включая педиатров-респираторов, детских радиологов, иммунологов, физиотерапевтов и микробиологов.Подход мультидисциплинарной команды, который оказался столь успешным в улучшении лечения и улучшении прогнозов людей с муковисцидозом, теперь применяется для ухода за этой требовательной группой пациентов в некоторых специализированных педиатрических центрах, в том числе в Королевской детской больнице Ливерпуля. Сосредоточение опыта многих редких состояний в специализированной команде позволяет разработать более методичный подход к клиническому уходу за такими детьми. Он также имеет потенциал для клинических исследований, которые явно необходимы для определения оптимального ухода за этими детьми.
Он также имеет потенциал для клинических исследований, которые явно необходимы для определения оптимального ухода за этими детьми.
Ключевые моменты клинической практики
• Рецидивирующие инфекции грудной клетки у детей могут быть вызваны множеством различных причин. Врач должен различать детей с самоограничивающимися или легко управляемыми состояниями, такими как рецидивирующие острые вирусные инфекции или астма, и детьми с более тяжелыми, часто прогрессирующими заболеваниями
• Важно понимать эпидемиологию острых респираторных инфекций. у детей и факторы, влияющие на характер этих распространенных инфекций
• Хронический или повторяющийся кашель с гнойной мокротой или повторяющиеся эпизоды пневмонии предполагают хроническое гнойное заболевание легких и возможность бронхоэктазов.Эти дети требуют подробного и специализированного обследования.
• Наиболее частыми причинами гнойного заболевания легких являются муковисцидоз, иммунодефицит, врожденные аномалии легких и ресничек, а также повреждение легких, вызванное острой пневмонией. Другие причины включают неожиданное инородное тело или повторную аспирацию.
• Хотя тщательный сбор анамнеза и обследование жизненно важны для оценки этих детей, часто показаны специальные обследования, включая пробы пота, иммунные и цилиарные тесты, а также бронхоскопию.Обычная рентгенология, компьютерная томография и магнитно-резонансная томография могут помочь определить место и степень любых аномалий, таких как бронхоэктазы, ателектазы или врожденные аномалии. Многопрофильный командный подход к оценке и уходу за этой требовательной и сложной группой детей имеет много преимуществ
Список литературы
1Информационное агентство по легким и астме. Бремя респираторных заболеваний , Информационный бюллетень 3. Лондон: LAIA, 1995
2 Hill AM. Тенденции в педиатрической госпитализации.
Тенденции в педиатрической госпитализации.
BMJ
1989
;298
:1479
–833Couriel JM. Инфекции нижних дыхательных путей в детстве. В: Эллис М. (ред) Инфекции дыхательных путей . Кембридж: Издательство Кембриджского университета, 1998; 406–27
4Woroniecka M, Ballow M. Офисная оценка детей с рецидивирующей инфекцией.
Pediatr Clin North Am
2000
;47
:1211
–245Heath PT.Эпидемиология и бактериология бактериальных пневмоний.
Педиатр Респир Ред.
2000
;1
:4
–76Денни Ф.В. Острые инфекции нижних дыхательных путей. В: Taussig LM, Landau LI. (eds) Детская респираторная медицина . Сент-Луис, Миссури: Мосби, 1999; 556–72
7Райт А.Л., Тауссиг Л.М., Рэй К.Г., Харрисон Х.Р., Холберг К.Дж. Детское респираторное исследование Tuscon II. Заболевание нижних дыхательных путей на первом году жизни.
Am J Epidemiol
1989
;129
:1232
–468Мерфи Т.Х., Хендерсон Ф.В., Клайд, Вашингтон, Коллиер А.М., Денни Ф.В.Пневмония: одиннадцатилетнее исследование в педиатрической практике.
Am J Epidemiol
1981
;113
:12
–219Йокинен К., Хейсканен Л., Ювонен Х. и др. . Заболеваемость внебольничной пневмонией среди населения четырех муниципалитетов Восточной Финляндии.
Am J Epidemiol
1993
;137
:977
–8810Korppi M, Heiskanen K, Jalonen E et al . Этиология внебольничной пневмонии у детей, находящихся на стационарном лечении.
Eur J Pediatr
1993
;152
:24
–3011Уэйд А.Ф., Кэмпбелл Д.М., Вен Э.Е. Основные причины рецидивирующей пневмонии у детей.
Arch Pediatr Adolesc Med
2000
;154
:190
–412Beaudry M., Dufour R, Marcoux S. Связь между кормлением грудных детей и инфекциями в течение первых шести месяцев жизни.
J Pediatr
1995
;126
:191
–713 Li JSM, Peat JK, Xuan W, Berry G. Метаанализ связи между воздействием ETS и распространенностью инфекций нижних дыхательных путей в раннем детстве.
Метаанализ связи между воздействием ETS и распространенностью инфекций нижних дыхательных путей в раннем детстве.
Pediatr Pulmonol
1999
;27
:5
–1314Couriel JM. Пассивное курение и здоровье детей.
Thorax
1994
;49
:731
–415Чилверс М.А., О’Каллаган К. Местные механизмы мукоцилиарной защиты.
Педиатр Респир Ред.
2000
;1
:27
–3416Ларсен Г.Защитные системы легкого. В: Taussig LM, Landau LI. (eds) Детская респираторная медицина . Сент-Луис, Миссури: Мосби, 1999; 57–75
17Герритсен Дж. Защита дыхательной системы хозяином.
Педиатр Респир Ред.
2000
;1
:128
–3418Wilmott RW, Khurana-Hershey G, Stark JM. Современные концепции защитных механизмов легочного организма у детей.
Curr Opin Pediatr
2000
;12
:187
–9019Рубин БК.Обследование ребенка с рецидивирующими инфекциями дыхательных путей.
Pediatr Infect Dis J
1985
;4
:88
–9820Дуглас Т., Куриэль Дж. М.. Дифференциальный диагноз астмы у детей.
Asthma J
2001
;6
:72
–621Child HF, Couriel JM. Бронхиолит и не только: у кого будет хрипеть и почему?
Asthma J
1999
;4
:20
–322Stein RT, Sherrill D, Morgan WJ et al .Респираторно-синцитиальный вирус в молодом возрасте и риск возникновения хрипов и аллергии к 13 годам.
Ланцет
1999
;354
:541
–523Дэвис Х., Гордон И., Мэтью Д. Т. и др. . Долгосрочное наблюдение после вдыхания инородных тел.
Arch Dis Child
1990
;65
:619
–2124Дагли Э. Бронхоэктазы без кистозного фиброза.
Педиатр Респир Ред.
2000
;1
:64
–7025 Morton RE, Wheatley R, Minford J.Инфекции дыхательных путей, вызванные прямой и рефлюксной аспирацией у детей с нейродизбалитетами.
Dev Med Child Neurol
1999
;41
:329
–4326Couriel JM, Bisset RAL, Miller R, Thomas A, Clarke M. Оценка трудностей с кормлением при нарушениях неврологического развития — командный подход.
Arch Dis Child
1993
;69
:609
–327Руусканен О., Ваахторанта-Лехтонен, Меурман О. Аденовирусная инфекция дыхательных путей.В: Дэвид Т.Дж. (ред) Последние достижения в педиатрии, том 11 . Эдинбург: Черчилль Ливингстон, 1994; 19–31
28Murtagh P, Cerquieo C, Halac A, Avila M, Kajon A. Аденовирусные респираторные инфекции типа 7: отчет о 29 случаях острых заболеваний нижних дыхательных путей.
Acta Paediatr Scand
1993
;82
:557
–6129Слай П.Д., Сото-Кирос М.Э., Ландау Л.И., Хадсон И., Ньютон-Джон Х. Факторы, предрасполагающие к нарушению функции легких после аденовирусной пневмонии 7-го типа.
Arch Dis Child
1984
:59
:935
–930Simila S, Linna O, Lanning P, Heikkinen E, Ala-Houhala M. Хроническое повреждение легких, вызванное аденовирусом типа 7: десять лет следовать за.
Комод
1981
;80
:127
–3131Хейни М. Выявление и лечение первичного иммунодефицита. В: Дэвид Т.Дж. (ред) Последние достижения в педиатрии, том 9 . Эдинбург: Черчилль Ливингстон, 1990; 21–40
32Сотомайор Дж. Л., Дуглас С. Д., Уилмотт Р. У.Легочные проявления нарушений иммунодефицита.
Pediatr Pulmonol
1989
;6
:275
–9233Соренсен Р.У., Мур С. Синдромы дефицита антител.
Pediatr Clin North Am
2000
;47
:1225
–5234Lawton AR. Дефицит подкласса IgG.
Pediatr Infect Dis J
1999
;18
:462
–635Старейшина ME. Дефицит Т-клеток.
Pediatr Clin North Am
2000
;47
:1253
–7436 Segal BH, Holland SM.Первичные фагоцитарные нарушения у детей.
Pediatr Clin North Am
2000
;47
:1311
–3837Grimbacher B, Holland SD, Gallin T et al . Синдром гипер-IgE с рецидивирующей инфекцией: аутосомно-доминантное состояние.
N Engl J Med
1999
;340
:692
–70238Микс М., Буш А. Первичная цилиарная дискинезия.
Пульмонол педиатр
2000
;29
:307
–1639Карадаг Б., Джеймс А.Дж., Гултекин Э., Уилсон Н.М., Буш А.Уровни оксида азота в носу и нижних дыхательных путях у детей с первичной цилиарной дискинезией.
Eur Respir J
1999
;13
:1402
40Bratu I, Flageole H, Chen MF, Di Lorenzo M, Yazbeck S, Laberge JM. Множественные аспекты легочной секвестрации.
J Pediatr Surg
2001
;36
:784
–9041Такеда С., Миёси С., Иноуэ М. и др. . Клинический спектр врожденных кистозных заболеваний легких у детей.
евро J Cardiothorac Surg
1999
;15
:11
–742Зак М., Эбер Э. Исход врожденных пороков развития нижних дыхательных путей у взрослых.
Грудь
2001
;56
:65
–7243Couriel JM, Hibbert M, Olinsky A, Phelan PD. Отдаленные легочные последствия атрезии пищевода.
Acta Paediatr Scand
1982
;71
:973
–844Chetcuti P, Phelan PD.Заболевание органов дыхания после восстановленной атрезии пищевода и трахео-пищеводного свища.
Arch Dis Child
1993
;68
:167
–7045Chetcuti P, Phelan PD, Greenwood R. Нарушения функции легких при восстановленной атрезии пищевода и трахео-пищеводной фистуле.
Thorax
1992
;47
:1030
–40Распространение бактерий в легких у детей с затяжным бактериальным бронхитом
Аннотация
Объективы
Гибкая бронхоскопия с бронхоальвеолярным лаважем (FB-BAL) все чаще используется для микробиологического подтверждения затяжного бактериального бронхита (PBB) у детей с хроническим влажным кашлем.В нашем центре при выполнении FB-BAL для микробиологической диагностики мы отбираем образцы из 6 долей (включая язычок), поскольку это, как известно, увеличивает частоту положительных посевов у детей с муковисцидозом. Мы исследовали, так ли это у детей с ПБД.
Методы
Мы провели ретроспективный обзор истории болезни 50 детей, обследованных на предмет подозрения на ПБД в период с мая 2011 года по ноябрь 2013 года.
Результаты
Средний возраст (IQR) при бронхоскопии составлял 2 года.9 (1,7–4,4) лет, а средняя (IQR) продолжительность кашля составляла 11 (8,0–14) месяцев. Положительные культуры были получены от 41/50 (82%) и 16 (39%) этих пациентов, выделенных ≥2 микроорганизмов. Наиболее частыми выделенными микроорганизмами были Haemophilus influenzae (25 пациентов), Moraxella catarrhalis (14 пациентов), Staphylococcus aureus (11 пациентов) и Streptococcus pneumoniae (8 пациентов). Если бы была взята только одна доля (согласно руководству Европейского респираторного общества), 17 различных организмов были бы пропущены у 15 пациентов, 8 из которых вообще не имели бы культивирования организмов.Результаты посева FB-BAL привели к назначению антибиотика, отличного от коамоксиклава, 17 из 41 (41%) пациента.
Выводы
Распределение бактерий в легких у детей с ПБД неоднородно, поэтому микроорганизмы могут быть пропущены, если в FB-BAL отбирается проба только из одной доли. Положительные результаты FB-BAL полезны для детей с PBB и могут повлиять на лечение.
Образец цитирования: Наранг Р., Бейкуэлл К., Пич Дж., Клейтон С., Сэмюэлс М., Александр Дж. И др.(2014) Распространение бактерий в легких у детей с затяжным бактериальным бронхитом. PLoS ONE 9 (9): e108523. https://doi.org/10.1371/journal.pone.0108523
Редактор: Эндрю Макдауэлл, Университет Ольстера, Великобритания
Поступила: 22 июля 2014 г .; Одобрена: 22 августа 2014 г .; Опубликован: 26 сентября 2014 г.
Авторские права: © 2014 Narang et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Авторы подтверждают, что все данные, лежащие в основе выводов, полностью доступны без ограничений. Все соответствующие данные находятся в документе.
Финансирование: У авторов нет финансирования или поддержки, чтобы сообщить.
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Введение
Хронический кашель — частый симптом у детей и частая причина обращения к специалисту.[1], [2] Хотя всегда необходимо исключать основное заболевание легких, у большинства детей с хроническим кашлем легкие в остальном нормальные. Затяжной бактериальный бронхит (ПББ) описывает хроническую инфекцию проводящих дыхательных путей и характеризуется чувствительным к антибиотикам влажным кашлем, сохраняющимся более 4 недель. [3] У все большего числа детей диагностируется ПБД, но неясно, связано ли это с истинным увеличением заболеваемости или повышением узнаваемости. [4] Было высказано предположение, что на заболеваемость ПБД могло повлиять врачи, прописывающие меньшее количество курсов антибиотиков при инфекциях нижних дыхательных путей, которые считаются вирусными [5], [6].
Микробиологическое подтверждение наличия ПБД представляет собой серьезную проблему, поскольку пораженные дети редко отхаркивают мокроту. В результате ПБД может быть пропущен, неправильно диагностирован или неадекватно лечиться. Это потенциально может привести к структурному повреждению дыхательной системы и увеличить вероятность сохранения симптомов. [7] Золотым стандартом отбора проб из нижних дыхательных путей у детей младшего возраста является гибкая бронхоскопия с бронхоальвеолярным лаважем (FB-BAL). Это безопасно и имеет низкий уровень осложнений.[8] В нашем центре дети с подозрением на ПБД, не ответившие на двухнедельный курс пероральных антибиотиков, обследуются с помощью рентгена грудной клетки (РРГ) и FB-BAL. Пациентов с положительными культурами БАЛ затем лечат 6-недельным курсом соответствующего перорального антибиотика. Другие центры предпочитают лечить пациентов длительным курсом антибиотиков до постановки микробиологического диагноза, оставляя FB-BAL для детей, которые не реагируют или рецидивируют.
При проведении FB-BAL у детей с подозрением на ПБД в нашей практике проводится однократная аликвотная промывка бронхов из каждой из 6 долей (включая язычок).Это отличается от руководства Европейского респираторного общества (ERS), которое рекомендует тройную аликвоту пробы из одной доли. [9] Наша практика основана на знании того, что эта методика безопасна и использовалась для демонстрации гетерогенного распределения бактерий в легких у детей с другими респираторными заболеваниями, такими как муковисцидоз (МВ). [10] Целью этого исследования был обзор результатов FB-BAL и CXR у детей с ПБД, чтобы оценить распределение бактерий в долях легких у детей с ПБД.
Методы
Мы ретроспективно рассмотрели истории болезни 50 детей, которых последовательно обследовали на предмет подозрения на ПБД в период с мая 2011 г. по ноябрь 2013 г. в Университетской больнице Северного Стаффордшира. Согласно определению Управления медицинских исследований, этот проект был оценкой услуг, поэтому согласие пациента получено не было. Перед анализом вся информация о пациентах была обезличена и обезличена. Все процедуры FB-BAL проводились под общей анестезией, и пациентов просили не принимать никаких антибиотиков в течение предшествующих 7 дней.Процедура была идентична у всех пациентов. Бронхоскоп (2,8 мм BF-XP260F или 4,0 мм BF-P260F; Olympus America Inc, Центер-Вэлли, США) вводился в нижние дыхательные пути через ларингеальную маску, а всасывающий порт не использовался до тех пор, пока кончик бронхоскопа не оказался ниже уровень киля. Единичные аликвоты смывов из бронхов получали из каждой доли, вклинивая кончик бронхоскопа в долевой бронх и осторожно закапывая 1 мл / кг (максимум 20 мл) 0,9% физиологического раствора комнатной температуры под прямым зрением.Физиологический раствор немедленно отсасывали в стерильную отсасывающую ловушку. Образцы долей отбирались в установленном порядке: правая верхняя, правая средняя, правая нижняя, левая верхняя, язычная и левая нижняя. Образцы отправлены в микробиологическую лабораторию для полуколичественного бактериального посева. Цитологические исследования не проводились. Каждый образец БАЛ использовали для инокуляции 5 чашек с агаром: один кровяной агар, один шоколадный агар, один агар с дефицитом цистеин-лактозного электролита, один агар Сабуро и один селективный хромогенный агар Staphylococcus aureus .Планшеты инкубировали 48 часов. Видимый рост был идентифицирован и классифицирован как: отсутствие роста, скудный рост, умеренный рост или сильный рост. После каждой бронхоскопии бронхоскоп вручную очищали моющим / ферментным раствором у постели больного, а затем обрабатывали с помощью автоматического репроцессора эндоскопа. Перед использованием бронхоскоп обработали. Еженедельные мазки для наблюдения брали из осциллографов, которые всегда были отрицательными.
Результаты
У всех 50 детей были FB-BAL и CXR.Средний возраст (IQR) детей составлял 2,9 (1,7–4,4) года, а средняя (IQR) продолжительность кашля составляла 11,0 (8,0–14,0) месяцев. Положительные культуры были получены от 41/50 (82%) детей; общее количество положительных культур составляло 64. Из тех, у кого были положительные культуры, 25 детей (61%) выращивали 1 организм, 9 (22%) выращивали 2 различных организма и 7 (17%) выращивали 3 или более разных организма. Наиболее часто культивировались следующие микроорганизмы: Haemophilus influenza (25 детей), Moraxella catarrhalis, (14 детей), Staphylococcal aureus (11 детей) и Streptococcus pneumonia, (8 детей).Не было связи между количеством долей с положительной культурой и количеством посевов. Только 15 (30%) рентгенограмм были нормальными. Наиболее частыми аномалиями были утолщение бронхиальной стенки у 24 детей (48%), усиление бронхиальных отметин у 10 (20%) и уплотнение у 7 (14%).
Если бы мы взяли образцы только наиболее пораженных или RML (согласно руководству ERS), 17 организмов (28 положительных культур) были бы пропущены у 15 детей. Ни у одного из этих 15 детей не было выявлено наиболее пораженной доли рентгенологически или макроскопически во время процедуры FB-BAL.Поэтому был использован результат RML. У восьми из 15 детей не было организмов, выращенных из RML. Таким образом, только взятие пробы из одной доли привело бы к тому, что 7 (14%) детей имели неполную микробиологическую информацию и 8 (16%) имели ложноотрицательный результат бронхоскопии. Если бы мы ограничили выборку язычка и RML, то 11 организмов (13 положительных культур) были бы пропущены у 10 (20%) пациентов, 6 (12%) из которых вообще не имели бы никаких организмов в культуре. См. Таблицу 1.
Все 41 пациент с положительным результатом посева БАЛ прошли 6-недельный курс пероральных антибиотиков.Наиболее часто назначаемыми антибиотиками были коамоксиклав (n = 24, 59%), кларитромицин (n = 5, 12%), амоксициллин (n = 4, 10%) и флуклоксациллин (n = 4, 10%). Два микроорганизма имели устойчивость к коамоксиклаву in vitro, а у 11 пациентов — изолированный Staphylococcus aureus , который наш отдел микробиологии рекомендует лечить флуклоксациллином или кларитромицином, а не ко-амоксиклавом.
Обсуждение
FB-BAL с выборкой 6 долей (включая язычок) ранее продемонстрировал гетерогенное распределение бактерий в легких детей с МВ.[10] Данные текущего исследования предполагают аналогичную гетерогенность бактериального распределения в ПБД. Из-за этой неоднородности, если бы мы ограничили выборку одной или двумя долями, ряд организмов был бы пропущен. Это привело бы к неполным микробиологическим данным или ложноотрицательным результатам и, в конечном итоге, к назначению неправильного антибиотика или к полному отказу от приема антибиотиков. Мы продемонстрировали, что положительные культуры были получены из 41/50 (82%) процедур FB-BAL.Это выше, чем частота 46% и 63%, наблюдавшаяся в предыдущих исследованиях, в которых отбиралась только одна доля. [11], [12] Наш более высокий уровень положительных посевов, по-видимому, связан с отбором образцов из 6 долей, как если бы мы взяли образец только одной доли (RML), процент положительных посевов процедур упал бы до 33/50 (66% ), а если бы мы выбрали 2 доли (RML и язычок), это было бы 35/50 (70%).
При выполнении БАЛ с тройной аликвотой рекомендуется направлять аликвоту 1 st на микробиологический посев, поскольку это более проксимальный образец.[9] 2 -й и 3 -й аликвоты объединены для цитологических и неклеточных исследований, поскольку они являются более дистальными образцами. Поэтому при проведении однократных промывок бронхов нецелесообразно отправлять цитологические исследования. Если цитология БАЛ проводится у пациентов с ПБД, она демонстрирует повышенное количество нейтрофилов. [3] В некоторых клинических ситуациях это может быть использовано для подтверждения того, что положительный посев на ЖБАЛ вызван инфекцией, а не колонизацией, но поскольку у всех пациентов с ПБД имеются симптомы, нельзя предположить, что положительный посев из дыхательных путей вызван колонизацией.Это означает, что результаты цитологического исследования не включены в качестве диагностического критерия для ПБД, и мы не думаем, что они предоставили бы какую-либо дополнительную информацию в этой конкретной клинической ситуации.
Основой лечения ПБД являются пероральные антибиотики, хотя сообщалось об использовании внутривенных и распыляемых антибиотиков. [11] Если существует микробиологическое подтверждение наличия ПБД, тогда антибиотики могут быть выбраны в соответствии с изолированным организмом и его чувствительностью. Если лечение начинается «вслепую», то наиболее широко применяемым препаратом первой линии является коамоксиклав.[13] Если это невозможно, можно использовать макролид или цефалоспорин. [14] В нашем исследовании, хотя ко-амоксиклав мог бы быть подходящим антибиотиком для большинства детей, результаты бронхоскопии привели нас к использованию другого антибиотика у 17 детей. Для 4 детей культуры позволили нам прописать амоксициллин, а не сопутствующие препараты. амоксиклав. Два изолированных организма с устойчивостью к коамоксиклаву in vitro и 11 детей изолировали Staphylococcus aureus , которые наше отделение микробиологии рекомендует лечить флуклоксациллином или кларитромицином, а не коамоксиклавом.
Таким образом, это исследование подтверждает, что FB-BAL является полезным исследованием у детей с PBB, и результаты могут повлиять на лечение. Это также предполагает, что при проведении FB-BAL у таких детей ряд организмов может быть пропущен, если выборка ограничена одной или двумя долями. Необходимы дальнейшие исследования для оценки наиболее подходящего времени проведения бронхоскопии у детей с ПБД и оптимальной продолжительности лечения.
Вклад авторов
Задумал и спроектировал эксперименты: FJG MS WL.Выполнял эксперименты: KB JP SC JA FJG. Проанализированы данные: РН. Участвовал в написании рукописи: RN FJG JA MS WL.
Ссылки
- 1. Brodlie M, Graham C, McKean MC (2012) Детский кашель. BMJ 344: e1177.
- 2. Faniran AO, Peat JK, Woolcock AJ (1999) Измерение стойкого кашля у детей в эпидемиологических исследованиях: разработка анкеты и оценка распространенности в двух странах. Сундук 115: 434–439.
- 3.Марчант Дж. М., Мастерс И. Б., Тейлор С. М., Кокс NC, Сеймур Дж. Дж. И др. (2006) Оценка и исходы у маленьких детей с хроническим кашлем. Сундук 129: 1132–1141
- 4. Craven V, Everard ML (2013) Затяжной бактериальный бронхит: новое изобретение старой болезни. Арч Дис Чайлд 98: 72–76
- 5. Арнольд С.Р., Буш А.Дж. (2006) Снижение ненадлежащего использования антибиотиков педиатрами в сообществе Теннесси за десять лет. Амбулаторный педиатр, J Ambul Pediatr Assoc 6: 225–229
- 6.Linehan MF, Hazell ML, Frank TL, Frank PI (2005) Распространенность респираторных симптомов у детей младше 5 лет: с 1993 по 2001 год. Arch Dis Child 90: 516–519
- 7. Истхэм К.М., Фолл А.Дж., Митчелл Л., Спенсер Д.А. (2004) Необходимость пересмотреть определение бронхоэктатической болезни, не связанной с кистозным фиброзом, в детстве. Грудь 59: 324–327.
- 8. De Blic J, Marchac V, Scheinmann P (2002) Осложнения гибкой бронхоскопии у детей: проспективное исследование 1328 процедур. Eur Respir J 20: 1271–1276.
- 9. Де Блик Дж., Мидулла Ф., Барбато А., Клемент А., Даб I и др. (2000) Бронхоальвеолярный лаваж у детей. Рабочая группа ERS по бронхоальвеолярному лаважу у детей. Европейское респираторное общество. Eur Respir J 15: 217–231.
- 10. Гилкрист Ф.Дж., Саламат С., Клейтон С., Пич Дж., Александр Дж. И др. (2011) Бронхоальвеолярный лаваж у детей с муковисцидозом: из скольких долей следует взять образец? Арч Дис Чайлд 96: 215–217
- 11. Доннелли Д., Кричлоу А., Эверард М.Л. (2007) Результаты лечения детей от стойкого бактериального бронхита.Грудь 62: 80–84
- 12. Згереа Д., Пагала С., Мендиратта М., Маркус М.Г., Шелов С.П. и др. (2012) Результаты бронхоскопии у детей с хроническим влажным кашлем. Педиатрия 129: e364–9
- 13. Marchant J, Masters IB, Champion A, Petsky H, Chang AB (2012) Рандомизированное контролируемое испытание амоксициллина клавуланата у детей с хроническим влажным кашлем. Грудь 67: 689–693
- 14. Shields MD, Bush A, Everard ML, McKenzie S, Primhak R (2008) Рекомендации BTS: Рекомендации по оценке и лечению кашля у детей.Грудная клетка 63 Дополнение 3: iii1 – iii15
антибиотиков: когда они помогают?
Антибиотики — сильнодействующие лекарства, убивающие бактерии. Они спасли много жизней и предотвратили плохие исходы. Эти препараты не убивают вирусы. Они действуют только на бактерии. Каждый день врачи должны решать, является ли инфекция у ребенка вирусной или бактериальной. Вот как они это делают:
Бактериальные инфекции
Гораздо реже, чем вирусные инфекции.Могут помочь антибиотики. Бактерии, вызывающие:
- Большинство инфекций уха
- Большинство инфекций носовых пазух (не заложенность носовых пазух)
- 20% ангины, которые представляют собой стрептококковые инфекции горла
- 10% пневмонии (легочная инфекция)
Вирусные инфекции
Большинство инфекций у детей вызваны вирусом. Антибиотики не помогают. Вирусы вызывают:
- 100% простудных заболеваний. (Примечание: если только они не перерастут в инфекцию уха или носовых пазух. Это случается в 5–10% случаев простуды.)
- 95% новых кашляет. (Примечание: астма также может начаться с кашля.)
- 95% лихорадок
- 80% болей в горле
- 90% пневмонии. (Примечание: большинство случаев у детей вызвано вирусом.)
- 99% диареи и рвоты
- Примечание. Существует несколько противовирусных препаратов, которые могут лечить вирусные инфекции. Примером может служить Тамифлю, применяемый при тяжелом гриппе.
Нормальные симптомы простуды
Иногда родителей беспокоят симптомы простуды.Приведенные ниже симптомы не являются признаками бактериальных инфекций. И это не повод для начала приема антибиотиков.
- Зеленые или желтые выделения из носа. Это нормальное явление при простуде. Это не ключ к инфекции носовых пазух.
- Зеленый или желтый кашель мокроты. Это нормальный процесс преодоления вирусного бронхита. Это не признак пневмонии.
- Высокая температура. Высокая температура (более 104 ° F или 40 ° C) может быть вызвана вирусом или бактериями.
Побочные эффекты антибиотиков
Все антибиотики имеют побочные эффекты.У некоторых детей, принимающих эти препараты, могут возникать побочные эффекты. Примеры: диарея, тошнота, рвота или сыпь. Жидкий стул возникает из-за того, что препарат убивает полезные бактерии в кишечнике. Если у вашего ребенка появилась сыпь, это может быть от препарата. Ваш врач должен решить, является ли сыпь аллергией или нет. Самый большой побочный эффект чрезмерного употребления — это устойчивость к антибиотикам. Это когда микробы больше не убиваются лекарством. Вот почему мы используем антибиотики только в том случае, если они действительно нужны вашему ребенку.
Назначение антибиотиков при вирусных инфекциях: что происходит?
Если у вашего ребенка вирус, антибиотик не избавит от лихорадки.Остальные симптомы не исчезнут. Препарат не вернет вашего ребенка в школу раньше. Это не вернет вас к работе быстрее. Если у вашего ребенка есть побочные эффекты от препарата, он почувствует себя хуже.
Что вы можете сделать
- Сохраните антибиотики от бактериальных инфекций, когда они действительно нужны вашему ребенку
- Не заставляйте врача принимать антибиотики
- Лечите симптомы простуды и кашля у вашего ребенка с помощью домашнего лечения, которое работает
- Хранить помните, что лихорадка борется с инфекцией.Он также укрепляет иммунную систему, чтобы предотвратить будущие инфекции.
Отделение неотложной помощи детям Сиэтла
Если болезнь или травма вашего ребенка опасны для жизни, звоните 911.
Последняя редакция: 17.03.2021
Последняя редакция: 11.03.2021
Copyright 2000-2021 Schmitt Pediatric Guidelines LLC.
.
 Пары агрессивных веществ раздражают слизистую оболочку бронхов. Ребенок страдает от их воздействия, если вы проживаете возле химического предприятия или в загруженном транспортом районе. Но чаще всего причина бытовая – это пассивное курение. Контакт с табачным дымом происходит дома, на улице, в школе или других общественных местах.
Пары агрессивных веществ раздражают слизистую оболочку бронхов. Ребенок страдает от их воздействия, если вы проживаете возле химического предприятия или в загруженном транспортом районе. Но чаще всего причина бытовая – это пассивное курение. Контакт с табачным дымом происходит дома, на улице, в школе или других общественных местах.
 С целью быстрой диагностики делают ПЦР – полимеразную цепную реакцию, которая позволяет выявить ДНК или РНК микроорганизма.
С целью быстрой диагностики делают ПЦР – полимеразную цепную реакцию, которая позволяет выявить ДНК или РНК микроорганизма. 5 и 5 мл
5 и 5 мл