Эффективное лечение Staphylococcus aureus — врачи, симптомы, диагностика на DocDoc.ru
Инфекционисты Москвы — последние отзывы
Кирилл Александрович хороший доктор. Он поставил диагноз и выписал мне заключение.
На модерации, 06 июня 2021
Вызывала невестке врача на дом, так как очень тяжелый диагноз. Хотелось бы, чтобы врач всё же приехал по-раньше, но нас предупреждали, что могут быть пробки и т.п. Претензий нет. У нас цирроз, а специалист по гепатиту, однако он сделал все рекомендации и написал нужные лекарства. Врач высококвалифицированный. Хорошо разбирается в этом деле. Всё доступно объяснил. Тактичный: говорил осторожно и обнадеживающе. Так же энергичный и имеет хорошее отношение.
Хотелось бы, чтобы врач всё же приехал по-раньше, но нас предупреждали, что могут быть пробки и т.п. Претензий нет. У нас цирроз, а специалист по гепатиту, однако он сделал все рекомендации и написал нужные лекарства. Врач высококвалифицированный. Хорошо разбирается в этом деле. Всё доступно объяснил. Тактичный: говорил осторожно и обнадеживающе. Так же энергичный и имеет хорошее отношение.
Галина, 03 июня 2021
Ольга, 27 апреля 2021
На модерации, 06 июня 2021
 Она дружелюбный врач, который интересуется проблемами.
Она дружелюбный врач, который интересуется проблемами.На модерации, 05 июня 2021
На модерации, 05 июня 2021
 Порекомендовала всё, что нужно сделать. После моей операции мы продолжим лечение с ней. Потрясающе высокий профессионализм, давно не видела таких врачей! Порекомендую всем на работе!
Порекомендовала всё, что нужно сделать. После моей операции мы продолжим лечение с ней. Потрясающе высокий профессионализм, давно не видела таких врачей! Порекомендую всем на работе!Лариса, 03 июня 2021
Любезный, терпеливый, внимательный и заботливый доктор. Она полностью нас обследовала, посмотрела анализы и все подробно расписала. Врач также очень хорошо нам помогла и дала направление.
Анушик, 03 июня 2021
Понимающий доктор, который разговаривает на одной волне с пациентами. Она меня проконсультировала, простым языком все объяснила и назначила анализы. Мне очень понравилась врач!
Она меня проконсультировала, простым языком все объяснила и назначила анализы. Мне очень понравилась врач!
Татьяна, 02 июня 2021
Доктор мне всё толково объяснил, рассказал, выписал рецепты на лечение и направил на сдачу анализов. Я очень довольна!
Александра, 02 июня 2021
Показать 10 отзывов из 1843v3_2011.
 p65
p65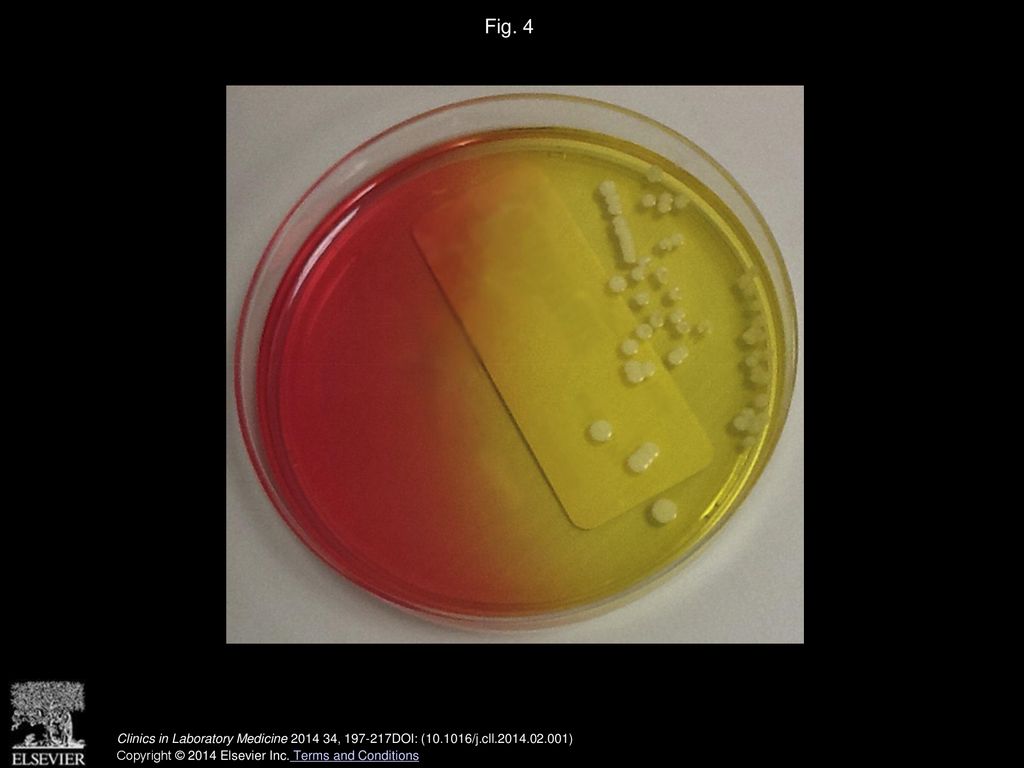
Метициллинрезистентный золотистый стафилококк (МРЗС) — Симптомы, диагностика и лечение
Метициллинрезистентные стафилококки (МРЗС) являются важной причиной инфекции как у здоровых людей во внебольничных условиях, так и у пациентов лечебно-профилактических учреждений.
Важно отличать образование колоний МРЗС от инфекции.
Вызванные МРЗС инфекции, связанные с оказанием медицинской помощи, и внебольничные инфекции МРЗС имеют существенные различия в чувствительности к антибиотикам.
Внебольничный МРЗС наиболее часто приводит к возникновению инфекций кожи и мягких тканей, а терапия чаще может проводиться с помощью антибиотиков для перорального приема.
Инфекции, вызванные МРЗС, связанные с оказанием медицинской помощи, как правило, требуют лечения с использованием внутривенного введения антибиотиков.
Изоляция больных с МРЗС с использованием мер предосторожности при контакте, может помочь предотвратить распространение инфекции.
МРЗС – это тип Staphylococcus aureus, который является резистентным к большинству бета-лактамных антибиотиков, антистафилококковым пенициллинам (например, к метициллину, оксациллину) и цефалоспоринам. Резистентность к метициллину определяется как минимальная ингибиторная концентрация оксациллина ≥4 мкг/мл.[1]Babel BS, Decker CF. Microbiology and laboratory diagnosis of MRSA. Dis Mon. 2008 Dec;54(12):769-73.
http://www.ncbi.nlm.nih.gov/pubmed/18996278?tool=bestpractice.com
Оксациллин принадлежит к тому же классу антибиотиков, что и метициллин, и поэтому в начале 90-х он был выбран в качестве агента для тестирования чувствительности S. aureus. Метициллин до сих пор используют для описания резистентности благодаря его исторической роли.[2]Centers for Disease Control and Prevention. Laboratory detection of oxacillin/methicillin-resistant Staphylococcus aureus. November 2010 [internet publication].
http://www.cdc.gov/HAI/settings/lab/lab_mrsa.html
МРЗС инфекции могут включать синдромы бактериемии, пневмонии, эндокардит, инфекции суставов и кожи или инфекции мягких тканей.
Резистентность к метициллину определяется как минимальная ингибиторная концентрация оксациллина ≥4 мкг/мл.[1]Babel BS, Decker CF. Microbiology and laboratory diagnosis of MRSA. Dis Mon. 2008 Dec;54(12):769-73.
http://www.ncbi.nlm.nih.gov/pubmed/18996278?tool=bestpractice.com
Оксациллин принадлежит к тому же классу антибиотиков, что и метициллин, и поэтому в начале 90-х он был выбран в качестве агента для тестирования чувствительности S. aureus. Метициллин до сих пор используют для описания резистентности благодаря его исторической роли.[2]Centers for Disease Control and Prevention. Laboratory detection of oxacillin/methicillin-resistant Staphylococcus aureus. November 2010 [internet publication].
http://www.cdc.gov/HAI/settings/lab/lab_mrsa.html
МРЗС инфекции могут включать синдромы бактериемии, пневмонии, эндокардит, инфекции суставов и кожи или инфекции мягких тканей.
Стафилококкоз у птицы — симптомы, схемы лечения и профилактика от NITA-FARM
Стафилококкоз птиц — остро или хронически протекающее инфекционное заболевание, сопровождающееся септицемией, артритами, реже везикулярным дерматитом.
Этиология. Возбудитель – Staphylococcus aureus — единственный вид стафилококков, рассматриваемый как безусловный патоген.
Эпизоотология. Восприимчивы все виды птиц. Источник возбудителя — больная птица, возбудитель передается при непосредственном контакте, через корма, воду, подстилку, трансовариально. Ворота инфекции — нарушения целостности кожи при травмах конечностей, сережек и гребешков, у только что вылупившихся цыплят — открытый пупок.
Клинические признаки. Инкубационный период короткий 48-72 часа.
Течение болезни острое и хроническое. Птица передвигается с трудом, хромает, взъерошенное оперение, свисание одного крыла или обоих. У цыплят до 10-дневного возраста воспаление пупка. При заражении в инкубаторе болезнь длится 2-6 дней и часто заканчивается гибелью. У перенесших острое заболевание — опухание суставов. У бройлеров — часто поражение лап в виде везикулярного или гангренозного дерматита, и пододерматиты (намины). При гангренозном дерматите — отек подкожной клетчатки и кровоизлияния на поверхности воспаленной кожи, перья выпадают. Часто осложняется Clostridium perfringens. У птенцов встречаются «вертолеты», также вызванные стафилококковым поражением зон роста костей.
При гангренозном дерматите — отек подкожной клетчатки и кровоизлияния на поверхности воспаленной кожи, перья выпадают. Часто осложняется Clostridium perfringens. У птенцов встречаются «вертолеты», также вызванные стафилококковым поражением зон роста костей.
Патоморфология. При остром течении – серозные или фибринозные полиартриты, массовые или единичные кровоизлияния на серозных оболочках, гиперемия и увеличение паренхиматозных органов, катаральное воспаление кишечника. При везикулярном и гангренозном дерматите конечностей пораженные ткани отечны, пропитаны серозно-фибринозной жидкостью. Желудочки сердца расширены, на эндокарде вблизи клапанов могут быть фибринозные наложения. В легких и почках — крупные абсцессы, содержащие фибринозные массы. При хроническом течении анкилоз суставов. Часто остеомиелит в виде локальных скоплений казеозного экссудата, поражаются проксимальный отдел большеберцовой кости и проксимальный отдел бедренной кости. При спондилите поражаются межпозвонковые диски грудопоясничного отдела позвоночника. У больных стафилококкозом часто отмечают некроз головки бедренной кости.
У больных стафилококкозом часто отмечают некроз головки бедренной кости.
Диагностика. На основании клинических признаков и патологоанатомических данных, а также результатов бактериологических исследований. Возбудителя выделяют из суставов конечностей – при локализованной форме и из внутренних органов – при септической. Дифференцируют от пастереллеза, пуллороза, перозиса и дерматита тиаминового происхождения.
Профилактика. Сводится к обеспечению высокой степени биобезопасности предприятия, ветеринарно-санитарных правил при сборе и дезинфекции инкубационных яиц, обеспечению нормального состояния подстилки, оптимальных параметров микроклимата в корпусах для выращивания птицы. Для лечения птицы применяют антибактериальные препараты, проверенные на активность против данного патогена. Наиболее эффективны амоксициллинсодержащие препараты (Амоксигард WS). Лечение эффективно на начальном этапе заболевания.
Против Staphylococcus aureus объявлена война
Микробный дисбаланс, или дисбиоз кожи, вызываемый Staphylococcus aureus, и атопический дерматит тесно взаимосвязаны.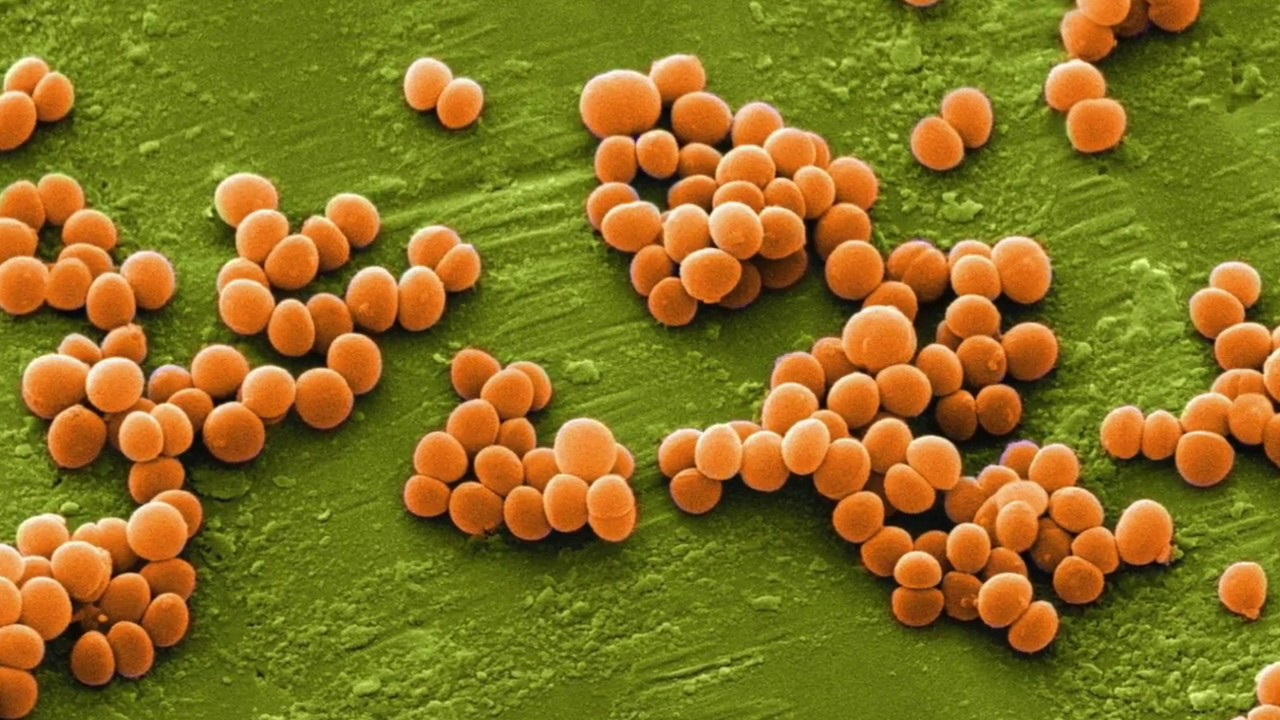 В настоящее время известно, что нарушение микробного равновесия у некоторых индивидов предшествует развитию заболевания. Это важное продвижение в изучении и даже в разработках новых лечебных стратегий.
В настоящее время известно, что нарушение микробного равновесия у некоторых индивидов предшествует развитию заболевания. Это важное продвижение в изучении и даже в разработках новых лечебных стратегий.
Еще с 1970-х годов установлено, что кожа больных, страдающих атопическим дерматитом, в большинстве случаев заселена Staphylococcus aureus (золотистый стафилококк). Это высокопатогенный возбудитель, и инфекции, вызванные им, часто коварны41. Золотистый стафилококк вызывает многочисленные нозокомиальные (госпитальные) инфекции, а также контактные и кишечные инфекции различной тяжести. В последнее время также было установлено, что инфекции протекают тяжелее там, где обнаруживают золотистый стафилококк определенных специфических штаммов и в большом количестве42. Между тем, благодаря техническому прогрессу в области генетики удалось подробно описать состав и выявить незначительное бактериальное разнообразие микрофлоры кожи у больных атопическим дерматитом43.:strip_icc()/s.glbimg.com/jo/g1/f/original/2011/06/03/bacteriasuperresistente2.jpg) Однако вплоть до недавнего времени не удавалось установить, является ли обилие Staphylococcus aureus причиной атопического дерматита или следствием дисбиоза микробиоты кожи
Однако вплоть до недавнего времени не удавалось установить, является ли обилие Staphylococcus aureus причиной атопического дерматита или следствием дисбиоза микробиоты кожи
В новом клиническом исследовании установлено, что колонизация Staphylococcus aureus предшествует началу заболевания у детей44. Это привело к тому, что бактерию стали считать причиной развития заболевания, что частично противоречит выводам другого современного исследования45 (в котором, между прочим, утверждается, что штаммы Staphylococcus также участвуют в развитии заболевания). Результатом двухлетнего исследования, в ходе которого изучались образцы кожи из области локтевого сгиба и подмышечной впадины (зоны типичного поражения) явилось следующее заключение. Первый вывод: у каждого четвертого ребенка развивался атопический дерматит. Второй вывод: начиная с возраста в три месяца, у детей с последующими проявлениями атопического дерматита заметно увеличивался удельный вес Staphylococcus aureus. С другой стороны, похоже, что некоторые бактерии, присутствующие у детей с атопическим дерматитом не в таком большом количестве, проявляли защитную функцию46.
С другой стороны, похоже, что некоторые бактерии, присутствующие у детей с атопическим дерматитом не в таком большом количестве, проявляли защитную функцию46.
Другие способы эрадикации
В неклинических экспериментах in vitro было показано, что Staphylococcus aureus может способствовать развитию заболевания у индивидов с генетической предрасположенностью за счет провоцирования токсической и/или воспалительной реакции в клетках кожи, подвергающихся воздействию со стороны микроорганизмов47. Экстраполируя полученные данные, исследователи предположили, что элиминация (то есть удаление) золотистого стафилококка может оказать благотворное влияние на лечение атопического дерматита. В настоящее время существуют относительно эффективные методики лечения, например, местные противомикробные средства, антибиотики, специальные средства для душа, но как ни парадоксально,до сих пор неизвестно, способствуют ли они элиминации Staphylococcus aureus и каково их влияние на микробиоту кожи. В связи с этим, первостепенной задачей является разработка методики трансплантации микробиоты кожи48, содержащей противодействующие Staphylococcus aureus микроорганизмы, схожей с трансплантацией фекальной микробиоты. Первые попытки увенчались успехом, значительно уменьшив колонизацию Staphylococcus aureus у пораженных индивидов. Можно быть уверенным, что дальнейшие попытки приведут к легализации этой многообещающей методики и последующему усовершенствованию терапии.
В связи с этим, первостепенной задачей является разработка методики трансплантации микробиоты кожи48, содержащей противодействующие Staphylococcus aureus микроорганизмы, схожей с трансплантацией фекальной микробиоты. Первые попытки увенчались успехом, значительно уменьшив колонизацию Staphylococcus aureus у пораженных индивидов. Можно быть уверенным, что дальнейшие попытки приведут к легализации этой многообещающей методики и последующему усовершенствованию терапии.
41 Leyden JJ, Marples RR, Kligman AM. Staphylococcus aureus in the lesions of atopic dermatitis. Br J Dermatol. 1974; 90:525–30
42 Byrd AL, Deming C, Cassidy SKB, Harrison OJ, Ng WI, Conlan S, et al. Staphylococcus aureus and Staphylococcus epidermidis strain diversity underlying pediatric atopic dermatitis. Sci Transl Med. 2017; 9(397):eaa14651
43 Kong HH, Oh J, Deming C, Conlan S, Grice EA, Beatson MA, et al. Temporal shifts in the skin microbiome associated with disease flares and treatment in children with atopic dermatitis. Genome Res. 2012; 22:850–9
Genome Res. 2012; 22:850–9
44 Williams MR, Gallo R. Evidence that Human Skin Microbiome Dysbiosis Promotes Atopic Dermatitis. J Invest Dermatol. 2017 December; 137(12): 2460–2461
45 Kennedy EA, Connolly J, Hourihane JO, Fallon PG, McLean WH, Murray D, et al. Skin microbiome before development of atopic dermatitis: early colonization with commensal staphylococci at 2 months is associated with a lower risk of atopic dermatitis at 1 year. J Allergy Clin Immunol. 2017; 139:166–72
46 Meylan P, Lang C, Mermoud S, Johannsen A, Norrenberg S, Hohl D, et al. Skin colonization by Staphylococcus aureus precedes the clinical diagnosis of atopic dermatitis in infancy. J Invest Dermatol. 2017; 137:2497–504
47 Nakamura Y, Oscherwitz J, Cease KB, Chan SM, MunozPlanillo R, Hasegawa M, et al. Staphylococcus delta-toxin induces allergic skin disease by activating mast cells. Nature. 2013; 503(7476):397–401
48 Nakatsuji T, Chen TH, Narala S, Chun KA, Two AM, Yun T, et al. Antimicrobials from human skin commensal bacteria protect against Staphylococcus aureus and are deficient in atopic dermatitis. Sci Transl Med. 2017; 9(378):eaah5680
Sci Transl Med. 2017; 9(378):eaah5680
Инфекции, вызываемые стафилококками
Стафилококки хорошо известны как возбудители гнойно-септических инфекций у человека и животных. Наряду с представителями семейства Enterobacteriaceae они занимают ведущее место в этиологии гнойных заболеваний. Род Staphylococcus включает в себя 35 различных видов. В зависимости от способности продуцировать коагулазу, фермент, вызывающий коагуляцию плазмы крови, они подразделяются на две группы: коагулазопозитивные и коагулазонегативные. Место обитания стафилококков – человек и теплокровных животные, внешняя среда. Локализация у человека – кожа и слизистые оболочки, толстый кишечник. Источником стафилококковых инфекций является больной человек или здоровый носитель. Пути передачи: воздушно-капельный, воздушно-пылевой, контактный, пищевой. Восприимчивость к инфекции зависит от общего состояния организма и возраста. Наиболее восприимчивы дети, особенно новорожденные и грудного возраста.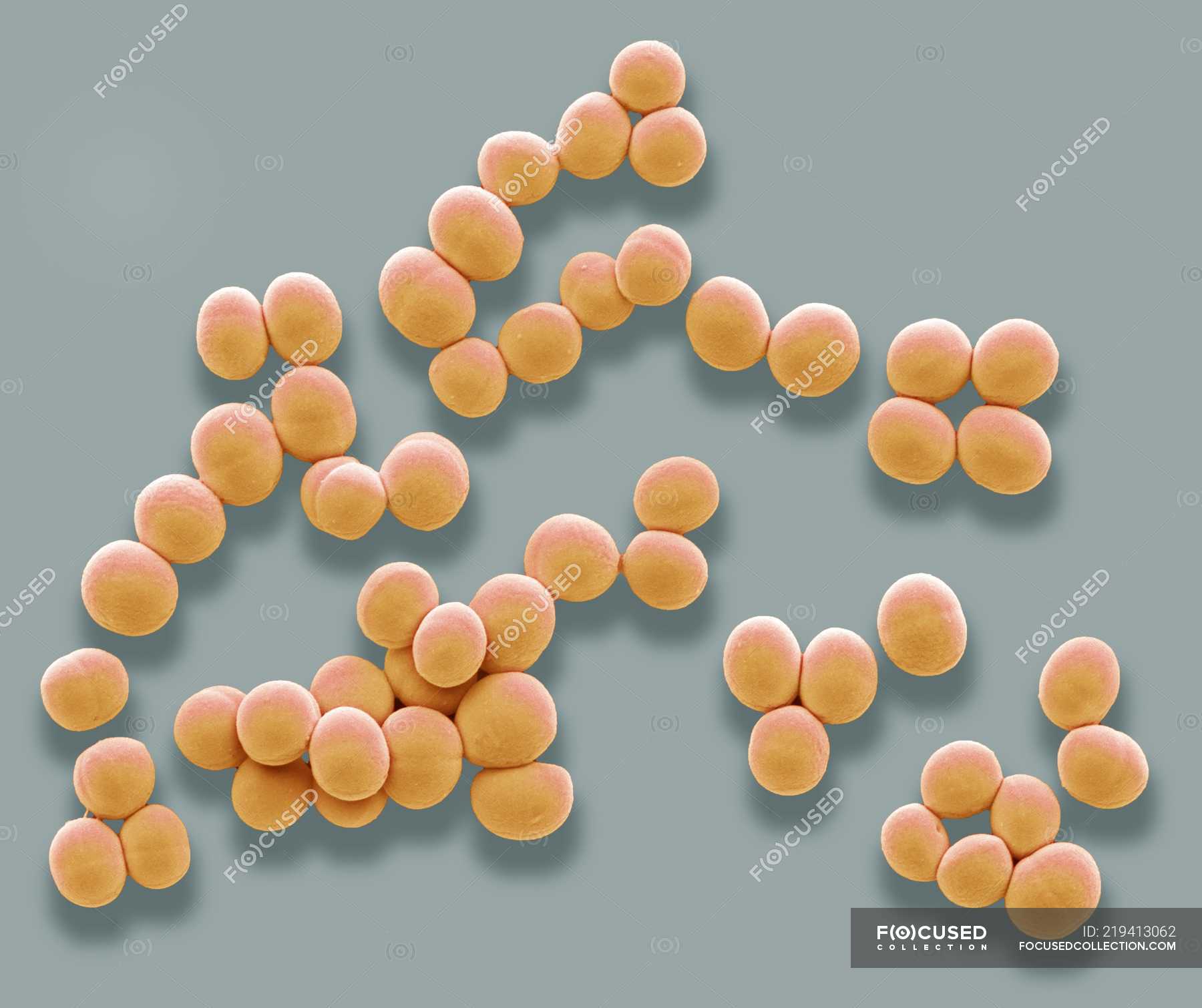 В норме способность стафилококка к инвазии и резистентность хозяина хорошо сбалансированы, поэтому инфекция не развивается, пока не создастся ситуация, когда встречаются высоковирулентный микроорганизм или макроорганизм со сниженной резистентностью.
В норме способность стафилококка к инвазии и резистентность хозяина хорошо сбалансированы, поэтому инфекция не развивается, пока не создастся ситуация, когда встречаются высоковирулентный микроорганизм или макроорганизм со сниженной резистентностью.
Наиболее известным представителем коагулазопозитивных стафилококков является S.aureus (золотистый стафилококк). Он встречается в передних отделах носовых ходов у 20–40% здоровых взрослых людей. Приблизительно у 1/3 населения он постоянно выделяется из носа, у 1/3 отмечается транзиторное носительство и 1/3 свободна от носительства. S.aureus наиболее часто выделяется при гнойной патологии, вызывает целый ряд заболеваний: фолликулиты, фурункулы и карбункулы, гидроадениты, маститы, раневые инфекции, бактериемии и эндокардиты, менингиты, перикардиты, легочные инфекции, остеомиелиты и артриты, гнойные миозиты, пищевые отравления, синдром токсического шока. Упомянутые заболевания обусловливаются факторами патогенности: капсульными полисахаридами, пептидогликанами и тейхоевыми кислотами, протеином А, ферментами, гемолизинами, токсинами (эксфолиативный, энтеротоксины от А до Е, Н и I), суперантигеном, который принадлежит к энтеротоксину (TSST-1), вызывающему токсический шок синдром.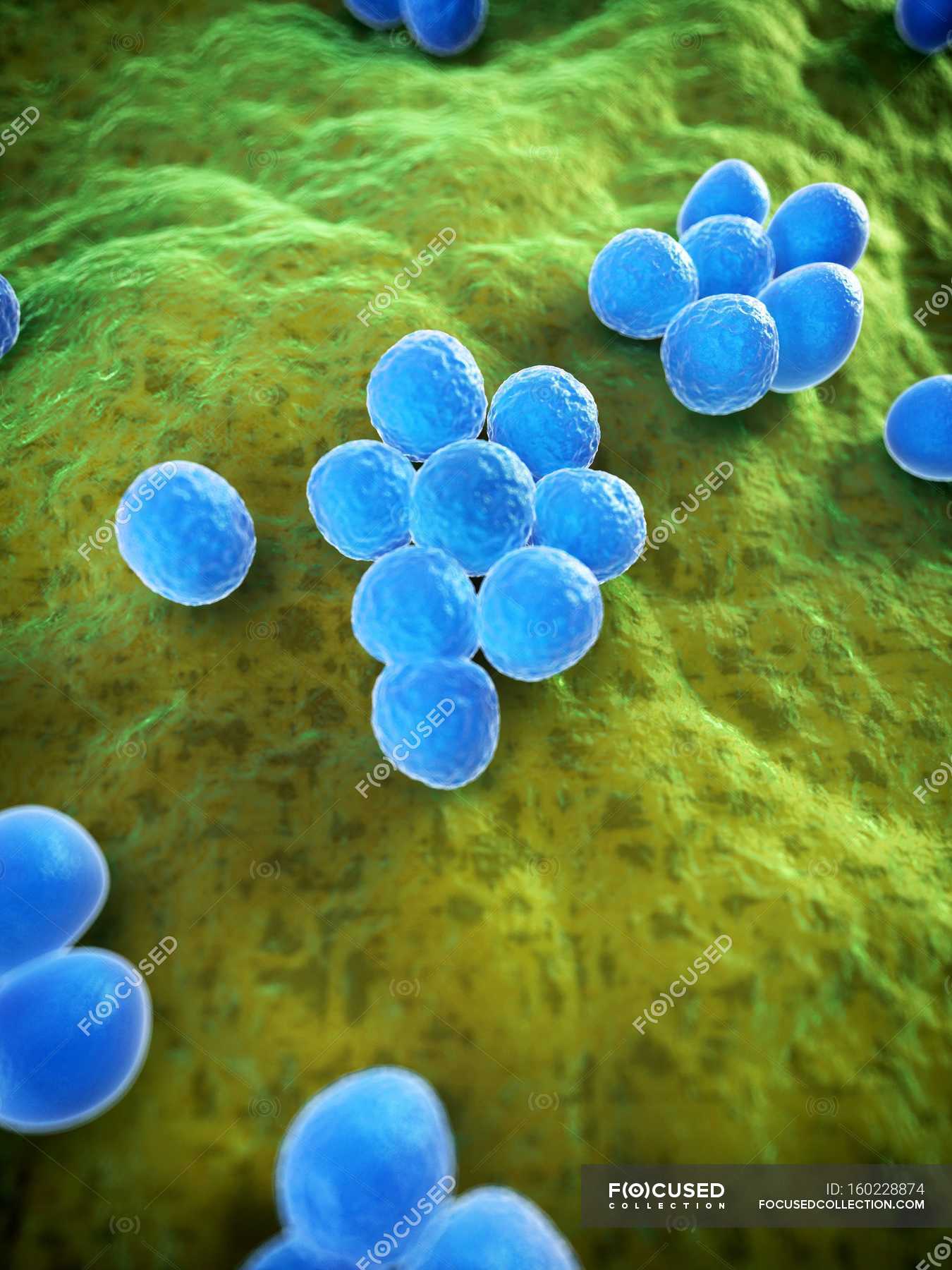
Все остальные коагулазопозитивные стафилококки выделяются в основном от животных и редко от человека, но в отдельных случаях могут вызывать у человека гнойно-воспалительные заболевания.
Среди коагулазонегативных стафилококков наиболее значимы в патологии человека S.epidermidis и S.saprophyticus. Они могут вызывать инфекции мочевыводящих путей, остеомиелиты, бактериемии, инфекции у новорожденных детей в палатах интенсивной терапии, заболевания глаз, кожные инфекции, поражают клапаны сердца, вызывают гнойные воспаления при операции по замене сердечных клапанов на искусственные, при шунтирование органов, использование внутривенных катетеров, катетеров при гемодиализе, а также при ангиопластике.
В настоящее время микроорганизмы рода Staphylococcus играют лидирующую роль среди возбудителей внутрибольничных инфекций. До определенного времени пенициллин был основным препаратом выбора при лечении тяжелых гнойных инфекций вызываемых S. aureus. Затем стали появляться штаммы устойчивые к этому антибиотику. Оказалось, что устойчивость к пенициллину была обусловлена продукцией фермента .-лактамазы разрушающей β-лактамное кольцо в молекуле пенициллина. В настоящее время около 80% изолируемых штаммов S.aureus синтезируют β-лактамазу. Вместо пенициллина в случае выделения пенициллин резистентных штаммов применяют полусинтетические пенициллины устойчивые к β-лактамазе. Но с 80-х годов начинают выделяться штаммы S.aureus устойчивые и к этой группе антибиотиков в частности к оксациллину и метициллину. Устойчивость таких штаммов связана с продукцией пенициллин связывающего белка (PBP 2а), синтез которого в свою очередь связан с приобретением стафилококками хромосомного гена mecA. Штаммы S.aureus, обладающие этим геном проявляют устойчивость ко всем β-лактамным антибиотикам включая цефалоспорины. S.aureus с упомянутым механизмом устойчивости присваивается термин метициллин- резистентные штаммы.
aureus. Затем стали появляться штаммы устойчивые к этому антибиотику. Оказалось, что устойчивость к пенициллину была обусловлена продукцией фермента .-лактамазы разрушающей β-лактамное кольцо в молекуле пенициллина. В настоящее время около 80% изолируемых штаммов S.aureus синтезируют β-лактамазу. Вместо пенициллина в случае выделения пенициллин резистентных штаммов применяют полусинтетические пенициллины устойчивые к β-лактамазе. Но с 80-х годов начинают выделяться штаммы S.aureus устойчивые и к этой группе антибиотиков в частности к оксациллину и метициллину. Устойчивость таких штаммов связана с продукцией пенициллин связывающего белка (PBP 2а), синтез которого в свою очередь связан с приобретением стафилококками хромосомного гена mecA. Штаммы S.aureus, обладающие этим геном проявляют устойчивость ко всем β-лактамным антибиотикам включая цефалоспорины. S.aureus с упомянутым механизмом устойчивости присваивается термин метициллин- резистентные штаммы. В ряде случаев устойчивость к полусинтетическим пенициллинам может быть обусловлена гиперпродукцией β-лактамаз. В этом случае устойчивость к полусинтетическим пенициллинам при определении ее в лабораторных условиях характеризуется как умеренная. Метициллин-резистентные штаммы S.aureus часто проявляют устойчивость к другим антибиотикам в частности к эритромицину и клиндамицину. В связи с их распространением в ряде зарубежных стран в качестве антибиотиков выбора начинают использовать ванкомицин и тейкопланин. Но уже в 1996 году появляются первые сообщения о выделении штаммов S.aureus с умеренной устойчивостью к ванкомицину (MIC=8 мкг/ мл.), а с 2002 г. штаммов с высокой устойчивостью (МIC>32 мкг/мл.). Метициллин резистентные штаммы выявляются также среди S.epidermidis, а ванкомицрезистентные среди S.haemolyticus.
В ряде случаев устойчивость к полусинтетическим пенициллинам может быть обусловлена гиперпродукцией β-лактамаз. В этом случае устойчивость к полусинтетическим пенициллинам при определении ее в лабораторных условиях характеризуется как умеренная. Метициллин-резистентные штаммы S.aureus часто проявляют устойчивость к другим антибиотикам в частности к эритромицину и клиндамицину. В связи с их распространением в ряде зарубежных стран в качестве антибиотиков выбора начинают использовать ванкомицин и тейкопланин. Но уже в 1996 году появляются первые сообщения о выделении штаммов S.aureus с умеренной устойчивостью к ванкомицину (MIC=8 мкг/ мл.), а с 2002 г. штаммов с высокой устойчивостью (МIC>32 мкг/мл.). Метициллин резистентные штаммы выявляются также среди S.epidermidis, а ванкомицрезистентные среди S.haemolyticus.
 В отличие от антибиотиков они не подавляют рост нормальной симбиотической микрофлоры человека и не приводят к дисбактериозам. Тем не менее, нужно имеет в виду, что фаги также вызывают развитие резистентности у стафилококков, поэтому перед их использованием, как и перед применением антибиотиков, необходимо проверять чувствительность к ним у изолируемых штаммах стафилококков.
В отличие от антибиотиков они не подавляют рост нормальной симбиотической микрофлоры человека и не приводят к дисбактериозам. Тем не менее, нужно имеет в виду, что фаги также вызывают развитие резистентности у стафилококков, поэтому перед их использованием, как и перед применением антибиотиков, необходимо проверять чувствительность к ним у изолируемых штаммах стафилококков.Показания к обследованию. Признаки гнойно-септической инфекции, обследование медицинского персонала на носительство.
Материал для исследований. Кровь, СМЖ, гной, раневое отделяемое, грудное молоко, мазки из носа; смывы c медицинского оборудования и инвентаря.
Этиологическая лабораторная диагностика включает выделение возбудителя на питательных средах, выявление его ДНК.
Сравнительная характеристика методов лабораторной диагностики, показания к применению различных лабораторных исследований. Техника выделения возбудителя в настоящее время хорошо отработана. Микроорганизмы довольно устойчивы к факторам внешней среды, поэтому если отобранный биологический материал невозможно сразу использовать для исследования, можно воспользоваться специальными контейнерами и траспортными средами. Подробнее техника отбора и транспортировки биологического материала в клинико- диагностическую лабораторию описана в разделе преаналитические этапы исследования. Для выделения возбудителя, как правило, достаточно 3–4 дня. Исключением является выделение стафилококков из крови. В этом случае успех техники во многом будет зависеть от правильного выбора времени для отбора крови и присутствия в крови пациентов антибактериальных препаратов.
Микроорганизмы довольно устойчивы к факторам внешней среды, поэтому если отобранный биологический материал невозможно сразу использовать для исследования, можно воспользоваться специальными контейнерами и траспортными средами. Подробнее техника отбора и транспортировки биологического материала в клинико- диагностическую лабораторию описана в разделе преаналитические этапы исследования. Для выделения возбудителя, как правило, достаточно 3–4 дня. Исключением является выделение стафилококков из крови. В этом случае успех техники во многом будет зависеть от правильного выбора времени для отбора крови и присутствия в крови пациентов антибактериальных препаратов.
 aureus и метициллинрезистентных коагулазонегативных стафилококков. Данное исследование отличается простотой и воспроизводимостью, что позволяет оптимизировать эпидемиологический надзор за распространением метициллинрезистентных штаммов, значительно снизив время и трудоемкость исследования. Однако, выявление специфического фрагмента ДНК S.aureus, S.epidermidis, S.haemolyticus, S.saprophyticus методом ПЦР не позволяет выявить жизнеспособные микроорганизмы, а также определить у них чувствительность к антибиотикам.
aureus и метициллинрезистентных коагулазонегативных стафилококков. Данное исследование отличается простотой и воспроизводимостью, что позволяет оптимизировать эпидемиологический надзор за распространением метициллинрезистентных штаммов, значительно снизив время и трудоемкость исследования. Однако, выявление специфического фрагмента ДНК S.aureus, S.epidermidis, S.haemolyticus, S.saprophyticus методом ПЦР не позволяет выявить жизнеспособные микроорганизмы, а также определить у них чувствительность к антибиотикам.Особенности интерпретации результатов лабораторных исследований. При исследовании стерильного биологического материала (кровь, СМЖ) клиническое значение имеет обнаружение S.aureus в любых концентрациях. В нестерильном биологическом материале клиническое значение имеют только высокие концентрации S.aureus, означающие его ведущую роль в воспалительном процессе.
Сравнительная оценка эффективности антибактериальной терапии MRSA – ассоциированной инфекции мягких тканей у тяжелообожженных пациентов в критическом состоянии
В.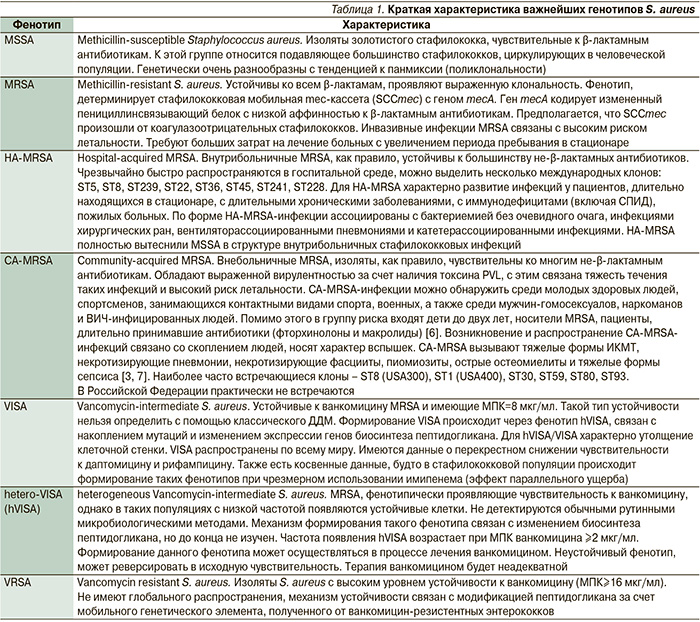 В. КУЛАБУХОВ, к.м.н., доцент, А.Н. КУДРЯВЦЕВ, А.Г. ЧИЖОВ, Институт хирургии им. А.В. Вишневского Минздрава России, Москва
В. КУЛАБУХОВ, к.м.н., доцент, А.Н. КУДРЯВЦЕВ, А.Г. ЧИЖОВ, Институт хирургии им. А.В. Вишневского Минздрава России, Москва
Отделения интенсивной терапии в настоящее время могут рассматриваться как зона высокого риска развития нозокомиальных инфекций. Грамположительная микрофлора, особенно в специализированных хирургических отделениях, может играть одну из ведущих ролей в развитие инфекционных осложнений данной группы, определяющих степень тяжести состояния пациентов, длительность пребывания в отделении интенсивной терапии и внутрибольничную летальность [13].
ВВЕДЕНИЕ
Золотистый стафилококк (Staphylococcus aureus) второй по значимости возбудитель, ответственный за инфекционные осложнения, связанные с фактом оказания медицинской помощи. Данный возбудитель ассоциируется с 30% случаев инфекции в зоне хирургического вмешательства, выделяется у 24% больных с вентилятор-ассоциированной пневмонией [7]. По данным мультицентрового исследования OASIS (2011 г. ), в северной и центральной Италии 44% случаев бактериемии ассоциировались с грамположительной флорой, из них 35,8% с различными штаммами золотистого стафилококка [12]. Наибольшим клиническим значением обладают штаммы S.aureus, обладающие лекарственной устойчивостью к полусинтетическим пенициллинам (MRSA). Они выделяются в 49—65% всех случаев всех нозокомиальных стафилококковых инфекций. По данным на 2007 г., в США было зарегистрировано 94 360 случаев инфекций, ассоциированных с MRSA. В течение года наблюдения было зафиксировано 18 650 смертей, определенных данным инфекционным осложнением [10]. В отношении форм локализации инфекционного заболевания, вызванного MRSA, наиболее часто наблюдают нозокомиальную пневмонию (34%), инфекцию мягких тканей (27%) и инфекцию кровотока (18%) [8]. В случае развития инфекции мягких тканей в зонах ожогового поражения, по данным С.В. Яковлева, 2013, S.аureus является наиболее частым возбудителем — до 40,4% случаев, у 61,7% больных выделяются MRSA-штаммы [2].
), в северной и центральной Италии 44% случаев бактериемии ассоциировались с грамположительной флорой, из них 35,8% с различными штаммами золотистого стафилококка [12]. Наибольшим клиническим значением обладают штаммы S.aureus, обладающие лекарственной устойчивостью к полусинтетическим пенициллинам (MRSA). Они выделяются в 49—65% всех случаев всех нозокомиальных стафилококковых инфекций. По данным на 2007 г., в США было зарегистрировано 94 360 случаев инфекций, ассоциированных с MRSA. В течение года наблюдения было зафиксировано 18 650 смертей, определенных данным инфекционным осложнением [10]. В отношении форм локализации инфекционного заболевания, вызванного MRSA, наиболее часто наблюдают нозокомиальную пневмонию (34%), инфекцию мягких тканей (27%) и инфекцию кровотока (18%) [8]. В случае развития инфекции мягких тканей в зонах ожогового поражения, по данным С.В. Яковлева, 2013, S.аureus является наиболее частым возбудителем — до 40,4% случаев, у 61,7% больных выделяются MRSA-штаммы [2].
Золотистый стафилококк, в т. ч. штаммы MRSA, могут бессимптомно колонизировать кожные покровы как больных, в случае обращения их за медицинской помощью, так и медицинского персонала, эту помощь осуществляющего. Наиболее важными локусами человеческого тела в отношении колонизации золотистым стафилококком являются кожные покровы и слизистые преддверия носовой полости, кожа аксиллярных впадин и промежности. Период колонизации MRSA может протекать достаточно долгое время, в среднем 56 дней, до момента развития инфекции [8]. В этот период человек, колонизированный MRSA, может представлять серьезную эпидемиологическую опасность, распространяя метициллин-резистентные штаммы S.aureus в окружающей среде. По данным S.S. Huang, 2011 [8], у 24% пациентов, перенесших инфекционное заболевание, связанное с MRSA, в течение года наблюдения отмечался рецидив инфекции, причем у половины заболевших в первые три месяца после выписки. Особого внимания требуют приводимые данные о летальности пациентов с идентифицированной MRSA колонизацией. Авторы указывают, что в течение одного года после обнаружения MRSA умерли 46% больных этой группы. Более чем одна треть всех смертельных случаев (35%, 94 из 269 пациентов) была обусловлена непосредственно MRSA-инфекцией. Примечательно, что четкой зависимости летальности от длительности периода MRSA-колонизации найдено не было, как не была обнаружена и связь со сроками госпитализации у этих больных.
Авторы указывают, что в течение одного года после обнаружения MRSA умерли 46% больных этой группы. Более чем одна треть всех смертельных случаев (35%, 94 из 269 пациентов) была обусловлена непосредственно MRSA-инфекцией. Примечательно, что четкой зависимости летальности от длительности периода MRSA-колонизации найдено не было, как не была обнаружена и связь со сроками госпитализации у этих больных.
Также необходимо отметить, что контактный механизм распространения MRSA является основным в условиях стационаров. Он реализуется как непосредственно при прямых контактах между больным или носителем и восприимчивым человеком, так и контактно-бытовым путем, через загрязнение предметов окружающей среды. В редких случаях возможна передача инфекции гемоконтактным путем через контаминированное медицинское оборудование при проведении лечебно-диагностических манипуляций. Факты развития устойчивости к полусинтетическим пенициллинам в течение времени носительства S.aureus очень редки.
Подобные особенности MRSA-инфекции объясняют повышенное внимание к этой проблеме большого числа клиницистов. Это приводит к созданию программ по предотвращению распространения метициллин-резистентных штаммов S.aureus в лечебно-профилактических учреждениях и в «домашних очагах», где происходит оказание регулярной медицинской помощи больным в амбулаторных условиях или куда выписывается пациент, колонизированный MRSA. Основой данных программ являются профилактические меры, направленные на блокирование путей передачи MRSA. Базовые мероприятия данных программ не являются MRSA-специфичными и направлены на эффективное предотвращение всех форм нозокомиальных инфекций. В отношении узконаправленных мероприятий необходимо выделить раннее распознавание и изоляцию носителей MRSA, деколонизационные стратегии, мотивацию настороженности персонала в отношении MRSA-инфекции, совершенствование микробиологической диагностики, эпидемиологическое наблюдение за носителями MRSA и т. д. Особо следует обратить внимание на раннюю этиотропную терапию в случае развития острой формы MRSA-инфекции. С учетом вышеизложенных обстоятельств к ее задачам следует отнести и эффективную эрадикацию возбудителя из организма больного, предотвращающую формирование MRSA-носительства у реконвалесцентов.
Это приводит к созданию программ по предотвращению распространения метициллин-резистентных штаммов S.aureus в лечебно-профилактических учреждениях и в «домашних очагах», где происходит оказание регулярной медицинской помощи больным в амбулаторных условиях или куда выписывается пациент, колонизированный MRSA. Основой данных программ являются профилактические меры, направленные на блокирование путей передачи MRSA. Базовые мероприятия данных программ не являются MRSA-специфичными и направлены на эффективное предотвращение всех форм нозокомиальных инфекций. В отношении узконаправленных мероприятий необходимо выделить раннее распознавание и изоляцию носителей MRSA, деколонизационные стратегии, мотивацию настороженности персонала в отношении MRSA-инфекции, совершенствование микробиологической диагностики, эпидемиологическое наблюдение за носителями MRSA и т. д. Особо следует обратить внимание на раннюю этиотропную терапию в случае развития острой формы MRSA-инфекции. С учетом вышеизложенных обстоятельств к ее задачам следует отнести и эффективную эрадикацию возбудителя из организма больного, предотвращающую формирование MRSA-носительства у реконвалесцентов.
В последние годы в качестве основного этиотропного агента для лечения MRSA-инфекции, использовали ванкомицин [3]. Существенными особенностями применения данного антимикробного агента являются: преимущественно бактериостатическое действие (весьма низкая бактерицидная активность может быть достижима при применении высоких доз препарата), отсутствие активности в структурированных микробных сообществах, значительные трудности в подборе оптимальной дозы, плохая переносимость и высокий риск побочных реакций при достижении эффективных для терапии дозировок. Данные обстоятельства затрудняют эрадикацию MRSA при лечении ванкомицином [4], что гипотетически предполагает формирование носительства MRSA у перенесших инфекцию. Трудности в подборе оптимальных дозировок ванкомицина связаны с феноменом «ползущей» минимальной ингибирующей концентрации («creep» MIC). Сущность данного феномена состоит в том, что в ходе применения антибиотика в субоптимальных дозах чувствительность MRSA к нему уменьшается, что требует увеличения количества вводимого препарата. Известным фактом является и то, что при росте МИК ванкомицина для MRSA в интервале между 1 и 2 мкг/мл повышение дозировок препарата может привести к увеличению его концентрации в сыворотке крови более 20,8 мг/л. Это значительно усиливает нефротоксичные эффекты антибиотика [9]. Кроме того, M.N. Jeffers с сотрудниками (2007) отмечали: длительная терапия ванкомицином даже в умеренных концентрациях провоцирует развитие почечной дисфункции. Таким образом, реальность сегодняшнего дня заставляет включать реконвалесцентов MRSA-инфекции, получавших ванкомицин, в группу риска MRSA колонизации. Особенности же фармакодинамического профиля препарата, низкая безопасность и плохая переносимость его в эффективных клинических дозировках не позволяют использовать ванкомицин в оптимальной концентрации, способной предотвратить данный феномен.
Известным фактом является и то, что при росте МИК ванкомицина для MRSA в интервале между 1 и 2 мкг/мл повышение дозировок препарата может привести к увеличению его концентрации в сыворотке крови более 20,8 мг/л. Это значительно усиливает нефротоксичные эффекты антибиотика [9]. Кроме того, M.N. Jeffers с сотрудниками (2007) отмечали: длительная терапия ванкомицином даже в умеренных концентрациях провоцирует развитие почечной дисфункции. Таким образом, реальность сегодняшнего дня заставляет включать реконвалесцентов MRSA-инфекции, получавших ванкомицин, в группу риска MRSA колонизации. Особенности же фармакодинамического профиля препарата, низкая безопасность и плохая переносимость его в эффективных клинических дозировках не позволяют использовать ванкомицин в оптимальной концентрации, способной предотвратить данный феномен.
Указанные выше обстоятельства определяют интерес клиницистов и исследователей к другим препаратам, обладающим активностью против MRSA. В настоящее время наибольшую распространенность получили линезолид, тигециклин и даптомицин. Из обозначенных ЛС бактерицидным эффектом в терапевтически доступных дозировках обладает только даптомицин. К преимуществам антибиотика относится способность проникать в структурированные микробные сообщества, такие как биопленки, создавать эффективную концентрацию в инфицированных тканях. Механизм антибактериального действия связан с нарушением целостности клеточной стенки бактерий, что приводит к их быстрой гибели. Скорость эрадикации MRSA зависит от применяемой дозы даптомицина (concentration-dependent killing). В настоящее время наивышая доза даптомицина лимитирована 6 мг/кг, но в клиническом эксперименте и более высокие дозировки (10—12 мг/кг) имели адекватный профиль безопасности, значительно сокращая сроки эрадикации MRSA [6]. Как и для ванкомицина, для даптомицина в исследовательской практике был описан феномен «ползущей» минимальной ингибирующей концентрации («creep» MIC) [3], однако развитие его легко преодолевается ввиду значительного терапевтического резерва, связанного с возможностью безопасного увеличения дозировки препарата до уровня удовлетворительной бактерицидной активности.
Из обозначенных ЛС бактерицидным эффектом в терапевтически доступных дозировках обладает только даптомицин. К преимуществам антибиотика относится способность проникать в структурированные микробные сообщества, такие как биопленки, создавать эффективную концентрацию в инфицированных тканях. Механизм антибактериального действия связан с нарушением целостности клеточной стенки бактерий, что приводит к их быстрой гибели. Скорость эрадикации MRSA зависит от применяемой дозы даптомицина (concentration-dependent killing). В настоящее время наивышая доза даптомицина лимитирована 6 мг/кг, но в клиническом эксперименте и более высокие дозировки (10—12 мг/кг) имели адекватный профиль безопасности, значительно сокращая сроки эрадикации MRSA [6]. Как и для ванкомицина, для даптомицина в исследовательской практике был описан феномен «ползущей» минимальной ингибирующей концентрации («creep» MIC) [3], однако развитие его легко преодолевается ввиду значительного терапевтического резерва, связанного с возможностью безопасного увеличения дозировки препарата до уровня удовлетворительной бактерицидной активности. По данным P. Lagace-Wiens с коллегами (2011), клинического подтверждения феномену «creep» MIC для даптомицина найдено не было [11]. Единичные случаи резистентности MRSA к даптомицину были связаны с предшествующим применением других антибиотиков с анти-MRSA активностью или в ходе длительного применения препарата в несоответствующей дозе [5]. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (Food and Drug Administration, FDA) одобрило применение даптомицина для лечения инфекций кожи и мягких тканей, инфекций кровотока с бактериемией и правосторонним эндокардитом. Федеральная служба по надзору в сфере здравоохранения и социального развития (Росздравнадзор) РФ от в сообщении от 4.10.2010 настоятельно рекомендует четко придерживаться данных показаний к применению даптомицина из-за риска развития ряда нежелательных явлений (обратимой эозинофильной пневмонии).
По данным P. Lagace-Wiens с коллегами (2011), клинического подтверждения феномену «creep» MIC для даптомицина найдено не было [11]. Единичные случаи резистентности MRSA к даптомицину были связаны с предшествующим применением других антибиотиков с анти-MRSA активностью или в ходе длительного применения препарата в несоответствующей дозе [5]. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (Food and Drug Administration, FDA) одобрило применение даптомицина для лечения инфекций кожи и мягких тканей, инфекций кровотока с бактериемией и правосторонним эндокардитом. Федеральная служба по надзору в сфере здравоохранения и социального развития (Росздравнадзор) РФ от в сообщении от 4.10.2010 настоятельно рекомендует четко придерживаться данных показаний к применению даптомицина из-за риска развития ряда нежелательных явлений (обратимой эозинофильной пневмонии).
Таким образом, представляется рациональным включение даптомицина в эмпирическую терапию инфекции мягких тканей в зонах ожогового поражения в качестве препарата выбора, способствующего быстрой эрадикации грамположительных возбудителей (в т. ч. MRSA) и позволяющего предотвратить их дальнейшее носительство у реконвалесцентов.
ч. MRSA) и позволяющего предотвратить их дальнейшее носительство у реконвалесцентов.
С целью анализа скорости полной эрадикации возбудителя при применении различных антибактериальных средств с анти-MRSA активностью для лечения инвазивной раневой инфекции зон ожогового поражения нами было предпринято обсервационное ретроспективное когортное исследование. В ходе него были проанализированы истории болезни пациентов с тяжелой ожоговой травмой (индекс Франка более 60 единиц), поступивших в отделение реанимации Отдела термических поражений Института хирургии им. А.В. Вишневского в период с ноября 2013 г. по февраль 2014 г. на 7—10-й дни после получения травмы. Критерием включения в исследование служило наличие у пациентов инвазивной раневой инфекции [1], ассоциированной с MRSA, в комплексной терапии которой использовали антибактериальные препараты с анти-MRSA активностью: Кубицин (Cubicin®, Novartis Pharmaceuticals UK, Ltd., Великобритания) активное вещество: даптомицин (daptomycin) и Ванкорус® (Vancorus, ОАО «СИНТЕЗ», Россия) активное вещество: ванкомицин (vancomycin).
Критериями исключения были наличие аллергических реакций на данные лекарственные средства, возраст пациента до 18 лет.
МАТЕРИАЛЫ И МЕТОДЫ
Поводом для перевода в специализированный ОРИТ ожогового центра Института хирургии им. А.В. Вишневского у всех пациентов было получение тяжелой термической травмы (индекс Франка более 60 единиц) с развитием ожоговой болезни в стадии септикотоксемии, осложненной течением инвазивной раневой инфекции в зонах ожогового поражения.
Всем пациентам (табл. 1), 12 человек (3 женщины, 9 мужчин, средний возраст 42 ± 17,3 года), на момент перевода в ОРИТ проводилась комплексная терапия, предусмотренная рекомендациями American Burn Association (ABA). Во всех наблюдаемых случаях имела место пролонгированная раневая инфекция в зонах ожогового поражения, этиология которой была определена ретроспективно.
Всем поступившим пациентам с целью ограничения патогенной нагрузки из областей раневой ожоговой инфекции были выполнены санирующие оперативные вмешательства. В послеоперационном периоде была продолжена многокомпонентная интенсивная терапия в условиях отделения реанимации. Все участвующие в исследовании получали необходимую терапию, основными составляющими которой были искусственная вентиляция легких, инфузионная и трансфузионная терапия, применение антикоагулянтов. В течение пребывания в ОРИТ больным проводилось всестороннее клиническое, лабораторное и инструментальное обследование с регистрацией клинических, биохимических показателей крови, гемостазиограммы; определением кислотно-щелочных показателей, газового состава артериальной и венозной крови.
В послеоперационном периоде была продолжена многокомпонентная интенсивная терапия в условиях отделения реанимации. Все участвующие в исследовании получали необходимую терапию, основными составляющими которой были искусственная вентиляция легких, инфузионная и трансфузионная терапия, применение антикоагулянтов. В течение пребывания в ОРИТ больным проводилось всестороннее клиническое, лабораторное и инструментальное обследование с регистрацией клинических, биохимических показателей крови, гемостазиограммы; определением кислотно-щелочных показателей, газового состава артериальной и венозной крови.
До начала антибактериальной терапии у пациентов были выполнены микробиологические исследования раневого отделяемого. В дальнейшем микробиологический мониторинг осуществляли путем культурального бактериологического анализа отделяемого ран каждые 48 ч, до стабилизации состояния и перевода из отделения. Микробиологические исследования выполнялись в соответствии со стандартами Clinical and Laboratory Standards Institute (CLSI).
Назначение антибактериальных препаратов проводилось по деэскалационной схеме в течение первых 60 мин пребывания в отделении с учетом предшествующего стационарного лечения и предшествующих данных микробиологических исследований. В качестве этиотропной терапии предполагаемой на момент поступления MRSA-инфекции использовали ванкомицин как традиционный антибактериальный агент и даптомицин, ставший доступным с момента включения его в терапевтическую практику Института хирургии. С учетом данных обстоятельств были отобраны 6 пациентов (группа Vanco), получавших ВАНКОРУС® (VANCORUS) 1 г через 12 ч в виде медленной в/в инфузии со скоростью не более 10 мг/мин в течение не менее 60 мин, и 6 пациентов (группа Cubic), которым применяли КУБИЦИН (CUBICIN®) 6 мг/кг препарата 1 раз в сутки, вводя путем в/в инфузии в течение 30 мин.
Критериями эффективности проводимой терапии являлись сроки эрадикации MRSA по данным микробиологического исследования раневого отделяемого.
Статистическая обработка. Для анализа данных использовали базу данных Microsoft Access и архивные материалы. Статистическую обработку проводили с помощью системы STATISTICA 7.0 (StatSoft, США). Выборки в исследовании сравнивали относительно средних значений, используя непараметрическую альтернативу t-тесту для независимых групп (учитывая общее количество наблюдений в исследовании n < 100) U — критерий Манна — Уитни.
Для анализа данных использовали базу данных Microsoft Access и архивные материалы. Статистическую обработку проводили с помощью системы STATISTICA 7.0 (StatSoft, США). Выборки в исследовании сравнивали относительно средних значений, используя непараметрическую альтернативу t-тесту для независимых групп (учитывая общее количество наблюдений в исследовании n < 100) U — критерий Манна — Уитни.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
У пациентов на момент подключения к монитору имело место течение ожоговой болезни в фазе септикотоксемии, осложненной инвазивной раневой инфекцией в зонах ожогового поражения. У всех больных в исследовании были получены положительные результаты микробиологического анализа раневого отделяемого (табл. 2). Были обнаружены микробные ассоциации грамотрицательной флоры с метициллин-резистентным стафилококком. Фекальный энтерококк был выделен в двух случаях, у одного пациента были выделены грибы Candida albicans.
Применение указанных антибактериальных средств не сопровождалось нежелательными явлениями в обеих группах пациентов. В ходе терапии у пациентов не было зафиксировано признаков почечной недостаточности.
В ходе терапии у пациентов не было зафиксировано признаков почечной недостаточности.
Длительность специфичной анти-MRSA терапии в группе Vanco была больше, чем в группе Cubic (табл. 3). Несмотря на это, из раневого отделяемого пациентов группы Vanco MRSA удавалось выделять в среднем более 20 дней наблюдения, что указывало на достоверно более длительную персистенцию метициллин-резистентных штаммов S.aureus, по сравнению с группой Cubic.
У двух пациентов группы Vanco MRSA продолжал выделяться с поверхности остаточных ожоговых дефектов кожи после купирования клинических признаков инвазивной раневой инфекции и перевода пациента из отделения реанимации. MRSA определяли в концентрации менее 105 КОЕ. Это рассматривалось как сохраняющаяся колонизация, что предрасполагало к формированию носительства MRSA в восстановительный период ожоговой болезни. Полной деконтаминации зоны ожогового поражения удалось достичь у одного пациента на 40-й, а у другого на 48-й день от момента поступления в отделение за счет проведения адекватного туалета оставшихся кожных дефектов антисептиками с анти-MRSA активностью.
Заключение
Резюмируя вышеизложенное можно отметить.
1. MRSA-колонизация является дополнительным фактором риска смерти у пациентов, обратившихся за оказанием медицинской помощи.
2. MRSA-колонизация может отмечаться у реконвалесцентов острой MRSA инфекции из-за неадекватного использования антибактериальных средств с анти-MRSA активностью.
3. Наиболее общим требованием к применяемым для лечения инфекции, ассоциированной с метициллин-резистентными штаммами Staphylococcus aureus, антибактериальным средствам является быстрая и эффективная эрадикация возбудителя из организма больного, предотвращающая формирование MRSA-носительства у выздоравливающих пациентов.
4. Даптомицин, включенный в эмпирическую терапию инфекции мягких тканей в зонах ожогового поражения, примененный в среднетерапевтических дозировках, имеет преимущества перед ванкомицином в отношении скорости эрадикации MRSА, предотвращает длительную персистенцию возбудителя в данной группе пациентов.
Литература
1. Крутиков М.Г. Фармакокинетика антибактериальных препаратов у обожженных [Электронный ресурс] Интернет-журнал «Комбустиология», 2003, 16-17. URL: www.burn.ru/all/number/show/?id = 3543 (дата обращения: 31.05.2014).
2. Яковлев С.В. Системная антибактериальная терапия ожоговой болезни. Фундаментальные исследования, 2013, 3 (1): 184-188.
URL: www.rae.ru/fs/?section=content&op=show_article&article_id=10000385 (дата обращения: 28.05.2014).
3. Bassetti M. Empiric Therapy of Gram-positive Bloodstream Infections and Pneumonia. M. Bassetti, G. Villa. In: J.-L.Vincent (Ed.). Annual Update in Intensive Care and Emergency Medicine. Springer-Verlag, 2012: 264-277.
4. Bassetti M. New approaches for empiric therapy in Gram-positive sepsis. M. Bassetti, F. Ginoccio, D.R. Giacobbe. Minerva Anestesiol., 2011, 77: 821-827.
5. Boucher HW. Perspectives on daptomycin resistance, with emphasis on resistance in Staphylococcus aureus. H.W. Boucher, G. Sakoulas. Clin. Infect. Dis., 2007, 45: 601-608.
H.W. Boucher, G. Sakoulas. Clin. Infect. Dis., 2007, 45: 601-608.
6. Figueroa DA. Safety of high-dose intravenous daptomycin treatment: three-year cumulative experience in a clinical program. D.A. Figueroa, E. Mangini, M. Amodio-Groton et al. Clin. Infect. Dis., 2009, 49: 177-180.
7. Hidron AI. Antimicrobial-Resistant Pathogens Associated With Healthcare-Associated Infections: Annual Summary of Data Reported to the National Healthcare Safety Network at the Centers for Disease Control and Prevention, 2006-2007. Hidron AI, Jonathan RE, Patel J, Horan TC, Sievert DM, Pollock DA, Fridkin SK. Infect. Control. Hosp. Epidemiol., 2008, 29: 996-1011.
8. Huang SS. Methicillin-Resistant Staphylococcus aureus Infection and Hospitalization in High-Risk Patients in the Year following Detection. Huang SS, Hinrichsen VL, Datta R, Spurchise L, Miroshnik I, Nelson K, Platt R. PLoS ONE, 2011, 6 (9).
9. Jeffers MN. A retrospective analysis of possible renal toxicity associated with vancomycin in patients with health care-associated methicillin-resistant Staphylococcus aureus pneumonia. Jeffres MN, Isakow W, Doherty JA, Micek ST, Kollef MH. Clin.Ther., 2007, 29: 1107-1115.
Jeffres MN, Isakow W, Doherty JA, Micek ST, Kollef MH. Clin.Ther., 2007, 29: 1107-1115.
10. Klevens RM. Invasive methicillin-resistant Staphylococcus aureus infections in the United States. Klevens RM, Morrison MA, Nadle J et al. JAMA, 2007, 298: 1763-1771.
11. Lagace-Wiens P, Adam H, Nichol K, Decorby M, Mulvey M, Karlowsky J. Vancomycin and Daptomycin MIC Creep in Staphylococcus spp.in Canada – Analysis of 4642 S. aureus and 497 S. epidermidis isolates from 2007–2010: Interscience Conference on Antimicrobial Agents and Chemotherapy. Chicago, USA, 2011.
12. Luzzaro F. Prevalence and epidemiology of microbial pathogens causing bloodstream infections: results of the OASIS multicenter study. Luzzaro F, Ortisi G, Larosa M, Drago M, Brigante G, Gesu G. Diagn. Microbiol. Infect. Dis., 69: 363-369.
13. Wisplinghoff H. Nosocomial bloodstream infections in US hospitals: analysis of 24,179 cases from a prospective nationwide surveillance study. Wisplinghoff H, Bischoff T, Tallent SM, Seifert H, Wenzel RP, Edmond MB. Clin. Inf. Dis., 2004, 39: 309-317.
Wisplinghoff H, Bischoff T, Tallent SM, Seifert H, Wenzel RP, Edmond MB. Clin. Inf. Dis., 2004, 39: 309-317.
Лечение инфекций, вызванных Staphylococcus aureus
Золотистый стафилококк, хотя его обычно называют комменсалом, также является частой причиной бактериальных инфекций человека, в том числе кожи и других мягких тканей, костей, кровотока и дыхательных путей. История лечения S. aureus отмечена развитием устойчивости к каждому новому классу антистафилококковых противомикробных препаратов, включая пенициллины, сульфаниламиды, тетрациклины, гликопептиды и другие, осложняющие терапию.Изоляты S. aureus, идентифицированные в 1960-х годах, иногда были устойчивы к метициллину, ß-лактамному антимикробному действию первоначально против большинства штаммов S. aureus. Эти изоляты MRSA, устойчивые почти ко всем ß-лактамным противомикробным препаратам, сначала были ограничены медицинским учреждением и пациентами, которые его посещали.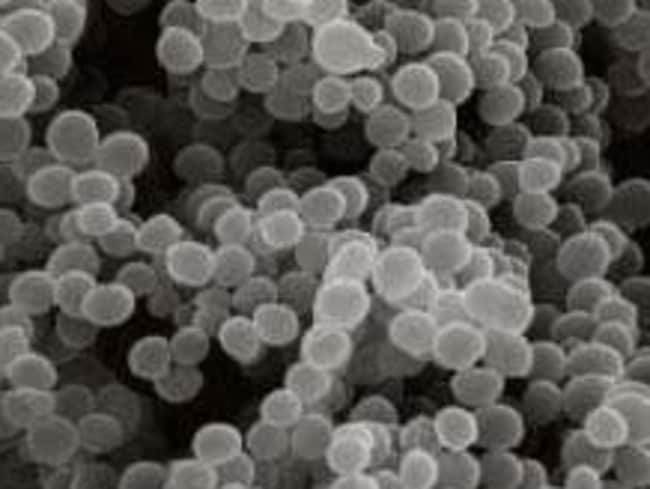 Однако в середине 1990-х годов появились новые штаммы, известные как штаммы MRSA, ассоциированные с сообществами (CA-). Организмы CA-MRSA, по сравнению с типами штаммов MRSA, связанных с оказанием медицинской помощи (HA-), более часто чувствительны к нескольким классам не-бета-лактамных противомикробных препаратов.В то время как инфекции, вызванные метициллин-чувствительными штаммами S. aureus (MSSA), обычно лечат препаратами из класса ß-лактамов, такими как цефалоспорины, оксациллин или нафциллин, инфекции MRSA лечат препаратами других классов противомикробных препаратов. Гликопептидный препарат ванкомицин, а в некоторых странах тейкопланин, является наиболее распространенным препаратом, используемым для лечения тяжелых инфекций MRSA. В настоящее время доступны другие классы противомикробных препаратов для лечения стафилококковых инфекций, в том числе несколько, которые были одобрены после 2009 года.Антимикробное лечение инвазивных и неинвазивных инфекций S. aureus в амбулаторных и стационарных условиях является темой этого обзора.
Однако в середине 1990-х годов появились новые штаммы, известные как штаммы MRSA, ассоциированные с сообществами (CA-). Организмы CA-MRSA, по сравнению с типами штаммов MRSA, связанных с оказанием медицинской помощи (HA-), более часто чувствительны к нескольким классам не-бета-лактамных противомикробных препаратов.В то время как инфекции, вызванные метициллин-чувствительными штаммами S. aureus (MSSA), обычно лечат препаратами из класса ß-лактамов, такими как цефалоспорины, оксациллин или нафциллин, инфекции MRSA лечат препаратами других классов противомикробных препаратов. Гликопептидный препарат ванкомицин, а в некоторых странах тейкопланин, является наиболее распространенным препаратом, используемым для лечения тяжелых инфекций MRSA. В настоящее время доступны другие классы противомикробных препаратов для лечения стафилококковых инфекций, в том числе несколько, которые были одобрены после 2009 года.Антимикробное лечение инвазивных и неинвазивных инфекций S. aureus в амбулаторных и стационарных условиях является темой этого обзора.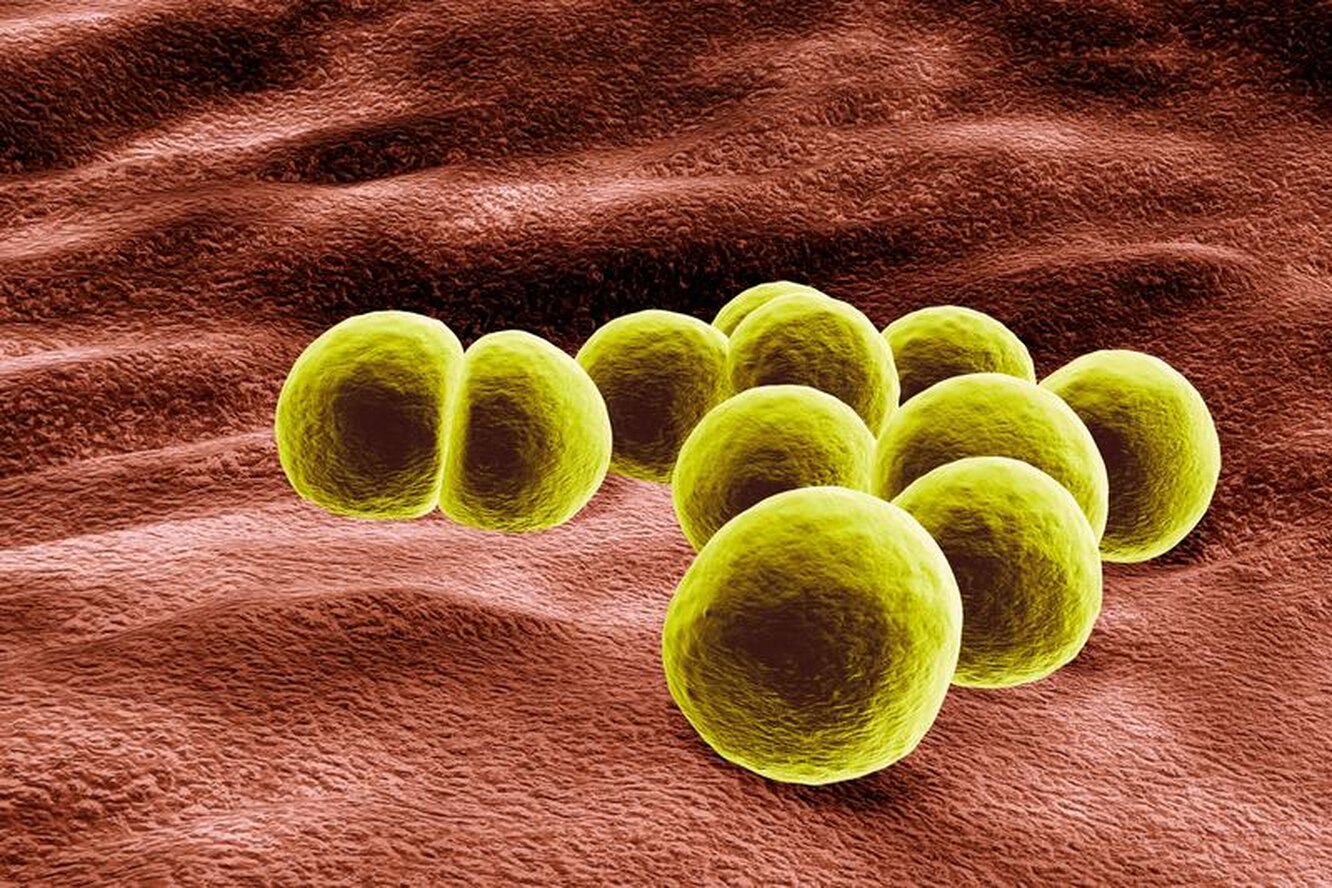 Также обсуждаются общие побочные эффекты антистафилококковых противомикробных агентов, преимущества одного агента перед другим при определенных клинических синдромах и использование дополнительных методов лечения, таких как хирургическое вмешательство и внутривенное введение иммуноглобулина. У нас есть подробные рекомендации по терапии неинвазивных и инвазивных инфекций, вызванных S. aureus. Далее следуют разделы, посвященные конкретным клиническим инфекционным синдромам, включая инфекции кожи и мягких тканей, бактериемию, эндокардит и внутрисосудистые инфекции, пневмонию, остеомиелит и вертебральный дискит, эпидуральный абсцесс, септический артрит, пиомиозит, мастит, некротический фасциит, инфекции глазницы, эндофтальмит. , стафилококковые токсинозы, урогенитальные инфекции и инфекции центральной нервной системы.
Также обсуждаются общие побочные эффекты антистафилококковых противомикробных агентов, преимущества одного агента перед другим при определенных клинических синдромах и использование дополнительных методов лечения, таких как хирургическое вмешательство и внутривенное введение иммуноглобулина. У нас есть подробные рекомендации по терапии неинвазивных и инвазивных инфекций, вызванных S. aureus. Далее следуют разделы, посвященные конкретным клиническим инфекционным синдромам, включая инфекции кожи и мягких тканей, бактериемию, эндокардит и внутрисосудистые инфекции, пневмонию, остеомиелит и вертебральный дискит, эпидуральный абсцесс, септический артрит, пиомиозит, мастит, некротический фасциит, инфекции глазницы, эндофтальмит. , стафилококковые токсинозы, урогенитальные инфекции и инфекции центральной нервной системы.
Диагностика и лечение золотистого стафилококка
S. aureus является частью нормальной человеческой флоры (бактерии, которые обычно обитают в организме человека или на нем) и обычно не вызывает инфекции.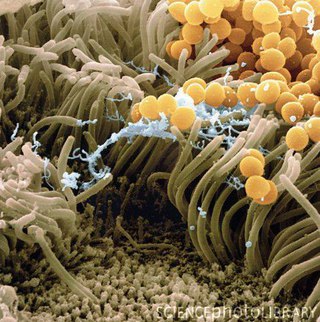 Когда бактерии живут на теле человека или внутри него, но не вызывают инфекцию, это называется «колонизацией». Люди чаще всего колонизируют S. aureus в носу, а также на коже и других участках тела.Со временем 20% популяции почти всегда будут колонизированы S. aureus , 60% популяции будут колонизированы S. aureus периодически и постоянно, а еще 20% почти никогда не колонизируются S. aureus .
Когда бактерии живут на теле человека или внутри него, но не вызывают инфекцию, это называется «колонизацией». Люди чаще всего колонизируют S. aureus в носу, а также на коже и других участках тела.Со временем 20% популяции почти всегда будут колонизированы S. aureus , 60% популяции будут колонизированы S. aureus периодически и постоянно, а еще 20% почти никогда не колонизируются S. aureus .
На этой странице:
Диагноз
Лечение
Диагностика
- Окончательный диагноз инфекции S. aureus ставится путем получения культуры из области подозрения на инфекцию.
- Подозрительный диагноз основывается на симптомах пациента и оценке врача.
Лечение
- Некоторые кожные инфекции не требуют лечения.
- Другие кожные инфекции могут потребовать разреза и дренирования инфицированного участка и / или лечения антибиотиками.

- Если ваш врач или поставщик медицинских услуг прописывает антибиотики, важно, чтобы вы принимали все предписанные дозы.
- Если ваша инфекция не проходит после лечения, обратитесь к своему врачу.
Обработка MRSA:
- Бактерии MRSA могут быть устойчивы ко многим типам антибиотиков.
- Важно убедиться, что получена культура из зараженной области.
Лаборатории- могут проверить, какие антибиотики убивают бактерии.
- Тестирование посева гарантирует, что для лечения инфекции будет назначен правильный антибиотик.
Стафилококковая инфекция кожи | DermNet NZ
Автор: Эми Стэнвей МБЧБ, регистратор отделения дерматологии, больница Вайкато, Гамильтон, Новая Зеландия, 2002 г. Обновлено доктором Джаннет Гомес, аспирантом в области клинической дерматологии, Лондонский университет Королевы Марии, Соединенное Королевство; Главный редактор: д-р Аманда Окли, дерматолог, Гамильтон, Новая Зеландия, декабрь 2015 г.
Что такое стафилококковая инфекция?
Стафилококковая инфекция — это распространенная бактериальная инфекция кожи.
Стафилококки («стафилококки») представляют собой распространенный тип бактерий, обитающих на коже и слизистых оболочках (например, в ноздрях) людей. Золотистый стафилококк ( S aureus ) является наиболее важным из этих бактерий при болезнях человека. Другие стафилококки, включая S epidermidis , считаются комменсалами или нормальными обитателями поверхности кожи.
Около 15–40 процентов здоровых людей являются носителями S aureus , то есть у них есть бактерии на коже без какой-либо активной инфекции или болезни (колонизации).Местами-носителями обычно являются ноздри и изгибы, где бактерии могут обнаруживаться периодически или каждый раз, когда их ищут.
Что вызывает стафилококковую инфекцию?
Несмотря на то, что S aureus безвреден для большинства людей, он способен вызывать различные инфекции кожи и других органов. S aureus часто встречается у людей с частыми повреждениями кожи, особенно если кожа сухая. Кожные инфекции, вызванные стафилококком, чаще всего наблюдаются у детей предпубертатного возраста и некоторых профессиональных групп, например, у медицинских работников.Но они могут возникать без очевидной причины у здоровых людей.
S aureus часто встречается у людей с частыми повреждениями кожи, особенно если кожа сухая. Кожные инфекции, вызванные стафилококком, чаще всего наблюдаются у детей предпубертатного возраста и некоторых профессиональных групп, например, у медицинских работников.Но они могут возникать без очевидной причины у здоровых людей.
Большинство стафилококковых инфекций возникает у здоровых людей, но основное заболевание и некоторые кожные заболевания повышают риск заражения. К ним относятся:
- Атопический дерматит тяжелой степени
- Сахарный диабет, плохо контролируемый
- Почечная недостаточность, особенно на диализе
- Заболевания крови, такие как лейкемия и лимфома
- Недоедание
- Недостаток железа
- Алкоголизм
- Потребители внутривенных наркотиков
- Наличие инородного тела, например протезного сустава, кардиостимулятора, постоянного катетера, гемодиализа, недавней хирургической процедуры
- Лекарства с системными стероидами, ретиноидами, цитотоксиками или иммунодепрессантами
- Дефицит иммуноглобулина М
- Хроническая гранулематозная болезнь
- Синдром Чедиака-Хигаши
- Синдромы Джоба и Вискотта-Олдрича (ассоциации тяжелой стафилококковой инфекции с экземой, повышенным уровнем иммуноглобулина Е и нарушением функции белых клеток)
Бактериология стафилококковой инфекции
Бактерии S aureus классифицируются как грамположительные кокки на основании их внешнего вида под микроскопом. Они могут встречаться поодиночке или сгруппированными парами, короткими цепочками или гроздьями винограда. Обычно это факультативные анаэробы, то есть они способны выживать при различных уровнях оксигенации и, как правило, являются очень выносливыми организмами.
Они могут встречаться поодиночке или сгруппированными парами, короткими цепочками или гроздьями винограда. Обычно это факультативные анаэробы, то есть они способны выживать при различных уровнях оксигенации и, как правило, являются очень выносливыми организмами.
Они могут проникать только через поврежденную кожу или слизистые оболочки, поэтому неповрежденная кожа является отличной защитой для человека. После вторжения у них есть различные способы избежать защиты хозяина. Они:
- Скрывают свои антигены, чтобы избежать иммунного ответа
- Убить клетки, борющиеся с инфекциями (фагоциты)
- Выжить в клетках-хозяевах, борющихся с инфекциями.
- Развитие устойчивости к антибиотикам
- Выпуск токсинов (интоксикация) — для их действия не требуется присутствие живых бактерий.
Кожные заболевания, вызванные стафилококковой инфекцией
Стафилококковая инфекция кожи может проявляться различными путями:
Примеры стафилококковых кожных инфекций
Кожные заболевания, вызванные токсинами, вырабатываемыми бактериями, включают:
- Синдром ошпаренной кожи стафилококка (SSSS), который обычно поражает детей в возрасте до пяти лет или, в редких случаях, взрослых с почечной недостаточностью.
- Синдром токсического шока. Это относительно редкое заболевание, обычно возникающее в результате выброса токсина-1 при синдроме токсического шока (TSST-1) или энтеротоксина B. Эти токсины также известны как суперантигены, поскольку они способны вызывать массивную воспалительную реакцию. Предыдущее воздействие делает пациента невосприимчивым к этим токсинам, то есть у него не будет повторной атаки.
- Скарлатина стафилококковая (скарлатина).
Стафилококковые токсины также могут вызывать пищевое отравление.
Как диагностируется стафилококковая инфекция?
Стафилококковая инфекция кожи часто диагностируется клинически. Если возникают трудности с диагностикой или лечение первой линии не дает результатов, диагноз может быть подтвержден положительным лабораторным посевом мазка из инфицированного места или посевом крови.
При стафилококковой интоксикации могут отсутствовать жизнеспособные бактерии для культивирования, и диагноз может быть установлен ретроспективно на основании анализа крови, демонстрирующего иммунный ответ (сероконверсию) на токсины после совместимого заболевания.
Как лечится стафилококковая инфекция?
Лечение стафилококковой инфекции включает:
- Соответствующие антибиотики, включая пероральные антибиотики цефалексин, клиндамицин, амоксициллин / клавуланат
- Вытекание гноя из очага заражения
- Хирургическое удаление (санация) омертвевших тканей (некроза)
- Удаление инородных тел (например, швов), которые могут быть очагом персистирующей инфекции
- Лечение основного кожного заболевания (например, атопической экземы)
Устойчивость к антибиотикам
Стафилококки становятся все более устойчивыми ко многим широко используемым антибиотикам, включая пенициллины, макролиды, такие как эритромицин, тетрациклины и аминогликозиды.
Устойчивость к пенициллину у S aureus обусловлена производством фермента, называемого бета-лактамазой или пенициллиназой. Метициллин (метициллин) и флуклоксациллин являются пенициллинами, устойчивыми к лактамазе, поэтому являются антибиотиками выбора при большинстве стафилококковых инфекций кожи. К сожалению, сейчас наблюдается рост устойчивости к метициллину (MRSA).
Пенициллины с ингибитором бета-лактамаз, таким как амоксициллин + клавулоновая кислота, могут использоваться для лечения инфекций S aureus и иногда эффективны против бактерий, устойчивых к флуклоксациллину.Эти антибиотики обладают широким спектром действия против нескольких бактерий и лучше всего подходят для пациентов со смешанными бактериальными инфекциями.
Пациенты с аллергией на пенициллин наиболее надежно лечатся ванкомицином, хотя при незначительных инфекциях могут подойти макролиды, такие как эритромицин. Устойчивость к макролидам также высока среди S aureus , но макролиды можно принимать внутрь, тогда как ванкомицин требует внутривенного введения. Другие варианты включают клиндамицин и рифампицин.
Профилактика стафилококковой инфекции
Из-за широко распространенной устойчивости к антибиотикам лучше предотвратить стафилококковую инфекцию там, где это возможно.
- Самый эффективный способ — часто мыть руки, а также до и после прикосновения к поврежденной коже.
- Также важно удалять бактерии, колонизирующие ноздри и под ногтями, с помощью мази с антибиотиком (например, фузидиевой кислоты или мупироцина) или вазелином несколько раз в день в течение одной недели каждого месяца.
- Полезны хлорные ванны два раза в неделю.
Лечение золотистого стафилококка
Золотистый стафилококк вызывает самые разные проявления и заболевания. Лечением выбора для инфекции S. aureus является пенициллин. В большинстве стран штаммов S. aureus выработали устойчивость к пенициллину из-за выработки бактериями фермента, называемого пенициллиназой.
Терапия первой линии — пенициллины, устойчивые к пенициллиназе, такие как оксациллин или флуклоксациллин.При более серьезных инфекциях терапия часто назначается в сочетании с аминогликозидами, такими как гентамицин. Продолжительность лечения зависит от очага инфекции и степени тяжести.
Устойчивость к антибиотикам
S. aureusШтаммы S. aureus могут стать устойчивыми к пенициллину, продуцируя такие ферменты, как пенициллиназа, которые разрушают антибиотик. Это форма β-лактамазы, которая разрушает β-лактамное кольцо молекулы пенициллина. Для преодоления этого были разработаны молекулы, устойчивые к пенициллиназе.К ним относятся:
- метициллин
- нафциллин
- оксациллин
- клоксациллин
- диклоксациллин
- флуклоксациллин
Генетическая мутация и модификация
Генетическая мутация и модификация считаются механизмами, которые делают S. aureus устойчивым к метициллину и продуцируют устойчивый к метициллину S. aureus или MRSA. Модификация в гене mecA бактерий, который кодирует измененный пенициллин-связывающий белок, приводит к более низкому сродству к связыванию β-лактамов (пенициллинов, цефалоспоринов и карбапенемов).Это обеспечивает устойчивость ко всем β-лактамным антибиотикам.
MRSA-инфекции как в больнице, так и в общественных местах обычно лечат не-β-лактамными антибиотиками, такими как клиндамицин (линкозамин) и котримоксазол (также широко известный как триметоприм / сульфаметоксазол). В тяжелых случаях применяется ванкомицин.
Модификация ферментов и другие методы устойчивости
Аминогликозиды, такие как гентамицин, амикацин, стрептомицин и канамицин, когда-то были эффективны против стафилококковых инфекций.У них выработалась устойчивость за счет модификации ферментов, изменения мест прикрепления рибосом и активного вытеснения лекарства из бактерий.
Антибактериальная терапия
- Лечение бактериемии или заражения крови S. aureus или инфекции от медицинского изделия — медицинское изделие или очаги инфекции необходимо удалить после идентификации. Из антибиотиков предпочтительны β-лактамы, оксациллин, нафциллин, цефазолин и др. Для MRSA ванкомицин, даптомицин, линезолид, хинупристин / далфопристин, котримоксазол, цефтаролин, телаванцин и т. Д.выбраны.
- Лечение инфекции сердца или его клапанов (эндокардита) — по возможности удаляют очаги. Выбор антибиотиков включает оксациллин, цефазолин, нафциллин, гентамицин и т. Д. Для штаммов, чувствительных к метициллину (MSSA). Другие включают ципрофлоксацин, рифампицин, ванкомицин, даптомицин и т. Д.
- Инфекции мягких тканей и кожи — основным лечением является удаление очагов инфекции путем дренирования гноя из абсцессов, целлюлита и т. Д. Выбор антибиотиков для MSSA включает цефалексин, диклоксациллин, клиндамицин, амоксициллин / клавуланат и т. Д.Для лечения MRSA можно использовать такие антибиотики, как котримоксазол, клиндамицин, тетрациклины, доксициклин, миноциклин, линезолид и т. Д. При кожных инфекциях также назначают местное применение антибиотиков, таких как мазь Мупироцин 2%.
- Инфекции легких или пневмония — для случаев MRSA можно использовать линезолид, ванкомицин, клиндамицин и т. Д.
- Инфекции костей и суставов — для MSSA можно использовать оксациллин, цефазолин, нафциллин, гентамицин и т. Д. Для случаев MRSA линезолид, ванкомицин, клиндамицин, даптомицин, коптримоксазол и т. Д.может быть использовано.
- Инфекция головного мозга и мозговых оболочек (менингит) — для MSSA можно использовать оксациллин, цефазолин, нафциллин, гентамицин и т. Д. В случаях MRSA можно использовать линезолид, ванкомицин, клиндамицин, даптомицин, котримоксазол и т. Д.
- Синдром токсического шока — для MSSA могут использоваться оксациллин, нафциллин, клиндамицин и т. Д. В случаях MRSA можно использовать линезолид, ванкомицин, клиндамицин и т. Д.
Дополнительная литература
Медицинская помощь, хирургическая помощь, профилактика
Jamal N, Teach SJ.Некротический фасциит. Скорая педиатрическая помощь . 2011 27 декабря (12): 1195-9; викторина 1200-2. [Медлайн].
Харамилло Д. Инфекция: опорно-двигательная. Педиатр Радиол . 2011 Май. 41 Приложение 1: S127-34. [Медлайн].
Chou H, Teo HE, Dubey N, Peh WC. Тропический пиомиозит и некротический фасциит. Радиол опорно-двигательного аппарата Семина . 2011 15 ноября (5): 489-505. [Медлайн].
Lane JW, Tang J, Taggard D, Byun R.Успешное применение даптомицина и линезолида без хирургического вмешательства при лечении обширного эпидурального абсцесса и бактериемии, вызванной метициллин-резистентным золотистым стафилококком (MRSA). Инфекция Dis Clin Pract . Сентябрь 2011 г. 19 (5): 362-364.
Абдель-Хак Н., Кесада М., Асмар Б.И. Заглоточный абсцесс у детей: рост числа устойчивых к метициллину Staphylococcus aureus. Pediatr Infect Dis J . 2012 июля 31 (7): 696-9. [Медлайн].
McNeil JC, Hulten KG, Kaplan SL, Mahoney DH, Mason EO. Инфекции, вызванные Staphylococcus aureus у больных детской онкологией: высокие показатели устойчивости к противомикробным препаратам, антисептическая толерантность и осложнения. Pediatr Infect Dis J . 2012 11 сентября [Medline].
Elliott DJ, Zaoutis TE, Troxel AB, Loh A, Keren R. Эмпирическая антимикробная терапия детской кожи и инфекций мягких тканей в эпоху метициллин-резистентного золотистого стафилококка. Педиатрия . 2009 июн.123 (6): e959-66. [Медлайн].
Lee S, Choe PG, Song KH, Park SW, Kim HB, Kim NJ, et al. Цефазолин уступает нафциллину при лечении бактериемии, вызванной чувствительным к метициллину Staphylococcus aureus? Противомикробные агенты Chemother . 2011 ноябрь 55 (11): 5122-6. [Медлайн]. [Полный текст].
Williams DJ, Cooper WO, Kaltenbach LA, Dudley JA, Kirschke DL, Jones TF, et al. Сравнительная эффективность стратегий лечения антибиотиками при инфекциях кожи и мягких тканей у детей. Педиатрия . 2011 15 августа [Medline].
[Рекомендации] Лю С., Байер А., Косгроув С.Е., et al. Руководство по клинической практике Американского общества инфекционистов по лечению устойчивых к метициллину инфекций Staphylococcus Aureus у взрослых и детей. Clin Infect Dis . 2011 г. 1. 52 (3): e18-e55. [Медлайн].
Кемпер А.Р., Долор Р.Дж., Фаулер В.Г. Младший. Лечение кожных абсцессов педиатрами первичной медико-санитарной помощи. Clin Pediatr (Phila) . 2011 июн. 50 (6): 525-8. [Медлайн].
Sreeramoju P, Porbandarwalla NS, Arango J, Latham K, Dent DL, Stewart RM и др. Рецидивирующие инфекции кожи и мягких тканей, вызванные устойчивым к метициллину Staphylococcus aureus, требующие хирургической обработки раны. Am J Surg . 2011 Февраль 201 (2): 216-20. [Медлайн].
Pääkkönen M, Kallio PE, Kallio MJ, Peltola H. Лечение костно-суставных инфекций, вызванных Staphylococcus aureus, аналогично лечению других этиологий: анализ 199 стафилококковых инфекций костей и суставов. Pediatr Infect Dis J . 2012 май. 31 (5): 436-8. [Медлайн].
Боггс В. Даптомицин лечит бактериемию S. aureus без нефротоксичности. Медицинские новости Medscape. 8 января 2013 г. Доступно по адресу http://www.medscape.com/viewarticle/777276. Доступ: 15 января 2013 г.
von Eiff C, Becker K, Machka K, Stammer H, Peters G. Носовое носительство как источник бактериемии Staphylococcus aureus. Исследовательская группа. N Engl J Med . 2001 4 января.344 (1): 11-6. [Медлайн].
van Belkum A, Verkaik NJ, de Vogel CP, Boelens HA, Verveer J, Nouwen JL. Реклассификация типов носового носительства Staphylococcus aureus. J Заразить Dis . 2009 15 июня. 199 (12): 1820-6. [Медлайн].
Венцель Р.П., Perl TM. Значение носительства Staphylococcus aureus через нос и частота послеоперационной раневой инфекции. J Hosp Infect . 1995 31 сентября (1): 13-24. [Медлайн].
Ruimy R, Angebault C, Djossou F и др.Является ли генетика хозяина доминирующей детерминантой стойкого носительства Staphylococcus aureus через нос у людей? J Заразить Dis . 2010 15 сентября. 202 (6): 924-34. [Медлайн].
Chen CJ, Hsu KH, Lin TY, Hwang KP, Chen PY, Huang YC. Факторы, связанные с носовой колонизацией метициллин-резистентного золотистого стафилококка среди здоровых детей на Тайване. Дж. Клин Микробиол . 2011 января 49 (1): 131-7. [Медлайн]. [Полный текст].
Нерби Дж. М., Горвиц Р., Лешер Л., Джуни Б., Джавахир С., Линфилд Р.Факторы риска передачи в домашних условиях связанного с сообществом метициллин-устойчивого Staphylococcus aureus. Pediatr Infect Dis J . 2011 30 ноября (11): 927-32. [Медлайн].
Fritz SA, Krauss MJ, Epplin EK, Burnham CA, Garbutt J, Dunne WM и др. Естественная история современной носовой колонизации Staphylococcus aureus у общинных детей. Pediatr Infect Dis J . 2011 Апрель 30 (4): 349-51. [Медлайн]. [Полный текст].
Джезуальдо Ф., Бонджорно Д., Риццо С., Белла А., Меничелла Д., Стефани С. и др.Колонизация носа MRSA у детей: метаанализ распространенности, обзор факторов риска и молекулярная генетика. Pediatr Infect Dis J . 2013 21 января [Medline].
Петерс П.Дж., Брукс Д.Т., Макаллистер С.К., Лимбаго В., Лоури Г.К., Фосхейм Г. и др. Колонизация метициллин-резистентного золотистого стафилококка в паху и риск клинической инфекции среди ВИЧ-инфицированных взрослых. Emerg Infect Dis . Апрель 2013. 19 (4): 623-629.
Faden H, Lesse AJ, Trask J, Hill JA, Hess DJ, Dryja D.Важность места колонизации в современной эпидемии стафилококковых кожных абсцессов. Педиатрия . 2010 15 февраля. [Medline].
Lee CJ, Sankaran S, Mukherjee DV, Apa ZL, Hafer CA, Wright L. Staphylococcus aureus ротоглоточное носительство у заключенных. Clin Infect Dis . 2011 15 марта. 52 (6): 775-8. [Медлайн].
Nowrouzian FL, Dauwalder O, Meugnier H, Bes M, Etienne J, Vandenesch F и др. Гены адгезина и суперантигена и способность Staphylococcus aureus колонизировать детский кишечник. J Заразить Dis . 2011 Сентябрь 204 (5): 714-21. [Медлайн].
Milstone AM, Song X, Coffin S, Elward A. Идентификация и искоренение колонизации устойчивых к метициллину Staphylococcus aureus в отделении интенсивной терапии новорожденных: результаты национального исследования. Инфекционный контроль Hosp Epidemiol . 2010 июля 31 (7): 766-8. [Медлайн]. [Полный текст].
Накамура М.М., Макадам А.Дж., Сандора Т.Дж., Морейра К.Р., Ли Г.М. Более высокая распространенность носительства Staphylococcus aureus через глотку, чем через нос, в педиатрических отделениях интенсивной терапии. Дж. Клин Микробиол . 2010 августа 48 (8): 2957-9. [Медлайн].
Matheson EM, Mainous AG 3rd, Everett CJ, King DE. Потребление чая и кофе и носовое носительство MRSA. Энн Фам Мед . 2011 июл-авг. 9 (4): 299-304. [Медлайн].
Зангер П., Нурджади Д., Гайле М., Габриш С., Кремснер П.Г. Использование гормональных контрацептивов и стойкое носительство золотистого стафилококка. Clin Infect Dis . 2012 декабрь 55 (12): 1625-32. [Медлайн].
Bartlett AH, Hulten KG. Патогенез золотистого стафилококка: системы секреции, адгезины и инвазины. Pediatr Infect Dis J . 2010 сентября, 29 (9): 860-1. [Медлайн].
Tuchscherr L, Heitmann V, Hussain M, Viemann D, Roth J, von Eiff C, et al. Варианты небольших колоний Staphylococcus aureus являются адаптированными фенотипами для внутриклеточной персистенции. J Заразить Dis . 1 октября 2010 г. 202 (7): 1031-40. [Медлайн].
Verkaik NJ, Dauwalder O, Antri K, Boubekri I, de Vogel CP, Badiou C.Иммуногенность токсинов при инфицировании золотистым стафилококком. Clin Infect Dis . 2010 г. 1. 50 (1): 61-8. [Медлайн].
Aalfs AS, Oktarina DA, Diercks GF, Jonkman MF, Pas HH. Стафилококковый синдром ошпаренной кожи: потеря десмоглеина 1 в коже пациента. Eur J Dermatol . 2010 июл-авг. 20 (4): 451-6. [Медлайн].
Bassetti M, Nicco E, Mikulska M. Почему MRSA, ассоциированный с сообществами, распространяется по всему миру и как это изменит клиническую практику ?. Int J Антимикробные агенты . 2009 июл. 34 Приложение 1: S15-9. [Медлайн].
Дэвид MZ, Daum RS. Связанный с сообществом метициллин-устойчивый золотистый стафилококк: эпидемиология и клинические последствия возникающей эпидемии. Clin Microbiol Ред. . 2010 июл.23 (3): 616-87. [Медлайн].
Пикетт А., Уилкинсон М., Менох М., Снелл Дж., Инигес Р., Буллох Б. Изменение частоты кожных абсцессов, вызванных метициллин-резистентным золотистым стафилококком, в педиатрическом отделении неотложной помощи. Скорая педиатрическая помощь . 2009 25 декабря (12): 831-4. [Медлайн].
Кайрам Н., Сильверман М.Э., Сало Д.Ф., Баорто Е., Ли Б., Амато К.С. Кожный метициллин-резистентный золотистый стафилококк в педиатрическом отделении пригородной городской больницы. J Emerg Med . 2011 ноябрь 41 (5): 460-5. [Медлайн].
Буше Х.В., Кори ГР. Эпидемиология метициллин-устойчивого золотистого стафилококка. Clin Infect Dis . 2008 г. 1 июня.46 Приложение 5: S344-9. [Медлайн].
Tenover FC, Goering RV. Метициллин-резистентный штамм золотистого стафилококка USA300: происхождение и эпидемиология. J Antimicrob Chemother . 2009 Сентябрь 64 (3): 441-6. [Медлайн].
Talan DA, Krishnadasan A, Gorwitz RJ, Fosheim GE, Limbago B, Albrecht V, et al. Сравнение золотистого стафилококка от инфекций кожи и мягких тканей у пациентов отделения неотложной помощи США, 2004 и 2008 гг. Clin Infect Dis .2011 Июль 53 (2): 144-149. [Медлайн].
Long CB, Madan RP, Herold BC. Диагностика и лечение внебольничных инфекций MRSA у детей. Expert Rev Anti Infect Ther . 2010 февраля 8 (2): 183-95. [Медлайн].
Lowy FD. Как золотистый стафилококк адаптируется к своему хозяину. N Engl J Med . 2011 26 мая. 364 (21): 1987-90. [Медлайн].
Hay R, Noor NM. Лейкоцидин Пантона-Валентайна и тяжелые инфекции кожи, вызванные Staphylococcus aureus: единственный виновник или у него есть сообщники? Curr Opin Infect Dis . 2011 24 апреля (2): 97-9. [Медлайн].
Ritz N, Curtis N. Роль Panton-Valentine Leukocidin в Staphylococcus aureus костно-мышечных инфекциях у детей. Pediatr Infect Dis J . 2012 май. 31 (5): 514-8. [Медлайн].
Mendes RE, Deshpande LM, Smyth DS, Shopsin B, Farrell DJ, Jones RN. Характеристика устойчивых к метициллину штаммов Staphylococcus aureus, полученных в результате клинического испытания фазы IV линезолида по сравнению с ванкомицином для лечения нозокомиальной пневмонии. Дж. Клин Микробиол . 2012 ноябрь 50 (11): 3694-702. [Медлайн]. [Полный текст].
Hermos CR, Yoong P, Pier GB. Высокие уровни антител к пантон-валентинному лейкоцидину не связаны с устойчивостью к инфекциям кожи и мягких тканей, связанным со Staphylococcus aureus. Clin Infect Dis . 2010 15 ноября. 51 (10): 1138-46. [Медлайн].
Grundmeier M, Tuchscherr L, Bruck M, Viemann D, Roth J, Willscher E. Штаммы стафилококков сильно различаются по своей способности вызывать воспалительный ответ в эндотелиальных клетках. J Заразить Dis . 2010 15 марта. 201 (6): 871-80. [Медлайн].
Strandberg KL, Rotschafer JH, Vetter SM, Buonpane RA, Kranz DM, Schlievert PM. Стафилококковые суперантигены вызывают у кроликов летальную болезнь легких. J Заразить Dis . 2010 декабрь 1. 202 (11): 1690-7. [Медлайн].
Li M, Cheung GY, Hu J, Wang D, Joo HS, Deleo FR, et al. Сравнительный анализ вирулентности и экспрессии токсинов глобальных сообществ устойчивых к метициллину штаммов Staphylococcus aureus. J Заразить Dis . 2010 15 декабря. 202 (12): 1866-76. [Медлайн].
Torres VJ, Stauff DL, Pishchany G, Bezbradica JS, Gordy LE, Iturregui J, et al. Регуляторная система золотистого стафилококка, которая реагирует на гем хозяина и модулирует вирулентность. Клеточный микроб-хозяин . 2007, 19 апреля. 1 (2): 109-19. [Медлайн]. [Полный текст].
Пищанский Г., Маккой А.Л., Торрес В.Дж., Краузе Дж.С., Кроу Дж.Э. младший, Фабри М.Э. и др. Специфичность для человеческого гемоглобина усиливает инфекцию Staphylococcus aureus. Клеточный микроб-хозяин . 2010 16 декабря. 8 (6): 544-50. [Медлайн]. [Полный текст].
Кобаяши С.Д., Малахова Н., Уитни А.Р., Браутон К.Р., Гарднер Д.Д., Лонг Д. и др. Сравнительный анализ детерминант вирулентности USA300 в модели инфекции кожи и мягких тканей кролика. J Заразить Dis . 2011 Сентябрь 204 (6): 937-41. [Медлайн]. [Полный текст].
Хота Б., Лайлс Р., Рим Дж., Попович К.Дж., Райс Т., Аручева А. Предикторы клинической вирулентности при внебольничных метициллин-устойчивых инфекциях Staphylococcus aureus: важность USA300 и пневмонии. Clin Infect Dis . 2011 Октябрь 53 (8): 757-65. [Медлайн].
Пейрани П., Аллен М., Вимкен Т.Л., Хак Н.З., Зервос М.Дж., Форд К.Д. и др. Тяжесть заболевания и клинические исходы у пациентов с внутрибольничной пневмонией, вызванной метициллин-устойчивыми штаммами Staphylococcus aureus, на которые не влияет наличие гена лейкоцидина Пантона-Валентина. Clin Infect Dis . 2011 Октябрь 53 (8): 766-71. [Медлайн].
Кебайер К., Чемберленд Р.Р., Аллен И.К., Гао Х, Бройли П.М., Холл Дж. Д.Staphylococcus aureus a-Hemolysin опосредует вирулентность в мышиной модели тяжелой пневмонии посредством активации инфламмасомы NLRP3. J Заразить Dis . 2012 Март 205 (5): 807-17. [Медлайн].
Рудкин Дж., Эдвардс А.М., Боуден М.Г., Браун Е.Л., Поцци С., Уотерс Э.М. Устойчивость к метициллину снижает вирулентность связанного со здоровьем метициллин-устойчивого золотистого стафилококка, вмешиваясь в систему определения кворума agr. J Заразить Dis . 2012 Март.205 (5): 798-806. [Медлайн].
Sharma-Kuinkel BK, Ahn SH, Rude TH, Zhang Y, Tong SY, Ruffin F и др. Наличие генов, кодирующих пантон-валентинский лейкоцидин, не является основным фактором, определяющим исход у пациентов с внутрибольничной пневмонией, вызванной Staphylococcus aureus. Дж. Клин Микробиол . 2012 Март 50 (3): 848-56. [Медлайн]. [Полный текст].
Сунг Дж., Чун Дж., Паркер Д., Принц А. Staphylococcus aureus Активация каспазы 1 / передачи сигналов кальпаина опосредует вторжение через кератиноциты человека. J Заразить Dis . 2012 май. 205 (10): 1571-9. [Медлайн].
Отто М. Как золотистый стафилококк поражает нашу кожу и вызывает инфекцию. J Заразить Dis . 2012 май. 205 (10): 1483-5. [Медлайн].
Wehrhahn MC, Робинсон Дж., Паско Е. М., Кумбс Г. В., Пирсон Дж. К., О’Брайен Ф. Г.. Тяжесть болезни при инвазивной инфекции Staphylococcus aureus, возникшей в сообществе, и наличие генов вирулентности. J Заразить Dis . 2012 июн.205 (12): 1840-8.[Медлайн].
Garofalo A, Giai C, Lattar S, Gardella N, Mollerach M, Kahl BC. Длина полиморфной области белка Staphylococcus aureus регулирует воспаление: влияние на острую и хроническую инфекцию. J Заразить Dis . 2012 Июль 206 (1): 81-90. [Медлайн].
Shallcross LJ, Fragaszy E, Johnson AM, Hayward AC. Роль лейкоцидинового токсина Пантона-Валентайна при стафилококковой инфекции: систематический обзор и метаанализ. Ланцет Infect Dis . 2013 января 13 (1): 43-54. [Медлайн]. [Полный текст].
Сурядевара М., Кларк А.Э., Волк Д.М., Карман А., Розенбаум П.Ф. Молекулярная характеристика инвазивной инфекции Staphylococcus aureus у детей из центральной части Нью-Йорка: важность двух клональных групп и несогласованное присутствие выбранных детерминант вирулентности. J Pediatr Infect Dis Soc . Март 2013. 2 (1): 30-39.
Schneider-Lindner V, Quach C, Hanley JA, Suissa S.Антибактериальные препараты и риск развития метициллин-резистентного золотистого стафилококка, ассоциированного с сообществом, у детей. Arch Pediatr Adolesc Med . 1 августа 2011 г. [Medline].
Смит Т.Л., Пирсон М.Л., Уилкокс К.Р. и др. Возникновение устойчивости к ванкомицину у золотистого стафилококка. Рабочая группа по гликопептиду-промежуточному стафилококку. N Engl J Med . 1999 18 февраля. 340 (7): 493-501. [Медлайн].
Zheng X, Qi C, Arrieta M, O’Leary A, Wang D, Shulman ST.Отсутствие повышения устойчивости к ванкомицину у детских метициллин-устойчивых изолятов Staphylococcus aureus с 2000 по 2007 год. Pediatr Infect Dis J . 2010 сентября, 29 (9): 882-4. [Медлайн].
Кэмерон Д.В., Уорд Д.В., Костулиас X, Хоуден Б.П., Меллеринг Р.К. младший, Элиопулос Г.М. Серин / треонинфосфатаза Stp1 способствует снижению восприимчивости к ванкомицину и вирулентности золотистого стафилококка. J Заразить Dis . 2012 июн.205 (11): 1677-87. [Медлайн].
Cheung A, Duclos B. Stp1 и Stk1: Инь и Ян чувствительности к ванкомицину и вирулентности в штаммах Vancomycin-Intermediate Staphylococcus aureus. J Заразить Dis . 2012 июн.205 (11): 1625-7. [Медлайн].
Shore AC, Deasy EC, Slickers P, et al. Обнаружение стафилококковой кассетной хромосомы mec типа XI, кодирующей сильно дивергентные гены mecA, mecI, mecR1, blaZ и ccr в клиническом клональном комплексе человека 130 Метициллин-устойчивый Staphylococcus aureus. Противомикробные агенты Chemother . 2011 г. 2 июня [Medline].
Гарсия-Альварес Л., Холден М.Т., Линдси Х. и др. Метициллин-резистентный золотистый стафилококк с новым гомологом mecA в популяциях людей и крупного рогатого скота в Великобритании и Дании: описательное исследование. Ланцет Infect Dis . 2011 г. 2 июня [Medline].
Кэмерон Д.Р., Хауден Б.П., Пелег А.Ю. Связь между устойчивостью к антибиотикам и вирулентностью Staphylococcus aureus и ее влияние на клинические исходы. Clin Infect Dis . 2011 Сентябрь 53 (6): 576-82. [Медлайн].
[Рекомендации] CDC. Временные рекомендации по профилактике стафилококковой инфекции, связанной со сниженной чувствительностью к ванкомицину, и борьбе с ней. MMWR Morb Mortal Wkly Rep . 1997 г. 11 июля. 46 (27): 626-8, 635. [Medline].
Ивамото М., Мю И, Линфилд Р., Буленс С.Н., Надл Дж., Арагон Д. и др. Тенденции инвазивных метициллин-устойчивых инфекций Staphylococcus aureus. Педиатрия . 13 октября 2013 г., 132 (4): e817-e824. [Медлайн].
Лэйдман Дж. Распространенность MRSA, связанная с сообществами, растет у детей. Medscape [сериал онлайн]. Доступно на http://www.medscape.com/viewarticle/811483. Доступ: 30 сентября 2013 г.
Helwick C. MRSA растет у детей с мышечно-скелетными инфекциями. Medscape [сериал онлайн]. Доступно на http://www.medscape.com/viewarticle/813484. Доступ: 4 ноября 2013 г.
Saravolatz LD, Pawlak J, Johnson LB.Чувствительность in vitro и молекулярный анализ изолятов стафилококка, устойчивых к ванкомицину, и устойчивых к ванкомицину изолятов Staphylococcus aureus. Clin Infect Dis . 2012 августа. 55 (4): 582-6. [Медлайн].
Frei CR, Makos BR, Daniels KR, Oramasionwu CU. Появление внебольничных инфекций кожи и мягких тканей Staphylococcus aureus, устойчивых к метициллину, как частая причина госпитализации детей в США. J Педиатр Хирург . 2010 Октябрь 45 (10): 1967-74.[Медлайн].
Hadler JL, Petit S, Mandour M, Cartter ML. Тенденции инвазивного заражения метициллин-резистентным золотистым стафилококком, Коннектикут, США, 2001-2010 гг. Emerg Infect Dis . 2012 июн. 18 (6): 917-24. [Медлайн]. [Полный текст].
Сурядевара М., Моро М.Р., Розенбаум П.Ф., Киска Д., Ридделл С., Вайнер Л.Б. Частота инвазивных внебольничных инфекций Staphylococcus aureus у детей в Центральном Нью-Йорке. J Педиатр .2010 Январь 156 (1): 152-154.e1. [Медлайн].
Landrum ML, Neumann C, Cook C, Chukwuma U, Ellis MW, Hospenthal DR. Эпидемиология Staphylococcus aureus крови и инфекций кожи и мягких тканей в системе военного здравоохранения США, 2005-2010 гг. Staphylococcus aureus в вооруженных силах США. JAMA . 2012 июл 4. 308 (1): 50-9. [Медлайн].
Сян М.С., Шиау Р., Надле Дж., Чан Л., Ли Б., Чемберс Х.Ф. и др. Эпидемиологическое сходство у педиатрических сообществ, устойчивых к метициллину и чувствительных к метициллину Staphylococcus aureus в районе залива Сан-Франциско. J Pediatr Infect Dis Soc . Сентябрь 2012. 1 (3): 200-211.
Рейес Дж., Ринкон С., Диаз Л. и др. Распространение устойчивой к метициллину линии передачи типа 8 Staphylococcus aureus USA300 в Латинской Америке. Clin Infect Dis . 2009 15 декабря. 49 (12): 1861-7. [Медлайн]. [Полный текст].
Sutter DE, Milburn E, Chukwuma U, Dzialowy N, Maranich AM, Hospenthal DR. Изменение восприимчивости к Staphylococcus aureus в педиатрической популяции США. Педиатрия . 2016 г. 1 марта [Medline].
Смит Дж., Согаард М., Шёнхейдер Х.С., Нильсен Х., Фрослев Т., Томсен Р.В. Диабет и риск внебольничной бактериемии Staphylococcus aureus: популяционное исследование случай-контроль. Eur J Эндокринол . 2016 г. 10 марта [Medline].
Давенпорт Л. Пациенты с диабетом с повышенным риском заражения крови S aureus. Медицинские новости Medscape. Доступно на http://www.medscape.com/viewarticle/860376.15 марта 2016 г .; Доступ: 27 апреля 2016 г.
Saxena S, Thompson P, Birger R, Bottle A, Spyridis N, Wong I. Увеличение кожных инфекций и осложнений Staphylococcus aureus у детей, Англия, 1997-2006 гг. Emerg Infect Dis . 2010 марта 16 (3): 530-533. [Медлайн].
Otter JA, French GL. Молекулярная эпидемиология ассоциированного с сообществами метициллин-устойчивого Staphylococcus aureus в Европе. Ланцет Infect Dis . 2010 апр.10 (4): 227-239. [Медлайн].
Lessa FC, Mu Y, Davies J, Murray M, Lillie M, Pearson A. Сравнение частоты инфицирования кровотока метициллин-резистентным золотистым стафилококком между Англией и США, 2006-2007 гг. Clin Infect Dis . 15 октября 2010 г. 51 (8): 925-8. [Медлайн].
Голдинг Г.Р., Леветт П.Н., Макдональд Р.Р., Ирвин Дж., Куинн Б., Нсунгу М. Высокие показатели инфекции Staphylococcus aureus USA400, Северная Канада. Emerg Infect Dis . 2011 Апрель 17 (4): 722-5. [Медлайн].
Голдинг Г.Р., Леветт П.Н., Макдональд Р.Р., Ирвин Дж., Нсунгу М., Вудс С. и др. Сравнение факторов риска, связанных с устойчивыми к метициллину и восприимчивыми к метициллину инфекциями Staphylococcus aureus в отдаленных районах. Эпидемиол. Инфекция . 2010 май. 138 (5): 730-7. [Медлайн].
Ким Дж., Феррато С., Голдинг Г. Р., Малви М. Р., Симмондс К. А., Свенсон Л. В. и др.Изменение эпидемиологии метициллин-устойчивого золотистого стафилококка в Альберте, Канада: популяционный эпиднадзор, 2005-2008 гг. Эпидемиол. Инфекция . 2010 21 сентября. 1-10. [Медлайн].
Matlow A, Forgie S, Pelude L, Embree J, Gravel D, Langley JM и др. Национальное наблюдение за устойчивым к метициллину Staphylococcus aureus среди госпитализированных педиатрических пациентов в канадских учреждениях неотложной помощи, 1995-2007 гг. Pediatr Infect Dis J . 2012 31 августа (8): 814-20.[Медлайн].
Алесана-Слейтер Дж., Ричи С.Р., Хеффернан Х., Лагерь Т., Ричардсон А., Гербисон П., Staphylococcus aureus, устойчивый к метициллину, Самоа, 2007-2008 гг. Emerg Infect Dis . 2011 июн.17 (6): 1023-9. [Медлайн].
Сузуки М., Ямада К., Нагао М., Аоки Е., Мацумото М., Хираяма Т. и др. Противомикробные мази и устойчивый к метициллину Staphylococcus aureus USA 300. Emerg Infect Dis . 2011 17 (10) октября: 1917-20. [Медлайн].
Тонг С.Ю., Епископ Э.Дж., Лиллибридж Р.А. и др. Связанные с сообществами штаммы устойчивых к метициллину Staphylococcus aureus и чувствительных к метициллину S. aureus у коренных жителей Северной Австралии: эпидемиология и результаты. J Заразить Dis . 2009 15 мая. 199 (10): 1461-70. [Медлайн].
Salmenlinna S, Lyytikainen O, Vainio A, Myllyniemi AL, Raulo S, Kanerva M, et al. Случаи заболевания человека метициллин-резистентным золотистым стафилококком CC398, Финляндия. Emerg Infect Dis . 2010 16 октября (10): 1626-9. [Медлайн].
Tappe D, Schulze MH, Oesterlein A, Turnwald D, Müller A, Vogel U, et al. Пантон-Валентайн, лейкоцидин-положительные инфекции Staphylococcus aureus у возвращающихся путешественников. Am J Trop Med Hyg . 2010 Октябрь 83 (4): 748-50. [Медлайн]. [Полный текст].
Чуа К., Лоран Ф., Кумбс Дж., Грейсон М.Л., Хауден Б.П. Не связанный с сообществом устойчивый к метициллину Staphylococcus aureus (CA-MRSA)! Руководство клинициста по сообществу MRSA — его развивающаяся устойчивость к противомикробным препаратам и последствия для терапии. Clin Infect Dis . 2011 Январь 52 (1): 99-114. [Медлайн].
Никерсон EK, Wuthiekanun V, Kumar V, Amornchai P, Wongdeethai N, Chheng K. Появление связанного с сообществом метициллин-устойчивого носительства золотистого стафилококка у детей в Камбодже. Am J Trop Med Hyg . 2011 Февраль 84 (2): 313-7. [Медлайн].
Hamdan-Partida A, Sainz-Espuñes T, Bustos-Martínez J. Характеристика и устойчивость штаммов Staphylococcus aureus, выделенных из передних ноздрей и глотки здоровых носителей в мексиканском сообществе. Дж. Клин Микробиол . 2010 май. 48 (5): 1701-5. [Медлайн].
Muttaiyah S, Coombs G, Pandey S, Reed P, Ritchie S, Lennon D, et al. Заболеваемость, факторы риска и исходы инфекций Staphylococcus aureus, чувствительных к метициллину, чувствительных к метициллину, по шкале Пантон-Валентайн, в Окленде, Новая Зеландия. Дж. Клин Микробиол . 2010 Октябрь 48 (10): 3470-4. [Медлайн]. [Полный текст].
Адлер А., Гивон-Лави Н., Моисей А.Е., Блок C, Даган Р. Носительство связанного с сообществом метициллин-устойчивого золотистого стафилококка в когорте младенцев на юге Израиля: факторы риска и молекулярные особенности. Дж. Клин Микробиол . 2010 Февраль 48 (2): 531-8. [Медлайн]. [Полный текст].
Васька В.Л., Гримвуд К., Голе Г.А., Ниммо Г.Р., Патерсон Д.Л., Ниссен М.Д. Связанный с сообществом метициллин-устойчивый золотистый стафилококк, вызывающий орбитальный целлюлит у детей Австралии. Pediatr Infect Dis J . 2011 30 ноября (11): 1003-1006. [Медлайн].
Марра Ф., Патрик Д.М., Чонг М., Маккей Р., Хоанг Л., Боуи В. Р.. Популяционное исследование увеличения частоты инфекций кожи и мягких тканей и связанного с ними использования противомикробных препаратов. Противомикробные агенты Chemother . 2012 декабрь 56 (12): 6243-9. [Медлайн]. [Полный текст].
Jenkins TC, Sabel AL, Sarcone EE, Price CS, Mehler PS, Burman WJ. Инфекции кожи и мягких тканей, требующие госпитализации в академическом медицинском центре: возможности для управления антимикробными препаратами. Clin Infect Dis . 15 октября 2010 г. 51 (8): 895-903. [Медлайн].
Spellberg B. Инфекции кожи и мягких тканей: современная эволюция древней проблемы. Clin Infect Dis . 15 октября 2010 г. 51 (8): 904-6. [Медлайн]. [Полный текст].
Каррильо-Маркес М.А., Халтен К.Г., Хаммерман В., Ламберт Л., Мейсон Е.О., Каплан С.Л. Staphylococcus aureus Пневмония у детей в эпоху внебольничной устойчивости к метициллину в Детской больнице Техаса. Pediatr Infect Dis J . 2011 июл.30 (7): 545-50. [Медлайн].
Вандер Хаве К.Л., Кармазин Б., Верма М., Кейрд М.С., Хенсингер Р.Н., Фарли Ф.А.Связанный с сообществом метициллин-устойчивый золотистый стафилококк при острой скелетно-мышечной инфекции у детей: правила игры. J Педиатр Ортоп . 2009 29 декабря (8): 927-31. [Медлайн].
Fretzayas A, Moustaki M, Tsagris V, Brozou T., Nicolaidou P. Пузырьковый дистальный дактилит MRSA и обзор зарегистрированных случаев. Педиатр дерматол . 2011 июл-авг. 28 (4): 433-5. [Медлайн].
Каррильо-Маркес М.А., Халтен К.Г., Хаммерман В., Мейсон Е.О., Каплан С.Л.USA300 является преобладающим генотипом, вызывающим септический артрит Staphylococcus aureus у детей. Pediatr Infect Dis J . 2009 28 декабря (12): 1076-80. [Медлайн].
Carrillo-Marquez MA, Hulten KG, Mason EO, Kaplan SL. Клиническая и молекулярная эпидемиология Staphylococcus aureus катетер-ассоциированной бактериемии у детей. Pediatr Infect Dis J . 2010 май. 29 (5): 410-4. [Медлайн].
Jacobson JA, Kasworm E, Daly JA. Риск развития синдрома токсического шока, связанного с токсином 1 синдрома токсического шока, после негенитальной стафилококковой инфекции. Ред. Заразить Dis . 1989 Янв-Фев. 11 Дополнение 1: S8-13. [Медлайн].
Джон С.К., Нирманн М., Шарон Б., Петерсон М.Л., Кранц Д.М., Шливерт П.М. Синдром стафилококкового токсического шока, эритродермия ассоциируется с суперантигенностью и гиперчувствительностью. Clin Infect Dis . 2009 15 декабря. 49 (12): 1893-6. [Медлайн]. [Полный текст].
Рамирес-Шремпп Д., Дорфман Д.Х., Бейкер В.Е., Литепло А.С. Аппликации УЗИ мягких тканей в педиатрическом отделении неотложной помощи: сливать или не сливать ?. Скорая педиатрическая помощь . 2009 25 января (1): 44-8. [Медлайн].
Sivitz AB, Lam SH, Ramirez-Schrempp D, Valente JH, Nagdev AD. Влияние прикроватного ультразвука на лечение инфекции мягких тканей у детей. J Emerg Med . 2010 ноябрь 39 (5): 637-43. [Медлайн].
Кори ГР. Бактериемия и эндокардит Staphylococcus aureus: роль диагностической оценки. Инфекция Dis Clin Pract . 2011/09. 19 (5): 307-312.
Kaasch AJ, Fowler VG Jr, Rieg S, Peyerl-Hoffmann G, Birkholz H, Hellmich M, et al.Использование простого набора критериев для ведения эхокардиографии при нозокомиальной бактериемии Staphylococcus aureus. Clin Infect Dis . 2011 июл 1. 53 (1): 1-9. [Медлайн]. [Полный текст].
Сориано А., Менса Дж. Обязательна ли чреспищеводная эхокардиография при внутрибольничной бактериемии Staphylococcus aureus ?. Clin Infect Dis . 2011 г. 1. 53 (1): 10-2. [Медлайн].
Showler A, Burry L, Bai AD, Steinberg M, Ricciuto DR, Fernandes T, et al.Использование трансторакальной эхокардиографии в лечении бактериемии Staphylococcus aureus с низким риском: результаты ретроспективного многоцентрового когортного исследования. JACC Cardiovasc Imaging . 2015 8 июля [Medline].
Боггс В. Трансторакальная эхокардиография, достаточная для исключения инфекционного эндокардита. http://www.medscape.com/viewarticle/848780. Доступно на http://www.medscape.com/viewarticle/848780. 30 июля 2015 г .; Доступ: 7 августа 2015 г.
Патель Уайли Ф, Каплан С.Л., Мейсон Е.О., Аллен СН.Аспирация игл для этиологической диагностики детей с целлюлитом в эпоху внебольничного метициллинрезистентного Staphylococcus aureus. Clin Pediatr (Phila) . 2011 июн. 50 (6): 503-7. [Медлайн].
Duong M, Markwell S, Peter J, Barenkamp S. Рандомизированное контролируемое исследование антибиотиков при лечении внебольничных кожных абсцессов у педиатрических пациентов. Энн Эмерг Мед . 2010 май. 55 (5): 401-7. [Медлайн].
Ли М.С., Риос А.М., Атен М.Ф., Мехиас А., Кавуоти Д., Маккракен Г.Х. младший и др.Лечение и исходы у детей с абсцессами кожи и мягких тканей, вызванными внебольничным метициллин-устойчивым золотистым стафилококком. Pediatr Infect Dis J . 2004 г., 23 (2): 123-7. [Медлайн].
Раджендран П.М., Янг Д., Маурер Т., Чемберс Х., Пердро-Ремингтон Ф., Ро П. Рандомизированное двойное слепое плацебо-контролируемое исследование цефалексина для лечения неосложненных кожных абсцессов в популяции, подверженной риску внебольничного метициллина -резистентная инфекция Staphylococcus aureus. Противомикробные агенты Chemother . 2007 ноябрь 51 (11): 4044-8. [Медлайн].
Ruhe JJ, Smith N, Bradsher RW, Menon A. Возникшие в сообществе устойчивые к метициллину инфекции кожи и мягких тканей Staphylococcus aureus: влияние антимикробной терапии на результат. Clin Infect Dis . 2007 15 марта. 44 (6): 777-84. [Медлайн].
Karchmer AW. Бактериемия Staphylococcus aureus и эндокардит нативного клапана: роль антимикробной терапии. Инфекция Dis Clin Pract . Март 2012. 20 (2): 100-108.
Chen AE, Carroll KC, Diener-West M, Ross T., Ordun J, Goldstein MA, et al. Рандомизированное контролируемое испытание цефалексина по сравнению с клиндамицином при неосложненных кожных инфекциях у детей. Педиатрия . 2011 Март 127 (3): e573-80. [Медлайн].
McNamara WF, Хартин CW младший, Escobar MA, Yamout SZ, Lau ST, Lee YH. Альтернатива открытому разрезу и дренажу при внебольничных абсцессах мягких тканей у детей. J Педиатр Хирург . 2011 Март 46 (3): 502-6. [Медлайн].
Келлер ДМ. Схема Staph aureus сокращает хирургическую инфекцию. Медицинские новости Medscape. Доступно на http://www.medscape.com/viewarticle/833457. Доступ: 19 октября 2014 г.
Schweizer M, et al. Многоцентровое вмешательство для снижения инфекций в области хирургического вмешательства у пациентов, перенесших операции на сердце и тотальную артропластику суставов (STOP SSI STUDY). Доклад, представленный на IDWeek; 8-12 октября 2014 г .; Филадельфия, Пенсильвания.[Полный текст].
Смит Дж., Лопес-Кортес Л.Е., Томсен Р.В., Шёнхейдер Х.С., Нильсен Х., Фрослев Т. и др. Использование статинов и риск внебольничной бактериемии Staphylococcus aureus: популяционное исследование «случай-контроль». Mayo Clin Proc . 2017 Октябрь 92 (10): 1469-1478. [Медлайн].
Брукс М. Статины могут помочь защититься от бактериемии S aureus. Новости Medscape. Доступно по адресу https://www.medscape.com/viewarticle/887676#vp_1. 26 октября 2017 г .; Доступ: 1 ноября 2017 г.
Nailor MD, Sobel JD. Антибиотики от грамположительных бактериальных инфекций: ванкомицин, тейкопланин, хинупристин / далфопристин, оксазолидиноны, даптомицин, далбаванцин и телаванцин. Infect Dis Clin N Am . Dec 2009. 23 (4): 965-82.
Thwaites GE, Edgeworth JD, Gkrania-Klotsas E, Kirby A, Tilley R, Török ME. Клиническое лечение бактериемии Staphylococcus aureus. Ланцет Infect Dis . 2011 марта, 11 (3): 208-222.[Медлайн].
Weisman LE, Thackray HM, Steinhorn RH, Walsh WF, Lassiter HA, Dhanireddy R, et al. Рандомизированное исследование моноклональных антител (пагибаксимаб) для предотвращения стафилококкового сепсиса. Педиатрия . 2011 августа 128 (2): 271-9. [Медлайн].
Jimenez-Truque N, Thomsen I, Saye E, Creech CB. Следует ли нацеливать более высокие минимальные уровни ванкомицина на инвазивные внебольничные метициллин-резистентные инфекции Staphylococcus aureus у детей? Pediatr Infect Dis J . 2010 Апрель 29 (4): 368-70. [Медлайн].
Агуадо Дж. М., Сан-Хуан Р., Лалуэса А., Санс Ф., Родригес-Отеро Дж., Гомес-Гонсалес С. и др. Высокий МПК ванкомицина и осложненная метициллин-чувствительная бактериемия золотистого стафилококка. Emerg Infect Dis . 2011 июн.17 (6): 1099-102. [Медлайн].
Любин А.С., Снайдман Д.Р., Рутазер Р., Биде П., Голан Ю. Прогнозирование высокой минимальной ингибирующей концентрации ванкомицина при инфекциях кровотока, вызванных устойчивостью к метициллину Staphylococcus aureus. Clin Infect Dis . 2011 г. 15 апреля. 52 (8): 997-1002. [Медлайн].
Куллар Р., Дэвис С.Л., Левин Д.П., Рыбак М.Дж. Влияние ванкомицина на исходы у пациентов с метициллин-резистентной бактериемией Staphylococcus aureus: поддержка согласованных руководящих принципов предлагает целевые показатели. Clin Infect Dis . 2011 г. 15 апреля. 52 (8): 975-81. [Медлайн].
Патель Н, Пай М.П., Родволд К.А., Ломаэстро Б., Друсано Г.Л., Лодизе Т.П. Ванкомицин: отсюда нам не добраться. Clin Infect Dis . 2011 г. 15 апреля. 52 (8): 969-74. [Медлайн].
van Hal SJ, Lodise TP, Paterson DL. Клиническое значение минимальной ингибирующей концентрации ванкомицина при инфекциях, вызванных Staphylococcus aureus: систематический обзор и метаанализ. Clin Infect Dis . 2012 Март 54 (6): 755-71. [Медлайн].
Дересински С. Метициллин-устойчивый золотистый стафилококк и ванкомицин: минимальная ингибирующая концентрация имеет значение. Clin Infect Dis . 2012 марта 54 (6): 772-4. [Медлайн].
Wunderink RG, Niederman MS, Kollef MH, Shorr AF, Kunkel MJ, Baruch A, et al. Линезолид при нозокомиальной пневмонии, устойчивой к метициллину Staphylococcus aureus: рандомизированное контролируемое исследование. Clin Infect Dis . 2012 марта 54 (5): 621-9. [Медлайн].
Рамирес П., Фернандес-Барат Л., Торрес А. Новые варианты лечения MRSA с респираторной инфекцией / пневмонией. Curr Opin Infect Dis .2012 Апрель 25 (2): 159-65. [Медлайн].
Morales G, Picazo JJ, Baos E, Candel FJ, Arribi A, Pelaez B. Устойчивость к линезолиду опосредуется геном cfr в первом сообщении о вспышке устойчивого к линезолиду Staphylococcus aureus. Clin Infect Dis . 2010 15 марта. 50 (6): 821-5. [Медлайн].
Санчес Гарсия М., Де ла Торре М.А., Моралес Г. и др. Клиническая вспышка линезолид-устойчивого золотистого стафилококка в отделении интенсивной терапии. JAMA . 9 июня 2010 г. 303 (22): 2260-4. [Медлайн].
Prokocimer P, De Anda C, Fang E, Mehra P, Das A. Тедизолид фосфат против линезолида для лечения острых бактериальных инфекций кожи и кожных структур: рандомизированное исследование ESTABLISH-1. JAMA . 2013 13 февраля. 309 (6): 559-69. [Медлайн].
Prokocimer P, Bien P, Deanda C, Pillar CM, Bartizal K. Активность тедизолида (TR-700) и микробиологическая эффективность in vitro в отношении грамположительных клинических изолятов из исследования фазы 2 перорального приема тедизолид фосфата (TR-701) у пациентов с осложненными инфекциями кожи и кожных структур. Противомикробные агенты Chemother . 2012 Сентябрь 56 (9): 4608-13. [Медлайн]. [Полный текст].
Prokocimer P, De Anda C, Fang E, Mehra P, Das A. Тедизолид фосфат против линезолида для лечения острых бактериальных инфекций кожи и кожных структур: рандомизированное исследование ESTABLISH-1. JAMA . 2013 13 февраля. 309 (6): 559-69. [Медлайн].
Moran GJ, Fang E, Corey GR, Das AF, De Anda C, Prokocimer P. Тедизолид в течение 6 дней по сравнению с линезолидом в течение 10 дней при острых бактериальных инфекциях кожи и структур кожи (ESTABLISH-2): рандомизированный, двойной слепое, фаза 3, испытание не меньшей эффективности. Ланцет Infect Dis . 2014 5 июня. [Medline].
Lowes, R. Новый антибиотик тедизолид (Sivextro), одобренный FDA. Медицинские новости Medscape. Доступно на http://www.medscape.com/viewarticle/827168. Дата обращения: 26 июня 2014 г.
Saravolatz LD, Stein GE, Johnson LB. Телаванцин: новый липогликопептид. Clin Infect Dis . 2009 15 декабря. 49 (12): 1908-14. [Медлайн].
Брукс М. FDA разрешает Оритаванцин (Orbactiv) при кожных инфекциях. Medscape Medical News . 7 августа 2014 г. [Полный текст].
Moellering RC, Jr, Ferraro MJ. Оритаванцин для лечения серьезных грамположительных инфекций. Clin Infect Dis . 15 апреля 2012 г. 54 (Дополнение 3): S201-S243.
Кори Г.Р., Уилкокс М., Талбот Г.Х. и др. Комплексный анализ CANVAS 1 и 2: многоцентровые рандомизированные двойные слепые исследования фазы 3 для оценки безопасности и эффективности цефтаролина по сравнению с ванкомицином плюс азтреонам при осложненной инфекции кожи и кожных структур. Clin Infect Dis . 2010 15 сентября. 51 (6): 641-50. [Медлайн].
Saravolatz LD, Stein GE, Johnson LB. Цефтаролин: новый цефалоспорин с активностью против метициллин-резистентного золотистого стафилококка. Clin Infect Dis . 2011 Май. 52 (9): 1156-63. [Медлайн].
Камедь JG. Цефтаролин фосамил: цефалоспорин широкого спектра действия с метициллин-резистентной активностью золотистого стафилококка. Инфекция Dis Clin Pract .Март 2012. 20 (2): 122-130.
Фаррелл DJ, Castanheira M, Mendes RE, Sader HS, Jones RN. Активность цефтаролина in vitro против Staphylococcus aureus и Streptococcus pneumoniae с множественной лекарственной устойчивостью: обзор опубликованных исследований и программы наблюдения AWARE (2008-2010). Clin Infect Dis . 2012 сентябрь 55 Приложение 3: S206-14. [Медлайн].
Sader HS, Flamm RK, Farrell DJ, Jones RN. Анализ активности изолятов стафилококка от детей, взрослых и пожилых пациентов: Программа наблюдения за цефтаролином AWARE. Clin Infect Dis . 2012 сентябрь 55 Приложение 3: S181-6. [Медлайн].
Jones RN, Mendes RE, Sader HS, Castanheira M. Результаты антимикробных исследований in vitro фузидовой кислоты против современных (2008-2009 гг.) Грамположительных организмов, собранных в Соединенных Штатах. Clin Infect Dis . 2011 июн. 52 Приложение 7: S477-86. [Медлайн].
Craft JC, Moriarty SR, Clark K, Scott D, Degenhardt TP, Still JG. Рандомизированное двойное слепое исследование фазы 2, сравнивающее эффективность и безопасность перорального режима ударной дозы фузидиевой кислоты с пероральным линезолидом для лечения острых бактериальных инфекций кожи и кожных структур. Clin Infect Dis . 2011 июн. 52 Приложение 7: S520-6. [Медлайн].
Фернандес П., Перейра Д. Усилия по поддержке разработки фузидовой кислоты в США. Clin Infect Dis . 2011 июн. 52 Приложение 7: S542-6. [Медлайн].
Lee AS, Macedo-Vinas M, François P, Renzi G, Schrenzel J, Vernaz N. Влияние комбинированной низкоуровневой устойчивости к мупироцину и генотипической хлоргексидину на стойкое носительство метициллин-устойчивого Staphylococcus aureus после деколонизирующей терапии: исследование случай-контроль . Clin Infect Dis . 2011 г. 15 июня. 52 (12): 1422-30. [Медлайн].
Джейн Р., Кралович С.М., Эванс М.Э. и др. Инициатива по делам ветеранов по профилактике метициллин-резистентных инфекций Staphylococcus aureus. N Engl J Med . 2011 г., 14 апреля. 364 (15): 1419-30. [Медлайн].
Robotham JV, Graves N, Cookson BD, Barnett AG, Wilson JA, Edgeworth JD. Стратегии скрининга, изоляции и деколонизации в борьбе с метициллин-резистентным Staphylococcus aureus в отделениях интенсивной терапии: оценка экономической эффективности. BMJ . 2011. 343: d5694. [Медлайн].
Simor AE. Стафилококковая деколонизация: эффективная стратегия профилактики инфекции ?. Ланцет Infect Dis . 2011 Декабрь 11 (12): 952-62. [Медлайн].
Фриц С.А., Хоган П.Г., Хайек Г., Эйзенштейн К.А., Родригес М., Эпплин Е.К. и др. Домашние и индивидуальные подходы к искоренению связанного с сообществом Staphylococcus aureus у детей: рандомизированное исследование. Clin Infect Dis .2012 Март 54 (6): 743-51. [Медлайн]. [Полный текст].
Миллер LG. Где мы находимся в области профилактики золотистого стафилококка, связанного с сообществами, — а пока что мы говорим нашим пациентам ?. Clin Infect Dis . 2012 марта 54 (6): 752-4. [Медлайн].
Kling J. Скрининг методом ПЦР сокращает внутрибольничную инфекцию. Medscape Medical News . 14 мая 2013 г. [Полный текст].
Милстон AM, Голднер Б.В., Росс Т., Шепард Дж.В., Кэрролл К.С., Perl TM.Колонизация метициллин-резистентного золотистого стафилококка и риск последующей инфекции у тяжелобольных детей: важность предотвращения внутрибольничной передачи метициллин-резистентного золотистого стафилококка. Clin Infect Dis . 2011 ноябрь 53 (9): 853-9. [Медлайн]. [Полный текст].
Хуанг С.С., Септимус Э., Клейнман К., Муди Дж., Хикок Дж., Эйвери Т.Р. и др. Целенаправленная и универсальная деколонизация для предотвращения инфекции в отделениях интенсивной терапии. N Engl J Med . 2013 29 мая.[Медлайн].
Эдмонд МБ, Венцель Р.П. Скрининг стационарных пациентов на MRSA — Дело закрыто. N Engl J Med . 2013 29 мая. [Medline].
Laidman J. MRSA: Универсальный скрининг и изоляция ритмов деколонизации. Медицинские новости Medscape. Доступно на http://www.medscape.com/viewarticle/805005. Доступ: 11 июня 2013 г.
Шеной Е.С., Ким Дж., Розенберг Е.С., Коттер Дж. А., Ли Х., Валенски Р.П. и др. Прекращение контактных мер предосторожности в отношении метициллин-устойчивого Staphylococcus aureus: рандомизированное контролируемое испытание, сравнивающее пассивный и активный скрининг с культивированием и полимеразной цепной реакцией. Clin Infect Dis . 2013 июль 57 (2): 176-84. [Медлайн]. [Полный текст].
Lin Y-C, Петерсон М.Л. Новые взгляды на профилактику стафилококковых инфекций и синдрома токсического шока. Эксперт Рев Клин Фармакол . 2010. 3: 753-767.
Худа Т., Наир Х, Теодорату Э, Згага Л., Фаттом А, Эль Арифин С. и др. Оценка новых вакцин и иммунотерапии против стафилококковой пневмонии у детей. BMC Public Health .2011 г., 13 апреля. 11 Прил. 3: S27. [Медлайн]. [Полный текст].
Даум Р.С., Спеллберг Б. Прогресс в создании вакцины против золотистого стафилококка. Clin Infect Dis . 2012 Февраль 54 (4): 560-7. [Медлайн].
Theilacker C, Kropec A, Hammer F, Sava I, Wobser D, Sakinc T. Защита от золотистого стафилококка с помощью антител к полиглицеринфосфатной основе гетерологичной липотейхоевой кислоты. J Заразить Dis . 2012 Апрель 205 (7): 1076-85.[Медлайн].
Проктор Р.А. Проблемы универсальной вакцины против Staphylococcus aureus. Clin Infect Dis . 2012 апр. 54 (8): 1179-86. [Медлайн].
Андерсон А.С., Скалли И.Л., Тимофеева Ю., Мерфи Е., Макнил Л.К., Мининни Т. и др. Staphylococcus aureus Транспортный белок C марганца — это высококонсервативный белок клеточной поверхности, который вызывает защитный иммунитет против S. aureus и Staphylococcus epidermidis. J Заразить Dis .2012 июн.205 (11): 1688-96. [Медлайн]. [Полный текст].
Fritz SA, Tiemann KM, Hogan PG, Epplin EK, Rodriguez M, Al-Zubeidi DN, et al. Серологический коррелят защитного иммунитета против внебольничной инфекции Staphylococcus aureus. Clin Infect Dis . 2013 июнь 56 (11): 1554-61. [Медлайн]. [Полный текст].
McNeil JC, Hulten KG, Kaplan SL, Mahoney DH, Mason EO. Инфекции, вызванные Staphylococcus aureus у больных детской онкологией: высокие показатели устойчивости к противомикробным препаратам, антисептическая толерантность и осложнения. Pediatr Infect Dis J . 2013 Февраль 32 (2): 124-8. [Медлайн].
Крил AM, Дарем SH, Беннер KW, Альтен JA, Винклер MK. Тяжелые инвазивные внебольничные метициллин-резистентные инфекции Staphylococcus aureus у ранее здоровых детей. Pediatr Crit Care Med . 2009 Май. 10 (3): 323-7. [Медлайн].
Vergnano S, Menson E, Smith Z, Kennea N, Embleton N, Clarke P. Характеристики инвазивного Staphylococcus aureus в неонатальных отделениях Соединенного Королевства. Pediatr Infect Dis J . 2011 30 октября (10): 850-4. [Медлайн].
Мениф К., Бузири А., Халди А., Хамди А., Бельхадж С., Борги А. и др. Связанные с сообществом метициллинрезистентные инфекции Staphylococcus aureus в педиатрическом отделении интенсивной терапии. J Infect Dev Ctries . 2011 12 августа. 5 (8): 587-91. [Медлайн].
Генрих Н., Мюллер А., Бартманн П., Саймон А., Бирбаум Г., Энгельхарт С. Успешное ведение вспышки MRSA в отделении интенсивной терапии новорожденных. Eur J Clin Microbiol Infect Dis . 2011 июл.30 (7): 909-13. [Медлайн].
Woodlief RS, Markowitz JE. Нераспознанная инвазивная инфекция у новорожденного, колонизированного метициллин-резистентным золотистым стафилококком. J Педиатр . 2009 декабрь 155 (6): 943-943.e1. [Медлайн].
Арора П., Калра В.К., Паппас А. Множественные абсцессы головного мозга у новорожденного после инфицирования кровотока метициллин-резистентным золотистым стафилококком. J Педиатр .2012 Сентябрь 161 (3): 563-563.e1. [Медлайн].
Niemann S, Ehrhardt C, Medina E, Warnking K, Tuchscherr L, Heitmann V, et al. Совместное действие вируса гриппа и Staphylococcus aureus panton-valentine leukocidin вызывает тяжелое повреждение эпителия легких. J Заразить Dis . 2012 Октябрь 1. 206 (7): 1138-48. [Медлайн]. [Полный текст].
Faden H, Gill S, Lesse A. Влияние управления и бактериальной геномики на исходы бактериемии Staphylococcus aureus у детей. Clin Pediatr (Phila) . 2011 г. 17 июня [Medline].
Mejer N, Westh H, Schønheyder HC, Jensen AG, Larsen AR, Skov R, et al. Стабильная заболеваемость и постоянное снижение краткосрочной смертности от бактериемии Staphylococcus aureus в период с 1995 по 2008 год. BMC Infect Dis . 17 октября 2012 г. 12:26. [Медлайн]. [Полный текст].
Sengupta A, Rand C, Perl TM, Milstone AM. Знания, осведомленность и отношение к метициллин-устойчивому золотистому стафилококку среди лиц, ухаживающих за госпитализированными детьми. J Педиатр . 2011 Март 158 (3): 416-21. [Медлайн].
Thwaites GE, Scarborough M, Szubert A ,. Дополнительный рифампицин при бактериемии Staphylococcus aureus (ARREST): многоцентровое рандомизированное двойное слепое плацебо-контролируемое исследование. Ланцет . 2018 17 февраля. 391 (10121): 668-678. [Медлайн].
Лечение инфекций Staphylococcus aureus
1. Moreillon P, Que Y-A, Glauser MP. Золотистый стафилококк (в том числе стафилококковый токсический шок).В: Man-dell GL, Bennett JE, Dolin R, eds. Принципы и практика инфекционных заболеваний Манделла, Дугласа и Беннета. 6-е изд. Филадельфия: Elsevier Churchill Livingstone, 2005: 2321–51 ….
2. Национальная система надзора за внутрибольничными инфекциями. Отчет Национальной системы надзора за внутрибольничными инфекциями (NNIS), сводка данных с января 1992 г. по июнь 2004 г., выпущенный в октябре 2004 г. Am J Infect Control . 2004. 32: 470–85.
3. Носкин Г.А., Рубин Р.Ж., Шентаг JJ, Клюйтманс Дж., Hedblom EC, Смолдерс М, и другие.Бремя инфекций Staphylococcus aureus для больниц в США: анализ общенациональной базы данных образцов стационарных пациентов за 2000 и 2001 годы. Arch Intern Med . 2005; 165: 1756–61.
4. Камеры ВЧ. Меняющаяся эпидемиология Staphylococcus aureus? Emerg Infect Dis . 2001; 7: 178–82.
5. Наими Т.С., LeDell KH, Комо-Сабетти К, Борхардт С.М., Боксруд ди-джей, Этьен Дж., и другие.Сравнение метициллин-резистентной инфекции Staphylococcus aureus, связанной с местным населением и медико-санитарной помощью. ЯМА . 2003. 290: 2976–84.
6. Центры по контролю и профилактике заболеваний. Связанные с сообществами инфекции, вызванные устойчивостью к метициллину Staphylococcus aureus, у жителей островов Тихого океана — Гавайи, 2001–2003 гг. MMWR Morb Mortal Wkly Rep 2004; 53: 767–70. Доступ онлайн 12 октября 2005 г., по адресу: http://www.cdc.gov/mmwr/preview/mmwrhtml/mm5333a5.htm.
7. Фрэнсис Дж. С., Доэрти MC, Лопатин У, Джонстон CP, Синха Джи, Росс Т, и другие.Тяжелая внебольничная пневмония у здоровых взрослых, вызванная метициллин-резистентным золотистым стафилококком, несущим гены лейкоцидина Пантона-Валентайна. Clin Infect Dis . 2005; 40: 100–7.
8. Каплан SL. Последствия метициллин-резистентного золотистого стафилококка как внебольничного патогена у педиатрических пациентов. Инфекция Dis Clin North Am . 2005; 19: 747–57.
9. Адем П.В., Монтгомери CP, Хусейн А.Н., Куглер Т.К., Аранджелович В, Humilier M, и другие.Staphylococcus aureus sepsis и синдром Уотерхауса-Фридериксена у детей. N Engl J Med . 2005; 353: 1245–51.
10. Левин Д.П., Фромм Б.С., Редди BR. Медленный ответ на ванкомицин или ванкомицин плюс рифампицин при метициллин-резистентном эндокардите Staphylococcus aureus. Энн Интерн Мед. . 1991; 115: 674–80.
11. Лю Ц., Камеры ВЧ. Золотистый стафилококк с гетерогенной устойчивостью к ванкомицину: эпидемиология, клиническое значение и критическая оценка методов диагностики. Противомикробные агенты Chemother . 2003; 47: 3040–5.
12. Моисе-Бродер П.А., Сакулас Г, Элиопулос GM, Шен-тег JJ, Форрест А, Moellering RC Jr. Полиморфизм вспомогательного гена-регулятора группы II у метициллин-резистентного золотистого стафилококка является прогностическим признаком неэффективности терапии ванкомицином. Clin Infect Dis . 2004; 38: 1700–5.
13. Вундеринк Р.Г., Rello J, Каммарата СК, Croos-Dabrera RV, Kollef MH.Линезолид против ванкомицина: анализ двух двойных слепых исследований пациентов с метициллин-резистентной нозокомиальной пневмонией Staphylococcus aureus. Сундук . 2003; 124: 1789–97.
14. Арбейт РД, Маки Д, Tally FP, Capanaro E, Эйзенштейн Б.И. Безопасность и эффективность даптомицина для лечения сложных инфекций кожи и кожных структур. Clin Infect Dis . 2004; 38: 1673–81.
15. Льюис Дж. С., Jorgensen JH.Индуцируемая устойчивость стафилококков к клиндамицину: следует ли беспокоиться клиницистам и микробиологам? Clin Infect Dis . 2005; 40: 280–5.
16. Фаулер В.Г. Младший, Ольсен М.К., Кори Г.Р., Вудс CW, Cabell CH, Реллер Л.Б., и другие. Клинические признаки осложненной бактериемии Staphylococcus aureus. Arch Intern Med . 2003. 163: 2066–72.
17. Фаулер В.Г. Младший, Ли Дж, Кори Г.Р., Боули Дж., Марр К.А., Гопал АК, и другие.Роль эхокардиографии в оценке пациентов с бактериемией Staphylococcus aureus: опыт 103 пациентов. Джам Колл Кардиол . 1997; 30: 1072–8.
18. Розен А.Б., Фаулер В.Г. Младший, Кори Г.Р., Даунс СМ, Биддл АК, Ли Дж, и другие. Экономическая эффективность чреспищеводной эхокардиографии для определения продолжительности терапии внутрисосудистой катетер-ассоциированной бактериемии Staphylococcus aureus. Энн Интерн Мед. .1999; 130: 810–20.
19. Фаулер В.Г. Младший, Сандерс Л.Л., Секстон DJ, Kong L, Марр К.С., Гопал АК, и другие. Исход бактериемии Staphylococcus aureus с соблюдением рекомендаций инфекционистов: опыт 244 больных. Clin Infect Dis . 1998. 27: 478–86.
20. Мермель Л.А., Фарр Б.М., Шерерц Р.Дж., Раад II, О’Грэйди Н, Харрис Дж.С., и другие.Рекомендации по ведению инфекций, связанных с внутрисосудистым катетером. Clin Infect Dis . 2001; 32: 1249–72.
21. Лобати Ф, Херндон Б, Бамбергер Д. Остеомиелит: этиология, диагностика, лечение и исход в государственном и частном учреждении. Инфекция . 2001; 29: 333–6.
22. Bamberger DM. Диагностика и лечение остеомиелита. Comp Ther . 2000; 26: 89–95.
23.Le Saux N, Говард А, Барроумен, штат Нью-Джерси, Габури I, Самп-сын М, Мохер Д. Более короткие курсы парентеральной антибактериальной терапии, по-видимому, не влияют на частоту ответа у детей с острым гематогенным остеомиелитом: систематический обзор. BMC Infect Dis . 2002; 2: 16.
24. Бербари Э. Ф., Штекельберг Дж. М., Осмон ДР. Остеомиелит. В: Mandell GL, Bennet JE, Dolin R, eds. Принципы и практика инфекционных заболеваний Манделла, Дугласа и Беннета.6-е изд. Филадельфия: Elsevier Черчилль Ливингстон, 2005: 1322–1332.
25. Zimmerli W, Видмер А.Ф., Блаттер М, Фрай Р., Ochsner PE. Роль рифампицина в лечении стафилококковых инфекций, связанных с ортопедическими имплантатами: рандомизированное контролируемое исследование. ЯМА . 1998. 279: 1537–41.
26. Colice GL, Кертис А, Deslauriers J, Хеффнер Дж. Свет R, Литтенберг Б, и другие. Медикаментозное и хирургическое лечение парапневмонических выпотов: рекомендации, основанные на фактических данных [опубликованные поправки опубликованы в Chest 2001; 119: 319]. Сундук . 2000; 118: 1158–71.
27. Jensen AG, Эсперсен Ф, Скинхой П, Росдаль ВТ, Фримодт-Мёллер Н. Менингит, вызванный золотистым стафилококком. Обзор 104 последовательных дел по всей стране. Arch Intern Med . 1993; 153: 1902–8.
28. Бамбергер DM. Результат лечения бактериальных абсцессов без терапевтического дренирования: обзор случаев, описанных в литературе. Clin Infect Dis .1996; 23: 592–603.
29. Бойс Дж. М., Хэвилл Н.Л., Кохан С, Думиган Д.Г., Ligi CE. Работают ли меры инфекционного контроля в отношении метициллин-устойчивого золотистого стафилококка? Инфекционный контроль Hosp Epidemiol . 2004. 25: 395–401.
30. Купер Б.С., Камень SP, Кибблер СС, Куксон Б.Д., Робертс Дж. А., Medley GF, г. и другие. Меры изоляции в больничном ведении метициллин-резистентного золотистого стафилококка (MRSA): систематический обзор литературы. BMJ . 2004; 329: 533.
31. Cepeda JA, Белый дом Т, Купер Б, Привет J, Джонс К., Кваку Ф, и другие. Изоляция пациентов в отдельных палатах или когортах для уменьшения распространения MRSA в отделениях интенсивной терапии: проспективное двухцентровое исследование. Ланцет . 2005; 365: 295–304.
32. Доббелинг Б.Н., Рейган Д.Р., Пфаллер М.А., Хьюстон AK, Холлис Р.Дж., Венцель Р.П. Долгосрочная эффективность интраназальной мази мупироцина.Проспективное когортное исследование носительства Staphylococcus aureus. Arch Intern Med . 1994; 154: 1505–8.
33. Perl TM, Каллен Дж. Дж., Венцель Р.П., Циммерман М.Б., Пфаллер М.А., Шеппард Д, и другие. Мупироцин интраназально для профилактики послеоперационных инфекций, вызванных Staphylococcus aureus. N Engl J Med . 2002; 346: 1871–7.
34. Вертхайм HF, Vos MC, г. Отт А, Восс А, Клюйтманс Я.А., Vandenbroucke-Grauls CM, и другие.Профилактика мупироцином против нозокомиальных инфекций Staphylococcus aureus у нехирургических пациентов: рандомизированное исследование. Энн Интерн Мед. . 2004. 140: 419–25.
35. Леб М, Главный C, Уокер-Дилкс С, Иди А. Противомикробные препараты для лечения колонизации устойчивым к метициллину Staphylococcus aureus. Кокрановская база данных Syst Rev . 2003; (4): CD003340.
Как лучше всего лечить взрослого пациента с бактериемией Staphylococcus aureus?
В недавнем проспективном когортном исследовании в центре третичной медицинской помощи, даже после поправки на ранее существовавшие сопутствующие заболевания и тяжесть заболевания, консультация по ID была связана со снижением 28-дневной смертности на 56%.
Корпус
82-летний мужчина с неходжкинской лимфомой в стадии ремиссии, с застойной сердечной недостаточностью и гипертонией в анамнезе. В течение недели страдает генерализованным недомоганием и перемежающейся лихорадкой. Жизненно важные органы показывают температуру 101 ° F, артериальное давление 130/60 мм рт.ст. и частоту сердечных сокращений 100. Его осмотр отличается эритематозным и болезненным участком порта на груди, без шума. Культуры крови, взятые при предъявлении, показывают грамположительные кокки, специфичные для Staphylococcus aureus. Каковы следующие шаги в ведении этого пациента?
Обзор
С.Бактериемия aureus (SAB) является распространенной инфекционной причиной заболеваемости и смертности во всем мире, вызывая как внебольничную, так и внутрибольничную бактериемию. Только в США он составляет 23% всех инфекций кровотока и является бактериальным патогеном, наиболее сильно связанным со смертью. 1 Показатели смертности составляют примерно 42% у пациентов с метициллин-резистентной бактериемией S. aureus (MRSA) и 28% у пациентов с метициллин-чувствительной бактериемией S. aureus (MSSA). 2
Признавая серьезность SAB, Американское общество инфекционных болезней (IDSA) опубликовало в 2011 году рекомендации по лечению, чтобы помочь направить клиническое лечение этого заболевания. 3 Однако большинство рекомендаций основано на наблюдательных исследованиях и мнениях экспертов, поскольку менее 1500 пациентов были включены в рандомизированные контролируемые испытания, специально нацеленные на изучение лечения САБ. 4
Обзор данных
Клинически значимый САБ обычно определяется как выделение S. aureus из посева венозной крови со связанными симптомами и признаками системной инфекции.5 Поскольку контаминация САБ встречается редко и может быть связана с множественными осложнениями, включая метастатические инфекции, эмболический инсульт, рецидивирующая инфекция и смерть, к любому положительному результату посева крови следует относиться серьезно. 4
Лечение SAB многогранно и должно быть сосредоточено на удалении любых очагов инфекции, таких как катетер или протез, использовании длительной антимикробной терапии и оценке потенциальных осложнений. В ретроспективном исследовании Johnson et al. Показали, что неспособность удалить источник является одним из самых сильных независимых предикторов рецидива у пациентов с SAB. 6 Однако от 10% до 40% пациентов не имеют определенного фокуса, что увеличивает стимул для оценки осложнений. 7-8 В целом, примерно у одной трети пациентов с SAB развиваются метастатические осложнения либо из-за гематогенного посева, либо из-за местного распространения инфекции. 9
Помимо пожилого возраста и таких коморбидных состояний, как цирроз, самым сильным предиктором осложнений является положительный посев крови через 48-96 часов после первоначального положительного посева крови, как показано в большом проспективном когортном исследовании Fowler et al. al. 7,10-11 Дополнительные независимые факторы риска (см. Таблицу 1) включают заражение в сообществе (вероятно, из-за длительного периода бактериемии), обследование кожи, указывающее на наличие острой системной инфекции, и стойкую лихорадку через 72 часа после первого положительного анализа крови. культура.Пациенты с хотя бы одним из этих факторов риска имеют высокий риск осложненного течения (который встречается примерно у 35%). В исследовании «случай-контроль» Chihara et al. Показали, что бактериурия S. aureus при отсутствии патологии мочевыводящих путей или недавнего инструментария мочевыводящих путей может быть связана с трехкратным увеличением смертности по сравнению с пациентами без бактериурии, даже после поправки на сопутствующие состояния. 12
Противомикробное лечение
Первоначальный выбор антибиотикотерапии для SAB должен учитывать распространенность MRSA в сообществе и больнице.Если подозрение на MRSA достаточно велико, рекомендации IDSA 2011 года предлагают лечение ванкомицином или даптомицином. 3 Несмотря на то, что опубликованных РКИ в поддержку определенной схемы приема антибиотиков нет, существуют испытания, позволяющие предположить, что отсрочка в лечении может нанести вред. Одно исследование, проведенное Lordis et al., Показало, что задержка в лечении, определяемая лечением через 44,75 часа, была связана с более длительным пребыванием в больнице, при этом группа отсроченного лечения была госпитализирована на 20,2 дня, а группа раннего лечения была госпитализирована на 14 дней. .3 дня. 13 Задержка в лечении также оказалась независимым предиктором смертности. 13
Когда чувствительность известна, важно правильно подобрать антибиотики, так как исследования показали более низкую частоту неудач лечения с использованием бета-лактамных антибиотиков по сравнению с эмпирическим охватом MRSA. 14-15 В одном проспективном исследовании 123 гемодиализных пациентов с бактериемией MSSA Stryjewski et al. Показали, что пациенты, получавшие ванкомицин, имели более высокий риск неудачи лечения, чем те, кто получал цефазолин. 15 В другом проспективном обсервационном исследовании 505 пациентов с SAB, Chang et al. Обнаружили, что лечение нафциллином превосходит ванкомицин в предотвращении стойкой бактериемии или рецидива бактериемии MSSA.14 Эти исследования подчеркивают преимущества корректировки эмпирически выбранных антибиотиков, поскольку сужение спектра может привести к меньшему количеству неудач в лечении.
Если чувствительность подтверждает MRSA, IDSA рекомендует продолжить лечение ванкомицином или даптомицином. 3 Хотя ванкомицин используется чаще всего, отчасти из-за низкой стоимости и знакомства, Fowler et al опубликовали исследование 246 пациентов с САБ с эндокардитом или без него, назначив им лечение даптомицином, начальными низкими дозами гентамицина плюс ванкомицин или другими препаратами. антистафилококковый пенициллин. 16 Исследование показало, что даптомицин не уступает другим препаратам, подтверждая, что даптомицин является разумным выбором для лечения инфекций MRSA.
Пероральные антибиотики могут лечить САБ при необходимости.РКИ, проведенное Heldman и соавторами с участием 85 потребителей инъекционных наркотиков с SAB (с подозрением на правосторонний эндокардит, 65% из которых имели ВИЧ), показало аналогичную эффективность ципрофлоксацина плюс рифампицин по сравнению со стандартной внутривенной терапией. 17 Последующее рандомизированное исследование 104 пациентов с SAB, сравнивающее пероральный флероксацин плюс рифампицин с традиционной внутривенной терапией, также показало аналогичные показатели излечения с дополнительным преимуществом более ранней выписки. 18 Кроме того, в метаанализе пяти рандомизированных исследований Shorr et al (см. Таблицу 2) было обнаружено, что исходы линезолида не уступали ванкомицину (клиническое излечение / микробиологический успех 56% / 69% в группа линезолида и 46% / 73% в группе ванкомицина). 19
Продолжительность лечения
Рекомендации относительно продолжительности лечения антибиотиками САБ в основном основаны на наблюдательных исследованиях, которые показывают неоднозначные результаты. В одном исследовании, проведенном в 1950-х годах, около двух третей случаев SAB были связаны с эндокардитом, и были рекомендованы более длительные курсы внутривенной терапии (более четырех недель). 20
В последнее время, с увеличением частоты катетер-связанных SAB и относительно высокой скоростью быстрого клиренса гемокультуры, более короткая продолжительность была оценена в нескольких исследованиях.В 1992 году анализ опубликованных данных и ретроспективная серия случаев показали, что менее 10 дней внутривенного введения антибиотиков может быть связано с повышенным риском рецидива, но 10-14 дней внутривенной терапии были эффективны в большинстве случаев катетер-ассоциированных САБ . 5 В другом проспективном исследовании Fowler et al. Обнаружили, что семидневного курса внутривенной антибиотикотерапии может быть достаточно при простых инфекциях, связанных с катетером. 21 Последующее проспективное исследование Jensen et al. Показало, что курс антибактериальной терапии менее 14 дней может быть связан с более высокой смертностью по сравнению с более длительным курсом. 9 Проспективное исследование 276 пациентов, проведенное Thomas et al., Обнаружило отсутствие связи между рецидивом и продолжительностью лечения (от семи до 15 дней) катетер-связанных САБ, сделав вывод о том, что более 14 дней антибиотикотерапии не требуется. 22
В соответствии с рекомендациями IDSA, неосложненный SAB (отсутствие имплантированного протеза, отрицательные посевы крови в течение двух-четырех дней, снижение температуры тела в течение 72 часов после начала терапии и отсутствие метастатических осложнений) можно лечить двухнедельным курсом антибиотиков. , в то время как осложненная бактериемия (любой из вышеперечисленных критериев) должна лечиться в течение четырех-шести недель. 3
Мониторинг осложнений: эхо
В соответствии с рекомендациями IDSA, эхокардиография рекомендуется всем пациентам с бактериемией, с предпочтением чреспищеводной эхокардиографии (ЧЭ) перед трансторакальной эхокардиографией (ТТЭ). 3 Совсем недавно Kaasch et al разработали простые критерии для выявления пациентов с нозокомиальным SAB с низким риском инфекционного эндокардита на основе двух проспективных когортных исследований. 23 Отсутствие любого из этих критериев, включая длительную бактериемию продолжительностью более четырех дней, наличие постоянного внутрисердечного устройства, зависимость от гемодиализа, спинальную инфекцию и невертебральный остеомиелит, а также отрицательный TTE указывает на то, что TEE не требуется (см. Таблицу 3).Однако эти пациенты нуждаются в тщательном наблюдении, чтобы гарантировать, что бактериемия исчезнет и не появятся новые признаки или симптомы, касающиеся метастатической инфекции.
ID Консультация
Несколько исследований показали, что консультация по ID не только улучшает приверженность научно обоснованному лечению САБ, но также снижает смертность. 24-27 В недавнем проспективном когортном исследовании в центре третичной медицинской помощи, даже после поправки на ранее существовавшие сопутствующие заболевания и тяжесть заболевания, консультация по ID была связана со снижением 28-дневной смертности на 56%. 24 Пациенты, которые находились под наблюдением консультационной службы по ID, с большей вероятностью получали антибиотики соответствующей продолжительности (81% против 29%, соответственно) и проходили соответствующее обследование для оценки метастатических инфекций (34% и 8%, соответственно) ). В этом исследовании сделан вывод о том, что у пациентов с САБ, особенно с тяжелым заболеванием и множественными сопутствующими заболеваниями, следует рассмотреть возможность регулярной консультации по ID.
Назад к корпусу
Пациенту начата эмпирическая терапия ванкомицином, получены серийные культуры крови.Он оставался гемодинамически стабильным, но с лихорадкой, с постоянно положительными культурами крови и мочи. Учитывая опасения, что порт является источником его инфекции, его грудной порт был удален. Было выполнено качественное ТТЕ, без примечаний.
ID был проконсультирован. После этого в культурах крови выросли MSSA, и ванкомицин был заменен на цефазолин 2 г каждые восемь часов. На 5-й день больницы у него прошла лихорадка, и посев крови стал отрицательным. Не было никаких клинических признаков или симптомов метастатических инфекций.Линия PICC была помещена после того, как культура крови оставалась отрицательной в течение 48 часов. Было принято решение лечить его четырехнедельным курсом антибиотиков из его последней положительной культуры крови с последующим наблюдением в клинике ID.
Итог
САБ — распространенная во всем мире причина заболеваемости и смертности. Лечение должно включать удаление очага, если таковой имеется, поиск и проведение соответствующей противомикробной терапии, оценку возможных осложнений и консультации с врачом-терапевтом.
Др.Ward — доцент, доктор Ким клинический инструктор и доктор Стоян клинический лектор в Системе здравоохранения Мичиганского университета в Анн-Арборе.
Благодарность
Авторы выражают благодарность доктору Джеффри Роде за рецензирование рукописи.
Список литературы
- Шорр А.Ф., Табак Ю.П., Киллиан А.Д. и др. Инфекция кровотока, связанная со здравоохранением: отдельная сущность? Выводы из большого U.База данных С. Crit Care Med . 2006; 34: 3588-3595.
- Mylotte JM, McDermott C, Spooner JA. Проспективное исследование 114 последовательных эпизодов бактериемии Staphylococcus aureus. Ред. Заразить Dis . 1987; 9: 891-907.
- Лю С., Байер А., Косгроув С.Е. и др. Руководство по клинической практике Американского общества инфекционистов по лечению метициллин-резистентных инфекций Staphylococcus aureus у взрослых и детей. Clin Infect Dis . 2011; 52 (3).
- Naber CK, Baddour LM, Giamarellos-Bourboulis EJ, et al. Конференция по клиническому консенсусу: исследование грамположительных инфекций кровотока с акцентом на Staphylococcus aureus. Clin Infect Dis . 2011; 52 (3): 285-292.
- Thwaites GE, Edgeworth JD, Gkrania-Klotsas E, et al. Клиническое лечение бактериемии, вызванной стафилококками. Ланцет Infect Dis . 2011; 11 (3): 208-222.
- Johnson LB, Almoujahed MO, Ilg K и др. Бактериемия, вызванная Staphylococcus aureus: соблюдение стандартного лечения, отдаленные результаты и предикторы рецидива. Scand J Infec Dis. 2003; 35 (11-12): 782-789.
- Фаулер В.Г. мл., Олсен М.К., Кори Г.Р. и др. Клинические признаки осложненной бактериемии Staphylococcus aureus. Arch Intern Med . 2003; 163: 2066-2072.
- Mylotte JM, Tayara A. Бактериемия золотистого стафилококка: предикторы 30-дневной смертности в большой когорте. Clin Infect Dis. 2000; 31: 1170-1174.
- Jensen AG, Wachmann CH, Espersen F, et al. Лечение и исход бактериемии Staphylococcus aureus: проспективное исследование 278 случаев. Arch Intern Med. 2002; 162 (1): 25-32.
- Малани П.Н., Рана М.М., Банерджи М. и др. Инфекции кровотока Staphylococcus aureus: связь между возрастом, смертностью и функциональным статусом. Дж. Ам Гериатр Соц . 2008; 56 (8): 1485-1489.
- Ким С.Х., Пак В.Б., Ли К.Д. и др. Исход бактериемии Staphylococcus aureus у пациентов с искорененными очагами по сравнению с неискоренимыми очагами. Clin Infect Dis . 2003; 37 (6): 794-799.
- Чихара С. Попович К.Дж., Вайнштейн Р.А. и др.Бактериурия Staphylococcus aureus как прогностический фактор исхода бактериемии Staphylococcus aureus: исследование случай-контроль. BMC Inf Dis . 2010; 10: 225.
- Лодизе Т.П., Маккиннон П.С., Свидерски Л., Рыбак М.Дж. Анализ результатов отсроченного лечения антибиотиками госпитальной бактериемии Staphylococcus aureus. Clin Infect Dis . 2003; 36: 1418-1423.
- Chang FY, Peacock JE Jr., Musher DM, et al. Бактериемия Staphylococcus aureus: рецидив и влияние лечения антибиотиками в проспективном многоцентровом исследовании. Медицина (Балтимор). 2003; 82: 333.
- Stryjewski ME, Szczech LA, Benjamin DK Jr., et al. Использование ванкомицина или цефалоспоринов первого поколения для лечения зависимых от гемодиализа пациентов с метициллин-чувствительной бактериемией Staphylococcus aureus. Clin Infect Dis . 2007; 44: 190-196.
- Fowler VG Jr., Boucher HW, Corey GR, et al. Даптомицин в сравнении со стандартной терапией бактериемии и эндокардита, вызванных Staphylococcus aureus. N Engl J Med. 2006; 355: 653.
- Heldman AW, Hartert TV, Ray SC и др. Пероральное лечение антибиотиками правостороннего стафилококкового эндокардита у потребителей инъекционных наркотиков: проспективное рандомизированное сравнение с парентеральной терапией. Am J Med . 1996; 101: 68-76.
- Schrenzel J, Harbarth S, Schockmel G, et al. Рандомизированное клиническое испытание по сравнению флероксацина-рифампицина с флуклоксациллином или ванкомицином для лечения стафилококковой инфекции. Clin Infect Dis . 2004; 39: 1285-1292.
- Shorr AF, Kunkel MJ, Kollef M. Линезолид против ванкомицина при бактериемии Staphylococcus aureus: объединенный анализ рандомизированных исследований. J Antimicrob Chemother . 2005; 56: 923-929.
- Wilson R, Hamburger M. Пятнадцатилетний опыт лечения стафилококковой септицемией в крупной городской больнице; анализ пятидесяти пяти случаев в Главной больнице Цинциннати с 1940 по 1954 год. Am J Med . 1957; 22: 437-457.
- Фаулер В.Г. мл., Сандерс Л.Л., Секстон Д.Д. и др.Исход бактериемии Staphylococcus aureus в соответствии с рекомендациями инфекционистов: опыт 244 больных. Clin Infect Dis . 1998; 27: 478-486.
- Томас М.Г., Моррис А.Дж. Бактериемия, вызванная канюлями, Staphylococcus aureus: исход в отношении лечения. Intern Med J. 2005; 35: 319-330.
- Kaasch AJ, Fowler VG Jr, Rieg S, et al. Использование простого набора критериев для ведения эхокардиографии при нозокомидальной бактериемии Staphylococcus aureus. Clin Infect Dis. 2011; 53: 1-9.
- Honda H, Krauss MJ, Jones JC и др. Значение консультации инфекциониста при бактериемии Staphylococcus aureus. Am J Med. 2010; 123: 631-637.
- Nagao M, Iinuma Y, Saito T и др. Тесное сотрудничество между врачами-инфекционистами и лечащими врачами может привести к лучшему лечению и улучшению результатов для пациентов с бактериемией Staphylococcus aureus. Euro Soc Clin Microbiology Infect Dis . 2010; 16: 1783-1788.
- Фаулер В.Г. мл., Сандерс Л.Л., Секстон Д.Д. и др. Исход бактериемии Staphylococcus aureus с соблюдением рекомендаций инфекциониста: опыт 244 больных. Clin Infect Dis. 1998; 27 (3): 478-486.
- Jenkins TC, Price CS, Sabel AL et al. Влияние обычных консультаций службы инфекционных заболеваний на оценку, лечение и исход бактериемии Staphylococcus aureus.

